POTENSI ANTIOKSIDASI EKSTRAK AIR DAN
EKSTRAK ETANOL 70% DAUN JATI BELANDA
(
Guazuma ulmifolia
Lamk.)
KHARISMA ADI MARTSOLICH
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Etanol 70% Daun Jati Belanda (Guazuma ulmifolia Lamk.). Dibimbing oleh
SULISTIYANI dan SURYANI.
Ekstrak air dan ekstrak etanol 70% daun jati belanda diteliti untuk
mempelajari potensi antioksidasinya pada konsentrasi 50, 200, dan 1000 ppm,
dengan menggunakan vitamin E 200 ppm sebagai pembanding. Analisis
dilakukan secara in vitro dengan metode Thiobarbituric Acid (TBA). Aktivitas
antioksidasi ditentukan dengan cara mengoksidasi substrat asam linoleat dalam
udara pada suhu 40 ºC selama enam hari dengan atau tanpa ekstrak. Hasil oksidasi
berupa malondialdehida (MDA) akan bereaksi dengan asam tiobarbiturat
membentuk produk berwarna merah yang serapannya dapat diukur dengan
spektrofotometer pada 532 nm.
ABSTRACT
KHARISMA ADI MARTSOLICH. The potency of water-and ethanol-extracts of
Jati Belanda (Guazuma
ulmifolia Lamk.) leaves as antioxidant. Under the
direction of SULISTIYANI and SURYANI.
The antioxidant potency of Jati Belanda leaves extracts had been studied
using water-and ethanol-extracts at concentrations of: 50, 200, and 1000 ppm,
with vitamin E as the control. Antioxidant activity were determined using
Thiobarbituric Acid (TBA) method. In this method, the linoleic acid was oxidized
by air at 40
0C for six days with or without extract and the final product
malondialdehida (MDA) was measured with spectrophotometer at 532 nm.
(
Guazuma ulmifolia
Lamk.)
KHARISMA ADI MARTSOLICH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Antioksidasi Ekstrak Air dan Ekstrak Etanol 70% Daun
Jati Belanda (Guazuma ulmifolia Lamk.)
Nama
: Kharisma Adi Martsolich
NRP
:
G44101033
Disetujui
Komisi Pembimbing
drh. Sulistiyani. M.Sc., Ph.D.
Dr. Suryani. M.Sc.
Ketua
Anggota
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, M.S.
NIP 131473999
Alhamdulillah, segala puji bagi Allah SWT atas segala rahmat dan
karunia-Nya, sehingga penulis dapat menyelesaikan karya ilmiah ini. Shalawat
serta salam semoga selalu tercurah kepada Nabi Muhammad SAW.
Karya ilmiah
ini berjudul Potensi Antioksidasi Ekstrak Air dan Ekstrak Etanol 70% Daun Jati
Belanda (Guazuma ulmifolia Lamk.). Penelitian dilaksanakan pada bulan Juni
2006 sampai dengan November 2006 di laboratorium Biokimia Institut Pertanian
Bogor.
Terima kasih penulis ucapkan kepada drh. Sulistiyani. M.Sc., Ph.D dan
Dr. Suryani. M.Sc selaku pembimbing yang dengan sabar membimbing,
mengarahkan, dan memberikan nasihatnya selama pelaksanaan penelitian,
segenap staf, laboran, dan teknisi di Departemen Biokimia, serta berbagai pihak
yang telah membantu dalam penulisan karya ilmiah ini, baik secara langsung
maupun tidak langsung yang terlibat dalam pelaksanaannya.
Ungkapan terima kasih juga disampaikan kepada Ibunda tercinta, Mbak
Antik, Mas Anto, dan Mas Helmi atas segala doa dan kasih sayangnya, dan tidak
lupa untuk Aisha Cinde
Az-Zahra atas doa dan motivasi yang telah diberikan,
serta semua pihak yang telah membantu penulis selama penulisan karya ilmiah
ini.
Semoga karya kecil ini dapat bermanfaat bagi ilmu pengetahuan dan
memberi tambahan ilmu bagi yang membutuhkan.
Bogor, Mei 2007
RIWAYAT HIDUP
Penulis dilahirkan di Brebes pada tanggal 7 Maret 1984 sebagai anak
keempat dari empat bersaudara dari pasangan Mas Doeki Budhiwihardjo dan Siti
Solicha. Tahun 2001 penulis lulus dari SMU Negeri 1 Brebes dan pada tahun
yang sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur
Undangan Seleksi Masuk IPB (USMI) pada Program Studi Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam (FMIPA).
DAFTAR ISI
Halaman
DAFTAR TABEL... ix
DAFTAR GAMBAR... ix
DAFTAR LAMPIRAN... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Jati Belanda (Guazuma ulmifolia Lamk.) ... 1
Radikal Bebas, Prooksidan, dan Lipid Peroksida ... 2
Senyawa Antioksidan Sebagai Penangkap (Scavenger) Radikal Bebas ... 3
Analisis Potensi Antioksidasi dengan Metode Asam Tiobarbiturat (TBA).... 4
BAHAN DAN METODE ... 6
Bahan dan Alat ... 6
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN... 7
Ekstraksi Daun Jati Belanda ... 7
Kandungan Fitokimia Ekstrak Air dan Ekstrak Etanol 70% Daun Jati
Belanda ... 8
Penentuan
Waktu
Inkubasi Asam Linoleat ... 9
Potensi Antioksidasi Ekstrak Air dan Ekstrak Etanol 70% Daun Jati
Belanda ... 9
SIMPULAN DAN SARAN ... 11
DAFTAR PUSTAKA ... 11
2
DAFTAR TABEL
Halaman
1 Mekanisme reaksi pembentukan radikal bebas... 2
2 Rendemen hasil ekstraksi air dan etanol 70% daun jati belanda. ... 7
3 Hasil uji fitokimia ekstrak air dan ekstrak etanol 70% daun jati belanda... 8
4 Daya hambat ekstrak air dan ekstrak etanol 70% daun jati belanda ... 10
DAFTAR GAMBAR
Halaman
1 Tanaman Jati Belanda (Guazuma ulmifolia Lamk.) ... 2
2 Pembentukan H
2O
2pada reaksi reduksi oksigen menjadi air. ... 3
3 Beberapa senyawa antioksidan alami... 4
4 Reaksi antara malondialdehida dan asam tiobarbiturat... 5
5 Contoh kurva standar TMP (
1,1,3,3-tetrametoksi propana)...5
6 Nilai serapan ikatan diena terkonjugasi asam linoleat selama waktu oksidasi. . 9
DAFTAR LAMPIRAN
Halaman
1 Tahapan ekstraksi daun jati belanda ... 14
2 Rendemen hasil ekstraksi daun jati belanda... 15
3 Penentuan waktu inkubasi asam linoleat dengan metode diena terkonjugasi.. 15
4 Hasil analisis hidroperoksida ... 16
5 Pembuatan kurva standar ... 16
6 Hasil pengukuran standar TMP (1,1,3,3-tetrametoksi propana) ... 17
7 Absorban pengukuran MDA sampel... 17
8 Pengukuran kadar malondialdehida sampel... 18
9 Data konsentrasi MDA dan daya hambat masing-masing sampel... 19
10 Analisis statistik potensi antioksidasi sampel ... 20
1
PENDAHULUAN
Dewasa ini penerapan pola hidup yang kurang sehat dapat menyebabkan proses penuaan dini dan penyakit degeneratif. Kerusakan akibat oksidasi terhadap DNA genetik sel merupakan penyebab utama proses penuaan dan juga penyakit-penyakit degeneratif seperti penyakit kanker, pembuluh darah, dan jantung, serta kemerosotan sistem kekebalan dan disfungsi otak serta sistem saraf (Atmosukarto & Mitri 2003). Hal ini juga bisa disebabkan karena adanya stres oksidatif, yaitu tidak seimbangnya jumlah oksidan dan prooksidan dalam tubuh. Berdasarkan penelitian yang telah dilakukan, stres oksidatif ini dapat dikurangi dengan mengonsumsi antioksidan dalam jumlah cukup.
Berbagai upaya pencegahan serta pengobatan telah dilakukan oleh sebagian masyarakat Indonesia dengan cara mengonsumsi obat tradisional atau yang biasa disebut dengan jamu. Beberapa tanaman baik yang liar maupun yang dibudidayakan telah diketahui berkhasiat mengobati penyakit-penyakit degeneratif. Namun penggunaan obat tradisional mempunyai kendala, yaitu kadar dan konsistensi bahan aktif yang terkandung belum dapat dijamin, terutama untuk penggunaan secara rutin. Berdasarkan kendala di atas, maka perlu diketahui secara lebih rinci mengenai zat aktif yang terkandung di dalam tanaman obat. Informasi ini tentu saja sangat
diperlukan sehingga dapat dipertanggungjawabkan secara ilmiah.
Salah satu di antara sekian banyak tanaman berkhasiat obat yang mulai banyak digunakan oleh masyarakat di Indonesia sebagai obat tradisional adalah tanaman jati belanda (Guazuma ulmifolia Lamk.). Dalam pengobatan tradisional, tanaman ini biasa digunakan sebagai obat pelangsing tubuh, perut kembung, diare, dan batuk. Tanaman ini mengandung senyawa steroid, alkaloid, flavonoid, karotenoid, tanin, dan saponin (Hartanto 1986). Daun Jati belanda diduga berpotensi sebagai antioksidan karena adanya kandungan flavonoid. Flavonoid sendiri diketahui mampu menghambat pembentukan radikal bebas (Yang et al. 2001).
Beberapa penelitian telah membuktikan bahwa tanaman jati belanda layak dikonsumsi sebagai obat alternatif, maupun dikonsumsi untuk perawatan tubuh. Joshita et al. (2000) menyebutkan bahwa seduhan daun jati belanda dapat meningkatkan kerja enzim lipase. Sementara itu Monica dan farida
(2000) menyebutkan bahwa daun jati belanda mampu menurunkan kadar kolesterol darah kelinci. Jati belanda tidak hanya digunakan sebagai pelangsing badan, melainkan apabila diformulasikan dengan tanaman obat lain juga dapat berkhasiat mencegah keputihan, merawat keindahan tubuh, serta memperbaiki pencernaan (Dewi et al. (2000).
Penelitian ini bertujuan untuk menentukan potensi antioksidasi ekstrak air dan ekstrak etanol 70% daun jati belanda (Guazuma ulmifolia Lamk.). Hipotesis penelitian ini adalah ekstrak air dan ekstrak etanol 70% daun jati belanda (Guazuma ulmifolia Lamk.) mampu menghambat proses oksidasi asam linoleat oleh radikal bebas secara in vitro. Penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai potensi antioksidasi daun jati belanda (Guazuma ulmifolia Lamk.) sehingga dapat dijadikan dasar pengembangan produk fitofarmaka.
TINJAUAN PUSTAKA
Jati Belanda (Guazuma ulmifolia Lamk.)Jati belanda merupakan tanaman yang berasal dari benua Amerika yang beriklim tropis. Tanaman ini juga tersebar luas di wilayah tropis lainnya seperti di pulau Jawa dan Madura. Di pulau Jawa, tanaman ini biasa disebut dengan jati londo atau jotos landi. Tanaman ini tumbuh baik pada dataran dengan ketinggian 1 sampai dengan 1800 m di atas permukaan laut.
Pohon ini tumbuh cepat dengan tingginya mencapai 10-22 m dan biasanya tumbuh di hutan-hutan. Bunganya berwarna kuning berbintik-bintik merah. Daunnya berbentuk jantung dan berbulu pada bagian bawah, tunggal, permukaan kasar, tepi bergerigi, ujung runcing, pertulangan menyirip, berseling, panjang 10-16 cm, lebar 3-6 cm (Gambar 1). Buahnya berwarna hijau, beruang lima, dan berwarna hitam. Berbiji banyak, berwarna kuning kecoklatan dan berlendir, dan rasanya agak manis (Anonim 2000).
Masyarakat pada umumnya memanfaatkan daun jati belanda untuk mengobati sakit perut atau diare, perut kembung, batuk, kaki bengkak, dan sebagai pelangsing tubuh. Penggunaan daun jati belanda sebagai obat tradisional di pasaran hanya ditemukan dalam bentuk ramuan, sedangkan dalam bentuk tunggal tidak ditemukan. Secara taksonomi, tanaman jati belanda termasuk ke dalam
angiospermae dan kelas dicotyledonae, ordo steruliaceae, dan genus Guazuma (Dewi et al.
2000.
Hasil penelitian secara in vivo menyatakan bahwa daun jati belanda mampu menghambat peningkatan kadar lipid peroksida pada darah kelinci yang diberi pakan kolesterol (Tombilangi 2004), namun sampai saat ini belum diketahui khasiat daun jati belanda sebagai antioksidan secara in vitro. Hal ini sangat penting mengingat pada percobaan secara in vivo terdapat beberapa faktor yang dapat mempengaruhi penghambatan peroksidasi lipid oleh ekstrak daun jati belanda, sehingga percobaan secara in vitro
perlu dilakukan untuk menentukan besarnya potensi daun jati belanda sebagai antioksidan.
Hasil penelitian pendahuluan terhadap komposisi daun jati belanda menunjukkan adanya senyawa yang berpotensi sebagai antioksidan. Menurut Hartanto (1986), daun jati belanda mengandung senyawa flavonoid, asam fenolat, tanin, steroid, triterpenoid, dan karotenoid. Miradiono (2002) menyebutkan bahwa serbuk daun jati belanda mengandung flavonoid, fenol hidrokuinon, dan senyawa flavonoid lain seperti kalkon, auron, dan flavonol, sedangkan Rachmadani (2001) melaporkan bahwa pada daun jati belanda terdapat tanin, steroid dan triterpenoid. Hasil berbeda dilaporkan Lestari dan Muhtadi (1997) yang menyatakan bahwa daun jati belanda hanya mengandung tanin saja..
Gambar 1 Tanaman jati belanda (Guazuma ulmifolia Lamk.).
Radikal Bebas, Oksidan, dan Lipid Peroksida
Radikal bebas didefinisikan sebagai suatu atom atau molekul yang memiliki satu atau lebih elektron yang tidak berpasangan (Mimić-Oka et al. 1999). Secara teoritis
radikal bebas dapat terbentuk bila terjadi pemisahan ikatan kovalen. Adanya elektron yang tidak berpasangan membuat molekul menjadi tidak stabil dan bersifat reaktif karena berusaha untuk mendapatkan pasangan elektron (Muhilal 1991).
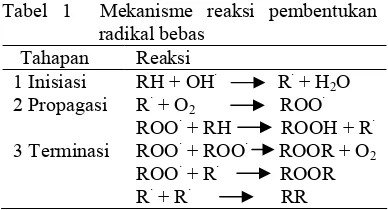
Radikal bebas dihasilkan dari dalam tubuh (endogenus) maupun luar tubuh (eksogenus) melalui sederetan mekanisme reaksi (Tabel 1). Reaksi tahap pertama adalah pembentukan radikal bebas awal (inisiasi). Tahap kedua adalah perambatan atau terbentuknya radikal baru (propagasi). Reaksi ini terjadi secara berantai dan terus menerus karena menghasilkan radikal lipid bebas (R•) lain yang menyebabkan peroksidasi lebih lanjut. Tahap terakhir (terminasi), yaitu pemusnahan atau pengubahan menjadi radikal bebas stabil dan tak reaktif. Terminasi terjadi bila ada reaksi antara radikal bebas itu sendiri.
Selain radikal bebas, terdapat pula jenis senyawa yang sifatnya serupa dengan radikal bebas, yaitu oksidan. Menurut Widjaja (1997), oksidan merupakan senyawa penerima elektron yang mempunyai kemampuan untuk menarik elektron dari berbagai molekul yang mengakibatkan terjadinya oksidasi molekul tersebut, sedangkan radikal bebas ialah atom atau molekul yang mempunyai elektron yang tidak berpasangan pada orbit luarnya dan bertindak juga sebagai akseptor elektron. Walaupun radikal bebas adalah oksidan, tetapi tidak semua oksidan merupakan radikal bebas. Radikal bebas lebih berbahaya jika dibandingkan dengan oksidan yang bukan radikal. Hal tersebut disebabkan oleh sifat radikal bebas yang mempunyai reaktivitas yang tinggi, yaitu kecenderungannya untuk menarik elektron. Selain itu reaksi antara radikal bebas dengan molekul nonradikal akan menghasilkan suatu radikal bebas yang baru dan selanjutnya menimbulkan reaksi berantai. Oleh karena itu, radikal bebas menjadi sangat berbahaya bagi makhluk hidup karena apabila reaksi ini terjadi di dalam tubuh, maka akan menimbulkan berbagai kerusakan.
Tabel 1 Mekanisme reaksi pembentukan radikal bebas
Tahapan Reaksi
1 Inisiasi RH + OH· R· + H2O
2 Propagasi R· + O2 ROO·
ROO· + RH ROOH + R· 3 Terminasi ROO· + ROO· ROOR + O2
3
Berbagai macam kerusakan yang diakibatkan oleh radikal bebas adalah kerusakan membran, protein, DNA, dan terjadinya peroksidasi lipid sebagai pencetus berbagai penyakit kardiovaskuler. Terdapat jenis radikal bebas atau oksidan yang terdapat di dalam tubuh manusia, yaitu derivat oksigen (ROS/Reactive Oxygen Species ), antara lain O2-, H2O2, HO•, ROO•, RO•. Para peneliti
meyakini bahwa ROS mempunyai peranan penting dalam patofisiologi manusia seperti kanker, kardiovaskuler, dan penyakit neurodegeneratif lain seperti penyakit
Alzheimer dan Parkinson (Tuminah 2000). Menurut Mimić-Oka et al. (1999), ROS secara konstan diproduksi di dalam tubuh melalui proses metabolisme normal khususnya pada proses reduksi O2 menjadi
H2O dalam rantai respirasi mitokondria
(Gambar 2). Sebagai contoh H2O2 merupakan
oksidan kuat namun bereaksi lambat dengan substrat organik. Oksidan ini dianggap toksik hanya dalam konsentrasi tinggi. Akumulasi H2O2 dapat berbahaya bila terdapat bersama
dengan ion Fe2+ atau chelating agent, karena akan terbentuk radikal hidroksil yang juga akan terbentuk setelah menerima elektron ketiga.
Jenis ROS yang lain yaitu radikal hidroksil (HO•). Radikal hidroksil merupakan salah satu oksidan yang paling berbahaya karena reaktivitasnya yang sangat tinggi dengan waktu paruh yang sangat pendek (10-9 detik), sehingga dengan cepat akan merusak molekul di dekatnya (Sies 1991). Radikal hidroksil dapat terbentuk dari H2O2 bila terdapat ion
logam Fe2+. Reaksi ini disebut reaksi Fenton dan reaksi Haber-Weiss, yang dapat dituliskan sebagai berikut menurut Lautan (1997):
1. H2O2 + Fe2+ Fe3+ + OH + HO•
2. O2- + H2O2 O2 + OH + HO•
Efek oksidatif radikal bebas dapat menyebabkan peradangan dan penuaan dini. Peroksidasi lipid merupakan reaksi yang terjadi antara radikal bebas dengan asam lemak tak jenuh ganda yang menyusun membran sel (linoleat, linolenat, arakidonat) sehingga terbentuk radikal lipid peroksida. Hal ini terjadi karena lipid merupakan molekul yang paling sensitif terhadap serangan radikal bebas. Reaksi ini terjadi secara berantai dan terus menerus dan baru dapat berakhir jika ada molekul yang memberikan elektron yang dibutuhkan radikal bebas atau jika dua buah gugus radikal bebas saling berinteraksi membentuk ikatan non
radikal (Murray 1999). Kelebihan lipid peroksida dalam darah maupun hati dapat mengakibatkan berbagai penyakit seperti: kanker, jantung koroner, stroke, katarak, autoimun, dan ketuaan (Yagi 1994).
1. O2 + e- O2
-2. O2- + e- + 2H+ H2O2
3. H2O2 + e- OH+ + OH
-4. OH+ + e- + H+ H2O
Gambar 2 Pembentukan H2O2 pada reaksi
reduksi oksigen menjadi air.
Senyawa Antioksidan Sebagai Penangkap (Scavenger) Radikal Bebas
Antioksidan adalah sejumlah enzim atau zat yang dapat menetralkan radikal bebas (Kartawiguna 1998). Mekanisme pertahanan tubuh terhadap stres oksidatif adalah dengan antioksidan yang dapat berasal dari makanan (eksogen), serta dari dalam tubuh sendiri (endogen). Menurut mekanisme kerjanya, antioksidan memiliki dua fungsi. Fungsi pertama merupakan fungsi utama dari antioksidan, yaitu sebagai pemberi atom hidrogen. Antioksidan (AH) ini dapat memberikan atom hidrogen secara cepat ke radikal lipida (R•, ROO•) atau mengubahnya ke bentuk lebih stabil, sementara turunan radikal antioksidan (A•) tersebut memiliki keadaan lebih stabil dibanding radikal lipida. Fungsi kedua merupakan fungsi sekunder antioksidan, yaitu memperlambat laju autooksidasi dengan berbagai mekanisme di luar mekanisme pemutusan rantai autooksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon 1990).
Penambahan antioksidan (AH) primer dengan konsentrasi rendah pada lipida dapat menghambat atau mencegah reaksi autooksidasi lipid. Penambahan tersebut dapat menghalangi reaksi oksidasi pada tahap inisiasi maupun propagasi. Radikal-radikal antioksidan (A•) yang terbentuk pada reaksi tersebut relatif stabil dan tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain membentuk radikal lipida baru (Gordon 1990). Menurut Hamilton (1983), antara radikal antioksidan dapat saling bereaksi membentuk produk nonradikal sebagai berikut:
Inisiasi : R• + AH RH + A• Propagasi: ROO• + AH ROOH + A•
5. OH- + H+ H2O
Antioksidan bisa dikelompokkan menjadi tiga, yaitu antioksidan primer, antioksidan sekunder, dan antioksidan tersier (Kartawiguna 1998). Antioksidan primer bekerja untuk mencegah pembentukan senyawa radikal bebas baru. Enzim katalase merupakan salah satu antioksidan primer yang memiliki fungsi mengubah H2O2 menjadi
oksigen dan air. Antioksidan sekunder berfungsi menangkap senyawa radikal, serta mencegah terjadinya reaksi berantai. Contoh antioksidan sekunder adalah vitamin E, vitamin C, beta karoten, asam urat, bilirubin, dan albumin. Jenis antioksidan yang ketiga yaitu antioksidan tersier yang berfungsi memperbaiki kerusakan sel dan jaringan yang disebabkan radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah metionin sulfoksidan reduktase. Adanya enzim perbaikan DNA ini berguna untuk mencegah penyakit misalnya kanker. Hasil berbagai penelitian dengan menggunakan hewan percobaan telah mendukung teori bahwa mengkonsumsi antioksidan yang memadai dapat mengurangi resiko terjadinya berbagai macam penyakit seperti kanker, kardiovaskuler, katarak serta penyakit degeneratif lain.
Antioksidan alami dapat ditemukan dalam berbagai tumbuh-tumbuhan baik pada tanaman berkayu, sayuran, atau buah-buahan. Pada tumbuhan berkayu diketahui banyak senyawa yang dapat bertindak sebagai antioksidan seperti: flavonoid, senyawa fenol, terpenoid, alkaloid, dan masih banyak lagi yang lainnya. Sayuran dan buah-buahan diketahui banyak mengandung vitamin A, vitamin B, vitamin C, vitamin E, dan
karotenoid yang diyakini dapat berperan sebagai antioksidan, sehingga mampu melindungi tubuh dari penyakit kanker (Atmosukarto 2003).
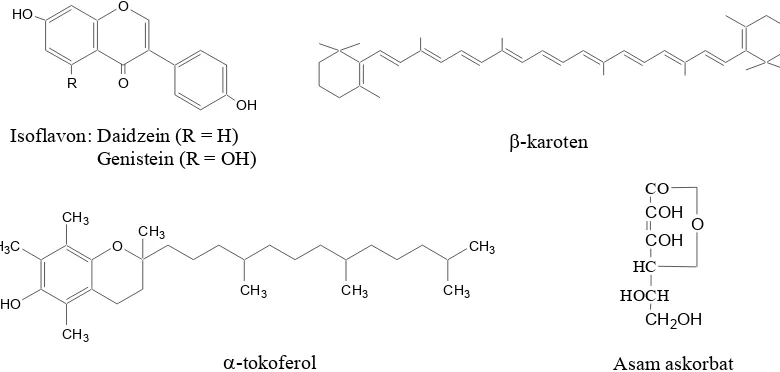
Senyawa turunan fenol tersebar luas dalam tumbuhan dan beberapa diantaranya lebih efektif dibanding dengan senyawa antioksidan sintetik (Moelyono dan Muhtadi 2001). Antioksidan yang umum terdapat pada tumbuhan tingkat tinggi antara lain asam askorbat, karoten, flavonoid, saponin, tanin, dan tokoferol. Zat antioksidan alami lain adalah isoflavon. Isoflavon termasuk golongan isoflavonoid yang merupakan isomer flavon. Senyawa ini banyak terkandung pada tanaman kacang-kacangan, terutama kacang kedelai. Beberapa struktur antioksidan alami dapat dilihat pada Gambar 3 Hart (1983) dan Harborne (1987).
Analisis Potensi Antioksidasi dengan Metode Asam Tiobarbiturat (TBA)
Metode asam tiobarbiturat (TBA) merupakan metode yang digunakan dalam penelitian ini untuk mengukur aktivitas antioksidasi suatu senyawa antioksidan. Pengujian aktivitas antioksidasi dengan menggunakan metode TBA dilakukan secara langsung yang didasarkan pada pengukuran produk utama atau sekunder dari oksidasi lipid, umumnya adalah pembentukan hidroksiperoksida atau produk sekunder seperti aldehid, sedangkan pengujian secara tidak langsung didasarkan pada pengukuran selain produk utama atau sekunder dari oksidasi lipid, seperti misalnya jumlah oksigen yang diperlukan untuk oksidasi.
O OH R HO O CO COH COH HC HOCH
CH2OH O
Isoflavon: Daidzein (R = H)
Genistein (R = OH) β-karoten
Asam askorbat
α-tokoferol O
H3C
HO
CH3
CH3 CH3 CH3
CH3
CH3 CH3
5
Selain metode TBA terdapat beberapa contoh pengujian aktivitas antioksidasi, yaitu metode oksigen aktif (active oxygen methode, AOM), metode fero tiosianat (FTC), uji Schall, uji masa simpan, dan metode Rancimat. (Adawiyah et al. 2001). Selain metode tersebut, ada pula beberapa metode lainnya seperti metode bilangan ansidin, metode Kreis, uji bilangan peroksida (Santoso 2001), dan metode diena terkonjugasi.
Prinsip kerja dari metode TBA adalah proses autooksidasi dari asam linoleat
menghasilkan senyawa TBA-reacting
substance (TBArs) seperti misalnya
malondialdehida (MDA). Gugus karbonil MDA dengan adanya asam 2-tiobarbiturat (TBA) akan membentuk senyawa yang berwarna merah jambu yang dapat diukur serapannya pada panjang gelombang 532 nm (Kikuzaki dan Nakatani 1993). Gambar 4 memperlihatkan reaksi yang terjadi antara MDA dan TBA. Pada reaksi ini sejumlah senyawa lain juga dapat bereaksi dengan TBA membentuk senyawa berwarna seperti glukosa, sukrosa, asam amino, dan urea. Namun karena konsentrasinya yang kecil, maka dapat diabaikan (Kosugi et al. 1991).
Nilai serapan yang terukur menggambarkan konsentrasi MDA sebagai hasil oksidasi lipid. Proses oksidasi tersebut oleh senyawa antioksidan dapat dihambat, akibatnya MDA yang terbentuk pun akan lebih sedikit daripada yang tanpa penambahan senyawa antioksidan. Akibat dari hal ini, intensitas warnanya pun rendah. Nilai serapan berbanding lurus dengan konsentrasi MDA dan berbanding terbalik dengan potensi antioksidasi. Artinya adalah semakin pekat warna yang dihasilkan, semakin lemah potensi antioksidatif sampel. Sebaliknya semakin rendah intensitas warnanya, semakin tinggi pula potensi antioksidatif sampel yang dianalisis.
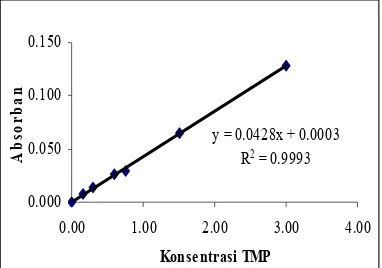
Metode TBA ini menggunakan TMP (1,1,3,3-tetrametoksi propana) sebagai standar pengukurannya. Senyawa TMP merupakan
sejenis TBArs atau senyawa hasil oksidasi lipid yang dapat bereaksi dengan TBA membentuk senyawa berwarna merah jambu yang dapat diukur serapannya pada panjang gelombang 532 nm. Berdasarkan penelitian yang dilakukan oleh Sulistiyani et al. (2006), TMP dapat dijadikan standar bagi pengukuran konsentrasi MDA pada sampel antioksidan (Gambar 5).
Masa inkubasi pada pembuatan standar TMP maupun sampel didasarkan pada pengukuran diena yang terkonjugasi selama proses oksidasi. Saat masa inkubasi, asam linoleat akan dioksidasi oleh oksigen. Pada tahap awal oksidasi asam linoleat akan terbentuk hidroperoksida terkonjugasi, yang selanjutnya diikuti tahap propagasi dimana kadar hidroperoksida terus meningkat. Asam linoleat yang mengandung dua ikatan rangkap terkonjugasi menunjukkan intensitas penyerapan pada panjang gelombang 234 nm (Rossel 1983, diacu dalam Tensiska 2001). Selanjutnya setelah hidroperoksida mencapai kadar maksimum, hidroperoksida akan mengalami tahap dekomposisi membentuk MDA.
y = 0.0428x + 0.0003 R2 = 0.9993
0.000 0.050 0.100 0.150
0.00 1.00 2.00 3.00 4.00
Konsentrasi TMP Ab so r b a n
Gambar 5 Contoh kurva standar TMP (1,1, 3,3-tetrametoksi propana)
CHO
CH
2CHO
TBA
MDA
C
H
C
H
C
H
2H
2O
2
Produk
Air
N
N
OH
HS
OH
N
N
OH
OH
S
N
N
OH
HO
SH
+
+
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan untuk ekstraksi ialah daun jati belanda, etanol 70%, dan akuades. Daun jati belanda yang digunakan berupa daun muda yang diperoleh dari kebun percobaan Pusat Studi Biofarmaka dalam bentuk serbuk kering.
Untuk analisis fitokimia digunakan ekstrak kasar etanol 70% daun jati belanda dan ekstrak airnya, kloroform, ammonia, H2SO4
2M, pereaksi Dragendorf, pereaksi Meyer, pereaksi Wagner, akuades, metanol, NaOH 10% (b/v), eter, pereaksi Lieberman Buchard (3 tetes asam asetat anhidrida ditambah 1 tetes H2SO4 pekat), dan FeCl3 1% (b/v).
Bahan untuk penentuan waktu inkubasi asam linoleat dan pengukuran konsentrasi MDA yaitu bufer fosfat 0,1 M pH 7, asam linoleat 50 mM dalam etanol 99,8%, etanol 75%, TMP (1,1,3,3-tetra metoksi propana) 6M, TBA 1% (b/v) dalam asam asetat 50%, TCA (Trichloroacetic Acid) 20%, dan α -tokoferol (vitamin E).
Alat-alat yang digunakan ialah alat-alat gelas, refluks, rotary evaporator, oven, penangas air, neraca analitik, spektro-fotometer UV-Vis, autoklaf, shaker, pipet mikro, pipet kapiler, dan sentrifus.
Metode Penelitian
Ekstraksi Daun Jati Belanda
Daun jati belanda yang telah berbentuk serbuk ditimbang sebanyak 20 gram. Untuk ekstrak air, serbuk daun jati belanda diekstraksi menggunakan pelarut akuades sebanyak 200 mL. kemudian dipanaskan pada suhu 100 ˚C selama kurang lebih 4 jam. Ekstrak yang diperoleh disaring dan filtratnya diuapkan dengan rotavapour pada suhu 60 ˚C dan kemudian disimpan dalam oven pada suhu 40 ˚C.
Untuk ekstraksi menggunakan etanol 70%, Sebanyak 20 gram serbuk daun jati belanda direfluks dengan 200 mL pelarut etanol 70% selama 2 jam pada suhu 70 ˚C. Selanjutnya ekstrak disaring dengan kertas saring. Ekstrak yang diperoleh diuapkan dengan rotavapour pada suhu 50 ˚C dan dioven pada suhu 40 ˚C sehingga diperoleh ekstrak kasar.
Analisis Fitokimia Ekstrak Air dan Ekstrak Etanol 70% Daun Jati Belanda (Harbone 1987)
Uji Alkaloid. Ke dalam 10 mL kloroform ditambahkan ekstrak sampel sebanyak 0.1 g
dan beberapa tetes ammonia. Fraksi kloroform dipisahkan dan diasamkan dengan 10 tetes H2SO4 2M. Fraksi asam diambil kemudian
ditambahkan pereaksi Dagendorf, Meyer, dan Wagner. Adanya alkaloid ditandai dengan terbentuknya endapan putih oleh pereaksi Meyer, endapan merah oleh pereaksi Dragendorf, dan endapan coklat oleh pereaksi Wegner. Sebagai sampel pembanding digunakan daun tapak dara
Uji Saponin. Ekstrak sampel sebanyak 0.1 g ditambah air secukupnya dan dipanaskan selama lima menit. Larutan tersebut didinginkan kemudian dikocok. Timbulnya busa selama ± 10 menit menunjukkan adanya saponin. Sebagai sampel pembanding digunakan buah klerak.
Uji Flavonoid dan Fenolik Hidrokuinon.
Ekstrak sampel sebanyak 0.1 g ditambah metanol 30% sampai terendam lalu dipanaskan. Filtratnya ditambah NaOH 10% (b/v) atau H2SO4. Terbentuknya warna merah
karena penambahan NaOH menunjukkan adanya senyawa fenolik hidrokuinon sedangkan warna merah yang terbentuk akibat
penambahan H2SO4 pekat menunjukkan
adanya flavonoid. Sebagai sampel pembanding digunakan buah pinang.
Uji Triterpenoid dan Steroid. Ekstrak sampel sebanyak 0.1 g ditambah 25 mL etanol 30% lalu dipanaskan dan disaring. Filtratnya diuapkan kemudian ditambah eter. Lapisan eter ditambah pereaksi Lieberman Buchard (3 tetes asam asetat anhidrida dan 1 tetes H2SO4
pekat). Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau menunjukkan adanya steroid. Sebagai sampel pembanding digunakan daun som jawa.
Uji Tanin.Ekstrak sampel sebanyak 0.1 g ditambahkan air kemudian dididihkan selama beberapa menit. Lalu disaring dan filtratnya ditambah FeCl3 1% (b/v). Warna biru tua atau
hitam kehijauan menunjukkan adanya tanin. Sebagai sampel pembanding digunakan daun teh.
Penentuan Waktu Inkubasi Asam Linoleat dengan Metode Diena Terkonjugasi
7
pada botol gelap berulir, kemudian campuran diinkubasi pada suhu 40 °C.
Pengukuran intensitas serapan dilakukan dengan cara sebanyak 50 µL campuran asam linoleat yang telah diinkubasi ditambahkan ke dalam 6 mL etanol 75%, kemudian campuran tadi dibaca serapannya pada panjang gelombang 234 nm. Pengukuran dilakukan setiap harinya sampai tercapai serapan maksimum.
Analisis Potensi Antioksidasi dengan Metode TBA (Kikuzaki 1993)
Pengukuran potensi antioksidasi dari ekstrak daun jati belanda dilakukan dengan konsentrasi larutan uji 50, 200, dan 1000 ppm dalam total campuran. Sebagai sampel dibuat campuran yang terdiri atas 2 mL bufer fosfat 0.1 M pH 7, 2 mL asam linoleat 50 mM dalam etanol 99.8%, dan 1 mL larutan uji dalam air bebas ion. Sebagai kontrol negatif dibuat campuran yang sama seperti di atas tetapi 1 mL larutan uji diganti dengan 1 mL air bebas ion. Sebagai pembanding atau kontrol positif dibuat campuran yang terdiri atas 2 mL bufer fosfat 0.1 M pH 7,2 mL asam linoleat 50 mM dalam etanol 99.8% yang mengandung α -tokoferol (vitamin E) 200 ppm total campuran, dan 1 mL air bebas ion.
Semua campuran diletakkan pada botol gelap berulir, kemudian campuran diinkubasi dalam penangas air yang bersuhu 40 °C dengan lama inkubasi berdasarkan hasil pengukuran diena terkonjugasi dari asam linoleat. Campuran reaksi kemudian diuji potensi antioksidasinya setelah 1 atau beberapa hari dari puncak serapan diena terkonjugasi. Masing-masing campuran diambil 1 mL kemudian ditambahkan 2 mL TCA 20% (b/v) dan 2 mL larutan TBA 1% (b/v) dalam pelarut asam asetat 50% (v/v). Lalu campuran reaksi tersebut diinkubasi dalam penangas air bersuhu 100 °C selama 10 menit. Setelah dingin dilakukan sentrifugasi pada 3000 rpm (960 kali gravitasi) selama 15 menit, selanjutnya diukur serapannya pada 532 nm.
Sebagai standar, larutan stok pereaksi TMP konsentrasi 6 M dibuat menjadi 1.5, 3.0, 6.0, 9.0, 12.0, 15.0, dan 18.0 µM.
Masing-masing konsentrasi dipipet sebanyak 1 mL, selanjutnya ditambahkan 2 mL TCA 20% (b/v) dan 2 mL larutan TBA 1% (b/v) dalam pelarut asam asetat 50% (v/v). Lalu campuran reaksi tersebut diinkubasi dalam penangas air mendidih selama 10 menit. Setelah dingin dilakukan sentrifugasi pada 3000 rpm (960 kali gravitasi) selama 15 menit, selanjutnya diukur serapannya pada 532 nm (Yagi 1968).
HASIL DAN PEMBAHASAN
Ekstraksi Daun Jati BelandaPelarut yang digunakan pada ekstraksi daun jati belanda adalah akuades dan etanol 70%. Pemilihan kedua pelarut ini didasarkan pada penelitian sebelumnya yang telah dilakukan oleh Tombilangi (2004) yang menggunakan pelarut akuades dan etanol 70% untuk mengekstrak daun jati belanda. Metode yang sama juga digunakan untuk mengekstrak sampel yaitu dengan metode refluks. Pada Tabel 2 terlihat bahwa rendemen rata-rata yang dihasilkan dengan menggunakan pelarut akuades ialah sebesar 72.13%, sedangkan pada sampel yang diekstrak menggunakan pelarut etanol 70% sebesar 23.66%. Pada penelitian yang telah dilakukan oleh Tombilangi tidak disebutkan jumlah rendemen ekstrak yang dihasilkan, baik menggunakan pelarut air maupun etanol 70%.
Berdasarkan nilai rendemen yang diperoleh, dapat diketahui bahwa jenis pelarut yang digunakan mempengaruhi jumlah rendemen yang dihasilkan. Nilai rendemen pada ekstrak air sekitar tiga kali lebih besar dari pada ekstrak etanol. Hal ini menunjukkan bahwa senyawa-senyawa yang terlarut pada akuades jauh lebih banyak dibandingkan yang terlarut pada etanol 70%. Penggunaan pelarut yang berbeda mempengaruhi hasil rendemen yang diperoleh. Berdasarkan kepolarannya, akuades melarutkan lebih banyak senyawa polar yang terkandung di dalam daun jati belanda dibandingkan pelarut etanol, sehingga rendemen yang dihasilkan lebih besar.
Tabel 2 Rendemen hasil ekstraksi air dan etanol 70% daun jati belanda
Sampel Bobot ekstrak (g) Bobot sampel (g) Rendemen (%)
Ekstrak air 20.00 13.07 72.13
Kandungan Fitokimia Ekstrak Air dan Ekstrak Etanol 70% Daun Jati Belanda
Analisis fitokimia dilakukan untuk mengetahui kandungan metabolit sekunder sampel yang bersifat kualitatif. Pada uji ini digunakan sampel pembanding berupa buah atau daun dari tanaman yang telah diketahui mengandung senyawa yang akan dianalisis. Sampel pembanding tersebut adalah daun tapak dara untuk uji alkaloid, biji buah pinang untuk uji flavonoid dan uji fenolik hidrokuinon, buah klerak untuk uji saponin, daun teh hijau untuk uji tanin, dan daun som jawa untuk uji steroid dan triterpenoid. Analisis dilakukan terhadap ekstrak kasar daun jati belanda dengan pelarut akuades dan pelarut etanol 70%. Senyawa-senyawa yang diperiksa keberadaannya adalah alkaloid, flavonoid, fenolik hidrokuinon, saponin, tanin, dan steroid dan triterpenoid.
Hasil analisis fitokimia pada Tabel 3 menujukkan bahwa alkaloid tidak terdapat pada ekstrak etanol 70% maupun ekstrak air. Senyawa steroid dan triterpenoid tidak terdapat dalam ekstrak air, namun terdapat dalam ekstrak etanol dalam jumlah sangat kecil. Senyawa flavonoid dan fenolik hidrokuinon memberikan hasil positif pada ekstrak air maupun ekstrak etanol. Saponin memberikan hasil positif pada semua bahan yang dengan adanya busa yang tidak hilang selama lebih dari 10 menit. Senyawa tanin diketahui keberadaannya dengan adanya pembentukan warna biru kehitaman setelah ditambahkan pereaksi FeCl3. Hasil uji steroid
dan triterpenoid memberikan hasil positif pada ekstrak etanol dalam jumlah sangat sedikit, sedangkan ekstrak air tidak mengandung kedua senyawa tersebut. Tidak adanya steroid dan triterpenoid dalam ekstrak air menjelaskan bahwa kedua senyawa ini tidak larut dalam pelarut polar (air), tetapi sedikit larut dalam etanol.
Hasil uji fitokimia ini sesuai dengan apa
yang dilakukan oleh Hartanto (1986) dan Miradiono (2002). Hartanto menyatakan bahwa daun jati belanda mengandung senyawa flavonoid, asam fenolat, tanin, steroid/triterpenoid, dan karotenoid. Sementara Miradiono menyebutkan bahwa serbuk daun jati belanda mengandung flavonoid, fenolik hidrokuinon, dan senyawa flavonoid lain seperti kalkon, auron, dan flavonol.
Hasil yang berbeda ditunjukkan oleh Rachmadani (2001) yang melaporkan bahwa ekstrak air daun jati belanda tidak mengandung flavonoid. Sementara Lestari dan Muhtadi (1997) menyatakan bahwa daun jati belanda hanya mengandung tanin saja. Hasil yang berbeda ini dapat disebabkan karena senyawa metabolit sekunder keberadaan serta jumlahnya dalam tanaman sangat tergantung pada kondisi lingkungan tanaman. Selain itu penggunaan metode, bahan-bahan yang dipakai, serta kesensitifan alat dalam menganalisis senyawa fitokimia tersebut turut mempengaruhi hasil yang diperoleh sehingga hasil yang berbeda dalam setiap penelitian bisa saja terjadi.
Penggunaan pelarut yang berbeda juga ikut mempengaruhi hasil yang diperoleh pada uji fitokimia. Pada ekstrak etanol, kandungan senyawa fitokimia yang diuji lebih besar dibandingkan pada ekstrak air. Hal ini menunjukkan bahwa senyawa-senyawa tersebut lebih larut dalam pelarut etanol. Suharmiati (2003) menyebutkan dalam bukunya bahwa zat-zat yang terkandung dalam jati belanda antara lain tanin, musilago, flavonoid, kafein, b-sitosterol, terpen, triterpen, karotenoid, resin, glukosa, asam lemak, asam fenolat, karbohidrat, dan lain-lain. Selain itu dilihat dari rendemen yang dihasilkan, ektrak air mempunyai nilai rendemen yang jauh lebih tinggi dibandingkan ekstrak etanol. Diasumsikan tidak semua zat terlarut dalam etanol, sedangkan pada pelarut air hampir sebagian besar senyawa polar larut
Tabel 3 Hasil uji fitokimia ekstrak air dan ekstrak etanol 70% daun jati belanda Sampel
Uji
Ekstrak air Ekstrak
etanol 70% Pembanding
Alkaloid Flavonoid Fenolik hidrokuinon Saponin Tanin Steroid triterpenoid - ++ + ++ +++ - - - +++ +++ +++
Daun tapak dara ++++
Biji buah pinang ++++
Biji buah pinang ++++
Duah klerak ++++
++++ Daun teh hijau ++++
+ +
Som jawa ++++
9
di dalamnya. Total senyawa antioksidan yang terekstrak dalam pelarut air dan etanol 70% mungkin saja sama jumlahnya, namun dilihat dari rendemen senyawa total, dapat diindikasikan presentase senyawa-senyawa antioksidan yang terdapat pada ekstrak air lebih kecil dibandingkan pada ekstrak etanol. Hal ini tentu saja mempengaruhi pengamatan pada kepekatan warna yang terbentuk pada uji fitokimia.
Penentuan Waktu Inkubasi Asam Linoleat
Sebelum analisis potensi antioksidasi dilakukan, terlebih dahulu ditentukan waktu inkubasi dari asam linoleat berdasarkan pengukuran serapan diena terkonjugasi yang terbentuk. Selama masa inkubasi, asam linoleat akan dioksidasi oleh oksigen, kemudian asam linoleat yang telah menjadi radikal lipid akan mengalami penataan ulang pada ikatan rangkapnya, sehingga terbentuk ikatan diena terkonjugasi.
Ikatan diena terkonjugasi akan memberikan serapan spesifik pada panjang gelombang 234 nm (Rossel 1983, diacu dalam Tensiska 2001). Semakin banyak ikatan diena terkonjugasi yang terbentuk, maka semakin besar pula nilai serapan yang dihasilkan. Hasil pengukuran serapan diena terkonjugasi dapat dilihat pada Gambar 6. Peningkatan nilai serapan diena terkonjugasi terjadi secara drastis pada hari ke-1. Nilai serapan diena terkonjugasi pada asam linoleat mencapai nilai maksimum terjadi pada hari ke-3. Nilai ini semakin menurun hingga hari ke-7.
Gambar 6 Nilai serapan ikatan diena ter-konjugasi asam linoleat selama waktu oksidasi
Potensi Antioksidasi Ekstrak Air dan Ekstrak Etanol 70% Daun Jati Belanda
Analisis potensi antioksidasi sampel dilakukan pada hari ke-6 dengan harapan
asam linoleat yang telah diinkubasi telah mengalami dekomposisi membentuk malondialdehid (MDA) sebagai produk akhir peroksidasi lipid. Potensi antioksidasi diukur dengan menggunakan metode asam tiobarbiturat (TBA).
Gambar 7 menunjukkan konsentrasi MDA ekstrak air dan ekstrak etanol 70% daun jati belanda. Dapat dilihat bahwa konsentrasi MDA pada kontrol negatif atau tanpa penambahan ekstrak adalah sebesar 20.788
M. Adanya proses oksidasi asam linoleat oleh udara menyebabkan tingginya konsentrasi MDA pada kontrol negatif. Proses oksidasi juga terjadi pada setiap sampel. Pada kontrol positif (Vitamin E 200 ppm), konsentrasi MDA yang dihasilkan sebesar 9.316 M. Rendahnya konsentrasi MDA pada kontrol positif menunjukkan bahwa vitamin E mampu manghambat proses oksidasi pada asam linoleat. Vitamin E di dalam tubuh merupakan substansi yang larut dalam lemak, dan merupakan antioksidan utama dalam semua membran seluler, serta melindungi asam lemak tak jenuh ganda terhadap peristiwa oksidasi. Hal inilah yang menyebabkan vitamin E digunakan sebagai kontrol positif atau pembanding.
Vitamin E 200 ppm pada penelitian ini mampu memberikan daya hambat terhadap pembentukan MDA sebesar 55.18%. Sementara itu Satria (2005) melaporkan bahwa pada konsentrasi 200 ppm, vitamin E mampu menghambat pembentukan MDA sebesar 93.00%, sedangkan Sufriadi (2006) menyebutkan nilai sebesar 84.01% pada konsentrasi yang sama. Hasil yang berbeda ini terjadi karena ada faktor yang ikut mempengaruhi nilai potensi antioksidasi vitamin E sebagai kontrol positif. Walupun vitamin E yang dipakai adalah berasal dari stok yang sama, namun tidak dengan bahan-bahan lainnya. Hal ini memungkinkan adanya perbedaan kemurnian dan kualitas bahan-bahan tersebut yang dapat mempengaruhi hasil yang diperoleh. Selain itu metode yang berbeda juga ikut mempengaruhi lamanya waktu yang digunakan untuk inkubasi asam linoleat. Pada penelitian Satria dan Sufriadi, digunakan metode tiosianat, sedangkan dalam penelitian ini digunakan metode diena terkonjugasi, sehingga perbedaan waktu inkubasi ini ikut mempengaruhi nilai potensi antioksidasi yang diperoleh.
0 0.2 0.4 0.6 0.8 1 1.2 1.4
0 1 2 3 4 5 6 7 8
Hari ke-A b so rb an
2.820 9.012 7.986 11.870 27.369 29.791 9.316 20.788 0 5 10 15 20 25 30 35 Kontrol Negatif (Air) Kontrol Positif (Vit E) Ekstrak air 50 ppm Ekstrak air 200 ppm Ekstrak air 1000 ppm Ekstrak etanol 50 ppm Ekstrak etanol 200 ppm Ekstrak etanol 1000 ppm Ra ta -r a ta [M D A ] ( μ M)
Gambar 7 Konsentrasi MDA ekstrak air dan ekstrak etanol 70% daun jati belanda.
ekstrak air 50 dan 200 ppm masing-masing sebesar 29.791 M dan 27.369 M. Berdasarkan uji statistik (α=0.05), konsentrasi MDA pada kontrol negatif dan ekstrak air 50 dan 200 ppm tidak berbeda nyata, artinya pada konsentrasi 50 dan 200 ppm, ekstrak air daun jati belanda belum mampu menghambat pembentukan MDA secara nyata.
Pengaruh nyata penghambatan MDA pada sampel ditunjukkan oleh ekstrak etanol 70%. Berdasarkan uji statistik (α=0.05), pemberian ekstrak etanol baik yang 50, 200, maupun yang 1000 ppm ternyata mampu menunjukan penghambatan secara nyata pada pembentukan MDA. Konsentrasi MDA pada ekstrak etanol 50, 200, dan 1000 ppm berturut-turut adalah sebesar 7.986, 9.012, dan 2.820 M.
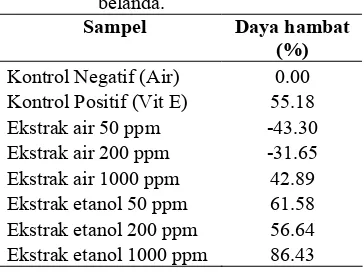
Daya hambat terbesar dari semua ekstrak sampel dimiliki oleh ekstrak etanol 1000 ppm sebesar 86.43%, selanjutnya ekstrak etanol 50 ppm sebesar 61.58%, ekstrak etanol 200 ppm sebesar 56.64%, dan ekstrak air 1000 ppm sebesar 42.89% (Tabel 4). Hal ini menunjukkan bahwa konsentrasi dari ekstrak yang diberikan mempengaruhi potensi antioksidasi sampel. Selain itu juga terdapat perbedaan potensi antioksidasi antara ekstrak air dan ekstrak etanol. Ekstrak etanol lebih berpotensi menghambat pembentukan MDA dibandingkan dengan ekstrak air, karena pada konsentrasi 50 ppm sudah mampu menghambat pembentukan MDA sebesar 61.58%, sedangkan ekstrak air konsentrasi 50 dan 200 ppm belum mampu menghambat pembentukan MDA.
Potensi antioksidasi ekstrak air adalah lebih rendah dibandingkan dengan vitamin E
200 ppm. Pada konsentrasi 200 ppm, vitamin E mempunyai daya hambat sebesar 55.18%, sedangkan pada konsentrasi yang sama ekstrak air belum mampu menghambat pembentukan MDA. Pada konsentrasi 200 ppm ekstrak etanol daun jati belanda mempunyai daya hambat yang sebanding dengan vitamin E, yakni sebesar 56.64%.
Meskipun daya hambat dari masing-masing sampel berbeda besarnya, namun hasil uji statistik (α=0.05) menunjukkan bahwa ekstrak air 1000 ppm, ekstrak etanol 50, 200, 1000 ppm, dan vitamin E 200 ppm adalah tidak berbeda nyata, sehingga dapat disimpulkan bahwa secara statistik, potensi antioksidasi ekstrak air 1000 ppm, ekstrak etanol 50, 200, dan 1000 ppm adalah sebanding dengan potensi antioksidasi vitamin E 200 ppm.
Penelitian yang dilakukan secara in vivo
oleh Tombilangi (2004) menunjukan bahwa ekstrak air dan ekstrak etanol 70% daun jati belanda pada dosis 1 g/kg berat badan mampu
Tabel 4 Daya hambat ekstrak air dan ekstrak etanol 70% daun jati belanda.
Sampel Daya hambat (%)
Kontrol Negatif (Air) 0.00
Kontrol Positif (Vit E) 55.18
Ekstrak air 50 ppm -43.30
Ekstrak air 200 ppm -31.65
Ekstrak air 1000 ppm 42.89
Ekstrak etanol 50 ppm 61.58
Ekstrak etanol 200 ppm 56.64
11
menghambat pembentukan lipid peroksida darah kelinci pada minggu ke-2 secara nyata. Antara ekstrak air dan ekstrak etanol 70% tidak ada perbedaan nyata dalam menghambat lipid peroksida darah kelinci. Dosis 1 g/kg berat badan yang digunakan dalam penelitian tersebut sebanding dengan 10.000 ppm ekstrak daun jati belanda pada penelitian ini, dengan asumsi bobot kelinci yang digunakan adalah 2 kg dan volume darah total 200 mL. Hal ini menunjukkan bahwa penelitian Tombilangi sejalan dengan penelitian ini, yakni pada konsentrasi 10.000 ppm, ekstrak air maupun ekstrak etanol 70% daun jati belanda mampu menghambat pembentukan lipid peroksida.
Jika dibandingkan dengan tanaman obat lainnya, seperti contohnya daun mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.), daun jati belanda mempunyai potensi antioksidasi yang lebih rendah. Sulistiyani et
al. (2006) menyebutkan bahwa pada
konsentrasi 200 ppm eksrak etanol 70% daun mahkota dewa muda dan tua mampu menghambat pembentukan MDA masing-masing sebesar 91.1% dan 89.9%. Sementara itu pada konsentrasi yang sama ekstrak etanol 70% daun jati belanda hanya mampu menghambat sebesar 56.64%. Berdasarkan hasil yang diperoleh, dapat disimpulkan bahwa ekstrak air dan ekstrak etanol dari daun jati belanda terbukti memiliki potensi sebagai antioksidan, namun tidak sebesar tumbuhan obat lainnya.
Adanya potensi atau khasiat sebagai antioksidan didasarkan pada keberadaan senyawa-senyawa yang berfungsi sebagai antioksidan alami yang terdapat pada daun jati belanda antara lain flavonoid, saponin, fenolik hidrokuinon, steroid, triterpenoid, dan tanin. Berdasarkan hasil fitokimia, tiga senyawa fitokimia yakni flavonoid, saponin, dan tanin merupakan senyawa yang dominan terdapat dalam ekstrak air dan ekstrak etanol, sedangkan fenolik hidrokuinon terdapat di ekstrak etanol dalam jumlah besar, namun hanya sebagian kecil yang terdapat dalam ekstrak air. Dua senyawa lain, yaitu steroid dan triterpenoid hanya terdapat di dalam ekstrak etanol. Keberadaan dua senyawa ini dan sebagian besar senyawa yang terdapat dalam ekstrak etanol dicurigai sebagai penyebab tingginya potensi antioksidasi ekstrak etanol dibandingkan dengan ekstrak air daun jati belanda.
Jenis flavonoid berdasarkan strukturnya dibagi dalam beberapa kelompok, antara lain flavon, flavonol, isoflavon, flavanon, dan
flavan (Samman et al. 1999). Dari beberapa jenisnya, ada yang mampunyai nilai RSA (Radical Scavenging Activity) yang besar (>50%), yaitu morin, taksifolin, kuersetin, kuesetrin, rutin katekin, dan 3-hidroksiflavon. (Amić et al. 2003). Palupi et al. (2000) telah berhasil mengidentifikasi senyawa flavonoid pada fraksi etil asetat daun jati belanda dan menemukan dua senyawa flavonoid, yaitu senyawa Gu-1 dan Gu-2 yang keduanya merupakan jenis flavonol dengan gugus hidroksi bebas. Diasumsikan flavonoid jenis ini yang berperan menghambat proses oksidasi asam linoleat.
Selain flavonoid, keberadaan saponin dan tanin telah terbukti memiliki aktivitas sebagai antioksidan. Mangan (2003) menuturkan bahwa saponin berkhasiat sebagai antitumor dan menghambat pertumbuhan kanker kolon. Tanin merupakan senyawa yang banyak terkandung dalam teh dan telah terbukti mampu menghambat proses mutasi, dan membersihkan radikal bebas, serta menginduksi enzim yang bersifat antioksidan (Yen 1995).
SIMPULAN DAN SARAN
SimpulanHasil penelitian menunjukkan bahwa ekstrak etanol 70% daun jati belanda terbukti lebih berpotensi menghambat pembentukan MDA dibandingkan dengan ekstrak air. Pada konsentrasi 50 ppm dan 200 ppm, ekstrak air daun jati belanda belum mampu menghambat pembentukan MDA, namun pada konsentrasi 1000 ppm mampu menghambat sebesar 42.89%. Daya hambat ekstrak etanol daun jati belanda pada konsentrasi 50, 200, dan 1000 ppm masing-masing adalah sebesar 61.58%, 56.64%, dan 86.43%.
Saran
Perlu dilakukan penelitian lebih lanjut untuk mengembangkan ekstrak etanol 70% daun jati belanda sebagai produk fitofarmaka. Selain itu perlu dilakukan pula metode ekstraksi dengan menggunakan pelarut yang berbeda.
DAFTAR PUSTAKA
Adawiyah DR, Sarastani D, Fardiaz D. 2001. Kajian aktivitas antioksidan biji buah atung (Parinarium glaberimum Hassk.) [laporan penelitian]. Bogor: Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Atmosukarto K, Rahmawati M. 2003. Mencegah penyakit degeneratif dengan
makanan. Cermin Dunia Kedokteran
140:41-49.
Anonim 2000: http://www.asiamaya.com/ jamu/isi/jatibelanda_sterculiaceae.htm.
Darusman LK. 2002. Standardisasi daun jati belanda (Guazuma ulmifolia Lamk.), keamanan, dan kemanfaatannya sebagai pelangsing/penurun kolesterol. Laporan Akhir Pekerjaan Riset Unggulan Kemitraan VII. PT Indofarma dan Pusat Studi Biofarmaka. Bogor: Lembaga Penelitian IPB.
Dewi et al. 2000. Ragam penggunaan jati belanda (Guazuma ulmifolia Lamk.) dalam jamu berbungkus yang beredar di pasaran. Warta Tumbuhan Obat Indonesia. 6:9-11.
Farida, Monica WS. 2000. Pengaruh ekstrak daun jati belanda (Guazuma ulmifolia
LamK.) terhadap penurunan kadar kolesterol darah kelinci. Warta Tumbuhan Obat Indonesia. 6:12-13.
Gordon, M.H 1990. The mechanism of antioxidants action in vitro. Di dalam: B.J.F. Hudson, editor. Food Antioxidants. London: .Elsivier Applied Science.
Hartanto B. 1986. Fitokimia daun jati belanda (Guazuma ulmifolia Lamk.). [tesis]. Bandung: Jurusan Farmasi FMIPA Institut Teknologi Bandung.
Harborne JB. 1987. Metode Fitokimia. Padmawinata K, Soediro I, penerjemah; Niksolihin S editor. Bandung: Penerbit
ITB. Terjemahan dari: Phytochemical Methode.
Hernani, Rahardjo M. 2005. Tanaman
Berkhasiat Antioksidan. Jakarta: Penebar Swadaya.
Joshita D, Azizahwati, Wahyuditomo. 2000. Pengaruh daun jati belanda terhadap kerja enzim lipase secara invitro. Warta Tumbuhan Obat Indonesia. 6:6-8.
Kartawiguna E. 1998. Vitamin yang berfungsi
sebagai antioksidan. Majalah Ilmiah
Kedokteran USAKTI 17(1):16-26.
Kikuzaki H, Nakatani N. 1993. Antioxidant effects of some ginger contituents. J Food Science 58:1407-1410.
Lautan J. 1997. Radikal bebas pada eritrosit dan lekosit. Cermin Dunia Kedokteran
116:49-52.
Lestari K, Muhtadi A. 1997. Uji aktifitas antihiperlipidemia daun jati belanda (Guazuma ulmifolia Lamk) pada tikus. Laporan Penelitian. Bandung: Universitas Padjajaran.
Mangan. 2003. Cara bijak Menaklukan Kanker. Jakarta : Agromedia Pustaka.
Miradiono A. 2002. Efektivitas pengekstrak senyawa flavonoid dari daun jati belanda (Guazuma ulmifolia Lamk.). [skripsi]. Bogor: IPB.
Mimić-Oka J, Simić DV, dan Simić TP. 1999. Free radicals in cardiovaskular desease.
The Scientific Journal Facta Universitatis
6: 11-12.
Muhilal. 1991. Teori radikal bebas dalam gizi
dan kedokteran. Cermin Dunia
Kedokteran 73: 9-11.
Murray RK, Granner DK, Mayes PA, Rodwell VW. 1999. Biokimia Harper. Hartono A, penerjemah; Santoso AH, editor. Jakarta: Penerbit Buku Kedokteran EGC. Terjemahan dari: Harper’s Biochemistry. Palupi et al. 2000. Isolasi dan identifikasi
senyawa flavonoid pada fraksi etil asetat daun jati belanda (Guazuma ulmifolia
LamK. Var. Tomentosa K Schum.) Warta Tumbuhan Obat Indonesia. 6:1-5.
13
Bogor: Jurusan Kimia FMIPA Institut Pertanian Bogor.
Satria E. 2005. Potensi antioksidan dari daging buah muda dan daging buah tua
mahkota dewa (Phaleria macrocarpa
(Scheff.) Boerl.). [skripsi]. Bogor: Program Studi Biokimia FMIPA IPB.
Sies H. 1991. Oxidative Stress. From Basic Research To Clinical Application.
Am.J.Med. 93: 480-489.
Siregar P. 1992. Metabolit oksigen radikal bebas dan kerusakan jaringan. Cermin Dunia Kedokteran 80: 112-115.
Sulistiyani, Anton S, Mega S. 2006. Manfaat
daun kayu manis (Cinnamomum
burmanni) terhadap khasiat antioksidasi
mahkota dewa (Phaleria macrocarpa
(Scheff.) Boerl.) selama penyimpanan. [abstrak]. Di dalam : Seminar Nasional Tumbuhan Obat Indonesia XXIX; Solo, 24-25 Mar 2006. Solo : FK UNS Solo & Pokjanas TOI. hlm 66. Abstr MP.PEF.27.
Sufriadi A. 2006. Manfaat daun kayu manis (Cinnamomum burmanni) terhadap khasiat antioksidasi mahkota dewa (Phaleria macrocarpa (Scheff.) Boerl.) selama penyimpanan. [skripsi]. Bogor : Program Studi Biokimia FMIPA IPB.
Tensiska. 2001. Aktivitas antioksidan ekstrak
buah andaliman (Zanthoxylum
acanthopodium DC) dalam beberapa sistem pangan dan kestabilan aktivitasnya terhadap kondisi suhu dan pH. [tesis]. Bogor: Program pasca sarjana Institut Pertanian Bogor.
Tombilangi AK. 2004. Khasiat ekstrak daun jati belanda (Guazoma ulmifolia Lamk.) terhadap kadar lipid peroksida darah kelinci yang hiperlipidemia. [skripsi]. Bogor: Program Studi Biokimia Departemen Kimia FMIPA IPB.
Tuminah S. 2000. Radikal bebas dan antioksidan-kaitannya dengan nutrisi dan
penyakit kronis. Cermin Dunia
Kedokteran 128: 49-51.
Yagi K. 1994. Lipid peroxides and related radicals in clinical medicine. Di dalam:
Free Radicals in Diagnostic Medicine. Penyunting: Amstrong D. New York, Plenum Press.
Yen GC, Hui YC. 1995. Antioxidant activity of various extracts in relation to their
Lampiran 1 Tahapan ekstraksi daun jati belanda
Daun Jati Belanda (Guazuma ulmifolia
Lamk.) Kering
Erlenmeyer 500 ml
Etanol 70% 200 ml
Rotavapour hingga pekat
Dikeringkan dalam oven 40 ºC hingga
kering Dipanaskan 70 ºC, 2 jam Erlenmeyer
500 ml
Akuades 200 ml
Dipanaskan 100 ºC, 4 jam
Rotavapour hingga pekat
Dikeringkan dalam oven 40 ºC hingga
kering
15
Lampiran 2 Rendemen hasil ekstraksi daun jati belanda
Sampel
Bobot sampel (g)
Bobot ekstrak (g)
Rendemen (%)
Rendemen rata-rata (%)
Ekstrak air
ulangan-1 20.00 13.07 65.35
Bobot ekstrak
Bobot sampel x 100 % 13.07
20.00 x 100 % Ekstrak air
ulangan-2 20.02 15.80 78.92
72.13
Ekstrak etanol 70 % ulangan-1
20.01 4.73 23.63
23.66 Ekstrak etanol
70 % ulangan-2
20.40 4.83 23.67
Contoh perhitungan: Rendemen (%) =
=
= 65.35 %
Lampiran 3 Penentuan waktu inkubasi asam linoleat dengan metode diena
terkonjugasi
Botol Gelap
2 ml bufer fosfat 0,1 M pH 7 2 ml asam linoleat 50 mM 1 ml air bebas ion
Inkubasi 40 0C
Diambil 50 l setiap hari sampai hari ke 7
Larutan 50 l
6 ml etanol 75%
Larutan
Didiamkan 3 menit
Lampiran 4 Hasil analisis hidroperoksida
Serapan
Hari ke- Ulangan 1 Ulangan 2 Ulangan 3 Rata-rata
0 0.719 0.731 0.742 0.730 1 1.123 1.107 1.137 1.122 2 1.184 1.120 1.189 1.164 3 1.201 1.127 1.205 1.177 4 1.107 1.090 1.158 1.118 5 1.046 1.085 1.069 1.066 6 0.946 1.035 0.968 0.983 7 0.835 0.991 0.831 0.885
Lampiran 5 Pembuatan kurva standar
Tetrametoksi Propana (TMP) 6 M
Pengenceran
1.5 µM 3.0 µM 6.0 µM 9.0 µM 12.0 µM 15.0 µM
1 ml tiap larutan diambil
2 ml TCA 20%
2 ml TBA 1 % dalam asam asetat 50%
Larutan
Larutan
Supernatan
Inkubasi 100 0C selama 10 menit Lalu dinginkan
Sentrifus 3000 rpm selama 15 menit
Diukur serapannya pada 532 nm
17
Lampiran 6 Hasil pengukuran standar TMP (1,1,3,3-tetrametoksi propana)
Serapan Konsentrasi TMP
(µM) 1 2 Rata-rata SD
0.00 0.000 0.000 0.000 ± 0.000
1.50 0.042 0.051 0.046 ± 0.006
3.00 0.106 0.100 0.103 ± 0.005
6.00 0.205 0.205 0.205 ± 0.000
9.00 0.320 0.313 0.316 ± 0.005
12.00 0.418 0.420 0.419 ± 0.002
15.00 0.527 0.517 0.522 ± 0.007
18.00 0.626 0.631 0.628 ± 0.004
y = 0.0351x - 0.0027 R2 = 0.9999
-0.1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7
0 5 10 15 20
Konsentrasi TMP (µM)
Se
ra
pa
n
Lampiran 7 Absorban pengukuran MDA sampel
Serapan Hari ke-0 Serapan Hari ke-6
Sampel
1 2 3 1 2 3
Kontrol Negatif (Air) 0.392 0.421 0.411 1.501 1.081 0.831
Kontrol Positif (Vit E) 0.396 0.401 0.393 0.820 0.682 0.669
Ekstrak air 50 ppm 0.448 0.443 0.433 2.189 1.069 1.203
Ekstrak air 200 ppm 0.429 0.398 0.469 1.945 1.008 1.225
Ekstrak air 1000 ppm 0.493 0.462 0.517 1.131 0.799 0.792
Ekstrak etanol 50 ppm 0.501 0.553 0.527 0.928 0.746 0.748
Ekstrak etanol 200 ppm 0.556 0.528 0.558 0.993 0.782 0.816
Lampiran 8 Pengukuran kadar malondialdehida sampel
1000 ppm
50 ppm 200 ppm
Sampel
Pengenceran
Vitamin E
200 ppm
1 ml tiap larutan diambil
2 ml bufer fosfat 0,1 M pH 7 2 ml asam linoleat 50 mM 1 ml air bebas ion
Inkubasi 40 0C
Larutan diambil 1 ml
Lama inkubasi ditentukan dari pengukuran diena terkonjugasi asam linoleat
2 ml TCA 20%
2 ml TBA 1% dalam asam asetat 50%
Larutan
Dipanaskan 100 0 C selama 10 menit Lalu dinginkan
Sentrifus 3000 rpm selama 15 menit
Supernatan
19
Sampel [MDA] hari ke-0 (μM)
[MDA] hari ke-6 (μM)
[MDA] (μM) SD
rata-rata [MDA]
(μM)
daya hambat
(%)
Kontrol Negatif (Air)-1 11.245 42.840 31.595
Kontrol Negatif (Air)-2 12.071 30.874 18.803 10.0 20.788 0.00
Kontrol Negatif (Air)-3 11.786 23.752 11.965
Kontrol Positif (Vit E)-1 11.501 19.507 8.005
Kontrol Positif (Vit E)-2 11.273 19.136 7.863 2.4 9.316 55.18
11.358 23.438 12.079
Lampiran 9 Data konsentrasi MDA dan
daya hambat masing-masing sampel
19
Kontrol Positif (Vit E)-3
Ekstrak air 50 ppm-1 12.698 30.532 17.834
Ekstrak air 50 ppm-2 12.840 62.441 49.601 17.3 29.791 -43.30
Ekstrak air 50 ppm-3 12.413 34.350 21.937
Ekstrak air 200 ppm-1 11.415 28.794 17.378
Ekstrak air 200 ppm-2 12.299 55.490 43.190 13.8 27.369 -31.65
Ekstrak air 200 ppm-3 13.438 34.977 21.538
Ekstrak air 1000 ppm-1 13.239 22.840 9.601
Ekstrak air 1000 ppm-2 14.122 32.299 18.176 5.5 11.870 42.89
Ekstrak air 1000 ppm-3 14.806 22.641 7.834
Ekstrak etanol 50 ppm-1 14.350 26.515 12.165
Ekstrak etanol 50 ppm-2 15.831 21.330 5.498 3.6 7.986 61.58
Ekstrak etanol 50 ppm-3 15.091 21.387 6.296
Ekstrak etanol 200 ppm-1 15.917 28.367 12.450
Ekstrak etanol 200 ppm-2 15.119 22.356 7.236 3.0 9.012 56.64
Ekstrak etanol 200 ppm-3 15.974 23.324 7.350
Ekstrak etanol 1000 ppm-1 15.461 13.609 0.00
Ekstrak etanol 1000 ppm-2 15.575 19.905 4.330 3.5 2.820 86.43
Lampiran 10 Analisis statistik potensi antioksidasi sampel
Uji Anova Sampel daun jati belanda
Sum of
Squares df
Mean
Square F Sig.
Between Groups 2087.44 7 298.2056 3.610973 0.015846
Within Groups 1321.331 16 82.58318
Total 3408.77 23
Uji lanjut Duncan
Kelompok Perlakuan
Ulangan
(N) Subset for alpha = 0.05
1 2 3 4
Ekstrak etanol 70% 1000 ppm 3 2.203513
Ekstrak etanol 70% 50 ppm 3 7.986705 7.986705
Ekstrak etanol 70% 200 ppm 3 9.012346 9.012346
Kontrol positif 3 9.316239 9.316239
Ekstrak air 1000 ppm 3 11.87085 11.87085 11.87085
Kontrol negatif 3 20.78822 20.78822 20.78822
Ekstrak air 200 ppm 3 27.36913 27.36913
Ekstrak air 50 ppm 3 29.79103
Sig. 0.255831 0.137699 0.063949 0.266964
21
Lampiran 11 Hasil uji fitokimia
Alkaloid:
a. Ekstrak etanol b. Ekstrak air c. Pembanding
Flavonoid: a.Pembanding b.Ekstrak etanol c.Ekstrak air
Fenolik Hidrokuinon: a.Pembanding b.Ekstrak etanol c.Ekstrak air
Saponin:
a.Pembanding b.Ekstrak air c.Ekstrak etanol
Tanin:
a.Pembanding b.Ekstrak etanol c.Ekstrak air
Triterpenoid: a.Pembanding b.Ekstrak etanol c.Ekstrak air
Steroid:
a. Pembanding
b. Ekstrak etanol c. Ekstrak air