SKRIPSI
MEMPELAJARI POTENSI GARUT (
Maranta arundiacea
L.)
DAN GANYONG (
Canna edulis
, Kerr) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT
Oleh
KIKI KRISNAYUDHA F24102053
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
MEMPELAJARI POTENSI GARUT (Maranta arundiacea L.) DAN GANYONG (Canna edulis, Kerr) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT
COVER DALAM
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
KIKI KRISNAYUDHA F24102053
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI POTENSI GARUT (Maranta arundiacea L.) DAN GANYONG (Canna edulis, Kerr) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT
LEMBAR PENGESAHAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
KIKI KRISNAYUDHA F24102088
Dilahirkan pada tanggal 9 Maret 1984 di Depok
Tanggal lulus: 5 Februari 2007 Menyetujui,
Bogor, Februari 2007
Mengetahui, Dr. Ir. Lilis Nuraida, M.Sc
Dosen Pembimbing 1
Didah Nur Faridah, STP, M.Si Dosen Pembimbing 2
Kiki Krisnayudha. F24102053. Mempelajari Potensi Garut (Maranta arundiacea l.) dan Ganyong (Canna edulis, kerr) Untuk Mendukung Pertumbuhan Bakteri Asam Laktat. Di bawah bimbingan Dr. Ir. Lilis Nuraida, M.Sc dan Didah Nur Faridah, STP M.Si
RINGKASAN
Prebiotik merupakan salah satu jenis pangan fungsional yang berguna bagi kesehatan. Pada umumnya prebiotik tidak dapat dicerna secara alami oleh usus manusia, namun memberikan efek yang menguntungkan pada flora intestinal melalui stimulasi pertumbuhan dan aktivitas satu atau lebih jenis bakteri yang menguntungkan bagi kesehatan. Salah satu kelompok bahan pangan yang berpotensi sebagai prebiotik adalah kelompok oligosakarida. Kelompok oligosakarida yang telah dikenal berpotensi sebagai prebiotik diantaranya adalah rafinosa, inulin, fruktooligosakarida (FOS), oligofruktosa, dan glukooligosakarida (GOS). Penelitian ini bertujuan (1) mengidentifikasi oligosakarida pada umbi garut (Maranta arundiacea L.) dan ganyong (Canna edulis Kerr.), (2) mengevaluasi potensi prebiotik dari senyawa oligosakarida yang terdapat pada umbi garut dan umbi ganyong, dan (3) mengkaji pengaruh pengolahan terhadap potensi prebiotik pada tepung garut dan tepung ganyong
Tahapan penelitian yang dilakukan meliputi : (1) identifikasi oligosakarida, (2) pengujian ekstrak gula dari tepung umbi untuk mendukung pertumbuhan BAL, (3) pengujian kompetisi BAL terbaik melawan patogen pada ekstrak gula tepung umbi dan (4) pengaruh proses pengolahan tepung umbi terhadap potensi prebiotiknya.
Tahap identifikasi oligosakarida dilakukan menggunakan kromatografi kertas. Hasil identifikasi menunjukkan bahwa pada ekstrak gula tepung umbi garut maupun ganyong terdapat kandungan rafinosa dan oligofruktosa, namun kandungannya sangatlah kecil. Selanjutnya ekstrak umbi garut dan umbi ganyong digunakan pada pengujian selanjutnya.
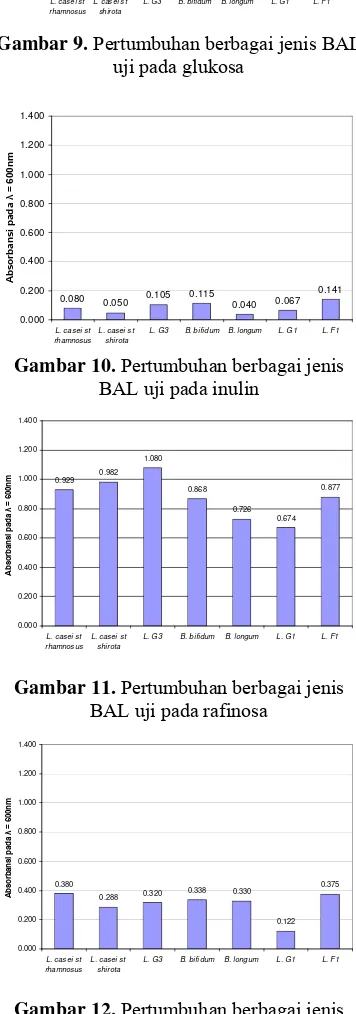
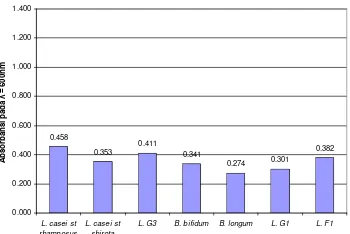
Tahap pengujian ekstrak gula tepung umbi untuk mendukung pertumbuhan BAL menggunakan tujuh jenis BAL uji yaitu Lactobacillus casei strain rhamnosus, L. casei strain shirota, Lactobacillus G3, Lactobacillus G1, Lactobacillus F1, Bifidobacterium bifidum dan B. longum. Hasil pengujian pertumbuhan BAL pada ekstrak gula tepung umbi, menunjukkan ketujuh BAL dapat menggunakan ekstrak gula tepung umbi garut dan ganyong untuk mendukung pertumbuhannya. Dari BAL genus Lactobacillus pertumbuhan terbaik diamati pada Lactobacillus G3 dengan nilai absorbansi sebesar 0.410 pada pengujian dengan ekstrak gula tepung umbi garut dan nilai absorbansi sebesar 0.752 pada pengujian dengan ekstrak gula tepung umbi ganyong. Dari BAL genus Bifidobacterium pertumbuhan terbaik dicapai oleh B. bifidum dengan nilai absorbansi sebesar 0.341 pada pengujian dengan ekstrak gula tepung umbi garut dan nilai absorbansi sebesar 0.682 pada pengujian dengan ekstrak gula tepung umbi ganyong. Kedua BAL terbaik kemudian digunakan pada pengujian kompetisi BAL melawan patogen pada ekstrak gula tepung umbi.
menggunakan dengan baik ekstrak gula tepung umbi garut dan ganyong sebagai sumber gula untuk pertumbuhannya sehingga mampu mereduksi jumlah patogen. Pada pengujian kompetisi Lactobacillus G3 melawan patogen dengan waktu kompetisi 24 jam, jumlah Salmonella mengalami penurunan sebesar 0.8 log cfu/ml pada ekstrak gula tepung umbi garut dan 1.0 log cfu/ml pada ekstrak gula tepung umbi ganyong, E. coli sebesar 1.0 log cfu/ml pada ekstrak gula tepung umbi garut dan 2.6 log cfu/ml pada ekstrak gula tepung umbi ganyong, B. cereus sebesar 3.0 log cfu/ml pada ekstrak gula tepung umbi garut dan 2.5 log cfu/ml pada ekstrak gula tepung umbi ganyong.
Pada pengujian kompetisi B. bifidum melawan patogen dengan waktu kompetisi 48 jam, jumlah Salmonella mengalami penurunan sebesar 2.6 log cfu/ml pada ekstrak gula tepung umbi garut dan 3.9 log cfu/ml pada ekstrak gula tepung umbi ganyong, E. coli sebesar 4.4 log cfu/ml pada ekstrak gula tepung umbi garut dan sebesar 4.2 log cfu/ml pada ekstrak gula tepung umbi ganyong. B. cereus sebesar 2.0 log cfu/ml pada ekstrak gula tepung umbi garut dan 3.8 log cfu/ml pada ekstrak gula tepung umbi ganyong.
Proses pengolahan terhadap potensi prebiotik menunjukkan adanya pengaruh pengolahan terhadap karakter fisik dari tepung dan ekstrak yang dihasilkan. Perubahan umumnya terjadi pada warna dan aroma. Warna yang dihasilkan lebih coklat, perubahan warna tersebut terjadi baik pada tepung maupun ekstrak yang dihasilkan. Pengaruh pengolahan terhadap komposisi dari gula pada ekstrak gula tepung umbi menunjukkan terbebasnya senyawa oligosakarida dan gula sederhana akibat gelatinisasi matriks pati. Dan terbentuknya komponen yang tidak dapat digunakan oleh BAL untuk pertumbuhannya akibat reaksi pencoklatan.
Hasil dari uji pertumbuhan BAL didalam ekstrak gula tepung umbi olahan menunjukkan nilai absorbansi pertumbuhan BAL uji yang tinggi pada ekstrak yang dikukusan dan dipanggang, namun rendah pada ekstrak gula tepung umbi yang disangray . Nilai absorbansi pertumbuhan BAL uj yang tinggi diduga akibat terbebasnya gula sederhana dari gelatinisasi matriks pati dan selama pengolahan berlangsung.
RIWAYAT PENULIS
Penulis dilahirkan di Depok pada tanggal 9 Maret 1984 dan merupakan putra kedua dari pasangan Dudun Rusmana dan Herawati Budhyarsi. Penulis menyelesaikan pendidikan dasarnya pada tahun 1996 di SD Budi Asih Manggarai, kemudian melanjutkan pendidikan menengah pertama di SLTP Negeri 115 Tebet hingga tahun 1999. Penulis menamatkan pendidikan menengah atas di SMU Negeri 8 Jakarta pada tahun 2002. Penulis melanjutkan pendidikan tinggi di Insitut Pertanian Bogor dengan mengambil jurusan Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian melalui Ujian Saringan Masuk IPB (USMI) pada tahun 2002.
Selama menjalani studi di IPB, penulis aktif di berbagai kegiatan dan organisasi kemahasiswaan dan lembaga pendidikan informal. Diantaranya menjadi pengurus Food Chat Club, anggota sie. acara Lepas Landas Sarjana Fakultas Teknologi Pertanian September 2003, Wakil ketua The 3rd National Student’s Paper Competition on Food Issues, anggota sie. pubdekdok Lomba
KATA PENGANTAR
Alhamdulillah,penulis panjatkan puji dan syukur kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Penulis menyadari bahwa terselesaikannya skripsi ini tidak lepas dari bantuan berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih sedalam-dalamnya kepada:
1. Mama dan teteh tercinta atas segala kesabaran dan jerih payahnya yang telah mengantarkan penulis mencapai pendidikan perguruan tinggi
2. Dr. Ir. Lilis Nuraida, M.Sc selaku Pembimbing Akademik atas segala ilmu, bimbingan, dan nasihat yang telah diberikan.
3. Didah Nur Faridah, STP, M.Si selaku pembimbing dalam penelitian atas segala bimbingan dan motivasi yang telah diberikan.
4. Dr. Ir. Feri Kusnandar, M.Sc selaku penguji dan penanggung jawab proyek yang penulis jalani atas segala dukungan, bimbingan, motivasi dan nasihat yang telah diberikan
5. Pak Koko yang telah memberikan segala upaya, tenaga dan waktu untuk membantu penulis menyelesaikan tugas akhir
6. Farah Sitaresmi yang selalu menemani dan memberikan semangat yang tiada hentinya kepada penulis.
7. Nurul Kartika Sari yang selalu memberikan motivasi, semangat dan teman dalam senang maupun susah.
8. Teman-teman staf BTA 8, Mas Dadang, Sakti, Ian, Mba Dewi, Mba Upik dan Reni yang selalu memahami dan memberikan support.
9. Teman-teman seperjuangan dalam penelitian, Hana, mba Nani, bu Rini yang bersama-sama memberikan semangat dan motivasi
10. Teknisi laboran Laboratorium dept ITP dan SEAFAST, pak Yahya, pak Wahid, pak Sob, pak Mul, bu Rub, teh Ida, mas Edi, pak Gatot, pak Rojak, pak Taufik, mba Ari, dan mang Minta yang senantiasa membantu penulis
Era, tim delivery (Ijal, Didin, Dadik, Boy), Aponk “sepupu”, teman satu sekolah (Ginea, Dora), tim capsa and troof (Ribka, Ina, Akew, Ajeng, Tintin, Prasna), teman-teman labkom (Konk, Hans, Ados, Putra, Kani, Imam, Faried, Teddy, Rial, bu Dias, mba Darsih, mas Dodi), tim Pati Resisten (Woro, Manginar, Nanda, Shinta), kelompok B5 (Maya, Yayah), Nene “ samchan”, Hansib, Tissa “tinggi bet”, Deddy, teman-teman DOTA’ers and CS’ers (Hendy, Agus, Meiko, Widhi, Andhal), adik-adik kelas ex-siswa les PTP, tim binglas BTA 8.
12. Enya, Tiesto, Kahitna, dan Warkop yang tidak bosan-bosan menghibur penulis.
13. Semua pihak yang telah membantu penulis, yang tidak dapat disebutkan satu per satu.
Tak ada gading yang tak retak, penulis menyadari bahwa masih ada kekurangan dalam diri penulis. Namun penulis berharap kekurangan tersebut tidak menghalangi niat baik penulis dan tulisan ini dapat berguna bagi penulis dan semua pihak yang memerlukan.
Februari 2007
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
DAFTAR TABEL... ix
DAFTAR GAMBAR ...x
DAFTAR LAMPIRAN... xii
I. PENDAHULUAN ...1
A. LATAR BELAKANG ...1
B. TUJUAN PENELITIAN...2
C. MANFAAT...2
D. SASARAN ...2
II. TINJAUAN PUSTAKA ...3
A. GARUT (Maranta arundiacea L.) ...3
1. Botani dan Budidaya Garut...3
2. Komposisi Kimia Umbi Garut dan Pengolahannya...4
B. GANYONG (Canna edulis, Kerr) ...5
1. Botani dan Budidaya Ganyong ...5
2. Komposisi Kimia Umbi Ganyong dan Pengolahannya ...7
C. PREBIOTIK...8
D. BAKTERI ASAM LAKTAT...9
1. Lactobacillus casei...9
2. Lactobacillus F1...10
3. Lactobacillus G1...11
4. Lactobacillus G3...12
5. Bifidobacterium bifidum...12
6. Bifidobacterium longum...13
III. METODOLOGI PENELITIAN...14
A. BAHAN DAN ALAT ...14
1. Bahan ...14
B. METODE PENELITIAN...15
1. Pembuatan Tepung...15
2. Ekstraksi oligosakarida (Muchtadi, 1989) ...17
3. Penyegaran dan Pengawetan Kultur ...18
4. Persiapan Media Fermentasi ...18
5. Uji Pertumbuhan BAL pada Ekstrak Gula Tepung Umbi ...19
6. Kompetisi BAL dan Uji Patogen ...20
7. Pengaruh Pengolahan Tepung Garut dan Tepung Ganyong Terhadap Potensi Prebiotik ...21
C. METODE ANALISIS...23
1. Analisis Kadar Oligosakarida Kualitatif (Mulimani, 2005) ...23
2. Total Padatan Terlarut ( Total solid )...23
3. Analisis Pertumbuhan BAL pada Ekstrak Gula Tepung Garut dan Tepung Ganyong...24
4. Analisis Kompetisi BAL melawan Patogen pada Ekstrak Gula Tepung Garut dan Tepung Ganyong...24
IV. HASIL DAN PEMBAHASAN...27
A. TEPUNG UMBI GARUT (Maranta arundiacea L.) DAN UMBI GANYONG (Canna edulis Kerr.) ...27
B. EKSTRAKSI OLIGOSAKARIDA ...28
C. IDENTIFIKASI OLIGOSAKARIDA ...30
D. PENGUJIAN EKSTRAK GULA TEPUNG UMBI UNTUK MENDUKUNG PERTUMBUHAN BAL ...37
E. KOMPETISI BAL TERBAIK DENGAN PATOGEN PADA EKSTRAK GULA TEPUNG UMBI ...44
F. PENGARUH PROSES PENGOLAHAN TEPUNG UMBI TERHADAP POTENSI PREBIOTIK ...53
1. Pengaruh Proses Pengolahan terhadap Tepung dan Ekstrak Gula Tepung Umbi ...54
SKRIPSI
MEMPELAJARI POTENSI GARUT (
Maranta arundiacea
L.)
DAN GANYONG (
Canna edulis
, Kerr) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT
Oleh
KIKI KRISNAYUDHA F24102053
2007
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
MEMPELAJARI POTENSI GARUT (Maranta arundiacea L.) DAN GANYONG (Canna edulis, Kerr) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT
COVER DALAM
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
KIKI KRISNAYUDHA F24102053
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
MEMPELAJARI POTENSI GARUT (Maranta arundiacea L.) DAN GANYONG (Canna edulis, Kerr) UNTUK MENDUKUNG
PERTUMBUHAN BAKTERI ASAM LAKTAT
LEMBAR PENGESAHAN
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
KIKI KRISNAYUDHA F24102088
Dilahirkan pada tanggal 9 Maret 1984 di Depok
Tanggal lulus: 5 Februari 2007 Menyetujui,
Bogor, Februari 2007
Mengetahui, Dr. Ir. Lilis Nuraida, M.Sc
Dosen Pembimbing 1
Didah Nur Faridah, STP, M.Si Dosen Pembimbing 2
Kiki Krisnayudha. F24102053. Mempelajari Potensi Garut (Maranta arundiacea l.) dan Ganyong (Canna edulis, kerr) Untuk Mendukung Pertumbuhan Bakteri Asam Laktat. Di bawah bimbingan Dr. Ir. Lilis Nuraida, M.Sc dan Didah Nur Faridah, STP M.Si
RINGKASAN
Prebiotik merupakan salah satu jenis pangan fungsional yang berguna bagi kesehatan. Pada umumnya prebiotik tidak dapat dicerna secara alami oleh usus manusia, namun memberikan efek yang menguntungkan pada flora intestinal melalui stimulasi pertumbuhan dan aktivitas satu atau lebih jenis bakteri yang menguntungkan bagi kesehatan. Salah satu kelompok bahan pangan yang berpotensi sebagai prebiotik adalah kelompok oligosakarida. Kelompok oligosakarida yang telah dikenal berpotensi sebagai prebiotik diantaranya adalah rafinosa, inulin, fruktooligosakarida (FOS), oligofruktosa, dan glukooligosakarida (GOS). Penelitian ini bertujuan (1) mengidentifikasi oligosakarida pada umbi garut (Maranta arundiacea L.) dan ganyong (Canna edulis Kerr.), (2) mengevaluasi potensi prebiotik dari senyawa oligosakarida yang terdapat pada umbi garut dan umbi ganyong, dan (3) mengkaji pengaruh pengolahan terhadap potensi prebiotik pada tepung garut dan tepung ganyong
Tahapan penelitian yang dilakukan meliputi : (1) identifikasi oligosakarida, (2) pengujian ekstrak gula dari tepung umbi untuk mendukung pertumbuhan BAL, (3) pengujian kompetisi BAL terbaik melawan patogen pada ekstrak gula tepung umbi dan (4) pengaruh proses pengolahan tepung umbi terhadap potensi prebiotiknya.
Tahap identifikasi oligosakarida dilakukan menggunakan kromatografi kertas. Hasil identifikasi menunjukkan bahwa pada ekstrak gula tepung umbi garut maupun ganyong terdapat kandungan rafinosa dan oligofruktosa, namun kandungannya sangatlah kecil. Selanjutnya ekstrak umbi garut dan umbi ganyong digunakan pada pengujian selanjutnya.
Tahap pengujian ekstrak gula tepung umbi untuk mendukung pertumbuhan BAL menggunakan tujuh jenis BAL uji yaitu Lactobacillus casei strain rhamnosus, L. casei strain shirota, Lactobacillus G3, Lactobacillus G1, Lactobacillus F1, Bifidobacterium bifidum dan B. longum. Hasil pengujian pertumbuhan BAL pada ekstrak gula tepung umbi, menunjukkan ketujuh BAL dapat menggunakan ekstrak gula tepung umbi garut dan ganyong untuk mendukung pertumbuhannya. Dari BAL genus Lactobacillus pertumbuhan terbaik diamati pada Lactobacillus G3 dengan nilai absorbansi sebesar 0.410 pada pengujian dengan ekstrak gula tepung umbi garut dan nilai absorbansi sebesar 0.752 pada pengujian dengan ekstrak gula tepung umbi ganyong. Dari BAL genus Bifidobacterium pertumbuhan terbaik dicapai oleh B. bifidum dengan nilai absorbansi sebesar 0.341 pada pengujian dengan ekstrak gula tepung umbi garut dan nilai absorbansi sebesar 0.682 pada pengujian dengan ekstrak gula tepung umbi ganyong. Kedua BAL terbaik kemudian digunakan pada pengujian kompetisi BAL melawan patogen pada ekstrak gula tepung umbi.
menggunakan dengan baik ekstrak gula tepung umbi garut dan ganyong sebagai sumber gula untuk pertumbuhannya sehingga mampu mereduksi jumlah patogen. Pada pengujian kompetisi Lactobacillus G3 melawan patogen dengan waktu kompetisi 24 jam, jumlah Salmonella mengalami penurunan sebesar 0.8 log cfu/ml pada ekstrak gula tepung umbi garut dan 1.0 log cfu/ml pada ekstrak gula tepung umbi ganyong, E. coli sebesar 1.0 log cfu/ml pada ekstrak gula tepung umbi garut dan 2.6 log cfu/ml pada ekstrak gula tepung umbi ganyong, B. cereus sebesar 3.0 log cfu/ml pada ekstrak gula tepung umbi garut dan 2.5 log cfu/ml pada ekstrak gula tepung umbi ganyong.
Pada pengujian kompetisi B. bifidum melawan patogen dengan waktu kompetisi 48 jam, jumlah Salmonella mengalami penurunan sebesar 2.6 log cfu/ml pada ekstrak gula tepung umbi garut dan 3.9 log cfu/ml pada ekstrak gula tepung umbi ganyong, E. coli sebesar 4.4 log cfu/ml pada ekstrak gula tepung umbi garut dan sebesar 4.2 log cfu/ml pada ekstrak gula tepung umbi ganyong. B. cereus sebesar 2.0 log cfu/ml pada ekstrak gula tepung umbi garut dan 3.8 log cfu/ml pada ekstrak gula tepung umbi ganyong.
Proses pengolahan terhadap potensi prebiotik menunjukkan adanya pengaruh pengolahan terhadap karakter fisik dari tepung dan ekstrak yang dihasilkan. Perubahan umumnya terjadi pada warna dan aroma. Warna yang dihasilkan lebih coklat, perubahan warna tersebut terjadi baik pada tepung maupun ekstrak yang dihasilkan. Pengaruh pengolahan terhadap komposisi dari gula pada ekstrak gula tepung umbi menunjukkan terbebasnya senyawa oligosakarida dan gula sederhana akibat gelatinisasi matriks pati. Dan terbentuknya komponen yang tidak dapat digunakan oleh BAL untuk pertumbuhannya akibat reaksi pencoklatan.
Hasil dari uji pertumbuhan BAL didalam ekstrak gula tepung umbi olahan menunjukkan nilai absorbansi pertumbuhan BAL uji yang tinggi pada ekstrak yang dikukusan dan dipanggang, namun rendah pada ekstrak gula tepung umbi yang disangray . Nilai absorbansi pertumbuhan BAL uj yang tinggi diduga akibat terbebasnya gula sederhana dari gelatinisasi matriks pati dan selama pengolahan berlangsung.
RIWAYAT PENULIS
Penulis dilahirkan di Depok pada tanggal 9 Maret 1984 dan merupakan putra kedua dari pasangan Dudun Rusmana dan Herawati Budhyarsi. Penulis menyelesaikan pendidikan dasarnya pada tahun 1996 di SD Budi Asih Manggarai, kemudian melanjutkan pendidikan menengah pertama di SLTP Negeri 115 Tebet hingga tahun 1999. Penulis menamatkan pendidikan menengah atas di SMU Negeri 8 Jakarta pada tahun 2002. Penulis melanjutkan pendidikan tinggi di Insitut Pertanian Bogor dengan mengambil jurusan Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian melalui Ujian Saringan Masuk IPB (USMI) pada tahun 2002.
Selama menjalani studi di IPB, penulis aktif di berbagai kegiatan dan organisasi kemahasiswaan dan lembaga pendidikan informal. Diantaranya menjadi pengurus Food Chat Club, anggota sie. acara Lepas Landas Sarjana Fakultas Teknologi Pertanian September 2003, Wakil ketua The 3rd National Student’s Paper Competition on Food Issues, anggota sie. pubdekdok Lomba
KATA PENGANTAR
Alhamdulillah,penulis panjatkan puji dan syukur kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Penulis menyadari bahwa terselesaikannya skripsi ini tidak lepas dari bantuan berbagai pihak. Oleh karena itu, penulis menyampaikan terima kasih sedalam-dalamnya kepada:
1. Mama dan teteh tercinta atas segala kesabaran dan jerih payahnya yang telah mengantarkan penulis mencapai pendidikan perguruan tinggi
2. Dr. Ir. Lilis Nuraida, M.Sc selaku Pembimbing Akademik atas segala ilmu, bimbingan, dan nasihat yang telah diberikan.
3. Didah Nur Faridah, STP, M.Si selaku pembimbing dalam penelitian atas segala bimbingan dan motivasi yang telah diberikan.
4. Dr. Ir. Feri Kusnandar, M.Sc selaku penguji dan penanggung jawab proyek yang penulis jalani atas segala dukungan, bimbingan, motivasi dan nasihat yang telah diberikan
5. Pak Koko yang telah memberikan segala upaya, tenaga dan waktu untuk membantu penulis menyelesaikan tugas akhir
6. Farah Sitaresmi yang selalu menemani dan memberikan semangat yang tiada hentinya kepada penulis.
7. Nurul Kartika Sari yang selalu memberikan motivasi, semangat dan teman dalam senang maupun susah.
8. Teman-teman staf BTA 8, Mas Dadang, Sakti, Ian, Mba Dewi, Mba Upik dan Reni yang selalu memahami dan memberikan support.
9. Teman-teman seperjuangan dalam penelitian, Hana, mba Nani, bu Rini yang bersama-sama memberikan semangat dan motivasi
10. Teknisi laboran Laboratorium dept ITP dan SEAFAST, pak Yahya, pak Wahid, pak Sob, pak Mul, bu Rub, teh Ida, mas Edi, pak Gatot, pak Rojak, pak Taufik, mba Ari, dan mang Minta yang senantiasa membantu penulis
Era, tim delivery (Ijal, Didin, Dadik, Boy), Aponk “sepupu”, teman satu sekolah (Ginea, Dora), tim capsa and troof (Ribka, Ina, Akew, Ajeng, Tintin, Prasna), teman-teman labkom (Konk, Hans, Ados, Putra, Kani, Imam, Faried, Teddy, Rial, bu Dias, mba Darsih, mas Dodi), tim Pati Resisten (Woro, Manginar, Nanda, Shinta), kelompok B5 (Maya, Yayah), Nene “ samchan”, Hansib, Tissa “tinggi bet”, Deddy, teman-teman DOTA’ers and CS’ers (Hendy, Agus, Meiko, Widhi, Andhal), adik-adik kelas ex-siswa les PTP, tim binglas BTA 8.
12. Enya, Tiesto, Kahitna, dan Warkop yang tidak bosan-bosan menghibur penulis.
13. Semua pihak yang telah membantu penulis, yang tidak dapat disebutkan satu per satu.
Tak ada gading yang tak retak, penulis menyadari bahwa masih ada kekurangan dalam diri penulis. Namun penulis berharap kekurangan tersebut tidak menghalangi niat baik penulis dan tulisan ini dapat berguna bagi penulis dan semua pihak yang memerlukan.
Februari 2007
DAFTAR ISI
Halaman
KATA PENGANTAR ... iv
DAFTAR TABEL... ix
DAFTAR GAMBAR ...x
DAFTAR LAMPIRAN... xii
I. PENDAHULUAN ...1
A. LATAR BELAKANG ...1
B. TUJUAN PENELITIAN...2
C. MANFAAT...2
D. SASARAN ...2
II. TINJAUAN PUSTAKA ...3
A. GARUT (Maranta arundiacea L.) ...3
1. Botani dan Budidaya Garut...3
2. Komposisi Kimia Umbi Garut dan Pengolahannya...4
B. GANYONG (Canna edulis, Kerr) ...5
1. Botani dan Budidaya Ganyong ...5
2. Komposisi Kimia Umbi Ganyong dan Pengolahannya ...7
C. PREBIOTIK...8
D. BAKTERI ASAM LAKTAT...9
1. Lactobacillus casei...9
2. Lactobacillus F1...10
3. Lactobacillus G1...11
4. Lactobacillus G3...12
5. Bifidobacterium bifidum...12
6. Bifidobacterium longum...13
III. METODOLOGI PENELITIAN...14
A. BAHAN DAN ALAT ...14
1. Bahan ...14
B. METODE PENELITIAN...15
1. Pembuatan Tepung...15
2. Ekstraksi oligosakarida (Muchtadi, 1989) ...17
3. Penyegaran dan Pengawetan Kultur ...18
4. Persiapan Media Fermentasi ...18
5. Uji Pertumbuhan BAL pada Ekstrak Gula Tepung Umbi ...19
6. Kompetisi BAL dan Uji Patogen ...20
7. Pengaruh Pengolahan Tepung Garut dan Tepung Ganyong Terhadap Potensi Prebiotik ...21
C. METODE ANALISIS...23
1. Analisis Kadar Oligosakarida Kualitatif (Mulimani, 2005) ...23
2. Total Padatan Terlarut ( Total solid )...23
3. Analisis Pertumbuhan BAL pada Ekstrak Gula Tepung Garut dan Tepung Ganyong...24
4. Analisis Kompetisi BAL melawan Patogen pada Ekstrak Gula Tepung Garut dan Tepung Ganyong...24
IV. HASIL DAN PEMBAHASAN...27
A. TEPUNG UMBI GARUT (Maranta arundiacea L.) DAN UMBI GANYONG (Canna edulis Kerr.) ...27
B. EKSTRAKSI OLIGOSAKARIDA ...28
C. IDENTIFIKASI OLIGOSAKARIDA ...30
D. PENGUJIAN EKSTRAK GULA TEPUNG UMBI UNTUK MENDUKUNG PERTUMBUHAN BAL ...37
E. KOMPETISI BAL TERBAIK DENGAN PATOGEN PADA EKSTRAK GULA TEPUNG UMBI ...44
F. PENGARUH PROSES PENGOLAHAN TEPUNG UMBI TERHADAP POTENSI PREBIOTIK ...53
1. Pengaruh Proses Pengolahan terhadap Tepung dan Ekstrak Gula Tepung Umbi ...54
3. Pengaruh Proses Pengolahan terhadap Kemampuan Mendukung
Pertumbuhan BAL ...63
V. KESIMPULAN DAN SARAN...67
A. KESIMPULAN...67
B. SARAN ...69
DAFTAR PUSTAKA ...70
DAFTAR TABEL
Halaman
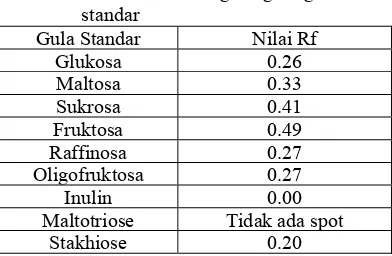
Tabel 1. Komposisi zat gizi dan kimiawi umbi garut kultivar Creole dan Banana (per 100 g umbi)...4 Tabel 2. Nama Lain Ganyong dari Berbagai Negara...6 Tabel 3. Komposisi Kimia Umbi Ganyong, Singkong, Uwi dan Talas...7 Tabel 4. Kombinasi BAL terbaik dan patogen pada uji kompetisi...20 Tabel 5. Rendemen tepung umbi garut dan umbi ganyong (berat basah)...28 Tabel 6. Hasil ekstraksi oligosakarida umbi garut dan umbi ganyong ...29 Tabel 7. Nilai Rf kromatografi gula-gula standar ...32 Tabel 8. Nilai Rf pada ekstrak gula umbi garut dalam berbagai konsentrasi ...35 Tabel 9. Nilai Rf pada ekstrak gula umbi garut dalam berbagai konsentrasi ...35 Tabel 10. Kenaikan jumlah BAL dan penurunan jumlah pathogen setelah uji
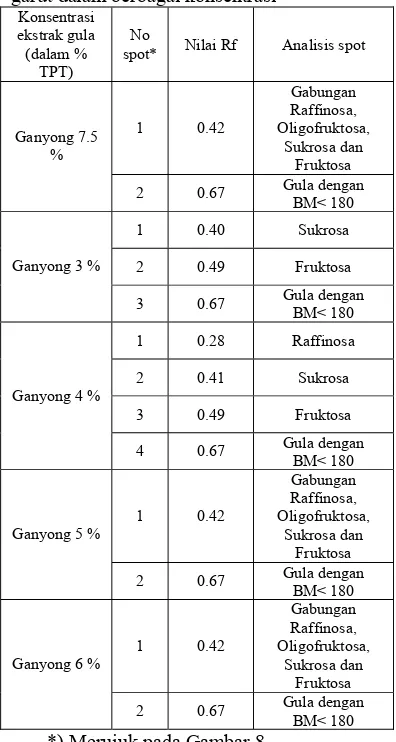
kompetisi BAL melawan patogen...51 Tabel 11. Rendemen tepung umbi hasil pengolahan ...56 Tabel 12. Nilai Rf dan analisis spot pada identifikasi oligosakrida tepung umbi
DAFTAR GAMBAR
Halaman Gambar 1. Umbi garut varietas Ciamis...14 Gambar 2. Umbi ganyong varietas ganyong putih ...15 Gambar 3. Diagram alir proses ekstraksi oligosakarida umbi garut dan umbi
ganyong...16 Gambar 4. Diagram alir pengujian potensi umbi garut dan umbi ganyong untuk
mendukung pertumbuhan BAL...17 Gambar 5. Diagram alir pengujian pengaruh pengolahan tepung garut dan tepung
ganyong terhadap potensi prebiotik ...22 Gambar 6. Tepung umbi garut ...27 Gambar 7. Tepung umbi ganyong ...28 Gambar 8. Ekstrak gula tepung umbi garut ...29 Gambar 9. Ekstrak gula tepung umbi ganyong...29 Gambar 10. Hasil kromatografi metode Muchtadi (1989)...31 Gambar 11. Hasil Kromatografi Gula Standar ...32 Gambar 12. Hasil Kromatografi Ekstrak Gula Umbi Garut ...33 Gambar 13. Hasil Kromatografi Ekstrak Gula Umbi Ganyong...34 Gambar 14. Pertumbuhan berbagai jenis BAL uji pada glukosa...38 Gambar 15. Pertumbuhan berbagai jenis BAL uji pada inulin ...38 Gambar 16. Pertumbuhan berbagai jenis BAL uji pada rafinosa ...39 Gambar 17. Pertumbuhan berbagai jenis BAL uji pada oligofruktosa ...39 Gambar 18. Pertumbuhan berbagai BAL uji pada ekstrak gula tepung umbi garut
segar ...40 Gambar 19. Pertumbuhan berbagai BAL uji pada ekstrak gula tepung umbi
ganyong segar ...40 Gambar 20. Pertumbuhan BAL pada kompetisi dengan Salmonella sp. dengan
ekstrak gula tepung umbi garut sebagai sumber gula. ...45 Gambar 21. Pertumbuhan BAL pada kompetisi dengan Salmonella sp. dengan
ekstrak gula tepung umbi ganyong sebagai sumber gula...45 Gambar 22. Pertumbuhan BAL pada kompetisi dengan E. coli dengan ekstrak
Gambar 23. Pertumbuhan BAL pada kompetisi dengan E. coli dengan ekstrak gula tepung umbi ganyong sebagai sumber gula ...46 Gambar 24. Pertumbuhan BAL pada kompetisi dengan B. cereus dengan ekstrak
gula tepung umbi garut sebagai sumber gula...47 Gambar 25. Pertumbuhan BAL pada kompetisi dengan B. cereus dengan ekstrak
gula tepung umbi ganyong sebagai sumber gula ...47 Gambar 26. Pertumbuhan Salmonella sp. pada kontrol dan kompetisi dengan BAL dengan ekstrak gula tepung umbi garut sebagai sumber gula...48 Gambar 27. Pertumbuhan Salmonella sp. pada kontrol dan kompetisi dengan BAL dengan ekstrak gula tepung umbi ganyong sebagai sumber gula. ....48 Gambar 28. Pertumbuhan E. coli pada kontrol dan kompetisi dengan BAL dengan ekstrak gula tepung umbi garut sebagai sumber gula ...49 Gambar 29. Pertumbuhan E. coli pada kontrol dan kompetisi dengan BAL dengan
ekstrak gula tepung umbi ganyong sebagai sumber gula...49 Gambar 30. Pertumbuhan B. cereus pada kontrol dan kompetisi dengan BAL
dengan ekstrak gula tepung umbi garut sebagai sumber gula...50 Gambar 31. Pertumbuhan B. cereus pada kontrol dan kompetisi dengan BAL
dengan ekstrak gula tepung umbi ganyong sebagai sumber gula ...50 Gambar 32. Tepung umbi garut hasil pengolahan dengan pengukusan ...54 Gambar 33. Tepung umbi garut hasil pengolahan dengan pemanggangan ...54 Gambar 34. Tepung umbi ganyong hasil pengolahan dengan pengukusan...55 Gambar 35. Tepung umbi ganyong hasil pengolahan dengan pemanggangan...55 Gambar 36. Tepung umbi hasil pengolahan dengan penyangrayan ...55 Gambar 37. Ekstrak gula tepung olahan umbi garut...57 Gambar 38. Ekstrak gula tepung olahan umbi ganyong ...57 Gambar 39. Hasil kromatografi ekstrak gula tepung umbi garut...58 Gambar 40. Hasil kromatografi ekstrak gula tepung umbi ganyong ...59 Gambar 41. Pertumbuhan BAL uji pada ekstrak gula tepung umbi garut olahan .63 Gambar 42. Pertumbuhan BAL uji pada ekstrak gula tepung umbi ganyong
DAFTAR LAMPIRAN
Halaman Lampiran 1. Bahan-bahan dan prosedur pembuatan media berbasis MRS... 74 Lampiran 2. Nilai absorbansi pertumbuhan L. casei strain rhamnosus pada
berbagai sumber gula ... 75 Lampiran 3. Nilai absorbansi pertumbuhan L. casei strain shirota pada berbagai
sumber gula ... 76 Lampiran 4. Nilai absorbansi pertumbuhan Lactobacillus G3 pada berbagai
sumber gula ... 77 Lampiran 5. Nilai absorbansi pertumbuhan B. bifidum pada berbagai sumber
gula... 78 Lampiran 6. Nilai absorbansi pertumbuhan B. longum pada berbagai sumber
gula... 79 Lampiran 7. Nilai absorbansi pertumbuhan Lactobacillus G1 pada berbagai
sumber gula ... 80 Lampiran 8. Nilai absorbansi pertumbuhan Lactobacillus F1 pada berbagai
sumber gula ... 81 Lampiran 9. Nilai absorbansi pertumbuhan Salmonella sp. pada berbagai
sumber gula ... 82
Lampiran 10. Nilai absorbansi pertumbuhan E.coli pada berbagai sumber gula ... 83
Lampiran 11. Nilai absorbansi pertumbuhan B. cereus pada berbagai sumber gula ... 84
Lampiran 12. Jumlah patogen awal dan setelah inkubasi 24 jam ... 85 Lampiran 13. Jumlah Salmonella sp. kompetisi dengan B. bifidum dengan lama
kompetisi 24 jam... 86 Lampiran 14. Jumlah B. cereus kompetisi dengan B. bifidum dengan lama
kompetisi 24 jam... 87 Lampiran 15. Jumlah E. coli kompetisi dengan B. bifidum dengan lama kompetisi
24 jam... 88 Lampiran 16. Jumlah Salmonella sp. kompetisi dengan Lactobacillus G3 dengan
Lampiran 17. Jumlah B. cereus kompetisi dengan LactobacillusS G3 dengan lama kompetisi 24 jam ... 90 Lampiran 18. Jumlah E. coli kompetisi dengan Lactobacillus G3 dengan lama
kompetisi 24 jam... 91 Lampiran 19. Jumlah BAL awal dan setelah inkubasi selama 24 jam ... 92 Lampiran 20. Jumlah B. bifidum kompetisi dengan Salmonella sp. dengan lama
kompetisi 24 jam... 93 Lampiran 21. Jumlah B. bifidum kompetisi dengan B. cereus dengan lama
kompetisi 24 jam ... 94 Lampiran 22. Jumlah B. bifidum kompetisi dengan E. coli dengan lama kompetisi
24 jam... 95 Lampiran 23. Jumlah Lactobacillus G3 kompetisi dengan Salmonella sp. dengan
lama kompetisi 24 jam ... 96 Lampiran 24. Jumlah Lactobacillus G3 kompetisi dengan B. cereus dengan lama
kompetisi 24 jam... 97 Lampiran 25. Jumlah Lactobacillus G3 kompetisi dengan E. coli dengan lama
kompetisi 24 jam... 98 Lampiran 26. Jumlah Salmonella sp. kontrol pada ekstrak umbi... 99 Lampiran 27. Jumlah B. cereus kontrol pada ekstrak umbi ... 100 Lampiran 28. Jumlah E. coli kontrol pada ekstrak umbi... 101 Lampiran 29. Jumlah B. bifidum kontrol pada ekstrak umbi ... 102 Lampiran 30. Jumlah Lactobacillus G3 kontrol pada ekstrak umbi... 103 Lampiran 31. Jumlah Salmonella sp. kompetisi dengan B. bifidum dengan lama
kompetisi 48 jam... 104 Lampiran 32. Jumlah B. cereus kompetisi dengan B. bifidum dengan lama
kompetisi 48 jam... 105 Lampiran 33. Jumlah E. coli kompetisi dengan B. bifidum dengan lama kompetisi 48 jam... 106 Lampiran 34. Jumlah B. bifidum kompetisi dengan Salmonella sp. dengan lama
kompetisi 48 jam... 107 Lampiran 35. Jumlah B. bifidum kompetisi dengan B. cereus dengan lama
I.
PENDAHULUAN
A. LATAR BELAKANG
Pangan merupakan salah satu jenis kebutuhan yang sangat mendasar dari manusia untuk dapat hidup. Pada umumnya sumber karbohidrat pangan berguna sebagai sumber energi untuk manusia dalam menjalankan aktivitasnya. Namun dewasa ini fungsi pangan berkembang, bukan hanya sebagai sumber energi namun juga sebagai pangan untuk kesehatan yang dikenal sebagai pangan fungsional. Pangan fungsional adalah pangan yang memberikan efek yang menguntungkan bagi kesehatan disamping memenuhi kebutuhan nutrisi dasar (Winarno dan Koswara, 2002). Jenis pangan fungsional bermacam-macam diantaranya adalah prebiotik.
Prebiotik merupakan komponen pada makanan yang tidak dapat dicerna namun mempunyai efek yang menguntungkan karena menstimulasi pertumbuhan satu atau beberapa jumlah bakteri di usus yang dapat meningkatkan kesehatan (Gibson dan Roberfoid, 1995). Komponen pada makanan yang pada umumnya tidak dapat dicerna adalah golongan oligosakarida. Beberapa jenis oligosakarida yang telah dikenal sebagai prebiotik yaitu inulin, rafinosa, FOS (fruktooligosakarida), dan GOS (Glukooligosakarida).
Oligosakarida merupakan salah satu kelompok karbohidrat yang merupakan polimer yang terdiri dari 2-10 monosakarida. Oligosakarida merupakan media yang baik untuk pertumbuhan bakteri yang menguntungkan di dalam saluran pencernaan, sehingga oligosakarida disebut sebagai prebiotik (Silalahi dan Hutagalung, 2002). Golongan oligosakarida umumnya terdapat pada umbi-umbian dan kacang-kacangan.
substitusi tepung. Tepung umbi ganyong untuk substitusi tepung beras dan tepung umbi garut untuk substitusi tepung terigu. Kandungan karbohidrat pada garut dan ganyong relatif tinggi yaitu berkisar antara 22 -26 g/100 g bahan. Diantara kandungan karbohidrat tersebut, tidak tertutup kemungkinan adanya senyawa oligosakarida yang berpotensi sebagai prebiotik. Oleh karena itu, dilakukan eksplorasi untuk mempelajari potensi umbi garut dan ganyong sebagai prebiotik.
Dengan mengkaji potensi umbi garut dan ganyong sebagai prebiotik, dapat meningkatkan potensi umbi garut dan ganyong yang tergolong umbi - umbian minor sebagai pangan fungsional Indonesia.
B. TUJUAN PENELITIAN
Tujuan dari penelitian ini adalah :
1. Mengidentifikasi kandungan oligosakarida pada tepung umbi garut (Maranta arundiacea L.) dan ganyong (Canna edulis Kerr.).
2. Mengevaluasi potensi prebiotik dari senyawa oligosakarida teridentifikasi yang terdapat pada umbi garut dan umbi ganyong.
3. Mengkaji pengaruh pengolahan terhadap potensi prebiotik pada tepung garut dan tepung ganyong.
C. MANFAAT
Manfaat dari penelitian ini adalah memberikan nilai tambah umbi garut (Maranta arundiaceae L.) dan umbi ganyong (Canna edulis Kerr.) sebagai sumber pangan fungsional yang mengandung prebiotik.
D. SASARAN
Sasaran penelitian ini adalah mengkaji potensi ekstrak tepung umbi garut (Maranta arundiacea L.) dan ganyong (Canna edulis Kerr.) dalam mendukung pertumbuhan beberapa BAL probiotik yaitu Lactobacillus casei strain shirota, Lactobacillus casei strain rhamnosus, Lactobacillus G3, Lactobacillus F1, Lactobacillus G1, Bifidobacterium bifidum dan B. longum
II.
TINJAUAN PUSTAKA
A. GARUT (Maranta arundiacea L.) 1. Botani dan Budidaya Garut
Tanaman garut merupakan tanaman umbi-umbian. Tanaman ini termasuk dalam famili Marantaceae, genus Maranta dan spesies Maranta arundiacea L. Garut dikenal dengan nama arrowroot, West Indian
arrowroot dan St. Vincent arrowroot. Di Indonesia tanaman ini disebut
juga dengan angkrik, arus, erut, garut (Jawa), larut, sagu patat (Sunda), arut dan selarut (Madura) (Villamajo dan Jurkema, 1996). Saat ini garut belum dibudidayakan secara intensif di Indonesia. Pada umumnya, garut masih tumbuh liar di kebun atau diusahakan secara kecil-kecilan di pekarangan rumah dan di kebun-kebun buah.
Garut adalah tanaman setahun yang termasuk jenis rumput-rumputan tegak, tingginya sekitar 60-80 cm dan berbatang lunak. Bentuk daun lebar dan runcing di bagian ujungnya dan bunga berwarna putih (Kay, 1973).
Menurut Kay (1973), garut merupakan tanaman yang tidak terikat oleh syarat suhu tertentu, tetapi akan lebih produktif jika ditanam pada suhu panas yang berembun. Pertumbuhan garut membutuhkan tanah subur dan liat yang bersifat asam. Lama pertumbuhan garut adalah 10-11 bulan, pemanenan dilakukan apabila daun-daun mulai menguning dan berguguran.
Garut memiliki dua kultivar penting (Kay, 1973), yaitu Creole dan Banana. Creole memiliki rimpang yang panjang dan langsing, lebih
menyebar dan menembus masuk ke dalam tanah, lebih berserat, tumbuh bergerombol dekat permukaan tanah, lebih mudah dipanen dan diolah untuk diambil patinya. Setelah dipanen Creole mempunyai daya tahan selama 3 hari sebelum dilakukan pengolahan. Umbi kultivar Creole kurus, tetapi kandungan pati dan seratnya lebih tinggi (Kay, 1973).
lebih mudah dipanen. Daya tahannya lebih rendah dari Creole, yaitu hanya 48 jam setelah panen, sehingga harus segera diolah. Umbi kultivar Banana lebih gemuk, pendek dan memiliki kandungan protein dan air yag lebih tinggi dibandingkan dengan kultivar Creole (Kay, 1973).
Umbi garut merupakan rhizoma dari tanaman garut. Umbi garut berwarna putih dan dibungkus dengan sisik-sisik yang membungkus secara teratur. Sisik-sisik ini berwarna putih hingga coklat pucat. Rhizoma garut memiliki panjang sekitar 20-45 cm dan tebal sekitar 2.5 cm. Pada rhizoma garut terdapat rambut-rambut, terutama pada sisik umbi (Kay, 1973). Persentase umbi yang dapat digunakan adalah 95.1 persen, sedangkan sisanya merupakan kulit dan kotoran yang biasanya adalah tanah (Ciptadi et al., 1980).
2. Komposisi Kimia Umbi Garut dan Pengolahannya
Terdapat perbedaan dalam jumlah pati dan serat diantara dua kultivar garut, yakni jenis Creole memiliki kadar pati dan serat yang lebih tinggi dibanding jenis Banana (Kay, 1973). Komposisi zat gizi dan kimiawi umbi garut dapat dilihat pada Tabel 1.
Tabel 1. Komposisi zat gizi dan kimiawi umbi garut kultivar Creole dan Banana (per 100 g umbi) (Kay, 1973)
Komponen Banana Creole
Pati (g) 19.4 21.7
Serat (g) 0.6 1.3
Protein (g) 2.2 1.0
Lemak (g) 0.1 0.1
Abu (g) 1.3 1.4
Air (g) 72.0 69.1
Menurut Mariati (2001), tepung garut dibuat dengan cara sebagai berikut : umbi segar dibersihkan dan dikupas kemudian dicuci setelah itu disawut dan direndam dalam larutan bisulfit selama 1 jam. Setelah direndam kemudian dilakukan pengepresan untuk mengurangi kadar air. Sawut basah yang dihasilkan langsung dikeringkan, sedangkan cairan yang dihasilkan dari pengepresan diendapkan sehingga diperoleh pati. Pati tersebut kemudian dikeringkan dalam pengering kabinet. Setelah kering sawut dan pati ditepungkan dan dicampur lalu diayak 100 mesh.
B. GANYONG (Canna edulis, Kerr) 1. Botani dan Budidaya Ganyong
Tanaman ganyong sejak dahulu telah dikenal oleh seluruh masyarakat di daerah asal Amerika Selatan sekitar tahun 2500 sebelum Masehi. Penduduk kawasan ini menggunakannya sebagai makanan yang pada waktu itu belum mengenal jagung dan singkong (Purseglove, 1975). Saat ini tanaman ganyong sudah menyebar di seluruh belahan bumi, yaitu daerah yang mempunyai iklim tropis dan hangat, seperti kawasan Asia Tenggara (Flach dan Rumawas, 1996).
Menurut Ropiq (1988) tanaman ganyong telah tumbuh dengan baik di pulau Jawa sejak tahun 1905. Sekarang ini sudah tersebar di seluruh Indonesia terutama Jawa Tengah, Jawa Barat dan Bali. Di Indonesia dan Malaysia ganyong lebih dikenal dengan nama bunga tasbeh, ganyong (Indonesia) dan ganjong serta pisang sebiak (Malaysia). Penduduk Sumatra lebih mengenal dengan nama ubi pikul (Flach dan Rumawas, 1996). Di daerah-daerah lain juga mempunyai nama-nama yang berbeda, seperti disajikan pada Tabel 2.
Tabel 2. Nama Lain Ganyong dari Berbagai Negara
Asal Negara Nama Lainnya Perancis Balisier, Canna Spanyol Achira
Indonesia Ganyong, bunga tasbeh, ubi pikul Malaysia Ganjong, daun tasbeh, pisang sebiak
Filipina Tikas-tikas, kukuwintasan, balubsaying Myanmar Adalut, butsarana
Kamboja Che:k te:hs
Laos Kwayz ke :som, kwayz ph’utta so:n Thailand Phuttharaksa, phuttason Vietnam Chu[oos]i hoa,dong rieefing, khoai dao Sumber : Flach dan Rumawas, 1996
Di Indonesia dikenal dua jenis ganyong yaitu ganyong merah dan ganyong putih. Ganyong merah ditandai dengan warna batang, daun dan pelepahnya berwarna merah atau ungu, sedangkan ganyong putih ditandai dengan batang, daun dan pelepahnya hijau serta sisik umbinya kecoklatan. Ganyong merah mempunyai batang yang lebih besar dan tinggi, agak tahan terhadap kekeringan, sulit menghasilkan biji dan umbinya lazim dimakan segar (direbus). Ganyong putih mempunyai sifat lebih pendek dan kecil, tahan terhadap sinar dan kekeringan, selalu menghasilkan biji serta umbinya diambil patinya (Lingga et al., 1986).
Menurut Flach dan Rumawas (1996), tanaman ganyong dapat tumbuh pada ketinggian sampai 1000 m di atas permukaan laut. Dengan curah hujan 1000-1200 mm. Produksi optimum akan dicapai apabila ditanam pada tanah liat yang berpasir. Perbanyakan tanaman dapat dilakukan dengan rimpangnya yang telah mencapai ukuran normal dan mengandung 1 sampai 2 tunas sehat (Sastrapradja, 1977).
Cara pemanenan bisa dilakukan dengan cara pencabutan apabila tanaman ganyong belum rapuh. Bila telah rapuh dapat dengan cara mencongkelnya dengan tongkat besi, kayu atau sejenisnya (Lingga et al., 1986). Umbi yang telah diambil kemudian dapat disimpan selama beberapa minggu tanpa mengalami kerusakan dengan menjaganya dalam keadaan dingin dan kering (Kay, 1973).
2. Komposisi Kimia Umbi Ganyong dan Pengolahannya
Umbi ganyong terdiri dari bagian kulit luar yang agak keras dan bagian daging yang berserat. Bagian kulit berlapis-lapis yang melindungi bagian daging yang berserat (Ropiq, 1988). Hal ini didukung dengan adanya kandungan serat kasar sebesar 0.6% (Kay, 1973).
Komposisi kimia ubi ganyong akan berbeda tergantung varietas, umur dan iklim tempat tumbuh umbi (Lingga et al., 1986). Komposisi kimia umbi disajikan pada Tabel 3. Menurut Flach dan Rumawas (1996), kadar pati pada umbi ganyong adalah 90% sedangkan kadar gulanya 10% sehingga umbi ganyong itu rasanya tidak terlalu manis.
Tabel 3. Komposisi Kimia Umbi Ganyong, Singkong, Uwi dan Talas Komponen (%) Ganyong1 Ganyong2 Singkong3 Uwi4 Talas5
Air 75.0 72.6 63 74.17 69.2 Karbohidrat 22.6 24.6 34.7 22.35 28.2
Protein 1.0 1.0 1.2 1.92 1.5 Lemak 0.1 0.1 0.3 0.33 0.3
Abu - 1.4 - 0.89 0.8
Serat Kasar - 0.6 - 1.10 0.7
1
Depkes RI, 1992 3Sukmawati, 1987
2
Kay, 1973 4Lingga, 1986
umbi yang mengandung kalsium, fosfor dan besi walaupun dalam jumlah sedikit (Ropiq, 1988).
C. PREBIOTIK
Prebiotik merupakan bahan pangan yang tidak dapat dicerna, namun memberikan efek yang menguntungkan terhadap flora intestinal dengan cara menstimulasi pertumbuhan dan keaktifan satu atau lebih jenis bakteri menguntungkan (Winarno dan Koswara, 2002). Bahan makanan yang diklasifikasikan sebagai prebiotik harus memenuhi syarat sebagai berikut:(1) tidak dapat dihidrolisa maupun diserap oleh bagian atas saluran gastrointestinal, (2) secara selektif mampu menstimulasi pertumbuhan satu atau sejumlah bakteri menguntungkan pada kolon, (3) mampu menurunkan pertumbuhan patogen maupun virus serta menginduksi efek yang menguntungkan bagi kesehatan (Salminen dan Ahokas, 2000).
Menurut Manning et al. (2004), apapun komponen nutrisi yang mencapai kolon tanpa tercerna berpotensi sebagai prebiotik, namun perkembangan penelitian mengenai prebiotik, mengklaim senyawa oligosakarida tak tercerna sebagai prebiotik utama. Senyawa oligosakarida tak tercerna yang antara lain fructooligosaccharides (FOS), transgalactooligosaccharides (TOS),
Isomaltooligosaccharides (IMO), xylooligosaccharides (XOS),
soyoligosaccharides (SOS), glucooligosaccharides (GOS), dan lactosucrose.
Oligosakarida lain yang telah dikenal mempunyai potensi sebagai prebiotik adalah inulin. Inulin merupakan senyawa oligosakarida yang termasuk didalam golongan fructooligosaccharides (FOS) (Franck, 2000). Menurut Shin et al. (2000) senyawa oligosakarida mempunyai kemampuan untuk meningkatkan pertumbuhan Bifidobacteria pada kolon tanpa dicerna oleh mikroflora usus lainnya.
senyawa oligosakarida maka senyawa tersebut dapat mencapai kolon dalam kondisi utuh dan berpotensi besar sebagai prebiotik.
Senyawa oligosakarida secara alami terdapat pada tumbuh-tumbuhan, namun pada umumnya terdapat pada umbi-umbian dan kacang-kacangan. Beberapa tanaman yang telah diketahui mengandung oligosakarida dalam jumlah banyak adalah dahlia, chicory, Jerusalem artichoke (Franck, 2000)
D. BAKTERI ASAM LAKTAT
Bakteri Asam Laktat (BAL) merupakan kelompok bakteri Gram positif yang menggunakan karbohidrat sebagai sumber energi dan mempoduksi asam laktat sebagai produk tunggal atau produk utama dari hasil metabolismenya (Fardiaz, 1992). Bakteri asam laktat diklasifikasikan menurut tipe fermentasi asam laktat yaitu homofermentatif dan heterofermentatif.
Bakteri homofermentatif melakukan fermentasi homolaktat karena hanya menghasilkan asam laktat sebagai produk fermentasinya sedangkan bakteri hoterofermentatif selain memproduksi asam laktat juga memproduksi asam asetat, etanol, dan karbondioksida sebagai hasil fermentasi (Fardiaz, 1992).
1. Lactobacillus casei
Lactobacillus casei berbentuk batang dalam koloni tunggal maupun
berantai, dengan ukuran panjang 1.5 – 5.0 µm dan lebar 0.6-0.7 µm. Bakteri ini bersifat Gram positif, katalase negatif, tidak membentuk endospora maupun kapsul, serta tidak mempunyai flagela. L.casei tumbuh dengan baik pada kondisi anaerobik fakultatif. Dapat hidup pada suhu 15-410C dan pada pH 3.5 atau lebih. Sedangkan kondisi optimum pertumbuhannya adalah pada suhu 370C dan pada pH 6.8. (Mutai, 1981 yang dikutip oleh Selamat, 1992). Galur penting dari L.casei diantaranya adalah L.casei galur shirota dan L.casei galur rhamnosus.
Lactobacillus casei strain shirota
L.casei strain shirota yang lebih dikenal dengan bakteri Yakult
shirota mampu mencapai usus dalam keadaan hidup dan jumlah yang relatif sama dengan sewaktu berada di lambung (Selamat, 1992).
Peranan L.casei shirota di dalam usus mamalia adalah : (1) mengatur keseimbangan mikroflora alami usus, (2) merangsang usus untuk memproduksi asam-asam organik seperti asam laktat yang berguna untuk membantu proses pencenaan dan penyerapan zat-zat, (3) mengurangi jumlah bakteri merugikan seperti E.coli, (4) menekan produksi senyawa beracun di dalam tubuh seperti ammonia, fenol dan hydogen sulfida (Anonim, 1990 yang diacu oleh Selamat, 1992). L.casei galur shirota mampu memecah glukosa, laktosa, fruktosa,
galaktosa, sukrosa, maltosa, manosa, selobiosa, dan trehalosa tetapi tidak mampu memfermentasi rhamnosa, xilosa, arabinosa maupun rafinosa (Mutai,1981 yang diacu oleh Selamat 1992).
Lactobacillus casei strain rhamnosus
Galur penting lainnya dari L. casei adalah L. casei galur rhamnosus. Beberapa penelitian menunjukkan bahwa L. casei galur rhamnosus dapat menurunkan kolonisasi bakteri patogenik pada jalur pernafasan serta mampu meningkatkan kemampuan sel darah putih untuk menelan dan membunuh bakteri berbahaya secara lebih efektif (Magdalena dan Dion, 2003). Penelitian yang dilakukan oleh Mack et al. (1999) menunjukkan bahwa L. casei galur rhamnosus dapat menghambat pertumbuhan bakteri patogen, yaitu E. coli.
b.
2. Lactobacillus F1
Lactobacillus F1 merupakan bakteri berbentuk batang pendek,
tergolong sebagai BAL homofermentatif dengan tidak menghasilkan CO2
pada proses fermentasinya (Evanikastri, 2003). Kekerabatannya mendekati dengan Lactobacillus acidophilus (similarity 41.2 %) (Evanikastri, 2003).
kemampuan yang baik sebagai anti mikroba yaitu terhadap Salmonella thypimorium dan E. coli O157:H7.
Lactobacillus F1 memiliki tingkat ketahanan terhadap asam lambung
yang baik. Pada uji ketahanan terhadap asam lambung, dari 17 isolat BAL ternyata terdapat 13 isolat BAL yang mengalami penurunan log kurang dari satu unit (paling resisten) diantaranya adalah Lactobacillus F1 (Evanikastri, 2003). Lactobacillus F1 tahan terhadap garam empedu. Terdapat 11 dari 17 isolat klinis BAL yang mempunyai ketahan yang tinggi terhadap 0.5% garam empedu, Lactobacillus G1 mempunyai ketahanan yang tinggi terhadap garam empedu kemudian disusul berturut – turut oleh F1, G2, M, Kk, NKp, En6, K, F2 dan Ae1 (penurunan log <1.0 log cfu/ml) (Evanikastri, 2003).
Sifat hidrofobisitas Lactobacillus F1 tergolong hidrofobik kuat. Isolat BAL yang paling bersifat hidrofobik diantaranya adalah Lactobacillus N, disusul berturut-turut oleh M, G3, G4, F3, G2, F2, F1 dan G1 (Evanikastri, 2003). Semakin tinggi sifat hidofobisitas maka semakin besar kemampuan bakteri tersebut untuk membentuk agregasi dan menempel pada permukaan sel epitel (Evanikastri, 2003).
3. Lactobacillus G1
Lactobacillus G1 merupakan bakteri berbentuk batang, tergolong
sebagai BAL heterofermentatif menghasilkan CO2 pada proses
fermentasinya (Evanikastri, 2003). Kekerabatannya mendekati dengan Lactobacillus plantarum (similarity 37.8 %) (Evanikastri, 2003).
Uji penggunaan gula oleh Lactobacillus G1 yang dilakukan Evanikastri (2003) menunjukkan bahwa bakteri ini dapat tumbuh pada gula maltosa, rafinosa, galaktosa, mellibiosa arabinosa, rhamnosa, dan xylosa. Lactobacillus G1 memiliki kemampuan yang baik sebagai anti mikroba yaitu terhadap Staphylococcus aureus, Salmonella thypimorium dan E. coli O157:H7.
resisten pada uji ketahanan terhadap asam lambung. Lactobacillus G1 mempunyai ketahanan yang tinggi terhadap garam empedu diantara isolat BAL klinis lainnya (Evanikastri, 2003).
Seperti Lactobacillus F1, Lactobacillus G1 memiliki sifat hidrofobisitas yang kuat.
4. Lactobacillus G3
Lactobacillus G3 merupakan bakteri berbentuk batang, bersifat
katalase negatif dan tergolong sebagai BAL homofermentatif (Evanikastri, 2003). Lactobacillus G3 tergolong sebagai BAL homofermentatif karena dalam proses fermentasinya, bakteri ini tidak memproduksi CO2 dari
glukosa.
Uji penggunaan gula oleh Lactobacillus G3 yang dilakukan oleh Evanikastri (2003) menunjukkan bahwa bakteri ini dapat tumbuh pada gula maltosa, galaktosa, melibiosa, rhamnosa dan sorbitol. Hasil penelitian yang dilakukan oleh Evanikastri (2003), juga menunjukkan bahwa Lactobacillus G3 memiliki kemampuan yang baik sebagai anti mikroba
yaitu terhadap Staphylococcus aureus dan Salmonella thypimurium. Lactobacillus G3 memiliki ketahanan terhadap asam lambung dengan
diantara 13 isolat BAL klinis yang paling resisten pada uji ketahanan terhadap asam lambung. Namun pada uji ketahanan terhadap garam empedu, Lactobacillus G3 mengalami penurunan log yang cukup besar (Evanikastri 2003). Hal ini menunjukkan Lactobacillus G3 tidak tahan terhadap garam empedu.
Seperti Lactobacillus F1 dan Lactobacillus G1, Lactobacillus G3 memiliki sifat hidrofobisitas yang kuat.
5. Bifidobacterium bifidum
Bifidobacterium bifidum merupakan salah satu spesies bakteri asam
Beberapa efek menguntungkan dari B. bifidum (Chaitow dan Trenev, 1990) antara lain : (1) melindungi usus dari bakteri maupun khamir patogen, (2) menghasilkan asam asetat dan asam laktat (2:3) sehingga menciptakan kondisi usus yang asam dan tidak dapat dihuni oleh bakteri berbahaya, (3) meningkatkan metabolisme protein, (4) mencegah pertumbuhan bakteri yang mampu mengubah senyawa nitrat dalam usus yang berasal dari makanan atau minuman menjadi senyawa nitrit yang bersifat prokarsinogenik, dan (5) menghasilkan vitamin B dan membantu fungsi hati dalam proses pencernaan makanan. Bifidobacterium bifidum menghasilkan suatu antibiotik yaitu bifidin yang sangat efektif melawan Shigella dysentria, Salmonella thypii, Staphylococcus aureus, E. coli dan
bakteri lainnya (Tomomatsu, 1994 didalam Silalahi dan Hutagalung, 2002).
Protein dan asam amino yang tidak terserap oleh usus akan diubah menjadi senyawa-senyawa busuk seperti ammonia, amines, phenols, indol dan hydrogen sulfide oleh bakteri pembusuk seperti Clostridium, koliform, dan Bacteriodes yang menyebabkan terjadinya pembusukan pada saluran usus.
6. Bifidobacterium longum
III.
METODOLOGI PENELITIAN
A. BAHAN DAN ALAT 1. Bahan
Bahan-bahan yang digunakan pada penelitian terdiri dari umbi garut varietas Ciamis dan ganyong varietas ganyong putih yang didapatkan dari Balai Besar Penelitian dan Pengembangan Bioteknologi dan Genetika Cimanggu - Bogor, media pertumbuhan dan fermentasi, larutan standar dan larutan ekstraksi. Media pertumbuhan dan fermentasi yang digunakan meliputi MRS (deMan, Rogosa and Sharpe) broth, MRS Agar, NA (Nutrient Agar), NB (Nutrient Broth), EMBA (Eosin Metil Bile Agar), bacto agar, Gas generating kit, proteose peptone, yeast extract, Tween 80, gliserol, dipotassium hidrogen fosfat, sodium asetat, MgSO4.7H2O, dan
MnSO4.4H2O.
Sebagai sumber gula pembanding digunakan larutan sukrosa, glukosa, maltosa, fruktosa, rafinosa, inulin, oligofruktosa. Larutan ekstraksi yang digunakan meliputi etanol 70% dan 95% (v/v), akuades, alkohol, 1-butanol, etil asetat, asam asetat, α-naphtol dan asam ortofosfat.
Bakteri Asam Laktat yang digunakan pada penelitian ini adalah Lactobacillus casei strain rhamnosus, L. casei strain shirota,
Lactobacillus F1, Lactobacillus G1, Lactobacillus G3, Bifidobacterium
bifidum, B. longum. Bakteri patogen yang digunakan adalah Salmonella
sp., Escherichia coli, Bacillus cereus. Kultur murni kedua BAL diperoleh
dari Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Gambar 2. Umbi ganyong varietas ganyong putih
2. Alat
Alat-alat yang digunakan pada penelitian terdiri dari peralatan pembuatan tepung, peralatan ekstraksi dan analisis oligosakarida dan peralatan analisis pertumbuhan dan fermentasi. Alat-alat pembuatan tepung yang digunakan meliputi oven, slicer, dry mill, neraca dan pisau. Alat-alat ekstraksi dan analisis oligosakarida yang digunakan meliputi mikropipet 10-100 µl, tips, sentrifus, evaporator vakum, kertas Whatman No. 1, tabung reaksi, botol penyemprot, chamber kromatografi. Alat-alat untuk analisis pertumbuhan dan fermentasi yang digunakan meliputi mikropipet 100-1000 µl, tabung reaksi, cawan petri, anaerobic jar, ANOXOMATtm, bunsen, spektrofometer, membran filter steril 0.2 µl, membran filter 0.45 µl, aluminium foil, kapas, kertas label, tissue, dan manik-manik.
B. METODE PENELITIAN
Tahap pertama penelitian ini adalah pembuatan tepung, kemudian dilakukan ekstraksi dan uji pertumbuhan terhadap hasil ekstraksi, serta dilihat pengaruh pengolahan terhadap bahan baku. Langkah-langkah penelitian yang akan dilakukan dapat dilihat pada Gambar 3 dan Gambar 4.
1. Pembuatan Tepung
suhu sekitar 50-600C. Hasil pengeringan digiling dengan menggunakan dry mill dan diayak menggunakan ayakan 60 mesh untuk mendapatkan
tepung garut dengan butiran yang halus.
Pembuatan tepung pada umbi ganyong relatif sama dengan langkah pembuatan tepung pada umbi garut, yaitu diawali dengan proses pengupasan, pencucian, pengirisan membujur, kemudian direndam dalam air untuk mencegah reaksi pencoklatan. Kemudian dilakukan pengeringan pada suhu 50-60 0C. Hasil pengeringan digiling dengan menggunakan dry mill dan diayak menggunakan ayakan 60 mesh untuk mendapatkan tepung
ganyong dengan butiran yang halus.
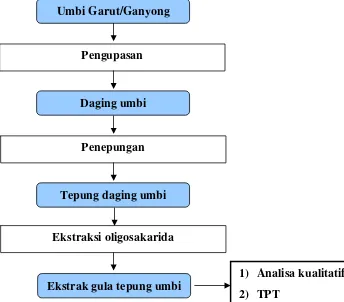
Umbi Garut/Ganyong
Pengupasan
Daging umbi
Penepungan
Tepung daging umbi
Ekstraksi oligosakarida
2) TPT
[image:43.595.207.551.319.621.2]1) Analisa kualitatif Ekstrak gula tepung umbi
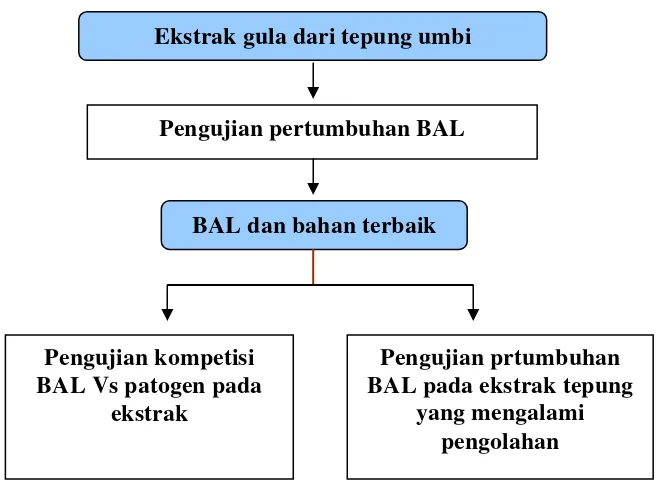
Ekstrak gula dari tepung umbi
Pengujian pertumbuhan BAL
BAL dan bahan terbaik
Pengujian kompetisi BAL Vs patogen pada
ekstrak
Pengujian prtumbuhan BAL pada ekstrak tepung
[image:44.595.165.495.89.331.2]yang mengalami pengolahan
Gambar 4. Diagram alir pengujian potensi umbi garut dan umbi ganyong untuk mendukung pertumbuhan BAL
2. Ekstraksi oligosakarida (Muchtadi, 1989)
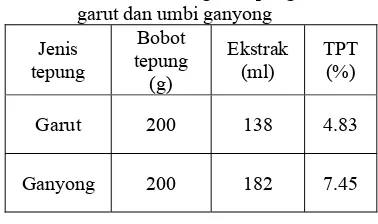
Oligosakarida pada garut dan ganyong diekstraksi dengan menggunakan etanol 70% dengan pengadukan selama 15 - 20 jam dengan menggunakan magnetic stirer pada suhu ruang. Larutan kemudian disaring dan residu pada kertas saring dicuci kembali dengan etanol 70%. Larutan yang telah disaring dipisahkan dari etanol dengan menggunakan rotavapor vakum sehingga diperoleh ekstrak gula pekat.
Ekstrak gula yang digunakan untuk pengujian in vitro disaring kembali dan disterilisasi menggunakan filter steril 0.2 µm. Setelah diperoleh ekstrak gula steril, larutan stok tersebut disimpan dengan lemari es. Total padatan terlarut dalam ekstrak dihitung dengan menggunakan metode penentuan kadar solid dari metode penentuan kadar air.
3. Penyegaran dan Pengawetan Kultur
Manik-manik yang mengandung mikroba yang digunakan (sebanyak ±3 biji) ditempatkan pada tabung reaksi yang mengandung MRS broth steril. Kemudian masing-masing tabung diinkubasi. Untuk Lactobacillus, inkubasi dilakukan pada suhu 370C selama 2 hari dan untuk Bifidobacterium, inkubasi dilakukan dalam anaerobic jar pada 370C selama 2 hari . Sedangkan untuk bakteri patogen, inkubasi dilakukan pada suhu 370C selama 1 hari. Penyegaran dilakukan hanya pada saat analisis akan dilakukan.
Pengawetan kultur sangat penting agar kultur bakteri dapat terus digunakan. Pengawetan dilakukan dengan cara kultur BAL yang telah diinokulasikan dalam MRS broth tersebut kemudian ditambahkan gliserol steril dengan perbandingan 4:1 dan dikocok rata. Suspensi bakteri yang telah berisi gliserol dimasukkan ke dalam tabung reaksi yang berisi manik-manik steril sampai manik-manik-manik-manik tersebut terendam.
Campuran kemudian dikocok dan sisa cairan dipipet dan dibuang. Kultur yang telah terimobilisasi disimpan pada suhu -200C. Pengawetan Bifidobacterium bifidum dan Bifidobacterium longum dilakukan dengan
cara menusukkan 1 ose kultur murni pada agar semisolid yang dibuat dengan cara mencampurkan MRSB dengan bacto agar sebanyak 0.5%.
4. Persiapan Media Fermentasi
Media fermentasi yang digunakan adalah media berbasis MRS broth tetapi glukosa pada media diganti dengan beberapa jenis gula yang digunakan. Media dibuat dengan mencampurkan protease peptone, yeast extract, Tween 80, dipotassium hidrogen fosfat, sodium asetat,
MgSO4.7H2O dan MnSO4.4H2O. Bahan-bahan dan prosedur pembuatan
media berbasis MRSB dapat dilihat pada Lampiran 1. Sterilisasi medium dilakukan dalam otoklaf pada suhu 1210 C selama 15 menit.
glukosa, rafinosa, oligofruktosa, dan inulin dengan konsentrasi 0.5% (w/v). Penambahan gula diatas dilakukan secara terpisah setelah didapatkan medium dan ekstrak gula steril. Sterilisasi gula dilakukan dengan menggunakan filter steril 0.2 µm.
• Media Uji pertumbuhan
Media berbasis MRS ditempatkan pada tabung reaksi sebanyak 9 ml kemudian ditambahkan ekstrak gula-gula garut dan ganyong dengan TPT sebesar 5% sebesar 1 ml sehingga konsentrasi dalam medium adalah 0.5%. Media siap untuk digunakan
• Media Uji kompetisi
Media berbasis MRS ditempatkan pada tabung reaksi sebanyak 8.1 ml kemudian ditambahkan ekstrak gula umbi garut atau ganyong dengan TPT sebesar 5% sebanyak 0.9 ml sehingga konsentrasi dalam medium mencapai 0.5%. Media siap untuk digunakan pada uji kompetisi.
5. Uji Pertumbuhan BAL pada Ekstrak Gula Tepung Umbi
Pada tahap uji pertumbuhan ekstrak gula umbi garut dan Ganyong diuji terhadap tujuh jenis BAL yaitu B. bifidum, B. longum, L. casei strain rhamnosus, L. casei strain shirota, Lactobacillus G3, Lactobacillus F1, dan Lactobacillus G1.
Pada tahap ini kultur dari masing-masing BAL sebanyak 0.1 ml ditambahkan pada tabung reaksi berisi media yang telah dipersiapkan sebelumnya untuk selanjutnya dilakukan inkubasi di inkubator 370 C selama 48 jam. Untuk uji pertumbuhan menggunakan Bifidobacterium, inkubasi dilakukan dalam anaerobic jar di inkubator 370 C selama 48 jam. Prosedur yang sama juga dilakukan terhadap standar gula.
6. Kompetisi BAL dan Uji Patogen
Tahap-tahap pengujian kompetisi BAL terbaik melawan patogen terhadap ekstrak umbi garut/ganyong meliputi beberapa tahap yaitu :
a.
b.
Persiapan kultur
Kultur bakteri hasil penyegaran terlebih dahulu diencerkan sehingga akan didapatkan jumlah mikroba awal yang diingingkan. Untuk BAL terbaik dilakukan pengenceran sebesar 10 kali dari inokulum hasil penyegaran, sedangkan untuk bakteri patogen tingkat pengenceran bervariasi. Untuk Salmonella sp. Pengenceran dilakukan sebesar 100 kali dari inokulum hasil penyegaran, E. coli dan B. cereus masing-masing pengenceran dilakukan sebesar 10000 kali dari inokulum hasil penyegaran. Inokulum bakteri yang telah diencerkan akan digunakan sebagai inokulum awal pada uji kompetisi.
Uji kompetisi
Dari masing-masing inokulum bakteri hasil pengenceran diambil sebanyak 1ml inokulum BAL terbaik dan patogen yang kemudian dimasukkan kedalam tabung yang berisi media berbasis MRS broth yang telah disiapkan sebelumnya pada tahap persiapan media uji kompetisi. Masing-masing tabung uji kompetisi mengandung satu jenis BAL dan satu jenis patogen. Kombinasi antara BAL terbaik dan patogen pada tabung uji kompetisi dapat dilihat pada Tabel 4.
Tabel 4. Kombinasi BAL terbaik dan patogen pada uji kompetisi
BAL terbaik Bakteri patogen
Lactobacillus G3
Eschericia coli Salmonella sp. Bacillus cereus
Bifidobacterium bifidum
Eschericia coli Salmonella sp. Bacillus cereus
sedangkan untuk BAL terbaik Bifidobacterium bifidum dilakukan inkubasi dalam anaerobic jar pada suhu 37 0C selama 24 jam dan 48 jam. Sebelum dan setelah dilakukan uji kompetisi, masing-masing BAL dan patogen dilakukan perhitungan jumlah koloni. Perhitungan dilakukan dengan menumbuhkan BAL pada media MRSA dan patogen pada media NA pada tingkat pemupukan tertentu. Tahap perhitungan dapat dilihat lebih detilnya pada metode analisis uji kompetisi.
7. Pengaruh Pengolahan Tepung Garut dan Tepung Ganyong Terhadap Potensi Prebiotik
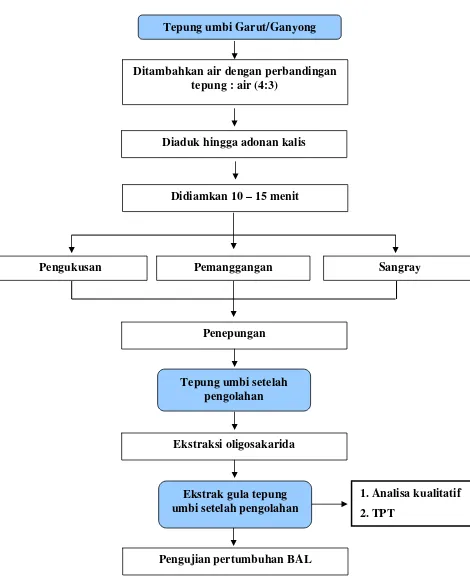
Selain dilakukan pengujian potensi tepung garut dan tepung ganyong untuk menumbuhkan BAL. Dilakukan pula pengujian potensi tepung yang telah mengalami proses pengolahan. Proses pengolahan yang dilakukan adalah pengukusan (steaming), sangray dan pemanggangan (baking). Pada pengujian pengaruh pengolahan, tepung garut dan tepung ganyong terlebih dahulu dibuat menjadi adonan yang kalis dengan hanya menambahkan air saja tanpa penambahan bahan-bahan lain. Pembuatan adonan dimulai dengan menambahkan sejumlah air ke dalam 400 gram tepung yang akan dijadikan adonan dengan perbandingan tepung : air (4:3), kemudian diaduk hingga kalis dimana tidak ada tepung yang terpisah, selanjutnya didiamkan selama 10 – 15 menit yang bertujuan memberikan waktu agar air dapat terserap oleh matrik tepung lebih sempurna. Langkah pembuatan adonan untuk pengaruh pengukusan dan pemanggangan dapat pada Gambar 5.
Langkah-langkah penelitian dalam melihat pengaruh pengolahan terhadap potensi prebiotik dapat dilihat pada Gambar 5.
Tepung umbi Garut/Ganyong
Ditambahkan air dengan perbandingan tepung : air (4:3)
Diaduk hingga adonan kalis
Didiamkan 10 – 15 menit
Pemanggangan
Pengukusan Sangray
Penepungan
Tepung umbi setelah pengolahan
Ekstraksi oligosakarida
2. TPT
1. Analisa kualitatif Ekstrak gula tepung
umbi setelah pengolahan
[image:49.595.87.557.127.708.2]Pengujian pertumbuhan BAL
C. METODE ANALISIS
1. Analisis Kadar Oligosakarida Kualitatif (Mulimani, 2005)
Penetapan kadar oligosakarida kualitatif menggunakan kromatografi kertas. Kromatografi kertas Whatman no. 1 dengan ukuran 14 x 20 cm. Ekstrak gula sebanyak 10 mikro-liter dispotkan pada kertas Whatman no.1 diikuti (sebelahnya) oleh larutan oligosakarida standar sebanyak 10 mikroliter. Migrasi dilakukan dalam chamber kromatografi dengan menggunakan larutan campuran n-butanol : etil asetat : asam asetat : air (40 : 30 : 25 : 40) (v/v) sebagai fase bergeraknya (eluen) selama 7 – 8 jam. Kemudian kertas dikering-anginkan pada suhu ruang.
Setelah kering, kertas disemprot dengan campuran 1 % α-naphtol dalam 95 % etanol yang mengandung 10 % asam ortofosfat. Setelah disemprotkan, kertas dikering anginkan kemudian ditempatkan dalam oven (100 0C) selama 10 - 15 menit. Spot oligosakarida akan berwarna biru kehitaman. Secara kualitatif jenis oligosakarida yang terkandung dalam sampel dapat diketahui dengan membandingkan Rf dengan oligosakarida standar. Berikut adalah rumus dalam menghitung nilai Rf.
eluen
tempuh
Jarak
spot
tempuh
Jarak
Rf
=
2. Total Padatan Terlarut ( Total solid )
Cawan aluminium yang akan digunakan, dikeringkan terlebih dahulu pada oven selama 15 menit, kemudian didinginkan dalam desikator sehingga diperoleh berat tetap. Cawan tersebut kemudian ditimbang (a gram). Sebanyak 1 ml ekstrak gula ditempatkan pada cawan tersebut kemudian diukur beratnya (b gram). Cawan yang telah berisi ekstrak kemudian ditempatkan dalam oven vakum selama sehari semalam.
Setelah kering, cawan berisi ekstrak didinginkan dalam desikator selama 15 menit. Berat akhir dari sampel yang telah kering kemudian diukur (c gram).
(
)
% 100
x b
a c
3. Analisis Pertumbuhan BAL pada Ekstrak Gula Tepung Garut dan Tepung Ganyong
Jumlah bakteri B.bifidum, B. longum, L. casei strain rhamnosus, L.casei shirota, Lactobacillus F1, Lactobacillus G1 dan Lactobacillus G3
sebelum dan sesudah kompetisi diukur secara kualitatif dengan absorbansi menggunakan spektrofotometer pada λ = 600 nm dengan blanko adalah media berbasis MRS tanpa perlakuan.
Pertumbuhan BAL diukur dengan cara membandingkan absorbansi media berbasis MRSB pada H-0 dengan H-2 kemudian dikurangi dengan pertumbuhan BAL pada media berbasis MRSB tanpa penambahan gula (kontrol).
Ket : A = Absorbansi pertumbuhan BAL
A2 = Absorbansi media sampel hari ke-2 pertumbuhan
A0 = Absorbansi media sampel hari ke-0 petumbuhan
B
) (
)
(A2 A0 B2 B0
A = − − −
B
2 = Absorbansi media kontrol hari ke-2 pertumbuhan
BB0 = Absorbansi media kontrol hari ke-0 pertumbuhan
4. Analisis Kompetisi BAL melawan Patogen pada Ekstrak Gula Tepung Garut dan Tepung Ganyong
Untuk H-0 dilakukan pengenceran dari kultur yang telah mengandung BAL terbaik : patogen yaitu 10-1 – 10-7. Untuk BAL dilakukan pemupukan pada MRS Agar dengan tingkat pemupukan yaitu 10-5 – 10 -7,sedangkan untuk bakteri patogen dilakukan pemupukan pada NA untuk Salmonella sp. dan B. cereus, dan EMBA untuk E. coli dengan tingkat pemupukan 10-1 – 10-4, kemudian masing-masing cawan diinkubasi pada 37 0C selama 48 jam. Untuk B. Bifidum inkubasi dilakukan dalam anaerobic jar pada suhu dan waktu yang sama. Setelah inkubasi 48 jam, jumlah mikroba dari masing-masing Agar kemudian dihitung.
Untuk H1 dan H2, media berbasis MRS yang telah ditambahkan BAL terbaik : patogen dan telah dikompetisikan selama 24 jam untuk H1 dan 48 jam untuk H2. Masing-masing tabung uji kemudian dilakukan penghitungan. Untuk BAL dilakukan pemupukan 10-5 – 10-7 pada MRS Agar. Untuk Salmonella dan B. cereus dilakukan pemupukan 10-1 – 10-4 pada NA, dan untuk E. coli dilakukan pemupukan 10-1 – 10-4 pada EMBA, selanjutnya masing-masing pemupukan diinkubasi kembali pada 37 0C selama 48 jam. Untuk B. Bifidum inkubasi dilakukan dalam anaerobic jar pada suhu dan waktu yang sama. Setelah inkubasi 48 jam, jumlah mikroba dari masing-masing Agar kemudian dihitung.
Ket : N = Jumlah mikroba (cfu/ml)
n1 = Jumlah cawan pada tingkat pengenceran tertinggi
n2 = Jumlah cawan pada tingkat pengenceran terendah
c = Jumlah total koloni yang terhitung pada cawan d = Tingkat pemupukan tertinggi yang dapat dihitung (ISO 4833 : 1991 didalam Harrigan, 2000)
(
n
n
)
d
c
N
⋅
+
=
∑
2
IV.
HASIL DAN PEMBAHASAN
A. TEPUNG UMBI GARUT (Maranta arundiacea L.) DAN UMBI GANYONG (Canna edulis Kerr.)
Umbi garut dan umbi ganyong yang digunakan dalam penelitian ini diperoleh dari Balai Besar Penelitian Bioteknologi dan Genetika (BALITBIOGEN), Departemen Pertanian, Bogor. Varietas umbi garut yang dipilih adalah varietas Ciamis karena varietas tersebut cukup mudah didapatkan di daerah Jawa Barat, selain itu varietas