TEKANAN ANTROPOGENIK: STUDI KASUS
PULAU BARRANGLOMPO DAN BONEBATANG
KEPULAUAN SPERMONDE SULAWESI SELATAN
KHAIRUL AMRI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi dengan judul “Sinekologi Padang Lamun Akibat Tekanan Antropogenik: Studi Kasus Pulau Barranglompo dan Bonebatang Kepulauan Spermonde Sulawesi Selatan” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Bogor, Juli 2012
Khairul Amri
Spermonde Archipelago, South Sulawesi. Supervised by DEDE SETIADI, IBNUL QAYIM, and D. DJOKOSETIYANTO.
Anthropogenic pressures along coastal areas particularly in small islands have increased in accordance with increasing of human population. A study has been conducted in two small islands within Spermonde Archipelago, South Sulawesi i.e. Barranglompo and Bonebatang Islands to elaborate impacts of increased anthropogenic pressure to the assemblages of seagrass beds and their associated organisms. Combined field sampling and laboratory analysis were applied to provide data and information on the impacts of anthropogenic activities occurred in small islands to the seagrass ecosystem. In Barranglompo Island, there were two activities with high intensity i.e. ship/boat transportation and domestic sewage disposal. Analysis of carbon contents of seagrass Enhalus acoroides showed that this species contributed to carbon stocks as much as
0.49-1.05 ton/ha in Barranglompo Island, while in Bonebatang Island, the values ranged between 0.08-0.34 ton/ha. Meanwhile, nitrogen concentrations in Barranglompo Island were significantly higher than those in Bonebatang Island. This was supported by lower C:N ratios and higher N:P ratios in Barranglompo Island and significantly different nitrate contents of water column between both Islands (p 0.01). Potential anthropogenic activities affecting nutrient
composition in Barranglompo Island were domestic sewage disposal and drainage of liquid household sewage. Based on the water quality parameter measured, It was concluded that anthropogenic activities in Barranglompo and Bonebatang Islands affected turbidity and Total Suspended Solid (TSS) only. Seagrass communities in Barranglompo and Bonebatang Islands were composed of eight and seven species, respectively, that grow in mixed community. Thalassia hemprichii was species with the highest important value index in both islands.
Most of macroalgae found in both islands live as epilithic (litophytic) and epipelic (rhizophytic). Three positive and two negative associations in Barranglompo and one positive and five negative associations in Bonebatang were formed among pairs of macrophytes. Analysis of macrophyte structure in both islands classified Barranglompo in moderate ecological status, whereas Bonebatang had high ecological status. This status indicated that in Barranglompo was detected a change in macrophyte composition due to anthropogenic pressure. The highest similarity index was found among stations in the same island indicating that different islands have different macrophyte assemblages. Among all sea urchin species found in both islands, Tripneustes gratilla and Diadema setosum were
two dominant species having the highest density. Index of Preponderance revealed that T. hemprichii was the largest seagrass diet within almost all sea
urchin guts. Electivity index indicated that sea urchins prefer several seagrass species especially T. hemprichii.
oleh DEDE SETIADI, IBNUL QAYIM, dan D. DJOKOSETIYANTO.
Sebagai negara kepulauan, selain memiliki wilayah laut yang luas, Indonesia juga memiliki garis pantai sepanjang 81.000 km. Wilayah perairan laut yang sangat luas ini memiliki banyak kekayaan alam hayati berupa tumbuh-tumbuhan (flora) dan hewan (fauna) yang beraneka ragam bentuk dan jenisnya. Salah satu kekayaan flora laut yang banyak tersebar di perairan pantai Indonesia adalah lamun. Lamun kadang membentuk hamparan luas di pantai sehingga dikenal sebagai padang lamun (seagrass beds).
Padang lamun memiliki banyak fungsi penting di perairan pantai, namun, padang lamun juga merupakan salah satu ekosistem yang mudah mengalami kerusakan dan perubahan. Berkurangnya penutupan padang lamun dapat disebabkan oleh faktor alami maupun aktivitas manusia (antropogenik).
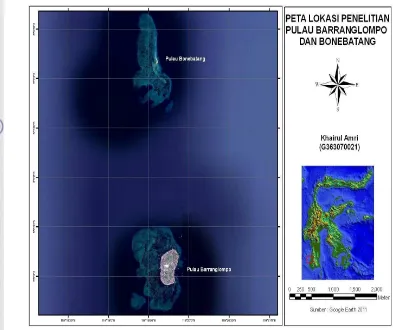
Tekanan antropogenik pada daerah pantai terutama pulau-pulau kecil semakin meningkat seiring dengan peningkatan jumlah penduduk. Oleh karena itu, penelitian yang bertujuan untuk mengkaji sinekologi ekosistem padang lamun akibat tekanan antropogenik yang terjadi di pulau kecil dengan jumlah penduduk berbeda telah dilaksanakan pada dua pulau dalam gugusan Kepulauan Spermonde, Sulawesi Selatan yaitu Pulau Barranglompo dan Pulau Bonebatang. Penelitian ini dilaksanakan mulai dari bulan Mei 2010 sampai bulan Juli 2011 dengan mengamati beberapa aspek yaitu: aktivitas antropogenik yang terjadi di pulau kecil, struktur komunitas lamun, potensi grazing oleh bulu babi, asosiasi dan interaksi makrofita (lamun dan makroalgae), dinamika nutrien jaringan lamun dan kolom air serta kualitas perairan habitat padang lamun pada tekanan antropogenik yang berbeda.
Aktivitas antropogenik diamati melalui pengamatan langsung terhadap kegiatan sehari-hari penduduk yang ada di pulau lokasi penelitian dan didukung dengan informasi masyarakat mengenai aktivitasnya selama ini. Dari pengamatan ini 9 aktivitas antropogenik yang teridentifikasi di Pulau Barranglompo yang sangat padat penduduknya, sedangkan di Pulau Bonebatang yang tidak berpenduduk, terdapat 2 aktivitas yang berlangsung saat ini. Di Pulau Barranglompo, terdapat dua aktivitas antropogenik yang memiliki intensitas tinggi yaitu lalu lintas kapal/perahu dan pembuangan sampah rumah tangga.
Untuk mengetahui dampak dari aktivitas antropogenik terhadap status nutrien pada jaringan lamun dan kolom air, dilaksanakan pengukuran pada daun lamun Enhalus acoroides dan kolom air. Sampel diambil dari daun lamun E. acoroides dan air permukaan pada tiga stasiun dengan jarak berbeda dari garis
pantai pada masing-masing pulau. Analisis kandungan karbon pada daun lamun
E. acoroides menunjukkan potensi stok karbon jenis ini di Pulau Barranglompo
paling potensial mempengaruhi komposisi nutrien di Pulau Barranglompo adalah pembuangan sampah rumah tangga dan aliran limbah cair dari rumah penduduk di sekitar pantai.
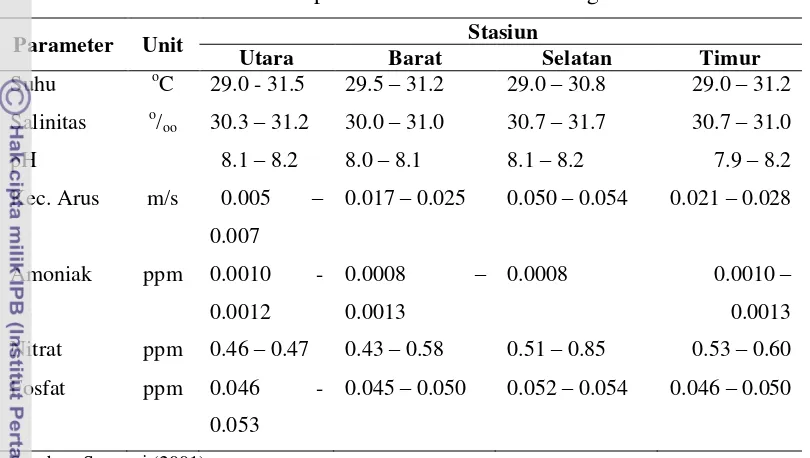
Faktor lingkungan memiliki pengaruh yang besar terhadap struktur komunitas dan pola penyebaran lamun beserta biota asosianya. Sebaliknya kompleksitas struktural lamun dapat juga mempengaruhi faktor lingkungan tersebut. Oleh karena itu, parameter lingkungan yang meliputi suhu, salinitas, ukuran butir sedimen, kekeruhan, padatan tersuspensi total, arah dan kecepatan arus, dan tinggi gelombang telah diukur di Pulau Barranglompo dan Pulau Bonebatang. Suhu dan salinitas di kedua pulau memiliki pola yang hampir sama dimana nilai yang tinggi dijumpai di sisi selatan, sedangkan yang lebih rendah di sisi barat laut. Jenis pasir halus memiliki proporsi terbesar dalam struktur sedimen di kedua pulau. Kekeruhan di Pulau Barranglompo telah melampaui ambang batas baku mutu lingkungan terutama pada stasiun yang berdekatan dengan garis pantai. Kekeruhan di Pulau Barranglompo nyata (p 0.05) dari Pulau
Bonebatang. Begitupula dengan padatan tersuspensi total (TSS) di Pulau Barranglompo lebih tinggi dibandingkan dengan Pulau Bonebatang dan berbeda sangat nyata (p 0.01). Sementara itu kecepatan arus dan tinggi gelombang di
kedua pulau relatif tidak berbeda nyata (p 0.05). Dapat disimpulkan bahwa aktivitas antropogenik mempengaruhi kekeruhan dan padatan tersuspensi total, namun tidak mempengaruhi parameter lain.
Pengamatan struktur komunitas lamun dilakukan pada 3 stasiun berdasarkan jaraknya dari garis pantai: stasiun A diambil pada vegetasi lamun terdekat dengan garis pantai, stasiun B berjarak sekitar 100 m dari garis pantai, dan stasiun C berjarak sekitar 200 m dari garis pantai dimana lamun sudah berbatasan dengan daerah terumbu karang. Sampling pada setiap stasiun dilakukan pada 9 sub stasiun mengelilingi pulau. Struktur komunitas lamun yang diamati meliputi kerapatan, frekuensi, luas penutupan, morfometri (panjang dan lebar) daun lamun dan indeks luas daun. Sebanyak 8 spesies lamun teridentifikasi di Pulau Barranglompo, sedangkan di Pulau Bonebatang dijumpai 7 spesies.
Thalassia hemprichii merupakan spesies yang memiliki nilai indeks nilai penting
(INP) tertinggi baik di Pulau Barranglompo maupun Pulau Bonebatang. Hasil pengukuran morfometri daun lamun menunjukkan bahwa daun E. acoroides, H. uninervis, S. isoetifolium dan T. hemprichii di Pulau Barranglompo lebih panjang
dibandingkan dengan spesies yang sama di Pulau Bonebatang, sedangkan daun C. rotundata dan H. ovalis di Pulau Barranglompo sedikit lebih pendek daripada
yang dijumpai di Pulau Bonebatang. Nilai indeks luas daun di Pulau Barranglompo memperlihatkan pola menurun dengan semakin jauhnya stasiun dari garis pantai, sedangkan di Pulau Bonebatang relatif lebih merata.
positif antara pasangan Cymodocea rotundata-Thalassia hemprichii, Acanthophora spicifera-Laurencia papillosa, dan Dictyota bartayresiana-Laurencia papillosa, sedangkan asosiasi negatif didapatkan pada dua pasangan
yaitu Enhalus acoroides-Halodule uninervis dan Thalassia hemprichii-Halodule uninervis. Di Pulau Bonebatang, asosiasi positif dijumpai pada pasangan C. rotundata-H. uninervis saja, sedangkan asosiasi negatif dijumpai pada beberapa
pasangan yaitu. C. rotundata-A.spicifera, C. rotundata-Actinoritchia fragilis, E. acoroides-H. uninervis, T. hemprichii-Gracilaria coronopifolia, dan T. hemprichii-Sargassum crassifolium. Sementara itu, untuk menguji fungsi
makrofita sebagai bioindikator perubahan ekosistem akibat tekanan antropogenik, didapatkan bahwa Pulau Barranglompo memiliki status ekologi sedang dan Pulau Bonebatang memiliki status ekologi sangat bagus. Indeks similaritas tertinggi dijumpai antar stasiun pada pulau yang sama, sehingga disimpulkan bahwa pulau yang berbeda memiliki konfigurasi makroalgae yang berbeda dan sangat dipengaruhi oleh aktivitas antropogenik yang berlangsung di pulau-pulau tersebut.
Untuk mengkaji potensi grazing oleh bulu babi dilakukan pengamatan dan pengukuran aspek-aspek yang meliputi komposisi jenis, kepadatan, diameter test dan analisis isi perut. Kepadatan bulu babi diamati dalam plot kuadrat (3 m x 3 m) yang dipasang secara acak pada daerah lamun mulai dari pinggir pantai sampai kedalaman dimana lamun masih tumbuh. Diameter cangkang (test) bulu babi diukur menggunakan mistar geser langsung di lapangan, sedangkan isi perutnya diamati di laboratorium. Terdapat 6 jenis bulu babi yang sama pada masing-masing pulau yaitu Diadema setosum, Echinothrix calamaris, Echinothrix diadema, Echinometra mathaei, Mespilia globulus dan Tripneustes gratilla. Bulu
babi jenis T. gratilla dan D. setosum merupakan jenis yang dominan dan memiliki
kepadatan tertinggi di kedua pulau. Indeks pilihan masing-masing jenis bulu babi mengindikasikan bahwa bulu babi menyukai berbagai jenis lamun, terutama T. hemprichii.
Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar bagi IPB
PULAU BARRANGLOMPO DAN BONEBATANG
KEPULAUAN SPERMONDE SULAWESI SELATAN
KHAIRUL AMRI
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Biologi Tumbuhan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Luar Komisi pada Ujian Tertutup
: Dr. Ir. Richardus F. Kaswadji. M.Sc. (Departemen Ilmu Kelautan FPIK IPB)
Dr. Sulistijorini
(Departemen Biologi FMIPA IPB)
Penguji Luar Komisi pada Ujian Terbuka
: Prof. Dr. Ir. Rokhmin Dahuri, M.S. (Guru Besar FPIK IPB)
Dr. Sulistijorini
Tuhan yang maha pengasih dan penyayang, atas segala limpahan rahmat dan karunia-Nya sehingga disertasi yang berjudul “Sinekologi Padang Lamun Akibat Tekanan Antropogenik: Studi Kasus Pulau Barranglompo dan Bonebatang Kepulauan Spermonde Sulawesi Selatan” ini dapat diselesaikan dengan baik. Karya ilmiah ini merupakan salah satu syarat memperoleh gelar Doktor pada Sekolah Pascasarjana Institut pertanian Bogor.
Karya ilmiah ini merupakan hasil dari penelitian yang telah dilaksanakan dari bulan Mei 2010 sampai bulan Juli 2011 di Pulau Barranglompo dan Bonebatang, Kepulauan Spermonde, Sulawesi Selatan. Dengan selesainya karya ilmiah ini penulis menyampaikan terima kasih dan penghargaan kepada Komisi Pembimbing, Ketua Program Studi Biologi Tumbuhan, Penguji ujian kualifikasi, ujian tertutup dan ujian terbuka atas masukannya terhadap karya ilmiah ini.
Selama studi, penelitian dan penulisan karya ilmiah ini, penulis mendapatkan bantuan finansial dari Dirjen DIKTI berupa beasiswa BPPS, bantuan penyelesaian studi program doktor dan juga beasiswa program Sandwich Tahun 2009. Bantuan juga penulis dapatkan dalam bentuk bantuan analisis data dari Rektor Universitas Hasanuddin serta bantuan penulisan disertasi dari Program Mitra Bahari-COREMAP 2 (Coral Reef Rehabilitation and Management
Program Phase 2). Oleh karena itu penulis berterima kasih atas bantuan dan
dukungan ini.
Penulis berharap agar karya ilmiah ini dapat memberikan informasi tentang ekosistem padang lamun di Indonesia terutama di Kepulauan Spermonde. Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2012
dan bantuan berbagai pihak. Oleh karena itu dengan segala kerendahan hati penulis mengucapkan terima kasih dan penghargaan yang tulus kepada:
1. Prof. Dr. Ir. Dede Setiadi, M.S., selaku ketua komisi pembimbing yang telah meluangkan waktu untuk membimbing dan mengarahkan penulis sejak masa perkuliahan, persiapan penelitian hingga penulisan disertasi ini.
2. Dr. Ir. Ibnul Qayim, dan Prof. Dr. Ir. D. Djokosetiyanto, DEA., selaku anggota komisi pembimbing yang telah mencurahkan waktunya untuk membimbing dan mengarahkan penulis selama ini.
3. Para penguji luar komisi: Prof. Dr. Ir. Dedi Soedharma dan Dr. Malikusworo Hutomo, APU (Ujian Kualifikasi), Dr. Ir. Richardus F. Kaswadji, M.Sc (Ujian Tertutup), Dr. Sulistijorini (Ujian Tertutup dan Terbuka), serta Prof. Dr. Ir. Rokhmin Dahuri, M.S (Ujian Terbuka) atas masukannya dalam penyempurnaan proposal dan disertasi ini.
4. Dekan Sekolah Pascasarjana IPB beserta staf atas pelayanan akademik yang telah diberikan sejak masuk hingga akhir studi.
5. Dr. Ir. Miftahudin, M.Si (Ketua Program Studi Biologi Tumbuhan FMIPA IPB) atas perhatiannya selama ini terutama atas masukannya terhadap naskah terakhir disertasi ini.
6. Rektor Universitas Hasanuddin, Dekan Fakultas Ilmu Kelautan dan Perikanan UNHAS dan Ketua Jurusan Ilmu Kelautan FIKP UNHAS atas izin dan rekomendasi untuk melanjutkan studi S3, serta bantuan analisis data Tahun 2011.
7. Dirjen DIKTI atas beasiswa BPPS, bantuan penyelesaian program doktor dan beasiswa program Sandwich Tahun 2009.
8. Dr. Harald Asmus dan Dr. Raghnild Asmus dari Alfred Wegener Institute (AWI) atas fasilitas dan bimbingan yang diberikan selama penulis melaksanakan kegiatan Sandwich di Jerman.
9. Program Mitra Bahari-COREMAP 2 (Coral Reef Rehabilitation and
dan Pulau-Pulau Kecil (Puslit LP3K) UNHAS atas kolaborasi riset selama ini serta penggunaan Laboratorium SPICE (Science for Protection of Indonesian
Coastal Ecosystem) selama penelitian ini.
11.Rekan-rekan dari FIKP UNHAS (Dr. Asmi Citra Malina, Dr. Mahatma Lanuru, Dr. Nurjanna Nurdin, Dr. Rohani AR) atas dukungan peralatan dan data sekunder selama penelitian.
12.Rekan-rekan JIKUNHAS 2007 (Ahmad Bahar, M. Banda Selamat, Supriadi, dan Syafyudin Yusuf) atas kerjasama dan kekompakannya selama ini, datang bersamaan ke IPB dan mengakhiri studi pada waktu yang bersamaan pula. 13.Rekan-rekan BOT 2007 (Jamili, Jati Batoro, Jumari, Radite Tistama, Ratna
Yuniati, Sri Widodo Agung Suedy, dan T. Alief Aththorick) atas kebersamaan dan kerjasamanya sejak awal perkuliahan hingga akhir studi.
14.Dr. Muh. Hatta Jamil, Dr. Mohammad Wijaya, Dr. Nadiarti, M. Chasyim Hasani, M. Syahrul, M.Si serta teman-teman dari Pengurus WACANA IPB dan Sulawesi Selatan 2008-2010 atas perhatian dan kerjasamanya selama ini. 15.Bunda Suri, Dody Priosambodo, Sabhan, Reski Praja Putra, Yulianto Suteja,
Mangopo Hardianto, Andi Haerul, Muh. Arham Rajab serta teman-teman dari Pondok Tanadoang/PTD atas keakraban dan dukungan yang telah diberikan selama ini.
16.Bapak Ridwan, Abdul Muttalib, Eka Hesdianti dan Yuke Puspitasari yang telah membantu dalam pengambilan data di Pulau Barranglompo dan Pulau Bonebatang.
17.Istri tercinta Fauzia P. Bakti, SH. MH., putri tersayang Tsabitah Austrina Khairul, Orang tua (H. Abd. Hakim & Hj. Syarifah), mertua (P. Bakti & Hj. Saenab Bando) serta seluruh keluarga atas doa, motivasi, perhatian dan kasih sayang yang telah diberikan selama ini.
sebagai anak ketiga dari pasangan H. Abdul Hakim (alm) dan Hj. Syarifah. Pendidikan sarjana ditempuh di Program Studi Ilmu dan Teknologi Kelautan, Universitas Hasanuddin Makassar, lulus pada tahun 1995. Pada tahun 2001, penulis mendapatkan beasiswa Australian Development Scholarship (ADS) dari Australian Agency for International Development (AusAID) untuk melanjutkan studi S2 pada School of Applied Sciences, University of Newcastle, Australia dan menamatkannya pada tahun 2003. Kesempatan untuk melanjutkan ke program doktor pada Program Studi Biologi Tumbuhan, Sekolah Pascasarjana Institut Pertanian Bogor diperoleh pada tahun 2007. Beasiswa pendidikan pascasarjana diperoleh dari BPPS-DIKTI.
Penulis bekerja sebagai tenaga pengajar di Universitas Hasanuddin Makassar sejak tahun 1995 dan ditempatkan pada Jurusan Ilmu Kelautan, Fakultas Ilmu Kelautan dan Perikanan. Mata kuliah yang diajarkan selama ini adalah Botani Laut, Biologi Laut, Planktonologi Kelautan, Avertebrata Laut, Ikhtiologi dan Teknik Budidaya Rumput Laut.
Selama mengikuti program S3, penulis aktif sebagai pengurus Forum Mahasiswa Pascasarjana (Forum WACANA) IPB dan Forum WACANA daerah Sulawesi Selatan tahun 2008-2010. Penulis juga mendapatkan beasiswa Sandwich DIKTI untuk melakukan kegiatan sandwich pada Alfred Wegener Institute (AWI), Lembaga Penelitian Laut dan Kutub di Jerman mulai dari bulan September 2009 hingga Januari 2010.
Salah satu bagian disertasi ini yang berjudul “Nutrient Content of
Seagrass Enhalus acoroides Leaves in Barranglompo and Bonebatang Islands:
Implication to Increased Anthropogenic Pressure” telah diterbitkan pada jurnal
DAFTAR TABEL ……… xvi
3. GAMBARAN UMUM LOKASI PENELITIAN
Kepulauan Spermonde ……….……….. 19
Pulau Barranglompo ……….. 21
Pulau Bonebatang ………. 24
4. AKTIVITAS ANTROPOGENIK DI PULAU BARRANGLOMPO DAN BONEBATANG, KEPULAUAN SPERMONDE
Abstrak ……… 29
Abstract ……… 29
Pendahuluan ………. 29
Bahan dan Metode ……… 30
Hasil dan Pembahasan ………. 32
Simpulan dan Saran ……….. 44
5. DINAMIKA NUTRIEN PADA JARINGAN DAUN LAMUN
Enhalus acoroides DAN KOLOM AIR
Abstrak ……… 45
Abstract ……… 45
Pendahuluan ……… 46
Bahan dan Metode ……… 47
Hasil dan Pembahasan ……….. 50
Simpulan ……… 58
6. DAMPAK AKTIVITAS ANTROPOGENIK TERHADAP
KUALITAS PERAIRAN HABITAT PADANG LAMUN
Abstrak ………. 59
Abstract ………. 59
Pendahuluan ……….. 60
Bahan dan Metode ……… 61
Hasil dan Pembahasan ……….. 64
BARRANGLOMPO DAN PULAU BONEBATANG
Abstrak ……….. 83
Abstract ……….. 83
Pendahuluan ……….. 84
Bahan dan Metode ……… 85
Hasil dan Pembahasan ……….. 91
Simpulan ……… 103
8. ASOSIASI DAN INTERAKSI MAKROFITA (LAMUN DAN
MAKROALGAE) AKIBAT TEKANAN ANTROPOGENIK YANG BERBEDA
Abstrak ……… 105
Abstract ……… 105
Pendahuluan ……… 106
Bahan dan Metode ……… 108
Hasil dan Pembahasan ………. 114
Simpulan ……… 142
9. POTENSI GRAZING BULU BABI PADA EKOSISTEM
PADANG LAMUN DI PULAU BARRANGLOMPO DAN BONEBATANG
Abstrak ……… 145
Abstract ……… 145
Pendahuluan ……… 145
Bahan dan Metode ……… 147
Hasil dan Pembahasan ………. 149
Simpulan ………. 160
10. PEMBAHASAN UMUM ……… 161
11. SIMPULAN DAN SARAN ……… 173
DAFTAR PUSTAKA ……….. 175
1. Pemicu stres penting yang membatasi distribusi dan kelimpahan lamun (Larkum & den Hartog 1989) ………
16
2. Parameter fisika-kimia kolom air di Pulau Barranglompo ……….. 23 3. Parameter fisika-kimia perairan di Pulau Bonebatang ……… 25 4. Judul-judul penelitian berkaitan dengan ekosistem padang lamun
yang pernah dilaksanakan di Pulau Barranglompo dan Pulau
Bonebatang ……… 26
5. Jenis-jenis aktivitas antropogenik di Pulau Barranglompo serta dampaknya terhadap ekosistem padang lamun ……… 33 6. Jumlah perahu besar (PB) dan perahu kecil (PK) yang berlabuh di
pantai Pulau Barranglompo ……….. 36
7. Aktivitas antropogenik yang dijumpai di Pulau Bonebatang ……… 43 8. Rasio C:N:P rata-rata pada daun lamun E. acoroides dari Pulau
Barranglompo dan Pulau Bonebatang ……… 52
9. Komposisi rasio atom daun lamun dari penelitian-penelitian terdahulu pada berbagai lokasi (Fourqurean et al. 1992) ………... 53
10. Klasifikasi sedimen berdasarkan ukuran (Skala Wenthworth) ……. 62 11. Kesesuaian perairan untuk kepentingan perikanan berdasarkan
nilai padatan tersuspensi total (TSS) ……… 75 12. Kelompok penciri karakteristik lingkungan di Pulau Barranglompo
dan Pulau Bonebatang ……….. 81
13. Klasifikasi Penutupan Lamun ……….. 90
14. Status Padang Lamun (SK Menteri Negara Lingkungan Hidup No.
200 Tahun 2004) ……….. 90
15. Komposisi jenis lamun di Pulau Barranglompo ……….. 91 16. Komposisi Jenis Lamun di Pulau Bonebatang ………. 93 17. Indeks Nilai Penting jenis-jenis lamun pada setiap stasiun di Pulau
Bonebatang ……… 99 19. Ukuran panjang daun (PD) rata-rata dan lebar daun (LD) rata-rata
(± sd) jenis-jenis lamun pada setiap stasiun pengamatan di Pulau
Barranglompo ……… 101
20. Ukuran panjang daun (PD) rata-rata dan lebar daun (LD) rata-rata (± sd) jenis-jenis lamun pada setiap stasiun pengamatan di Pulau
Bonebatang ……… 101
21. Nilai indeks luas daun lamun di Pulau Barranglompo dan Pulau
Bonebatang ……… 102
22. Nilai skala Braun-Blanquet untuk berbagai persentase penutupan makroalgae (Braun-Blanquet 1965 diacu Gab-Alla 2007)………… 109 23. Sistem skoring numerik untuk evaluasi status ekologis perairan
transisi dan perairan pantai (Orfanidis et al. 2001) ……….. 113
24. Penentuan tingkat kemiripan vegetasi antar stasiun pengamatan … 114 25. Klasifikasi makroalgae yang ditemukan di lokasi penelitian ……… 115 26. Kategori Lifeform setiap jenis makroalgae yang ditemukan di
Pulau Barranglompo ……… 127
27. Kategori Lifeform setiap jenis makroalgae yang ditemukan di
Pulau Bonebatang ……… 127
28. Frekuensi Braun Blanquet makroalgae di Pulau Barranglompo dan
Pulau Bonebatang ……… 128
29. Kelimpahan Braun Blanquet makroalgae di Pulau Barranglompo
dan Pulau Bonebatang ……… 130
30. Kerapatan Braun Blanquet makroalgae di Pulau Barranglompo dan
Pulau Bonebatang ……… 131
31. Asosiasi lamun dan makroalgae di Pulau Barranglompo. ………… 134 32. Asosiasi lamun dan makroalgae di Pulau Bonebatang. ……… 136 33. Persentase kategori nilai indeks asosiasi delapan spesies lamun dan
makroalgae dominan di Pulau Bonebatang ………. 138
35. Pembagian spesies makroalgae di Pulau Barranglompo ke dalam
kelompok status ekologi (Ecological Status Group-ESG) I dan II .. 139
36. Pembagian spesies makroalgae di Pulau Bonebatang ke dalam
kelompok status ekologi (Ecological Status Group-ESG) I dan II .. 140
37. Nilai tutupan makrofita laut (lamun dan makroalgae) setiap kelompok status ekologi pada setiap stasiun di Pulau
Barranglompo dan Bonebatang ……… 140
38. Indeks similaritas dan disimilaritas makrofita antar stasiun di Pulau
Barranglompo dan Pulau Bonebatang ……….. 142 39. Komposisi jenis Bulu Babi di Pulau Barranglompo dan Pulau
Bonebatang ……… 149
40. Kepadatan Bulu babi rata-rata setiap stasiun (Individu/m2) di Pulau Barranglompo dan Pulau Bonebatang ……….. 152 41. Kepadatan beberapa jenis bulu babi di berbagai lokasi di Indonesia
(Dobo 2009) ………. 153
42. Diameter cangkang (cm ± sd) setiap jenis bulu babi di Pulau
Barranglompo dan Pulau Bonebatang ……… 153 43. Nilai Indeks Pilihan (Electivity Index) empat jenis bulu babi
terhadap makanan lamun dan makroalgae di Pulau Barranglompo
dan Bonebatang ……… 156
44. Rangkuman hasil-hasil yang diperoleh selama penelitian ………… 163 45. Perkiraan skala waktu (maksimum) untuk penguraian sampah (Tait
& Dipper 1998) ……… 164
46. Contoh dampak stres antropogenik terhadap komunitas makrofita
1. Skema penelitian mengenai sinekologi padang lamun akibat
aktivitas antropogenik ...………
3
2. Komponen dasar arsitektur lamun (Hemminga & Duarte 2000) ….. 8 3. Sekawanan ikan kecil yang berlindung di celah-celah daun lamun E.
acoroides di Pulau Barranglompo ……… 11
4. Peta pembagian zona Kepulauan Spermonde ……….. 20 5. Rumah panggung salah satu warga di Pulau Barranglompo ……… 23 6. Peta lokasi penelitian Pulau Barranglompo dan Pulau Bonebatang . 31 7. Pulau Barranglompo yang diambil dari sisi tenggara ……….. 31 8. Pulau Bonebatang diambil dari sisi timur ………. 32 9. Perahu bermotor (a) beserta bagian-bagiannya, jangkar (b),
baling-baling (c) dan papan kemudi (d) yang dapat menyebabkan kerusakan
fisik terhadap lamun ……… 35
10. Perahu besar yang sedang berlabuh di pantai barat Pulau
Barranglompo ……….. 36
11. Perahu ukuran kecil, (a) jolloro, (b) katinting, (c) lepa-lepa……… 37
12. Kapal yang sedang menjalani perbaikan ……….. 38 13. Tumpukan sampah di pinggir pantai barat Pulau Barranglompo …. 39 14. Tumpukan karang batu yang dikumpulkan penduduk untuk bahan
bangunan dan disusun sebagai penahan ombak di depan rumah di
sisi selatan Pulau Barranglompo ………. 40
15. Penimbunan/reklamasi pantai yang dilakukan masyarakat Pulau Barranglompo di sisi utara (atas) dan sisi barat (bawah) …………. 41 16. Alat perangkap ikan (bubu) yang dipasang nelayan di daerah padang
lamun Pulau Barranglompo ……….. 42
17. Aktivitas praktek lapang mahasiswa di pantai ……….. 43 18. Kadar rata-rata (± sd) karbon, nitrogen dan fosfor (sebagai % bobot
kering) pada daun lamun E. acoroides di Barranglompo dan
Pulau Barranglompo dan Pulau Bonebatang ……… 54 20. Klorofil-a rata-rata lamun E. acoroides pada setiap stasiun di Pulau
Barranglompo dan Pulau Bonebatang ……….. 55
21. Konsentrasi nitrat (± sd) pada setiap stasiun di Pulau Barranglompo
dan Pulau Bonebatang ……… 56
22. Konsentrasi fosfat (± sd) pada setiap stasiun di Pulau Barranglompo
dan Pulau Bonebatang ……… 57
23. Nilai suhu (± sd) pada setiap stasiun di Pulau Barranglompo dan
Pulau Bonebatang ………. 64
24. Sebaran suhu (oC) di Pulau Barranglompo ……….. 65 25. Sebaran suhu (oC) di Pulau Bonebatang ……….. 65 26. Bulu babi Tripneustes gratilla menutupi permukaan tubuhnya
dengan daun lamun ………. 66
27. Nilai salinitas (± sd) pada setiap stasiun di Pulau Barranglompo dan
Pulau Bonebatang ……….. 67
28. Sebaran salinitas (o/oo) di Pulau Barranglompo ……… 68 29. Sebaran salinitas (o/oo) di Pulau Bonebatang ……… 68 30. Persentase masing-masing jenis sedimen di Pulau Barranglompo dan
Pulau Bonebatang ……….. 69
31. Nilai kekeruhan (± sd) pada setiap stasiun di Pulau Barranglompo
dan Pulau Bonebatang ………. 71
32. Sebaran kekeruhan (NTU) di Pulau Barranglompo ………. 71 33. Sebaran kekeruhan (NTU) di Pulau Bonebatang ……… 72 34. Nilai padatan tersuspensi total (± sd) pada setiap stasiun di Pulau
Barranglompo dan Pulau Bonebatang ………. 73
35. Sebaran TSS (mg/l) di Pulau Barranglompo ……… 73 36. Sebaran TSS (mg/l) di Pulau Bonebatang ……… 74 37. Nilai kecepatan arus (± sd) pada setiap stasiun di Pulau
38. Sebaran arah dan kecepatan arus (m/detik) di Pulau Barranglompo.. . 77 39. Sebaran arah dan kecepatan arus (m/detik) di Pulau Bonebatang … 77 40. Tinggi gelombang (± sd) pada setiap stasiun di Pulau Barranglompo
dan Pulau Bonebatang ……… 78
41. Sebaran tinggi gelombang (cm) di Pulau Barranglompo ……… 79 42. Sebaran tinggi gelombang (cm) di Pulau Bonebatang ……… 79 43. Analisis Komponen Utama (Principal Component Analysis) sebaran
karakteristik fisika-kimia padang lamun di Pulau Barranglompo dan
Pulau Bonebatang ……….. 80
44. Analisis Komponen Utama (Principal Component Analysis) sebaran stasiun di Pulau Barranglompo dan Pulau Bonebatang ……….. 81 45. Sebaran stasiun dan sub-stasiun pengamatan struktur komunitas
lamun di Pulau Barranglompo ……….. 86
46. Sebaran stasiun dan sub-stasiun pengamatan struktur komunitas
lamun di Pulau Bonebatang ……….. 86
47. Pengamatan komunitas lamun menggunakan transek kuadrat ……. 87 48. Spesies lamun yang dijumpai di lokasi penelitian. (a) Syringodium
isoetifolium, (b) Cymodocea rotundata, (c) Thalassia hemprichii, (d)
Enhalus acoroides, (e) Halophila minor, (f) Halophila ovalis, (g)
Halodule pinifolia, (h) Halodule uninervis ……….. 92
49. Kerapatan relatif (Rdi) jenis-jenis lamun pada setiap stasiun di Pulau
Barranglompo ……….. 94
50. Kerapatan relatif (Rdi) jenis-jenis lamun pada setiap stasiun di Pulau
Bonebatang ………. 95
51. Frekuensi relatif (Rfi) jenis-jenis lamun pada setiap stasiun di Pulau
Barranglompo ………. 96
52. Frekuensi relatif (Rfi) jenis-jenis lamun pada setiap stasiun di
Pulau Bonebatang ……….. 96
53. Penutupan (Ci) dan penutupan relatif (RCi) jenis-jenis lamun pada
54. Penutupan relatif (RCi) jenis-jenis lamun pada setiap stasiun di
Pulau Bonebatang ……… 98
55. Nilai rata-rata (± sd) penutupan lamun di setiap stasiun. BL=Pulau Barranglompo, BB=Pulau Bonebatang, A,B,C=Stasiun …...………. 98 56. Hasil uji Correspondence Analysis (CA) jenis-jenis lamun pada
setiap stasiun di Pulau Barranglompo dan Pulau Bonebatang …….. 100 57. Tabel kontingensi 2 x 2 atau tabel asosiasi spesies (Ludwig &
Reynolds 1988) ………. 110
58. Matriks berdasarkan kelimpahan rata-rata ESG untuk menentukan status ekologis perairan transisi dan perairan pantai (Orfanidis et al.
2001) ………. 112
59. Makroalgae hijau (Chlorophyta) yang dijumpai di daerah padang lamun. (a) Boodlea composita, (b) Chlorodesmis fastigiata, (c)
Neomeris annulata, (d) Halimeda macroloba, (e) Halimeda opuntia 117
60. Makroalgae coklat (Phaeophyta) yang dijumpai di daerah padang lamun. (a) Dictyota bartayresiana, (b) Hydroclathrus clathratus, (c)
Hormophysa triquetra, (d) Padina australis, (e) Rosenvingea
intricata……… 119
61. Makroalgae coklat (Phaeophyta) dari genera Sargassum dan
Turbinaria yang dijumpai di daerah padang lamun. (a) Sargassum
binderi, (b) S. crassifolium, (c) S. polycistum, (d) Turbinaria
conoidess, (e) T. ornata ……… 121
62. Makroalgae merah (Rhodophyta) yang dijumpai di daerah padang lamun. (a) Acanthophora spicifera (b) Acanthophora muscoides,
(c) Actinoritchia fragilis, (d) Amphiroa fragilissima ……… 122
63. Makroalgae merah (Rhodophyta) yang dijumpai di daerah padang lamun. (a) Eucheuma denticulatum (b) Eucheuma serra,
64. Makroalgae merah (Rhodophyta) yang dijumpai di daerah padang lamun. (a) Gracilaria coronopifolia (b) Gracilaria salicornia,
(c) Hypnea esperi, (d) Hypnea cervicornis, (e) Laurencia papillosa . 126
65. Biomassa (g bobot kering/m2) spesies makroalgae yang dijumpai di daerah padang lamun Pulau Barranglompo ……… 132 66. Biomassa (g bobot kering/m2) spesies makroalgae yang dijumpai
di daerah padang lamun Pulau Bonebatang ……… 133 67. Matriks asosiasi lamun dan makroalgae di Pulau Barranglompo …. 135 68. Matriks asosiasi lamun dan makroalgae di Pulau Bonebatang ……. 137 69. Pengukuran diameter cangkang bulu babi menggunakan mistar
geser. Foto diambil saat penelitian ………. 148 70. Jenis-jenis bulu babi yang terdapat di Pulau Barranglompo dan
Pulau Bonebatang. (a) Diadema setosum; (b) Tripneustes gratilla;
(c) Echinothrix calamaris; (d) Echinothrix diadema;
(e) Echinometra mathaei; (f) Mespilia globulus ……… 150
71. Kepadatan bulu babi rata-rata (± sd) di Pulau Barranglompo dan
Pulau Bonebatang ……… 152
72. Diameter cangkang rata-rata (cm ± sd) setiap jenis bulu babi di Pulau Barranglompo dan Pulau Bonebatang ………. 154 73. Persentase makanan rata-rata dalam lambung bulu babi berdasarkan
indeks bagian terbesar (preponderance index) di Pulau
Barranglompo ………. 155
74. Persentase makanan rata-rata dalam lambung bulu babi berdasarkan indeks bagian terbesar (preponderance index) di Pulau Bonebatang . 155
75. Bagian dalam cangkang bulu babi Tripneustes gratilla yang dikoleksi dari perairan Pulau Barranglompo. ……… 157 76. Korelasi antara kerapatan lamun dengan kepadatan bulu babi di
Pulau Barranglompo ……… 158
77. Korelasi antara kerapatan lamun dengan kepadatan bulu babi di
1. Daftar Istilah ……… 199 2. Koordinat GPS Posisi Stasiun dan Sub stasiun Penelitian ……….. 200 3. Kunci Identifikasi Lamun di Indonesia ……… 201 4. Kerapatan, Frekuensi dan Penutupan jenis-jenis lamun pada setiap
stasiun di Pulau Barranglompo dan Pulau Bonebatang ………….. 208 5. Nilai Indeks Luas Daun Lamun di Pulau Barranglompo dan
Bonebatang ………... 210
6. Sebaran Kepadatan dan Diameter Cangkang Bulu Babi ………… 211 7. Biomassa rata-rata Makroalgae di Pulau Barranglompo dan
Bonebatang ……….. 213
8. Nilai Indeks Ochiai Makrofita di Pulau Barranglompo dan Pulau
Bonebatang ……….. 215
9. Kelimpahan Makrofita Kelompok Status Ekologi I dan II di Pulau
Barranglompo dan Pulau Bonebatang ……… 217
10. Nilai Nutrien Jaringan Daun Enhalus acoroides dan Kolom air di
Pulau Barranglompo dan Pulau Bonebatang ………... 219 11. Ukuran Butir Sedimen Habitat Padang Lamun Pulau
Barranglompo dan Pulau Bonebatang ………. 220
12. Parameter Kualitas Perairan di Pulau Barranglompo dan Pulau
Bonebatang ……….. 221
13. Ringkasan hasil uji t nutrien dan parameter kualitas air di Pulau Barranglompo (Grup 1) dan Pulau Bonebatang (Grup 2) ………… 224 14. Hasil Analisis PCA Parameter Fisika-Kimia Perairan ………. 225 15. Hasil Analisis Correspondence Analysis (CA) komunitas lamun … 226
16. Ringkasan hasil uji t kepadatan dan diameter cangkang bulu babi
dan Bonebatang Kepulauan Spermonde Sulawesi Selatan
Nama : Khairul Amri
NIM : G363070021
Disetujui
Komisi Pembimbing
Ketua
Prof.Dr.Ir. Dede Setiadi, M.S
Dr.Ir. Ibnul Qayim
Anggota Anggota
Prof.Dr.Ir. D. Djokosetiyanto,DEA
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB
Biologi Tumbuhan
Dr.Ir. Miftahudin, M.Si Dr. Ir. Dahrul Syah, M.Sc.Agr
1.
PENDAHULUAN
Latar Belakang
Sebagai negara kepulauan, selain memiliki wilayah laut yang luas, Indonesia juga memiliki garis pantai sepanjang 81.000 km. Wilayah perairan laut yang sangat luas ini memiliki banyak kekayaan alam hayati berupa tumbuh-tumbuhan (flora) dan hewan (fauna) yang beraneka ragam bentuk dan jenisnya. Salah satu kekayaan flora laut yang banyak tersebar di perairan pantai Indonesia adalah lamun. Lamun kadang membentuk hamparan luas di pantai sehingga dikenal sebagai padang lamun (seagrass beds). Lamun menutupi paling tidak
30.000 km2 sepanjang perairan Kepulauan Indonesia dari Pulau We di Aceh hingga Merauke di Papua (Kuriandewa et al. 2003).
Lamun merupakan tumbuhan berbunga (angiospermae) yang telah beradaptasi untuk hidup dalam keadaan terbenam di lingkungan laut dan estuaria. Lamun terdiri atas sekelompok kecil tumbuhan yang berjumlah sekitar 60 spesies dan 12 genera (Edgar 1997; Hemminga & Duarte 2000; Huisman 2000; Edgar 2001; Waycott et al. 2004; Short et al. 2007). Di Indonesia sendiri selama ini
hanya terdapat 12 spesies dan 7 genera (Tomascik et al. 1997; Nontji 2007),
ditambah spesies baru yaitu Halophila sulawesii yang ditemukan di perairan
Kepulauan Spermonde (Kuo 2007). Meskipun jumlah jenisnya tidak banyak yaitu kurang dari 0.02 % dari semua flora angiospermae (Hemminga & Duarte 2000), namun peranan ekologis padang lamun sangat besar (Den Hartog 1977; Keough & Jenkins 2000; Hogarth 2007; Short et al. 2007) dan merupakan salah
satu ekosistem pantai yang produktif dan mendukung banyak organisme autotrof dan heterotrof (Duarte & Chiscano 1999) serta memiliki nilai konservasi yang tinggi (Edgar & Shaw 1995).
Lamun memiliki banyak fungsi yang dianggap penting bagi kestabilan perairan dangkal dan estuaria (Hillman et al. 1989; Edgar 2001; Hogarth 2007).
detritus), menstabilkan dasar-dasar lunak sehingga melindungi banyak organisme, tempat pembesaran bagi banyak spesies yang menghabiskan waktu dewasanya di lingkungan lain, sebagai perangkap sedimen, membentuk habitat yang berair tenang di bawahnya dan sebagai pelindung organisme dari pengaruh cahaya matahari yang kuat (Zieman 1986; Nybakken 1992). Lamun juga telah dimanfaatkan secara langsung. Penduduk di Kepulauan Seribu memanfaatkan biji Enhalus acoroides sebagai makanan (Nontji 2007), beberapa jenis lamun
digunakan sebagai makanan ternak, serta sebagai bahan baku pembuatan kertas dan karton (Hutomo & Azkab 1987). Secara global, nilai ekonomi yang dapat diperoleh dari padang lamun adalah sekitar US$ 3.8 trilliun per tahun dan ada kecenderungan semakin meningkat (Costanza et al. 1997).
Karena hidup pada perbatasan antara lingkungan daratan dan lautan, padang lamun merupakan salah satu ekosistem yang mudah mengalami kerusakan dan perubahan. Berkurangnya penutupan padang lamun dapat disebabkan oleh faktor alami maupun aktivitas antropogenik. Faktor alam seperti badai, perubahan iklim, banjir besar dan interaksi biologi spesifik (Hamdorf & Kirkman 1995; Preen et al. 1995; Kirkman 1997; Hemminga & Duarte 2000). Sedangkan
faktor antropogenik yang dapat merusak lamun antara lain adalah eutrofikasi, aktivitas pertambangan pantai, pengerukan, jangkar dan baling-baling kapal (Hamdorf & Kirkman 1995; Hastings et al. 1995; Kirkman 1997; Ralph et al.
2006).
Permasalahan
Kepulauan Spermonde terdiri atas lebih dari seratus pulau kecil yang tersebar di sebelah barat daratan utama Provinsi Sulawesi Selatan. Pulau-pulau tersebut ada yang berpenduduk ada juga beberapa pulau yang tidak berpenduduk. Ketersediaan air tawar merupakan salah satu faktor utama yang menyebabkan masyarakat pulau memilih untuk menetap di pulau tertentu.
Universitas Hasanuddin mengakibatkan pertambahan penduduk di pulau ini semakin pesat terutama dalam dua dasawarsa terakhir.
Dengan semakin bertambahnya penduduk, lahan yang tersedia makin terbatas sehingga banyak rumah yang dibangun menjorok ke pantai. Hal tersebut menyebabkan tekanan ke lingkungan laut makin besar. Penduduk pulau banyak yang membuang limbah rumah tangganya ke perairan sehingga potensial mempengaruhi ekosistem yang ada di sekitarnya. Begitupula dengan semakin banyaknya perahu yang digunakan oleh nelayan di pulau-pulau tersebut dapat menyebabkan kerusakan secara fisik terhadap ekosistem padang lamun yang dilalui oleh jalur perahu tersebut.
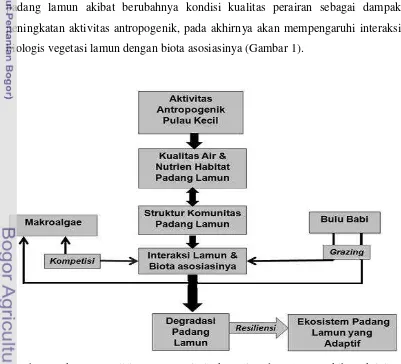
Aktivitas antropogenik pada pulau-pulau yang banyak penduduknya potensial untuk mencemari dan menurunkan kualitas perairan yang juga akan mempengaruhi ekosistem padang lamun. Perubahan yang terjadi pada komunitas padang lamun akibat berubahnya kondisi kualitas perairan sebagai dampak peningkatan aktivitas antropogenik, pada akhirnya akan mempengaruhi interaksi biologis vegetasi lamun dengan biota asosiasinya (Gambar 1).
Identifikasi dan pemahaman akan ketersediaan sumberdaya dan struktur komunitas yang diakibatkan oleh berbagai perturbasi antropogenik merupakan hal yang mendasar untuk upaya-upaya rehabilitasi dan pemulihan proses-proses ekosistem yang esensial (Tewfik et al. 2005). Oleh karena itu, untuk memahami
dampak dari aktivitas antropogenik terhadap sinekologi ekosistem padang lamun di Kepulauan Spermonde, diperlukan penelitian pada lokasi dengan tingkat tekanan antropogenik yang berbeda.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Menganalisis aktivitas-aktivitas antropogenik yang terjadi di lokasi penelitian yang potensial mempengaruhi ekosistem padang lamun.
2. Mempelajari dinamika nutrien pada jaringan lamun dan kolom air habitat padang lamun yang mendapatkan tekanan antropogenik berbeda.
3. Mengkaji dampak aktivitas antropogenik terhadap kualitas perairan di daerah padang lamun.
4. Mempelajari struktur komunitas lamun di Kepulauan Spermonde berdasarkan tekanan antropogenik.
5. Mengkaji interaksi dan asosiasi makrofita (lamun dan makroalgae) di Pulau Barranglompo dan Bonebatang.
6. Mengkaji potensi pemangsaan (grazing) bulu babi terhadap vegetasi
lamun dan makroalgae di Pulau Barranglompo dan Bonebatang.
Manfaat Penelitian
Penelitian ini diharapkan untuk :
1. Menyediakan data dasar (baseline) tentang kondisi padang lamun di Pulau Barranglompo dan Pulau Bonebatang yang ada di Kepulauan Spermonde. Data ini dapat digunakan untuk mengetahui perubahan yang terjadi secara temporal di kawasan tersebut.
3. Menjadi salah satu referensi atau acuan dalam pengelolaan ekosistem pantai.
Hipotesis
Penelitian ini disusun berdasarkan hipotesis bahwa terdapat pengaruh yang signifikan dari aktivitas antropogenik terhadap kondisi faktor kualitas air dan dinamika nutrien di daerah padang lamun. Selanjutnya faktor-faktor lingkungan ini juga mempengaruhi proses-proses dan interaksi antara padang lamun dengan biota yang berasosiasi dengannya.
Kebaruan (Novelty)
Hal-hal yang baru dari penelitian ini adalah :
1. Informasi mengenai interaksi biologis antara padang lamun dengan biota asosiasinya akibat tekanan antropogenik berbeda terutama untuk kawasan pulau-pulau kecil seperti Pulau Barranglompo dan Pulau Bonebatang belum tersedia. Penelitian ini akan menghasilkan informasi mengenai respon ekosistem padang lamun akibat aktivitas-aktivitas antropogenik masyarakat yang ada di pulau-pulau kecil.
2. Indeks Asosiasi Lamun dan Makroalgae juga belum tersedia hingga saat ini. Indeks ini penting untuk menggambarkan interaksi di antara kedua kelompok produsen primer di laut ini.
2. TINJAUAN PUSTAKA
Sinekologi
Sinekologi atau ekologi komunitas adalah cabang ekologi yang membahas pengkajian golongan atau kumpulan organisme yang berasosiasi bersama sebagai satu kesatuan (Odum 1996; Hanum 2009). Pendekatan sinekologi menggunakan komposit variabel biodiversitas yaitu variabel-variabel sinekologi seperti kekayaan jenis, kelangkaan, endemisme dan komposisi komunitas baik yang diamati maupun yang diestimasi untuk menggambarkan keseluruhan pola variasi biodiversitas (Hortal & Lobo 2006).
Sinekologi tidak melihat individu secara sendiri, melainkan dinamika tingkah laku spasial dan temporal populasi termasuk pertumbuhan dan homeostasis. Dengan demikian beberapa hal yang menjadi bahasan dalam sinekologi tumbuhan adalah interaksi antara vegetasi dengan lingkungannya, interaksi antara tumbuhan dengan hewan dan interaksi antar tumbuhan (Schulze 2005).
Deskripsi Lamun
Lamun (seagrass) adalah tumbuhan berbunga (angiospermae) yang sudah
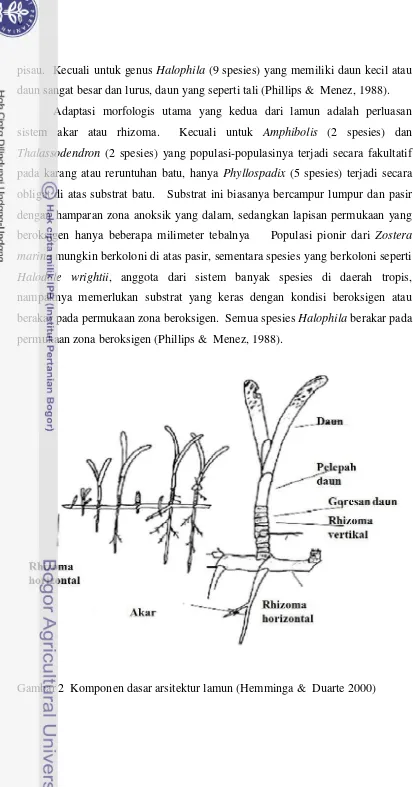
sepenuhnya menyesuaikan diri untuk hidup terbenam pada lingkungan laut dan estuaria (Price 1990; Keough & Jenkins 2000; Den Hartog & Kuo 2006; Castro & Huber 2007). Tumbuhan ini terdiri dari rhizoma, daun dan akar (Gambar 2). Kebanyakan rhizoma lamun tersusun atas internode, yaitu fragmen rhizoma antar node yang merupakan titik munculnya daun (Hemminga & Duarte 2000).
Banyak spesies lamun yang mempunyai rhizoma dimorfik terdiri atas dua jenis yang berbeda; rhizoma horizontal (plagiotropik) yang secara relatif memiliki internode yang panjang, dan rhizoma vertikal (orthotropik) yang memiliki internode yang lebih pendek (Hemminga & Duarte 2000). Ciri-ciri struktural/morfologis lamun yang pertama adalah semua lamun memiliki penampakan vegetatif yang mirip dalam hal pertumbuhan dan morfologinya, kecuali untuk Syringodium (2 spesies) yang memiliki daun-daun terete, semua
pisau. Kecuali untuk genus Halophila (9 spesies) yang memiliki daun kecil atau
daun sangat besar dan lurus, daun yang seperti tali (Phillips & Menez, 1988). Adaptasi morfologis utama yang kedua dari lamun adalah perluasan sistem akar atau rhizoma. Kecuali untuk Amphibolis (2 spesies) dan
Thalassodendron (2 spesies) yang populasi-populasinya terjadi secara fakultatif
pada karang atau reruntuhan batu, hanya Phyllospadix (5 spesies) terjadi secara
obligat di atas substrat batu. Substrat ini biasanya bercampur lumpur dan pasir
dengan hamparan zona anoksik yang dalam, sedangkan lapisan permukaan yang beroksigen hanya beberapa milimeter tebalnya Populasi pionir dari Zostera
marina mungkin berkoloni di atas pasir, sementara spesies yang berkoloni seperti
Halodule wrightii, anggota dari sistem banyak spesies di daerah tropis,
nampaknya memerlukan substrat yang keras dengan kondisi beroksigen atau berakar pada permukaan zona beroksigen. Semua spesies Halophila berakar pada
permukaan zona beroksigen (Phillips & Menez, 1988).
Daun lamun merupakan tempat fotosintesis dan dapat menyerap nutrien, gas dan air dari kolom air (Warry & Hindell 2009). Anatomi yang unik dari jaringan daun lamun memungkinkan ekspor yang cepat oksigen hasil fotosintesis ke dalam air laut. Hal ini dapat dilihat di lapangan, dengan munculnya sejumlah gelembung gas yang seringkali melekat pada permukaan helaian daun. Pada padang lamun yang luas gelembung gas seringkali muncul melalui kolom air hingga permukaan (Phillips & Menez, 1988).
Jenis–Jenis Lamun
Lamun terdiri dari 12 genera yang berasal dari 2 famili, yaitu famili Hydrocharitacea terdiri atas 3 genera, dan famili Potamogetonacea, terdiri atas 9 genera. Dari kedua belas genera tersebut, 7 genera menghuni perairan tropis, yaitu: Enhalus, Halophila dan Thalassia dari famili Hydrocharitaceae serta
Cymodocea, Halodule, Syringodium, dan Thalassodendron dari famili
Potamogetonaceae (Den Hartog 1977; Hemminga & Duarte 2000; Den Hartog & Kuo 2006).
Padang lamun di dunia ada lebih dari 50 jenis, sedangkan di Indonesia terdapat 12 jenis, tergolong dalam 7 genera. Ketujuh genera lamun di Indonesia terdiri dari tiga genera dari suku Hydrocharitaceae yaitu Enhalus, Thalassia, dan
Halophila, dan empat genera dari suku Potamogetonaceae yaitu Halodule,
Cymodocea, Syringodium dan Thalassodendron (Nontji 2007). Baru-baru ini,
satu lagi spesies lamun yang diberi nama Halophila sulawesii ditemukan pada
perairan Spermonde Sulawesi Selatan (Kuo 2007).
Habitat dan Distribusi Lamun
Semua lamun merupakan tumbuhan air, mereka melakukan pertumbuhan dan melengkapi siklus reproduksi dan pertumbuhan vegetatif meskipun terendam sempurna dan benar-benar terkait pada substrat (Phillips & McRoy 1990; Walker
et al. 2001; Green & Short 2003). Hanya sedikit spesies yang mampu bertahan
Padang lamun merupakan salah satu ekosistem pantai yang paling produktif dan paling tersebar luas pada semua daerah pantai di dunia, kecuali sepanjang pantai Antartika (Hemminga & Duarte 2000; Green & Short 2003; Duffy 2006). Menurut Waycott et al. (2004), keanekaragaman lamun tertinggi di
dunia dijumpai di perairan tropis mulai dari utara Australia sampai ke Filipina. Kawasan yang dikenal sebagai Indo Pasifik Barat ini memiliki banyak spesies lamun yang hidup bersama-sama (Castro & Huber 2007).
Lamun ditemukan hidup pada perairan dangkal yang agak berpasir, perairan pantai bersubstrat lunak dan terlindung pada daerah estuaria, sering pula dijumpai di terumbu karang. Kadang–kadang ia membentuk komunitas yang lebat hingga merupakan padang lamun (seagrass bed) yang cukup luas (Nontji
2007).
Peranan dan Fungsi Padang Lamun
Di daerah tropis, lamun bersama mangrove merupakan vegetasi dominan di tepi pantai dan bertindak sebagai barrier antara aktifitas di darat dan di laut (Waycott et al. 2004). Padang lamun memiliki peranan penting dalam ekosistem
pantai. Tegakan lamun berfungsi untuk menjebak sedimen (De Boer 2007). Selain itu, padang lamun juga berperan dalam melindungi pantai dari abrasi, karena daun dan batang tumbuhan ini dapat meredam ombak (Fonseca et al.
1982; Nybakken & Bertness 2005; Castro & Huber 2007).
Akar dan daun lamun menyediakan kompleksitas horizontal dan vertikal (Nybakken & Bertness 2005). Oleh karena itu secara ekologis padang lamun dapat menjadi daerah asuhan, daerah pemijahan, daerah mencari makan, dan daerah untuk mencari perlindungan bagi berbagai jenis biota laut seperti ikan (Gambar 3), crustasea, moluska, echinodermata, dan sebagainya (Phillips & Menez 1988; Tomascik et al. 1997; Green & Short 2003).
Tumbuhan lamun itu sendiri merupakan makanan penting bagi dugong (Dugong dugon), penyu hijau (Chelonia mydas) (Lee Long et al. 1993; Kirkman
1997) dan bulu babi (Jernakoff et al. 1996). Di laut tropis yang hangat dijumpai
Banyak di antara hewan laut yang memiliki nilai penting secara komersil dan rekreasi, pada stadia tertentu dalam siklus hidupnya sangat bergantung pada keberadaan ekosistem padang lamun. Banyak orang yang tinggal di daerah pantai menggunakan lamun sebagai tempat untuk mengumpulkan cacing dan kerang sebagai bahan makanan atau umpan bahkan ada juga yang memanfaatkan padang lamun sebagai tempat menggembalakan ternaknya saat surut (Waycott et al.
2004).
Gambar 3 Sekawanan ikan kecil yang berlindung di celah-celah daun lamun E. acoroides di Pulau Barranglompo. Foto diambil selama penelitian
Meskipun padang lamun merupakan ekosistem yang penting, namun pemanfaatan langsung tumbuhan lamun untuk kebutuhan manusia belum banyak dilakukan. Di Asia Tenggara, biji Enhalus acoroides dan rhizoma Cymodocea
digunakan sebagai makanan bagi masyarakat pantai (Hemminga & Duarte 2000; Hutomo & Moosa 2005; Bjork et al. 2008). Di Indonesia sendiri, pemanfaatan
lamun sebagai bahan makanan telah dilakukan masyarakat di Kepulauan Seribu yang telah memanfaatkan biji E. acoroides yang secara lokal diberi nama samo–
samo (Nontji 2007). Nilai gizi tepung yang terbuat dari biji Enhalus sebanding
Kerusakan Ekosistem Padang Lamun
Padang lamun berada pada garis terdepan yang menerima dampak dari perubahan pemanfaatan lahan oleh manusia karena kebanyakan pusat pemukiman dibangun di sekitar daerah pantai (Waycott et al. 2004). Hal ini mengakibatkan
padang lamun mudah mengalami kerusakan (Green & Short 2003; Warry & Hindell 2009). Dalam dua dekade terakhir, daerah padang lamun telah berkurang sekitar 18% dari luasan lamun yang tercatat di seluruh dunia (Walker et al. 2006).
Kerusakan dan kehilangan yang luas padang lamun telah didokumentasikan dengan baik dan penyebabnya dapat karena bencana alam seperti badai, dan karena aktivitas manusia (Poiner et al. 1989; Keough & Jenkins
2000; Orth et al. 2006). Aktivitas manusia yang dapat merusak ekosistem padang
lamun diantaranya adalah pengerukan dan penimbunan/reklamasi di wilayah pesisir sehingga menenggelamkan ekosistem tersebut. Adanya dermaga dan tempat pendaratan kapal/perahu, penggunaan jaring pantai (beach seine) yang
ditarik melalui ekosistem padang lamun, perburuan ikan duyung (dugong),
adanya limbah pertanian dan pertambakan juga ikut berperan dalam merusak ekosistem padang lamun di Asia Tenggara (Fortes 1990; Duarte 2002). Pembangunan yang gencar dilaksanakan dapat merubah ekologi pantai dan menyebabkan hilangnya habitat-habitat padang lamun (Björk et al. 2008).
Berkurangnya areal padang lamun akibat ledakan populasi bulu babi pada padang
Posidonia australis di Botany Bay, Australia dilaporkan oleh Larkum & West
(1990). Peristiwa ini mengakibatkan hilangnya seluruh kanopi lamun pada areal seluas puluhan hektar.
Penurunan tutupan padang lamun biasanya disertai dengan fragmentasi padang yang lebih luas menjadi bagian-bagian yang lebih kecil. Akibatnya akan muncul mozaik-mozaik daerah (patches) tak bervegetasi yang bervariasi ukuran,
bentuk dan orientasinya (Brooks & Bell 2001). Sebagai contoh, Australia yang memiliki spesies lamun terbesar dan padang lamun yang luas telah mengalami penurunan dalam 40 – 50 tahun terakhir (Butler & Jernakoff 1999). Sekitar 1300 ha lamun yang terdiri atas Zostera capricorni Aschers, Halophila ovalis (R.Br)
Hooker dan Ruppia megacarpa Mason di Tuggerah Lakes telah hilang (Shepherd
Ekosistem padang lamun di perairan pesisir Indonesia sendiri telah mengalami kerusakan sekitar 30% - 40%. Di pesisir Pulau Jawa kondisi ekosistem padang lamun telah mengalami gangguan yang cukup serius akibat pembuangan limbah dan pertumbuhan penduduk dan diperkirakan sekitar 60% padang lamun telah mengalami kerusakan. Di pesisir Pulau Bali dan Pulau Lombok gangguan bersumber dari penggunaan potasium sianida dan telah berdampak pada penurunan nilai penutupan dan kerapatan spesies lamun (Fortes 1994).
Sebagaimana terjadi pada kebanyakan ekosistem laut dangkal lainnya, ancaman besar yang terjadi pada ekosistem padang lamun, adalah eutrofikasi, overfishing, kerusakan fisik serta biogenik habitat, introduksi spesies invasif serta perubahan iklim global (Duarte et al. 2004; Waycott et al. 2009).
Eutrofikasi adalah faktor antropogenik yang paling banyak dilaporkan berpotensi mengakibatkan penurunan populasi lamun (Short & Wyllie-Echeverria 1996; Ralph et al. 2006). Ancaman-ancaman tersebut menyebabkan terjadinya
perubahan-perubahan utama dalam hal kelimpahan spesies, komposisi spesies (keanekaragaman hayati), struktur komunitas bahkan mengancam kepunahan spesies. Hal tersebut selanjutnya berdampak terhadap proses ekosistem dan fungsi dari suatu ekosistem (Carlton et al. 1999; Jackson et al. 2001; Smith &
Smith 2003). Oleh karena itu, meningkatnya kehilangan dan fragmentasi habitat-habitat lamun menjadi keprihatinan utama karena pentingnya ekosistem ini terhadap ekologi dan produktivitas perairan pantai (Boström & Bonsdorff 2000;
Cummins et al. 2004).
Interaksi Lamun dan Makroalgae
Interaksi merupakan hal penting dalam ekologi spesies. Pada komunitas, terdapat sejumlah faktor biotik dan abiotik yang mempengaruhi penyebaran, kelimpahan dan interaksi spesies (Ludwig & Reynolds 1988).
epifit dapat juga memberikan efek merugikan terhadap fungsi ekologis ekosistem lamun (Jernakoff et al. 1996; Vanderklift & Lavery 2000).
Eksperimen oleh Irlandi et al. (2004) menggunakan tutupan alga terapung
(drift algae) yang tinggi selama 2-3 bulan menghasilkan pengurangan sekitar 25
% biomassa di atas permukaan substrat (aboveground biomass) dibanding
plot-plot yang bebas algae. Biomassa di bawah substrat (belowground biomass) dan
kerapatan tegakan tidak dipengaruhi oleh keberadaan drift algae ini.
Grazing Lamun oleh Bulu Babi
Di antara semua fauna invertebrata, bulu babi (Echinoidea) merupakan pemangsa (grazer) lamun yang paling menonjol. Kadang-kadang populasinya
cukup besar untuk mengkonsumsi proporsi lamun yang besar (Klumpp et al.
1989).
Bulu babi dapat dijumpai sangat melimpah pada padang lamun, dimana mereka memakan daun-daun efifit segar, detritus atau kombinasi dari keduanya. Bulu babi ungu Lythecinus variegatus di Teluk Mexico memotong-motong daun
lamun sehingga meninggalkan banyak daerah-daerah gundul (Hogarth 2007). Dampak grazing bulu babi terhadap pertumbuhan dan kelimpahan lamun
Thalassia testudinum di Florida Keys, Amerika Serikat sangat bervariasi
tergantung musim dan kondisi faktor lingkungan (Valentine et al. 2000).
Grazing oleh bulu babi Tripneustes gratilla terhadap lamun
Thalassodendron ciliatum telah diteliti oleh Alcoverro & Mariani (2002) di
Kenya. Mereka menggunakan penelitian eksperimental dan penelitian lapangan deskriptif untuk menguji pengaruh aggregasi bulu babi yang padat terhadap padang lamun di Lagoon Mombasa. Mereka menemukan bahwa 39% lamun
Thalassodendron ciliatum mengalami grazing berat (> 75% tegakan mati), 23.4%
mengalami grazing sedang (> 50% tegakan mati), dan 38.5% mengalami grazing ringan (19.8% tegakan yang mati). Dari model sederhana yang dibuatnya, mereka mendapatkan waktu pulih lamun ini adalah 44 bulan.
Penelitian mengenai grazing bulu babi Tripneustes gratilla pada tiga jenis
lamun yaitu Thalassia hemprichii, Halodule uninervis dan Cymodocea rotundata
(2008). Mereka menemukan bahwa total konsumsi Tripneustes gratilla pada
kepadatan 1.55 ± 0.07 bulu babi/m2 sekitar 1.28 berat kering/m2/hari setara dengan 26% produksi bersih lamun di atas permukaan substrat. Mereka menyimpulkan bahwa peningkatan grazing Tripneustes gratilla hanya
mempengaruhi kerapatan tegakan di atas permukaan substrat untuk Halodule
uninervis dan Cymodocea rotundata saja dan tidak mempengaruhi Thalassia
hemprichii.
Grazing oleh bulu babi juga memiliki peran ekologis dalam mengontrol ketebalan algae. Hal ini terbukti setelah terjadinya penurunan populasi bulu babi
Diadema antillarum di Karibia akibat kematian massal tahun 1983. Pada
daerah-daerah yang telah habis bulu babinya, ketebalan pada algae meningkat dari 1-2 mm ke 20-30 mm (Karleskint et al. 2010).
Respon Lamun terhadap Stres
Stres atau cekaman adalah penyimpangan signifikan dari kondisi kehidupan yang optimal dan mengakibatkan perubahan dan respon pada semua tingkatan fungsional organisme (Larcher 1995). Stres terjadi akibat perubahan proses-proses fisiologis yang diakibatkan oleh satu atau kombinasi faktor lingkungan dan faktor biologis (Hale & Orcutt 1987). Tumbuhan yang terpapar terhadap stres lingkungan sering memperlihatkan berbagai gejala atau indikator. Indikator stres adalah tanda-tanda disturbansi, baik yang terlihat seperti pertumbuhan dan modifikasi morfologi, ataupun yang tak terlihat seperti perubahan fisiologis dan biokimia yang terkait dengan upaya perbaikan dan mekanisme resistensi (Rachmilevitch et al. 2000). Resistensi atau toleransi terhadap stres adalah
kapasitas suatu tumbuhan untuk bertahan dan tumbuh meskipun dihadapkan pada suatu lingkungan yang tidak mendukung, dimana tumbuhan tersebut dapat menahan pengaruh stres tanpa mati atau terserang kerusakan yang tidak dapat dipulihkan (Hale & Orcutt 1987).
1997). Larkum & Den Hartog 1989 mengidentifikasi berbagai pemicu stres pada ekosistem padang lamun (Tabel 1).
Tabel 1 Pemicu stres penting yang membatasi distribusi dan kelimpahan lamun (Larkum & Den Hartog 1989)
Stres Adaptasi Kerentanan
Salinitas tinggi Pelepah (Sheaths)
Pompa ion (ion pump)
Perubahan suhu Races Perubahan suhu mendadak
Aksi gelombang Daun yang kuat
Rhizoma di bawah substrat
Blow-outs
Perpindahan Sedimen Tekanan N/A? Gangguan fotosintesis Anaerobiosis Aerenchyma
Metabolisme Fermentatif
Efifit Air anoksik
Keterbatasan Nutrien Absorpsi akar dan daun kurangnya trace elements kekurangan N dan/atau P Efifit Daun secara kontinu
tumbuh dari basal
Smothering, shading, anoxia Produktifitas menurun Cahaya/naungan Toleransi naungan Produktifitas yang rendah
Naungan oleh efifit
herbivora Fenolik Pemindahan bagian-bagian kritis seperti daun dan meristem
Monitoring karakteristik fisiologis lamun mempunyai potensi untuk mendeteksi stres pada lamun sebelum penurunan populasi terjadi. Mobilisasi karbon tersimpan (starch) telah digunakan untuk mengukur stres lamun sebagai
akibat ketersediaan cahaya yang kurang (Warry & Hindell 2009). Metrik fisiologis lamun yang lain yang potensial menggambarkan kesehatan lamun yang dapat digunakan untuk mendeteksi respon terhadap stres akibat sedimentasi dan pengayaan nutrien adalah kadar nitrogen, fosfor serta kandungan klorofil (Leoni
et al. 2008; Warry & Hindell 2009).
Resiliensi Ekosistem terhadap Disturbansi
kemampuan sistem ini untuk menyerap perubahan. Defenisi resiliensi yang lebih baru dikemukakan oleh Walker et al. (2004) yang mendefinisikan resiliensi
sebagai kemampuan dari suatu sistem untuk menyerap disturbansi dan mereorganisasi diri saat mengalami perubahan sehingga tetap mempertahankan fungsi, struktur, identitas dan feedback yang sama. Sedangkan disturbansi adalah
segala mekanisme atau proses yang mempengaruhi struktur dan fungsi komunitas (Smith & Smith 2003; Molles 2008). Pengaruh disturbansi bersifat kompleks dan sulit untuk diukur karena banyak spesies yang mampu untuk membiasakan diri terhadap disturbansi dan memperlihatkan respon yang bervariasi (Treweek, 1999).
Berdasarkan definisi awal resiliensi dari Holling (1973), Folke et al.
(2004) mendefinisikan resiliensi ekosistem sebagai besarnya gangguan atau disturbansi yang dapat diterima oleh suatu sistem sebelum terjadi perubahan menjadi suatu kondisi stabilitas baru yang berbeda struktur dan fungsinya.
3. GAMBARAN UMUM LOKASI PENELITIAN
Penelitian ini dilaksanakan pada dua pulau yaitu Pulau Barranglompo dan Pulau Bonebatang yang masuk dalam gugusan Kepulauan Spermonde Provinsi Sulawesi Selatan. Secara administratif kedua pulau ini masuk dalam wilayah pemerintahan Kecamatan Ujung Tanah, Kota Makassar, Provinsi Sulawesi Selatan.
Kepulauan Spermonde
Kepulauan Spermonde terbentuk dan muncul di atas dangkalan Spermonde (Spermonde Shelf) yang terletak di pesisir barat Provinsi Sulawesi
Selatan atau sebelah tenggara Selat Makassar (Erftemeijer & Middelburg 1993; Tomascik et al. 1997). Kepulauan ini membentang dari utara ke selatan sepanjang
kurang lebih 300 km dengan luas 16 000 km2. Di kawasan ini bertebaran 120 pulau dengan kisaran luas antara 2 ha (Pulau Bone Batang) sampai 3328.2 ha (Pulau Tanakeke). Secara administratif, kepulauan ini termasuk ke dalam wilayah Kabupaten Barru, Kabupaten Pangkajene Kepulauan (Pangkep), Kabupaten Maros, Kota Makassar dan Kabupaten Takalar (McCarthy 2007).
Spermonde merupakan gugus kepulauan yang telah dikenal sejak lama. Para penjelajah Portugis telah mendatangi daerah ini sekitar abad ke-16 dalam upaya mencari sumber rempah-rempah yang perdagannya berpusat di Bandar Pelabuhan Makassar. Bangsa Portugislah yang pertama kali memberi nama kepulauan di pesisir barat Makassar ini dengan nama Kepulauan Spermon. Selanjutnya bangsa Belanda mencapai daerah ini pada abad ke-17 dan menggunakan nama Kepulauan Spermonde dalam peta-peta mereka. Namun, jauh sebelum kedatangan Bangsa Portugis dan Belanda, masyarakat setempat telah memberi nama gugusan pulau ini dengan nama Sangkarang (FIKP Unhas & Bakosurtanal 2007).
rata-rata 10 m dan substrat dasar yang didominasi oleh pasir berlumpur. Zona kedua berjarak kurang lebih 5 km dari daratan Pulau Sulawesi dan mempunyai kedalaman laut rata-rata 30 m dan banyak dijumpai pulau karang. Zona ketiga dimulai pada jarak 12.5 km dari Pantai Sulawesi dengan kedalaman laut antara 20-50 m. Pada zona ini banyak dijumpai wilayah terumbu karang yang masih tenggelam (patch reef). Zona keempat atau zona terluar merupakan terumbu
penghalang (barrier reef) dan berjarak 30 km dari daratan utama Pulau Sulawesi
(Moll 1983; Hoeksema 1990).