PENAPISAN BAKTERI RHIZOSFER PADI PENGHASIL
NITROGENASE YANG TAHAN KONDISI SALIN DAN
IDENTIFIKASI GEN
nif
H
SAFIRAH TASA NERVES RATU
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Penapisan Bakteri Rhizosfer Padi Penghasil Nitrogenase yang Tahan Kondisi Salin dan Identifikasi Gen nifH adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SAFIRAH TASA NERVES RATU. Penapisan Bakteri Rhizosfer Padi Penghasil Nitrogenase yang Tahan Kondisi Salin dan Identifikasi Gen nifH. Dibimbing oleh POPI ASRI KURNIATIN dan DWI NINGSIH SUSILOWATI.
Penambatan nitrogen oleh bakteri rhizosfer dapat dimanfaatkan untuk menyiasati dampak salinitas pada tanah sawah pesisir. Kemampuan tersebut disebabkan oleh adanya aktivitas nitrogenase yang disandikan gen nifH pada komponen II. Penelitian ini bertujuan menyeleksi sejumlah bakteri rhizosfer yang dapat menunjukkan aktivitas nitrogenase pada kondisi salin serta mengidentifikasi gen nifH. Sebanyak 50 isolat bakteri rhizosfer asal tanah sawah pesisir Daerah Eretan dan Patimban, Jawa Barat telah dianalisis. Lima isolat menunjukkan aktivitas nitrogenase pada kondisi salin, yaitu Er B1 3, Er B1 4, Er B1 9, Er B2 10 dan Ptb B1 4. Gen nifH kelima isolat diidentifikasi menggunakan polymerase chain reaction (PCR) menghasilkan amplikon berukuran ~360 bp. Aktivitas nitrogenase tertinggi berdasarkan analisis reduksi asetilen (ARA) terdapat pada isolat Er B2 10 sebesar 4,4081 µmol.mL-1jam-1.
Kata kunci: aktivitas nitrogenase, ARA, bakteri rhizosfer, gen nifH, lahan pesisir
ABSTRACT
SAFIRAH TASA NERVES RATU. Screening of Nitrogenase Producing and Saline Resistant Rhizosfer Paddy Bacteria and Identification of nifH Gene. Supervised by POPI ASRI KURNIATIN dan DWI NINGSIH SUSILOWATI.
The ability of nitrogen fixing by rhizosfer bacteria could be used to decrease salinity impact in coastal rice field. It was caused by nitrogenase, encoded by nifH gene in component II. The objectives of this research were to screen of rhizosfer bacterias that have the nitrogenase activity in saline condition and identify the presence of nifH gene. The fifty isolates of rhizosfer bacteri isolated from coastal rice field Eretan and Patimban region, West Java was analyzed. Five isolates showed the nitrogenase activity under saline condition, are Er B1 3, Er B1 4, Er B1 9, Er B2 10 dan Ptb B1 4. The identification of nifH gene from these 5 samples using polymerase chain reaction (PCR) showed that the size is ~360 bp. The highest activity of nitrogenase used acetylene reduction assay (ARA) was showed by Er B2 10 is 4,4081 µmol.mL-1hour-1.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PENAPISAN BAKTERI RHIZOSFER PADI PENGHASIL
NITROGENASE YANG TAHAN KONDISI SALIN DAN
IDENTIFIKASI GEN
nif
H
SAFIRAH TASA NERVES RATU
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Penapisan Bakteri Rhizosfer Padi Penghasil Nitrogenase yang Tahan Kondisi Salin dan Identifikasi Gen nifH
Nama : Safirah Tasa Nerves Ratu NIM : G84100057
Disetujui oleh
Popi Asri Kurniatin, SSiApt MSi Pembimbing I
Dwi Ningsih Susilowati, STP MSi Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Bismillahirrahmanirrahim
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul penelitian yang dilaksanakan sejak bulan November 2013 ini adalah Penapisan Bakteri Rhizosfer Padi Penghasil Nitrogenase yang Tahan Kondisi Salin dan Identifikasi Gen nifH.
Terima kasih penulis ucapkan kepada Ibu Popi Asri Kurniatin, SSiApt MSi dan Ibu Dwi Ningsih Susilowati, STP MSi selaku pembimbing yang telah banyak memberikan pengarahan dan saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Jajang, Ibu Aminah beserta seluruh staf Konservasi Mikrobiologi BB-Biogen yang telah membantu selama pengumpulan data penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga dan teman-teman Biokimia 47 untuk segala doa, kasih sayang dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR TABEL iv
DAFTAR LAMPIRAN iv
PENDAHULUAN 1
METODE 2
Bahan dan alat 2
Metode Penelitian 3
Analisis Kualitatif Aktivitas Nitrogenase 3
Uji Salinitas Nitrogenase 3
Identifikasi Gen nifH dengan Metode PCR 4
Analisis Kuantitatif Aktivitas Nitrogenase dengan Metode ARA 5
HASIL 5
Hasil Analisis Kualitatif Aktivitas Nitrogenase 5
Hasil Uji Salinitas Nitrogenase 6
Amplikon Gen nifH 6
Hasil Analisis Kuantitatif Aktivitas Nitrogenase dengan Metode ARA 7
PEMBAHASAN 8
Hasil Analisis Kualitatif Aktivitas Nitrogenase 8
Hasil Uji Salinitas Nitrogenase 9
Amplikon Gen nifH 11
Hasil Analisis Kuantitatif Aktivitas Nitrogenase dengan Metode ARA 12
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 14
DAFTAR PUSTAKA 14
DAFTAR GAMBAR
1 Amplikon gen nifH berukuran ~360 bp 7
2 Proses pengubahan N2 menjadi NH3 yang dikatalisis nitrogenase 9
3 Kompleks nitrogenase 11
DAFTAR TABEL
1 Hasil analisis kualitatif aktivitas nitrogenase pada media NFB semi
padat 6
2 Hasil uji salinitas terhadap aktivitas nitrogenase pada media salinitas
10% dan 20% 6
3 Hasil analisis kuantitatif aktivitas nitrogenase dengan metode ARA 7
DAFTAR LAMPIRAN
1 Isolat-isolat bakteri rhizosfer yang digunakan dalam penelitian 19
2 Diagram alir penelitian 20
3 Hasil analisis kualitatif aktivitas nitrogenase isolat pada media NFB
semi padat 21
4 Hasil analisis kualitatif aktivitas nitrogenase isolat pada media
salinitas 10% dan 20% 21
5 Konsentrasi dan kemurnian DNA isolat 21
6 Isolat yang dilakukan uji ARA dengan kromatografi gas 22 7 Contoh kromatogram, hasil pengukuran standar etilen yang digunakan
PENDAHULUAN
Peningkatan permukaan air laut sebagai efek dari pemanasan global merupakan masalah serius yang harus dihadapi sektor pertanian daerah pesisir Indonesia. Berdasarkan hasil kajian the Intergovernmental Panel on Climate Change (IPCC 2007) menunjukkan bahwa sejak tahun 1850, tercatat terdapat 12 tahun terpanas berdasarkan data suhu permukaan global. Sebelas dari 12 tahun terpanas tersebut terjadi dalam waktu 12 tahun terakhir. Kenaikan suhu total dari tahun 1850−1899 sampai dengan 2001−2005 tercatat mencapai 0,76°C. Permukaan air laut global juga meningkat dengan laju rata-rata 1,80 mm/tahun dalam kurun waktu tahun 1961−2003. Kenaikan total permukaan air laut yang berhasil dicatat pada abad ke-20 diperkirakan mencapai 0,17 m. Dampak paling nyata dari peningkatan permukaan air laut adalah penciutan lahan pertanian di pesisir pantai (Jawa, Bali, Sumatera Utara, Lampung, Nusa Tenggara Barat, dan Kalimantan), kerusakan infrastruktur pertanian, dan peningkatan salinitas yang merusak tanaman (Las 2007). Hal ini dapat terjadi karena adanya akumulasi garam-garam berupa NaCl yang dapat menurunkan produktivitas pertanian di daerah pesisir pantai. Dampak peningkatan permukaan air laut yang demikian besar terhadap sektor pertanian di daerah pesisir memerlukan upaya aktif untuk mengantisipasinya melalui strategi mitigasi dan adaptasi lahan salin tersebut (Elza et al. 2010).
Beberapa penelitian telah dilakukan untuk mengatasi permasalahan tersebut, di antaranya penelitian mengenai teknologi identifikasi dan rehabilitasi tanah salin, pengembangan varietas tanaman tahan kondisi salin serta telah dilakukan pemetaan salinitas tanah daerah pesisir. Namun demikian, upaya untuk menyiasati adanya dampak salinitas pada lahan sawah daerah pesisir dari aspek mikrobiologis belum banyak dilakukan. Salah satu peran mikrobiologis yang dapat dimanfaatkan untuk menyiasati permasalahan tanah salin daerah pesisir adalah dengan memanfaatkan keberadaan bakteri yang mampu menyediakan unsur hara utama yang dibutuhkan oleh tanaman, seperti unsur nitrogen (N) (Elza et al. 2010).
Nitrogen menyusun sekitar 78% dari keseluruhan gas yang ada di atmosfir. Meskipun keberadaannya sangat melimpah di atmosfir, nitrogen tidak dapat digunakan langsung oleh tanaman. Pengolahan kimia atau fiksasi alami nitrogen diperlukan untuk mengkonversi gas nitrogen menjadi bentuk yang dapat digunakan oleh tanaman. Fiksasi alami nitrogen dari atmosfir dapat dilakukan oleh bakteri tanah agar ketersediaan unsur nitrogen bagi tanaman tetap tercukupi meskipun tumbuh di wilayah marjinal dengan kandungan unsur hara yang sangat rendah, seperti pesisir pantai. Salah satu bakteri yang dapat melakukan penambatan nitrogen dari atmosfir adalah bakteri rhizosfer (Handayanto dan Hairiah 2007). Bakteri rhizosfer merupakan bakteri yang hidup di daerah perakaran (rhizosfer) tanaman yang memiliki kemampuan mengikat N2 bebas di udara dan mereduksinya
menjadi senyawa ammonia. Kemampuan bakteri tersebut untuk melakukan penambatan nitrogen disebabkan oleh aktivitas nitrogenase (Buchanan et al. 2000).
Nitrogenase merupakan enzim kompleks yang terlibat dalam proses fiksasi nitrogen. Nitrogenase berperan dalam pengubahan bentuk nitrogen bebas (N2) di
udara menjadi bentuk terikat, amonia (NH3). Nitrogenase terdiri atas dua
nif, yaitu: nifA, nifB, nifZ, nifH, nifD, nifK, nifE, nifN, nifX, nifO, nifU, nifS, nifV, nifW, nifT, nifY, nifE, nifM, nifF, nifL (Lee et al. 2000) dan di antara 20 gen nif tersebut, gen nifH merupakan gen terpenting yang dapat digunakan untuk mendeteksi keberadaan nitrogenase karena mengkodekan sub unit pembentuk kompleks nitrogenase (Choo et al. 2003). Gen nifH mengkode komponen II pada nitrogenase yang merupakan homodimer dengan berat molekul 60-70 kilodalton (kDa) (Chai 2007).
Sebanyak 50 isolat bakteri rhizosfer telah berhasil diisolasi dari tanah sawah pesisir Daerah Eretan dan Patimban, Jawa Barat. Isolat-isolat bakteri tersebut belum dilakukan analisis aktivitas nitrogenase dan diidentifikasi keberadaan gen nifH sehingga penelitian tersebut perlu dilakukan. Tujuan penelitian ini adalah untuk menyeleksi sejumlah bakteri rhizosfer yang menunjukkan aktivitas nitrogenase pada kondisi salin dan mengidentifikasi subunit pembentuk kompleks nitrogenase, yaitu gen nifH. Informasi yang akan diperoleh nantinya diharapkan dapat membantu pemanfaatan bakteri rhizosfer sebagai agen biofertilizer untuk lahan salin.
Penelitian ini dilaksanakan mulai bulan November 2013 hingga bulan Februari 2014 di Laboratorium Konservasi Mikroorganisme, Balai Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Bogor.
METODE
Bahan dan alat
Bahan-bahan yang digunakan dalam penelitian ini adalah 50 isolat bakteri rhizosfer asal tanah sawah pesisir Daerah Eretan dan Patimban, Jawa Barat (Lampiran 8), DL-malic acid, KOH, K2HPO4, MgSO4.7H2O, MnSO4.H2O, NaCl,
CaCl2, Na2MoO4.2H2O, bacto agar, FeSO4.7H2O, Wizard Genomic DNA
Purification KIT Promega, Wizard SV Gel dan PCR Clean-Up System Promega, bromtimol blue (BTB) 0.5%, agarosa, media lactose broth (LB), etilen diamin tetra asam asetat (EDTA) 50 mM, bufer tris-EDTA (TE) 0.1x, bufer tris-asetat EDTA (TAE) 0.5x, ethidium bromida (EtBr), primer universal untuk identifikasi gen nifH: primer nifHf (5’GGCAAGGGCGGTATCGGCAAGTC’3) dan primer nifHr (5’CCATCGTGATCGGGTCGGGATG’3), komponen PCR, yaitu: Gotaq DNA polimerase 2x, loading dyne 6x, nuclease free water, akuades, pendana ukuran 1kb, dan gas C2H2.
3
Swift Maxi Termal Cycler Block model MX-BLC-7, stiring Barnstead International model SP131014, waterbath Memmert model WNB 7-45, dan kromotografi gas Hitachi model 263-50 dengan detektor flame ionization detector (FID).
Metode Penelitian
Penapisan Bakteri Rhizosfer Padi Penghasil Nitrogenase yang Tahan Kondisi Salin dan Identifikasi Gen nifH pada penelitian ini terbagi menjadi 4 tahapan penting, yaitu analisis kualitatif aktivitas nitrogenase, uji salinitas nitrogenase, identifikasi gen nifH dengan metode polymerase chain reaction (PCR), dan analisis kuantitatif aktivitas nitrogenase dengan metode analisis reduksi asetilen (ARA). Tahapan awal, isolat ditumbuhkan pada media spesifik nitrogen free bromtimol blue (NFB) semi padat untuk menyeleksi sejumlah isolat yang dapat menunjukkan adanya aktivitas nitrogenase. Selanjutnya, isolat yang terseleksi diuji kembali aktivitas nitrogenasenya pada media salinitas 10% dan 20%. Uji ini bertujuan melihat pengaruh salinitas terhadap aktivitas nitrogenase yang dimiliki isolat. Setelah dilakukan uji salinitas, tahap selanjutnya dilakukan identifikasi gen pembentuk kompleks nitrogenase, yaitu gen nifH. Identifikasi gen nifH isolat dilakukan dengan menggunakan teknik PCR. Tahap terakhir, dilakukan analisis kuantitatif aktivitas nitrogenase isolat dengan metode ARA menggunakan kromatografi gas.
Analisis Kualitatif Aktivitas Nitrogenase
Pembuatan Media Nitrogen Free Bromtimol Blue (NFB) padat dan semi padat. Media NFB padat dan semi padat dibuat dari komposisi bahan-bahan yang
sama. Sebanyak 5 g DL-malic acid, KOH 4 g, K2HPO4 0.5 g, MgSO4.7H2O 0.1 g,
MnSO4.H2O 0.05 g, NaCl 0.02 g, CaCl2 0.01 g, FeSO4.7H2O 0.05 g,
Na2MoO4.2H2O 0.002 g dan bacto agar 30 g untuk media NFB padat sedangkan
untuk media NFB semi padat ditambahkan bacto agar sebanyak 1.75 g serta bromtimol blue (BTB) 0.5% sebanyak 2 mL. Semua bahan dilarutkan di dalam akuades kemudian volumenya ditera hingga mencapai 1000 mL dan dibuat hingga pH-nya mencapai 6.8. Media kemudian disterilisasi dalam autoklaf pada tekanan 1 atm dan suhu 121ºC selama 15 menit (Ding et al. 2005).
Peremajaan dan Permurnian Isolat. Sebanyak 1 ose koloni isolat diambil
dari stok kultur awal kemudian ditumbuhkan pada media NFB padat dengan metode gores dan diinkubasi pada suhu 250C selama 5 hari (Ding et al. 2005).
Analisis Kualitatif Aktivitas Nitrogenase. Sebanyak 1 ose koloni isolat
yang dapat tumbuh pada media NFB padat ditumbuhkan kembali pada media NFB semi padat dan diinkubasi pada suhu 250C selama 5 hari. Tahapan ini dilakukan triplo (Ding et al. 2005).
Uji Salinitas Nitrogenase
isolat diinkubasi pada suhu 250C selama 14 hari. Tahapan ini dilakukan triplo (Ding
et al. 2005).
Identifikasi Gen nifH dengan Metode PCR
Isolasi DNA Genom. Isolasi DNA genom isolat dilakukan dengan Wizard Genomic DNA Purification KIT Promega. Kultur isolat yang telah ditumbuhkan pada media lactose broth (LB) dipindahkan ke tabung mikro sebanyak 1.5 mL dan disentrifus selama 2 menit pada kecepatan 21.920 g. Pelet yang terbentuk diambil dan supernatan dibuang. Pelet isolat bakteri gram negatif langsung dilakukan proses lisis sel sedangkan pelet isolat bakteri gram positif diresuspensikan terlebih dahulu dengan etilen diamin tetra asam asetat (EDTA) 50 mM sebanyak 480µL, ditambahkan 120 µL lisozim, diinkubasi pada suhu 370C selama 45 menit dan disentrifus pada kecepatan 21.920 g selama 2 menit. Pelet yang terbentuk kemudian diambil dan supernatan dibuang. Tahap selanjutnya dilakukan proses lisis sel. Sebanyak 600 µL nuclei lysis solution ditambahkan ke dalam isolat dan diinkubasi pada suhu 800C selama 5 menit. RNase ditambahkan sebanyak 3 µL ke dalam isolat dan diinkubasi pada suhu 370C selama 45 menit. Sebanyak 200 µL protein precipitation solution ditambahkan, divorteks kemudian diinkubasi pada suhu -200C selama 5 menit. Setelah diinkubasi, isolat disentrifus pada kecepatan 21.920 g selama 3 menit. Supernatan yang terbentuk diambil dan dipindahkan ke dalam tabung mikro baru dan ditambahkan 600 µL isopropanol pada suhu 250C kemudian
divorteks. Isolat disentrifus kembali pada kecepatan 21.920 g selama 2 menit, supernatan dibuang sedangkan pelet yang terbentuk ditambahkan etanol 70% sebanyak 600 µL. Sentrifus kembali pada kecepatan 21.920 g selama 2 menit. Buang supernatan, pelet dikeringkan dengan cara diangin-anginkan di udara selama 10-15 menit. Tahap terakhir isolat ditambahkan 100 µL rehydration solution dan diinkubasi pada suhu 650C selama 1 jam (Promega 2010).
Analisis Kuantitatif DNA dengan Metode Nanodrop.Sebanyak 2 μL bufer
tris-EDTA (TE) dimasukkan ke dalam lubang ukur. Setelah itu, tutup nanodrop dan tekan tombol read blank pada komputer. Sisa bufer TE dibersihkan dengan tisu. Isolat DNA dimasukkan sebanyak 2 μL ke dalam lubang ukur, kemudian pilih menu read sample. Hasil pengukuran berupa nilai kemurnian isolat akan muncul dalam satuan konsentrasi ng/μL. Kemudian DNA dapat dilihat berdasarkan nilai Å260/Å280 (Thermo Fisher Scientific 2009).
Amplifikasi DNA. Hasil isolasi DNA genom isolat yang telah ditentukan
konsentrasinya selanjutnya diamplifikasi dengan mesin PCR ESCO Swift Maxi Termal Cycler Block model MX-BLC-7. Sebanyak 2 µL DNA (20 ng/µL) ditambahkan ke dalam coktail PCR. Coktail PCR terdiri dari 12,5 µL GoTaq master mix 2x (komposisi: laruan PCR bufer pH 8.5, 400µM dATP, 400µM dGTP, 400µM dCTP, 400µM dTTP dan 3mM MgCl), 1 µL primer (1.0µM) foward dan reverse, dan 8,5 µL nuclease free water. Proses amplifikasi dilakukan pada kondisi suhu denaturasi awal 940C selama 3 menit dengan 1 siklus, denaturasi 940C selama 30 detik, penempelan 550C selama 30 detik, dan ekstensi 720C selama 30 detik dengan 29 siklus, ekstensi akhir 720C selama 5 menit dengan 1 siklus (Poly et al.
2010 a,b).
Pemurnian Hasil PCR dan Visualisasi Amplikon. Hasil PCR selanjutnya
5
disaring melalui spin or vacuum (SV) minicolum yang telah dimasukkan ke tabung mikro baru, inkubasi selama 1 menit. Selanjutnya sentrifus pada kecepatan 21.920 g selama 1 menit, supernatan yang terbentuk dibuang. Sebanyak 700 µL membran wash solution ditambahkan melalui saringan SV minicolum, kemudian sentrifus kembali pada kecepatan dan waktu yang sama, supernatan dibuang kembali. Sebanyak 500 µL membran wash solution ditambahkan kembali melalui SV minicolum, sentrifus pada kecepatan 21.920 g selama 5 menit, supernatan dibuang, lakukan sentrifus kembali pada kecepatan yang sama selama 1 menit. Pindahkan SV minicolum ke dalam tabung mikro baru. Nuclease free water sebanyak 20 µL ditambahkan melalui SV minicolum kemudian sentrifus pada kecepatan 21.920 g selama 1 menit. Selanjutnya, DNA hasil amplifikasi yang telah dimurnikan divisualisasi melalui elektroforesis dengan gel agarosa 1% (Promega 2010).
Analisis Kuantitatif Aktivitas Nitrogenase dengan Metode ARA
Sebanyak satu ose isolat dari media NFB padat yang telah terseleksi dapat melakukan penambatan nitrogen dan hidup pada kondisi salin, dikulturkan kembali pada media NFB semi padat. Isolat diinkubasi pada suhu 250C selama 5 hari. Kultur isolat yang terbentuk selanjutnya digunakan untuk pengujian kuantitatif aktivitas nitrogenase dengan menggunakan kromatografi gas (Ding et al.2005).
Alat kromatografi gas yang akan digunakan dikondisikan terlebih dahulu selama ±3 jam sebelum dilakukan penyuntikan isolat. Kromatografi gas diatur suhu inisial sebesar 1000C, suhu injektor sebesar 1500C, suhu detektor sebesar 2000C dan suhu akhir sebesar 1000C. Gas pembawa dan aliran gas yang digunakan adalah nitrogen (40 psi), hidrogen (1.5 kgf.cm-2), dan udara (0.5 kgf.cm-2) (Hawkes 2001).
Kurva standar dibuat dengan menggunakan standar etilen dengan konsentrasi 0, 50, 100, 150, 175, 200 dan 225 µgram.mL-1. Kromatogram yang dihasilkan selanjutnya dibaca dan hasil yang diperoleh kemudian diplotkan menjadi kurva standar etilen hubungan antara konsentrasi dengan luas area standar untuk mengetahui konsentrasi gas etilen yang terbentuk pada masing-masing isolat yang diujikan.
Kultur isolat yang telah ditumbuhkan pada media NFB semi padat sebelumnya diganti tutup kapasnya dengan tutup karet. Gas yang ada di dalam tabung diambil sebanyak 1 mL dengan microsyringe kemudian ke dalamnya diinjeksikan gas asetilen (C2H2) dengan volume yang sama. Selanjutnya, isolat
diinkubasi selama 1 jam. Setelah dilakukan inkubasi, gas pada bagian headspace diambil kembali sebanyak 1 mL untuk diukur konsentrasi etilen (C2H4) yang
terbentuk karena adanya aktivitas nitrogenase dengan teknik kromatografi gas (Hawkes 2001).
HASIL
Hasil Analisis Kualitatif Aktivitas Nitrogenase
pada media NFB semi padat. Berdasarkan penelitian yang dilakukan, terseleksi 9 isolat yang dapat menunjukkan adanya aktivitas nitrogenase pada media NFB semi padat, yaitu isolat Er B1 2, Er B1 3, Er B1 4, Er B1 9, Er B2 10, Ptb B1 4, Ptb B2 5, Ptb B2 8, dan Ptb B2 10. Adanya aktivitas nitrogenase ditandai dengan terbentuknya pelikel putih pada media (Lampiran 3).
Tabel 1 Hasil analisis kualitatif aktivitas nitrogenase pada media NFB semi padat No Isolat Pelikel yang terbentuk
Keterangan: + = pelikel tipis, ++ = pelikel tebal, +++ = pelikel sangat tebal
Hasil Uji Salinitas Nitrogenase
Selanjutnya dari 9 isolat yang terseleksi, diuji kembali aktivitas nitrogenase pada media salinitas 10% dan 20%. Berdasarkan penelitian yang dilakukan didapatkan hasil, hanya 5 isolat yang terseleksi tetap dapat menunjukkan aktivitas nitrogenase pada kondisi kadar garam tinggi. Pada media salinitas 10%, yaitu isolat Er B1 3, Er B1 4, Er B1 9, dan Er B2 10 sedangkan pada media salinitas 20%, yaitu isolat Er B1 3, Er B1 4, Er B1 9, Er B2 10 dan Ptb B1 4. Adanya aktivitas nitrogenase ditandai dengan terbentuknya pelikel berwarna putih pada media (Lampiran 4).
Tabel 2 Hasil uji salinitas terhadap aktivitas nitrogenase pada media salinitas 10% dan 20%
No Isolat Salinitas 10% Pelikel yang terbentuk Salinitas 20%
1 Er B1 3 + +
2 Er B1 4 ++ ++
3 Er B1 9 +++ +++
4 Er B2 10 +++ +++
5 Ptb B1 4 - +
Keterangan: - = tidak terbentuk pelikel, + = pelikel tipis, ++ = pelikel tebal, +++ = pelikel sangat tebal
Amplikon Gen nifH
7
primer spesifik nifHr dan nifHf. Gen nifH diamplifikasi dengan metode PCR dan menghasilkan pita berukuran ~360 bp (Gambar 1).
Gambar 1 Amplikon gen nifH berukuran ~360 bp (Keterangan: M= Marker 1 kb, 1= Er B1 3, 2= Er B1 4, 3= Er B1 9, 4= Er B2 10, dan 5= Ptb B1 4)
Hasil Analisis Kuantitatif Aktivitas Nitrogenase dengan Metode ARA
Tahap terakhir dilakukan analisis kuantitatif aktivitas nitrogenase kelima isolat dengan menggunakan metode ARA. Tahap awal, dilakukan pembuatan kurva standar hubungan antara konsentrasi gas etilen dengan luas area standar sehingga didapatkan konsentrasi gas etilen yang terbentuk pada masing-masing isolat. Dari konsentrasi gas etilen yang terbentuk tersebut selanjutnya dilakukan perhitungan aktivitas nitrogenase untuk kelima isolat. Aktivitas nitrogenase isolat dihitung menggunakan rumus sebagai berikut (Hawkes 2001):
PEMBAHASAN
Hasil Analisis Kualitatif Aktivitas Nitrogenase
Aktivitas nitrogenase pertama kali dianalisis secara kualitatif dengan cara menguji kemampuan isolat dalam melakukan penambatan nitrogen pada media spesifik. Di lingkungan, bakteri rhizosfer melakukan penambatan nitrogen dengan tujuan memenuhi kebutuhannya untuk pembentukan asam nukleat (RNA dan DNA) bakteri. Saat kebutuhan nitrogen bakteri rhizosfer telah terpenuhi, kelebihan nitrogen akan dikeluarkan ke dalam tanah sehingga dapat digunakan oleh tanaman melalui akar (Caton 2007). Bagi tanaman, nitrogen memiliki berbagai peranan penting, yaitu meningkatkan pertumbuhan tanaman, menunjang pertumbuhan daun, meningkatkan kadar protein dalam tubuh tanaman, meningkatkan kualitas tanaman, sintesis asam nukleat (RNA dan DNA) dan sebagai komponen pigmen klorofil yang diperlukan dalam proses fotosintesis (Choudhury dan Kennedy 2004) akan tetapi di dalam tanah ketersediaan nitrogen terbatas sehingga proses penambatan nitrogen dari atmosfir mutlak diperlukan di lingkungan karena pada akhirnya semua kebutuhan nitrogen tanaman bergantung pada nitrogen yang ditambat dari atmosfir (Buchanan et al. 2000).
Media spesifik yang digunakan untuk menganalisis aktivitas nitrogenase isolat pada penelitian ini adalah media nitrogen free bromtimol blue (NFB). Media NFB merupakan media pertumbuhan yang digunakan untuk menganalisis aktivitas nitrogenase dalam melakukan penambatan nitrogen karena komposisi media yang tidak mengandung unsur nitrogen sama sekali serta mampu menyediakan nutrisi-nutrisi lain yang dibutuhkan oleh isolat (Nurosid et al. 2008). Pada penelitian ini media NFB yang digunakan memiliki pH sebesar 6.8 yang merupakan pH pertumbuhan optimum dari isolat bakteri rhizosfer. Bakteri rhizosfer sangat sensitif terhadap pH rendah sehingga pada pH<6 bakteri rhizosfer akan sulit tumbuh. Suhu optimum pertumbuhan bakteri rhizosfer berada pada suhu dikisaran 25-280C (Rasti et al. 2007).
Berdasarkan penelitian yang dilakukan dari 50 isolat awal, hanya 9 isolat yang menunjukkan aktivitas nitrogenase pada media selektif NFB semi padat, yaitu isolat Er B1 2, Er B1 3, Er B1 4, Er B1 9, Er B2 10, Ptb B1 4, Ptb B2 5, Ptb B2 8, dan Ptb B2 10 (Lampiran 3). Aktivitas nitrogenase pada uji ini ditandai dengan terbentuknya pelikel berwarna putih pada media. Isolat membentuk pelikel di atas dekat dari permukaan media. Saat jumlah nitrogen di dalam media telah terakumulasi maka pelikel akan berpindah ke permukaan media. Isolat melakukan pergerakan (bersifat motil) di dalam media karena memiliki kemampuan aerotaktik dengan tujuan mencari keseimbangan difusi oksigen. Saat laju difusi oksigen sama dengan laju respirasi isolat maka kondisi tersebut merupakan kondisi yang baik untuk aktivitas nitrogenase (Susilowati et al. 2007). Keberadaan oksigen di dalam media dapat menghambat aktivitas nitrogenase dalam melakukan penambatan nitrogen (Rasti et al. 2007)
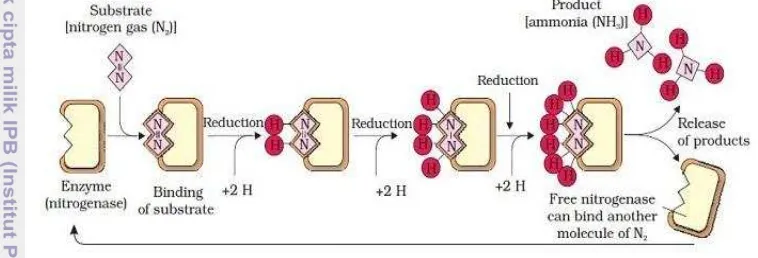
Aktivitas nitrogenase dalam penambatan nitrogen dimulai ketika nitrogen bebas (N2) di atmosfir berikatan dengan kompleks nitrogenase, yaitu pada
9
Ferredoxin atau flavodoxin dibentuk dari proses fotosintesis, respirasi, atau fermentasi yang dilakukan oleh tanaman. Kemudian protein Fe yang tereduksi akan berikatan dengan ATP untuk membentuk kompleks yang akan mereduksi protein Fe-Mo. Selanjutnya, protein Fe-Mo yang tereduksi akan menyumbangkan sepasang elektron kepada substrat berupa N2 sehingga ikatan rangkap tiga pada molekul N2
akan putus dan membentuk HN=NH karena adanya penambahan sepasang proton berupa ion H+. Proses selanjutnya, HN=NH yang terbentuk akan mengalami pemutusan ikatan rangkapnya kembali menjadi H2N-NH2 dan pada akhirnya akan
tereduksi menjadi 2NH3. Setiap pemutusan satu ikatan molekul N2 memerlukan
sepasangelektron dan sepasang proton berupa ion H+ (Kristian 2010) (Gambar 2).
Gambar 2 Proses pengubahan N2 menjadi NH3 yang dikatalisis nitrogenase
(Kristian 2010)
Molekul N2 bersifat relatif stabil di atmosfir sehingga dibutuhkan energi yang
tinggi untuk dapat memecah ikatan molekul N2. Selain melalui proses fiksasi
nitrogen, ikatan molekul N2 juga dapat dipecah oleh sambaran kilat. Pada proses ini
molekul N2 mengalami oksidasi oleh O2 atau ozon dengan bantuan kilat. Hal ini
dapat terjadi karena suhu tinggi yang dihasilkan dari sambaran kilat cukup untuk memecah ikatan molekul N2 sehingga dapat bereaksi dengan molekul O2. Ikatan
rangkap tiga pada molekul N2 hanya dapat dipecah oleh sambaran kilat yang
memiliki suhu tinggi, sekitar 250000C sehingga memungkinkan terjadinya pembentukan nitrogen oksida (NOx) di atmosfir (Prayudi 2001). Berdasarkan hal ini dapat disimpulkan bahwa nitrogen yang terdapat di dalam media NFB merupakan nitrogen yang berasal dari proses fiksasi N2 menjadi NH3 yang
dikatalisis oleh nitrogenase yang dimiliki isolat bukan berasal dari pengubahan N2
menjadi nitrogen oksida dengan bantuan sambaran kilat. Hal ini dikarenakan pada uji ini prosesnya dilakukan di dalam ruangan, dimana tidak tersedia lighting yang berupa sambaran kilat.
Hasil Uji Salinitas Nitrogenase
dapat berdampak pada menurunnya kemampuan aktivitas nitrogenase karena terhambatnya pertumbuhan bakteri.
Media salinitas yang digunakan pada penelitian ini memiliki konsentrasi salinitas sebesar 10% dan 20% (b/v). Pemilihan konsentrasi salinitas yang digunakan pada penelitian didasarkan pada sifat isolat, yaitu bakteri halofilik moderat. Bakteri halofilik moderat merupakan kelompok bakteri yang membutuhkan garam dengan konsentrasi berkisar 5-20% untuk pertumbuhannya (Rasti et al. 2007). Berdasarkan penelitian yang dilakukan oleh Annie dan John (2003) pada bakteri rhizosfer jenis Leucaena leucocephala dari akar tanaman buncis dan kedelai, pada penambahan NaCl dengan konsentrasi 0.025 mol/L dan lebih besar dapat mengurangi pertumbuhan tanaman, mengurangi kemampuan penambatan N2 dari udara, dan mengurangi presentasi keberadaan jaringan nitrogen
pada tanaman yang berumur dibawah 1 tahun. Selain itu, dari penelitian yang dilakukan oleh Shovitri et al (2011) di daerah Wonorejo, Pantai Timur Surabaya dapat diketahui bahwa kadar salinitas mempengaruhi jumlah keberadaan bakteri rhizosfer di suatu lingkungan. Pada kadar salinitas 7.00‰ dapat ditemukan 24 jenis bakteri rhizosfer sedangkan pada kadar salinitas 15.33‰ hanya 6 jenis bakteri rhizosfer yang berhasil ditemukan.
Berdasarkan penelitian yang dilakukan hanya 5 isolat yang terseleksi dapat hidup dan menunjukkan aktivitas nitrogenase pada media salinitas (Lampiran 4). Aktivitas nitrogenase isolat ditandai dengan terbentuknya pelikel berwarna putih pada media. Terbentuknya pelikel berwarna putih menunjukkan adanya pertumbuhan dan pergerakan isolat di dalam media salinitas. Isolat membentuk koloni di bagian atas dekat permukaan media. Hal ini disebabkan oleh bagian atas dekat permukaan media merupakan posisi terbaik untuk melakukan penambatan nitrogen karena dekat dari atmosfir (Nurosid et al. 2008). Berdasarkan hasil tersebut dapat diketahui bahwa terdapat beberapa isolat yang dapat bertahan hidup dan melakukan penambatan nitrogen meskipun berada di lingkungan salin. Isolat Ptb B1 4 hanya dapat tumbuh pada media salinitas 20% dan tidak dapat tumbuh pada media salinitas 10%. Hal ini diduga karena pada media salinitas 10% kebutuhan garam isolat Ptb B1 4 tidak dapat terpenuhi sehingga isolat tidak dapat tumbuh.
11
Amplikon Gen nifH
Keberadaan nitrogenase pada isolat dapat diketahui dengan cara mengidentifikasi gen-gen pembentuk subunit kompleks nitrogenase. Nitrogenase terdiri dari dua komponen, yaitu komponen I dinitrogenase (protein Fe-Mo) dan komponen II dinitrogenase reduktase (protein Fe). Dinitrogenase dikodekan oleh gen nifD dan gen nifK yang memiliki berat masing-masing molekul antara 220-250 kDa. Subunit ini berbentuk tetramer dengan dua metallo-komplek heterodimer yang disebut klaster fosfat (P) dan kofaktor besi molibdenum (FeMo-co). Satu subunit dinitrogenase memiliki sepasang rantai α-β dan sepasang klaster P serta molekul FeMo-co. Komponen dinitrogenase mengandung situs katalitik enzim yang akan berikatan dengan substrat untuk menghasilkan produk. Komponen II nitrogenase, yaitu dinitrogenase reduktase berukuran lebih kecil dengan berat molekul sekitar 60-70 kDa. Dinitrogenase reduktase disusun oleh dua subunit identik rantai α yang mempunyai gugus 4Fe-4S di bagian tengah. Komponen dinitrogenase reduktase memiliki dua situs pengikatan Mg-ATP yang terletak di setiap subunit. Bagian ini berperan sebagai donor elektron obligat ke komplek Fe-Mo yang kerjanya dipengaruhi oleh jumlah ATP yang tersedia di lingkungan. Komponen dinitrogenase reduktase dikodekan oleh gen nifH (Chai 2007) (Gambar 3).
Gambar 3 Kompleks nitrogenase (Chai 2007)
fragmen-fragmen ini menjadi bentuk rakitan penuh [8Fe-7S] kelas P. Meskipun demikian kebenaran mengenai pendapat ini belum dapat dibuktikan karena belum dilakukan penelitian lebih lanjut.
Deteksi keberadaan gen nifH pada isolat dapat dilakukan dengan menggunakan metode polymerase chain reaction (PCR). Ampilifikasi gen nifH dilakukan dengan menggunakan sepasang primer spesifik, yaitu nifHf (foward) yang memiliki panjang sekuen 23 nukleotida dan nifHr (reverse) yang memiliki panjang sekuen 22 nukleotida (Zehr dan McReynold 1989). Amplikon gen nifH hasil PCR memiliki ukuran ~360 bp (Gambar 1). Ukuran gen nifH tersebut berasal dari hasil amplifikasi sekuen gen yang mengandung molekul protein besi dari nitrogenase dengan pengulangan siklus sebanyak 31 siklus. Gen nifH yang berhasil tervisualisasi pada gel agarosa ini menandakan bahwa kelima isolat terbukti secara molekuler memiliki nitrogenase sehingga dapat melakukan penambatan nitrogen dari atmosfir.
Hasil Analisis Kuantitatif Aktivitas Nitrogenase dengan Metode ARA
Analisis kuantitatif aktivitas nitrogenase dapat dilakukan dengan menggunakan metode analisis reduksi asetilen (ARA). Metode ARA didasarkan pada kemampuan nitrogenase untuk mereduksi beberapa komponen dengan ikatan rangkap tiga selain dinitrogen, yaitu asetilen. Prinsip dasar metode ini adalah perhitungan banyaknya gas etilen yang terbentuk dari hasil reduksi asetilen menggunakan kromatografi gas dalam µmol per satuan waktu. Semakin tinggi jumlah gas etilen yang terukur maka semakin tinggi aktivitas nitrogenase pada isolat. Proses perhitungan aktivitas nitrogenase menggunakan kromatografi gas bersifat sangat sensitif karena kepekaannya bisa mencapai pada tingkat yang paling rendah sekalipun (Rao et al. 1997). Menurut Hardy et al. (1996) uji ARA dengan menggunakan kromatografi gas dapat mendeteksi isolat hingga konsentrasi 0.001 µmol sehingga keakuratannya tinggi.
Pengolahan data pada penelitian menggunakan metode analisis kalibrasi mutlak, yaitu dengan pembuatan kurva kalibrasi gas etilen murni. Syarat metode analisis kalibrasi mutlak adalah cuplikan murni (gas etilen) yang disuntikkan banyaknya harus diketahui dan disuntikkan dengan kuantitas yang berbeda-beda. Selain itu, kepekaan detektor harus tetap tak berubah pada setiap pengukuran dan dari hari ke hari agar dapat membandingkan hasil dengan kurva kalibrasi (McNair HM dan EJ Boneli 1988). Berdasarkan penelitian yang dilakukan didapatkan hasil nilai regresi linier untuk kurva standar sebesar 0,9961 (Lampiran 7). Dari kurva standar tersebut dapat diketahui nilai kosentrasi gas etilen yang terbentuk pada masing-masing isolat (Tabel 3).
13
NFB semi padat. Semakin tebal pelikel yang terbentuk pada media menunjukkan bahwa aktivitas nitrogenase yang dilakukan oleh bakteri tersebut semakin tinggi. Semakin tinggi aktivitas nitrogenase maka jumlah nitrogen yang dapat ditambat oleh isolat saat berada di lingkungan akan semakin tinggi pula (Rasti et al. 2007).
Perbedaan besar aktivitas nitrogenase antar isolat dapat disebabkan oleh beberapa faktor, seperti perbedaan waktu inkubasi optimum isolat. Hardy et al. (1996) menyatakan pembentukan etilen mencapai nilai tertinggi pada waktu inkubasi optimum untuk tiap spesies yang diujikan. Tiap spesies memiliki waktu inkubasi optimum yang berbeda. Berdasarkan hal tersebut dapat disimpulkan bahwa waktu inkubasi yang digunakan pada penelitian, yaitu 1 jam merupakan waktu inkubasi terbaik untuk isolat Er B2 10, sedangkan untuk isolat Ptb B1 4 waktu inkubasi yang digunakan bukan merupakan waktu inkubasi optimum untuk spesiesnya sehingga aktivitas nitrogenase Ptb B1 4 memiliki nilai yang rendah. Matsuguchi et al. (2000) menyatakan bahwa waktu inkubasi yang terlalu lama dari waktu inkubasi optimum masing-masing spesies dapat menyebabkan etilen yang telah terbentuk terurai kembali menjadi asetilen. Selain itu, waktu inkubasi yang kurang dari waktu inkubasi masing-masing spesies dapat menyebabkan kerja dari nitrogenase tidak maksimal sehingga substrat berupa asetilen belum sepenuhnya diubah menjadi produk akhir, yaitu etilen.
Faktor lain yang dapat mempengaruhi besar aktivitas nitrogenase adalah konsentrasi nitrogenase dalam isolat. Aktivitas nitrogenase memiliki hubungan yang linier dengan konsentrasi nitrogenase dalam isolat. Semakin tinggi konsentrasi nitrogenase maka aktivitas nitrogenase pun akan semakin tinggi (Hardy et al. 1996). Berdasarkan hal tersebut dapat disimpulkan bahwa isolat Er B2 10 memiliki konsentrasi nitrogenase terbesar karena memiliki nilai aktivitas nitrogenase paling tinggi. Sebaliknya, isolat Ptb B1 4 memiliki konsentrasi nitrogenase paling rendah karena memiliki nilai aktivitas nitrogenase yang paling kecil. Nilai aktivitas nitrogenase berbanding lurus dengan aktivitas penambatan nitrogen yang dilakukan oleh isolat. Semakin tinggi nilai aktivitas nitrogenase isolat maka aktivitas penambatan nitrogen yang dilakukan isolat akan semakin baik.
SIMPULAN DAN SARAN
Simpulan
Saran
Analisis aktivitas nitrogenase pada isolat sebaiknya dilakukan pada rentan waktu inkubasi yang lebih bervariasi sehingga aktivitas nitrogenase pada setiap isolat memiliki data yang lebih valid. Penelitian lebih lanjut melalui teknik inokulasi isolat ke dalam tanaman perlu dilakukan agar dapat terlihat besar efektivitas aktivitas nitrogenase isolat untuk menambat nitrogen di lingkungan.
DAFTAR PUSTAKA
Annie Anthraper dan John DD. 2003. The Effect of NaCl on Growth, N2 Fixation
(Acetylene Reduction), dan Percentage Total Nitrogen In Leucaena Leucocephala (Leguminosae) Var. K-8. American Journal of Botany 90(5): 683–692. 2003.
Blomberg A dan Adler L.2003. Physiology of osmotolerance in fungi. Advances in Microbial Physiology 33: 145–212.
Bordeleau LM dan Prevost D. 2001. Nodulation dan nitrogen fixation in extreme environments. Plant dan Soil 161, 115-125.
Buchanan B, Gruissem W, dan Jones R. 2000. Biochemistry and Molecular Biology of Plants. American Society of Plant Physiologists 30: 52-57. Caton IR. 2007. Abundance of nifH genes in urban, agricultural, and pristine
prairie streams exposed to different levels of nitrogen loading [thesis]. Wichita State University.
Chai YH. 2007. Characterization of nitrogen fixation (nif) genes from Paenabacillus polymyxa [thesis]. University Sains Malaysia.
Choo QC, Samian MR, Najimudin N. 2003.Phylogeny dan characterization of three nifH-homologous genes from Paenibacillus azotofixans. Appl Environ Microbiol 69: 3658-3662.
Choudhury ATMA dan Kennedy IR. 2004. Prospects and potentials for systems of biological nitrogen fixation in Sustainable Rice Production. Biol. Fertil. Soils 39 : 219–227.
Csonka LN. dan Hanson AD. 2001. Prokaryotic osmoregulation: genetics and physiology. Annu. Rev. Microbiol. 45:569–606.
Ding Y, Wang J, Liu Y, Chen S. 2005. Isolation and identification of nitrogen-fixing bacilli from plant rhizospheres in Beijing region. J Appl Microbiol 2005;99:1271–81.
Elza Surmaini, Eleonora Runtunuwu, dan Irsal Las. 2010. Upaya sektor pertanian dalam menghadapi perubahan iklim. Jurnal Litbang Pertanian, 30(1), 2010.
15
Galinski EA. 2005. Osmoadaptation in bacteria. Adv. Microbiol. Physiol. 37:273– 328.
Gong Z, Koiwa H, Cushman MA, Ray A, Bufford D, Kore-Eda S, Matsumoto TK, Zhu J, Cushman JC. and Bressan PM. 2001. Genes that are uniquely stress regulated in salt overly sensitive (sos) mutants. Plant Physiol 126: 363−375.
Hall BG. 2001. Phylogenetic Trees Made Easy: A Molecular Biologist. Sunderldan: Sinauer Associates.
Hadanayanto dan Hairiah K. 2007. Biologi Tanah. Yogyakarta: Pustaka Adipura. Hardy RWF, RD Holsten, EK Jackson, dan RC Burns. 1996. The Acetylene-Etilen
Assay for N2 Fixation: Laboratory and Field Evaluation. Plant Physiol 43:
1185-1207.
Hawkes C. 2001. Acetylene Reduction Method for Meaningsuring Nitrogenase
Activity tested by Christine Hawkes 2001.
http://www.biosci.utexas.edu.IB/faculty/hawkes/protocol/acetylene r eduction.pdf. 10 Januari 2014.
IPCC. 2007. Climate Change 2007: Impacts,Adaptation and Vulnerability. Contribution of Working Group II to the Fourth Assess-ment Report of the Intergoverenmental Panel on Climate Change (IPCC), M.L. Parry, O.F. Canziani, J.P. Palutikof, P.J. van der Linden, dan C.E. Hanson (Eds.). Cambridge University Press, Cambridge.
Kristian Metasari. 2010. Eksplorisasi Bakteri Penambat Nitrogen Non-Simbiosis dari Tanah Kawasan Mangarove Wonorejo Surabaya. Prodi S-1 Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
Las I. 2007. Menyiasati Fenomena Anomali Iklim bagi Pemantapan Produksi Padi Nasional pada Era Revolusi Hijau Lestari. Jurnal Biotek-LIPI. Naskah Orasi Pengukuhan Profesor Riset Badan Litbang Pertanian.
Lee S, Reth A, Meletzus D, Sevilla M, Kennedy C. 2000. Characterization of major cluster of nif, fix, and associated genes in sugarcane endophyte, Acetobacter diazotrophicus. J Bacteriol. 182(24): 7088-7091.
McNair HM dan EJ Boneli. 1988. Dasar Kromatigrafi Gas, Edisi ke-5. diterjemahkan oleh Kosasih Padmawimata. Bdanung: ITB.
Matsuguchi T, Shimomura T, dan Lee SK. 2000. Factor Regulating Acetylene Reduction Assay for Meaningsuring Heterotrophic Nitrogen Fixation in Waterlogged Soils. Society of Soil Science dan Plant Nutrition, 25 (3): 323-336.
Nurosid, Oedjijono, dan PujiLestari. 2008. Kemampuan Azospirilium sp. JG3 dalam Menghasilkan Lipase pada Medium Campuran Bedak dan Onggok dengan Waktu Inkubasi Berbeda. Departemen of Microbiology, Biology Faculty Jenderal Soedirman: Purwokerto.
Prayudi Teguh. 2001. Dampak industri pengecoran logam terhadap kualitas gas NO2 dalam udara ambien di Daerah Ceper. Jurnal Teknik Lingkungan.
Poly F, Ranjard L, Nazaret S, Gourbiere F, Monrozier LJ. 2001. Comparison of nifH gene pools in soil microenvirontments with contrasting properties. App Environ Microbiol. 2001a;67:2255-62.
Poly F, Jocteur Monrozier, Bally R. 2001. Improvement in RFLP procedure to study the community of nitrogen fixers in soil through the diversity of nifH gene. Res Microbiol. 2001b:;152:95-103.
Promega 2010. Wizard Genomic DNA Purification KIT Quick Protocol.
[terhubung berkala]. Eukarya (Gunde-Cimerman N,Oren A, Plemenitaš A, eds). Springer, the Netherldans:441–451.
Rasti S, Edi Husen, RDM Simanungkalit. 2007. Metode Analisis Biologi Tanah. Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian. Bogor.
Rao VR , Jena PK, dan Adya TK. 1997. Inoculation of rice with nitrogen fixing bactria problems and perspective. Biol Fertil Soils 4:21-26.
Robert MF. 2005. Organic Compatible Solutes of Halotolerant and Halophilic Microorganisms. Saline Systems 1:5.
Shovitri M, Tutik Nurhidayanti, Enny Zulaika, Nova Maulidina A, dan Purwanti. 2011. Bakteri rhizosfer di Rhizosfer Avicennia marina dan Pluchea indica di Pantai Wonorejo, Pantai Timur Surabaya. Seminar Kelautan Nasional VII: Surabaya.
Surmaini Elza, Eleonora Runtunuwu, dan Irsal Las. 2010. Upaya Sektor Pertanian dalam Menghadapi Perubahan Iklim. Jurnal Litbang Pertanian, 30(1): 1-7. Susilowati DN, Saraswati R, RD Hastuti, dan Yuniarti E. 2007. Peningkatan Serapan N pada Kedelai yang Diinokulasi Bakteri Diazotrof Endofit di Medium Vermiculit. J Tanah Iklim. Bogor. 26. 41-46.
Thermo Fisher Scientific. 2009. Nanodrop 2000/200c Spectrpphotometer V1.0 User Manual. Wilmington (US): Thermo Fischer Scientific.
Ueda T, Suga Y, Yahiro N, Matsuguchi T. 1995. Remarkable N2-fixing bacterial
diversity detected in riceroots by molecular evolutionary analysis of nifH gene sequnces. J Bacteriol 177: 1414-1417.
17
Organoleptik Produk Lada Hijau dalam Larutan Garam. J.Pascapanen 4 (1): 44-56.
Yoon Jung-Hoon, In-Gi Kim, Kook Hee Kang, Tae-Kwang Oh,Yong-Ha Park. 2003. Bacillus marisflavisp. nov. and Bacillus aquimaris sp. nov., isolated from sea water of a tidal flat of the Yellow Sea in Korea. International Journal of Systematic dan Evolutionary Microbiology 53: 1297–1303. Zehr JP dan McReynolds LA. 1989. Use of degenerate oligonucleotides for
amplification of the nifH gene from the marine cyanobacterium Trichodesmium-thiebautii. Appl. Environ. Microbiol. 55: 2522–2526. Zhu B, Chen TH, dan Li PH.2005. Expression of three osmotin-like protein genes
19
Lampiran 1 Isolat-isolat bakteri rhizosfer yang digunakan dalam penelitian No Kode Isolat Asal Isolat Media
Lampiran 2 Diagram alir penelitian
Purifikasi hasil PCR Uji Salinitas
Analisis kualitatif aktivitas nitrogenase
Tidak terbentuk pelikel Terbentuk pelikel
Isolat Bakteri Peremajaan dan pemurnian isolat bakteri pada media NFB padat
Bakteri tidak tumbuh Bakteri tumbuh
Elektroforesis agarosa Analisis kuantitatif
aktivitas nitrogenase (Uji ARA)
Visualisasi amplikon Pengolahan data
Isolasi DNA bakteri
Identifikasi gen nifH dengan PCR Terbentuk pelikel Tidak terbentuk pelikel
Sampel ditumbuhkan kembali pada media
NFB semi padat
21
Lampiran 3 Hasil analisis kualitatif aktivitas nitrogenase isolat pada media NFB semi padat
Lampiran 4 Hasil analisis kualitatif aktivitas nitrogenase isolat pada media salinitas 10% dan 20%
Lampiran 5 Konsentrasi dan kemurnian DNA isolat
No. Isolat Kosentrasi DNA (ng/µL) 260/280
1 Er B1 3 258.0 1.91
2 Er B1 4 651.7 1.88
3 Er B1 9 307.0 1.94
4 Er B2 10 639.0 1.99
5 Ptb B1 4 644.0 1.93
20%
10% 20%
20%
10% 10% 20%
Er B1 2 Er B1 3 Er B1 4 Er B1 9 Er B2 10 Ptb B1 4 Ptb B2 5 Ptb B2 8 Ptb B2 10
Er B1 3 Er B1 4 Er B1 9 Er B2 10 Ptb B1 4
1 2 3 4 5 M 20%
Lampiran 6 Isolat yang dilakukan uji ARA dengan kromatografi gas
No Isolat Luas area standar (unit luas)
1 Ptb B1 4 +
2 Er B1 4 +++
3 Er B1 3 ++
4 Er B2 10 +++
5 Er B1 9 +++
Keterangan: + = pelikel tipis, ++ = pelikel tebal, +++ = pelikel sangat tebal
23
Lampiran 7 Contoh kromatogram, hasil pengukuran standar etilen yang digunakan dan contoh perhitungan aktivitas nitrogenase isolat
No Konsentrasi standar etilen (µg.mL-1) Luas area standar (unit luas)
RIWAYAT HIDUP
Penulis dilahirkan di Depok pada tanggal 25 Mei 1992 dari ayah bernama Fadillah Umar dan ibu bernama Anjar Yuri Herawaty. Penulis merupakan anak pertama dari 3 bersaudara. Pendidikan penulis dimulai dari SDN Polisi 4 Bogor, kemudian melanjutkan pendidikan ke jenjang Sekolah Menengah Pertama di SMP Negeri 5 Bogor. Tahun 2010 penulis menyelesaikan pendidikan Sekolah Menengah Atas di SMA Negeri 3 Bogor dan pada tahun yang sama lolos seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan penulis pernah menjadi asisten praktikum mata kuliah Biokimia Umum untuk mahasiswa FKH dan Biologi tahun ajaran 2012/2013. Penulis juga aktif dalam kegiatan organisasi kampus, diantaranya sebagai Bendahara Divisi Metabolisme Community Research dan Educatioan of Biochemistry (CREB’s) periode 2011/2012, Tim Bina Desa IPB di bawah Kementrian Sosial Kesejahteraan Masyarakat Badan Eksekutif Mahasiswa IPB tahun 2012 dan sebagai Staff Kementrian Seni dan Budaya Badan Eksekutif Mahasiswa IPB tahun 2013.