Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) PADA BUAH
MANGGA SELAMA PENYIMPANAN
DWI SUGIPRIATINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Potensi Penggunaan Khamir dan Kitosan untuk Pengendalian Busuk Buah Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) pada Buah Mangga selama Penyimpanan adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
DWI SUGIPRIATINI. Potencial Use of Yeast and Chitosan for Control of Mango Stem End Rot Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn.
Botryodiplodia theobromae Pat.) during Storage. Supervised by WIDODO and
SURYO WIYONO.
Infection rate of stem end rot on fruit mango caused by Lasidiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) reach 54% of the total volume of export. This is becoming a serious problem of the exported mango of Indonesia. An integrated biological treatment during storage process can alternatively be proposed to substitute the use of fungicides for controlling diseases. This research aims to study the potency of yeasts and chitosan in controlling stem end rot mango in storage.
Cryptococcus albidus var aerius IPB1, C. albidus var aerius IPB2, Candida edax IPB, C. terreus A IPB, C. luteolus, C. edax 13, and C. albidus var aerius 6 have antagonistic activity against L. theobromaein vitro. C. albidusvar aerius IPB1 is the most effective isolate for inhibiting pathogen compared to the control and other yeasts tested. The chitinolytic activity was only performed by Buleromyces albus 7 and C. edax 13 as shown by the appearance of clearing zone at day-7 on the media that contain colloidal chitin. The most effective chitosan concentration that inhibits the growth of pathogen is 2% (v/v) at day-3 incubation with relative inhibiton level 89,74%. Through the in vivo
test, five potential yeasts for biological control are found, i.e. C. albidus var aerius IPB1,
Pichia guilliermondi A1, Debaryomyces hansenii C12, Rhodotorulaglutinis, and C. edax
13 suppress disease C. albidus var aerius IPB1 is the most effective isolate for inhibiting pathogenic compared to the other tested. The most effective chitosan and thiram concentration in inhibiting the pathogeni growth respectively is 2% (4 day) with relative inhibiton level 89,74% compared to the other test. The combination of C. albidus var
aerius 1, R. glutinis, D. hansenii C 12, C. edax 13 and chitosan to provided higher inhibiting effect against disease than individual treatment.
RINGKASAN
DWI SUGIPRIATINI. Potensi Penggunaan Khamir dan Kitosan untuk Pengendalian Busuk Buah Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) pada Buah Mangga selama Penyimpanan. Dibimbing oleh WIDODO dan SURYO WIYONO.
Infeksi busuk buah pada buah mangga buah disebabkan oleh Lasidiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) mencapai 54% dari total volume ekspor. Hal ini menjadi masalah utama dalam ekspor mangga Indonesia. Pengendalian hayati terpadu selama penyimpanan digunakan sebagai alternatif penggunaan fungisida dalam pengendalian penyakit. Penelitian ini bertujuan untuk mengetahui potensi khamir dan kitosan dalam pengendalian busuk buah mangga selama penyimpanan.
Perlakuan tunggal secara in vitro dilakukan dengan uji antagonis, uji kitinolitik khamir, perlakuan kitosan (konsentrasi 0,1%, 0,5%, 1%, 1,5%, dan 2% v/v), dan perlakuan thiram (konsentrasi 0,001%, 0,01%, 0,1%, 0,3%, 0,5%, 0,7%, dan 1% b/v). Perlakuan secara in vivo dilakukan dengan pencelupan isolat uji khamir (20 isolat) , kitosan (0,01%, 0,025%, 0,05%, 0,1%, 0,5%, 1%, 1,5%, dan 2% v/v), dan thiram (konsentrasi 0,1% dan 0,3% b/v) pada buah mangga. Perlakuan kombinasi secara in vivo dengan pencelupan khamir dan kitosan dalam menekan penyakit busuk buah dan mempertahankan penampilan fisik buah. Penelitian ini disusun dalam rancangan acak lengkap dengan 3 ulangan dengan uji berjarak Duncan (DMRT).
Cryptococcus albidus var aerius IPB1, C. albidus var aerius PB2, Candida edax
IPB, C. terreus A IPB, C. luteolus, C. edax 13, dan C. albidus var aerius 6 mempunyai aktivitas penghambatan terhadap B. theobromae secara in vitro. C. albidus var aerius
IPB1 paling efektif dalam menghambat patogen dibandingkan perlakuan khamir lainnya dan kontrol. Aktivitas kitinolitik hanya ditunjukkan oleh Buleromyces albus 7 dan C. edax 13 dengan adanya zona bening pada koloidal kitin agar pada hari ke-7 inkubasi. Konsentrasi kitosan paling efektif dalam menghambat pertumbuhan patogen adalah 2% (v/v) pada hari ke-3 inkubasi dengan tingkat hambatan relatif sebesar 89,74%. Pada uji in vivo, C. albidus var aerius IPB1, Pichia guilliermondi A1, Debaryomyces hansenii C12, Rhodotorula glutinis, dan C. edax 13 mampu menghambat patogen. C. albidus var
aerius IPB1 paling efektif dalam menghambat dibandingkan perlakuan khamir lainnya. Konsentrasi kitosan dan thiram paling efektif dalam menghambat pertumbuhan patogen adalah 2% (4 hari setelah inkubasi) dengan tingkat hambatan relatif sebesar 89,74% dibandingkan pengujian lainnya. Kombinasi C. albidus var aerius IPB 1, R. glutinis, D. hansenii C 12, C. edax 13 dan kitosan menunjukkan pengaruh penghambatan lebih tinggi terhadap penyakit daripada perlakuan tunggal
Kata kunci : Mangga, Botryodiplodia, pengendalian hayati, khamir, kitosan.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
POTENSI PENGGUNAAN KHAMIR DAN KITOSAN UNTUK
PENGENDALIAN BUSUK BUAH Lasiodiplodia theobromae (Pat.)
Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) PADA BUAH
MANGGA SELAMA PENYIMPANAN
DWI SUGIPRIATINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Entomologi/Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Penggunaan Khamir dan Kitosan untuk Pengendalian Busuk Buah Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) pada Buah Mangga selama Penyimpanan
Nama Mahasiswa : Dwi Sugipriatini
NIM : A451064134
Disetujui : Komisi Pembimbing
Dr. Ir. Widodo, MS Dr. Ir. Suryo Wiyono, M.Sc.Agr
Ketua Anggota
Diketahui:
Ketua Program Studi Dekan Sekolah Pasca Sarjana Entomologi/Fitopatotogi
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Prof. Dr. Ir. Khairil Anwar Notodipuro, M.S
Segala puji bagi Allah SWT yang telah memberikan Ramat dan karuniaNya kepada penulis, sehingga penulis dapat menyelesaikan penulisan tesis yang berjudul “ Potensi Penggunaan Khamir dan Kitosan untuk Pengendalian Busuk Buah Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.) pada Buah Mangga selama Penyimpanan” sebagai prasyarat dalam menyelesaikan pendidikan pascasarjana pada Program Entomologi/Fitopatologi di Institut Pertanian Bogor.
Penulis menyampaikan rasa terima kasih yang tidak terhingga kepada Dr. Ir. Widodo, MS dan Dr. Ir. Suryo Wiyono, M.Sc atas bimbingan, kesabaran, pengkayaan wawasan, saran, kritik dan dukungan moril yang sangat besar peranannya dalam penyelesaian penulisan tesis ini. Ucapan terima kasih juga disampaikan kepada Ir. Syukur Iwantoro, MS, MBA, Dr. Ir. Eliza S. Rusli, Dr. Ir Catur Putra Budiman M.Agric. atas kesempatan yang diberikan kepada penulis untuk mengikuti program magister di IPB.
Ucapan terima kasih juga disampaikan kepada Ir. Ummu Salamah Rustiani, M.Si yang bersedia menjadi Penguji Luar Komisi pada Ujian Tesis. Ucapan terima kasih juga penulis sampaikan kepada Bapak Ir. Bambang Hesti, M.Sc. (mantan Kepala Stasiun Karantina Tumbuhan Kelas I Cirebon) beserta staf atas bantuannya selama survai di Kabupaten Cirebon.
Penulis juga menyampaikan terimakasih kepada rekan-rekan di Balai Besar Uji Standar Karantina Pertanian Ir. Riza Desnurvia, M.Sc., Dra. Tuti Murdiati, Ariningsih Salji Endah, Ade Syah Putra, Nurjanah, Rumenda Ginting, Jati Adiputra, R. Yudiarto dan Yani Dawy atas persahabatan dan kerjasamanya. Penulis juga mengucapkan terima kasih kepada Pak Dadang dari Laboratorium Cendawan dan mbak Ati dari Klinik Tanaman IPB atas bantuannya selama penelitian.
Rasa hormat yang setinggi-tingginya penulis sampaikan kepada kedua orang tua tercinta, Ayahanda H. Muhammad Hasanudin (alm), Ibunda Hj. M. Sudarmi dan Keluarga Besar di Bogor dan di Klaten yang telah mencurahkan kasih sayang, doa, dorongan semangat, dan bantuan moril selama ini. Ucapan terima kasih yang tidak terhingga juga penulis ucapkan kepada suami tercinta Katiryawan dan ananda tercinta Dieta Wisesa Setiyani atas kesabaran, kasih sayang dan dukungannya.
Akhir kata saya haturkan terima kasih kepada semua pihak dan semoga hasil penelitian ini bermanfaat untuk bidang perlakuan pascapanen terutama untuk perlakuan karantina pertanian di Indonesia.
Bogor, 12 Februari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bogor, pada tanggal 29 Oktober 1974 sebagai putra keenam dari dari enam bersaudara dari Ayah H. Muhammad Hasanudin (Alm) dan Ibu Hj. M. Sudarmi. Penulis menikah dengan Katiryawan dan dikaruniai seorang putri, Dieta Wisesa Setiyani.
Pada tahun 1993 penulis lulus dari Sekolah Menengah Atas Negeri 2, Bogor dan melanjutkan pendidikan sarjana di Institut Pertanian Bogor (IPB) melalui Program Undangan Seleksi Masuk IPB. Pada tahun 1998, penulis lulus sebagai Sarjana Biologi, FMIPA IPB. Penulis pernah bekerja sebagai honorer di Puslitbang Mikrobiologi LIPI, Bogor pada tahun 1997 sampai tahun 1999. Pada tahun 2000 sampai 2002, penulis bekerja sebagai honorer di Laboratorium Penelitian Kedokteran, Bagian Radioterapi RSUPN-CM, Jakarta. Pada tahun 2003, penulis diterima sebagai tenaga Calon Pengendali Organisme Pengganggu Tumbuhan di Laboratorium Karantina Pertanian Balai Besar Uji Standar, Jakarta. Pada tahun 2007, penulis memperoleh beasiswa dari Badan Karantina Pertanian untuk melanjutkan pendidikan Program Studi Entomologi dan Fitopatologi, Program Magister Sains pada Sekolah Pascasarjana, Institut Pertanian Bogor.
Halaman Penyakit Busuk Pangkal Buah Mangga ... Gejala ... Morfologi dan Daur Penyakit ... Penyakit Pascapanen ... Pengendalian Penyakit Pascapanen ... Khamir (Agen Hayati) ... Kitin dan Kitosan ... Thiram ... Perlakuan Kombinasi ... Perlakuan Karantina ...
BAHAN DAN METODE ... Tempat dan Waktu Penelitian ... Metode Penelitian ...
Isolasi Khamir dan L. theobromae dari Buah Mangga di Lapangan ... Identifikasi Khamir ... Potensi Penggunaan Khamir, Kitosan, dan Thiram dalam Pengendalian L.theobromae secara in vitro ......
Uji Kitinolitik ... Perlakuan Antagonis Khamir, Kitosan dan Thiram ... Preparasi Khamir dan Patogen untuk Perlakuan secara in vivo Potensi Penggunaan Khamir, Kitosan, dan Thiram dalam Pengendalian L. theobromae pada Buah Mangga secara in vivo ...
Analisa Data ...
HASIL DAN PEMBAHASAN ... Isolasi dan Identifikasi L. theobromae ... Isolasi dan Identifikasi Khamir ... Potensi Penggunaan Khamir, Kitosan, dan Thiram dalam Pengendalian L.theobromae secara in vitro ...
Perlakuan Tunggal Khamir, Kitosan, dan Thiram ... Perlakuan Kombinasi ...
SIMPULAN DAN SARAN ... Simpulan ...
Saran ...
DAFTAR PUSTAKA ...
LAMPIRAN ...
30 37
40 40 40
41
DAFTAR TABEL
Halaman
1
2
3
4
5
Berbagai jenis perlakuan mangga terhadap daya simpan ...
Hasil identifikasi khamir dari buah mangga dengan metode BIOLOGTM...
Uji kitinolitik beberapa khamir secara kualitatif pada media kitin 0.2% selama 7 hari inkubasi...
Diameter koloni dan persentase tingkat hambatan relatif L. theobromae dengan penggunan beberapa konsentrasi kitosan dan thiram pada media PDA selama 12 hari inkubasi ...
Jumlah sel khamir dengan turbidimeter pada tiga konsentrasi ...
14
24
25
27
DAFTAR GAMBAR
Gejala serangan L. theobromae) pada buah mangga berwarna hitam (sumber : Affandi 2005) ...
Makroskopis dan mikroskopis L. theobromae (sumber : CAB
Internastional 2007) ...
Struktur kitosan (Yoshioka et al. 1995) ... Struktur thiram (Tomlin 1998) ……...
Teknik cawan tuang dengan dilakukan pengenceran berseri untuk isolasi khamir asal buah mangga ...
Bagan uji antagonis khamir terhadap L. theobromae pada media PDA ...
Inokulasi L. theobromae pada buah mangga yang telah diberi perlakuan ...
Pengamatan L. theobromae (a) Gejala pada buah mangga; (b) pembentukan chirus pada pengamatan makroskopis; (c) miselia seperti wool (abu-abu gelap); (d) konidia bersekat satu (sudah masak) ...
Uji kitinolitik beberapa khamir secara kualitatif pada media koloidal kitin 0.2% selama 7 hari inkubasi ...
Lebar zona hambatan beberapa khamir terhadap pertumbuhan koloni L. theobromae pada media PDA pada 5, 10, dan 15 hari setelah inkubasi (HSI) ...
Pengaruh beberapa konsentrasi kitosan dan thiram terhadap pertumbuhan L. theobromae pada media PDA selama 7 hari inkubasi ...
Persentase kejadian penyakit dan tingkat hambatan relatif L. theobromae dengan penggunaan beberapa khamir secara in vivo selama 4 hari inkubasi (Th : thiram, KP : kejadian penyakit, THR : tingkat hambatan relatif) ...
Pengaruh beberapa khamir dalam menekan penyakit busuk buah pada irisan kulit buah mangga selama 4 hari inkubasi ...
Persentase kejadian penyakit dan tingkat hambatan relatif L. theobromae dengan penggunaan beberapa konsentrasi kitosan dan thiram secara in vivo selama 4 hari inkubasi (Ki : kitosan, Th : thiram, KP : kejadian penyakit, THR : tingkat hambatan ...
15
16
17
Pengaruh beberapa konsentrasi kitosan dan thiram dalam menekan penyakit busuk buah pada irisan kulit buah mangga selama 4 hari masa inkubasi ...
Persentase kejadian penyakit dan tingkat hambatan relatif L. theobromae dengan kombinasi penggunaan khamir dan kitosan 2% secara in vivo selama 4 hari inkubasi (Ki : kitosan, Th : thiram KP : kejadian penyakit, THR : tingkat hambatan relatif) ...
Pengaruh kombinasi khamir dan kitosan 2% dalam menekan penyakit busuk buah pada irisan kulit buah mangga selama 4 hari masa inkubasi ...
37
38
DAFTAR LAMPIRAN
Komposisi media Martin Agar, Potato Dextrose Agar, dan koloidal kitin agar ...
Proses preparasi untuk identifikasi khamir dengan metode BIOLOGTM ...
Pembacaan dengan Biolog MicroStation Reader untuk identifikasi khamir ...
Lebar zona hambatan beberapa khamir terhadap pertumbuhan patogen pada media PDA pada 5, 10, dan 15 hari inkubasi ...
Analisis ragam persentase penghambatan beberapa khamir terhadap pertumbuhan patogen secara in vitro ... Uji antagonis beberapa khamir terhadap pertumbuhan patogen pada media PDA dengan masa inkubasi 5 hari ...
Analisis ragam pengaruh perlakuan beberapa konsentrasi kitosan terhadap diameter koloni L. theobromae setelah 12 hari inkubasi secara in vitro ... Pengaruh perlakuan beberapa konsentrasi thiram terhadap diameter koloni L. theobromae setelah 18 hari inkubasi secara in vitro ……...….
Persamaan regresi beberapa khamir untuk perlakuan in vivo …….
Penggunaan beberapa khamir dalam menekan penyakit busuk buahsecara in vivo selama 5 hari inkubasi ...
Analisis ragam penggunaan beberapa khamir dalam menekan penyakit busuk buah secara in vivo ...
Pengaruh penggunaan beberapa konsentrasi kitosan dan thiram menekan penyakit busuk buah secara in vivo selama 5 hari inkubasi ....
Analisis ragam pengaruh penggunaan beberapa konsentrasi kitosan dan thiram terhadap pertumbuhan L. theobromae secara
in vivo ...
Latar Belakang
Mangga (Mangifera indica L.) merupakan salah satu produk hortikultura yang mempunyai nilai ekonomis tinggi dan potensi pasar yang baik. Mulai 2003
mangga sebagai target ekspor. Salah satu varietas anjuran komersial komoditas
mangga adalah Gedong Gincu (Direktorat Budidaya Tanaman Buah 2006). Sejak
tahun 1981 mulai dipasarkan ke luar negeri, walaupun masih dalam skala kecil
sebagai promosi dagang. Salah satu sentra terbesar di Jawa Barat penghasil
mangga Gedong Gincu adalah Kabupaten Cirebon (Ditlinhorti 2006). Namun
perkembangan ekspor tersebut sangat lambat karena masih kalah bersaing
dalam hal mutu dengan negara lain yang menerapkan standar mutu tinggi.
Banyak faktor yang mempengaruhi mutu mangga. Salah satunya adanya
serangan penyakit.
Penyebab utama mutu mangga masih rendah karena adanya serangan
penyakit yang menyerang saat prapanen sampai pascapanen. Dalam rangka
menghadapi tantangan era perdagangan bebas melalui AFTA (Asean Free Trade Agreement), perlu dilakukan langkah-Iangkah dalam mengantisipasi muncul dan berkembangnya penyakit sehingga mutu dapat lebih baik.
Kerusakan pascapanen buah mangga Arumanis di tingkat Pasar Induk
Jakarta cukup tinggi sebesar 31% disebabkan oleh serangan mikroorganisme
(Dasuki 1989). Sedangkan kerusakan pascapanen tersebut pada buah mangga
Gedong Gincu sampai saat ini belum ada. Keadaan ini karena pada umumnya
buah mangga setelah dipanen, dikumpulkan, dan dipilah untuk kemudian
dilakukan pengepakan tanpa perlakuan, sehingga setelah transportasi dan
penyimpanan pada suhu kamar mengalami serangan patogen pascapanen
cukup tinggi. Dua jenis busuk buah yang mendominasi kerusakan mikrobiologis
pada mangga adalah Colletotrichum gloeosporioides dan Lasiodiplodia theobromae (Pat.) Griffon & Maubl. (syn. Botryodiplodia theobromae Pat.). Yulianingsih et al. (1990) menyebutkan bahwa serangan L. theobromae pada mangga Arumanis mencapai 54% dan Sepiah (1986) dalam salah satu
penelitiannya pada mangga Arumanis di Malaysia mengemukakan bahwa
persentase serangannya mencapai 50,2% pada suhu kamar. Pordesimo et al. (1984) juga menyatakan bahwa penyakit busuk pangkal buah pada mangga
2
Ekspor mangga Indonesia juga telah mengalami hambatan non tarif berupa
peraturan karantina tujuan ekspor dengan mensyaratkan adanya pest list beserta informasi tambahan mengenai OPT untuk digunakan oleh negara tujuan ekspor
untuk melakukan analisis risiko OPT (PRA). Pest list dapat dijadikan pedoman untuk pengambilan keputusan pengendalian dan pencegahan penyebaran
patogen tersebut (Ditlinhorti 2006).
Penyebab penyakit busuk pangkal buah pada buah mangga Gedong Gincu
adalah Botryodiplodia theobromae Pat. bersifat laten dan berkembang jauh setelah buah matang (Semangun 2004). Patogen ini mampu menyerang selama
penyimpanan dan transportasi. Patogen tersebut mempunyai mode of action yang berbeda sehingga memerlukan perlakuan yang sesuai.
Perlakuan pascapanen dapat dilakukan pengelolaan pada saat
penyimpanan dan lingkungan abiotik serta penggunaan fungisida. Pengemasan
yang kurang baik dapat menimbulkan kontaminasi misalnya : Aspergillus rot dan stem end rot. Penggunaan benomyl dilakukan segera setelah panen (Prabawati et al. 1993). Menurut Bhuiyan (2005) bahwa perlakuan fungisida dilakukan 24 jam setelah panen dengan merendam buah mangga rendam dalam carbendazim atau air panas selama 5 menit (52±0,5oC) atau prochloraz (45%) pada 55
mL/100L air pada suhu ruangan. Namun penggunaan fungisida banyak
berdampak terhadap lingkungan dan adanya residu pestisida yang tidak
dikehendaki oleh konsumen. Sehingga diperlukan pengendalian hayati sebagai
alternatif. Salah satunya dengan penggunaan khamir dan kitosan.
Strategi umum pengendalian hayati adalah penggunaan mikroorganisme
antagonis dalam pengendalian penyakit pascapanen dan prapanen (Janisiewicz
& Korsten 2002). Beberapa mikroba antagonis telah dilaporkan untuk
mengendalikan beberapa patogen pada berbagai sayur-mayur dan buah-buahan
(Mari & Guizzardi 1998). Salah satunya dengan menggunakan khamir. Khamir
umumnya tidak menghasilkan spora alergenik atau mikotoksin seperti cendawan
miselial (Droby & Chalutz 1994), kebutuhan nutrisi sederhana, dan dapat tumbuh
dengan cepat dengan menghasilkan sel dalam jumlah besar (Druvefors 2004).
Tindakan pengendalian hayati dengan khamir memiliki sedikit resiko terhadap
konsumen (Arras et al. 1999). Sel khamir juga mengandung vitamin, mineral, dan asam amino penting telah dimanfaatkan dalam makanan dan pakan
menekan kejadian penyakit C. capsici yang menginfeksi cabai sampai dengan 6,5%. Perlakuan khamir tersebut lebih efektif dibandingkan perlakuan
konvensional dengan klorin (Chanchaichaovivat et al. 2007).
Pelapisan kitosan pada buah mangga menunjukkan bahwa konsentrasi 2%
mampu menghambat perkembangan penyakit antraknosa sehingga dapat
menunda pematangan (ripening), mengurangi respirasi, menghambat produksi etilen, dan mengurangi kerusakan berat (Wang et al. 2007). Selain itu pula dapat menginduksi β 1,3-glukanase yang berhubungan dengan pertahanan sistemik tanaman (Vasyukova 2001).
Kombinasi teknik perlakuan efektif digunakan dalam pengendalian penyakit
cendawan pascapanen (Mari & Guizzardi 1998). Aplikasi pengendalian ini harus
bersifat murah, mudah diperoleh, efektif, dan ramah lingkungan. Selain itu juga
perlu diperhatikan aspek keamanan hayati sehingga buah mangga mampu
mengakses pasar ekspor. Hingga saat ini penelitian tentang pengendalian hayati
dengan khamir dan kitosan belum ada.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk mengetahui potensi penggunaan khamir dan
kitosan dalam pengendalian busuk buah L. theobromae pada buah mangga selama penyimpanan.
Hasil dari penelitian ini diharapkan dapat menemukan metode perlakuan
yang efektif sehingga mampu meningkatkan mutu buah mangga selama
penyimpanan untuk tujuan ekspor.
Hipotesis
Hipotesis pada penelitian ini adalah penggunaan kombinasi khamir dan
kitosan efektif dalam menghambat perkembangan L. theobromae pada buah mangga selama penyimpanan sehingga buah mangga mampu mengakses pasar
TINJAUAN PUSTAKA
Penyakit Busuk Pangkal Buah Mangga
Salah satu penyakit yang terdapat pada buah mangga adalah penyakit
busuk pangkal buah (stem end rot) yaitu Lasiodiplodia theobromae (Pat.) Griffon & Maubl. Sinonim : B. theobromae Pat. L. theobromae, dulu dikenal dengan nama D. natalensis P. Evans. Patogen penyebab penyakit pada buah mangga yang lainnya adalah Phomopsis mangiferae Ahmad, Colletotrichum gloeosporioides (Penz.) Penz. & Sacc., Cytosphaera mangiferae Died., Aspergillus niger Trech., Pestalotiopsis mangiferae (Henn.) Steyaert (Ploetz et al. 1994). Menurut Chen & Liang (1980) klasifikasi penyakit busuk buah ini yaitu :
Kingdom : Fungi
Filum : Ascomycota
Kelas : Ascomycetes
Ordo : Dothideales
Marga : Botryosphaeriaceae.
Cendawan penyebab busuk pangkal buah terjadi pada jaringan
tangkai/ranting yang tua. Cendawan membentuk koloni pada perbungaan dan
akhirnya mencapai tangkai buah (peduncle dan pedicel) beberapa minggu setelah pembungaan. Penyakit busuk pangkal buah menjadi lebih nyata apabila
umur kebun mangga semakin tua dan penyakit antraknosa tidak muncul karena
dilakukan pengendalian dengan fungisida di lapangan (Ditlinhorti 2005).
Gejala
Gejala bervariasi terjadi pada bagian pangkal buah pada saat buah masak.
Infeksi yang disebabkan oleh L. theobromae menimbulkan gejala kebasahan yang meluas dari ujung tangkai buah menyebar menjari kemudian secara cepat
menghitam dan menyatu membentuk bercak di sekeliling pangkal buah. Bercak
nekrotik terdapat pada lapisan kutikula dan dapat menjalar ke dalam daging buah
dalam waktu 7 hari atau kurang jika suhu kurang dari 25oC. Selanjutnya, miselia
akan muncul di sekitar tangkai buah, cairan berwarna coklat keluar dari pangkal
buah atau permukaan tangkai buah (Ploetz et al. 1994).
Infeksi pada pangkal buah tidak menjalar sampai buah masak. Tidak
terbentuknya antifungal resorcinol. Spektrum cendawan yang menyebabkan busuk pangkal buah dipengaruhi oleh suhu, cekaman kelembaban, dan nutrisi
dari inang. Gejala busuk pangkal buah nampak 3-7 hari setelah panen pada
suhu 25oC, tetapi gejala tersebut dapat tertunda menjadi 7-12 hari pada suhu
13oC (Ploetz et al. 1994).
L. theobromae juga dapat menginfeksi buah melalui tangkai buah pada saat panen, terutama pada saat buah dibalik ke arah tanah untuk menghilangkan
getah. Pada saat panen, infeksi melalui tular tanah berkembang lebih awal
daripada infeksi melalui ranting. Penularan dari buah ke buah dapat terjadi
melalui kontak fisik atau melalui eksudat yang keluar dari buah yang busuk
(Ditlinhorti 2005).
Cendawan ini menyerang pangkal batang dan cabang-cabang besar yang
menghadap sinar matahari penuh misalnya karena pemangkasan yang berat.
Gejala yang terlihat dari luar yaitu getah pohon yang mengalir dari lubang pada
batang. Bila semakin parah serangannya maka warna getahnya akan semakin
coklat kelam. Pada buah menyebabkan hancurnya jaringan bagian dalam
sehingga daging buah lunak. Mula-mula bercak berwarna ungu kemudian coklat
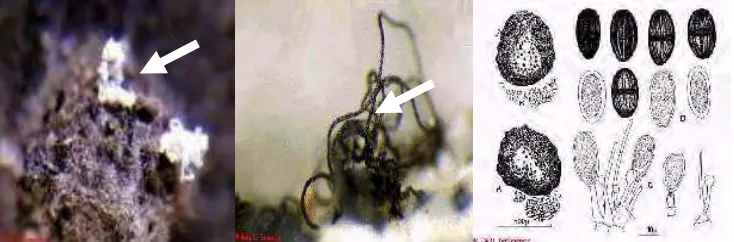
tua dan akhirnya hitam (Gambar 1).
Morfologi dan Daur Penyakit
Beberapa cendawan menyebabkan busuk pangkal buah. L. theobromae terjadi pada daerah panas. L. theobromae adalah anamorph dari Botryosphaeria spp. Cendawan tersebut dalam proses sporulasi (menghasilkan spora)
memerlukan cahaya ultraviolet (Ditlinhorti 2005).
6
Menurut Ploetz et al. (1994), koloni L. theobromae pada agar oatmeal dan Potato Dextrose Agar (PDA) berlimpah, berwarna abu-abu gelap sampai hitam, miselia seperti wool. Secara makroskopis dapat dilihat struktur sirrus (putih saat
masih muda dan coklat tua saat masak). Konidia pada awalnya bening, tidak
bersepta (aseptate), bulat; bulat telur sampai elips (jorong), dan berdinding tebal. Konidia yang sudah masak berukuran 20-30 x 10-15 µm, bersepta satu (satu
sekat), berwarna coklat (Gambar 2).
Perkembangan dan tingkat serangan penyakit dipengaruhi oleh basah
sehingga menjadi rentan. Bertambahnya umur tanaman tertentu meningkat
ketahanannya tetapi pada jenis lain bisa menurun ketahanannya. Kekeringan
yang terjadi secara tiba-tiba, pembuahan yang terlalu lebat dan pelukaan pada
tanaman merupakan kondisi yang baik untuk berkembangan patogen. Di
Indonesia penyakit ini terdapat diSumatera, Jawa, Bali, dan Sulawesi Selatan. Di
luar negeri penyakit ini terdapat di India, Cina, Thailand, Filipina, Pakistan,
Meksiko, Nigeria dan Brazil (Ditlinhorti 2005).
Gambar 2 Makros dan mikroskopik L. theobromae (sumber : CABI 2007)
Penyakit Pascapanen
Penyakit pascapanen dapat menyerang buah mangga ketika masih di
tanaman atau setelah dipanen. Serangan yang terjadi pada buah yang masih
berada di pohon, berupa infeksi laten, yaitu baru terlihat gejalanya setelah buah
dipanen dan diperam. Infeksi setelah panen terjadi karena adanya luka pada
saat penanganan pascapanen yang tidak hati-hati, yaitu : tangkai buah yang
dipatahkan sewaktu dipanen, memar, lecet, dan pecah karena terjatuh. Luka
tersebut merupakan gerbang masuknya mikroba perusak. Mikroba penyebab
infeksi laten penyakit busuk pangkal buah (stem end rot) adalah L. theobromae. Mikroba penyebab penyakit ini masuk ke dalam buah melalui luka pada tangkai
dibelah terlihat daging buah dan kulit biji yang menghitam dan membusuk
(Ditlitbanghorti 2005).
Penanggulangan penyakit pascapanen pada saat pascapanen dengan
penggunaan air panas, fungisida, penyimpanan pada suhu rendah atau
kombinasi dari perlakuan tersebut (Sepiah 1986).
Pengendalian Penyakit Pascapanen
Salah satu teknik pengendalian pascapanen yang saat ini sedang
dikembangkan adalah pengendalian hayati. Strategi umum pengendalian hayati
adalah penggunaan organisme hidup untuk mengendalikan yang lain (Druvefors
2004). Pengendalian hayati telah dikembangkan sebagai suatu alternatif
perlakuan fungisida sintetik dan dipertimbangkan digunakan untuk
memanfaatkan mikroorganisme antagonis dalam pengendalian penyakit
pascapanen dan prapanen (Janisiewicz & Korsten 2002). Penggunaan agen
hayati perlu dipertimbangkan keamanan pangan dan dan penerimaan
masyarakat (Wilson & Pusey 1985). Beberapa mikroba antagonis telah
dilaporkan untuk mengendalikan beberapa patogen pada berbagai sayuran dan
buah-buahan (Mari & Guizzardi 1998).
Salah satu agen hayati yang digunakan untuk pengendalian penyakit
pascapanen tersebut adalah khamir dan pelapis produk untuk memperpanjang
masa simpan buah. Pelapis digunakan untuk memperpanjang masa simpan
produk segar dan melindungi kerusakan buah dari pengaruh lingkungan yang
tidak menguntungkan misalnya serangan mikroorganisme (Greener & Fennema
1994).
Fungsi pelapis ini dapat bersifat aditif, yaitu merupakan tambahan pelapis
apabila permukaan produk telah mempunyai lapisan alami, atau sebagai
pengganti apabila lapisan alami hilang atau berkurang akibat pencucian,
sehingga diharapkan resistensi akan meningkat. Salah satu yang dipergunakan
sebagai dasar pemilihan pelapis adalah sifatnya yang tidak membahayakan
kesehatan misalnya pelapis edibel (edible coating) (Nurrachman 2004).
Pelapis edibel adalah suatu lapisan tipis yang rata, dibuat dari bahan yang
dapat dimakan dan digunakan sebagai pelapis produk makanan. McHugh &
Krochta (1994) menyatakan kemampuan pelapis dalam memberikan tahanan
terhadap transpirasi, CO2, dan O2, tergantung pada jenis pelapis itu sendiri.
8
dengan cara pencelupan (dip application), penyemprotan (spray application), pembuihan (foam application ), dan penetesan (drip application). Sifat lain yang harus diperhatikan adalah pelapisan tidak memberikan pengaruh buruk serta
harus bersifat biodegradable (Greener & Fennema 1994).
Pelapis edible mengalami peningkatan penggunaan karena lebih praktis dibandingkan dengan penggunaan kemasan lain seperti plastik. Salah satu yang
mempunyai potensi baik sebagai pelapis edibel maupun sebagai fungisidal adalah kitosan yang berasal dari turunan polisakarida (El-Ghaouth et al. 1992).
Khamir (Agen Hayati)
Khamir adalah kelompok mikroorganisme uniseluler termasuk dalam filum
Ascomycota (Kelas Hemiascomycetes) dan Basidiomycota (Gandjar et al. 2006). Pada lima belas tahun yang lalu, pengendalian hayati untuk penyakit
pascapanen secara ekstensif menggunakan khamir dan bakteri sebagai
antagonis (Filnonow et al. 1996).
Khamir memiliki banyak kegunaan yaitu biasanya tidak menghasilkan
spora alergenik atau mikotoksin seperti cendawan miselial (Droby & Chalutz
1994), dapat tumbuh dengan cepat substrat yang murah dalam fermentor dan
menghasilkan dalam jumlah besar (Druvefors 2004). Tindakan pengendalian
hayati dengan khamir memiliki sedikit resiko terhadap konsumen (Arras et al. 1999). Sel khamir juga mengandung vitamin, mineral, dan asam amino penting
digunakan dalam makanan dan pakan (Hussein et al. 1996).
Warnasuriya et al. (1985) melaporkan di Sri Lanka isolat khamir berhasil diisolasi dari buah segar dan produk olahan buah – buahan sebanyak 36 strain
yang diidentifikasi menggunakan karakterisasi morfologi dan biokimia. Khamir
tersebut dikelompokkan dalam 6 genus yaitu : Candida (6 strain), Kloeckera (9 strain), Hanseniaspora (3 strain), Pichia (4 strain), Saccharomyces (3 strain), Torulopsis (1 strain). Paling banyak ditemukan adalah Candida krusei (10 strain). Kesempatan untuk memperoleh agen antagonis yang efektif akan lebih
besar dengan mencari sebanyak mungkin jumlah calon agen antagonis (Baker &
Cook 1974).
Khamir antagonis digunakan untuk pengendalian penyakit antraknosa pada
cabai sampai dengan 6,5%. Perlakuan khamir tersebut lebih efektif dibandingkan
perlakuan konvensional dengan klorin (Chanchaichaovivat et al. 2007).
Beberapa spesies Cryptococcus digunakan dalam pengendalian penyakit busuk pascapanen pada buah apel dan pear (Roberts 1990). Parasitisme
khamir telah diusulkan sebagai mekanisme penghambatan cendawan. P. guilliermondii mampu menghambat pertumbuhan Botrytis cinerea (Wisniewski et al. 1991). Cryptococcus albidus mampu menghambat Penicillium glabrum pada strawberi (Helbig 2002). Rhodotorula glutinis mampu menghambat pertumbuhan Penicillium expansum pada buah apel (Lima et al. 1998). Jijakli dan Lepoivre (1998) juga menunjukkan bahwa P. anomala strain K mampu menghasilkan enzim β 1,3-glukanase yang mampu menurunkan kandungan dinding sel cendawan. Produk komersil Yield Plus® mengandung C. albidus sebagai antagonis aktif yang telah diperkenalkan di Afrika Selatan pada tahun 1997
dengan nama Anchor Yeast. Yield Plus® digunakan sebagai produk pengendalian hayati terhadap Botrytis, Penicillium dan Mucor pada buah apel dan buah pear (Druvefors 2004). Strain khamir C. laurentii digunakan untuk pengendalian hayati penyakit busuk kapang abu-abu pada apel (Roberts 1990),
busuk kapang abu-abu dan biru pada pear (Zhang et al. 2005), dan penyakit pascapanen pada buah (strawberi, kiwi, dan anggur) (Lima et al. 1998).
Kompetisi makanan untuk melihat mekanisme beberapa organisme
pengendali hayati seperti : P. guilliermondii dan Debaromyces hansenii terhadap P. digitatum pada buah anggur (Droby et al. 1997).
Penggunaan khamir dapat menunda pemasakan buah saat penyimpanan.
Hal ini terjadi akibat adanya aktivitas antagonis yang mampu merangsang respon
pertahanan buah mangga seperti pada perlakuan K1 (P. guilliermondi A). P. guilliermondii dapat merangsang produksi etilen (Droby et al. 1997), produksi fitoaleksin (Rodov et al. 1994), dan kadar fenilalanin amonia liase (Wisniewski & Wilson 1992) pada buah jeruk.
Konsentrasi suspensi khamir yang digunakan di laboratorium umumnya
sebesar 107cfu/ml (Myrto et al. 2004). Suspensi sel khamir pada konsentrasi rendah yaitu 106 sampai 107 cfu/ml efektif dalam menghambat perkembangan
10
Kitin dan Kitosan
Kitin adalah polimer berantai lurus yang tersusun atas residu
N-asetilglukosamina melalui ikatan ß-(1,4). Secara umum kitin banyak terdapat
pada eksoskeleton atau kutikula serangga, crustacea, dan jamur (Tsigos et al. 2000). Lebih dari 80.000 metrik ton kitin diperoleh dari limbah laut dunia per
tahun (Patil et al. 1999), di Indonesia limbah kitin yang belum dimanfaatkan sebesar 56.200 metrik ton per tahun (DKP 2003). Menurut Abidin (2007)
melaporkan bahwa kulit udang putih (Penaeus penicillatus) mengandung protein (25-40%), CaCO3 (40-50%) dan kitin atau poli-N asetiglukosamina (15–30%),
dan glukosamina.
Koloidal kitin merupakan salah satu substrat (sumber karbon) yang dapat
digunakan untuk menginduksi kitinase pada bakteri, cendawan, dan
aktinomisetes. Kitinase berguna dalam produksi kitooligosakarida.
Kitooligo-sakarida berperan sebagai pertahanan tanaman. Kitinase digunakan dalam
pertanian sebagai pengendalian cendawan patogen tanaman. Organisme ini
memiliki kitin pada penutup tubuhnya sehingga dapat didegradasi oleh enzim
tersebut (Patil et al. 1999).
Zona bening ini merupakan salah satu karakteristik aktivitas kitinolitik yang
mudah dikenali. Kitinase dihasilkan oleh khamir dengan menghidrolisis kitin
menjadi monomer N-asetil glukosamina sebagai sumber karbon. Biasanya
mikroorganisme menghasilkan kitinase untuk menghidrolisis berbagai bentuk
kitin yang terdapat di alam dan dimanfaatkan oleh mikroba sebagai sumber
karbon (Yanai et al. 1992). Penambahan kitosan asal kulit udang pada media PDA mampu menghambat pertumbuhan C. musae baik secara vegetatif maupun reproduktif (Rogis et al. 2007). Biasanya mikroorganisme menghasilkan kitinase untuk menghidrolisis berbagai bentuk kitin yang terdapat di alam dan
dimanfaatkan oleh mikroba sebagai sumber karbon (Yanai et al. 1992).
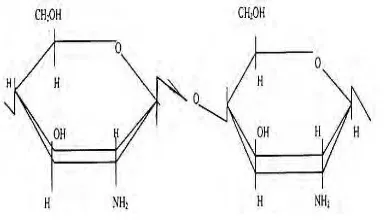
Kitosan adalah kitin yang telah dihilangkan gugus asetilnya menyisakan
gugus amina bebas yang menjadikannya bersifat polikationik dan merupakan
polimer rantai linier glukosamin dengan rumus (C6H11NO4)n (Gambar 3). Berat
molekul kitosan sekitar 1,036 x 105 dalton tergantung proses pembuatannya.
Kitosan mudah mengalami degradasi secara biologi, tidak beracun, dan tidak
larut pada pH di atas 6,5 (Kurt et al. 1991). Kitosan mempunyai gugus fungsional amina yang bersifat non polar. Gugus ini dapat mengikat ion positif
1989). Sifat polar dan non polar dari kitosan menyebabkan kitosan menjadi
fleksibel, dapat mengikat air dan minyak sehingga dapat membentuk konfirmasi
kompak dan memanjang. Sifat ini bermanfaat untuk meningkatkan daya guna
dalam penggunaannya. Kitosan pertama sekali ditemukan Routget pada tahun
1859 (Abidin 2007) dengan struktur seperti pada Gambar 3.
Gambar 3 Struktur kitosan (Yoshioka et al. 1995)
Pelapis kitosan digunakan untuk menunda pemasakan dan
memper-panjang masa simpan buah mangga pada suhu 15±1°C dan 85-90% RH selama
35 hari. Perlakuan buah mangga dengan kitosan (2%) efektif dalam mengurangi
timbulnya kebusukan dan kerusakan berat, dan menunda perubahan warna, pH
dan keasaman hasil titrasi saat penyimpanan sehingga dapat meningkatkan
mutu mangga (Wang et al. 2007).
Perlakuan kitosan dengan konsentrasi 0, 0,5, 1,0, dan 2,0% (b/v) yang
dilisis dengan asam asetat 0,5% (b/v) diujikan pada media Potato Dextrose Agar (PDA). Hasil menunjukkan bahwa kitosan dengan konsentrasi 2,0% adalah
konsentrasi terbaik dalam menghambat pertumbuhan miselia dan spora
perkecambahan C. musae (Rogis et al. 2007).
Penurunan jumlah kitin pada dinding hifa akibat adanya penambahan
kitosan pada media PDA mempengaruhi warna miselium Colletotrichum musae menjadi lebih terang dibandingkan dengan yang tanpa perlakuan kitosan
Penambahan kitosan asal kulit udang pada media PDA mampu menghambat
pertumbuhan C. musae baik secara vegetatif maupun reproduktif (Rogis et al. 2007).
Pelapisan kitosan pada mangga dapat menunda pematangan (ripening), mengurangi respirasi, produksi etilen, kerusakan berat, kadar asam askorbat dan
kadar keasaman hasil titrasitetapi tidak dapat mempertahankan kekerasan buah
mangga (Pumchai et al. 2005). Kitosan larut air dengan berat molekul rendah (5 kDa) berasal dari kulit udang menunjukkan aktivitas elisitor dengan merangsang
12
terhadap serangan Phytophthora infestans. Kitosan tersebut merangsang akumulasi fitoaleksin jaringan tanaman inang, kitinase, β glukanase, dan lipoksigenase (Vasyukova et al. 2001). Kitosan juga memiliki aktivitas antimikroba dan telah dilaporkan efisien dalam pengendalian kebusukan
buah-buahan pascapanen (Wang et al. 2007).
Menurut Baldwin et al. (1999) mengemukakan bahwa penggunaan pelapis polisakarida pada buah mangga mampu menurunkan konsentrasi O2 internal
buah dibanding dengan lilin carnuaba. Pelapis kitosan yang digunakan pada tomat dengan konsentrasi 1% (b/v) dan 2% (b/v) dapat menurunkan tingkat
produksi CO2 sebesar 20% dan 25% dibanding dengan kontrol. Kitosan
menurunkan konsentrasi oksigen internal sebesar 30% dan 17% serta
meningkatkan CO2 internal 2- 4 kali (El-Ghaouth et al. 1992). Menurut Zhang &
Quantrick (1997) perlakuan kitosan 1% (b/v) dan 2 % (b/v) dapat mengakibatkan
penurunan suplai oksigen pada buah leci.
Sebagai alternatif, produksi kitosan secara enzimatis kini tengah menjadi
perhatian. Di samping ramah lingkungan, kitosan sudah dimanfaatkan secara
luas dalam industri, pertanian, peternakan, maupun kesehatan. Kitosan di
bidang pertanian digunakan juga sebagai pelapis benih sehingga dapat tahan
terhadap jamur tanah, serta meningkatkan viabilitas benih. Penggunaan kitosan
pada pelapisan buah -buahan dapat menghambat difusi oksigen ke dalam buah
sehingga proses respirasi dapat dihambat (Hirano 1989).
Thiram
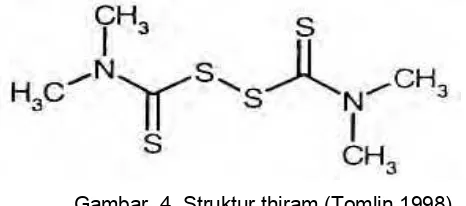
Gambar 4 Struktur thiram (Tomlin 1998)
Fungisida untuk mengendalikan penyakit tanaman dibagi menjadi dua
protektan dengan aktivitas multisite dengan bahan kimia organik kelompok dithiocarbamate mengandung bahan aktif thiram (Zwieten et al. 2007).
Salah satu fungisida yang digunakan untuk perlakuan pascapanen produk
buah–buahan dan sayuran adalah thiram. Thiram yang biasa digunakan adalah
TIFLO 80 WG (nama dagang) yang mengandung bahan aktif thiram (80%).
Thiram termasuk fungisida kontak ini dalam mengendalikan penyakit antraknosa
(Colletotrichum spp) pada tanaman cabai merah. Izin tetap pada tanggal 6 Agustus 2007 (Direktorat Sarana Produksi 2006). Penyakit antraknosa ini juga
sering terjadi di Pantai Utara Selandia Baru. Saat ini, perlakuan thiram efektif
digunakan untuk mengedalikan penyakit antraknosa (Dirou & Stovold 2005).
Fungisida nonsistemik yang digunakan adalah tembaga oksiklorida
(blitox-50% WP), mancozeb (indofil M-45 75% WP), propineb (antracol 70% WP),
thiram (thiram 75% WP) dan zineb (indofil Z-78 75% WP). Perlakuan thiram
(Granuflo 80 WP) sebesar 0,3%, 0,2%, dan 0,1% efektif dalam menghambat
pertumbuhan miselia A. alternata. Menurut CABI (2003) konsentrasi thiram yang digunakan untuk pengendalian Diplodia sp. sebesar 0.25%. Thiram 80 WG juga mampu mengendalikan penyakit antraknosa dan kudis pada buah mangga
(Sopina 1988).
Menurut standar keamanan pangan di Singapura menyatakan bahwa batas
maksimum residu untuk thiram dalam mengendalikan penyakit pada buah–
buahan (apel, pisang, strawberry, dan tomat) sebesar 7 ppm (Anonim 2000).
Selain untuk perlakuan pascapanen produk buah – buahan, thiram juga
dapat dilakukan untuk mengendalikan infeksi penyakit pada benih. Varietas
unggul sangat peka terhadap penyakit rebah kecambah (damping-off) yang disebabkan oleh Pythium sp, dan penyakit layu yang disebabkan oleh Fusarium oxysporum.
Perlakuan Kombinasi Kitosan dan Khamir Antagonis
Kombinasi teknik perlakuan efektif digunakan dalam pengendalian penyakit
cendawan pascapanen. Kombinasi kitosan dengan beberapa khamir antagonis
dikaitkan dengan keamanan bagi manusia dan efeknya terhadap kualitas
14
Perlakuan Karantina
Buah mangga banyak diekspor ke Singapura, Hong Kong, Timur Tengah
dan Eropa. Beberapa negara mengenakan batasan karantina yang amat ketat
terhadap pengimporan buah mangga. Sebelum diekspor ke Amerika Serikat,
Jepang, Australia, dan New Zealand, buah tersebut harus dilakukan perlakuan
karantina tertentu bagi memastikan tidak adanya penyakit stem end rot pada buah tersebut.
Perlakuan karantina bagi mangga Gedong Gincu telah dikembangkan.
Buah yang dipetik pada peringkat kematangan yang betul (12 minggu selepas
keluar putik) direndam dengan air panas pada suhu 46,5°C dan kelembaban
relatif 50% selama 20 menit. Buah yang diberi perlakuan segera diberi perlakuan
dingin selama satu jam sebelum dibungkus dalam karton papan beralun.
Perlakuan suhu pada saat penyimpanan bertujuan memperpanjang daya
tahannya pada suhu tertentu (15oC) agar dapat dikonsumsi dalam keadaan baik.
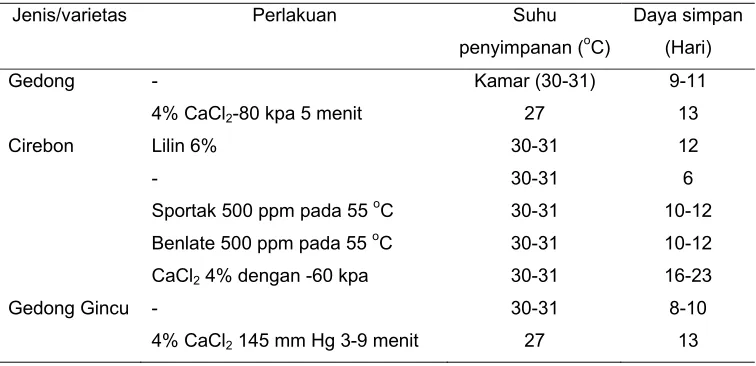
Daya tahan simpan beberapa jenis mangga dengan berbagai perlakuan seperti
pada Tabel 1.
Tabel 1 Berbagai jenis perlakuan mangga terhadap daya simpan
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Cendawan Balai Besar Uji Standar
Karantina Pertanian (BBUSKP), Jakarta mulai Juli 2008 sampai Januari 2009.
Bahan
Bahan yang digunakan yaitu : kitosan koloid (asal kulit udang diperoleh dari
Departemen Teknologi Hasil Perikanan, Fakultas Perikanan) bersifat larut dalam
air (water soluble) memiliki berat molekul belum diketahui (unidentified), fungisida (thiram 80 WP), kit BIOLOGTM, isolat khamir (khamir berwarna kuning, oranye,
putih 1, dan putih 2 asal bawang merah dari Laboratorium Klinik Tanaman,
Departemen Proteksi Tanaman, IPB dan asal buah mangga Gedong Gincu dari
lapang), akuades steril, Media Martin Agar (MA), rose bengal, streptomycin,
media Potato Dextrose Agar (PDA), natrium hipoklorit (NaClO) dengan konsentrasi 1%, D-glucose, asparagine, agar (Bacto), Tween 20, alkohol 70%,
dan buah mangga Gedong Gincu asal Cirebon.
Metode Penelitian
Pengambilan Sampel Buah Mangga dari Lapangan
Lokasi pengambilan contoh yaitu di Desa Munjul, Kabupaten Cirebon,
Jawa Barat merupakan sentra mangga Gedong Gincu dengan metode purposif untuk mengetahui ada atau tidak ada serangan stem end rot pada buah mangga. Survei dilaksanakan di sentra perkebunan mangga di Desa Munjul, Kabupaten
Cirebon, Jawa Barat dengan ketinggian tempat berkisar dari 0 m dpl sampai
dengan 30 m dpl terletak. Selain itu pula dilakukan pengambilan buah mangga
sehat belum matang untuk isolasi agen hayati khamir asal buah mangga dari
lapangan dan beberapa perlakuan di laboratorium. Buah mangga Gedong Gincu
dipetik pada tingkat belum matang dari lapangan (umur 120 hari dari buah mekar
16
Isolasi L. theobromae dan Khamir dari Buah Mangga di Lapangan
L. theobromae diisolasi dari buah mangga yang terinfeksi di lapangan dengan menggunakan media PDA. Kemudian dilakukan isolasi sampai diperoleh
biakan murni. Khamir asal mangga sehat (belum matang) dari lapang diisolasi
dengan menggunakan media MA ditambahkan dengan streptomycin 150 ppm dan rose bengal.
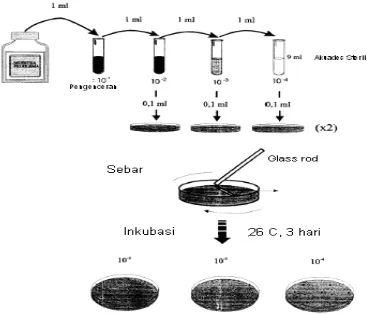
Khamir diisolasi dari buah mangga sehat dicuci dengan akuades steril.
Kemudian buah mangga dimasukkan ke dalam plastik dan diletakkan di atas
shaker dengan kecepatan 150 rpm selama 24 jam. Kemudian diambil
supernatan diencerkan berseri mulai dari : 10-1, 10-2, 10-3, 10-4, 10-5, 10-6 dan 10-7.
Setiap pengenceran diambil suspensi sebanyak 50 µl dan disebarkan pada
media MA yang mengandung streptomycin (150 ppm) lalu diratakan
menggunakan glassrod. Lakukan pada setiap seri pengenceran dengan cara yang sama (Gambar 5).
Hasil pengenceran tersebut diinkubasikan pada suhu 25 - 30oC selama 3–7
hari (tergantung cepat atau lambatnya pertumbuhan khamir). Media agar yang
digunakan yaitu : MA (Lampiran 1). Pemurnian khamir dari koloni yang tumbuh
(ambil khamir dari koloni tunggal), lalu gores pada media PDA dan inkubasikan
kembali. Apabila isolat khamir sudah murni, diremajakan kembali pada media
PDA. Isolat murni berumur 3 sampai dengan 5 hari siap diuji untuk identifikasi
sampai tingkat spesies dengan metode BIOLOGTM .
Identifikasi Khamir
Isolat khamir (khamir berwarna putih 1, putih 2, kuning, dan orange asal
Laboratorium Klinik Tanaman, Departemen Proteksi Tanaman IPB serta isolat
khamir dari buah mangga) diidentifikasi secara morfologi. Kemudian identifikasi
dilakukan secara fisiologis dan biokimiawi dengan menggunakan metode
BIOLOGTM (MicroLogTM System, Release 4.2) sampai penentuan tingkat spesies.
Persentase probability dan umur inkubasinya masing – masing isolat khamir dicatat.
Koloni isolat murni khamir berumur 3 sampai dengan 5 hari diambil
menggunakan cotton swab steril, kemudian suspensikan dalam tabung reaksi yang berisi akuades steril sebanyak 10 ml (hati-hati jangan sampai terbentuk
gelembung udara). Turbiditas suspensi khamir diukur dengan BIOLOG
47% (Lampiran 2). Mikroplate BIOLOG yang digunakan adalah jenis YT untuk
yeast/khamir. Suspensi khamir dimasukkan ke dalam mikroplate tersebut sebanyak 100 µl tiap sumuran dengan mikropipet multichannel (8 lubang). Inkubasikan pada temperatur sesuai petunjuk pada tabel selama 24, 48, 72, atau
96 jam. Pembacaan dengan BIOLOG Microstation Reader (Lampiran 3). Identifikasi sampai tingkat spesies ditunjuk-kan berdasarkan persentase
probability dan similarity.
Gambar 5 Teknik cawan tuang dengan dilakukan pengenceran berseri untuk isolasi khamir asal buah mangga
Potensi Penggunaan Khamir, Kitosan, dan Thiram dalam Pengendalian L. theobromae secara in vitro
Uji Kitinolitik. Pengujian potensi kitinolitik beberapa isolat khamir
dilakukan pada media koloidal kitin agar 0,2%. Adapun pembuatan koloidal kitin
mengikuti metode Arnold & Solomon (1986) yaitu sebanyak 20 gram kitin
(C8H13NO5)n diperoleh dari kulit udang (C717O practical grade sigma) dilarutkan
18
dingin. Setelah disaring menggunakan glass wool, filtrat ditambah 200 ml akuades dingin. Tambahkan kira – kira 500 ml 10 N NaOH hingga diperoleh pH
7,0 (setelah 350 ml penambahan selanjutnya setetes demi setetes). Filtrat
kemudian disentrifugasi pada kecepatan 7.000 rpm selama 10 menit. Setelah
pelet diresuspensi (aduk–aduk) dengan akuades dingin. Kemudian dilakukan
sentrifugasi lagi. Pelet koloidal kitin harus disimpan pada suhu 4oC. Pembuatan
media kitin agar tersebut dapat dilihat pada Lampiran 1. Semua isolat khamir uji
dengan umur isolat 7 hari ditanam pada media kitin. Kemudian diinkubasikan
pada suhu ruang. Pengamatan dilakukan setiap hari. Khamir kitinolitik yang
muncul, yaitu khamir yang memiliki zona bening pada tepi koloni.
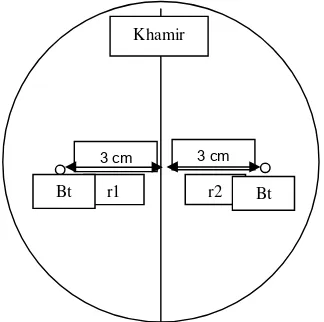
Perlakuan Antagonis Khamir, Kitosan dan Thiram. Uji antagonis
beberapa khamir dilakukan terhadap L. theobromae. Khamir uji digoreskan pada media PDA tepat di tengah petri (diameter 9 cm) secara transversal
sebanyak 1 lup inokulasi. Setelah itu pada media PDA tersebut ditumbuhkan
cendawan B. theobromae yang berasal dari biakan murni berumur 14 hari dengan menggunakan bor gabus (diameter 5 mm) yang diletakkan di tepi kiri dan
kanan goresan tersebut. Adapun jarak masing – masing patogen terhadap
khamir adalah 3 cm (Gambar 6). Inkubasikan pada suhu kamar. Pengamatan
lebar zona bening dan persentase tingkat hambatan relatif terhadap patogen
dilakukan setiap 5 hari inkubasi sampai hari ke-15 inkubasi. Persentase tingkat
hambatan relatif terhadap patogen dihitung dengan rumus Hadiwiyono (1999)
sebagai berikut :
THR = dk - dp x 100%
dk
THR = Persentase tingkat hambatan relatif terhadap pertumbuhan patogen dk = Diameter koloni pertumbuhan patogen tanpa perlakuan khamir (kontrol) dp = Diameter koloni pertumbuhan patogen yang diberi perlakuan khamir
(r1+r2)
Perlakuan kitosan digunakan yaitu pada 5 taraf konsentrasi yaitu 0,1%,
0,5%, 1%, 1,5%, dan 2% (v/v). Perlakuan dilakukan dengan cara menuangkan
senyawa alami kitosan sesuai konsentrasi perlakuan masing – masing sebanyak
400 µl/cawan petri untuk setiap taraf perlakuan (Wilson et al. 1994). Selanjutnya pada masing – masing cawan petri dituangkan PDA cair (suhu 40oC) sebanyak
10 ml. Kemudian petri digoyang – goyang agar kitosan tercampur rata dengan
kitosan) disiapkan sebagai pembanding. Masing – masing perlakuan dilakukan
dengan 3 ulangan.
Gambar 6 Bagan uji antagonis khamir terhadap L. theobromae pada media PDA
Media PDA tersebut ditumbuhkan cendawan L. theobromae (berumur 14 hari) dengan menggunakan bor gabus (diameter 5mm) yang diletakkan tepat di
tengah cawan petri. Inkubasi dilakukan pada suhu ruang. Pengamatan
dilakukan secara periodik terhadap diameter koloni dan persentase tingkat
hambatan relatif terhadap patogen L.theobromae mulai hari 1 sampai hari ke-12 setelah tanam dengan interval waktu pengamatan 3 hari.
Perlakuan thiram sebagai pembanding digunakan yaitu pada 7 taraf
konsentrasi yaitu 0,001%, 0,01%, 0,1%, 0,3%, 0,5%, 0,7%, dan 1% (b/v).
Perlakuan dilakukan dengan cara menuangkan thiram sesuai konsentrasi
perlakuan masing–masing sebanyak 400 µl/cawan petri untuk setiap taraf
perlakuan. Selanjutnya pada masing–masing cawan petri dituangkan PDA cair
(suhu 40oC) sebanyak 10 ml. Kemudian petri digoyang–goyang sampai thiram
tercampur rata dengan PDA. Campuran PDA dan thiram dibiarkan beku.
Kontrol (tanpa perlakuan kitosan) disiapkan sebagai pembanding.
Setelah itu pada media tersebut ditumbuhkan cendawan L. theobromae yang berasal dari biakan murni berumur 14 hari dengan menggunakan bor gabus
(diameter 5mm) yang diletakkan tepat di tengah cawan petri. Inkubasi dilakukan
pada suhu ruang. Pengamatan dilakukan secara periodik terhadap diameter
koloni dan persentase tingkat hambatan relatif terhadap patogen L.theobromae mulai hari ke-1 sampai hari ke-18 setelah tanam dengan interval waktu
pengamatan 3 hari.
r1 r2
Bt Bt
Khamir
20
Preparasi Khamir dan Patogen untuk Perlakuan secara in vivo
Persentase turbidity suspensi beberapa khamir uji diukur dengan BIOLOG Turbiditimeter sampai nilai suspensi tiap isolat khamir dan patogen tersebut
mencapai 25%, 50%, dan 75%. Ketiga turbidity dari masing – masing khamir tersebut dilakukan penghitungan jumlah spora per ml dengan hemasitometer
(Neubauer Improved, Germany dengan kedalaman 0,1 mm). Hasil penghitungan
tersebut dibuat kurva standar dan persamaan regresinya. Adapun rumusan
untuk penentuan jumlah spora per ml adalah sebagai berikut :
A (OD) = 2 – log %T A = Absorbans
OD = Optical Density /Rapat Optis (spora/ml) T = Transmitans
Penentuan konsentrasi suspensi masing – masing khamir yang digunakan
untuk perlakuan in vivo yaitu sebanyak 107 spora per ml (disesuaikan dengan persamaan regresi). Konsentrasi tersebut dikonversikan ke dalam persen
Transmitans (%T) dengan menggunakan BIOLOG Turbiditimeter.
Potensi Penggunaan Khamir, Kitosan, dan Thiram dalam Pengendalian L. theobromae pada Buah Mangga secara in vivo
Perlakuan secara in vivo dilakukan dengan menggunakan khamir, kitosan, dan thiram pada buah mangga. Buah mangga direndam dalam larutan natrium
hipoklorit (NaClO) 1% selama 2 menit (Zhang et al 2007). Kemudian buah tersebut dicuci sebanyak 2 kali dengan akuades steril dan dikeringanginkan.
Buah mangga tersebut dicelupkan ke dalam suspensi khamir (20 isolat khamir
dengan konsentrasi 107 spora per ml) yang mengandung Tween 20 (konsentrasi
0,006%, v/v), larutan kitosan (0,01%, 0,025%, 0,05%, 0,1%, 0,5%, 1%, 1,5%,
dan 2%), dan thiram (0,1% dan 0,3% b/v). Larutan perangsang perkecambahan
spora L. theobromae ditambahkan pada suspensi tiap bahan perlakuan dengan menggunakan D-glucose (0,04%) dan Asparagin (0,008%).
Buah tersebut ditiriskan dan dikeringanginkan selama 2 jam pada suhu kamar.
Buah dikupas dengan pisau steril dan kulitnya diiris sebanyak 8 irisan. Irisan
tersebut diletakkan di atas penyangga/sedotan plastik steril dengan alas tisu
yang telah dilembabkan dengan akudes steril pada nampan plastik steril. Masing
hari) pada tiga titik yaitu : tepi kanan,tengah, dan tepi kiri tiap irisan tersebut
(Gambar 7). Tutup dengan plastik wrap untukmenjaga kelembaban. Inkubasikan selama 24 jam pada kondisi gelap kemudian pindahkan kondisi tidak gelap
selama 6 hari. Kontrol (tanpa perlakuan) disiapkan sebagai pembanding.
Pengamatan tiap 3 hari sampai hari ke-6 inkubasi dengan menghitung
persentase kejadian penyakit. Kejadian penyakit diamati dengan cara mencatat
irisan kulit buah tersebut yang menunjukkan gejala stem end rot tiap satuan percobaan. Selanjutnya persentase kejadian penyakit (KP) dihitung dengan
menggunakan rumus :
KP = n x 100%
N
n = Jumlah irisan yang menunjukkan gejala stem end rot N = Jumlah irisan yang diamati
Gambar 7 Inokulasi L. theobromae pada buah mangga yang telah diberi perlakuan
Apabila hasil perlakuan tunggal secara in vivo yang menunjukkan potensi yang baik maka dilakukan perlakuan kombinasi dalam optimalisasi pengendalian
L. theobromae pada buah mangga. Adapun tujuan perlakuan tersebut untuk mengurangi tingkat kerusakan buah mangga selama penyimpanan. Kombinasi
yang dilakukan yaitu perlakuan khamir (hasil seleksi in vitro dan in vivo) dan kitosan 2% dan disiapkan pula kontrol (tanpa perlakuan) sebagai pembanding
Analisis Data
Pengujian in vitro maupun in vivo menggunakan rancangan acak lengkap dengan 3 ulangan. Perlakuan mencakup penggunaan khamir, kitosan, thiram,
dan kontrol dengan model statitikanya sebagai berikut :
Yij = µ + Ai + εij Keterangan :
Yij : nilai pengamatan dari pengaruh perlakuan ke-i pada ulangan ke-j µ : nilai rata – rata
Ai : pengaruh perlakuan jenis agens pengendali ke-i
22
Data yang diperoleh dianalisis dengan menggunakan program Minitab 15.
Pengaruh perlakuan dianalisis dengan sidik ragam. Apabila terdapat beda nyata
Isolasi dan Identifikasi L. theobromae
Gejala yang tampak pada buah mangga selama penyimpanan sebelum diisolasi
adalah berupa busuk pangkal buah. Mikroba penyebab penyakit ini masuk ke dalam
buah melalui luka pada tangkai ditandai dengan noda warna hitam pada kulit di sekitar
pangkal buah. Bila dibelah terlihat daging buah dan kulit biji yang menghitam dan
membusuk. Koloni L. theobromae menunjukkan pada media PDA berlimpah, berwarna
abu-abu gelap sampai hitam, miselia seperti wool. Pengamatan secara mikroskopis
ditemukan konidia pada awalnya bening, tidak bersepta (aseptate), bulat; bulat telur
sampai elips (jorong), dan berdinding tebal. Konidia yang sudah masak berukuran 20
-30 x 10 - 15 µm, bersepta satu (satu sekat), dan berwarna coklat (Gambar 8).
(a) (b) (c) (d)
Gambar 8 Pengamatan L. theobromae (a) Gejala pada buah mangga; (b) pembentukan
chirus pada pengamatan makroskopis; (c) miselia seperti wool (abu-abu gelap); (d) konidia bersekat satu
Isolasi dan Identifikasi Khamir
Khamir adalah kelompok mikroorganisme uniseluler termasuk dalam filum
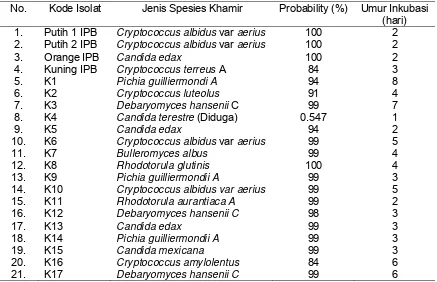
Ascomycota dan Basidiomycota. Hasil identifikasi isolat khamir uji dengan metode
BIOLOGTM menunjukkan spesies yang berbeda–beda. Parameter identifikasi metode
BIOLOGTM ini berdasarkan persentase probability (Tabel 2). Hasil isolasi dari buah
mangga segar diperoleh 20 isolat khamir. Identifikasi isolat khamir tersebut dengan
metode BIOLOGTM diperoleh spesies seperti : Bulleromyces albus, Candida edax,
Candida mexicana, Cryptococcus albidus var aerius, Cryptococcus terreus A,
Cryptococcus luteolus, Cryptococcus amylolentus, Debaryomyces hansenii C, Pichia
guilliermondi A, Rhodotorula aurantiaca A, Rhodotorula glutinis dan tidak teridentifikasi
24
pengendali hayati untuk pengendalian L.theobromae dalam uji in vitro maupun in vivo.
Kesempatan untuk memperoleh agen antagonis yang efektif akan lebih besar dengan
mencari sebanyak mungkin jumlah calon agen antagonis (Baker & Cook 1974).
Warnasuriya et al. (1985) melaporkan di Sri Lanka berhasil diisolasi isolat khamir
dari buah segar dan produk olahan buah – buahan sebanyak 36 strain yang
diidentifikasi menggunakan karakterisasi morfologi dan biokimia. Khamir tersebut
dikelompokkan dalam 6 genus yaitu : Candida (6 strain), Kloeckera (9 strain),
Hanseniaspora (3 strain), Pichia (4 strain), Saccharomyces (3 strain), Torulopsis (1
strain). Paling banyak ditemukan adalah Candida krusei (10 strain).
Tabel 2 Hasil identifikasi khamir dari buah mangga dengan metode BIOLOGTM
No. Kode Isolat Jenis Spesies Khamir Probability (%) Umur Inkubasi (hari)
12. K8 Rhodotorula glutinis 100 4
13. K9 Pichia guilliermondii A 99 3
14. K10 Cryptococcus albidus var aerius 99 5
15. K11 Rhodotorula aurantiaca A 99 2
16. K12 Debaryomyces hansenii C 98 3
17. K13 Candida edax 99 3
18. K14 Pichia guilliermondii A 99 3
19. K15 Candida mexicana 99 3
20. K16 Cryptococcus amylolentus 84 6
21. K17 Debaryomyces hansenii C 99 6
Potensi Penggunaan Khamir, Kitosan, dan Thiram dalam Pengendalian
L.theobromae secara in vitro
Uji Kitinoltik
Pengamatan pengujian aktifitas kitinase dari khamir hasil isolasi pada media agar
kitin yang dilakukan secara kualitatif hampir semua isolat khamir tidak memiliki potensi
kitinolitik kecuali isolat khamir L. albus 7dan C. edax 13 (Gambar 9 dan Tabel 3). Isolat
merupakan salah satu karakteristik aktivitas kitinolitik yang mudah dikenali dan diduga
mampu menghasilkan kitinase. Kitinase dihasilkan oleh khamir dengan menghidrolisis
koloidal kitin asal kulit udang menjadi monomer N-asetil glukosamina sebagai sumber
karbon.
Biasanya mikroorganisme menghasilkan kitinase untuk menghidrolisis berbagai
bentuk kitin yang terdapat di alam dan dimanfaatkan oleh mikroba sebagai sumber
karbon (Yanai et al. 1992). Penambahan kitosan asal kulit udang pada media PDA
mampu menghambat pertumbuhan C. musae baik secara vegetatif maupun reproduktif
(Rogis et al. 2007). Sehubungan potensi kitinolitik kedua isolat tersebut baik, keduanya
dapat digunakan sebagai acuan untuk aplikasi in vivo dalam pengendalian L.
theobromae pada buah mangga (in vivo).
Gambar 9 Uji kitinolitik beberapa khamir secara kualitatif pada media koloidal kitin 0,2% selama 7 hari inkubasi
Tabel 3 Uji kitinolitik beberapa khamir secara kualitatif pada media kitin 0,2% selama 7 hari inkubasi
Keterangan : + = ada zona bening; - = tidak ada zona bening No. Isolat Khamir Uji Kitinolitik
26
Perlakuan Antagonis Khamir, Kitosan, dan Thiram
Lebar zona bening dan tingkat hambatan relatif beberapa khamir terhadap
pertumbuhan koloni L. theobromae pada media PDA (secara in vitro) menunjukkan
pengaruh yang berbeda – beda (Gambar 10). C. albidus var aerius IPB1, C. albidus var
aerius IPB2, C. edax IPB, C. terreus A IPB, C. luteolus, C. edax 13, dan C. albidus var
aerius 6 memiliki daya penghambatan (lebar zona bening dan tingkat hambatan relatif)
yang stabil/tidak berubah sampai dengan 15 hari inkubasi. Penggunaan C. albidus var
aerius IPB1 paling efektif dalam penghambatan pertumbuhan koloni L. theobromae
dibandingkan khamir uji lainnya dan kontrol (beda nyata pada taraf 5%, Lampiran 4, 5,
dan 6) pada semua waktu inkubasi. Hal ini terjadi persaingan ruang antara patogen dan
antagonis. C. albidus var aerius IPB1 dapat digunakan sebagai acuan untuk perlakuan
uji in vivo. Beberapa spesies Cryptococcus digunakan dalam pengendalian penyakit
busuk pascapanen pada buah apel dan pear (Roberts 1990).
0
Gambar 10 Lebar zona hambatan beberapa khamir terhadap pertumbuhan koloni L.
Zona hambatan yang dibentuk diduga adanya mekanisme enzimatik yang
dihasilkan oleh kelima khamir tersebut sehingga terjadi kompetisi makanan oleh
antagonis terhadap patogen (Gambar 10 dan Lampiran 6). Enzim tersebut mampu
mendegradasi dinding sel patogen dengan merangsang proses hidrolisis kandungan
kitin (poli β-1,4-(acetamido-2-deoxy)-D-glucoside yang merupakan komponen terbesar
penyusun dinding sel cendawan (Chet & Henis 1975).
Perlakuan beberapa konsentrasi kitosan terhadap L. theobromae secara in vitro
menunjukkan hasil yang berbeda–beda (Tabel 4). Konsentrasi kitosan efektif dalam
menghambat pertumbuhan L. theobromae mulai hari ke-3 sampai ke-12 inkubasi adalah
2% (berbeda nyata pada taraf 5%, Lampiran 7 dan 8).
Hal tersebut ditunjukkan dengan pertumbuhan diameter koloni L. theobromae
pada hari ke-3 inkubasi paling rendah (0,67 cm) sedangkan tingkat hambatan relatif
paling tinggi (89,74%). Pemberian kitosan akan menghambat pertumbuhan miselia
cendawan patogen dengan adanya aktivitas kitinase, glukanase, serta senyawa
antifungal lain yang dikandung oleh kitosan. Menurut Pumchai et al. (2005) konsentrasi
terbaik kitosan pada media Potato Dextrose Agar (PDA) adalah 2,0% dalam
menghambat pertumbuhan miselia dan spora perkecambahan C. gloeosporioides.
Konsentrasi ini dapat merangsang aktivitas kitinase dan β-1,3-glukanase yang terlibat
dalam mekanisme sistemik pertahanan tanaman. Semakin tinggi konsentrasi yang
diberikan semakin besar pula peng-hambatan terhadap diameter koloni L. theobromae.
Tabel 4 Diameter koloni dan persentase tingkat hambatan relatif L. theobromae dengan
penggunan beberapa konsentrasi kitosan dan thiram pada media PDA selama 12 hari inkubasi
No. Perlakuan Diameter koloni (cm) dan persentase tingkat hambatan relatif L. theobromae inkubasi hari ke-
3 6 9 12 Keterangan : nilai rataan yang diikuti huruf yang sama menunjukkan tidak berbeda nyata dengan uji DMRT pada taraf