POTENSI KITOSAN, KHAMIR, AKTINOMISET DAN
KOMBINASINYA DALAM MENGHAMBAT BUSUK
ANTRAKNOSA (Colletotrichum gloeosporioides (Penz.) Sacc.)
BUAH JAMBU KRISTAL
DESSY KUSUMAWARDHANY
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
DESSY KUSUMAWARDHANY. Potensi Kitosan, Khamir, Aktinomiset dan Kombinasinya dalam Menghambat Busuk Antraknosa (Colletotrichum gloeosporioides (Penz.) Sacc.) Buah Jambu Kristal. Dibimbing oleh MEITY SURADJI SINAGA.
Busuk antraknosa yang disebabkan C. gloeosporioides merupakan salah satu penyakit penting pada buah jambu kristal selama di penyimpanan. Pengendalian biologi dengan menggunakan kitosan, khamir, aktinomiset dan kombinasinya menjadi alternatif pengendalian yang menjanjikan terhadap penyakit pascapanen pada buah-buahan. Studi ini bertujuan untuk mengevaluasi potensi kitosan, khamir, aktinomiset dan kombinasinya dalam menghambat busuk antraknosa pada buah jambu kristal. Pengujian dilakukan secara in vitro dengan metode peracunan media dan in vivo dengan pelapisan larutan kitosan, suspensi khamir, suspensi aktinomiset dan kombinasinya pada buah jambu kristal. Hasil uji in vitro menunjukkan perlakuan suspensi YP, APS5, dan kombinasinya lebih efektif menghambat cendawan C. gloeosporioides dibandingkan dengan perlakuan metabolit saja. Hasil uji in vivo dengan inokulasi patogen menunjukkan tingkat keparahan penyakit pada perlakuan YP+APS5sus, YPsus, CT, APS5sus, CT+APS5sus, dan CT+YPsus lebih kecil atau berbeda nyata dibandingkan kontrol. Pelapisan larutan CT, suspensi APS5 dan CT+APS pada buah jambu kristal paling efektif untuk mempertahankan ketegaran buah dan memperpanjang daya simpan jambu kristal.
Kata kunci: aktinomiset, busuk antraknosa, Colletotrichum gloeosporioides, jambu kristal, khamir, kitosan, kombinasi.
ABSTRACT
DESSY KUSUMAWARDHANY. (Potencial of Chitosan, Yeast, Actinomycetes and Their Combination in Suppressing Crystal Guava Anthracnose (Colletotrichum
gloeosporioides (Penz.) Sacc.). Supervised by MEITY SURADJI SINAGA.
Anthracnose due to C. gloeosporioides is one of important disease on crystal guava during storage. Biological control using chitosan, yeast, actinomycetes and their combination are a promising alternative to control postharvest diseases of fruits. The study has been designed to evaluate the potencial of chitosan, yeast, actinomycetes and their combination in suppressing crystal guava anthracnose. In vitro evaluated has been done by poisoning tests methods and in vivo evaluated has been done by coating a solution of chitosan, suspension of yeast, suspension of actinomycetes and their combination on the crystal guava. The result of in vitro test showed that suspension of YP, APS5, and their combination are more effective in suppressing C. gloeosporioides than experiments with using metabolit only. The result of in vivo test with inoculation pathogen showed that severity disease of YP+APS5sus, YPsus, CT, APS5sus, CT+APS5sus, and CT+YPsus are smaller or significantly different with control. The coating of solution CT, suspension of APS5 and CT+APS5 on crystal guava are most effective to maintained fruits rigidity and extending the shelf life of crystal guava. Keywords: actinomycetes, anthracnose, chitosan, Colletotrichum gloeosporioides,
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apa pun tanpa izin IPB
POTENSI KITOSAN, KHAMIR, AKTINOMISET DAN
KOMBINASINYA DALAM MENGHAMBAT BUSUK
ANTRAKNOSA (Colletotrichum gloeosporioides (Penz.) Sacc.)
BUAH JAMBU KRISTAL
DESSY KUSUMAWARDHANY
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Potensi Kitosan, Khamir, Aktinomiset dan Kombinasinya dalam Menghambat Busuk Antraknosa (Colletotrichum
gloeosporioides (Penz.) Sacc.) Buah Jambu Kristal
Nama Mahasiswa: Dessy Kusumawardhany NIM : A34090077
Disetujui oleh
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi. Ketua Departemen
6
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul “Potensi Kitosan, Khamir, Aktinomiset dan Kombinasinya dalam Menghambat Busuk Antraknosa (Colletotrichum gloeosporioides (Penz.) Sacc.) Buah Jambu Kristal”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman dari bulan Februari hingga Juli 2013.
Terima kasih penulis ucapkan kepada:
1. Keluarga tercinta (ayah, ibu, kakak, serta seluruh keluarga) atas doa, semangat, dukungan, dan kasih sayangnya.
2. Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. selaku dosen pembimbing yang telah memberikan bimbingan, arahan, saran, serta pengetahuan kepada penulis selama melaksanakan penelitian hingga penyusunan skripsi. 3. Dr. Ir. Ruly Anwar, M.Si. selaku dosen penguji tamu yang telah
memberikan saran dan masukan.
4. Dr. Ir. Teguh Santoso, DEA. selaku dosen pembimbing akademik yang telah membimbing penulis selama berkuliah di Departemen Proteksi Tanaman.
5. Teman-teman Departemen Proteksi Tanaman angkatan 46 yang telah memberikan motivasi dan dukungan yang sangat berharga.
Penulis menyadari bahwa masih banyak kekurangan dalam skripsi ini. Oleh karena itu, penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan skripsi ini.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Waktu dan Tempat Penelitian 4
Metode 4
Persiapan bahan-bahan 4
Isolasi Cendawan Patogen dari Bahan Tanaman Sakit 4 Peremajaan Agens Antagonis 4 Pembuatan Larutan Kitosan 4 Penyediaan Metabolit Sekunder Khamir dan Aktinomiset 4 Penyediaan Suspensi Khamir dan Aktinomiset 5 Uji Penghambatan In Vitro 5
Uji Keefektifan In Vivo 5
Rancangan Percobaan dan Analisis Data 6
HASIL DAN PEMBAHASAN 7
Isolasi Cendawan Patogen 7
Uji Penghambatan In Vitro 7
Uji Keefektifan In Vivo 9
PENUTUP 13
Kesimpulan 13
Saran 13
DAFTAR PUSTAKA 14
DAFTAR TABEL
1 Hambatan relatif (% HR) masing-masing perlakuan terhadap
pertumbuhan C. gloeosporioides pada media PDA dari 1 hingga
7 HSI 8
2 Pengaruh pelapisan kitosan, khamir, aktinomiset dan kombinasinya terhadap keparahan penyakit busuk antraknosa pada buah jambu kristal dengan pengujian in vivo (inokulasi patogen) 10 3 Pengaruh pelapisan kitosan, khamir, aktinomiset dan kombinasinya
terhadap keparahan penyakit busuk antraknosa serta ketegaran buah jambu kristal dengan pengujian in vivo tanpa inokulasi patogen pada
10 HSI 11
DAFTAR GAMBAR
1 Kultur cendawan C. gloeosporioides 7 HSI pada media PDA (a); morfologi cendawan C. gloeosporioides dibawah mikroskop dengan
perbesaran 40 x 10 yaitu, seta (b), aservulus (c), dan konidia (d). 7 2 Perbedaan diameter koloni C. gloeosporioides pada uji in vitro 7 HSI
yaitu perlakuan YP+APS5sus (a), CT (b), YPsus (c), APS5sus (d), CT+APS5sus (e), CT+YPsus (f), CT+YPmet (g), APS5met (h),
CT+APS5met (i), YP+APS5met (j), YPmet (k), dan kontrol (l). 8 3 Keparahan penyakit busuk antraknosa pada setiap perlakuan dengan uji
in vivo (inokulasi patogen) pada 10 HSI, yaitu perlakuan YP+APS5sus
(a), YPsus (b), CT (c), APS5sus (d), CT+APS5sus (e), CT+YPsus (f),
dan kontrol (g) 10
4 Ketegaran buah jambu kristal pada setiap perlakuan dengan uji in vivo (tanpa inokulasi patogen) pada 10 HSI, yaitu perlakuan CT (a), APS5sus (b), CT+APS5sus (c), YP+APS5sus (d), YPsus (e),
DAFTAR LAMPIRAN
1 Kitosan 17
2 Isolat agens antagonis khamir (YP) dan aktinomiset (APS5) 17 3 Diameter pertumbuhan C. gloeosporioides pada masing-masing
perlakuan dari 1 hingga 7 HSI secara in vitro 17 4 Pengaruh pemberian kitosan, khamir, aktinomiset, dan kombinasinya
terhadap keparahan penyakit busuk antraknosa pada buah jambu kristal dengan pengujian in vivo dengan inokulasi patogen dari 1
hingga 10 HSI 18
5 Pengaruh pemberian kitosan, khamir, aktinomiset, dan kombinasinya terhadap keparahan penyakit busuk antraknosa pada buah jambu kristal dengan pengujian in vivo tanpa inokulasi patogen dari 1
PENDAHULUAN
Latar Belakang
Jambu kristal (Psidium guajava L.) merupakan salah satu produk hortikultura yang mempunyai nilai ekonomi tinggi dan potensi pasar yang baik. Buah ini juga baik untuk kesehatan jika dikonsumsi karena mengandung vitamin A dan C dalam jumlah yang tinggi. Namun, produk hortikultura ini tidak terhindar dari masalah hama dan penyakit tanaman. Salah satu penyakit penting pada buah jambu kristal selama di lapangan hingga penyimpanan adalah busuk antraknosa yang disebabkan oleh cendawan Colletotrichum gloeosporioides (Penz.) Sacc.). C. gloeosporioides merupakan bentuk anamorf dari Glomerella cingulata (CAB Internasional 2007). Adapun nama lain dari cendawan ini adalah Glomerella psidii (Del) Sheld,
Gloeosporium psidii (Del), Gloeosporium fructigenum Berk, dan Colletotrichum psidii Curzi (Cahyono 2010).
Penyakit busuk antraknosa dapat menyerang semua bagian tanaman, kecuali akar. Bagian tanaman seperti pucuk, daun muda, dan ranting akan mudah terinfeksi penyakit ini ketika masih lunak (Cahyono 2010), namun serangan utama penyakit ini adalah bagian tanaman yang bernilai ekonomis yaitu pada buah (Dickman 1993). Gejala serangan pada buah ditandai dengan adanya bercak-bercak coklat atau hitam yang agak cekung ke dalam (Amusa et al. 2006). Seringkali bercak-bercak tersebut mengumpul pada bagian pangkal buah, sehingga buah yang terinfeksi tidak dapat dikonsumsi (Indratmi 2009). Pada kondisi yang sesuai untuk perkembangannya, kerusakan buah akibat penyakit busuk antraknosa dapat mencapai lebih dari 50% (Hashem dan Alamri 2009). Pada survey yang dilakukan Amusa et al. (2006) di tiga lokasi penelitian di Ibadan Nigeria, sekitar 80% tanaman jambu biji terinfeksi oleh penyakit busuk antraknosa dan lebih dari 40% buah yang diproduksi pada tanaman terinfeksi tersebut menunjukkan infeksi yang parah.
Faktor yang mendukung berkembangnya penyakit busuk antraknosa adalah kondisi yang lembab dan teduh. Soesanto (2006) menyatakan suhu dan kelembaban yang tinggi berperan dalam pertumbuhan cendawan ini, disamping tingkat ketahanan dan kerentanan inangnya. Suhu optimum bagi pertumbuhan cendawan
C. gloeosporioides adalah 26-28.5 0C. Pada kondisi tersebut, cendawan yang telah
menginfeksi buah akan membentuk massa spora berwarna merah salmon dalam lingkaran-lingkaran sepusat pada permukaan bercak.
Hingga saat ini penggunaan fungisida sintetik masih menjadi langkah andalan untuk mengurangi kerugian dan kehilangan hasil akibat penyakit busuk antraknosa (Kefialew dan Ayalew 2008). Penggunaan fungisida secara intensif memberikan banyak dampak negatif, diantaranya resistensi patogen terhadap fungisida, serta tertinggalnya residu bahan kimia pada produk pertanian. Untuk mengurangi intensitas penggunaan fungisida, metode perlindungan tanaman yang lebih lestari dan aman bagi konsumen perlu dikembangkan (Indratmi 2009), misalnya dengan pengendalian hayati. Strategi umum pengendalian hayati adalah penggunaan mikroorganisme antagonis dalam pengendalian penyakit pascapanen dan prapanen. Beberapa pendekatan biologi termasuk penggunaan mikroorganisme antagonis atau bahan alami telah dikembangkan sebagai alternatif penggunaan fungisida sintetik untuk pengelolaan penyakit pascapanen dan mengendalikan pembusukan buah dan sayuran pascapanen (Janisiewicz dan Korsten 2002). Kitosan, khamir, dan
2
aktinomiset, dan kombinasinya berpotensi baik untuk dikembangkan sebagai alternatif pengendalian yang aman bagi makhluk hidup dan lingkungan.
Kitosan merupakan produk turunan dari polimer kitin yang berbahan baku limbah kulit udang. Kitosan telah banyak dimanfaatkan diberbagai bidang seperti medis, kosmetik, makanan, termasuk juga dalam pengendalian penyakit tanaman dan peningkatan daya simpan produk pascapanen (Aranaz et al. 2009). Kitosan dapat menginduksi enzim kitinase pada jaringan tanaman. Enzim kitinase merupakan enzim yang dapat mendegradasi kitin yang merupakan penyusun utama dinding sel cendawan. Kitosan telah terbukti sebagai agen antimikroba sehingga dapat diaplikasikan sebagai pelapis pada berbagai jenis makanan, termasuk buah-buahan. Bautista-Banos (2003) melaporkan penggunaan kitosan mampu menekan pertumbuhan Fusarium oxysporum, Rhizopus stolonifer, Penicillium digitatum dan
C. gloeosporioides. Studi lain melaporkan penambahan kitosan dari kulit udang
pada media PDA mampu menghambat pertumbuhan Colletotrichum musae baik secara vegetatif maupun reproduktif (Rogis et al. 2007).
Khamir merupakan kelompok mikroorganisme uniseluler yang termasuk dalam filum Ascomycota dan Basidiomycota (Gandjar et al. 2006). Keuntungan dari penggunaan khamir antagonis adalah dapat diisolasi dari alam, bersifat non patogenik terhadap tanaman dan binatang termasuk manusia, mudah dibiakkan, serta reproduksinya cepat (Payne dan Bruce 2001), selain itu sel khamir juga mengandung vitamin dan asam amino penting yang telah banyak dimanfaatkan dalam makanan dan pakan (Hashem dan Alamri 2009). Khamir umumnya memerlukan nutrisi dengan ikatan rantai C sederhana dan mampu mengkolonisasi permukaan inang dalam kondisi kering pada waktu yang cukup lama seperti fungisida yang umum digunakan pada perlakuan pascapanen. Sugiprihatini et al. (2011) melaporkan penggunaan khamir Cryptococcus albidus var. aerius efektif menghambat perkembangan penyakit busuk buah (Botryodiplodia theobromae) pada buah mangga hingga mencapai 70.83%. Payne dan Bruce (2001) menyatakan khamir Debaryomyces sp. dan Pichia guilliermondii efektif menghambat perkembangan penyakit antraknosa yang disebabkan cendawan C. gloeosporioides. Aktinomiset merupakan kelompok besar dari bakteri berbentuk filamen yang termasuk dalam filum Actinobacteria dan pada umunya bersifat gram positif. Bakteri ini menghasilkan eksospora yang dapat bertahan dalam kondisi yang tidak menguntungkan, seperti rendahnya kadar air dan suhu tinggi, serta dapat bertahan dalam waktu yang lama (Schaad et al. 2000). Aktinomiset mampu mensintesis berbagai senyawa bioaktif (metabolit) diantaranya antibiotik, antiparasitik, antibakteri, antifungi, antioksidan, antitumor, antiviral, dan enzim ekstraseluler seperti selulase dan xylanase yang penting dalam industri, obat-obatan, dan pertanian (Oskay et al. 2004 dan George et al. 2011). Crawford (1993) melaporkan penggunaan aktinomiset yang berasal dari rizosfer dan non rizosfer efektif mengendalikan patogen akar Pythium ultimum pada tanaman selada.
Perlakuan kombinasi memiliki potensi yang besar dalam mengendalikan suatu patogen apabila kedua agens yang digunakan dapat bekerja secara sinersis. Kwok et al. (1987) melaporkan kombinasi bakteri antagonis dengan cendawan
Trichoderma hamatum lebih efektif menekan penyakit yang disebabkan Rhizoctonia solani dibandingkan perlakuan tunggal.
3
Tujuan Penelitian
Penelitian ini bertujuan mengevaluasi potensi kitosan, khamir, aktinomiset dan kombinasinya dalam menghambat busuk antraknosa (C. gloeosporioides) pada buah jambu kristal.
Manfaat Penelitian
Manfaat dari penelitian diharapkan dapat memberikan informasi tambahan mengenai potensi kitosan, khamir, aktinomiset dan kombinasinya dalam menghambat busuk antraknosa (C. gloeosporioides) pada buah jambu kristal, sehingga dapat dikembangkan menjadi salah satu alternatif pengendalian yang aman dan ramah lingkungan.
4
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Percobaan dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari bulan Februari hingga Juli 2013.
Metode Persiapan bahan-bahan
Isolasi Cendawan Patogen dari Bahan Tanaman Sakit. Metode yang
digunakan pada saat isolasi cendawan patogen dari bahan tanaman sakit mengacu pada studi Indratmi (2009). Sampel buah jambu kristal yang menunjukkan gejala busuk antraknosa diperoleh dari toko buah di sekitar daerah Dramaga, Bogor. Isolasi patogen dilakukan dengan menggunakan metode pemotongan jaringan, yaitu memotong jaringan buah jambu kristal diantara bagian sehat dan sakit sepanjang 0.5 x 0.5 cm. Potongan jaringan buah tersebut disterilisasi permukaan dengan alkohol 70%, kemudian direndam dalam natrium hipoklorit (NaOCl) 1% selama 3 menit, dibilas menggunakan air steril sebanyak 3 kali pembilasan, lalu dikeringanginkan. Setelah kering, potongan jaringan buah jambu kristal ditumbuhkan pada media Potato Dextrose Agar (PDA) dan diinkubasi pada suhu ruang. Koloni C. gloeosporioides yang tumbuh dimurnikan pada media PDA baru dan diremajakan sesuai kebutuhan.
Peremajaan Agens Antagonis.Isolat khamir (YP) dan aktinomiset (APS5) yang digunakan merupakan koleksi Laboratorium Klinik Tanaman dan Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, IPB. Peremajaan isolat murni YP dilakukan dengan menumbuhkannya pada media PDA, sedangkan APS5 pada media Casamino Acids-yeast extract-glucose-agar (YCED) melalui penggoresan sebanyak satu lup masing-masing agens antagonis dan diinkubasi pada suhu ruang selama 7 hari.
Pembuatan Larutan Kitosan. Kitosan (CT) diperoleh dari Departemen
Teknologi Hasil Perikanan, Fakultas Perikanan dan Ilmu Kelautan, IPB yang berasal dari kulit udang. Konsentrasi kitosan yang digunakan dalam uji in vitro dan
in vivo adalah 1%. Larutan kitosan dengan konsentrasi 1% diperoleh dengan
melarutkan sebanyak 1 gram kitosan dengan 30 ml asam asetat 1.5% dan 70 ml aquades.
Penyediaan Metabolit Sekunder Khamir dan Aktinomiset. Metode yang
digunakan pada saat penyediaan metabolit sekunder YP dan APS5 mengacu pada studi Sitompul (2013). Sebanyak satu lup YP dan APS5 yang berumur 7 hari diinokulasikan ke dalam 10 ml media cair Potato Dextrose Broth (PDB) untuk YP, dan 10 ml media cair Luria Broth (LB) untuk APS5. Selanjutnya kedua biakan diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm selama 4 hari. Media cair PDB dan LB yang mengandung biakan YP dan APS5 dimasukkan ke dalam tabung ependorff masing-masing sebanyak 1 ml, lalu disentrifugasi dengan
5 kecepatan 12000 rpm selama 15 menit hingga diperoleh supernatan yang mengandung senyawa bioaktif YP dan APS5. Supernatan YP dan APS5 disaring dengan millipore ukuran 0.22 μm untuk memperoleh senyawa bioaktif dari masing-masing agens antagonis yang steril. Konsentrasi metabolit YP dan APS5 yang digunakan dalam uji in vitro dan in vivo adalah 10%.
Penyediaan Suspensi Khamir dan Aktinomiset. Sebanyak satu lup YP
dan APS5 yang berumur 7 hari diinokulasikan ke dalam 10 ml media cair PDB untuk YP, dan 10 ml media cair LB untuk APS5. Selanjutnya kedua biakan diinkubasi pada inkubator bergoyang dengan kecepatan 100 rpm selama 4 hari hingga diperoleh suspensi dari YP dan APS5. Konsentrasi suspensi YP dan APS5 yang digunakan dalam uji in vitro dan in vivo adalah 10%.
Uji Penghambatan In Vitro
Uji penghambatan in vitro dilakukan dengan metode peracunan media. Larutan CT serta metabolit dan suspensi dari YP dan APS5 dicampurkan ke dalam media PDA yang telah dicairkan dengan suhu kurang lebih 50 0C sesuai perlakuan. Selanjutnya isolat C. gloeosporioides yang berumur 7 hari ditanam di tengah media. Pengamatan penghambatan tiap perlakuan dilakukan selama 7 hari dengan mengukur diameter pertumbuhan koloni cendawan C. gloeosporioides.
Perlakuan-perlakuan yang digunakan pada uji penghambatan in vitro diantaranya:
1. Kitosan tunggal (CT)
2. Metabolit khamir tunggal (YPmet) 3. Suspensi khamir tunggal (YPsus)
4. Metabolit aktinomiset tunggal (APS5met) 5. Suspensi aktinomiset tunggal (APS5sus)
6. Metabolit kombinasi kitosan dan khamir (CT+YPmet) 7. Suspensi kombinasi kitosan dan khamir (CT+YPsus)
8. Metabolit kombinasi kitosan dan aktinomiset (CT+APS5met) 9. Suspensi kombinasi kitosan dan aktinomiset (CT+APS5sus) 10. Metabolit kombinasi khamir dan aktinomiset (YP+APS5met) 11. Suspensi kombinasi khamir dan aktinomiset (YP+APS5sus) 12. Kontrol
Hambatan relatif (% HR) dari perlakuan uji dihitung dengan menggunakan rumus:
HR (%) =Dk − Dp
Dk 𝑥 100% Keterangan :
Dk = diameter koloni C. gloeosporioides pada kontrol (cm) Dp = diameter koloni C. gloeosporioides pada perlakuan (cm)
Uji Keefektifan In Vivo
Uji keefektifan in vivo terdiri dari 2 macam pengujian yaitu pengujian dengan inokulasi patogen dan pengujian tanpa inokulasi patogen. Buah jambu kristal sehat dicuci bersih dengan air steril, kemudian dikeringanginkan. Selanjutnya buah tersebut direndam dalam larutan CT, YP, APS5 maupun kombinasinya sesuai perlakuan. Khusus untuk kontrol perendaman buah jambu kristal dilakukan ke
6
dalam aquades steril. Untuk pengujian in vivo dengan inokulasi patogen, cendawan
C. gloeosporioides yang berumur 7 hari diinokulasikan pada permukaan atas buah
jambu kristal yang telah dilukai sebelumnya dengan jarum steril, sedangkan untuk pengujian tanpa inokulasi patogen cukup dilakukan perendaman pada setiap perlakuan yang ditetapkan. Setelah itu, buah jambu kristal (sesuai perlakuan) disimpan dalam baki steril berukuran 40 cm x 30 cm yang dilapisi kertas yang sudah dilembabkan. Baki dibungkus dengan menggunakan plastik bening untuk menjaga kelembaban.
Perlakuan-perlakuan yang digunakan pada uji keefektifan in vivo diantaranya:
1. Kitosan tunggal (CT)
2. Suspensi khamir tunggal(YPsus)
3. Suspensi aktinomiset tunggal (APS5sus)
4. Suspensi kombinasi kitosan dan khamir (CT+YPsus)
5. Suspensi kombinasi kitosan dan aktinomiset (CT+APS5sus) 6. Suspensi kombinasi khamir dan aktinomiset (YP+APS5sus) 7. Kontrol
Pengamatan uji keefektifan in vivo dilakukan dengan menghitung keparahan penyakit busuk antraknosa yang muncul pada buah kristal serta mengamati tingkat ketegaran buah serta selama 10 hari. Keparahan penyakit (% KP) dihitung dengan menggunakan rumus:
Σ (jumlah sampel per kategori x skor keparahan)
KP = x 100%
Jumlah sampel yang diamati x skor tertinggi
Skor tiap kategori serangan mengacu pada James (1971) dengan modifikasinya:
0 = tidak ada perkembangan bercak (sehat) 1 = 0 < x ≤ 10% (bercak ringan pada buah) 2 = 10 < x ≤ 20% (bercak sedang pada buah)
3 = 20 < x ≤ 30% (bercak luas disertai busuk sedang pada buah) 4 = x > 30% (bercak luas disertai busuk berat pada buah) Kriteria ketegaran buah jambu kristal setelah perlakuan adalah: ++++ = sangat tegar; +++ = tegar; ++ = lunak; + = busuk dan lunak.
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan pada uji penghambatan in vitro dan uji keefektifan in vivo yaitu rancangan acak lengkap (RAL), dengan 4 ulangan. Data yang diperoleh dianalisis ragam (ANOVA) dengan menggunakan Microsoft Office
Excel 2013 dan program Statistical Analysis System (SAS) versi 9.0. Perlakuan
yang berpengaruh nyata diuji lanjut dengan uji Duncan dengan taraf α=5% (Mattjik
HASIL DAN PEMBAHASAN
Isolasi Cendawan Patogen
Cendawan patogen diisolasi dari buah jambu kristal yang menunjukkan gejala busuk antraknosa. Gejala awal penyakit ini adalah adanya bercak-bercak nekrotik berwarna coklat atau hitam yang agak cekung ke dalam pada kulit buah. Bercak-bercak tersebut akan meluas dan bersatu secara cepat, sehingga pada akhirnya menyebabkan pembusukan. Pada tengah bercak terdapat bagian menghitam yang merupakan aservuli dari cendawan. Munculnya bercak coklat kehitaman pada buah dikarenakan cendawan C. gloeosporioides menghasilkan enzim selulase yang dapat menghidrolisis selulosa kulit buah sehingga kulit buah terdisintegrasi dan lunak. Selanjutnya akan berubah warna menjadi coklat yang dapat meluas dan akhirnya membusuk. Proses pembusukan semakin cepat ketika buah mencapai kematangan puncak (Ippolito dan Nigro 2000).
Kultur C. gloeosporioides hasil isolasi dari jambu kristal terinfeksi memiliki miselium berwarna putih keabuan, serta massa konidia yang berwarna merah muda seperti warna salmon (Gambar 1a). Pengamatan secara mikroskopis menunjukkan bahwa cendawan ini mempunyai konidia yang berbentuk silinder dengan ujung yang membulat atau tumpul, hialin, bersel satu, dan terbentuk dalam aservulus, serta memiliki seta yang berwarna coklat tua (Gambar 1b, c, dan d). Hasil ini sesuai dengan studi Dickman (1993) yang menyatakan bahwa C. gloeosporioides mempunyai miselium berwarna putih hingga keabuan, massa konidia berwarna merah salmon, konidianya berbentuk oval dengan ujung tumpul atau membulat, hialin, bersel satu, tidak bersekat, terbentuk dalam aservulus, dan berukuran 9-15 x 3-7 µm, memiliki seta dengan konidiofor yang sederhana, pendek, dan tegak. Seta berwarna coklat tua, panjang 60-160 µm, sering bersekat 1 atau 2 teratur di tepi aservulus.
.
Gambar 1 Kultur cendawan C. gloeosporioides 7 HSI pada media PDA (a); morfologi cendawan C. gloeosporioides dibawah mikroskop dengan perbesaran 40 x 10 yaitu, seta (b), aservulus (c), dan konidia (d).
Uji Penghambatan In Vitro
Larutan kitosan 1%, khamir 10%, aktinomiset 10% dan kombinasinya pada media PDA mampu menghambat pertumbuhan C. gloeosporioides secara nyata dibandingkan dengan kontrol. Pada perlakuan kontrol pertumbuhan cendawan C.
gloeosporioides dapat memenuhi cawan petri pada 7 hari setelah inokulasi (HSI).
Pada media PDA yang diberi perlakuan kitosan 1%, khamir 10%, aktinomiset 10% dan kombinasinya pertumbuhan cendawan ini tampak terhambat dan tidak sampai memenuhi cawan petri hingga 7 HSI (Gambar 2).
c
b a
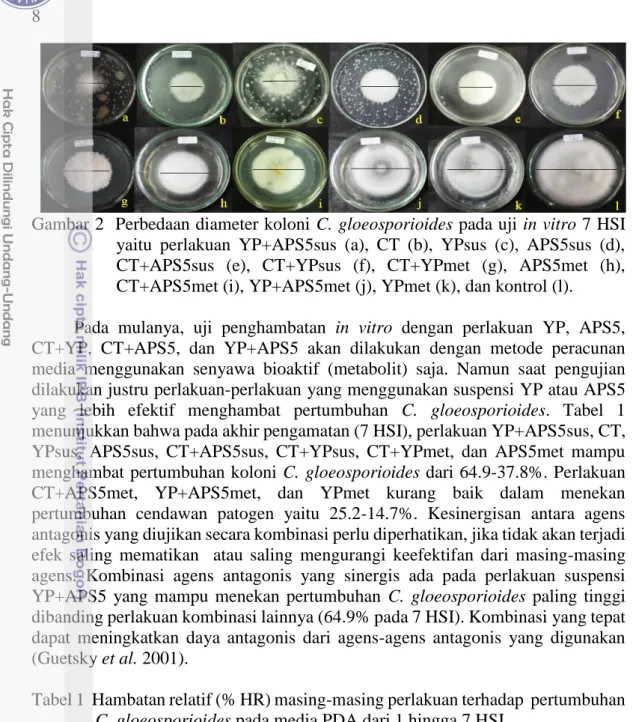
d
8
Gambar 2 Perbedaan diameter koloni C. gloeosporioides pada uji in vitro 7 HSI yaitu perlakuan YP+APS5sus (a), CT (b), YPsus (c), APS5sus (d), CT+APS5sus (e), CT+YPsus (f), CT+YPmet (g), APS5met (h), CT+APS5met (i), YP+APS5met (j), YPmet (k), dan kontrol (l). Pada mulanya, uji penghambatan in vitro dengan perlakuan YP, APS5, CT+YP, CT+APS5, dan YP+APS5 akan dilakukan dengan metode peracunan media menggunakan senyawa bioaktif (metabolit) saja. Namun saat pengujian dilakukan justru perlakuan-perlakuan yang menggunakan suspensi YP atau APS5 yang lebih efektif menghambat pertumbuhan C. gloeosporioides. Tabel 1 menunjukkan bahwa pada akhir pengamatan (7 HSI), perlakuan YP+APS5sus, CT, YPsus, APS5sus, CT+APS5sus, CT+YPsus, CT+YPmet, dan APS5met mampu menghambat pertumbuhan koloni C. gloeosporioides dari 64.9-37.8%. Perlakuan CT+APS5met, YP+APS5met, dan YPmet kurang baik dalam menekan pertumbuhan cendawan patogen yaitu 25.2-14.7%. Kesinergisan antara agens antagonis yang diujikan secara kombinasi perlu diperhatikan, jika tidak akan terjadi efek saling mematikan atau saling mengurangi keefektifan dari masing-masing agens. Kombinasi agens antagonis yang sinergis ada pada perlakuan suspensi YP+APS5 yang mampu menekan pertumbuhan C. gloeosporioides paling tinggi dibanding perlakuan kombinasi lainnya (64.9% pada 7 HSI). Kombinasi yang tepat dapat meningkatkan daya antagonis dari agens-agens antagonis yang digunakan (Guetsky et al. 2001).
Tabel 1 Hambatan relatif (% HR) masing-masing perlakuan terhadap pertumbuhan
C. gloeosporioides pada media PDA dari 1 hingga 7 HSI
Keterangan : a angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda
nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%. HSI
Perlakuan
Hambatan relatif (%)a
1 2 3 4 5 6 7
YP+APS5sus 39.9ab 59.7a 64.4a 68.9a 68.8a 68.6a 64.9a CT 47.8a 53.4ab 53.3b 54.3bc 56.0b 56.9b 56.1ab YPsus 21.4c 33.3e 48.7bc 55.6bc 55.8b 57.1b 55.6ab APS5sus 16.8cd 43.4bcd 51.8b 58.4b 58.6b 58.1b 55.5ab CT+APS5sus 35.3b 42.7cde 46.1bc 46.3de 48.3cd 51.2bc 48.6bc CT+YPsus 33.6b 48.0bc 48.2bc 48.3cd 51.6bc 51.3bc 45.8bc CT+YPmet 38.4ab 37.1de 40.3c 40.0e 43.9d 44.7cd 42.2c
APS5met 19.9c 17.0f 18.8d 24.4f 33.7e 39.4de 37.8c CT+APS5met 46.1a 48.1bc 45.0bc 40.0e 37.2e 31.5e 25.2d YP+APS5met 7.6de 6.1g 5.8e 8.5hf 14.7f 17.2f 15.3d YPmet 20.1c 18.8f 16.2d 17.0g 15.5f 18.7f 14.7d
9 Ada beberapa kemungkinan yang menyebabkan penggunaan metabolit dalam suatu pengujian menjadi kurang efektif, diantaranya rendahnya konsentrasi metabolit yang dihasilkan oleh suatu agens antagonis atau terurai oleh mikroorganisme lain. Kemungkinan lainnya adalah ikut tersaringnya metabolit sekunder yang dihasilkan khamir dan aktinomiset pada saat penyaringan supernatan dengan menggunakan millipore. Adanya pertumbuhan koloni agens antagonis pada media PDA juga diduga dapat berpengaruh terhadap kemampuan suatu agens antagonis dalam menekan pertumbuhan patogen tanaman. Pada perlakuan khamir dan aktinomiset yang menggunakan suspensi, koloni dari masing-masing agens antagonis masih tetap tumbuh sehingga produksi metabolit sekunder masih dapat terus terjadi sedangkan pada perlakuan yang menggunakan metabolit saja, sudah tidak bisa diproduksi metabolit sekunder lagi.
Kemampuan penghambatan kitosan terhadap pertumbuhan cendawan penyebab busuk antraknosa (C. gloeosporioides) diduga karena adanya aktivitas kitinase, glukanase, serta senyawa antifungal lain yang dimiliki kitosan (Vasyukova
et al. 2001). El-Gaouth et al. (1992) menyatakan bahwa pertumbuhan koloni
cendawan patogen dapat terhambat dikarenakan kitosan mengandung enzim β-1.3 glukanase yang dapat menyebabkan penurunan jumlah kitin pada dinding hifa cendawan patogen.
Mekanisme kerja khamir dalam menekan patogen tanaman dapat terjadi melalui kompetisi ruang dan nutrisi, parasitisme, antibiosis, dan lisis (Janisiewicz dan Korsten 2001). Diduga, kompetisi ruang dan nutrisi merupakan mekanisme kerja yang terjadi pada perlakuan YP yang menggunakan suspensi dalam menghambat pertumbuhan C. gloeosporioides, sedangkan mekanisme kerja khamir pada perlakuan YP yang menggunakan metabolit diduga terjadi karena adanya kontak langsung antara metabolit sekunder yang dihasilkan YP dengan cendawan
C. gloeosporioides. Indratmi (2009) menyatakan bahwa kejadian antagonis dapat
terjadi karena adanya kontak langsung antara agens antagonis dengan patogen, maupun antara senyawa/zat yang dihasilkan agens antagonis berupa metabolit sekunder yang toksik pada patogen atau enzim yang mampu mendegradasi dinding sel cendawan patogen.
Franco-Gonzales dan Hernandez (2009) menyatakan bahwa mekanisme kerja aktinomiset dalam menekan pertumbuhan patogen tanaman dapat terjadi melalui antibiosis, kompetisi ruang dan nutrisi, serta parasitisme. Diduga kompetisi ruang dan nutrisi merupakan mekanisme kerja yang terjadi pada perlakuan APS5 yang menggunakan suspensi dalam menghambat pertumbuhan C. gloeosporioides, sedangkan mekanisme kerja aktinomiset pada perlakuan APS5 metabolit diduga karena adanya aktivitas antimikroba yang dihasilkan oleh aktinomiset. Berbagai senyawa antimikrob yang dihasilkan oleh aktinomiset diantaranya tetrasiklin, streptomisin, eritromisin, kloramfenikol, ivermektin, dan rifampisin (Todar 2008).
Uji Keefektifan In Vivo
Perlakuan yang digunakan dalam uji keefektifan in vivo mengacu pada hasil uji penghambatan in vitro, yaitu perlakuan-perlakuan yang memiliki potensi baik dalam menghambat pertumbuhan C. gloeosporioides, diantaranya YP+APS5sus, CT, YPsus, APS5sus, CT+APS5sus, dan CT+YPsus. Selain perlakuan-perlakuan tersebut ada pula kontrol yang digunakan sebagai pembanding.
10
Hasil uji keefektifan in vivo dengan penginokulasian patogen menunjukkan munculnya gejala busuk antraknosa pada semua perlakuan (Gambar 3), namun tingkat keparahan penyakitnya berbeda-beda (Tabel 2). Keparahan penyakit terendah ada pada perlakuan YP+APS5sus, diikuti perlakuan YPsus, CT, APS5sus, CT+APS5sus dan CT+YPsus. Pelapisan buah jambu kristal dengan kitosan, khamir, aktinomiset dan kombinasinya mampu menekan keparahan penyakit busuk antraknosa secara berbeda nyata dibanding kontrol.
Masih berkembangnya penyakit busuk antraknosa pada buah jambu kristal bukan karena agens antagonis yang digunakan tidak efektif, namun selama penelitian berlangsung kondisi lingkungan diatur sesuai untuk timbulnya infeksi cendawan C. gloeosporioides, yaitu melalui pelukaan pada permukaan buah jambu kristal. Pelukaan ini akan menyebabkan hilangnya pertahanan mekanis pada buah. Selain itu cara pengaplikasian kitosan, khamir, aktinomiset dan kombinasinya yang bersamaan dengan penginokulasian patogen menyebabkan berkurangnya daya antagonis semua agens dalam menghambat infeksi patogen. Kitosan akan bekerja optimum apabila diaplikasikan sebelum penginokulasian patogen (Bautista-Banos 2006). Begitu pula dengan khamir, aktinomiset, dan kombinasinya yang masih dalam taraf beradaptasi belum berkolonisasi, sedangkan C. gloeosporioides berada dalam kondisi virulen dan kondisi lingkungan yang sangat mendukung untuk terjadinya infeksi.
Tabel 2 Pengaruh pelapisan kitosan, khamir, aktinomiset dan kombinasinya terhadap keparahan penyakit busuk antraknosa pada buah jambu kristal dengan pengujian in vivo (inokulasi patogen)
Keterangan: a angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda
nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%
Gambar 3 Keparahan penyakit busuk antraknosa pada setiap perlakuan dengan uji
in vivo (inokulasi patogen) pada 10 HSI, yaitu perlakuan YP+APS5sus
(a), YPsus (b), CT (c), APS5sus (d), CT+APS5sus (e), CT+YPsus (f), dan kontrol (g).
HSI Perlakuan
Keparahan penyakit (%)a
2 4 6 8 10
Kontrol 10.9a 23.4a 32.8a 40.6a 60.9a CT+YPsus 6.2ab 25.0a 25.0b 39.1ab 42.2b CT+APS5sus 6.2ab 25.0a 28.1ab 32.8abc 35.9bc
APS5sus 6.2ab 25.0a 25.0b 31.2bc 34.4bc CT 6.2ab 23.4a 28.1ab 28.1c 32.8c YPsus 6.2ab 23.4a 26.6b 31.2bc 32.8c YP+APS5sus 4.7b 23.4a 25.0b 28.1c 29.7c
11 Hasil pengujian in vivo tanpa inokulasi patogen menunjukkan tingkat keparahan penyakit busuk antraknosa yang tidak berbeda nyata untuk semua perlakuan (Tabel 3). Munculnya gejala busuk antraknosa pada perlakuan CT+APS5sus bukan karena perlakuan ini tidak efektif, namun diduga terjadi karena infeksi penyakit busuk antraknosa yang bersifat laten. Secara visual, penampilan buah jambu kristal yang diberi perlakuan CT, APS5sus, CT+APS5sus, YP+APS5sus, YPsus, dan CT+YPsus tidak jauh berbeda, kecuali kontrol (Gambar 4). Buah jambu kristal yang diberi perlakuan tampak tetap segar hingga 10 HSI sedangkan pada kontrol terserang cendawan patogen lain, penampilan buahnya menjadi busuk dan berair, ketika ditekan teksturnya lunak dan mudah hancur. Pelapisan buah jambu kristal dengan kitosan, khamir, aktinomiset dan kombinasinya mampu mempertahankan ketegaran buah jambu kristal hingga 10 HSI dibanding kontrol (Tabel 3).
Tabel 3 Pengaruh pelapisan kitosan, khamir, aktinomiset dan kombinasinya terhadap keparahan penyakit busuk antraknosa serta ketegaran buah jambu kristal dengan pengujian in vivo tanpa inokulasi patogen pada 10 HSI
Keterangan: a angka-angka pada kolom yang sama yang diikuti oleh huruf yang sama tidak berbeda
nyata berdasarkan uji selang berganda Duncan pada taraf nyata 5%.
b keterangan tanda menunjukkan + busuk dan lunak, ++ lunak, +++ tegar, ++++ sangat
tegar.
Gambar 4 Ketegaran buah jambu kristal pada setiap perlakuan dengan uji in vivo (tanpa inokulasi patogen) pada 10 HSI, yaitu perlakuan CT (a), APS5sus (b), CT+APS5sus (c), YP+APS5sus (d), YPsus (e), CT+YPsus (f), dan kontrol (g)
Penggunaan kitosan sebagai pelapis dalam buah-buahan dapat menghambat difusi oksigen ke dalam buah sehingga proses respirasi dapat dihambat (El-Ghaouth
et al. 1992). Respirasi rendah dapat mengakibatkan pemecahan pati termasuk gula
berjalan lambat sehingga proses kematangan buah semakin lambat pula. Khamir dapat menunda pemasakan buah dengan menghambat produksi etilen dan menghasilkan enzim yang berpotensi menghambat, menekan, dan merangsang beberapa jenis respon pertahanan inang (Droby et al. 1997). Aktinomiset
Perlakuan Keparahan penyakit (%)a Ketegaran buahb
YP+APS5sus 0.0a +++ YPsus 0.0a +++ CT 0.0a ++++ APS5sus 0.0a ++++ CT+APS5sus 2.5a ++++ CT+YPsus 0.0a ++ Kontrol 0.0a +
a
b
c
d
e
f
g
12
mempunyai kapasitas metabolisme yang bersifat antimikroba (Oskay et al. 2004). Jika proses pematangan buah dapat dihambat, maka ketegaran buah dapat dipertahankan dalam waktu yang lebih lama, sehingga daya simpan buah jambu kristal dapat diperpanjang. Begitu pula dengan dihasilkannya senyawa antimikrob dan enzim tertentu, yang dapat merangsang respon pertahanan buah terhadap serangan patogen. Penggunaan kitosan, khamir, aktinomiset dan kombinasinya dapat menjadi alternatif pengendalian penyakit-penyakit pascapanen pada komoditas pertanian.
13
PENUTUP
Kesimpulan
Berdasarkan hasil uji penghambatan in vitro perlakuan-perlakuan yang menunjukkan potensi baik dalam menghambat pertumbuhan C. gloeosporioides pada media PDA adalah perlakuan kitosan 1%, suspensi khamir 10%, suspensi aktinomiset 10% dan kombinasinya. Hasil uji keefektifan in vivo juga menunjukkan bahwa pelapisan perlakuan-perlakuan tersebut pada buah jambu kristal mampu menekan tingkat keparahan penyakit busuk antraknosa dan mempertahankan ketegaran buah jambu kristal hingga 10 HSI. Penggunaan kitosan, khamir, aktinomiset dan kombinasinya dapat menjadi alternatif pengendalian penyakit pascapanen pada buah-buahan, khususnya busuk antraknosa pada buah jambu kristal yang disebabkan cendawan C. gloeosporioides.
Saran
Perlu dilakukan penelitian lanjut untuk mengetahui tingkat keparahan penyakit busuk antraknosa jika kitosan, khamir, aktinomiset dan kombinasinya diaplikasikan tidak bersamaan dengan penginokulasian patogen, selain itu perlu dilakukan pengujian tingkat keamanan terhadap penggunaan kitosan, khamir, aktinomiset dan kombinasinya apabila dikonsumsi manusia.
14
DAFTAR PUSTAKA
Amusa NA, Ashaye OA, Amadi J, Oladapo O. 2006. Guava fruit anthracnose and the effects on its nutritional and market values in Ibadan, Nigeria. J Appl Sci. 6(3):539-543.
Aranaz I, Mengibar M, Harris R, Panos I, Miralles B, Acosta N, Galed G, Heras A. 2009. Functional characterization of chitin and chitosan. Cur Chem Biol. 3:303-230.
Bautista-Banos S, Hernandez-Lauzardoa AN, Velazquez-del Valle MG, Hernandez-Lopez M, Barka EA, Bosquez-Molina E, Wilson CL. 2006. Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities. Crop Prot. 25:108-118. doi:10.1016. Bautista-Banos S, Hernandez-Lopez M, Bosquez-Molina E, Wilson CL. 2003.
Effects of chitosan and plant extracts on growth of Colletotrichum
gloeosporioides, anthracnose levels and quality of papaya fruit. Crop Prot.
22:1087-1092. doi:10.1016.
Cahyono B. 2010. Sukses Budi Daya Jambu Biji di Pekarangan dan Perkebunan. Yogyakarta (ID): Lily Publisher.
[CABI] CAB International. 2007. Crop Protection Compendium (CD-ROM). Wallingford (GB): CABI.
Crawford DL, Lynch JM, Whipps JM, Qusley MA. 1993. Isolation and characterization of actinomyceteses antagonists of a fungal root phatogen.
Appl Environ Microbiol. [Internet]. [diunduh 2013 Jan 22];
59(11):3899-3905. Tersedia pada:http://www.ncbi.nlm.nih.gov/pmc/articel/PMC182547/. Dickman KB. 1994. Part V. Papaya: Anthracnose. Di dalam: Ploetz RC, Zentmyer GA, Nishijima WT, Rohrbach KG, Ohr HD, editor. Compendium of Tropical
Fruit Diseases. St Paul (US): APS Press. hlm 58-59.
Droby S, Wisniewski ME, Cohen L, Weiss B, Touitou D, Eilam Y, Chalutz E. 1997. Influence of CaCl2 on Penicillium digitatum, grape fruit peel tissue, and biocontrol activity of Pichia guilliermondii. Phytopathology. 87(3):310-315. El Ghaouth A, Ponnampalan R, Castaigne F, Arul J. 1992. Chitosan coating to
extend the storage life of tomatoes. HortScience. 27(9):1016-1018.
Franco-Gonzalez AC, Hernandez LR. 2009. Actinomycetes as biological control agents of phytopathogenic fungi. Techno Chih. 3(2):64-73.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Yayasan Obor Indonesia, Jakarta.
George M, Anjumol, George G, Hatha AAM. 2011. Distribution and bioactive potential of soil actinomycetes from different ecological habitats. Afric J
Microbiol Res. 6(10): 2265-2271. doi: 10.5897/AJMR11.856.
Guetsky R, Shtienberg D, Elad Y, Dinoor A. 2001. Combining biocontrol agents to reduce the variability of biological control. Phytopathology. 91:621-627. Hashem M, Alamri S. 2009. The biocontrol of postharvest disease (Botryodiplodia
theobromae) of guava (Psidium guajava L.) by the application of yeast
strains. Postharvest Biol Technol. 53:123-130.
Indratmi D. 2009. Penggunaan Debaryomyces sp. dan Schizosaccharomyces sp. dengan adjuvant untuk pengendalian penyakit antraknosa pada mangga.
15 Ippolito A, Nigro F. 2000. Impact of postharvest of biological control agents on
postharvest disease of fresh fruit and vegetables. Crop Prot. 19:715-723 James WC. 1971. An illustrated series of assessment keys for plant diseases, their
preparation and usage. Can Plant Dis Surv. 51 (2):63.
Janisiewicz WJ, Korsten L. 2002. Biological control of postharvest diseases of fruits. Annu Rev Phytopathol. 40:11-441.
Kefialew Y, Ayalew A. 2008. Postharvest biological control of anthracnose (Colletotrichum gloeosporioides) on mango (Mangifera indica). Postharvest
Biol Technol. 50:8-11.
Kwok OCH, Fahy PC, Hoitink HAJ, Kuter GA. 1987. Interactions between bacteria and Trichoderma hamatum in suppression of Rhizoctonia damping-off in bark compost media. Phytopathology. 77(8):1206-1212.
Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi SAS
dan Minitab. Bogor (ID): Institut Pertanian Bogor Press.
Oskay M, Tamer AU, Azeri C. 2004. Antibacterial activity of some actinomycetes isolated from farming soil of Tukey. African J Biotechnol. [internet]. [diunduh 2013 Apr 8]; 3(9):441-446. Tersedia pada: http://www.academicjournals.org/AJB.
Payne C, Bruce A. 2001. The yeast Debaryomyces hansenii as a short term biological control agent against fungal spoilage of sawn Pinus sylvestris Timber. Biol Contr. 22:22-28. doi:10.1008.
Rogis A, Pamekas T, Mucharromah. 2007. Karakteristik dan uji efikasi bahan senyawa alami kitosan terhadap patogen pascapanen antraknosa. JIPI. 9(1):58-63.
Schaad Nw, Jones JB, Chun W. 2000. Laboratory Guide for Identification of Plant
Pathogenic Bacteria. Minnesota: APS Press.
Sitompul SK. 2013. Evaluasi keefektifan penghambatan beberapa agens biokontrol terhadap pertumbuhan Marasmius palmivorus Sharples [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Soesanto L. 2006. Penyakit Pascapanen. Yogyakarta (ID): Kanisius.
Sugiprihatini D, Wiyono S, Widodo. 2011. Selection of yeast antagonist as biocontrol agent of mango fruit rot caused by Botryodiplodia theobromae.
Microbiol Indo. 5(4):154-159.
Todar K. 2008. Antimicrobial agents used in treatment of infection disease [research report]. Madison (US): University of Wisconsin.
Vasyukova NI, Zinoveva SV, Iiinskaya LI, Perekhod EA, Chalenko GI, Gerasimova NG, llina AV, Varlamov VP, Ozeretskovskaya OL. 2001. Modulation of plant resistance ti diseases by water soluble chitosan and polyphenols. Food Sci Tech Int. 13(4):317-322.
16
17 Lampiran 1 Kitosan
Keterangan: Kitosan yang belum dilarutkan (A), kitosan yang sudah dilarutkan dengan konsentrasi 1% (B)
Lampiran 2 Isolat agens antagonis khamir (YP) dan aktinomiset (APS5)
Keterangan: Biakan YP pada media PDA 7 HSI (A), dan biakan APS5 pada media YCED 7 HSI (B)
Lampiran 3 Diameter pertumbuhan C. gloeosporioides pada masing-masing perlakuan dari 1 hingga 7 HSI secara in vitro
HSI Perlakuan
Diameter koloni C. gloeosporioides (cm)
1 2 3 4 5 6 7 Kontrol 1.6 3.2 4.8 6.4 7.8 8.7 8.8 CT 0.8 1.5 2.2 2.9 3.4 3.8 3.9 YPmet 1.3 2.6 4.0 5.3 6.6 7.1 7.5 YPsus 1.2 2.0 2.4 2.8 3.5 3.7 3.9 APS5met 1.3 2.7 3.9 4.8 5.2 5.3 5.5 APS5sus 1.3 1.8 2.3 2.7 3.2 3.6 3.9 Ct+YPmet 1.0 2.0 2.8 3.8 4.4 4.8 5.1 Ct+YPsus 1.0 1.7 2.5 3.3 3.8 4.2 4.8 Ct+APS5met 0.8 1.7 2.6 3.8 4.9 6.0 6.6 Ct+APS5sm 1.0 1.8 2.6 3.4 4.0 4.2 4.5 YP+APS5met 1.5 3.0 4.5 5.9 6.7 7.2 7.4 YP+APS5sus 0.9 1.3 1.7 2.0 2.4 2.7 3.1 A B A B
18
Lampiran 4 Pengaruh pemberian kitosan, khamir, aktinomiset, dan kombinasinya terhadap keparahan penyakit busuk antraknosa pada buah jambu kristal dengan pengujian in vivo dengan inokulasi patogen dari 1 hingga 10 HSI
Lampiran 5 Pengaruh pemberian kitosan, khamir, aktinomiset, dan kombinasinya terhadap keparahan penyakit busuk antraknosa pada buah jambu kristal dengan pengujian in vivo tanpa inokulasi patogen dari 1 hingga 10 HSI
Perlakuan Keparahan penyakit pada hari ke- (%)
1 2 3 4 5 6 7 8 9 10
Kontrol 0.0a 10.9a 23.4a 23.4a 26.6a 32.8a 39.1a 40.6a 43.7a 60.9a CT+YP 0.0a 6.2ab 21.9a 25.0a 25.0a 25.0b 31.2b 39.1ab 40.6ab 42.2b CT+APS5 0.0a 6.2ab 23.4a 25.0a 25.0a 28.1ab 29.7b 32.8abc 32.8bc 35.9bc
APS5 0.0a 6.2ab 20.3a 25.0a 25.0a 25.0b 26.6b 31.2bc 34.4bc 34.4c YP 0.0a 6.2ab 17.2a 23.4a 25.0a 28.1ab 29.7b 31.2bc 32.8bc 32.8c CT 0.0a 6.2ab 18.7a 23.4a 25.0a 26.6b 28.1b 28.1c 28.1c 32.8c YP+APS5 0.0a 4.7b 20.3a 23.4a 25.0a 25.0b 28.1b 28.1c 29.7c 29.7c
Perlakuan Keparahan penyakit pada hari ke- (%)
1 2 3 4 5 6 7 8 9 10
Kontrol 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a CT+YP 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a CT+APS5 0.0a 0.0a 0.0a 0.0a 1.2a 1.2a 1.2a 1.2a 2.5a 2.5a APS5 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a YP 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a CT 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a YP+APS5 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a 0.0a
19
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 17 Desember 1990 dari ayah Cucun Amir Bakhtiar dan ibu Eti Rohayati. Penulis adalah putri kedua dari dua bersaudara. Penulis menyelesaikan pendidikan sekolah dasar di SDN Sindur II, Kecamatan Rancabali, Kabupaten Bandung, Jawa Barat pada tahun 2003. Menyelesaikan pendidikan sekolah menengah pertama di SMP Negeri 1 Ciwidey, Kecamatan Ciwidey, Kabupaten Bandung, Jawa Barat pada tahun 2006. Tahun 2009 penulis lulus dari SMA Negeri 1 Margahayu Bandung dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Beasiswa Utusan Daerah dan diterima di Departemen Proteksi Tanaman, Fakultas Pertanian.
Selama mengikuti perkuliahan, penulis pernah menjadi asisten praktikum Hama dan Penyakit Tanaman Setahun serta praktikum Dasar-Dasar Proteksi Tanaman pada tahun ajaran 2012-2013. Penulis juga pernah aktif sebagai anggota Himpunan Mahasiswa Proteksi Tanaman periode 2012-2013 divisi Bisnis dan Kewirausahaan.