KEEFEKTIFAN KITOSAN DAN AKTINOMISET DALAM
PENCEGAHAN BUSUK ANTRAKNOSA (Colletotrichum capsici
(Syd.) Butler & Bisby) BUAH CABAI MERAH
RIZKY AMALLIA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
RIZKY AMALLIA. Keefektifan Kitosan dan Aktinomiset dalam Pencegahan Busuk Antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) Buah Cabai Merah. Dibimbing oleh MEITY SURADJI SINAGA.
Antraknosa yang disebabkan oleh Colletotrichum capsici merupakan salah satu penyakit yang dapat menurunkan kuantitas dan kualitas produksi cabai di Indonesia. Kitosan dan aktinomiset kini mulai banyak digunakan untuk mengendalikan berbagai penyakit tanaman. Studi ini bertujuan untuk mengevaluasi keefektifan kitosan dan dua isolat aktinomiset dalam mencegah penyakit busuk antraknosa cabai merah. Pengujian in vitro dilakukan dengan metode makanan beracun dan pengujian in vivo dengan pelapisan larutan kitosan, suspensi aktinomiset serta kombinasinya pada cabai merah. Percobaan dilakukan dalam rancangan acak lengkap (RAL) dengan 4 ulangan. Peubah yang diamati meliputi pertumbuhan diameter koloni jamur C. capsici, hambatan relatif, keparahan penyakit, dan ketegaran buah cabai merah. Hasil percobaan in vitro menunjukkan bahwa suspensi aktinomiset isolat APS12, APS5, dan APS512 konsentrasi 10% efektif dalam menekan pertumbuhan C. capsici dengan tingkat hambatan relatif mencapai 57%-72%. Pelapisan buah cabai dengan larutan CT, kombinasi CTAPS5, dan kombinasi CTAPS12 pada uji in vivo efektif dalam menekan infeksi C. capsici dan dapat memperpanjang daya simpan buah cabai merah hingga 10 hari.
Kata kunci: kitosan, aktinomiset, C. capsici, pascapanen, cabai merah
ABSTRACT
RIZKY AMALLIA. The effectiveness of Chitosan and Actinomycetes in The Prevention Anthracnose (Colletotrichum capsici (Syd.) Butler & Bisby) on Red Chilli. Supervised by MEITY SURADJI SINAGA.
Anthracnose due to Colletotrichum capsici is one disease that can decrease the quantity and quality of chillies production in Indonesia. Chitosan and actinomycetes are now widely used in controlling various plant diseases. The objectives of this research have been designed to evaluate the effectiveness of chitosan and two isolates of actinomycetes in preventing anthracnose on red chilli. In vitro test was conducted through baiting poisonous methods, while in vivo test has been done by solution coating of chitosan, isolate actinomycetes of APS5 and APS12, and their combination on the red chilli. The experiment had been done in a completely randomized design with 4 replications. The variables observed were the diameter growth of fungal colonies C. capsici, relative prevention growth, disease severity, and the rigidity of red chilli. The results of in vitro experiment showed that the concentration suspension of APS12, APS5, and APS512 (10%) were effective in suppressing the growth of C. capsici with 57%-72% of relative prevention growth. In vivo experiment showed that the coating of 1% CT, CTAPS5, CTAPS12 could reduce disease severity of C. capsici and lengthen the shelf life of red chilli until 10 days.
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KEEFEKTIFAN KITOSAN DAN AKTINOMISET DALAM
PENCEGAHAN BUSUK ANTRAKNOSA (Colletotrichum capsici
(Syd.) Butler & Bisby) BUAH CABAI MERAH
RIZKY AMALLIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Keefektifan Kitosan dan Aktinomiset dalam Pencegahan Busuk Antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) Buah Cabai Merah
Nama Mahasiswa : Rizky Amallia NIM : A34090079
Disetujui oleh
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, M.Si Ketua Departemen
PRAKATA
Segala puji bagi Allah SWT yang atas kuasa dan kehendak-Nya penulis dapat menyelesaikan skripsi yang berjudul Keefektifan Kitosan dan Aktinomiset dalam Pencegahan Busuk Antraknosa (Colletotrichum capsici (Syd.) Butler & Bisby) Buah Cabai Merah, sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian. Penelitian ini dilaksanakan di laboratorium Mikologi, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari bulan Februari 2013 sampai Juli 2013.
Terima kasih penulis ucapkan kepada Ibu Prof. Dr. Ir. Meity Suradji Sinaga,M.Sc. selaku dosen pembimbing akademik dan pembimbing skripsi atas perhatian, bantuan, arahan, dan bimbingan dalam penulisan skripsi ini. Penulis juga menyampaikan terima kasih kepada ayah, ibu, seluruh keluarga, serta teman-teman penulis yang senantiasa memberikan perhatian, dorongan semangat, doa dan kasih sayang selama penulis belajar. Semoga Allah SWT senantiasa membalas segala amal ibadah dan kebaikan kepadanya. Penulis memohon maaf bila dalam penulisan skripsi ini masih terdapat kekurangan. Semoga skripsi ini bermanfaat.
Bogor, September 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
BAHAN DAN METODE 4
Waktu dan Tempat 4
Metode 4
Penyediaan Isolat Patogen 4 Penyediaan Suspensi dan Metabolit Sekunder Aktinomiset 4 Pembuatan Larutan Kitosan 4
Penghambatan in vitro 5
Keefektifan in vivo 5
Rancangan Percobaan dan Analisis Data 6
HASIL DAN PEMBAHASAN 7
Isolasi Cendawan Patogen 7
Penghambatan Pertumbuhan C. capsici oleh Kitosan dan Aktinomiset
pada Uji In Vitro 8
Keefektifan Kitosan dan Aktinomiset dalam Penghambatan Antraknosa
pada Uji In Vivo 10
PENUTUP 13
Kesimpulan 13
Saran 13
DAFTAR PUSTAKA 14
DAFTAR TABEL
1 Diameter koloni C. capsici setiap perlakuan pada uji in vitro dalam media
tumbuh PDA sampai 7 HSI 8
2 Tingkat hambatan relatif (THR) masing-masing perlakuan terhadap
pertumbuhan C. capsici pada media tumbuh PDA sampai 7 HSI 9 3 Keparahan penyakit antraknosa dan ketegaran buah cabai pada masing-
masing perlakuan 11
DAFTAR GAMBAR
1 Skor keparahan penyakit antraknosa pada buah cabai merah 6 2 Gejala busuk antraknosa pada buah cabai merah besar dan morfologi
koloni C. capsici pada media PDA berumur 7 hari 7 3 Aservulus cendawan C. capsici dengan seta dan konidia dibawah
mikroskop perbesaran 40x10 8
4 Perbedaan diameter koloni C. capsici pada uji in vitro 7 HSI pada perlakuan CT, APS5ssp, APS12ssp, CTAPS5, CTAPS12, APS512ssp,
APS5met, APS512met, dan kontrol 9 5 Perbedaan ketegaran buah cabai pada uji in vivo yang dilapisi dengan
larutan kitosan, APS5, APS12, CTAPS5, CTAPS12, APS512, dan
kontrol pada 10 HSP 12
DAFTAR LAMPIRAN
1 Diameter koloni C. capsici setiap perlakuan pada uji in vitro dalam media tumbuh PDA sampai 7 hari setelah inokulasi (HSI) 18 2 Tingkat hambatan relatif (THR) masing-masing perlakuan terhadap
pertumbuhan C. capsici pada media tumbuh PDA sampai 7 HSI 19 3 Keparahan penyakit antraknosa buah cabai dengan inokulasi patogen pada
masing-masing perlakuan 20
4 Hasil transformasi arcsin data keparahan penyakit antraknosa buah cabai
dengan inokulasi patogen pada masing-masing perlakuan 21 5 Keparahan penyakit antraknosa buah cabai tanpa inokulasi patogen pada
masing-masing perlakuan 22
PENDAHULUAN
Latar Belakang
Cabai merah (Capsicum annuum L.) termasuk kedalam 4 jenis sayuran penting dunia dan merupakan salah satu sayuran unggulan yang banyak dibudidayakan oleh petani di Indonesia karena memiliki harga jual dan tingkat konsumsi yang tinggi (FAO 2011, Prajnanta 2011). Konsumsi per kapita cabai di Indonesia cenderung meningkat dari 1.35 kg pada tahun 2003 menjadi 1.47 kg pada tahun 2007 (Syukur et al. 2012). Badan Pusat Statistik (2012) melaporkan bahwa produktivitas cabai di Indonesia pada tahun 2011 baru mencapai 6.19 ton/ha dengan total produksi 1.4 juta ton. Jumlah tersebut masih belum dapat mencapai jumlah total potensinya yaitu sebesar 12 ton/ha (Purwati et al. 2000). Indonesia pernah tercatat sebagai salah satu negara pengekspor cabai kering. Sampai dekade 1970-an, jumlah ekspor cabai kering mencapai hampir 7000 ton dengan nilai lebih dari US$3 juta. Namun, sejak 1974 ekspor ini terus merosot karena ketidakmampuan dalam menjaga mutu cabai kering (Setiadi 2008). Salah satu faktor utama yang menyebabkan rendahnya produktivitas cabai di Indonesia dan kendala dalam menjaga mutu cabai di Indonesia adalah adanya gangguan hama dan penyakit dalam pelaksanaan produksi dan pengelolaan pascapanen (Semangun 2000).
Setiadi (2008) melaporkan bahwa beberapa jenis penyakit yang sering ditemui pada tanaman cabai antara lain antraknosa yang dikenal dengan penyakit patek, penyakit tepung, penyakit layu dan berbagai jenis virus yang ditularkan oleh hama. Namun, penyakit yang lebih sering menyerang buah cabai baik sebelum panen maupun setelah panen adalah antraknosa. Penyakit antraknosa ini dapat disebabkan oleh serangan cendawan Colletotrichum capsici (Syd.) Butl. & Bisby dan Gloeosporium piperatum Ell. & Ev. Kedua patogen tersebut dapat menyerang buah yang masih muda. Gejala serangan G. piperatum dapat terlihat pada buah yang masih mentah maupun yang sudah masak, sedangkan gejala serangan cendawan C. capsici hanya dapat dijumpai di buah yang sudah masak saja.
Permukaan buah yang terserang antraknosa biasanya akan terbentuk lingkaran yang berlapis atau konsentris yang merupakan bentuk dari seta dan konidia dari cendawan C. capsici. Bila serangan berlanjut, buah cabai cenderung kering, mengerut, dan akhirnya membusuk (Roberts et al. 2001, Montri et al. 2009). Gejala yang disebabkan oleh penyakit ini sangat merugikan dan secara langsung dapat menurunkan kualitas buah cabai merah. Oleh karena itu, adanya patogen ini membuat buah cabai merah yang sudah dipanen tidak dapat bertahan lama dan membuat buah cabai cepat membusuk. Antraknosa merupakan masalah yang sering dihadapi dalam produksi cabai di sebagian besar wilayah tropis dan subtropis dunia dan menyebabkan kehilangan hasil yang cukup besar (Montri et al. 2009). Kusandriani (1996) melaporkan bahwa busuk antraknosa ini dapat menurunkan produksi cabai hingga 75%. Infeksi buah yang menunjukkan gejala dari antraknosa ini dapat mengurangi daya jual buah.
2
memiliki ketahanan terhadap antraknosa berdaya hasil rendah dan bentuk buahnya tidak disukai pasar (Syukur et al. 2009). Oleh karena itu, buah cabai yang terserang antraknosa lebih sering dikendalikan dengan menggunakan berbagai macam fungisida sintetik, diantaranya fungisida yang mengandung tembaga (Cu) ataupun karbendazim (Martoredjo 2009). Namun, pengendalian dengan menggunakan fungisida sintetik akan memberikan dampak yang tidak baik bagi lingkungan dan kesehatan manusia, sehingga pengendalian secara alami saat ini sangat dibutuhkan agar produk-produk pascapanen yang langsung dikonsumsi bebas dari residu yang ditimbulkan dari bahan-bahan kimia berbahaya. Pengendalian penyakit tanaman yang dilakukan dengan metode-metode alami dapat menurunkan kejadian dan dampak negatif serta efek samping bagi kesehatan manusia. Pengendalian hayati menjadi alternatif pengendalian yang lebih aman terhadap manusia dan juga lingkungan dalam mengendalikan pembusukan pascapanen (Sharma et al. 2009). Beberapa hasil penelitian menunjukkan bahwa beberapa jenis penyakit tanaman yang disebabkan oleh patogen dapat dikendalikan secara alami dengan menggunakan kitosan dan aktinomiset.
Kitosan adalah poli–(2-amino-2-deoksi-β-(1-4)-D-glukopiranosa) dengan rumus molekul (C6H11NO4)n yang merupakan biopolimer alami kedua terbanyak di alam setelah selulosa. Kitosan dapat diperoleh dari deasetilasi kitin cangkang krustasea laut yang banyak dimanfaatkan di berbagai bidang seperti medis dan farmasi, kosmetik, makanan, pengendalian penyakit tanaman serta meningkatkan daya simpan produk pascapanen (El Gaouth et al. 1992, Okuzumi dan Fujii 2000, Aranaz et al. 2009, Holipah 2010). Kitosan memperoleh banyak perhatian di bidang pertanian karena bentuk dan sifatnya yang khas dalam menghambat pertumbuhan banyak cendawan patogen dan kemampuannya sebagai elisitor reaksi ketahanan tanaman (Hirano dan Nagao 1989, El Gaouth et al. 1992). Banos et al. (2006) juga melaporkan bahwa kitosan merupakan senyawa alami yang potensial untuk mengendalikan penyakit prapanen dan pascapanen komoditas hortikultura. Sampai saat ini, kitosan telah terbukti dapat meningkatkan toleransi tanaman terhadap berbagai patogen, efektif mengendalikan pembusukan produk pascapanen selama penyimpanan serta menunda dan memperlambat timbulnya infeksi yang disebabkan oleh patogen. Beberapa hasil penelitian menunjukkan bahwa pelapisan kitosan dengan konsentrasi 1-1.5% pada buah apel, kiwi, pir, dan stroberi efektif mengendalikan busuk pada saat penyimpanan (Banos et al. 2006). Liu et al. (2006) juga menunjukkan bahwa kitosan dapat menghambat perkecambahan spora cendawan patogen penyebab kapang biru pada buah tomat, Penicillium expansum dan Botrytis cinerea secara signifikan. Selain itu, penyakit busuk buah pada kakao, kerdil hampa pada padi, busuk akar Fusarium pada tomat, Potato Spindle Tuber Viroid pada daun tomat, dan antraknosa pada buah pepaya juga dapat dikendalikan dengan kitosan (Nawar 2005, Kurzawinka 2007, Hamdayanti et al. 2012, Simanjuntak 2012).
3
dan bahan makanan fungsional. Kitosan juga telah digunakan dalam beberapa produk suplemen nutrisi karena kemampuannya untuk mengikat lemak cukup baik.
Selain menggunakan kitosan yang tidak patogenik pada tanaman, pengendalian penyakit tanaman secara alami adalah menggunakan agens hayati. Salah satu mikroba yang berpotensi dalam mengendalikan penyakit tanaman adalah aktinomiset. Aktinomiset termasuk dalam filum Actinobacteria dari bakteri gram positif berbentuk filamen dengan miselia aerial. Ukuran miselium umumnya memiliki diameter 0.5-1.0 µm dengan panjang yang tidak tentu dan tidak memiliki sekat pada fase vegetatif (Madigan et al. 1996). Aktinomiset hidup di berbagai tempat di alam, membentuk spora, dan tersebar di tanah, air, dan tanaman (George et al. 2011). Aktinomiset dapat menghasilkan struktur bertahan berupa spora sebagai cara utama dalam melakukan pemencaran atau dispersal yang dapat bertahan dalam kondisi yang tidak menguntungkan, seperti rendahnya kadar air dan suhu tinggi serta dapat bertahan dalam waktu yang lama (Schaad et al. 2000). Sebagian besar aktinomiset mampu menghasilkan spora dari ujung-ujung miselium yang terbentuk. Spora aktinomiset dikenal dengan eksospora karena terbentuk tidak dari dalam sel serta memiliki dinding sel yang tidak terlalu tebal (Janse 2005).
Aktinomiset memiliki peranan penting pada rizosfer, melindungi perakaran dari serangan cendawan patogen dan mempengaruhi pertumbuhan tanaman (Crawford et al. 1993, Madigan et al. 1996). Aktinomiset juga memiliki kemampuan untuk mensintesis banyak metabolit sekunder dan senyawa bioaktif yang memiliki aktivitas biologi seperti antibiotik, antiparasitik, antibakteri, antifungi, antioksidan, antitumor, antiviral dan enzim ekstraseluler (selulase dan xylanase) yang penting dalam industri, obat-obatan, dan pertanian (Oskay et al. 2004, George et al. 2011). Sehingga, penggunaan aktinomiset juga dapat dijadikan alternatif pengendalian penyakit tanaman.
Pemanfaatan beberapa antagonis dalam pengendalian penyakit tanaman merupakan langkah perbaikan pendekatan pengendalian hayati. Menurut Mari dan Guizzardi (1998), kombinasi teknik perlakuan efektif digunakan dalam pengendalian penyakit cendawan pascapanen. Oleh karena itu, kerugian pascapanen buah cabai akibat penyakit antraknosa pada masa yang akan datang diharapkan dapat ditekan dengan menggunakan kitosan dan aktinomiset serta kombinasinya.
Tujuan Penelitian
Penelitian ini bertujuan mengevaluasi keefektifan kitosan, aktinomiset, dan kombinasinya dalam mencegah penyakit busuk antraknosa yang disebabkan oleh cendawan C. capsici pada buah cabai merah.
Manfaat Penelitian
BAHAN DAN METODE
Waktu dan Tempat
Percobaan dilaksanakan di Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari Februari 2013 hingga Juli 2013.
Metode Penyediaan Isolat Patogen
C. capsici diisolasi dari buah cabai merah bergejala busuk antraknosa yang diperoleh dari pasar Dramaga, Bogor. Isolasi patogen dilakukan dengan metode penanaman jaringan. Bagian buah yang menunjukkan gejala dan tidak menunjukkan gejala dipotong sepanjang 0.5 cm x 0.5 cm. Potongan jaringan buah cabai tersebut didisinfeksi dengan alkohol 70% selama 3 menit, kemudian direndam dalam natrium hipoklorit (NaOCl) 1% selama 3 menit, dibilas menggunakan air steril sebanyak 3 kali pembilasan selama 3 menit, lalu dikeringanginkan. Setelah kering, potongan jaringan buah cabai tersebut ditumbuhkan pada media Potato Dextrose Agar (PDA) dalam cawan petri dan diinkubasi pada suhu ruang. Koloni C. capsici yang tumbuh dimurnikan pada media PDA yang telah diberi cloramphenicol. Selanjutnya C. capsici berumur 7 hari digunakan untuk uji penghambatan in vitro dan uji keefektifan in vivo. Semua kegiatan isolasi C. capsici dilakukan dalam kondisi aseptik di laminair flow.
Penyediaan Suspensi dan Metabolit Sekunder Aktinomiset
Isolat aktinomiset yang digunakan adalah jenis APS5 dan APS12 yang merupakan koleksi Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, IPB. Peremajaan aktinomiset dilakukan dengan menumbuhkan inokulum melalui penggoresan sebanyak 1 lup pada media Casamino Acids-yeast extract-glucose-agar (YCED) dan diinkubasi pada suhu ruang. Masing-masing aktinomiset yang berumur 7 hari diinokulasikan ke dalam 10 ml media cair Luria Broth (LB) sebanyak 1 lup lalu diinkubasi selama 4 hari pada inkubator bergoyang dengan kecepatan 100 rpm. Media cair LB yang mengandung biakan aktinomiset dimasukan ke dalam tabung eppendorf masing-masing sebanyak 1 ml,
lalu disentrifugasi dengan kecepatan 12000 rpm selama 15 menit pada suhu 25˚C
hingga didapatkan supernatan yang mengandung senyawa bioaktif aktinomiset. Supernatan disaring dengan millipore ukuran 0.22 μm untuk memperoleh senyawa metabolit yang steril. Sedangkan suspensi aktinomiset diperoleh dari isolat aktinomiset yang telah diinkubasi selama 4 hari pada inkubator bergoyang. Konsentrasi senyawa metabolit dan suspensi aktinomiset yang digunakan dalam pengujian in vitro dan in vivo adalah 10%.
Pembuatan Larutan Kitosan
5
Penghambatan in vitro
Uji penghambatan in vitro dilakukan dengan menggunakan metode makanan beracun pada media PDA yang mengandung kitosan, aktinomiset, dan kombinasinya didalam cawan petri. Perlakuan yang diuji adalah
1. kitosan (CT),
2. suspensi APS5 (APS5ssp), 3. suspensi APS12 (APS12ssp),
4. kombinasi APS5 dan APS12 (APS512ssp), 5. metabolit APS5 (APS5met),
6. kombinasi metabolit APS5 dan APS12 (APS512met), 7. kombinasi kitosan dan APS5 (CTAPS5),
8. kombinasi kitosan dan APS12 (CTAPS12), dan 9. kontrol.
Isolat C. capsici yang berumur 7 hari dipotong dengan menggunakan cork borer dengan diameter 7 mm, lalu ditanam di tengah media. Pengamatan penghambatan kitosan, aktinomiset, dan kombinasinya dilakukan selama 7 hari dengan mengukur diameter pertumbuhan C. capsici. Tingkat hambatan relatif (THR) dari perlakuan yang diujikan dapat dihitung dengan menggunakan rumus:
aktinomiset, dan kombinasinya terhadap buah cabai merah dengan inokulasi patogen dan tanpa inokulasi patogen. Perlakuan tanpa inokulasi patogen bertujuan melihat pengaruh perlakuan terhadap ketegaran buah cabai dan lamanya daya simpan buah cabai. Perlakuan yang diuji adalah:
1. kitosan (CT),
2. suspensi APS5 (APS5ssp), 3. suspensi APS12 (APS12ssp),
4. kombinasi APS5 dan APS12 (APS512ssp), 5. kombinasi kitosan dan APS5 (CTAPS5), 6. kombinasi kitosan dan APS12 (CTAPS12), dan 7. kontrol.
6
sedotan. Setiap nampan berisi 5 buah cabai sebagai unit percobaan. Selanjutnya, nampan tersebut dibungkus dengan menggunakan plastik bening yang sudah dilubangi dengan jarum untuk menjaga kelembaban.
Keefektifan kitosan, aktinomiset, dan kombinasinya diukur dengan mengamati gejala yang muncul, mengamati ketegaran buah secara visual, dan menghitung keparahan penyakit selama 10 hari setelah inokulasi (HSI). Keparahan penyakit (KP) dihitung dengan menggunakan rumus:
Σ (jumlah sampel per kategori x skor keparahan)
KP = x 100%
Jumlah sampel yang diamati x skor tertinggi
Skor tiap kategori serangan menurut James (1971) dengan modifikasi:
Gambar 1 Skor keparahan penyakit antraknosa pada buah cabai merah yaitu skor
0 = 0 ≤ x ≤ 0.05% (a), 1 = 0.05 < x ≤ 1% (b), 2 = 1 < x ≤ 10% (c), 3 = 10 < x ≤ 25% (d), 4 = 25 < x ≤ 50% (e), 5 = > 50% (f)
Kategori ketegaran buah cabai setelah perlakuan adalah: **** = sangat tegar; *** = tegar; ** = lunak; * = busuk.
Rancangan Percobaan dan Analisis Data
Rancangan percobaan yang digunakan pada uji penghambatan in vitro dan uji keefektifan in vivo yaitu rancangan acak lengkap (RAL) dengan 4 ulangan. Data yang diperoleh dianalisis ragam (ANOVA) dengan menggunakan Microsoft Office Excel 2013 dan program Statistical Analysis System for Windows (SAS) versi 9.0. Perlakuan yang berpengaruh nyata diuji lanjut dengan uji Duncan
dengan taraf α = 5% (Mattjik et al. 2006). Ketegaran buah cabai diuji secara nonparametrik dengan uji Kruskal-Wallis α = 1%.
HASIL DAN PEMBAHASAN
Isolasi Cendawan Patogen
Cendawan patogen C. capsici diperoleh dari buah cabai merah yang menunjukkan gejala busuk antraknosa. Gejala yang ditemukan berupa bercak konsentris dengan bintik-bintik hitam dan bagian buah menjadi melekuk ke dalam. Buah cabai yang seharusnya berwarna merah menjadi berwarna jerami, mengerut, kering, dan terlihat jelas bintik-bintik hitam di permukaan buah yang merupakan aservulus dari cendawan patogen tersebut (Gambar 2a). Gejala yang ditemukan tersebut sesuai dengan pernyataan Roberts et al. (2001) bahwa gejala antraknosa pada permukaan buah cabai yang disebabkan oleh C. capsici umumnya ditemukan bercak berbentuk lingkaran yang berlapis atau konsentris dari aservulus cendawan tersebut. Bila serangan berlanjut, buah cabai cenderung kering, mengerut, dan membusuk.
Gambar 2 Gejala busuk antraknosa pada buah cabai merah besar (a) dan morfologi koloni C. capsici pada media PDA berumur 7 hari bagian permukaan atas (b) dan permukaan bawah (c)
Cendawan C. capsici dari buah cabai bergejala antraknosa yang diisolasi pada media PDA menghasilkan koloni berwarna putih keabu-abuan pada permukaan atas, miselium berwarna putih kelabu (Gambar 2b), dan pada dasar koloni berwarna hitam melingkar seperti cincin (Gambar 2c). Pada 7 hari setelah inkubasi, diameter koloni C. capsici dapat mencapai 65-80 mm. Menurut Roberts et al. (2001), koloni miselium C. capsici pada media PDA membentuk lingkaran konsentris berwarna abu-abu dan putih dengan aservuli hitam dan konidia berbentuk sabit dengan laju pertumbuhan berkisar antara 5.64-7.28 mm per hari. Karakteristik yang serupa dari koloni C. capsici pada media PDA juga dikemukakan oleh Sangdee et al. (2011) yaitu menghasilkan koloni seperti kapas dengan warna putih keabu-abuan hingga abu-abu gelap pada permukaan ventral sedangkan kebalikan dari koloni berwarna hitam dan melingkar.
Pengamatan mikroskopis biakan C. capsici pada media PDA menunjukkan adanya aservuli (Gambar 3) dengan banyak seta yang berwarna coklat, kaku, bersekat, panjang dan meruncing keatas (Gambar 3a). Selain itu ditemukan pula konidia hialin tanpa sekat, runcing pada ujungnya membentuk seperti bulan sabit, bersel tunggal, dan mengelompok (Gambar 3b). Hasil tersebut sesuai dengan yang pernah dilaporkan Semangun (2000), Martoredjo (2009), dan Sangdee et al. (2011) bahwa cendawan C. capsici memiliki aservulus berwarna hitam berdiameter 100 µ m dengan seta berwarna cokelat berukuran 75-100 x 2-6.2 µ m dan konidia berwarna hialin, berbentuk tabung (silindris), ujungnya tumpul atau bengkok seperti sabit, bersel tunggal, dan bersekat dengan rata-rata panjang dan
8
lebar konidia bervariasi yaitu masing-masing antara 23.5-35.0 µm dan 2.5-3.75 µ m. Berdasarkan hal tersebut, maka dapat disimpulkan bahwa isolat Colletotrichum dari buah cabai merah yang diisolasi adalah C. capsici.
Gambar 3 Aservulus cendawan C. capsici dengan seta (a) dan konidia (b) dibawah mikroskop perbesaran 40x10
Penghambatan Pertumbuhan C. capsici oleh Kitosan dan Aktinomiset pada
Uji In Vitro
Berdasarkan hasil uji penghambatan in vitro diketahui bahwa penambahan kitosan, aktinomiset dan kombinasinya mampu menekan pertumbuhan koloni patogen C. capsici dibandingkan dengan kontrol. Pada awalnya, perlakuan aktinomiset hanya akan menggunakan senyawa metabolit sekundernya saja. Namun, pada saat pengujian ditemukan bahwa adanya pertumbuhan koloni aktinomiset justru memberi penghambatan yang sangat baik terhadap pertumbuhan C. capsici. Sedangkan perlakuan senyawa metabolit aktinomiset saja justru tidak berpengaruh terhadap pertumbuhan C. capsici. Perlakuan senyawa metabolit APS12 tidak dilakukan karena senyawa metabolit yang dihasilkan hanya cukup digunakan dalam kombinasi APS512. Sehingga hanya perlakuan senyawa metabolit APS5 dan APS512 saja yang dapat dilakukan dalam pengujian in vitro ini.
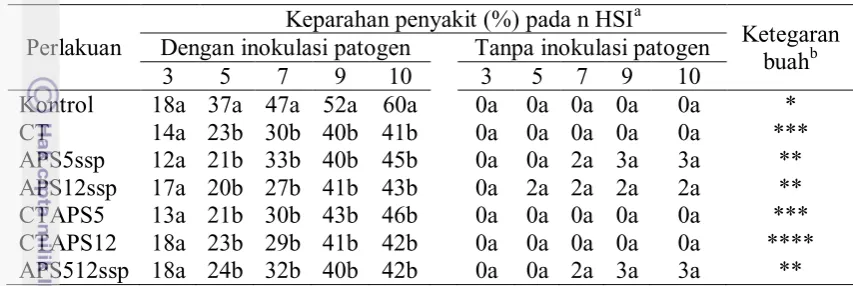
Tabel 1 Diameter koloni C. capsici setiap perlakuan pada uji in vitro dalam media tumbuh PDA sampai 7 HSI
HSI Perlakuan
Diameter koloni C. capsici (cm)a
1 2 3 4 5 6 7
Kontrol 1.05b 2.05b 3.00a 3.93a 4.80a 5.75a 6.43a APS5met 1.45a 2.10b 3.30a 4.30a 5.15a 6.00a 6.65a APS512met 1.38a 2.45a 3.08a 4.15a 4.90a 5.80a 6.63a CT 0.70d 1.18d 1.78c 2.48c 3.30b 4.08b 4.80b CTAPS5 0.80cd 1.50c 2.15b 2.88b 3.70b 4.35b 4.80b CTAPS12 0.90c 1.50c 2.08bc 2.73bc 3.50b 4.15b 4.85b APS5ssp 0.83cd 1.53c 1.83bc 2.08d 2.30c 2.48c 2.75c APS12ssp 0.70d 0.95d 1.10d 1.35e 1.48d 1.68d 1.80d APS512ssp 0.78cd 1.13d 1.30d 1.75d 1.75d 2.10cd 2.28cd
a
Nilai tengah yang memiliki huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan DMRT α=5%.
a
9
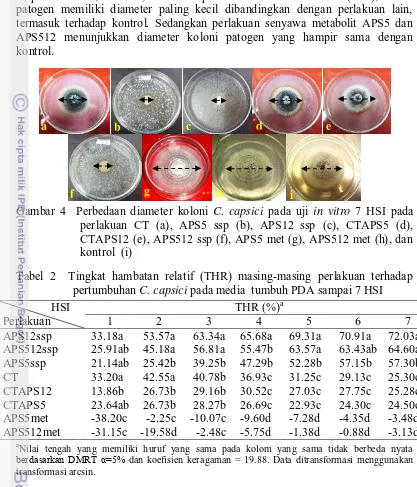
Pada Tabel 1 dan Gambar 4 terlihat bahwa pada media PDA dengan suspensi APS12, APS512, dan APS5 pada 7 hari setelah inokulasi (HSI), koloni patogen memiliki diameter paling kecil dibandingkan dengan perlakuan lain, termasuk terhadap kontrol. Sedangkan perlakuan senyawa metabolit APS5 dan APS512 menunjukkan diameter koloni patogen yang hampir sama dengan kontrol.
Gambar 4 Perbedaan diameter koloni C. capsici pada uji in vitro 7 HSI pada perlakuan CT (a), APS5 ssp (b), APS12 ssp (c), CTAPS5 (d), CTAPS12 (e), APS512 ssp (f), APS5 met (g), APS512 met (h), dan kontrol (i)
Tabel 2 Tingkat hambatan relatif (THR) masing-masing perlakuan terhadap pertumbuhan C. capsici pada media tumbuh PDA sampai 7 HSI HSI berdasarkan DMRT α=5% dan koefisien keragaman = 19.88. Data ditransformasi menggunakan transformasi arcsin.
Berdasarkan tingkat hambatan relatif (THR) perlakuan terhadap pertumbuhan C. capsici pada Tabel 2, terlihat bahwa APS12ssp, APS5ssp, dan APS512ssp memberikan penghambatan yang cukup besar pada 7 HSI yaitu 57.3%-72%. Sedangkan perlakuan CT, CTAPS5, dan CTAPS12 kurang mampu menghambat pertumbuhan koloni patogen yaitu hanya sebesar 25% saja. Penggunaan senyawa metabolit APS5 dan APS512 terlihat tidak menunjukkan penghambatan terhadap pertumbuhan C. capsici (Tabel 2). Pertumbuhanpatogen yang diberi perlakuan tersebut bahkan nampak lebih cepat dibandingkan dengan kontrol. Hal tersebut menunjukkan bahwa penggunaan senyawa metabolit saja tanpa disertai dengan adanya pertumbuhan koloni aktinomiset pada media PDA belum mampu menghambat pertumbuhan koloni C. capsici.
10
Penggunaan senyawa metabolit aktinomiset yang tidak efektif ini diduga dapat dikarenakan senyawa metabolit ikut tersaring pada saat penyaringan supernatan dengan millipore dan dimungkinkan pula aktinomiset yang berumur 4 hari dengan pengenceran sampai 10% belum cukup untuk menghasilkan enzim ataupun senyawa metabolit yang dapat menghambat pertumbuhan C. capsici. Selain itu, ada beberapa kelemahan yang membuat senyawa bioaktif dari aktinomiset menjadi kurang efektif antara lain pertumbuhan dan produksi senyawa bioaktif antimikrob atau senyawa metabolit yang dihasilkan sangat lambat pada media agar, konsentrasi senyawa metabolit yang dihasilkan rendah, atau senyawa metabolit tersebut terurai oleh organisme lain (Sariyanto 2006).
Penggunaan suspensi aktinomiset yang mampu menekan pertumbuhan patogen C. capsici secara efektif diduga bahwa adanya pertumbuhan koloni aktinomiset pada media meskipun pertumbuhannya lambat, tetap mampu memproduksi senyawa metabolit sekunder yang dapat menghambat tumbuhnya patogen C. capsici. Franco dan Hernandez (2009) melaporkan bahwa mekanisme penekanan penyakit yang dilakukan oleh aktinomiset terdiri dari antibiosis, persaingan nutrisi dan ruang, dan parasitisme. Namun, dalam percobaan ini hanya dapat terlihat mekanisme penghambatan suspensi aktinomiset yaitu kemampuannya dalam menghasilkan senyawa tertentu dan berkolonisasi pada ruang atau media untuk memperoleh nutrisi, dapat menghambat atau bahkan mematikan patogen.
Penghambatan kitosan terhadap pertumbuhan C. capsici diduga dapat terjadi melalui sifat antifungi dari spektrum luas gugus amino dalam bentuk asetil amino (HCOCH3) dan glukosamine (C6H9NH2). Gugus amino tersebut dapat berikatan dengan bagian makromolekul yang bermuatan negatif dari polikationik alami pada permukaan sel cendawan. Oleh karena itu, pertumbuhan cendawan akan terhambat (Restuati 2008). Bentuk hifa dari koloni C. capsici pada pemberian CT, CTAPS5, dan CTAPS12 yang melingkar dan berwarna sangat hitam di bagian permukaan atas koloni nampak berbeda jika dibandingkan dengan pertumbuhan koloni pada kontrol (Gambar 4). Hal tersebut diduga dapat dikarenakan adanya mekanisme kitosan yang tidak hanya mampu menghambat pertumbuhan patogen tetapi juga menunjukkan perubahan morfologi, struktur, dan susunan molekuler sel cendawan (Benhamou 1996 dalam Banos et al. 2006). Selain itu, Ratih (2011) juga melaporkan bahwa pada pemberian kitosan konsentrasi 1-6% dapat memperkecil pertumbuhan diameter koloni, memperlama masa inkubasi, dan mengurangi kerapatan sporangium cendawan.
Keefektifan Kitosan dan Aktinomiset dalam Penghambatan Busuk Antraknosa pada Uji In Vivo
11
dikarenakan agens antagonis yang digunakan tidak efektif, namun kondisi lingkungan memang diatur sesuai untuk timbulnya infeksi patogen C. capsici melalui pelukaan jaringan pada permukaan buah cabai.
Tabel 3 Keparahan penyakit antraknosa dan ketegaran buah cabai pada masing-masing perlakuan
Perlakuan
Keparahan penyakit (%) pada n HSIa
Ketegaran buahb Dengan inokulasi patogen Tanpa inokulasi patogen
3 5 7 9 10 3 5 7 9 10 menggunakan transformasi arcsin. bKeterangan tanda menunjukkan * busuk, ** lunak, *** tegar,
**** sangat tegar dan diuji dengan metode nonparametrik berdasarkan uji Kruskal-Wallis α=1%
Kemampuan kitosan, aktinomiset, dan kombinasinya menghambat pertumbuhan C. capsici yang diinokulasikan pada buah cabai diduga terjadi karena mekanisme yang dapat menghambat aktivitas peroksidase dan merusak produksi aktivitas virulensi fungi seperti enzim pendegradasi dinding sel (polygalacturonase, pectate lyase, dan selulase) (Reddy 1998). Kitosan sudah dilaporkan efektif dalam mengendalikan berbagai penyakit pascapanen saat penyimpanan pada beberapa komoditas seperti buah apel, kiwi, stroberi, dan pir dengan cara menunda infeksi dan memperlambat proses infeksi patogen (Banos et al. 2006). Aktinomiset dapat menghasilkan senyawa bioaktif yang bersifat antimikrob maupun enzim. Namun, penggunaan aktinomiset dalam mengendalikan patogen penyebab penyakit pascapanen dan kemampuannya dalam menjaga ketegaran buah belum banyak diketahui.
Efek positif yang diharapkan dengan pelapisan kitosan, aktinomiset, dan kombinasinya berhubungan dengan kemampuan daya simpan buah dan sayur. Pada pengujian in vivo ini, daya simpan buah cabai dapat ditunjukkan dengan mengamati ketegaran buah cabai yang diberi perlakuan tanpa inokulasi patogen. Berdasarkan hasil pengujian, keparahan penyakit antraknosa tidak berbeda nyata untuk semua perlakuan. Munculnya gejala antraknosa pada beberapa buah cabai diduga bahwa patogen C. capsici memang sudah berada didalam buah cabai ketika di pertanaman. Pada kondisi lingkungan yang sesuai pada saat dilakukan pengujian sangat memungkinkan timbulnya gejala antraknosa tersebut. Hal tersebut menunjukkan bahwa penyakit antraknosa yang disebabkan oleh cendawan C. capsici bersifat laten.
12
baik diduga karena keduanya dapat bekerja secara sinergis. Adanya sinergitas antara kitosan dan aktinomiset ini dapat menjadi kombinasi teknik perlakuan yang efektif digunakan dalam pengendalian penyakit cendawan pascapanen. Selain itu, pelapisan buah cabai dengan CT dan CTAPS5 juga menunjukkan hasil yang cukup baik, meskipun pada beberapa buah cabai terlihat sudah mengerut. Banos et al. (2006) melaporkan bahwa kitosan memiliki sifat preventif daripada efek kuratif. Oleh karena itu, pada buah yang direndam dalam larutan kitosan dan suspensi aktinomiset 10% mampu menghambat serangan patogen pada buah cabai.
Gambar 5 Perbedaan ketegaran buah cabai pada uji in vivo yang dilapisi dengan larutan kitosan (a), APS5 (b), APS12 (c), CTAPS5 (d), CTAPS12 (e), APS512 (f), dan kontrol (g) pada 10 HSP
Buah cabai pada kontrol mulai mengalami perubahan menjadi mengerut dan lunak pada 4 HSP, sedangkan pada buah cabai yang dilapisi dengan kitosan masih dalam keadaan tegar, tidak lunak, dan belum mengalami fase maserasi sampai 10 HSP. Oleh karena itu, dengan adanya perlakuan tersebut dapat menunjukkan peningkatan daya simpan buah cabai. Hal ini mungkin terjadi karena menurut Banos et al. (2006), kitosan dapat digunakan sebagai elisitor eksogenus respon ketahanan inang, mengakumulasi kitinase, menginduksi lignin, mensintesis fitoaleksin oleh jaringan inang yang terinfeksi dan menghambat enzim maserasi jaringan inang. Kitosan yang digunakan sebagai pelapis umumnya menyebabkan tingkat respirasi dan kadar air menurun. Bentuk kitosan yang semipermeabel mengontrol perpindahan gas dan menurunkan kehilangan transpirasi dan menghambat kematangan buah. Jika proses pematangan buah dapat dihambat, ketegaran buah cabai dapat dipertahankan dalam waktu yang lebih lama, sehingga masa simpan buah cabai dapat diperpanjang.
a b c
e f g
PENUTUP
Kesimpulan
Berdasarkan hasil percobaan in vitro dan in vivo perlakuan kitosan, suspensi aktinomiset dan kombinasinya mampu menekan pertumbuhan koloni cendawan patogen C. capsici pada media PDA dan menekan keparahan penyakit antraknosa pada pascapanen buah cabai, serta dapat memperpanjang umur simpan buah hingga 10 hari. Kombinasi kitosan (1%) dan suspensi aktinomiset (10%) dapat menjadi teknik perlakuan yang efektif untuk menghambat busuk antraknosa pada buah cabai dibandingkan hanya dengan perlakuan tunggal.
Saran
DAFTAR PUSTAKA
Aranaz I, Mengibar M, Harris R, Panos I, Miralles B, Acosta N, Galed G, Heras A. 2009. Functional characterization of chitin and chitosan. Cur Chem Biol. [Internet]. [diunduh 2012 Sept 14]; 3(2009):303-230. Tersedia pada: http://benthamscience.com/ccb/openacsesarticle/ccb3-2/0009CCB.pdf. Banos SB, Lauzardoa ANH, Vallea MHL, Barkab EA, Molinac EB, Wilsond CL.
2006. Chitosan as a potential natural compound to control pre and postharvest diseases of horticultural commodities. Crop Prot. [Internet]. [diunduh 2012 Sept 14]; 25(2006):108-118. Tersedia pada: http://www.sciencedirect.com/science/article/pii/S0261219405001110. Crawford DL, Lynch JM, Whipps JM, Ousley MA. 1993. Isolation and
characterization of actinomycete antagonists of a fungal root pathogen. App Env Microbiol. [Internet]. [diunduh 2013 April 11]; 59(11): 3899-3905. Tersedia pada: http://www.ncbi.nlm.nih.gov/pmc/articles/ PMC182547/. El Gaouth A, Ponnampalam R, Castaigne F, Arul J. 1992. Chitosan coating to
extend the storage life of tomatoes. Hort Sci. [Internet]. [diunduh 2012 Desember 17]; 27(9):1016-1018. Tersedia pada: http://hortsci. ashspublications.org/content/27/9/1016.abstract.
[FAO] Food and Agriculture Organization of the United Nations. 2011. Production data. [Internet]. [diunduh 2013 April 11]. Tersedia pada: http://faostat.fao.org/.
Franco ACG, Hernandez LR. 2009. Actinomycetes as a biological control agents of phytopathogenic fungi. Techno Chih. [Internet]. [diunduh 2013 April 11]; 3(2): 64–73. Tersedia pada: http://tecnociencia.uach.mx/numeros/v3n2/da-ta/Actinomycetes_as_biological_control_agents_of_phytopathogenic_fungi. pdf.
George M, Anjumol, George G, Hatha AAM. 2011. Distribution and bioactive potential of soil actinomycetes from different ecological habitats. Afric J Microbiol Res. [Internet]. [diunduh 2013 April 11]; 6(10): 2265-2271. doi: 10.5897/AJMR11.856.
Hamdayanty, Yunita R, Amin NN, Damayanti TA. 2012. Pemanfaatan kitosan untuk mengendalikan antraknosa pada pepaya (Colletotrichum gloeosporioides) dan meningkatkan daya simpan buah. Fitopatol Indo. [Internet]. [diunduh 2013 April 11]; 8(4): 97-102. Tersedia pada: http://journal.ipb.ac.id/index.php/jfiti/article/view/6779/5212.
Hirano A, Nagao N. 1989. Effects of chitosan, pectic acid, lysozyme and chitinase on the growth of several phytopathogens. Agric Biol Chem. [Internet]. [diunduh 2013 April 11]; 11(1989): 3065-3066. Tersedia pada: http://ci.nii.ac.jp/els/110006324114.pdf?id=ART0008331431&type=pdf&la ng=en&host=cinii&order_no=&ppv_type=0&lang_sw=&no=1365923364& cp=.
Holipah, SN. 2010. Aplikasi kitosan sebagai pengawet alami dalam meningkatkan mutu simpan produk pascapanen. [Internet]. [diunduh 2012 Oktober 2]. Tersedia pada: http://repository.ipb.ac.id/handle/123456789/ 27828.
15
Janse JD. 2005. Phytobacteriology: Principle and Practice. [Internet]. Wallingford (GB): CAB International Publishing; [diunduh 2013 April 11]. Tersedia pada: http://bookshop.cabi.org/Uploads/Books/PDF/9781845-930257/9781845930257.pdf
Kurzawinka H. 2007. Potential use of chitosan in the control of lettuce pathogens. [Internet]. Poland (PL): Krakow Department of Plant Protection; [diunduh 2012 Sept 14]. Tersedia pada: www.ptchit.lodz.pl/pliki/ PTChit_(otxwq05k-c7794z7j). pdf.
Kusandriani Y. 1996. Pembentukan Hibrida Cabai. Bandung (ID): Balai Penelitian Tanaman Sayuran.
Liu J, Tian S, Meng X, Xu Y. 2006. Effects of chitosan on control of postharvest diseases and physiological responses of tomato fruit. Postharv Biol Tech. [Internet]. [diunduh 2012 Sept 14]; 44(2007):300-306. Tersedia pada: http://tianlab.ibcas.ac.cn/04fbwz/2007/liujia-2007-PBT.pdf.
Madigan MT, John MM, dan Jack P. 1996. Brock Biology of Microorganisms 8th edition. New Jersey (US): Prentice-Hall.
Mari M, Guizzardi M. 1998. The postharvest phase: emerging technologies for the control of fungal diseases. Phytoparasitica. 26(1):59-66.
Martoredjo T. 2009. Ilmu Penyakit Pascapanen. Jakarta (ID): Bumi Aksara. Mattjik AA, Sumertajaya M. 2006. Perancangan Percobaan dengan Aplikasi SAS
dan Minitab. Bogor (ID): Institut Pertanian Bogor Press.
Montri P, Taylor PWJ, Mongkolporn O. 2009. Pathotypes of Colletotrichum capsici, the causal agent of chili anthracnose, in Thailand. Plant Dis. [Internet]. [diunduh 2012 Sept 14]; 93:17-20. doi:10.1094/PDIS-93-1-0017. Nawar LS. 2005. Chitosan and three Trichoderma spp. to control Fusarium crown and root rot of tomato in Jeddah, Kingdom Saudi Arabia. Egypt J Phytopathol. [Internet]. [diunduh 2012 Sept 14]; 33(2005): 45-58. Tersedia pada: http://www.onasseef.kau.edu.sa/Files/195/Researches/5620026534. pdf.
Okuzumi M, Fujii T. 2000. Nutrinional and Functional Properties of Squid and Cuttlefish. Japan Translation Center, Ltd, penerjemah. Tokyo (JP): Terjemahan dari: Ika no Eiyo kino Seibun.
Oskay M, Tamer AU, Azeri C. 2004. Antibacterial activity of some actinomycetes isolated from farming soils of Turkey. Afric J Biotechnol. [Internet]. [diunduh 2013 April 11]; 3(9): 441-446. Tersedia pada: http://www.academicjournals.org/AJB.
Prajnanta F. 2011. Mengatasi Permasalahan Bertanam Cabai. Jakarta (ID): Penebar Swadaya.
Purwati E, Jaya B, Duriat AS. 2000. Penampilan beberapa varietas cabai dan uji resistensi terhadap penyakit virus kerupuk. J Hort. [Internet]. [diunduh 2013 April 11]; 10(2): 88-94. Tersedia pada: http://www.pustaka.litbang. deptan.go.id/bptpi/lengkap/IPTANA/fullteks/okt05/JHORTI/2000/NO2/1.p df.
16
Restuati M. 2008. Perbandingan chitosan kulit udang dan kulit kepiting dalam menghambat pertumbuhan kapang Aspergillus flavus. Di dalam: Prosiding Seminar Nasional Sains dan Teknologi; 2008 Nov 17; Bandar Lampung. Bandar Lampung (ID): Satek. hlm 582-590.
Roberts PD, Pernezny KL, Kucharek TA. 2001. Anthracnose on pepper in Florida. [Internet]. Gainesville (US): University of Florida, IFAS Extension; [diunduh 2013 April 11]. Tersedia pada: http://edis.ifas.ufl.edu.
Sangdee A, Sachan S, Khankhum S. 2011. Morphological, pathological and molecular variability of Colletotrichum capsici causing anthracnose of chilli in the North-east of Thailand. Afric J Microbiol Res [Internet]. [diunduh 2013 April 11]; 5(25):4368-4372. Tersedia pada: http://www.academicjournals.org/ajmr/pdf/pdf2011/9Nov/Sangdee%20et% 20al.pdf. DOI: 10.5897/AJMR11.476.
Sariyanto N. 2006. Eksplorasi agens antagonis yang berpotensi menekan penyakit layu Fusarium pada pisang [skripsi]. Bogor (ID): Institut Pertanian Bogor. Schaad NW, Jones JB, Chun W. 2000. Laboratory Guide for Identification of
Plant Pathogenic Bacteria. St. Paul (US): APS Press.
Semangun, H. 2000. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Ed ke-4. Yogyakarta (ID): Gadjah Mada University Press.
Setiadi. 2008. Bertanam Cabai. Jakarta (ID): Penebar Swadaya.
Sharma RR, Dinesh S, Rajbir S. 2009. Biological control of postharvest diseases of fruits and vegetables by microbial antagonists: A review. Biol Contr. [Internet]. [diunduh 2012 Desember 17]; 50(2009): 205–221. Tersedia pada: http://www.sciencedirect.com/science/article/pii/S10499644090012-36. Simanjuntak VTA. 2012. Pengaruh kitosan terhadap penyakit kerdil hampa pada
tanaman padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Syukur M, Sujiprihati S, Koswara J, Widodo. 2009. Ketahanan terhadap antraknosa yang disebabkan oleh Colletotrichum acutatum pada beberapa genotipe cabai (Capsicum annuum L.) dan korelasinya dengan kandungan kapsaicin dan peroksidase. J Agron Indones. [Internet]. [diunduh 2012 Sept 19]; 37(3): 233-239. Tersedia pada: http://journal.ipb.ac.id/index.php/ jurnalagronomi/article/viewFile/1240/346.
18
Lampiran 1 Diameter koloni C. capsici setiap perlakuan pada uji in vitro dalam media tumbuh PDA sampai 7 hari setelah inokulasi (HSI)
Perlakuan HSI ul
Diameter koloni C. capsici (cm)a
19
20
Lampiran 3 Keparahan penyakit antraknosa buah cabai dengan inokulasi patogen pada masing-masing perlakuan
Perlakuan HSI ul
KP (%)
21
Lampiran 4 Hasil transformasi arcsin data keparahan penyakit antraknosa buah cabai dengan inokulasi patogen pada masing-masing perlakuan
Perlakuan HSI ul
KP
1 2 3 4 5 6 7 8 9 10 Kontrol 1 0.0 0.0 26.6 31.9 39.2 39.2 43.9 43.9 46.1 48.4
22
Lampiran 5 Keparahan penyakit antraknosa buah cabai tanpa inokulasi patogen pada masing-masing perlakuan
Perlakuan HSI ul
KP (%)
1 2 3 4 5 6 7 8 9 10 Kontrol 1 0 0 0 0 0 0 0 0 0 0
23
Lampiran 6 Ketegaran buah cabai 10 HSP berdasarkan hasil uji Kruskal-Wallis Kruskal-Wallis Test
Ranks
PERLAKUAN N Mean Rank
KETEGARAN BUAH
K 4 5,50
CT 4 20,75
APS5 4 12,00
APS12 4 11,38
CTAPS5 4 15,75
CTAPS12 4 25,63
APS512 4 10,50
Total 28
Test Statisticsa,b
KETEGARAN
BUAH
Chi-Square 16,580
Df 6
Asymp. Sig. ,011
a. Kruskal Wallis Test
b. Grouping Variable:
24
Lampiran 7 Morfologi koloni aktinomiset APS5 (a) dan APS12 (b)
Lampiran 8 Tepung kitosan (a) dan larutan kitosan konsentrasi 1% (b)
a b
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 17 Januari 1992 dari Bapak Muhammad Syahrul dan Ibu Masrifawati. Penulis adalah putri pertama dari tiga bersaudara. Tahun 2006 penulis menyelesaikan sekolah menengah atas di SMA Plus Negeri 17 Palembang, Sumatera Selatan dan pada tahun yang sama penulis diterima sebagai mahasiswa Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB) melalui jalur Ujian Talenta Mandiri IPB (UTMI).