FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2013
LIA ELVIRA
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Studi Histopatologi Organ Limpa Hamster (Mesocricetus auratus) yang Diinfeksi Coxiella burnetii adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
LIA ELVIRA. Studi Histopatologi Organ Limpa Hamster (Mesocricetus auratus) yang Diinfeksi Coxiella burnetii. Dibimbing oleh AGUS SETIYONO dan MAWAR SUBANGKIT.
Query fever (Q fever) merupakan zoonosis yang disebabkan oleh bakteri Coxiella burnetii. Tujuan penelitian ini adalah untuk mengetahui gambaran histopatologi limpa hamster (Mesocricetus auratus) yang diinfeksi Coxiella burnetii menggunakan pewarnaan Hematoksilin-Eosin (HE) dan Imunohistokimia (IHK). Penelitian ini menggunakan 6 ekor hamster yang dibagi menjadi dua pasase. Pemeriksaan gambaran histopatologi organ limpa hamster dengan pewarnaan HE pada hamster pasase pertama menunjukkan hasil yang relatif sama dengan hamster pasase kedua berupa hemoragi pulpa merah, serta infiltrasi sel radang. Sedangkan pengamatan histopatologi organ limpa hamster pasase pertama dengan pewarnaan IHK menunjukkan hasil yang tidak begitu jelas tingkat kepositifannya nya dibandingkan dengan hamster pasase kedua.
Kata kunci: Coxiella burnetii, Imunohistokimia, Query Fever,
ABSTRACT
LIA ELVIRA. Histopathological Study of Hamster’s (Mesocricetus auratus) Spleen which were Infected by Coxiella burnetii. Supervised by AGUS SETIYONO and MAWAR SUBANGKIT.
Query fever is a zoonosis caused by Coxiella burnetii (C. burnetii). The aim of this research was to determine the histopathological changes of spleen of hamster (Mesoscricetus auratus) which were infected by C. burnetii using Haematoxylin-Eosin (HE) and Immunohistochemistry (IHC) methods. This research used 6 hamsters which were devided into two passage. The histopathological examination picture with HE staining of first passage in hamsters showed relatively similar results with those the second passage such as red pulp hemorrhage and infiltration of inflammatory cells. Histopathological observation of spleen from first passage hamster by using IHC staining showed the positivity was unclear compared to the second passage hamster.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan
pada
Fakultas Kedokteran Hewan
LIA ELVIRA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Judul Skripsi : Studi Histopatologi Organ Limpa Hamster (Mesocricetus auratus) yang Diinfeksi Coxiella burnetii
Nama : Lia Elvira
NIM : B04090062
Disetujui oleh
drh Agus Setiyono, MS PhD APVet drh Mawar Subangkit, MSi Pembimbing I Pembimbing II
Diketahui oleh
drh Agus Setiyono, MS PhD APVet Wakil Dekan
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan juli 2012 sampai Juli 2013 ini ialah Q fever, dengan judul ”Studi Histopatologi Organ Limpa Hamster (Mesocricetus auratus) yang Diinfeksi Coxiella burnetii”.
Terima kasih penulis ucapkan kepada Bapak drh Agus Setiyono, MS PhD APVet dan Bapak drh Mawar Subangkit, MSi selaku pembimbing. Penghargaan juga penulis sampaikan kepada staf Laboratorium Patologi FKH IPB yang telah banyak membantu dalam pelaksanaan penelitian ini. Ungkapan terima kasih juga disampaikan kepada ayahanda Yurman Ma’is (alm) dan ibunda Rasdiana, kepada kakanda Herly, Fentry, Nanda, Dicky, dan Levran, kepada Bapak Dr drh Yusuf Ridwan, MSi selaku dosen Pembimbing Akademik, serta kepada teman sepenelitian atas doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Manfaat Penelitian 3
METODE 3
Waktu dan Tempat Penelitian 3
Bahan dan Peralatan 3
Metode Penelitian 4
Persiapan Hewan Coba 4
Persiapan Antigen 4
Perlakuan Penelitian 4
Pembuatan Sediaan Histopatologi 4
Proses Deparafinisasi 4
Pewarnaan Hematoksilin Eosin 5
Pewarnaan Imunohistokimia 5
HASIL DAN PEMBAHASAN 6
SIMPULAN 10
DAFTAR PUSTAKA 10
DAFTAR TABEL
1 Gambaran histopatologi limpa hamster pada pasase pertama dengan
pewarnaan HE dan IHK 8
2 Gambaran histopatologi limpa hamster pada pasase kedua dengan
pewarnaan HE dan IHK 8
DAFTAR GAMBAR
1
PENDAHULUAN
Latar Belakang
Query fever (Q fever) merupakan penyakit yang disebabkan oleh bakteri Coxiella burnetii (C. burnetii) Menurut OIE (2010) C. burnetii dahulu termasuk golongan Rickettsiaceae. Namun seiring berkembangnya ilmu pengetahuan, ternyata C. burnetii memiliki hubungan dekat dengan Legionella, Francisella, dan Rickettsiella. C. burnetii juga digolongkan kedalam jenis mikroorganisme kelompok B yang berbahaya dan dapat menjadi senjata biologis (Center of Disease Control and Prevention 2005). Selain itu C. burnetii digolongkan kedalam group resiko 3 dimana harus menggunakan penerapan biosafety level 3 dalam rangka isolasi agen. C. burnetii sangat resisten terhadap kondisi ekstrim seperti panas, kekeringan, desinfektan, serta radiasi sinar UV.
Q fever atau demam Q pertama kali ditemukan menyerang Australia pada tahun 1935. Pada saat itu Q fever menyerang para pekerja rumah potong di Bisbane. Setiyono (2005) menyatakan bahwa berdasarkan laporan WHO Q fever pertama kali ditemukan di Indonesia pada tahun 1937 dimana pada saat itu ditemukan antibodi terhadap agen C. burnetii pada serum sapi. Menurut OIE (2010) Q fever telah tersebar hampir keseluruh dunia kecuali New Zealand. Q fever dapat menyerang semua jenis hewan namun yang paling sering terjangkit adalah manusia, sapi, domba dan kambing (Arricau Bovery & Rodolakis 2005; EFSA 2010).
Q fever merupakan penyakit yang tergolong zoonosis yaitu dapat ditularkan dari hewan ke manusia dan sebaliknya. Hewan yang menderita Q fever biasanya tidak menunjukkan gejala yang spesifik. Pada fase akut C. burnetii akan ditemukan pada darah, hati, dan limpa hewan yang terinfeksi (Setiyono 2005). Setelah itu biasanya penyakit akan berlanjut menjadi kronis yang akhirnya hewan akan mengekskresikan bakteri tersebut didalam tinja maupun urin. Proses penularan penyakit ini dapat melalui kontak langsung dengan hewan terinfeksi ataupun terpapar oleh cairan plasenta hewan tertular, daging dari ternak yang terinfeksi, transfusi darah ataupun luka pada kulit, serta dapat pula tertular secara aerosol. Bahkan susu segar dari sapi yang terinfeksi bakteri C. burnetii juga dapat menjadi rute infeksi pada manusia (Ho et al. 1995; Setiyono et al. 2006). Selain itu penularan secara intraplasental juga dapat terjadi namun masih jarang dilaporkan.
Pada manusia penularan dapat terjadi secara aerosol ataupun kontak langsung dengan hewan yang terinfeksi maupun oleh partikel debu yang terkontaminasi agen. Selain itu penularan juga dapat terjadi melalui transfusi darah ataupun peroral akibat meminum susu tanpa pasteurisasi. Penularan secara vertikal melalui plasenta juga dapat terjadi namun masih jarang dilaporkan (CFSPH 2007). C. burnetii juga sering ditemukan pada wool sehingga memungkinkan terjadinya penularan melalui wool. Tidak hanya itu, penularan Q fever juga dapat terjadi melalui urin ataupun feses bahkan cairan alantois hewan yang terinfeksi agen tersebut.
2
manusia manifestasi klinis akibat infeksi agen ini dapat bersifat akut maupun kronis (ECDC 2010). Q fever yang bersifat akut biasanya dapat sembuh dengan sendirinya dalam jangka waktu dua hingga tiga minggu dengan pemberian antibiotik. Sedangkan pada Q fever yang bersifat kronis membutuhkan waktu berbulan-bulan bahkan sampai dua tahun lebih proses penyembuhannya. Gejala klinis akut biasanya tidak spesifik ataupun sangat ringan seperti flu, demam tinggi, lemah, sakit kepala, nyeri otot, lethargi, sakit tenggorokan, dan nyeri pada dada. Seringkali Q fever akut diikuti dengan adanya pneumonia dan hepatitis. Namun Q fever akut jarang sekali terjadinya komplikasi seperti diikuti dengan adanya meningitis, endokarditis, myokarditis, encephalitis dan lain-lain. Sedangkan pada keadaan kronis paling sering diikuti dengan adanya endokarditis. Hal ini biasanya terlihat pada seeorang yang telah mengalami kerusakan pada katup jantungnya ataupun dalam keadaan imunosupresi. Gejala lain yang dapat ditimbulkan akibat Q fever kronis adalah osteoarthritis, osteomyelitis, tendosynovitis, spondylodiscitis, abses paravetebral dan hepatitis.
Q fever sangat beresiko tinggi pada petugas kandang atau peternak yang sering kontak langsung dengan hewan ternak. Oleh karena itu penyakit ini digolongkan kedalam occupational disease atau berhubungan dengan pekerjaan. Dampak yang dapat timbul akibat adanya wabah Q fever sangat banyak selain abortus ataupun stillbirth. Misalnya terjadinya penurunan hasil produksi, penurunan kualitas daging yang secara otomatis akan berdampak pada kondisi ekonomi negara. Kemudian akibat adanya wabah maka akan menyebabkan turunnya jumlah wisatawan asing ke negara Indonesia yang disebabkan karena adanya rasa ketakutan dan kepanikan terhadap Q fever. Selain itu C. burnetii memiliki kemampuan untuk melumpuhkan manusia dalam kelompok besar dengan dosis yang rendah, memiliki ketahanan dalam lingkungan yang ekstrim serta rute transmisi secara aerosol sehingga dapat dijadikan sebagai agen bioterorisme (OIE 2010).
Menurut Setiyono et al. (2006) Q fever merupakan salah satu masalah penting bagi kesehatan masyarakat di berbagai negara seperti Australia, Amerika, Perancis, Inggris, Kanada dan Jepang. Bahkan Malaysia yang merupakan negara tetangga juga memiliki masalah terhadap penyakit ini. Hal ini tentunya menjadi ancaman bagi negara kita dan memungkinkan bahwa negara kita juga sebenarnya memiliki masalah yang besar tehadap kasus ini.Untuk itu pentingnya dilakukan penelitian mendalam mengenai Q fever ini di negara Indonesia. Mengingat di negara-negara yang telah disebutkan diatas telah melakukan penelitian yang demikian maju. Hal ini dikarenakan C. burnetii memiliki potensi sebagai senjata biologis atau yang sering disebut dengan bioterorisme.
Menurut CDC (2012), sejak tahun 1999 Q fever digolongkan sebagai penyakit yang harus dilaporkan (notifiable disease). Sedangkan Australia telah lebih dahulu menggolongkan Q fever kedalam kategori notifiable disease yaitu sejak tahun 1977. Jumlah kasus Q fever di Amerika yang telah dilaporkan kepada CDC meningkat sejak dikategorikan sebagai notifiable disease. Hal ini ditunjukkan dengan adanya laporan bahwa pada tahun 2000 terdapat 17 kasus dan pada tahun 2007 meningkat menjadi 167 kasus.
3 terhadap Q fever yang didukung oleh immunoflourescence assay (IFA) (Setiyono 2004). Namun, teknik ini sangat dipengaruhi oleh antigen standar yang dipakai. Teknik imunohistokimia memiliki tingkat akurasi yang sangat baik. Hal ini disebabkan karena jejak agen C. burnetii yang berada didalam organ maupun jaringan tubuh hewan dapat dilacak. Selain itu, teknik imunohistokimia ini juga dapat memberikan signal bagi keamanan pangan asal hewan. Bahkan sebagian peneliti berpendapat bahwa akurasi analisa imunohistokimia setara dengan pembacaan hasil reaksi polymerase chain reaction (PCR).
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui gambaran histopatologi organ limpa hamster (Mesocricetus auratus) yang diinfeksi C. burnetii.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Histopatologi, Bagian Patologi, Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian ini dilaksanakan pada bulan Juli 2012 sampai Juli 2013.
Alat dan Bahan
Bahan yang digunakan pada penelitian ini antara lain hamster jantan berumur 2 bulan sebanyak 6 ekor, sel C. burnetii, Buffer Neutral formalin 10%, etanol (30%, 50%, 70%, 80%, 90%, absolut), xylene, parafin, pewarna jaringan Mayer hematoksilin, pewarna eosin, pewarna imunohistokimia, Lithium carbonat etanol absolut I dan II, Xylene I dan II, perekat PermountTM, citrate buffer, PBS tween, 3% H2O2, methanol, dH2O, FBS 1%, Rabbit anti C. burnetii antibody,
biotin, Streptavidine, DAB (diaminobenzidine) dan aquades serta kebutuhan harian hamster.
4
Metode Penelitian
Persiapan Hewan Coba
Kandang diletakkan diatas meja atau rak yang telah disediakan dan dijaga agar tidak basah, lantai kandang diberi sekam yang berfungsi untuk memberikan kenyamanan pada hamster. Hewan coba yang digunakan adalah hamster sebanyak 6 ekor berumur 2 bulan. Hamster berasal dari indukan yang sama dan dipastikan bebas dari penyakit. Sebelum dilakukan penginjeksian hamster terlebih dahulu diadaptasikan pada kandang yang telah disediakan. Lama pengadaptasian berlangsung sekitar 7-10 hari.
Persiapan antigen
Antigen berupa sel C. burnetii strain Nine Mile didapat dari Laboratorium Rickettsia dan Chlamydia, National Institute of Infectious Disease, Tokyo, Jepang. Antigen kemudian di injeksikan kepada 4 ekor hamster secara intraperitoneum dengan dosis 0,4 ml. Kemudian diamati selama 7 hari dan dilihat perubahan fisik yang terjadi.
Perlakuan penelitian
Hamster yang telah menunjukkan perubahan fisik, kemudian dieutanasi menggunakan diazepam dengan dosis 0,25 mg/kg dan dinekropsi. Proses nekropsi berguna untuk melihat perubahan Patologi Anatomi (PA) pada organ limpa. Limpa yang telah dilihat PAnya diambil sebagian untuk dijadikan preparat histopatologi sedangkan sebagian lagi digerus dan diambil ekstraknya. Pembuatan ekstrak limpa dilakukan dengan menambahkan phosphate buffered saline (PBS) pada gerusan limpa. Kemudian campuran tersebut disentrifusi untuk mengambil ekstraknya. Ekstrak limpa tersebut kemudian diinjeksikan kembali kepada 2 ekor hamster dan diinkubasi selama 7 hari. Setelah itu perlakuan pada hamster ini sama dengan 4 hamster sebelumnya.
Pembuatan Sediaan Histopatologi
Pertama jaringan dicuci dengan aquades, kemudian jaringan tersebut difiksasi dengan menggunakan formalin 10%. Selanjutnya dilakukan proses dehidrasi dengan menggunakan etanol bertingkat (70%, 80%, 96% dan absolut). Jaringan yang telah didehidrasi kemudian diclearing menggunakan xylene 2 kali, masing-masing 60 menit. Proses dilanjutkan dengan infiltrasi menggunakan paraffin cair selama 60 menit pada suhu 51oC, kemudian dilakukan penelitian dalam paraffin cair pada cetakan dan didiamkan selama sehari. Paraffin yang sudah mengeras ditempelkan pada holder untuk dilakukan pemotongan setebal 4-6 µm dengan rotary microtome. Selanjutnya dilakukan mounting pada objek dengan menggunakan poly-L-Lysine.
Proses Deparafinisasi
5 Pewarnaan Hematoksilin-Eosin (HE)
Pewarnaan dilakukan pertama-tama dengan perwarna Mayer’s hematoksilin selama 4 menit. Kemudian dibilas dengan air mengalir dan dicuci dengan Lithium carbonat selama 3 detik, Setelah itu dibilas dengan air mengalir lagi. Selanjutnya jaringan dicelupkan ke dalam pewarna eosin selama6 menit. Kemudian sediaan dicuci dengan cara dicelupkan etanol 90% sebanyak 10 kali, etanol absolut I 10 kali, etanol absolut II selama 2 menit, xylene I selama 3 menit, xylene II selama 3 menit. Lalu dilanjutkan dengan menetesi sediaan dengan perekat PermountTM kemudian ditutup dengan cover glass. Terakhir sediaan kemudian diperiksa di bawah mikroskop.
Pewarnaan Imunohistokimia (IHK)
Berdasarkan reaksinya teknik imunohistokimia dibedakan menjadi dua macam yaitu imunohistokimia langsung dan tidak langsung. Imunohistokimia langsung berbeda dengan imunohistokimia tidak langsung. Hal ini disebabkan karena pada imunohistokimia tidak langsung terdapat adanya antibodi sekunder yang berikatan dengan antibodi primer dan dilabel oleh enzim. Pada penelitian ini, kami menggunakan teknik imunohistokimia tidak langsung.
Slide sebelum diwarnai harus diunmasking terlebih dahulu dengan citrate buffer selama 15 menit pada suhu 95oC. Kemudian slide dicuci dengan PBS tween 3 kali masing-masing 5 menit. Lalu dilakukan blocking endogenous peroxidase yaitu slide ditetesi 0,3% H2O2 yang terlarut dalam methanol selama 30 menit.
Kemudian dicuci kembali dengan PBS tween 3 kali masing-masing 5 menit. Setelah itu dilakukan proses blocking normal serum FBS 1% selama 30 menit. Lalu Slide preparat dicuci kembali dengan menggunakan PBS tween 3 kali masing-masing 5 menit. Selanjutnya slide diinkubasi dengan Rabbit anti C. burnetii antibody selama satu malam. Lalu dicuci kembali dengan PBS tween 3 kali masing-masing 5 menit. Kemudian slide ditetesi antibodi sekunder yaitu biotin selama 30 menit. Selanjutnya dicuci kembali dengan PBS tween 3 kali masing-masing 5 menit. Kemudian ditetesi dengan Streptavidine selama 30 menit. Lalu slide dicuci lagi dengan menggunakan PBS tween 3 kali masing-masing 5 menit sebelum dilakukan proses aplikasi kromogen untuk HRP yaitu DAB (diaminobenzidine) selama 15 detik. Kemudian slide direndam dalam air. Setelah itu dilakukan pewarnaan Mayer Hematoksilin selama 7 detik dan dicuci dengan air lagi. Kemudian dilakukan proses dehidrasi dan diclearing. Selanjutnya dilakukan proses mounting menggunakan cover glass, kemudian slide diamati dibawah mikroskop.
HASIL DAN PEMBAHASAN
6
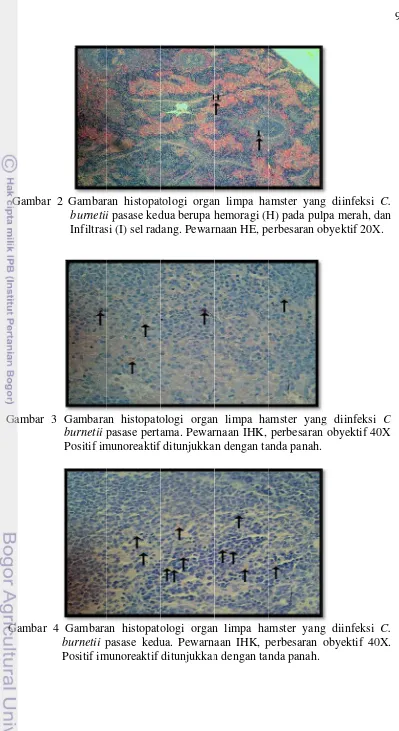
limpa hamster pada pasase kedua menunjukkan hasil yang serupa. Sehingga pada pewarnaan HE tersebut tidak dapat dilihat perbedaan tingkat keganasan C. burnetii antara pasase pertama dan pasase kedua hamster. Gambaran tersebut dapat ditunjukkan pada Gambar 2. Hasil pengamatan sediaan histopatologi dengan pewarnaan HE dan IHK organ limpa hamster yang telah diinjeksi antigen C. burnetii strain Nine Mile dapat dilihat pada Tabel 1. Sedangkan hasil pengamatan sediaan histopatologi dengan pewarnaan HE dan IHK organ limpa hamster pada pasase kedua dapat dilihat pada Tabel 2.
Hemoragi merupakan peristiwa keluarnya darah dari vaskula (ekstravasasi) ke luar tubuh, ke dalam rongga tubuh atau ke jaringan sekitarnya. Terjadinya hemoragi pada pulpa merah dimungkinkan disebabkan karena infeksi agen infeksius. Dalam kasus ini agen infeksius tersebut adalah antigen C. burnetii.
Migrasi sel-sel darah terutama netrofil dan monosit dari pembuluh darah ke jaringan merupakan suatu respon imun yang menunjukkan terjadinya peradangan akut. Pada keadaan ini, neutrofil akan bermigrasi ke jaringan dalam jumlah banyak. Kemudian diikuti dengan migrasi monosit yang akhirnya akan berdiferensiasi menjadi makrofag. Sel makrofag berfungsi dalam memakan benda-benda asing dan membentuk sel raksasa yang akan menghasilkan sitokin. Kemudian sitokin akan menyebabkan sel B berdiferensiasi menjadi sel plasma dan membentuk antibodi.
Dalam keadaan normal, jumlah limfosit sangat sedikit dijumpai pada jaringan tubuh. Namun, dalam keadaan patologis limfosit akan banyak ditemukan. Secara fungsional, sel limfosit dikelompokkan menjadi dua yaitu limfosit T dan limfosit B. Limfosit T berperan dalam reaksi kekebalan yang diperantarai oleh cell-mediated immunity. Sedangkan limfosit B berperan dalam produksi antibodi. Aktivasi folikel limfoid pada limpa berupa peningkatan jumlah limfosit dan makrofag merupakan suatu respon imunitas tubuh terhadap antigen. Sel B yang ada di folikel limfoid akan membentuk antibodi untuk melawan antigen yang masuk kedalam limpa. Menurut Tizard (2004), ketika ada infeksi antigen maka makrofag akan membawa antigen tersebut menuju folikel primer selanjutnya sel B akan bermigrasi kedaerah tersebut untuk membentuk antibodi. Sedangkan peningkatan jumlah megakaryosit akan menghasilkan banyak trombosit yang dapat menutupi kerusakan pembuluh darah akibat infeksi antigen.
Mikroorganisme intraseluler umumnya memiliki reseptor spesifik untuk dapat berikatan dengan sel inangnya. Coxiella burnetii fase I menghambat reseptor CR3 dan mengikat monosit melalui kompleks leucocyte response integrin (LRI) dan integrine associated protein (IAP) (Setiyono 2004). Berbeda dengan fase II yang justru memakai reseptor CR3 untuk dapat berikatan dengan sel monosit. Secara alamiah C. burnetii fase I memiliki kelemahan untuk dapat berikatan dengan sel inang melalui monosit. Tetapi apabila telah mampu menembus sel inang maka daya tahan untuk hidup didalamnya lebih lama. Sebaliknya C. burnetii fase II memiliki kemampuan untuk masuk kedalam sel inang namun tidak dapat bertahan lama didalamnya karena terbunuh melalui phagolisosomal pathway. Hal ini sejalan dengan hasil penelitian ini bahwa pada sediaan histopatologi limpa hamster pada pasase pertama dan kedua dengan pewarnaan HE ditemukan infiltrasi monosit.
7 periode postnatal, limpa berperan penting dalam produksi antibodi. Selain itu limpa juga berperan dalam pengangkutan sel-sel yang tidak berguna lagi dari aliran darah. Peran ganda ini terlihat dari komponen kompleks limpa yaitu pulpa merah dan pulpa putih. Sistem kekebalan dibentuk oleh pulpa putih sedangkan pulpa merah berperan untuk mengangkat eritrosit yang rusak, sudah tua, maupun benda-benda asing yang berada di aliran darah.
Menurut Andoh et al. (2003) infiltrasi sel makrofag merupakan salah satu lesi histopatologi yang dapat terlihat pada mencit yang telah diinokulasi dengan C. burnetii. Hal ini menunjukkan bahwa pada hamster yang diinjeksikan dengan antigen C. burnetii maupun yang diinjeksikan dengan ekstrak limpa yang telah diinjeksikan antigen C. burnetii sebelumnya memiliki lesi yang sama dengan lesi tikus yang diinokulasikan dengan agen tersebut berupa infiltrasi makrofag.
Lesi histopatologi organ limpa hamster dengan pewarnaan HE belum begitu spesifik baik pada pasase pertama maupun pasase kedua. Gambaran kerusakan histopatologi akibat infeksi C. burnetii pada limpa hamster ini masih tidak dapat dibedakan dengan kerusakan akibat penyakit lain. Untuk melihat lebih jauh penyebab kerusakan tersebut adalah oleh infeksi C. burnetii maka dilakukan pewarnaan IHK.
Gambaran hasil pengamatan histopatologi organ limpa hamster dengan pewarnaan IHK pada pasase pertama yang merupakan fase dua tidak menunjukkan hasil yang begitu jelas. Gambaran tersebut dapat terlihat pada Gambar 3. Pada pasase pertama menunjukkan hasil positif hanya pada daerah pulpa merah, bahkan pada hamster IC tidak menunjukkan hasil positif. Sedangkan pada pasase kedua kemungkinan telah terjadi perubahan fase dari fase dua menjadi fase satu. Hal ini dapat dilihat dari gambaran pewarnaan IHK dengan hasil yang lebih jelas dari pasase pertama. Gambaran histopatologi limpa hamster yang terlihat dengan pewarnaan IHK pada pasase pertama rata-rata setiap lapang pandang ditemukan sekitar 9 titik yang menunjukkan hasil positif imunoreaktif. Sedangakan pada pasase kedua rata-rata setiap lapang pandang ditemukan sekitar 19 titik yang menunjukkan hasil positif imunoreaktif. Gambaran hasil pewarnaan IHK pada pasase kedua juga terlihat lebih menyebar dengan ditemukannya hasil positif pada pulpa putih dan kapsula. Gambaran ini dapat terlihat pada Gambar 4. Hal ini membuktikan bahwa tingkat virulensi C. burnetii pada fase satu lebih tinggi dari fase dua. Hal ini sejalan dengan pernyataan Setiyono (2005) yang menyebutkan bahwa antigen C. burnetii fase I lebih patogen dibandingkan fase II.
10
SIMPULAN
Gambaran organ limpa hamster yang diinfeksi C. burnetii dengan pewarnaan HE menunjukkan perubahan berupa infiltrasi sel radang netrofil, monosit, makrofag, megakaryosit, dan limfosit. Hasil pemeriksaan dengan pewarnaan IHK menunjukkan positif imunoreaktivitas pada organ limpa.
DAFTAR PUSTAKA
Andoh M, Naganawa T, Hotta A, Yamaguchi T, Fukushi H, Masegi T, Hirai K. 2003. SCID Mouse Model for Lethal Q Fever. Infect and Immun 71(8): 4717-4723.
Arricau BN, Rodolakis A. 2005. Is Q fever an emerging or re-emerging zoonosis. Vet Res (3): 327–349.
[CDC] Centers for Disease Control and Prevention. 2012. Statistic - Q fever. USA: Centers for Disease Control and Prevention 1600 Clifton Rd. Atlanta.
[CFSPH] The Centers for Food Security & Public Health. 2007. Q Fever Ames Iowa USA: Iowa State University College of Veterinary Medicine.
[ECDC] European Centre for Disease Prevention and Control. 2010. Panel with Representatives from the Netherlands, France, Germany, United Kingdom, United States of America. Risk assessment on Q fever. ECDC Technical Report, 40 pp. doi:10.2900/28860. Available online: www.ecdc.europa.eu [EFSA] European Food Safety Authority. 2010. Scientific Opinion on Q Fever.
EFSA J 8 (5):1595-1736. Available online: www.efsa.europa.eu
Fournier PE, Thomas JM, Raoult D. 1998. Diagnosis of Q fever . J. Clin. Microbiol. 36(7):1823-1834.
Ho T, Htwe KK, Yamasaki N, Zhang GO, Ogawa M, Yamaguchi T, Fukushi H, Hirai K. 1995. Isolation of Coxiella burnetii from catlle and ticks, and some Characteristics of the isolates in Japan. Microbiol. Immunol. 39(9): 663 – 671
Maurin M, Raoult D. 1999. Q Fever. Clin. Microbiol. Rev. 12(4):518-553.
[OIE] Office Internationale des Epizootics. 2010. Q Fever. OIE Terrestrial Manual 2010.Chapter 2.1.12.
Playfair JHL, Chain BM. 2005. Immunology At A Glance Eight Edition. London(GB): Blackwell Publishing.
Samuel JE, Hendrix LR. 2009. Laboratory maintenance of Coxiella burnetii. Curr. Proto. Micriobiol., 6C (suppl.15), 1–16.
Setiyono, A. 2004. The Development of new surveillance system for prevention of zoonosis, especially Q fever. Post Doctoral Report Supported by the Japan Health Sciences Foundation. Laboratory of Rickettsia and Chlamydia, Department of Virology I, National Institute of Infectious Diseases 1-23-1 Toyama, Shinjuku-Ku, Tokyo, Japan.
11 Setiyono A, Ogawa M, Cai Y, Shiga S, Kishimoto T, Kurane. 2005. New Criteria
for Immunofluorescence Assay for Q fever Diagnosis in Japan. J. Clin. Microbiol. 43(11): 5555 – 5559.
Setiyono A, Mahatmi A, Soejoedono RD, Pasaribu FA. 2006. Deteksi Coxiella burnetii pada ruminansia. Seminar Nasional Teknologi Peternakan dan Veteriner: 260-266.
Sidi BK, Duquesne V, Rousset E, Cochonneau D, Cutler SJ, Frangoulidis D, Rodolakis A, Roest HJ, Ruuls R, Van RB, Vincent G, Thiery R. 2009. A multicentre MLVA and MST typingring trial for C. burnetii genotyping: An approach to standardization of methods. 5th MedVetNet Annual Scientific Conference. Madrid, Spain.
Swearengen JR. 2012. Biodefense: Research Methodology and Animal Models. USA: Taylor & Francis Group, LLC: 185.
12
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 03 januari 1992 di Kabupaten Lahat, Sumatera Selatan dari bapak Yurman Ma’is dan ibu Rasdiana. Penulis merupakan anak bungsu dari enam bersaudara.
Pendidikan formal yang pernah ditempuh sebelumnya, yaitu SDN 47 Lahat pada tahun 1998, SMPN 5 Lahat pada tahun 2003, dan SMAN 2 Lahat pada tahun 2006. Kemudian pada tahun 2009 penulis melanjutkan pendidikannya di Fakultas Kedokteran Hewan Institut Pertanian Bogor melalui jalur USMI.