DETEKSI AVIAN INFLUENZA PADA ANAK AYAM UMUR
SEHARI MENGGUNAKAN UJI CEPAT DAN REAL TIME
RT-PCR
INTARTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Deteksi Avian Influenza pada Anak Ayam Umur Sehari Menggunakan Uji Cepat dan Real Time RT-PCR adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
INTARTI. Deteksi Avian Influenza pada Anak Ayam Umur Sehari Menggunakan Uji Cepat dan Real Time RT-PCR. Dibimbing oleh RETNO D SOEJOEDONO dan TRIOSO PURNAWARMAN.
Avian influenza merupakan zoonosis prioritas yang memerlukan prioritas untuk dikendalikan dan ditanggulangi. Anak ayam umur sehari merupakan salah satu hewan yang berpotensi membawa risiko masuk dan tersebarnya penyakit avian influenza. Kasus penyakit avian influenza yang tidak terdeteksi dengan tepat, menyebabkan meluasnya kasus di lapangan. Pemilihan sampel dan metode uji yang tepat penting untuk membuat diagnosis yang cepat dan handal. Uji cepat masih digunakan karena memberikan hasil uji yang cepat sehingga penyebaran avian influenza di lapangan dapat dicegah secara maksimal. Penelitian ini bertujuan untuk mendeteksi kasus avian influenza pada anak ayam umur sehari yang dilalulintaskan melalui Bandara Mozes Kilangin menggunakan uji cepat dan real time reverse transcriptase polymerase chain reaction (rRT-PCR).
Besaran sampel usap trakea dihitung berdasarkan metode disease detection didapatkan 113 sampel usap trakea berasal dari Jayapura, Surabaya, dan Kediri. Metode pengujian sampel usap trakea yang digunakan dalam penelitian ini adalah uji cepat dan rRT-PCR. Primer yang digunakan dalam metode rRT-PCR adalah
primer forward H5 IVA-D148H5 (5ʹ
-AACAGAGAGGAAATAAGTGGAGTAAA-ATT-3ʹ), primer reverse H5 IVA-D149H5 (5ʹ-AAAGATAGACCAGCTACCATGATTGC-3ʹ), probe H5-IVA-H5a (5ʹFAM-TCAACAGTGGCGAGTTCCCTAGCA-TAMRA3ʹ), primer forward H5 IVA-D204f (5ʹ-ATGGCTCCTCGGRAACCC-ATT-3ʹ), primer reverse H5 IVA-D205r (5ʹ-TTYTCCACTATGTAAGACCATTCCG-3ʹ), probe H5-IVA-D215P (5ʹFAM-ATGTGTGACGAATTCMT-MGBNFQ-3ʹ). Data yang dihasilkan dari penelitian dianalisis secara deskriptif.
Hasil uji cepat dari sampel usap trakea menunjukkan bahwa anak ayam umur sehari tidak terdeteksi virus avian influenza. Hasil ini ditandai dengan munculnya satu garis berwarna ungu pada garis kontrol. Hasil pengujian dengan metode rRT-PCR menunjukkan hasil tidak terdeteksi virus avian influenza. Hasil uji ini ditandai dengan grafik tidak membentuk kurva sigmoid dan nilai cycle treshold undetermined.
SUMMARY
INTARTI. Detection Avian Influenza in Day Old Chick Using Rapid Test and Real Time RT-PCR. Supervised by RETNO D SOEJOEDONO and TRIOSO PURNAWARMAN.
Avian influenza is a priority zoonoses that require to be controlled and mitigated. Day old chicks is one animal that has potential to carry the risk of entry and spread of avian influenza. Cases of avian influenza that has not detected correctly, causing the spread of cases in the field. Sample and test methods are selected appropriately is important to make a fast and reliable diagnosis. Rapid test method is used because it provides a rapid test results so that the spread of avian influenza in the field can be prevented to the maximum. The aim of this study was to detect avian influenza in day old chicks transported via Mozes Kilangin Airport by rapid test and real time reverse transcriptase polymerase chain reaction (rRT-PCR).
Sample size of tracheal swab was calculated based on disease detection method, obtained 113 tracheal swab originating from Jayapura, Surabaya, and Kediri. The examination of tracheal swab samples were conducted using rapid test and rRT-PCR. Primers used in the rRT-PCR method are primer forward H5 IVA-D148H5 (5ʹ-AACAGAGAGGAAATAAGTGGAGTAAA-ATT-3ʹ), primer reverse H5 IVA-D149H5 (5ʹ-AAAGATAGACCAGCTACCATGATTGC-3ʹ), probe H5-IVA-H5a (5ʹFAM-TCAACAGTGGCGAGTTCCCTAGCA-TAMRA3ʹ), primer forward H5 IVA-D204f (5ʹ-ATGGCTCCTCGGRAACCC-ATT-3ʹ), primer reverse H5 IVA-D205r (5ʹ-TTYTCCACTATGTAAGACCATTCCG-3ʹ), probe H5-IVA-D215P (5ʹFAM-ATGTGTGACGAATTCMT-MGBNFQ-3ʹ). The data generated from the study were analyzed descriptively.
Rapid test results from tracheal swab samples showed that the day old chicks were not detected towards avian influenza virus. This results are marked by the appearance of a purple line on the control line. Test results with rRT-PCR showed were not detected towards avian influenza virus. This results are marked by graph which do not form a sigmoid curve and cycle threshold value undetermined.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Kesehatan Masyarakat Veteriner
DETEKSI AVIAN INFLUENZA PADA ANAK AYAM UMUR
SEHARI MENGGUNAKAN UJI CEPAT DAN REAL TIME
RT-PCR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Deteksi Avian Influenza pada Anak Ayam Umur Sehari Menggunakan Uji Cepat dan Real Time RT-PCR
Nama : Intarti NIM : B251130204
Disetujui oleh Komisi Pembimbing
Prof Dr Drh Retno D Soejoedono, MS Ketua
Dr Drh Trioso Purnawarman, MSi Anggota
Diketahui oleh
Ketua Program Studi
Kesehatan Masyarakat Veteriner
Dr med vet Drh Denny Widaya Lukman, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 4 Februari 2015 (tanggal pelaksanaan ujian tesis)
Tanggal Lulus:
(tanggal penandatanganan tesis oleh Dekan Sekolah
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah. Tema penelitian yang dipilih dengan judul “Deteksi Avian Influenza pada Anak Ayam Umur Sehari Menggunakan Uji Cepat dan Real Time RT-PCR”.
Penghargaan dan terima kasih penulis ucapkan kepada Prof Dr Drh Retno D Soejoedono, MS dan Dr Drh Trioso Purnawarman, MSi selaku pembimbing, yang telah banyak meluangkan waktu untuk membimbing, mengarahkan dan mendorong penulis sejak awal usulan penelitian hingga selesainya penulisan tesis ini. Terima kasih juga disampaikan kepada Dr med vet Drh Denny Widaya Lukman, MSi selaku Ketua Program Studi Kesehatan Masyarakat Veteriner. Penulis sampaikan pula ucapan terima kasih kepada Badan Karantina Pertanian yang telah memberikan beasiswa, Stasiun Karantina Pertanian Kelas 1 Timika dan manajer program kelas khusus karantina Program Studi Kesehatan Masyarakat Veteriner serta pak Agus yang sudah membantu kelancaran studi ini. Terima kasih juga kepada rekan-rekan sejawat kelas khusus karantina Program Studi Kesehatan Masyarakat Veteriner tahun 2013 (Tini, Anin, Yasmin, Hanif, Zulfikhar, Rifky, Syahdu, Saimah, Citra, Ambar, Leo, Kamil, Sumitro, Aditya, Heru, Santo, Winda, Doni, Isti).
Akhirnya ucapan terima kasih yang dalam kepada Ibu Rubiyem, Bapak Girno Raharjo, adik, suami Andi Hajar Aswad dan anakku Andi Alfaraby Ibnu Hajar yang telah memberikan dukungan moral dan material dalam menyelesaikan penulisan tesis ini. Terima kasih juga penulis sampaikan kepada semua pihak yang tidak dapat kami sebutkan satu persatu yang telah membantu dalam kelancaran studi dan penelitian ini.
Semoga karya ilmiah ini dapat bermanfaat.
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 TINJAUAN PUSTAKA 4
Karakteristik Virus Avian Influenza 4
Ketahanan Virus Avian Influenza di Lingkungan 5
Patogenesis Virus Avian Influenza 5
Avian Influenza pada Unggas dan Anak Ayam Umur Sehari (DOC) 6 Metode Diagnosa Avian Influenza 7
3 METODE 9
Tempat dan Waktu Penelitian 9
Bahan dan Alat 9
Metode Pengambilan Sampel 9
Uji Cepat Avian Influenza 10
Uji rRT-PCR 10
Analisis Data 13
4 HASIL DAN PEMBAHASAN 14
Deteksi AI pada DOC 14
Uji Cepat dan rRT-PCR Virus AI 16
5 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 25
DAFTAR TABEL
1 Dampak infeksi virus AI pada unggas komersial di wilayah Hazara 7
2 Besaran sampel DOC 10
3 Preparasi untuk membuat viral lysis/binding sol 11
4 Preparasi untuk membuat bead resuspension mix 11
5 Preparasi wash solution mix 12
6 Komposisi master mix rRT-PCR untuk AI H5 12
7 Hasil sampel usap trakea DOC yang diambil di Bandara Mozes Kilangin 14 8 Hasil pengujian AI menggunakan uji cepat dan rRT-PCR 14
DAFTAR GAMBAR
1 Struktur virus Influenza 4
2 Prinsip uji cepat AIV Ag 8
3 Anak ayam umur sehari (DOC) a) broiler, b) ayam kampung super yang dilalulintaskan melalui Bandara Mozes Kilangin 15 4 Hasil uji cepat sampel usap trakea terbentuk hanya satu garis berwarna
ungu, a) asal Jayapura 1, b) asal Jayapura 3, c) asal Jayapura 4, d) asal
Surabaya, e) asal Kediri 16
5 Kurva amplifikasi hasil uji RT-PCR virus avian influenza H5 a) kontrol positif membentuk kurva sigmoid dan menembus batas threshold, b) batas threshold 0.2, c) 113 sampel, kontrol negatif dan kontrol tanpa template tidak membentuk kurva yang sigmoid dan tidak menembus batas
threshold 17
DAFTAR LAMPIRAN
1 Data hasil uji cepat dan rRT-PCR usap trakea DOC 25 2 Nilai cycle threshold (Ct) rRT-PCR AI H5 (threshold 0.2, baseline start 3,
baseline end 15, reporter FAM, quencher TAMRA) 28
1
PENDAHULUAN
Latar Belakang
2
Peningkatan intensitas dan volume perdagangan hewan termasuk anak ayam umur sehari (day old chick/ DOC) yang berdampak pada tingginya risiko masuk dan tersebarnya penyakit hewan karantina HPAI menuntut kesiapan karantina hewan. Persyaratan lalu lintas DOC yang berkaitan dengan tindakan karantina antara lain DOC bibit induk (parent stock) dan final stock berasal dari peternakan yang induknya telah divaksinasi, DOC yang dilalulintaskan harus memiliki titer maternal antibodi yang protektif terhadap virus AI, uji rRT-PCR dengan primer matriks dan H5 menunjukkan hasil negatif atau tidak ditemukan adanya partikel virus AI serta berasal dari peternakan pembibitan yang tidak terjadi kasus AI sekurang-kurangnya 30 hari terakhir sebelum dikeluarkan (Deptan 2008). Tindakan monitoring harian atau mingguan merupakan langkah yang paling tepat untuk mengetahui kebenaran persyaratan dokumen karantina, monitoring dinamika penyakit AI dari DOC yang dilalulintaskan (Mujiatun 2009).
Avian influenza merupakan salah satu penyakit hewan menular strategis (Kementan 2013a) dan zoonosis prioritas. Zoonosis prioritas merupakan zoonosis yang memerlukan prioritas untuk dikendalikan dan ditanggulangi. Pengendalian dan penanggulangan zoonosis prioritas dilakukan di daerah tertular dengan prioritas nasional (Kementan 2013b). Kasus-kasus penyakit HPAI menjadi sulit diagnosanya dengan adanya kasus subklinik (Barantan 2006). Kasus subklinik mengakibatkan hewan yang terinfeksi tidak menunjukkan gejala penyakit tetapi di dalam tubuhnya terdapat agen penyakit (Wibawan 2012). Adanya kasus penyakit HPAI yang tidak terdeteksi dengan tepat, menyebabkan meluasnya kasus di lapangan (Barantan 2006). Praktek pengendalian secara komprehensif dengan penerapan biosekuriti. Tiga perlakuan utama dalam biosekuriti yaitu isolasi, kontrol lalu lintas dan sanitasi. Kontrol lalu lintas dan sanitasi merupakan metoda yang efektif untuk mengendalikan manajemen resiko suatu penyakit. Penanganan dan pengawasan lalu lintas unggas yang terinfeksi HPAI atau berasal dari kandang tertular harus dilakukan dengan cermat untuk meminimalkan resiko kerugian peternak.
Prosedur operasional standar disusun untuk lebih meningkatkan kewaspadaan terhadap menyebarnya wabah AI. Prosedur tersebut antara lain biosekuriti, depopulasi, vaksinasi unggas, pengawasan lalulintas unggas, diagnosa dengan deteksi dini, pengisian kandang kembali, public awareness (Deptan 2008). Provinsi Papua dan Papua Barat merupakan provinsi berstatus kasus rendah AI (Widiasih et al. 2012). Perkembangan kasus AI pada unggas di Papua terutama di Kabupaten Mimika pada bulan Mei 2014 telah ditemukan satu kasus AI berdasarkan hasil surveilen Balai Besar Veteriner Maros (Ditjennak 2014). Pencegahan masuk dan tersebarnya AI melalui DOC di Kabupaten Mimika telah dilakukan. Hal ini dibuktikan dengan ditemukannya DOC positif AI pada tahun 2013 (SKP Kelas I Timika 2014).
Perumusan Masalah
3 kerugian ekonomi, kesehatan manusia, lingkungan, keresahan masyarakat, kematian hewan yang tinggi, potensi masuk dan menyebarnya penyakit hewan. Kewaspadaan terhadap masuknya penyakit hewan menular AI harus ditingkatkan. Karantina hewan harus mampu mendeteksi AI pada DOC yang mungkin saja lolos dari hasil pemeriksaan di daerah asal. Pengawasan penyakit AI diperlukan untuk memperoleh status bebas AI pada peternakan yang akan mengirim unggas atau produknya. Pemilihan sampel dan metode uji yang tepat penting untuk membuat diagnosis yang cepat dan handal. Deteksi virus AI secara rutin di lapangan memerlukan metode yang cepat, akurat, sensitif, dan spesifik sehingga keberadaan virus AI dapat dengan cepat, tepat, dan akurat diketahui. Saat ini terdapat beberapa metode untuk mendeteksi AI pada unggas, sehingga perlu kajian ilmiah untuk memberikan gambaran tentang metode untuk mendeteksi AI pada DOC secara cepat.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendeteksi kasus AI pada DOC yang dilalulintaskan melalui Bandara Mozes Kilangin menggunakan uji cepat dan real time reverse transcriptase polymerase chain reaction (rRT-PCR).
Manfaat Penelitian
4
2
TINJAUAN PUSTAKA
Karakteristik Virus Avian Influenza
Virus AI merupakan virus RNA yang termasuk dalam famili Orthomyxoviridae, mempunyai tiga genus yaitu virus Influenza tipe A, B dan C. Virus Influenza A ditemukan pada unggas, manusia, babi, kuda. Virus Influenza B dan C hanya ditemukan pada manusia (OIE 2004). Virus Influenza tipe A terbagi dalam subtipe berdasarkan hubungan antigenik pada permukaan glikoprotein hemaglutinin (H) dan neuraminidase (N). Struktur virus Influenza ditunjukan pada Gambar 1. Saat ini terdapat 16 subtipe H yang telah dikenali (H1-H16) dan 9 subtipe neuraminidase (N1-N9) (Fouchier et al. 2005). Masing-masing virus memiliki H dan N antigen subtipe dengan berbagai kombinasi. Semua subtipe dan sebagian besar kombinasi yang telah diisolasi dari spesies Avian (Olsen et al. 2006).
Virion virus AI berbentuk sperikal dengan diameter 80 sampai 120 nm. Permukaannya diselubungi oleh filamen sepanjang 10 sampai 12 nm. Virus AI mempunyai selubung yang terdiri atas kompleks protein, lemak dan karbohidrat. Penentu utama sifat antigenik virus AI adalah hemaglutinin dan neuraminidase. Keduanya merupakan glikoprotein transmembran dan memiliki kemampuan untuk menimbulkan respon imun yang spesifik untuk subtipe yang sama. Respon imun yang terbentuk tidak dapat bereaksi silang atau protektif terhadap subtipe lainnya (Widiasih et al. 2012).
Gambar 1 Struktur virus Influenza (Adams & Sandrock 2010)
5 ditandai dengan angka kematian hampir 100% pada unggas terutama ayam buras dan ras dengan atau tanpa menunjukkan gejala klinis sebelum terjadi kematian (Hejawuli & Dharmayanti 2008). Virus LPAI bereplikasi dalam usus dan organ pernapasan dan shedding virus terutama dalam feses unggas yang terinfeksi, dengan beberapa shedding orofaringeal (Keawcharoen 2008). Penularan virus LPAI terjadi terutama melalui fekal oral. Virus HPAI bereplikasi secara sistemik pada unggas dan lebih mudah ditularkan melalui nasal dan oral (Harimoto & Kawaoka 2005).
Ketahanan Virus Avian Influenza di Lingkungan
Virus AI H5N1 termasuk tipe ganas dan peka terhadap panas. Virus ini dapat bertahan hidup di air sampai 4 hari pada suhu 22 ºC dan lebih dari 30 hari pada suhu 0 ºC. Virus dapat bertahan lama di dalam kotoran dan tubuh unggas yang sakit tetapi mati pada pemanasan 60 ºC selama 30 menit. Semakin tinggi suhu, virus semakin mudah mati (Soejoedono & Handharyani 2006). Partikel virus dapat bertahan hidup selama 48 jam di permukaan peralatan (Tamher & Noorkasiani 2008). Hal ini menunjukkan bahwa virus AI dapat bertahan di lingkungan dalam kurun waktu dan suhu tertentu. Sifat tersebut memungkinkan terjadinya penyebaran virus AI di alam (Tabbu 2000). Sekresi virus AI di lingkungan akan terlindungi oleh material organik dan tahan terhadap pengaruh kimia dan fisik. Pemberian perlakuan sinar ultraviolet (UV) pada feses unggas tidak efektif dalam membunuh virus HPAI (Widiasih et al. 2012).
Patogenesis Virus Avian Influenza
Mutasi genetik virus AI seringkali terjadi sesuai dengan kondisi dan lingkungan replikasinya. Mutasi gen ini tidak saja untuk mempertahankan diri tetapi juga dapat meningkatkan sifat patogenisitasnya. Virus AI mampu bermutasi melalui dua cara yaitu antigenic drift dan antigenic shift. Antigenic drift terjadi karena perubahan struktur antigen yang bersifat minor pada antigen permukaan HA atau NA. Pola mekanisme mutasi melalui antigenic drift ini hanya menyebabkan penambahan atau pengurangan urutan nukleotida antigen HA, NA atau keduanya tanpa menghasilkan subtipe virus baru. Antigenic shift terjadi karena perubahan struktur antigen yang bersifat dominan pada antigen permukaan HA atau NA melalui aktivitas dua macam subtipe virus AI sehingga mampu menghasilkan virus subtipe baru sebagai hasil rekombinasi genetik (Hejawuli & Dharmayanti 2008).
6
AI H5N1 dapat bereplikasi di dalam sel nasofaring (Peiris et al. 2004), dan di dalam sel gastrointestinal (de Jong et al. 2005; Uiprasertkul et al. 2005).
Fase penempelan (attachment) adalah fase yang paling menentukan apakah virus bisa masuk atau tidak ke dalam sel hospesnya untuk melanjutkan replikasinya. Virus Influenza A melalui spikes hemaglutinin akan berikatan dengan reseptor yang mengandung sialic acid (SA) yang ada pada permukaan sel hospesnya. Molekul reseptor yang ada pada manusia dengan reseptor yang ada pada unggas atau binatang terdapat perbedaan. Virus AI dapat mengenali dan terikat pada reseptor yang hanya terdapat pada jenis unggas yang terdiri dari oligosakarida yang mengandung N-acethylneuraminic acid -2,3-galactose (SA
-2,3- Gal), molekul ini berbeda dengan reseptor yang ada pada manusia. Reseptor yang ada pada permukaan sel manusia adalah SA - 2,6-galactose (SA-2,6-Gal), sehingga secara teoritis virus AI tidak bisa menginfeksi manusia karena perbedaan reseptor spesifiknya. Perubahan hanya satu asam amino saja konfigurasi reseptor tersebut dapat dirubah sehingga reseptor pada manusia dikenali oleh HPAI H5N1. Potensi virus AI H5N1 untuk melakukan mutasi inilah yang dikhawatirkan sehingga virus dapat membuat varian-varian baru dari HPAI H5N1 yang dapat menular antar manusia ke manusia (Russel & Webster 2005; Stevens et al. 2006).
Avian Influenza pada Unggas dan Anak Ayam Umur Sehari (DOC)
Menurut Wibawan (2012) antibodi terhadap virus HPAI H5N1 dapat menahan replikasi virus AI sehingga tidak menimbulkan gejala sakit dan kematian. Hal ini menyebabkan induk semang tidak melakukan eliminasi terhadap virus AI tersebut. Penelitian tersebut memberi informasi awal tentang peran DOC dalam penyebaran penyakit ke berbagai wilayah distribusinya. Manifestasi subklinik AI terjadi apabila induk semang membentuk respon kebal yang tidak memadai, sehingga tidak mampu mengeliminasi virus yang menginfeksinya secara sempurna. Penyebab terjadinya manifestasi subklinis, yaitu:
1. Kondisi penyakit AI yang sudah endemik, dalam kondisi ini akan terjadi infeksi virus HPAI subtipe H5N1 secara alamiah dan menimbulkan respon kebal dengan titer antibodi yang tidak memadai
2. Penggunaan bibit vaksin AI yang kurang tepat, yaitu homologi bibit vaksin dan virus lapangan sangat rendah sehingga tidak terjadi netralisasi virus AI secara sempurna
3. Aplikasi vaksin yang tidak tepat, misalnya unggas hanya divaksin satu kali saja tanpa adanya vaksinasi yang kedua (booster) sehingga terbentuk titer antibodi yang tidak memadai
4. Sifat virus AI yang selalu berubah (antigenic drift dan antigenic shift), sehingga tidak dikenali secara sempurna oleh antibodi yang timbul akibat vaksinasi.
7 Hasil deteksi virus AI (antigen) pada sampel organ trakea, paru-paru dan usus DOC dengan teknik immunohistokimia diperoleh hasil positif sebanyak 65.8% (Setyawati 2010). Sampel DOC asal Cianjur memiliki prevalensi virus Influenza A sebesar 2.08%, sampel kadaver DOC impor dari USA memiliki prevalensi virus Influenza A sebesar 1.74%. Virus AI yang terkandung dalam DOC merupakan virus yang hidup dan berpotensi menularkan ke unggas lain dan menyebar ke wilayah tujuan DOC dikirim. Adanya virus AI yang hidup dalam tubuh DOC dibuktikan dengan diperolehnya hasil propagasi isolat AI (Mujiatun 2009). Virus AI H5N1 pada ayam, puyuh dan kalkun menyebabkan mortalitas 75 sampai 100% dalam waktu 10 hari setelah infeksi (Perkins & Swayne 2001; Setyawati 2010). Virus AI dapat mengakibatkan kematian sebesar 43.3% pada ayam petelur (Nakatani et al 2005; Setyawati 2010). Ayaz et al. (2010) melakukan kajian dampak infeksi virus AI pada unggas komersil broiler breeder, layer dan broiler di wilayah Hazara (Tabel 1).
Tabel 1 Dampak infeksi virus AI pada unggas komersial di wilayah Hazara Unggas Mortalitas seperti tortikolis, tremor, kesulitan berdiri, kehilangan keseimbangan saat berjalan, dan pada kasus parah disertai kematian. Peternakan itik lokal komersial di Korea Selatan telah mengalami kasus AI yang menyebabkan kematian sampai dengan 12% (Dybing et al. 2000). Hasil pemeriksaan patologi anatomi tidak ditemukan perubahan yang spesifik kecuali adanya kornea mata yang keputihan baik unilateral maupun bilateral, garis-garis keputihan pada jantung dan kongesti pembuluh darah serta nekrosis pada otak dengan variasi dari ringan sampai berat. Pemeriksaan histopatologi menunjukkan adanya infiltrasi limfosit pada otot jantung, pada otak terjadi multifocal nekrosis hingga infiltrasi limfosit disertai perivascular cuffing ringan sampai berat (Wibawa et al. 2011).
Shedding virus HPAI terjadi dalam waktu 1 sampai 2 hari pada ayam yang diinokulasi dengan virus HPAI (Swayne et al. 2006). Inokulasi secara intranasal akan menyebabkan shedding virus AI pada hari pertama setelah inokulasi melalui sekresi pernafasan dan feses. Virus LPAI dapat terdeteksi pada sekresi pernafasan dan feses pada ayam yang diinokulasi secara intranasal, intraoral, intratrakeal. Virus ditemukan pada feses pada hari kedua setelah inokulasi, dan ditemukan pada sekresi pernafasan pada hari pertama setelah inokulasi (Swayne & Beck 2005). Shedding virus pada ayam yang diinokulasi dengan virus HPAI H5N1 dari Asia melalui trakea dan feses pada atau sebelum hari kedua (Swayne et al. 2006).
Metode Diagnosa Avian Influenza
8
test), dan uji serologi AI. Diagnosa akhir (definitive diagnosis) adalah dengan isolasi virus AI dan diagnostik molekuler subtipe (RT-PCR) (Widiasih et al. 2012). Kit diagnostik cepat untuk virus AI dapat mendeteksi antigen virus (Allwinn et al. 2002). Sampel yang diperiksa dengan kit ini berupa usap kloaka dan usap trakea. Sampel feses segar atau usap kloaka harus disimpan pada suhu 2 ºC sampai 8 ºC selama 48 jam, jika waktu penyimpanan lebih dari 48 jam harus disimpan pada suhu -20 ºC atau lebih rendah (Deptan 2006). Rapid avian influenza virus antigen test (AIV Ag) adalah immunoassay kromatografi untuk deteksi kualitatif avian influenza tipe A antigen virus (HPAI) di kloaka, trakea, ginjal atau kotoran (Gambar 2) (Bionote 2009).
Gambar 2 Prinsip uji cepat AIV Ag (Bionote 2009)
Metode RT-PCR dapat digunakan sebagai metode diagnosis cepat untuk mendeteksi dan menentukan subtipe virus AI secara spesifik (Payungporn et al. 2004). Prinsip dari RT-PCR adalah ekstraksi virus RNA disintesis menjadi complementary DNA (cDNA) dengan menggunakan enzim reverse transcriptase. complementary DNA digunakan sebagai template untuk PCR yang akan menghasilkan complementary double strand (dsDNA) yang dihasilkan melalui siklus denaturasi, annealling dan ekstensi yang didukung dengan adanya primer sense, antisense spesifik dan thermal stable Taq Polymerase. Saat ini terdapat beberapa teknik RT-PCR diantaranya RT-PCR konvensional dan rRT-PCR. Reaksi RT-PCR konvensional selama ini membutuhkan waktu kurang lebih 4 sampai 5 jam untuk ekstraksi RNA, proses 40 siklus PCR (denaturasi, annealling dan ekstensi DNA) serta elektroforesis pada gel. Teknik rRT-PCR tahap elektroforesis dihilangkan dan hasil langsung dapat dibaca di layar monitor komputer. Prinsip kerja dari rRT-PCR yaitu denaturasi, annealling dan ekstensi. Perjalanan reaksi di dalam PCR dilihat per satuan waktu (siklus) dalam rRT-PCR digunakan probe (penanda) yang menempel pada cetakan DNA, dimana dalam probe tersebut dilengkapi dengan reporter (pembawa sinyal) dan quencher (penahan sinyal). Primer memulai ekstensi DNA, selanjutnya ekstensi DNA yang diperantarai oleh enzim polymerase akan menghantam probe DNA menyebabkan lepasnya ikatan reporter dan quencher. Terlepasnya ikatan ini mengakibatkan terbacanya emisi sinyal reporter oleh perangkat filter dalam mesin rRT-PCR dalam bentuk sebuah grafik penambahan copy DNA per satuan siklus PCR (Hewajuli & Dharmayanti 2008).
Avian Influenza virus in a specimen
Test line
Monoclonal anti-AIV
9
3
METODE
Tempat dan Waktu Penelitian
Pengambilan sampel usap trakea DOC untuk penelitian ini dilakukan di Bandara Mozes Kilangin. Uji cepat AI dilakukan di laboratorium Stasiun Karantina Pertanian Kelas I Timika. Pengujian rRT-PCR dilakukan di Laboratorium Bioteknologi Balai Besar Veteriner Wates. Penelitian dilaksanakan pada bulan Juli sampai dengan Oktober 2014.
Bahan dan Alat
Bahan yang digunakan adalah cotton swab sterile, brain heart infusion broth (BHI), rapid test AIV Ag, etanol 96-100%, isopropanol, MagMaxTM-96 AI/ND viral RNA isolation kit, Ag-Path-ID One Step RT-PCR Kit, nuclease free water. Primer yang digunakan AI duplex H5 yaitu primer forward H5 IVA-D148H5 (5ʹ-AACAGAGAGGAAATAAGTGGAGTAAA-ATT-3ʹ), primer reverse H5 IVA-D149H5 (5ʹ-AAAGATAGACCAGCTACCATGATTGC-3ʹ),
probe H5-IVA-H5a (5ʹ
FAM-TCAACAGTGGCGAGTTCCCTAGCA-TAMRA3ʹ), primer forward H5 IVA-D204f (5ʹ
-ATGGCTCCTCGGRAACCC-ATT-3ʹ), primer reverse H5 IVA-D205r (5ʹ
-TTYTCCACTATGTAAGACCATTCCG-3ʹ), probe H5-IVA-D215P (5ʹ FAM-ATGTGTGACGAATTCMT-MGBNFQ-3ʹ) (AAHL 2013).
Peralatan yang digunakan adalah biosafety cabinet class II (BSC class II), orbital shaker, vorteks, sentrifus, PCR work station, micropipette dan microtips, optical PCR tube atau optical 96 well microplate (ABI PRISMTM 96-well optical), adhesive cover untuk optical tube atau 96-well microplate, adhesive cover applicator, mesin real time PCR ABI 7500.
Metode Pengambilan Sampel
Besaran sampel dihitung berdasarkan metode disease detection (Thrusfield 2005). Prevalensi yang digunakan 2.08% (Mujiatun 2009), tingkat kepercayaan 90%, maka didapatkan besaran sampel sekurang-kurangnya 110. Sampel diambil secara acak dari 3 daerah pengeluaran dan dihitung menurut alokasi proporsional dari total pemasukan DOC (Tabel 2). Sampel yang diperoleh dilakukan sistem pooling berdasarkan masing-masing daerah pengeluaran DOC, dalam satu pool terdapat 4 sampai 5 sampel.
n = [1-(1-p)1/d] [N-d/2]+1] Keterangan:
n = jumlah DOC
N= jumlah populasi DOC
10
Tabel 2 Besaran sampel DOC (SKP Kelas I Timika 2014)
No Tempat Pengeluaran Jumlah 2013 (ekor) Besaran sampel (ekor)
1 Surabaya 83 450 39
2 Kediri 11 000 9
3 Jayapura 196 692 65
Total 291 142 113
Uji Cepat Avian Influenza
Uji cepat AI menggunakan rapid avian influenza virus antigen test kit (AIV Ag test kit). Kit ini memiliki huruf “T” sebagai garis uji dan “C” sebagai garis kontrol pada permukaan kit. Garis uji dan kontrol tidak muncul sebelum penambahan sampel. Garis kontrol digunakan untuk prosedur kontrol, garis muncul jika prosedur uji dilakukan dan reagen uji bereaksi. Sampel usap trakea dimasukan dalam tabung yang berisi assay diluent, didiamkan selama 1 menit sampai partikel besar mengendap di bawah tabung. Pengujian dilakukan dengan menambahkan 4 sampai 5 tetes sampel dalam sample hole kit menggunakan dispossable dropper. Interpretasi hasil uji dilakukan dalam waktu 20 menit. Garis uji berwarna ungu akan terlihat jika antigen virus AI terdapat pada sampel.
Uji rRT-PCR
Pengujian dengan rRT-PCR dilakukan terhadap semua pool sampel. Pengujian rRT-PCR menggunakan metode dari Balai Besar Veteriner Wates (BBVet Wates).
Ekstraksi RNA
11 Plate dipindahkan dari magnetic stand, lalu ditambahkan 100 µ l wash solution II ke dalam masing-masing sampel. Microplate 96-well digoyang dengan orbital shaker dengan posisi 4 sampai 5 (550 sampai 600 rpm) selama 30 detik. Plate diletakkan ke dalam 96-well magnetic stand dan diinkubasi pada suhu kamar selama 1 menit untuk capture RNA binding. Supernatan yang terbentuk dibuang untuk memperoleh RNA lebih murni. Plate dipindahkan dan diletakkan ke dalam shaker dan digoyang selama 2 menit pada posisi 4 sampai 5 (550 sampai 600 rpm) untuk mengevaporasi sisa-sisa alkohol. Masing-masing sampel ditambahkan 35 µ l bufer elusi dan digoyang dengan shaker selama 3 menit. Plate diletakkan ke dalam 96-well magnetic stand dan diinkubasi pada suhu kamar selama 1 menit untuk capture RNA binding. Supernatan yang terbentuk diambil untuk memperoleh RNA lebih murni.
Tabel 3 Preparasi untuk membuat viral lysis/binding sol Viral lysis/binding solution Volume per 1
sampel (µ l)
Volume 26 untuk sampel
(µl) 1. Larutan viral lysis/binding solution
yang digunakan:
- Viral lysis/binding sol. concentrate - Carrier RNA
2. Dicampur dengan resuspensi, lalu ditambahkan:
- 100% isopropanol
3. Dicampur dengan cara divorteks, total volume
Tabel 4 Preparasi untuk membuat bead resuspension mix Bead resuspension mix Volume per 1
sampel/well (µ l)
Volume 26 untuk sampel (µ l) 1. Larutan bead resuspension mix
yang digunakan:
- Bead resuspension sol - Nuclease/Rnase-free water 2. Dicampur dengan resuspensi,
lalu ditambahkan:
- RNA binding beads (divorteks sebelumnya) 3. Dicampur dengan resuspensi,
12
Tabel 5 Preparasi wash solution mix Wash solution mix Larutan wash solution mix II dibuat dengan cara wash solution II concentrate
Ag-Path-ID One-Step RT-PCR Kit (Ambion, Cat. No AM1005) digunakan untuk reaksi rRT-PCR dengan komposisi seperti yang ditunjukkan pada Tabel 6.
Tabel 6 Komposisi master mix rRT-PCR untuk AI H5
Komponen Volume untuk 1
13 Analisis Data
14
4
HASIL DAN PEMBAHASAN
Deteksi AI pada DOC
Sebanyak 113 usap trakea diperoleh dari DOC yang berasal dari Surabaya, Kediri dan Jayapura (Tabel 7). Sampel usap trakea dari semua daerah pengeluaran tidak ada yang memberikan hasil terdeteksi virus AI menggunakan uji cepat dan rRT-PCR (Tabel 8).
Tabel 7 Hasil sampel usap trakea DOC yang diambil di Bandara Mozes Kilangin
Asal Pengusaha Jenis DOC Jumlah sampel
Jayapura
Tabel 8 Hasil pengujian AI menggunakan uji cepat dan rRT-PCR No Asal DOC Jumlah sampel (pool) Hasil uji
Pengujian AI menggunakan uji cepat dan rRT-PCR dilakukan dengan sistem pooling dan menggunakan media transport BHI. Menurut Spackman et al. (2013) metode yang optimal untuk mengkoleksi sampel usap oral dari unggas untuk deteksi virus AI menggunakan flocked swab (nylon flocked swab) dan media transport BHI. Deteksi virus AI menggunakan prinsip uji antigen immunoassay (AgIA) secara signifikan hasil uji menunjukkan lebih banyak positif pada sampel usap oral menggunakan flocked swab dan media transpor BHI. Jumlah maksimum sampel usap dalam satu vial yang direkomendasikan adalah 5 sampel usap. Volume media transport untuk 5 sampel usap dalam satu vial minimum 3.5 ml. Volume media transport berpengaruh langsung terhadap konsentrasi virus dan konsentrasi bahan penghambat dalam spesimen. Deteksi virus AI pada sampel usap oral dengan sistem pooling 1, 5, atau 11 dalam satu vial menggunakan uji rRT-PCR menunjukkan tidak ada perbedaan.
15 dan kesesuaian jumlah DOC. Berdasarkan hasil pemeriksaan fisik DOC yang dilalulintaskan menunjukkan kondisi fisik DOC lincah dan aktif bergerak, reflek cepat, bulu tidak kusam, tingkat kematian rendah yaitu dibawah 2% (Gambar 3).
Gambar 3 Anak ayam umur sehari (DOC) a) broiler, b) ayam kampung super yang dilalulintaskan melalui Bandara Mozes Kilangin
Menurut Barantan (2006) pemeriksaan fisik terhadap gejala klinis AI pada DOC yang dilalulintaskan antara lain morbiditas dan mortalitas tinggi (dapat mencapai 100%), pembengkakan (oedema subcutaneous) di kepala, mata dan leher, kebiruan (cyanosis) pada pial kepala, ptechi pada laring dan trakea.
Beberapa faktor mempunyai hubungan positif dengan infeksi H5N1 di peternakan komersial. Faktor tersebut yaitu peternakan dapat diakses hewan liar dan adanya footbath di pintu masuk peternakan atau gudang (Biswas et al. 2009), adanya burung yang mati di peternakan atau dekat peternakan, bertukar eggtrays, adanya kematian ayam di sekitar peternakan (Biswas et al. 2011). Resiko wabah HPAI H5N1 meningkat pada flok yang tidak divaksinasi atau hanya sekali divaksinasi dibandingkan dengan flok yang dua kali divaksinasi, flok di peternakan yang boleh dikunjungi orang lain, keberadaan angsa (Henning et al 2009), pekerja peternakan tinggal di luar peternakan (Fasina et al. 2011). Pengamatan ini menunjukkan bahwa peningkatan biosekuriti dapat mengurangi terjadinya wabah HPAI di peternakan komersial.
Anak ayam (DOC) mewarisi kekebalan dari induknya. Vaksinasi AI H5N1 pada ayam bibit (breeder) menyebabkan telur, khususnya kuning telur mengandung imunoglobulin Y (IgY) spesifik terhadap AI H5N1. Imunoglobulin Y (IgY) anti HPAI H5N1 yang terdapat dalam kuning telur dapat menahan replikasi virus AI apabila DOC terinfeksi virus AI. Imunoglobulin Y (IgY) ditransfer dari darah induk ke dalam kuning telur dan berguna untuk pertahanan tubuh hingga 7 sampai 10 hari setelah menetas Wibawan 2012).
Pengambilan sampel dilakukan pada bulan Agustus yang masih dalam periode musim kemarau. Kejadian AI pada musim kemarau cenderung lebih sedikit, hal tersebut karena virus AI relatif tidak stabil dalam lingkungan. Virus cepat mengalami inaktivasi ketika terjadi perubahan pH, suhu (panas), dan kekeringan (Perez et al. 2005; Setyawati 2010).
16
Uji Cepat dan rRT-PCR Virus AI
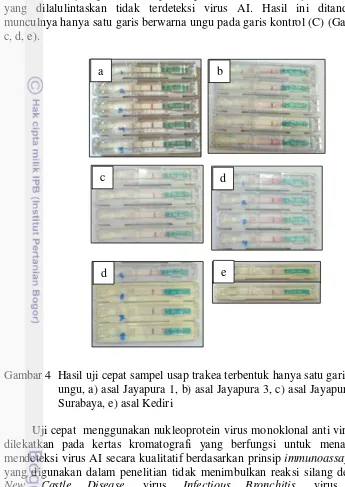
Hasil uji cepat dari sampel usap trakea DOC menunjukkan bahwa DOC yang dilalulintaskan tidak terdeteksi virus AI. Hasil ini ditandai dengan munculnya hanya satu garis berwarna ungu pada garis kontrol (C) (Gambar 4a, b, c, d, e).
Gambar 4 Hasil uji cepat sampel usap trakea terbentuk hanya satu garis berwarna ungu, a) asal Jayapura 1, b) asal Jayapura 3, c) asal Jayapura 4, d) asal Surabaya, e) asal Kediri
Uji cepat menggunakan nukleoprotein virus monoklonal anti virus AI yang dilekatkan pada kertas kromatografi yang berfungsi untuk menangkap dan mendeteksi virus AI secara kualitatif berdasarkan prinsip immunoassay. Uji cepat yang digunakan dalam penelitian tidak menimbulkan reaksi silang dengan virus New Castle Disease, virus Infectious Bronchitis, virus Infectious Laringotracheitis, Pneumovirus (TRTV), Reovirus (REV-T), virus Infectious Bursal Disease (Winterfield 2510), virus Marek Disease (CV1988). Sensitivitas rapid test dibandingkan dengan uji isolasi virus memberikan hasil 100% pada 19 peternakan, 77.3% pada 150 sampel feses, sedangkan spesifisitasnya 100% dibandingkan dengan isolasi virus (Bionote 2009). Menurut Deptan (2006) kit tersebut akan memberikan reaksi positif terhadap semua antigen virus AI. Uji cepat hanya mampu mendeteksi isolat virus AI hingga 104.5 egg infectious dose 50 (EID50) atau 0.13 HAU, apabila konsentrasi virus dibawah 104.5 EID50 akan memberikan hasil negatif. Kit tersebut hanya digunakan untuk membantu dalam deteksi dini kasus AI.
a b
c d
17 Interpretasi terhadap hasil uji cepat ini yaitu jika hasilnya negatif maka investigasi dilanjutkan pemeriksaan laboratorium lengkap (isolasi dan identifikasi virus). Hasil uji positif di daerah endemis (tertular dan disertai dengan gejala klinis AI dan ditunjang dengan data epidemiologi (morbiditas dan mortalitas tinggi, informasi penyebaran penyakit), maka dapat dinyatakan sebagai kasus positif AI. Khusus daerah bebas, jika hasilnya positif disertai dengan gejala klinis AI dan ditunjang oleh data epidemiologi (morbiditas dan mortalitas tinggi, informasi penyebaran penyakit), maka berdasarkan prinsip maksimum sekuriti diperlakukan sebagai kasus positif AI dan dilanjutkan dengan pemeriksaan laboratorium (isolasi dan identifikasi). Kriteria diperlukannya konfirmasi pengujian laboratorium yaitu jika terdapat kasus positif AI hasil uji cepat di daerah bebas, jika uji cepat menunjukkan hasil dubius/meragukan sedangkan gejala klinis dan epidemiologi mengarah positif AI (Deptan 2008).
Hasil pengujian dengan metode rRT-PCR AI Duplex H5 menunjukkan hasil tidak terdeteksi virus AI. Hasil uji ini ditandai dengan grafik yang terbentuk saat pengujian rRT-PCR tidak membentuk kurva sigmoid dan nilai Cycle threshold (Ct) undetermined (Gambar 5).
Gambar 5 Kurva amplifikasi hasil uji rRT-PCR virus avian influenza H5 a) kontrol positif membentuk kurva sigmoid dan menembus batas
threshold, b) batas threshold 0.2, c) 113 sampel, kontrol negatif dan kontrol tanpa template tidak membentuk kurva yang sigmoid dan tidak menembus batas threshold
18
Metode uji rRT-PCR berfokus pada fase eksponensial karena memberikan data yang paling tepat dan akurat. Metode uji rRT-PCR menghitung dua nilai pada fase eksponensial. Garis threshold adalah tingkat deteksi dimana reaksi mencapai intensitas fluoresens di atas latar belakang. Jumlah siklus PCR yang dibutuhkan untuk mendapatkan signal fluoresens yang melintasi threshold disebut Cycle threshold (Ct). Nilai Ct digunakan dalam kuantisasi hilir atau deteksi ada atau tidaknya. Jumlah template DNA pada reaksi yang tidak diketahui dapat ditentukan secara akurat dengan membandingkan nilai-nilai Ct sampel yang tidak diketahui konsentrasinya dengan serangkaian standar uji.
Nilai Ct berkorelasi dengan kuantitas urutan DNA target (Giglio et al. 2003). Kuantitas urutan DNA target tinggi di awal reaksi, nilai Ct akan lebih cepat diketahui (Hejawuli dan Dharmayanti 2014). Nilai Ct berbanding terbalik dengan jumlah asam nukleat (N) yang terkandung dalam sampel, sehingga semakin rendah Ct semakin banyak asam nukleat. Nilai Ct nilai sebanding dengan -log (N), N adalah jumlah awal molekul target. Semakin tinggi N semakin rendah Ct, saat N nol maka -log (N) menjadi tak terhingga. Nilai Ct sampel dengan nol molekul target benar-benar akan menjadi tak terhingga, kurva amplifikasi tidak akan pernah naik (karena amplifikasi spesifik dari sequence target) dan tidak akan pernah menyeberangi batas threshold.
Prinsip dalam analisis rRT-PCR adalah jika gen target yang dievaluasi terekspresi maka akan ada mRNA yang disandi dari gen target dalam preparasi total mRNA, jika mRNA dari gen target ada maka akan ada molekul cDNA spesifik yang disintesis dari mRNA tersebut, jika cDNA spesifik ada maka ketika dilakukan amplifikasi PCR dengan menggunakan primer spesifik untuk gen target akan dihasilkan potongan DNA hasil amplifikasi PCR (PCR positif). Hasil uji rRT-PCR negatif jika gen target yang dievaluasi tidak terekspresi maka mRNA gen target tidak ada diantara preparasi total mRNA yang diisolasi dan tidak terdapat molekul cDNA spesifik di dalam preparasi cDNA yang disintesis, akibatnya ketika diamplifikasi PCR dengan menggunakan primer spesifik tidak akan dihasilkan potongan DNA hasil amplifikasi PCR.
Metode rRT-PCR memiliki sensitivitas dan spesifisitas yang sangat tinggi dalam mendeteksi keberadaan virus influenza dalam spesimen meskipun dalam jumlah yang sangat sedikit. Jenis sampel berpengaruh terhadap hasil rRT-PCR AI. Sampel jaringan dan usap kloaka biasanya mengandung beberapa penghambat PCR. Keberadaan penghambat PCR dalam sampel akan menurunkan sensitifitas pengujian rRT-PCR AI (Hejawuli & Dharmayanti 2014).
Saat pembacaan amplifikasi DNA menggunakan rRT-PCR, selain sampel juga disertakan kontrol positif dan negatif. Kontrol ini berfungsi untuk mengetahui apakah saat mencampurkan mix reagen ke dalam sampel terdapat kontaminasi atau tidak. Kontrol negatif akan tetap negatif setelah pembacaan jika tidak terdapat kontaminasi atau dalam arti lain bahwa pengerjaan dari mixing reagen berhasil dan hasil rRT-PCR dianggap layak dan dapat dipercaya. Hal tersebut berlaku sebaliknya yakni jika kontrol negatif menjadi positif maka dapat diperkirakan telah terjadi kontaminasi dan hasil dari pembacaan dianggap tidak dapat dipercaya untuk selanjutnya pemeriksaan akan diulang. Pada penelitian ini telah melalui proses yang benar dengan hasil kontrol negatif tetap negatif sehingga hasil pembacaan rRT-PCR dapat dipercaya (Kartikasari 2008).
19 apabila dilakukan dengan jumlah RNA sebagai template memenuhi jumlah minimum yang telah ditentukan. Faktor yang dapat mempengaruhi sensitivitas uji rRT-PCR yaitu substansi penghambat RT-PCR dalam sampel, prosedur ekstraksi RNA dan degradasi RNA sebelum pengujian (Chen et al. 2007).
Deteksi minimum titer virus (EID50 per ml) dari berbagai isolat subtipe AIV H6, H9, dan H11 berkisar antara 101 dan 102.9 dengan uji HA-rRT-PCR dan antara 101 dan 101.9 dengan MA-rRT-PCR (Das & Suarez 2007). Periode infeksius (hari shedding virus) adalah 1.3 hari (1.2 sampai 1.5 hari) (Spekreijse et al. 2011a). Ayam yang diinokulasi dengan EID50 104 virus AI dan ayam yang kontak dengan ayam yang diinokulasi positif pada trakea hari ketiga saat diuji dengan rRT-PCR. Ayam yang hanya kontak dengan ayam yang diinokulasi dengan EID50 102, EID50 103 virus AI positif pada hari ketiga, hari kedua saat diuji dengan rRT-PCR (Spekreijse et al. 2011b).
20
5
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil uji cepat dan rRT-PCR tidak terdeteksi keberadaan material genetik virus AI pada 113 sampel usap trakea DOC yang dilalulintaskan melalui Bandara Mozes Kilangin.
Saran
21
DAFTAR PUSTAKA
[AAHL] Australian Animal Health Laboratory. 2013. Nucleic Acid Detection for Diagnosis and Emergency Disease Investigation: Influenza Virus Type A Generic AI Matrix Gene and H5 TaqMan PCR. Geelong (AU): CSIRO.
Adams S, Sandrock C. 2010. Avian influenza: update. Med Princ Pract. 119:421-432.
Akoso BT. 2006. Waspada Flu Burung: Penyakit Menular pada Hewan dan Manusia. Yogyakarta (ID): Kanisius.
Allwinn R, Preiser W, Rabenau H, Burbaum S, Sturmer M, Doerr HW. 2002. Laboratory diagnosis of Influenza virology or serology. Med Microbiol Immunol. 191:157-160.
Ayaz M, Sajid M, Khan S, Qureshi MS, Rehman A, Khwaja N, Rafiq M, Maqbool M. 2010. Prevalence of avian influenza and its economic impact on poultry population of Hazara Region Pakistan. Sarhad J Agric. 26(4):629-633.
[Barantan] Badan Karantina Pertanian. 2006. Keputusan Kepala Badan Karantina Pertanian Nomor 316.a/Kpts/PD.670.320/L/11/06 tentang Petunjuk Teknis Tindakan Karantina Hewan terhadap Media Pembawa HPAI. Jakarta (ID): Barantan.
Bionote. 2009. Anigen Rapid Avian Influenza Virus Antigen Test Kit. Seogu-dong (KR): Bionote.
Biswas PK, Christensen JP, Ahmed SS, Barua H, Das A, Rahman MH, Giasuddin M, Hannan AS, Habib AM, Debnath NC. 2009. Risk factors for infection with highly pathogenic Influenza A virus (H5N1) in commercial chickens in Bangladesh. Vet Rec. 164(24):743-746.
Biswas PK, Rahman MH, Das A, Ahmed SS, Giasuddin M, Christensen JP. 2011. Risk for highly pathogenic avian influenza H5N1 virus infection in chickens in small-scale commercial farms, in a high-risk area, Bangladesh 2008. Transbound Emerg Dis. 58(6):519-525.
Boseret G, Losson B, Mainil JG, Thiry E, Saegerman C. 2013. Zoonoses in pet birds: review and perspectives. Vet Research. 44(36):1-17.
Capua I, Marangon S. 2006. Control of avian influenza in poultry. Emerg Infect Dis. 12(9):1319-1324.
Chen W, He B, Li C, Zhang X, Wu W, Yin X, Fan B, Fan X, Wang J. 2007.
Real-time RT-PCR for H5N1 avian influenza A virus detection. J Med Microbiol. 56:603-607.
Das A, Suarez DL. 2007. Development and bench validation of real-time reverse transcription polymerase chain reaction protocols for rapid detection of the subtypes H6, H9, and H11 of avian influenza viruses in experimental samples. J Vet Diagn Invest. 19:625-634.
de Jong MD, Cam BV, Qui PT. 2005. Fatal avian influenza A (H5N1) in a child presenting with diarrhea followed by coma. N Engl J Med. 352:686-691. [Deptan] Departemen Pertanian. 2004. Workshop Avian Influenza: Perkembangan
Wabah Avian Influenza. Jakarta (ID): Deptan.
22
karta (ID): Deptan.
[Deptan] Departemen Pertanian. 2008. Prosedur Operasional Standar Pengendalian Penyakit Avian Influenza. Jakarta (ID): Deptan.
Desvaux S, Marx N, Ong S, Gaidet N, Hunt M, Manuguerra JC, sorn S, Peiris M, Werf SV, Reynes JM. 2009. Highly pathogenic avian influenza virus
(H5N1) outbreak in captive wild birds and cats, Cambodia. Emerg Infect Dis. 15(3):475-478.
Dharmayanti NLPI, Damayanti R, Wiyono A, Indriani, Darminto. 2004. Identifikasi virus avian influenza isolat Indonesia dengan reverse transcriptase polymerase chain reaction (RT-PCR). JITV. 9(2):136-142. [Ditjennak] Direktorat Jenderal Peternakan. 2014. Perkembangan kasus avian
influenza (AI) pada unggas kondisi s/d 31 Agustus 2014 [Internet].
[diunduh 2014 Okt 7]. Tersedia pada:
http://ditjennak.pertanian.go.id/berita-463-perkembangan-kasus-avian influenza-ai-pada-unggas-kondisi-sd-31-agustus-2014.html
Dybing JK, Schulzt-Cherry S, Swayne DE, Suarez DI, Perdue ML. 2000. Distinct pathogenesis of Hongkong origin H5N1 viruses in mice compared to that of other highly pathogenic H5 avian influenza viruses. J Virol. 74(3):1143-1450.
Fasina FO, Rivas AL, Bisschop SP, Stegeman AJ, Hernandez JA. 2011. Identification of risk factors associated with highly pathogenic avian influenza H5N1 virus infection in poultry farms, in Nigeria during the epidemic of 2006-2007. Prev Vet Med. 98(2):204-208. Fouchier RAM, Munster VJ, Wallensten A, Bestebroer TM, Herfst S, Smith DJ,
Rimmelzwaan GF, Olsen, Osterhaus ADME. 2005. Characterization of a novel Influenza A virus hemagglutinin subtype (H16) obtained from Black-headed Gulls. J Virol. 79:2814-2822.
Giglio S, Monis PT, Saint CP. 2003. Demonstration of preferential binding of SYBR Green I to specific DNA fragments in real-time multiplex PCR. Nucleic Acids Research. 31(22):1-5.
Horimoto T, Kawaoka Y. 2005. Influenza: Lessons from past pandemics, warnings from current incidents. Nat Rev Microbiol. 3:591-600.
Hejawuli DA, Dharmayanti NLPI. 2008. Karakterisasi dan identifikasi virus avian influenza (AI). Wartazoa. 18(2):86-100.
Hejawuli DA, Dharmayanti NLP. 2014. Perkembangan teknologi reverse transcriptase-polymerase chain reaction dalam mengidentifikasi genom avian influenza dan newcastle diseases. Wartazoa. 24(1):16-29.
Henning KA, Henning J, Morton J, Long NT, Ha NT, Meers J. 2009. Farm- and flock-level risk factors associated with highly pathogenic avian influenza outbreaks on small holder duck and chicken farms in the Mekong Delta of Vietnam. Prev Vet Med. 91(2):179-188.
Kartikasari DS. 2008. Perbandingan tingkat sensitivitas dan spesifisitas pada pemeriksaan Influenza A dengan menggunakan rapid test dan real time-reverse transcriptase PCR (rRT-PCR) [tesis]. Semarang (ID): Universitas Diponegoro.
23 [Kementan] Kementerian Pertanian. 2013a. Keputusan Menteri Pertanian Nomor 4026/Kpts/OT.140/4/2013 tentang Penetapan Jenis Penyakit Hewan Menular Strategis. Jakarta (ID): Kementan.
[Kementan] Kementerian Pertanian. 2013b. Keputusan Menteri Pertanian Nomor Nomor 4971/Kpts/OT.140/12/2013 tentang Penetapan Zoonosis Prioritas. Jakarta (ID): Kementan.
Mattjik AN, Sumertajaya IM.2013. Perancangan Percobaan dengan Aplikasi SAS dan Minitab. Bogor (ID): IPB Pr.
Mujiatun. 2009. Deteksi keberadaan virus avian influenza pada DOC yang
dilalulintaskan melalui Bandara Soekarno Hatta [tesis]. Bogor (ID): Institut Pertanian Bogor.
Nakatani H, Nakamura K, Yamamoto Y, Yamada M. 2005. Epidemiology, pathology, and immunohistochemistry of layer hens naturally affected with H5N1 highly pathogenic avian influenza in Japan. Avian Dis. 49(3):436-441.
[OIE] Office Internationale des Epizooties. 2004. Manual of diagnostic test and vaccines for terrestrial animal. 4:258-269.
Olsen B, Munster VJ, Wallensten A, Waldenstrom J, Osterhaus ADME, Fouchier RAM. 2006. Global patterns of Influenza A virus in wild birds. Science. 312:384-388.
Payungporn S, Phakdeewirot P, Chutinimitkul S, Theamboonlers A, Keawcharoen J, Oraveerakul K, Amonsin A, Poovorawan Y. 2004. Single-step multiplex reverse transcription-polymerase chain reaction (RT-PCR) for Influenza A virus subtype H5N1 detection. Viral Immunol. 17:588-593.
Peiris JS, Yu WC, Leung CW. 2004. Re-emergence of fatal human Influenza A subtype H5N1 disease. Lancet. 363:617-619.
Perez DR, Nazarian SH, Mcfadden G, Gillmore MS. 2005. Biodefense: Principles and pathogens. Edited by Bronze MS, Greenfield RA. Bab 21 “Miscellaneous Threats: Highly Pathogenic Avian Influenza and Novel Bio-enggineered Organisms. Norfolk (GB): Horizon Bioscience.
Perkins LEL, Swayne DE. 2001. Pathobiology of A/Chicken/Hongkong/220/97 (H5N1) avian influenza virus in seven Gallinaceous species. Vet Pathol. 38:149-164.
Russel CJ, Webster RG. 2005. The genesis of a pandemic Influenza virus. Cell. 123(3):368-371.
Setyawati S. 2010. Kajian epidemiologi virus avian influenza pada distribusi anak ayam umur satu hari [disertasi]. Bogor (ID): Institut Pertanian Bogor. [SKP Kelas I Timika] Stasiun Karantina Pertanian Kelas I Timika. 2014. Laporan
Tahunan Tahun 2013. Mimika (ID): SKP Kelas I Timika.
Soejoedono RD, Handharyani E. 2006. Flu Burung. Cetakan ke-3. Jakarta (ID): Penebar Swadaya.
Spackman E, Senne DA, Myers TJ, Bulaga LL, Garber LP, Perdue ML, Lohman K, Daum LT, Suarez DL. 2002. Development of a real time reverse transcription PCR assay for type A Influenza virus and the avian H5 and H7 hemagglutinin subtypes. J Clin Microbiol. 40(9):3256-3260.
24
Spackman E, Pedersen JC, McKinley ET, Gelb J. 2013. Optimal specimen collection and transport methods for the detection of avian influenza virus and newcastle disease virus. BMC Vet Research. 9(35):1-12.
Spackman E. 2014. Avian inflenza virus detection and quantitation by real-time RT-PCR. Methods Mol Biol. 1161:105-118.
Spekreijse D, Bouma A, Stegeman JA, Koch G, de Jong MCM. 2011a. The effect of inoculation dose of highly pathogenic avian influenza virus strain H5N1 on the infectiousness of chickens. Vet Microbiol. 147:59-66.
Spekreijse D, Bouma A, Koch G, Stegeman JA. 2011b. Airborne transmission of a highly pathogenic avian influenza virus strain H5N1 between groups of chickens quantified in an experimental setting. Vet Microbiol. 152:88-95. Stevens J, Ola B, Terrence M. Tumpey, Jeffery K. Taubenberger, James C.
Paulson, Ian A. Wilson. 2006. Structure and receptor specificity of the hemaglutinin from an H5N1 Influenza virus. Science. 312(5772):404-410.
Swayne DE, Beck JR. 2005. Experimental study to determine if low-pathogenicity and high-low-pathogenicity avian influenza viruses can be present in chicken breast and thigh meat following intranasal virus inoculation. Avian Dis. 49:81-85.
Swayne DE, Lee CW, Spackman E. 2006. Inactivated North American and European H5N2 avian influenza virus vaccines protect chickens from Asian H5N1 high pathogenicity avian influenza virus. Avian Pathol. 35:141-146.
Tabbu CR. 2000. Penyakit Ayam dan Penanggulangannya. Yogyakarta (ID): Kanisius.
Tamher S, Noorkasiani. 2008. Flu Burung: Aspek Klinis dan Epidemiologis. Jakarta (ID): Salemba Medika.
Thrusfield M. 2005. Veterinary Epidemiology 3rd Edition: Veterinary Clinical Studies. Edinburgh (GB): Backwell Science.
Uiprasertkul M, Puthavathana P, Sangsiriwut K. 2005. Influenza A H5N1 replication sites in humans. Emerg Infect Dis. 11:1036-1041.
Wibawa H, Henning J, Wong F, Selleck P, Junaidi A, Bingham J, Daniels P, Meers J. 2011. A molecular and antigenic survey of H5N1 highly pathogenic avian influenza virus isolates from smallholder duck farms in Central Java Indonesia during 2007-2008. J Virol. 8(425):1-17.
Wibawan IWT. 2012. Manifestasi Subklinis Avian Influenza pada Unggas: Ancaman Kesehatan dan Penanggulangannya [Internet]. [diunduh 2014 Feb 22]. Tersedia pada: http://fkh.ipb.ac.id/download/Orasi_2012_IWT_ Wibawan_FKH_IPB
25 Lampiran 1 Hasil uji cepat dan rRT-PCR usap trakea DOC
27
No Kode Pooling Hasil uji
Uji cepat rRT-PCR
80 LJ-21 S23 - -
81 LJ-22
82 LJ-23
83 LJ-24
84 LJ-25
85 EJ-1 S24 - -
86 EJ-2
87 EJ-3
88 EJ-4
89 EJ-5
90 EJ-6 S25 - -
91 EJ-7
92 EJ-8
93 EJ-9
94 EJ-10
95 EJ-11 S26 - -
96 EJ-12
97 EJ-13
98 EJ-14
99 EJ-15
100 EJ-16 S27 - -
101 EJ-17
102 EJ-18
103 EJ-19
104 EJ-20
105 HK-1 S28 - -
106 HK-2
107 HK-3
108 HK-4
109 HK-5 S29 - -
110 HK-6
111 HK-7
112 HK-8
28
Lampiran 2 Nilai cycle threshold (Ct) rRT-PCR AI H5 (threshold 0.2, baseline start 3, baseline end 15, reporter FAM, quencher TAMRA)
No Kode pooling Detektor Ct
1 S9 AI Duplex H5 Undetermained
2 S8 AI Duplex H5 Undetermained
3 S7 AI Duplex H5 Undetermained
4 S29 AI Duplex H5 Undetermained
5 S28 AI Duplex H5 Undetermained
6 S27 AI Duplex H5 Undetermained
7 S26 AI Duplex H5 Undetermained
8 S25 AI Duplex H5 Undetermained
9 S24 AI Duplex H5 Undetermained
10 S23 AI Duplex H5 Undetermained
11 S22 AI Duplex H5 Undetermained
12 S21 AI Duplex H5 Undetermained
13 S20 AI Duplex H5 Undetermained
14 S19 AI Duplex H5 Undetermained
15 S18 AI Duplex H5 Undetermained
16 S17 AI Duplex H5 Undetermained
17 S16 AI Duplex H5 Undetermained
18 S15 AI Duplex H5 Undetermained
19 S14 AI Duplex H5 Undetermained
20 S13 AI Duplex H5 Undetermained
21 S12 AI Duplex H5 Undetermained
22 S11 AI Duplex H5 Undetermained
23 S10 AI Duplex H5 Undetermained
24 NTC AI Duplex H5 Undetermained
25 C-H5 AI Duplex H5 Undetermained
30
RIWAYAT HIDUP
Penulis dilahirkan di Klaten pada tanggal 26 Maret 1982 sebagai anak sulung dari bapak Girno Raharjo dan ibu Rubiyem. Pendidikan sarjana ditempuh di Fakultas Kedokteran Hewan Universitas Udayana, lulus sebagai sarjana kedokteran hewan pada tahun 2004 dan tahun 2006 penulis lulus sebagai dokter hewan. Tahun 2013, penulis diterima di Program Studi Kesehatan Masyarakat Veteriner, Sekolah Pascasarjana Institut Pertanian Bogor. Beasiswa pendidikan pascasarjana diperoleh dari Badan Karantina Pertanian, Kementerian Pertanian.