POTENSI KITINOLIK
Bacillus amyloliquefaciens
SAHA 12.07
DAN
Serratia marcescens
KAHN 15.12 SEBAGAI AGENS
BIOKONTROL
Ganoderma boninense
SITI NUR AZIZAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Potensi Kitinolik
Bacillus amyloliquefaciens SAHA 12.07 dan Serratia marcescens KAHN 15.12
sebagai Agens Biokontrol Ganoderma boninense adalah benar karya saya dengan
arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
SITI NUR AZIZAH. Potensi Kitinolik Bacillus amyloliquefaciens SAHA 12.07
dan Serratia marcescens KAHN 15.12 sebagai Agens Biokontrol Ganoderma boninense. Dibimbing oleh NISA RACHMANIA MUBARIK dan LISDAR I
SUDIRMAN.
Kitin merupakan komponen utama dinding sel filum Basidiomycota terutama Ganoderma. Kitin pada cendawan berfungsi sebagai penyusun dinding
sel yang terdapat dalam miselium dan spora. Ganoderma boninense merupakan
patogen utama penyebab penyakit busuk pangkal batang kelapa sawit yang menyebabkan penurunan produktifitas kelapa sawit di Indonesia dan Malaysia. Kitin pada cendawan dapat didegradasi secara enzimatik oleh kitinase yang berfungsi sebagai antifungi. Kitinase adalah enzim hidrolitik yang berfungsi untuk mendegradasi kitin menjadi monomer N-asetilglukosamin. Kitinase banyak diproduksi oleh bakteri. Kitinase yang dihasilkan bakteri kitinolitik asal tanah kelapa sawit di Taman Nasional Bukit Dua Belas, Jambi berpotensi sebagai biokontrol yang mampu menghambat pertumbuhan Curvularia affinis dan Colletotrichum gloeosporioides penyebab penyakit hawar kelapa sawit. Namun
demikian masih belum ada laporan penghambatan kitinase yang dihasilkan oleh bakteri terhadap G. boninense. Oleh karena itu penelitian ini bertujuan untuk
menyeleksi dan mengidentifikasi bakteri kitinolitik asal tanah kelapa sawit TNBDB yang memiliki kemampuan menghambat pertumbuhan G. boninense dan
mengkarakterisasi aktivitas kitinase dalam mendegradasi kitin pada G. boninense.
Isolat SAHA 12.07 dan KAHN 15.12 mampu menghambat pertumbuhan
G. boninense dengan persentase penghambatan masing-masing 68.19 dan 40.29%.
Isolat SAHA 12.07 dan KAHN 15.12 teridentifikasi sebagai Bacillus amyloliquefaciens and Serratia marcescens dengan kemiripan 99% berdasarkan
16S rRNA. Isolat SAHA 12.07 memproduksi kitinase optimum pada jam ke-48 inkubasi dan KAHA 15.12 pada jam ke-54 inkubasi dengan aktivitas spesifik masing-masing sebesar 63.35 U/mg dan 143.51 U/mg. Kitinase ekstrak kasar dari SAHA 12.07 dan KAHN 15.12 dapat diendapkan menggunakan aseton masing-masing dengan konsentrasi 60 dan 20%, dengan aktivitas spesifik meningkat masing-masing sebesar 33.372 U/mg dan 1029.2 U/mg. Aktivitas kitinase ekstrak
kasar dan hasil pengendapan pada B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 aktif pada kisaran pH luas antara 4-10 dan juga
memiliki spektrum suhu yang luas antara 20-80 °C. Enzim hasil pengendapan pada B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12
memiliki persentase penghambatan lebih tinggi terhadap pertumbuhan miselium
G. boninense yaitu masing-masing 54.92 dan 40.84% dibandingkan kitinase
ekstrak kasar yaitu masing-masing 11.97 dan 8.45%. Kitinase S. marcescens
KAHN 15.12 melepaskan NAG lebih tinggi dibandingkan B. amyloliquefaciens
SAHA 12.07.
SUMMARY
SITI NUR AZIZAH. Potential of Chitinolytic Bacillus amyloliquefaciens SAHA
12.07 and Serratia marcescens KAHN 15.12 as Biocontrol Agents of Ganoderma boninense. Supervised by NISA RACHMANIA MUBARIK and LISDAR I
SUDIRMAN.
Chitin is a major component of cell wall on Basidiomycetes particularly of
Ganoderma. Chitin of fungi has a main function as constituent of cell wall that is
contained in the mycelium and spores. Ganoderma boninense is a causal pathogen
of basal stem rot disease in oil palm that decrease its productivity in Indonesia and Malaysia. Chitin in fungi can be degraded enzymatically by chitinase which is function as biocontrol in fungal pathogens. Chitinases are hydrolytic enzymes with function to degrade chitin to N-acetylglucosamine as monomer. Chitinase is produced widely by bacteria. Chitinase which produced by chitinolytic bacteria from soil of oil palm plantation in Taman Nasional Bukit Dua Belas, Jambi Province, had potential as biological control that could inhibit the gowth of
Curvularia affinis and Colletotrichum gloeosporioides causing leaf blight disease
on oil palm. However, there is still no reports of the chitinase inhibition against
G. boninense. Therefore, the objective of this research was to screen and identify
of chitinolytic bacteria which has an ability to inhibit the growth of G. boninense,
and also to characterize its chitinase activity on degrading the chitin of
G. boninense.
Isolates SAHA 12.07 and KAHN 15.12 were capable to inhibit the growth of G. boninense with percentage inhibition of 68.19 and 40.29%, respectively.
Based on 16S rRNA identification, SAHA 12.07 and KAHN 15.12 had 99% of similarity with Bacillus amyloliquefaciens and Serratia marcescens, respectively.
Isolate SAHA 12.07 produced optimum chitinase at 48 h and KAHN 15.12 at 54 h of incubation in chitin medium with the specific activity up to 63.35 U/mg and 143.51 U/mg, respectively. Crude chitinase of SAHA 12.07 and KAHN 15.12 have precipitated by acetone at 60 and 20%, respectively with the specific activity improve up to 33.372 U/mg and 1029.2 U/mg. Crude and partially purification enzyme of B. amyloliquefaciens SAHA 12.07 and S. marcescens KAHN 15.12
had active at pH 4-10 and temperature between 20-80 °C. Partially purification enzyme of B. amyloliquefaciens SAHA 12.07 and S. marcescens KAHN 15.12
had higher inhibition percentage against mycelial growth of G. boninense by an
average 54.92 and 40.84%, compared to crude enzyme by an average 11.97 and 8.45%, respectively. Chitinase of S. marcescens KAHN 15.12 was higher in
releasing N-acetylglucosamine compared to chitinase of B. amyloliquefaciens
SAHA 12.07.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Progam Studi Mikrobiologi
POTENSI KITINOLIK
Bacillus amyloliquefaciens
SAHA 12.07
DAN
Serratia marcescens
KAHN 15.12 SEBAGAI AGENS
BIOKONTROL
Ganoderma boninense
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2014 sampai Juli 2015 ini ialah biokontrol, dengan judul Potensi Kitinolik Bacillus amyloliquefaciens SAHA 12.07 dan Serratia marcescens KAHN 15.12 sebagai
Agens Biokontrol Ganoderma boninense.
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Prof Dr Lisdar I Sudirman sebagai anggota komisi pembimbing, yang telah sabar memberikan nasehat, saran, motivasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Selain itu penulis ucapkan terima
kasih kepada penguji luar komisi Dr Abdjad Asih Nawangsih, MSi dan Prof Dr Anja Meryandini, MS selaku Ketua Progam Studi Mikrobiologi IPB,
yang telah memberikan nasehat dan masukan saat pada ujian sidang tesis.
Penulis juga mengucapkan terima kasih kepada Bapak Iwa selaku staf Laboratorium Mikrobiologi dan biokimia PAU atas bantuan selama penulis melakukan isolasi dan budidaya Ganoderma, Bapak Jaka dan Ibu Heni selaku staf
Laboratorium Mikrobiologi FMIPA Biologi atas bantuan dan nasehat selama penulis menjalani penelitian. Rekan satu tim penelitian (Gaby, Meli, Erni, Melda, Dame, Dian, Fitria, Ismi, Kak Eliya, Mas Asril, Bang Risky, Mbak Eja, Mbak Rike), rekan penelitian di Laboratorium Mikrobiologi IPB (Cicho, Noor, Naswandi, Sasmiati, Putri, Susi, Hidayah, Mery, Dita, Ai, Sasa, Agesti, dan lainnya) dan sahabat Jember di IPB (Hidayah, Mada, Mbak Nurul, Arif, Syubanul, Imam) atas dukungan, motivasi dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis sampaikan kepada Ibunda Siti Maisaroh, Ayahanda Ahmad serta seluruh keluarga atas doa dan kasih sayangnya. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 atas bantuan, kerjasama, persaudaraan, dan kebersamaan yang diberikan selama penulis menjalani penelitian dan masa studi. Terimakasih kepada pemerintah Indonesia melalui Beasiswa Progam Pascasarjana Dalam Negeri (BPPDN) Tahun 2013 sehingga penulis dapat menyelesaikan studi dengan baik.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Ganoderma boninense sebagai Patogen Kelapa Sawit 2
Kitin 4
Bakteri Kitinolitik 5
Kitinase 5
METODE 7 Kerangka Penelitian 7 Waktu dan Tempat 8 Bahan 8 Peremajaan Bakteri Kitinolitik 8 Isolasi Ganoderma boninense 8
Penapisan Bakteri Kitinolitik Penghambat Pertumbuhan G. boninense 8
Identifikasi Bakteri Kitinolitik Terpilih Berdasarkan Gen 16S rRNA 9 Pembuatan Kurva Tumbuh dan Produksi Enzim Isolat Terpilih 10 Pengukuran Aktivitas Kitinase dan Konsentrasi Protein 10 Pengendapan Kitinase 10 Karakterisasi pH dan Suhu serta Stabilitas Kitinase 11 Uji Penghambatan Kitinase terhadap pertumbuhan G. boninense 11 Lisis Dinding Sel G. boninense 11 HASIL DAN PEMBAHASAN 12
Isolasi Ganoderma boninense sebagai Patogen Kelapa Sawit 12 Penapisan Bakteri Kitinolitik Penghambat Pertumbuhan G. boninense 12 Identifikasi Bakteri Terpilih 14 Pertumbuhan dan Produksi Enzim Bakteri Terpilih 15
Pengendapan Kitinase 15
Karakterisasi pH dan Suhu serta Stabilitas Kitinase 16
Uji Penghambatan In vitroG. boninense Menggunakan Kitinase 18 Lisis Dinding Sel G. boninense 19 Pembahasan 19
SIMPULAN 23
DAFTAR PUSTAKA 24
LAMPIRAN 28
DAFTAR TABEL
1 Kitinase asal mikrob yang berperan sebagai agens biokontrol 6 2 Persentase daya hambat bakteri kitinolitik terhadap G. boninense 13
3 Ringkasan hasil tahapan pemurnian parsial kitinase 16 4 Persentase penghambatan kitinase terhadap pertumbuhan G. boninense 19
DAFTAR GAMBAR
1 Struktur kitin yang mengandung monomer N-asetilglukosamin 4
2 Komposisi dinding sel pada Basidiomycota 4
3 Hidrolisis kitin oleh kitinase 6
4 Diagam alur penelitian ini 7
5 Tubuh buah G. boninense dan pertumbuhan miseliumnya di media
PDA 12
6 Uji antagonis G. boninense dengan bakteri kitinolitik 13
7 Kerusakan miselium G. boninense setelah uji antagonis dengan bakteri
kitinolitik 13
8 Visualisasi hasil amplifikasi gen 16S rRNA pada gel agarosa 0,8 % 14 9 Pohon filogenetik gen 16S rRNA dari SAHA 12.07 menggunakan
metode Neighbor Joining (NJ) dengan boostrap 1000x 14 10 Pertumbuhan sel dan aktivitas kitinase dari B. amyloliquefaciens SAHA
12.07 dan S. marcescens KAHN 15.12 15
11 Pengaruh penambahan aseton terhadap aktivitas spesifik kitinase 16 12 Pengaruh pH terhadap aktivitas kitinase ekstrak kasar dan hasil
pengendapan 17
13 Pengaruh suhu terhadap aktivitas kitinase ekstrak kasar dan hasil
pengendapan 17
14 Stabilitas enzim ekstrak kasar dan pengendapan kitinase pada pH dan
suhu optimum 18
15 Penghambatan G. boninense menggunakan kitinase 100 L setelah
inkubasi 7 hari 18
16 Pembebasan NAG dari dinding sel G. boninense menggunakan enzim
hasil pengendapan 19
DAFTAR LAMPIRAN
1 Komposisi media dan reagen 28
2 Penapisan awal bakteri kitinolitik penghambat G. boninense 29
3 Isolasi DNA genom menggunakan PrestoTMMini gDNA Bacteria 30 4 Hasil sekuensing gen 16S rRNA isolat SAHA 12.07 31 5 Kesamaan sekuen isolat SAHA 12.07 dengan spesies pembanding pada
6 Metode kerja pengukuran aktivitas kitinase 32
7 Metode pengukuran kadar protein 33
8 Metode pengukuran N-asetilglukosamin dari miselum G. boninense 33
PENDAHULUAN
Latar belakang
Kelapa sawit (Elaeis guineensis jacq) merupakan komoditi tanaman
perkebunan sebagai penghasil minyak yang memiliki nilai ekonomi tinggi. Namun salah satu kendala dalam budidaya kelapa sawit antara lain gangguan penyakit. Penyakit yang paling penting dan sangat merugikan kelapa sawit di Indonesia ialah penyakit busuk pangkal batang (basal stem rot/BSR) yang
disebabkan oleh Ganoderma boninense. Penyakit ini dilaporkan menyebabkan
kerugian sekitar 50%-80% per hektar pada tanaman sawit berusia 13 tahun (Cooper et al. 2011). Namun saat ini, Ganoderma juga ditemukan pada
pembibitan dan pangkal atas kelapa sawit (Sanderson 2005; Paterson 2007). Upaya pengendalian penyakit BSR menggunakan kultur teknis dan fungisida kimia belum menunjukkan hasil yang maksimal, bahkan menyebabkan masalah seperti pencemaran lingkungan dan resistensi patogen pada fungisida. Pengendalian biologi menggunakan bakteri endofit telah dilakukan untuk menekan pertumbuhan G. boninense (Bivi et al. 2010; Suryanto et al. 2012).
Namun, aplikasi di lapangan belum konsisten untuk memberantas G. boninense.
Pengembangan agens biokontrol saat ini banyak dilakukan secara enzimatik dalam mendegradasi dinding sel cendawan, seperti pada β-glukan dan kitin (Ilyina
et al. 2013).
Kitin adalah suatu homopolimer β
-
1,4 dengan monomer berupa N-
asetilglukosamin (NAG) dan merupakan polimer kedua melimpah di alamsetelah selulosa (Patil et al. 2000). Kitin secara alami tersebar luas pada dinding
sel cendawan, cangkang udang, nematoda, dan eksoskeleton serangga. Kitin pada cendawan terdapat pada Chytridiomycota, Zygomycota, Ascomycota dan Basidiomycota sebagai komponen dari dinding sel pada miselium dan spora (Landecker 1996). Kandungan kitin pada miselium dari filum Basidiomycota sekitar 26,4-64,5% (Mario et al. 2008), sedangkan pada Ganoderma lucidum yaitu
41% (Álvarez et al. 2014). Kitin dapat didegradasi secara enzimatik oleh kitinase
yang berfungsi sebagai biokontrol pada cendawan patogen (Singh et al. 1999; Dai et al. 2011) dan hama serangga (Mubarik et al. 2010; Nurdebyandaru et al. 2010;
Tu et al. 2010; Lee dan Kim 2015).
Kitinase adalah enzim hidrolitik yang mendegradasi kitin. Salah satu peran kitinase ialah sebagai antifungi yang banyak digunakan sebagai agens biokontrol penyakit tanaman yang disebabkan oleh cendawan patogen (Singh et al. 1999;
Wang et al. 2002; Zarei et al. 2011; Dai et al. 2011; Patil et al. 2013; Fadhil et al.
2014). Kitinase diproduksi oleh bakteri, fungi, insekta, dan tanaman. Namun, produksi dan aplikasi kitinase dari bakteri lebih luas digunakan (Bhattacharya et al. 2007). Penelitian sebelumnya dilaporkan bahwa bakteri kitinolitik telah ditapis
dari tanah kelapa sawit di Taman Nasional Bukit Dua Belas (TNBDB), Jambi (Haryanto 2013) dan kitinasenya mampu menghambat pertumbuhan Curvularia affinis and Colletotrichum gloeosporioides penyebab penyakit hawar kelapa sawit,
baik menggunakan sel, enzim kasar, dan kitinase hasil pengendapan (Asril et al.
2
ini untuk menyeleksi dan mengidentifikasi bakteri kitinolitik asal kelapa sawit TNBDB dalam menghambat pertumbuhan G. boninense dan menguji kembali
kemampuan kitinasenya dalam mendegradasi dinding sel G. boninense.
Perumusan Masalah
Ganoderma boninense merupakan patogen utama kelapa sawit dan sampai
saat ini belum ditemukan pengendalian yang maksimal dalam menanganinya. Kandungan kitin yang tinggi di dalam dinding sel G. boninense menjadi target
penggunaan kitinase dalam mengendalikannya. Kajian penggunaan kitinase sebagai agens biokontrol cendawan patogen pada tanaman komersial lainnya telah banyak digunakan dan dinilai lebih efektif, namun belum dikaji potensinya terhadap patogen G. boninense. Bakteri penghasil kitinase telah ditapis dari tanah
kelapa sawit Jambi. Bakteri kitinolitik atau kitinasenya dapat menjadi agens biokontrol terhadap G. boninense pada tanaman kelapa sawit.
Tujuan Penelitian
Tujuan penelitian ini ialah menyeleksi dan mengidentifikasi bakteri kitinolitik asal tanah kelapa sawit TNBDB yang memiliki kemampuan menghambat pertumbuhan G. boninense dan mengkarakterisasi aktivitas kitinase
dalam kemampuannya mendegradasi dinding sel G. boninense.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai potensi bakteri kitinolitik atau kitinasenya dalam menghambat pertumbuhan G. boninense.
Karakterisasi kitinase dari bakteri asal TNBDB Jambi dalam penelitian ini, diharapkan mampu memberikan informasi tentang potensi kitinase sebagai biokontrol dan menambah informasi tentang karakter kitinase bakteri yang telah tersedia. Potensi bakteri kitinolitik dan kitinase penghambat G. boninense dapat
digunakan sebagai biofungisida pada tanaman kelapa sawit.
TINJAUAN PUSTAKA
Ganoderma boninense sebagai Patogen Kelapa Sawit
3 terdapat di Thailand, Ghana, Nigeria, Kamerun, San Tome dan Principe, Zaire Angola, Zimbabwe Utara, dan Tanzania (Turner 1981).
Busuk pangkal batang (basal stem rot/ BSR) kelapa sawit disebabkan oleh Ganoderma boninense (Abadi dan Dharmaputra 1987). Ganoderma boninense
sebelumnya hanya ditemukan pada pohon dewasa sebagai penyakit busuk pangkal batang, namun akhir-akhir ini telah ditemukan mulai dari pembibitan dan juga ditemukan di bagian atas batang yang disebut penyakit busuk batang atas (Sanderson 2005; Paterson 2007; Susanto et al. 2013). Gejala yang khas pada
penyakit busuk pangkal batang berupa pembusukan pada pangkal batang sebelum terbentuk tubuh buah Ganoderma, terdapat jalur coklat tua pada penampang
batang. Lebih dari separuh pangkal batang sudah membusuk saat gejala pada daun mulai nampak. Tubuh buah dibentuk setelah penyakit berkembang cukup lanjut setelah gejala pada daun. Pohon yang sakit sering rebah walaupun adakalanya tetap tegak meskipun sudah mati (Semangun 2008). Ganoderma boninense yang
menyerang pada saat pembibitan menimbulkan gejala berupa perubahan pada daun menjadi menguning dan diikuti dengan gejala nekrotik. Tubuh buah tidak diproduksi sampai akhir penyakit (Paterson 2007; Suryanto et al. 2012).
Morfologi G. boninense memiliki ciri makroskopis dan mikroskopis.
Warna permukaan atas tubuh buah bervariasi dari coklat muda sampai coklat tua, biasanya tampak mengkilat seperti dilapisi lak. Permukaan atas kurang rata, dan permukaan bawahnya berwarna putih suram. Lapisan bawah tubuh buah terdiri atas lapisan pori, tempat terbentuknya basidium dan basidiospora (Semangun 2008). Ganoderma boninense di Sumatera Utara, memiliki lapisan atas yang
tebalnya 0,1 mm, terdiri atas benang-benang rapat yang sel-selnya berukuran 20-30 x 4-10 µm. Basidiospora berbentuk bulat panjang, berwarna keemasan, bagian atasnya agak rata, berduri, kadang memiliki vakuola yang jelas. Basidiospora berukuran 9-12 x 4,75-6 µm. Di Indonesia G. boninense dapat tumbuh pada pH
3-8,5 dengan suhu optimum 30 0C. Pertumbuhannya terganggu pada suhu 15 oC dan 35 oC, dan tidak tumbuh pada 40 oC (Jing 2007).
Pengendalian penyakit BSR telah dilakukan dengan berbagai cara, namun hingga saat ini belum dapat dikatakan berhasil. Ganoderma boninense merupakan soil borne dan kemampuannya dapat bertahan dalam kondisi kurang optimal
mempersulit usaha pengendalian baik secara kultur teknis, mekanis, maupun kimiawi. Pengendalian menggunakan fungisida kurang efektif, karena mempengaruhi sifat fisik, kimia, dan biologi tanah (Susanto 2002). Namun saat ini fungisida masih digunakan untuk menangani G. boninense (Idris et al. 2010).
Pengendalian yang bersifat ramah lingkungan dan mampu menekan inokulum patogen, ialah pengendalian hayati yang dapat dilakukan melalui introduksi agens antagonis ke dalam agoekosistem. Pengendalian G. boninense menggunakan
bakteri sebagai agens biokontrol telah dilakukan (Bivi et al. 2010; Suryanto et al.
2012). Namun belum konsisten dalam G. boninense secara menyeluruh. Hal ini
karena mutu dari biokontrol dan kondisi lingkungan yang kurang cocok. Oleh karena itu perlu dilakukan penelitian lanjut untuk mengembangkan pengendalian biologi dalam mengendalikan G. boninense. Pengendalian biologi berbasis enzim
dalam mendegradasi komponen dinding sel cendawan patogen seperi kitin dan glukan telah banyak dikaji saat ini.
4
Kitin
Kitin termasuk golongan polisakarida dan merupakan polimer yang dibangun oleh unit-unit monomer N-asetilglukosamin yang tersusun linier dengan ikatan β (1-4) glikosida (Gambar 1). Struktur kitin sama dengan selulosa yaitu ikatan yang terjadi antara monomernya terangkai dengan ikatan β (1-4) glikosida. Perbedaan antara kitin dengan selulosa ialah gugus hidroksil yang terikat pada atom karbon nomor dua digantikan oleh gugus asetamida (NHCOCH3) sehingga kitin menjadi sebuah polimer berunit N-asetilglukosamin, sedangkan pada kitosan digantikan oleh gugus amin (NH2) (Hirano et al. 1999). Kitin tersebar luas di alam
seperti ditemukan pada kutikula insekta, cangkang udang, nematoda, dan dinding sel sebagian besar cendawan (Bhattacharya et al. 2007).
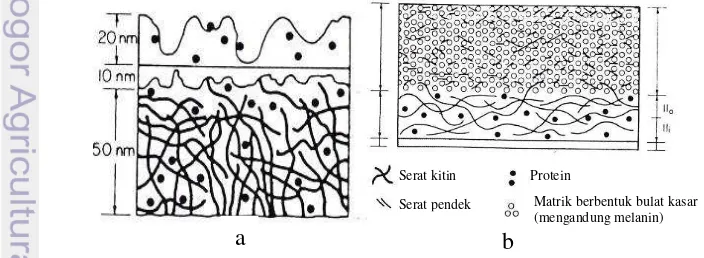
Gambar 1 Struktur kitin yang mengandung monomer N-asetilglukosamin (Bhatnagar dan Sillanpaa 2009)
Kitin pada cendawan tersebar luas khususnya pada Chytridiomycota, Zygomycota, Ascomycota, dan Basidiomycota sebagai komponen dari dinding sel dari miselium dan spora. Pada filum Basidiomycota terdapat sekitar 26,4-64.5% kitin dan 12,6-30,1% glukan (Mario et al. 2008) (Gambar 2). Kandungan kitin ini
berbeda setiap genus cendawan. Dinding sel cendawan mengandung 80-90% polisakarida. Komponen penting lainnya termasuk protein, yang berkonjugasi dengan polisakarida, dan sedikit lemak (Landecker 1996; Deacon 1997). Mayoritas cendawan mengandung kitin dan glukan sebagai polisakarida utama pada dinding selnya, kecuali oomycota yang mengandung selulosa dan glukan sebagai komponen dinding sel fibrilnya (Deacon 1997).
Gambar 2 Komposisi dinding sel pada Basidiomycota. Miselium (a), spora (b) (Landecker 1996).
a b
Kitin
N-asetilglukosamin N-asetilglukosamin
Serat kitin
5 Bakteri Kitinolitik
Bakteri kitinolitik merupakan bakteri yang memiliki kemampuan untuk menghasilkan enzim kitinase (Patil et al. 2000). Bakteri ini dapat ditemukan di
berbagai sumber seperti tanah, rhizosfer, filosfer, endofit tanaman, dan cangkang udang (Haryanto 2013; Sapak et al. 2008, Bivi et al. 2010). Genus bakteri yang
banyak dilaporkan penghasil kitinase antara lain Aeromonas, Alteromonas, Bacillus, Chromobacterium, Enterobacter, Ewingella, Pseudoalteromonas, Pseudomonas, Seratia, Vibrio, dan Pyrococcus (Harman dan Tronsmo 1993).
Bakteri kitinolitik atau kitinasenya salah satunya berpotensi sebagai biokontrol pada penyakit tanaman yang disebabkan oleh cendawan fitopatogenik dan hama serangga (Bhattacharya et al. 2007). Hal ini berpotensi sebagai
biofungisida yang ramah lingkungan dan berpotensi dibidang bioteknologi lainnya (Wang et al. 2002). Peranan kitinase dalam pertahanan tanaman terhadap
serangan patogen terjadi melalui dua cara, yaitu menghambat fungi dengan secara langsung menghidrolisis dinding miselia dan melalui pelepasan elisitor endogen oleh aktivitas kitinase yang kemudian memicu reaksi ketahanan sistemik pada inang. Mekanisme interaksi antara inang dengan patogen sangat menentukan tingkat ketahanan tanaman terhadap suatu penyakit (Oku 1996). Mikrob ini dapat digunakan langsung sebagai agens antagonis atau menggunakan protein murni dari mikroba kitinolitik atau melalui manipulasi gen (Singh et al. 1999; Ilyina et al. 2013). Selain bakteri menghasilkan enzim litik ekstraseluler, seperti kitinase,
keunggulan bakteri tanah dari rhizosfer lainnya ialah mampu memproduksi senyawa antimikrob lainnya, HCN, dan menginduksi resistensi sistemik tanaman yang memberi efek positif bagi kesehatan tanaman (Raaijmakers et al. 2009).
Kitinase
Kitinase merupakan enzim yang aktif mengkatalisis polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin. Degradasi kitin oleh kompleks kitinase bekerja secara sinergis yaitu, endokitinase mendegradasi polimer menjadi oligomer dengan menghidrolisis ikatan glikosida β-(1,4) kemudian eksokitinase mendegradasi oligomer menjadi monomer yang bekerja pada ujung pereduksi, sedangkan β-N-asetilglukosaminidase memotong unit NAG (Bhattacharya et al. 2007) (Gambar 3). Degradasi kitin yang selanjutnya yaitu
mekanisme pengubahan kitin oleh deasetilase kitin menjadi kitosan. Ikatan
6
Gambar 3 Hidrolisis kitin oleh kitinase (Bhattacharya et al. 2007)
Kitinase memiliki banyak fungsi dan aplikasinya di bidang pertanian dan industri. Kitinase paling banyak digunakan sebagai agens biokontrol yang efektif untuk pertahanan dalam mengatasi cendawan patogen serta hama serangga (Tabel 1). Kitinase dari bakteri berperan dalam patogenitas sedangkan pada cendawan, protozoa, dan invertebrata, kitinase berperan dalam morfogenesis. Kitinase juga terlibat dalam mekanisme pertahanan pada tanaman dan vertebrata, sebagai target untuk biopestisida potensial yang sudah banyak dieksplorasi dan digunakan untuk produksi protein sel tunggal (Patil et al. 2000).
Tabel 1 Kitinase asal mikrob yang berperan sebagai agens biokontrol
Mikrob Patogen Refrensi
Paenibacillus sp. Streptomyces sp.
Fusarium oxysporum Sing et al. 1999 Bacillus cereus Botrytis elliptica Huang et al. 2005 Bacillus
thuringiensis
Bacillus licheniformis S. maltophilia
Fusarium sp., Sclerotium rolfsii. Curvularia affinis, C. gloeosporioides
raphani, A.brassicicola.Trichophyton rubrum, A.alternate, A. fumigatus, A.
7
METODE
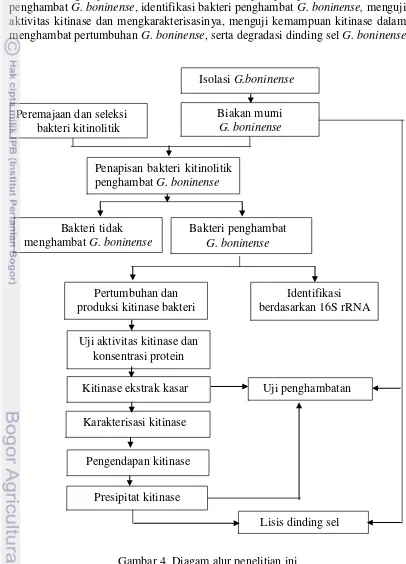
Kerangka Penelitian
Kerangka penelitian ini (Gambar 4) meliputi penapisan bakteri kitinolik penghambat G. boninense, identifikasi bakteri penghambat G. boninense, menguji
aktivitas kitinase dan mengkarakterisasinya, menguji kemampuan kitinase dalam menghambat pertumbuhan G. boninense, serta degradasi dinding sel G. boninense.
Gambar 4 Diagam alur penelitian ini Isolasi G.boninense
Uji penghambatan Peremajaan dan seleksi
bakteri kitinolitik
Biakan murni
G. boninense
Penapisan bakteri kitinolitik penghambat G. boninense
Bakteri tidak menghambat G. boninense
Bakteri penghambat
G. boninense
Identifikasi berdasarkan 16S rRNA Pertumbuhan dan
produksi kitinase bakteri
Karakterisasi kitinase
Pengendapan kitinase
Presipitat kitinase Uji aktivitas kitinase dan
konsentrasi protein Kitinase ekstrak kasar
8
Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan Agustus 2014 sampai Juli 2015. Penelitian dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, Institut Pertanian Bogor (IPB) dan Laboratorium Mikrobiologi dan Biokimia, Pusat Antar Univeritas (PAU), Institut Pertanian Bogor (IPB).
Bahan
Bakteri kitinolitik yang digunakan merupakan bakteri hasil isolasi dari tanah perkebunan kelapa sawit dan karet TNBDB Jambi, dan telah dikoleksi di IPB Culture Collection, Departemen Biologi, Institut Pertanian Bogor (Haryanto, 2013; Purnamasari, 2013). Gadonerma yang digunakan merupakan Ganoderma boninense UTP hasil isolasi dari tubuh buah asal kebun percobaan kelapa sawit
Universitas Tanjungpura, Pontianak, Kalimantan Barat.
Peremajaan Bakteri Kitinolitik
Isolat-isolat bakteri kitinolitik sebelum dilakukan penelitian lanjut, dilakukan peremajaan dan konfirmasi aktivitas kitinolitik. Peremajaan dan konfirmasi kitinolitik dilakukan dengan menumbuhkan isolat tersebut pada media agar-agar kitin (Lampiran 1). Isolat diinkubasi selama 48 jam pada suhu 37 oC.
Isolasi Ganoderma boninense
Isolat G. boninense diisolasi dari kelapa sawit yang mengalami gejala
penyakit busuk pangkal batang. Tubuh buah Ganoderma tersebut sebelumnya
telah teridentifikasi sebagai G. boninense (Nandung 2015). Tubuh buah
dibersihkan menggunakan air steril kemudian didisinfeksi menggunakan alkohol 90%. Basidiokarp tubuh buah dipotong menggunakan pisau steril dan diambil daging buahnya dengan ukuran 1-2 cm dan ditumbuhkan pada media PDA (Lampiran 1). Inkubasi 30 oC dan setelah tumbuh dilakukan pemurnian isolat cendawan hingga mendapat isolat Ganoderma murni (Soytong 2014). Miselium
yang murni ditumbuhkan di dalam baglog yang mengandung tandan kosong
kelapa sawit (Lampiran 1).
Penapisan Bakteri Kitinolitik Penghambat Pertumbuhan G. boninense
Penapisan awal bakteri kitinolitik penghambat G. boninense dilakukan
untuk mengetahui adanya zona hambat berdasarkan metode Aktuganova et al
(2014). Isolat G. boninense berumur 7 hari pada media PDA diambil
menggunakan cock borer berdiameter 1 cm dan diinokulasikan ke dalam media
9 digoreskan bersama dengan cendawan pada empat bagian sisi yang berbeda. Pasangan kultur tersebut diinkubasi kembali selama 10 hari pada suhu 30 ºC.
Bakteri yang mampu membentuk zona hambat terhadap G. boninense diuji
kembali untuk mengetahui persentase penghambatan berdasarkan metode kultur ganda (Bivi et al. 2010). Isolat G. boninense berumur 7 hari pada media PDA
diambil menggunakan cock borer berdiameter 1 cm dan diinokulasikan ke dalam
media agar-agar PDA pada bagian pusat media. Koloni bakteri diinokulasikan bersama dengan cendawan pada jarak 3 cm dari kedua sisi cendawan. Pasangan kultur tersebut diinkubasi kembali selama 10 hari pada suhu 30 ºC. Kontrol menggunakan cendawan tanpa bakteri. Persentase penghambatan antara bakteri terhadap cendawan dapat dihitung dengan mengukur jari-jari cendawan ke arah koloni bakteri (R2), dan mengukur jari-jari cendawan pada media PDA kontrol (R1). Persentase penghambatan dihitung menggunakan persamaan:
Persentase penghambatan (%) = R1R1 – R2 x 100%
Kerusakan miselium G. boninense oleh bakteri kitinolitik yang memiliki
persentase penghambatan tinggi juga dilakukan pengamatan mikroskopis. Pengamatan dilakukan secara langsung di bawah mikroskop dengan cara mengamati pada bagian miselium G. boninense sebelum zona hambat (Suryanto et al. 2012).
Identifikasi Bakteri Kitinolitik Terpilih Berdasarkan Gen 16S rRNA
Tahap awal untuk identifikasi berdasarkan gen 16S rRNA ialah isolasi genom. Isolasi DNA genom dilakukan dengan menggunakan PrestoTMMini gDNA Bacteria Kit (Genaid) (Lampiran 3). Konsentrasi dan kemurnian DNA diukur dengan menggunakan spektrofotometer Nano drop 2000 (Thermo Scientific, Wilmington, DE, USA). Amplifikasi gen dilakukan dengan PCR menggunakan
primer spesifik 63F (5‟-CAG GCC TAA CAC ATG CAA GTC-3‟) dan 1387r (5'-GGG CGG WGT GTA CAA GGC-3') (Marchesi et al. 1998). Total reaksi
PCR sebanyak 50 L mengandung 25 L GoTaq Geen Master Mix, 0.5 L
masing-masing primer, 1 L DNA template, dan 23 L nuclease free water.
Gadien suhu yang digunakan yaitu pra-denaturasi (94 oC, 2 menit), denaturasi (92 oC, 30 detik),
annealing (55 oC, 30 detik), elongasi (72 oC, 5 menit) serta final extension pada (72 oC, 5 menit). Proses ini dilakukan sebanyak 30 siklus
kemudian hasil PCR divisualisasi menggunakan elektroforesis gel agarosa 0,8%. Produk PCR sekitar 1300 bp dimurnikan dan disekuen ke perusahaan jasa sekuensing. Hasil sekuensing (Lampiran 4) dianalisis dengan menggunakan progam Bioedit kemudian disejajarkan dengan data base Gen 16S rRNA menggunakan progam BLAST-N. Analisis filogenetik dilakukan dengan
10
Pembuatan Kurva Tumbuh dan Produksi Enzim Isolat Terpilih
Pembuatan kurva pertumbuhan dilakukan pada isolat bakteri kitinolitik potensial yang memiliki persentase penghambatan besar terhadap G. boninense.
Pembuatan kurva pertumbuhan diukur secara langsung menggunakan spektrofotometer. Sebanyak 2 lup bakteri terpilih diinokulasikan ke dalam 50 mL medium kitin dan diinkubasi selama 36 jam pada suhu 37 oC sambil dikocok pada kecepatan 120 rpm. Optical density (OD) dari sel dihitung hingga didapatkan
jumLah sel bakteri 108 sel/mL sebagai inokulum kemudian dimasukkan ke dalam 100 mL media kitin. Hasil pertumbuhan diukur berdasarkan nilai OD pada panjang gelombang 600 nm setiap 6 jam selama 72 jam. Kultur sel yang sama kemudian disentrifugasi selama 10 menit dengan kecepatan 6.000 rpm (Sentrifuge HermLe dengan rotor 220.97) pada suhu 4 oC. Supernatan yang diperoleh merupakan kitinase ekstrak kasar yang selanjutnya diukur aktivitas kitinasenya dan diuji daya antagonis kembali.
Pengukuran Aktivitas Kitinase dan Konsentrasi Protein
Aktivitas kitinase diukur dengan metode Spindler (1997). Sebanyak 150 L ekstrak kasar kitinase ditambahkan ke dalam 300 L 0,3% koloidal kitin dan 150 L bufer fosfat 0,1 M pH 7 pada suhu 37 oC. Campuran diinkubasi pada 37 oC selama 30 menit kemudian dididihkan pada 100 oC selama 10 menit dan didinginkan selama 10 menit pada 4 oC. Setelah sentrifugasi pada 8400 g selama 5 menit, filtrat ditambahkan ke dalam akuades 500 L dan 1000 L reagen schales (Lampiran 1) dan dididihkan kembali pada 100 oC selama 10 menit. Aktivitas enzim ditentukan dengan mengukur absorbansi pada panjang gelombang 420 nm. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang menghasilkan
1 mol N-asetilglukosamin per menit (Lampiran 6). Konsentrasi protein ditentukan dengan metode Bradford (1976) (Lampiran 7) menggunakan Bovine serum Albumin sebagai standar (Lampiran 9).
Pengendapan Kitinase
11
Karakterisasi pH dan Suhu serta Stabilitas Kitinase
Penentuan pH optimum aktivitas kitinase ekstrak kasar dan hasil pengendapan dilakukan dengan mengujikan kitinase ekstrak kasar yang diperoleh pada waktu produksi tertinggi. Pengukuran aktivitas enzim diuji pada substrat koloidal kitin 0,3 % dalam bufer dengan rentang pH 4-10 (selang 1 unit) menggunakan bufer sitrat 0,1 M (pH 4-6), bufer fosfat 0,1 M (pH 7-8), dan bufer glisin-NaOH 0,1 M (pH 9-10). Penentuan suhu optimum aktivitas kitinase dilakukan dengan mengujikan ekstrak kasar enzim pada pH optimum dengan rentang suhu 20 oC - 90 oC (selang 10 oC).
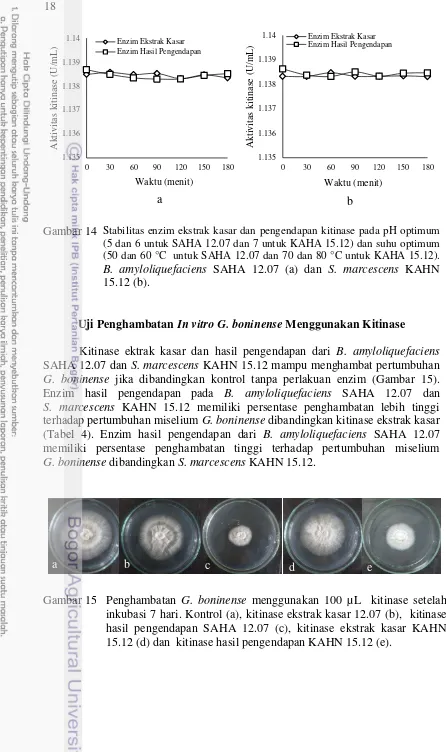
Stabilitas enzim dilakukan dengan menginkubasikan kitinase ekstrak kasar dan hasil pengendapan. Enzim diuji setiap 30 menit pada pH dan suhu optimumnya dengan menggunakan substrat koloidal kitin 0,3%. Pengujian dilakukan hingga 180 menit.
Uji Penghambatan Kitinase terhadap Pertumbuhan G. boninense
Uji penghambatan dan penilaian persentase daya hambat dilakukan menggunakan kitinase ektrak kasar dan kitinase hasil pengendapan dari isolat bakteri terpilih berdasarkan metode Bivi et al. (2010) yang dimodifikasi. Kitinase
sebanyak 50 dan 100 µL yang sebelumnya telah disaring dengan milipore ukuran
0,2 m kemudian dicampur dalam 10 mL media PDA hangat steril. Campuran tersebut dituang di cawan petri steril kemudian setelah media dingin, Ganoderma
dengan diameter 1 cm diinokulasikan di tengah-tengah media PDA. Media PDA tanpa penambahan enzim digunakan sebagai kontrol.
Lisis Dinding Sel G. boninense
Kemampuan kitinase dalam melisiskan kitin pada dinding sel cendawan ditentukan dengan adanya N-asetilglukosamin yang dibebaskan setelah dicampur dengan kitinase menggunakan metode Singh et al. (1999) yang dimodifikasi.
Tahapan ini meliputi produksi enzim dan pengendapan protein, produksi miselium dan pembuatan suspensi miselium, dan pengukuran N-asetilglukosamin.
Kitinase awalnya diperoleh dengan cara membuat inokulum bakteri sebanyak 2 lup bakteri terpilih diinokulasikan ke dalam 50 mL medium koloidal kitin dan diinkubasi selama 36 jam pada suhu 37 oC, 120 rpm. Inokulum diambil 108 sel/mL dan diinokulasikan ke dalam 1000 mL medium produksi koloidal kitin dan diinkubasi selama waktu produksi optimum kitinase (Gambar 10) pada 37 oC, 120 rpm. Kitinase ekstrak kasar diperoleh dengan mensentrifugasi biakan pada 6000 rpm, selanjutnya diendapkan dengan aseton pada konsentrasi aseton optimum (Gambar 11). Kitinase hasil pengendapan yang diperoleh digunakan untuk uji lisis kitin G. boninense.
Miselium G. boninense diperoleh dengan cara menumbuhkan 3 potong G. boninense masing-masing berdiameter 1 cm ke dalam medium 250 mL Potato
12
pada 5000 rpm selama 10 menit. Pelet kemudian dicuci dengan akuades steril beberapa kali. Pelet kemudian disuspensikan ke dalam bufer fosfat pH 7 0,1 M dengan perbandingan 1:3. Suspensi miselium dan kitinase hasil pengendapan dicampur dengan perbandingan 1:1 dan diinkubasi pada suhu 30 oC selama 12 jam. Kontrol merupakan suspensi miselium tanpa pemberian enzim dan diganti dengan akuades. Setiap 2 jam selama 12 jam diukur kadar N-asetilglukosamin yang dibebaskan dari dinding sel G. boninense berdasarkan metode Miller (1959)
menggunakan reagen DNS (Lampiran 8) dengan standar N-asetilglukosamin (Lampiran 9).
HASIL DAN PEMBAHASAN
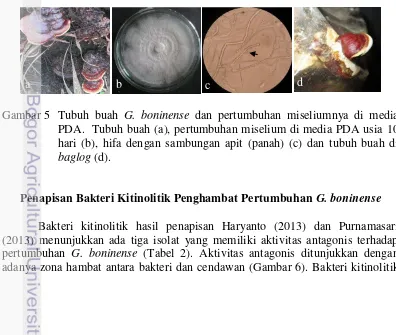
Isolasi Ganoderma boninense sebagai Patogen Kelapa Sawit
Tubuh buah G. boninense dari batang kelapa sawit terinfeksi berhasil
diisolasi dari perkebunan kelapa sawit di Pontianak, Kalimantan Barat. Tubuh buah G. boninense memiliki diameter 10-12 cm. Permukaan atas tubuh buah
berwarna kecokelatan dan mengkilat dengan garis putih kekuningan pada bagian pinggir basidiokarp. Permukaan bawah tubuh buah berwarna putih suram yang terdiri atas pori sebagai tempat terbentuknya basidium. Permukaan miselium berwarna putih dengan pertumbuhan miselium cenderung lambat yaitu 10-12 hari baru dapat tumbuh memenuhi cawan petri yang berdiameter 9 cm. Miselium
Ganoderma juga tampak adanya sambungan apit pada hifa sekunder dan mampu
membentuk tubuh buah setelah ditumbuhkan pada media tandan kosong kelapa sawit selama 4 bulan dengan diameter sebesar 1.5 cm (Gambar 5).
Gambar 5 Tubuh buah G. boninense dan pertumbuhan miseliumnya di media
PDA. Tubuh buah (a), pertumbuhan miselium di media PDA usia 10 hari (b), hifa dengan sambungan apit (panah) (c) dan tubuh buah di
baglog (d).
Penapisan Bakteri Kitinolitik Penghambat Pertumbuhan G. boninense
Bakteri kitinolitik hasil penapisan Haryanto (2013) dan Purnamasari (2013) menunjukkan ada tiga isolat yang memiliki aktivitas antagonis terhadap pertumbuhan G. boninense (Tabel 2). Aktivitas antagonis ditunjukkan dengan
adanya zona hambat antara bakteri dan cendawan (Gambar 6). Bakteri kitinolitik b
14
Identifikasi Bakteri Terpilih
Bakteri terpilih yang mampu menghambat G. boninense teridentifikasi
sebagai Bacillus amyloliquefaciens SAHA 12.07 dan Serratia marcescens KAHN
15.12 secara molekuler berdasarkan gen penyandi 16S rRNA. Visualisasi hasil amplifikasi gen 16S rRNA dari isolat SAHA 12.07 menunjukkan adanya pita berukuran ± 1300 bp (Gambar 8). Kemiripan sekuen gen 16S rRNA dengan data melalui progam BLAST-N menunjukkan bahwa isolat SAHA 12.07 memiliki kemiripan 99% dengan Bacillus amyloliquefaciens galur MPA 1034. Isolat SAHA
12.07 juga memiliki konsistensi berkerabat dekat dengan Bacillus amyloliquefaciens dan Bacillus siamensis galur PD-A10 berdasarkan analisis
filogenetik (Gambar 9, Lampiran 5). Isolat KAHN 15.12 memiliki kemiripan dengan Serratia marcescens galur H3010 yang sebelumnya telah teridentifikasi
secara molekuler (Astriani2015).
Gambar 8 Visualisasi hasil amplifikasi gen 16S rRNA pada gel agarosa 0,8 %. Marker 1 kb (M), SAHA 12. 07 (1).
Gambar 9 Pohon filogenetik gen 16S rRNA dari SAHA 12.07 menggunakan metode Neighbor Joining (NJ) dengan boostrap 1000x
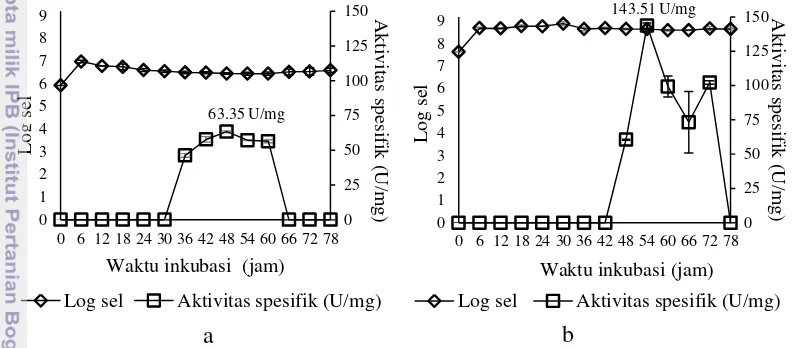
15 Pertumbuhan dan Produksi Enzim Bakteri Terpilih
Bakteri kitinolitik terpilih yaitu Bacillus amyloliquefaciens SAHA 12.07
dan Serratia marcescens KAHN 15.12 memiliki pola pertumbuhan dan aktivitas
enzim kitinase di media koloidal kitin (Gambar 10). Kedua pertumbuhan bakteri tersebut memasuki fase logaritmik hingga jam ke-6 kemudian memasuki fase stasioner hingga akhir pengamatan pada jam ke-78. Produksi kitinase dari
B. amyloliquefaciens SAHA 12.07 mulai memiliki aktivitas pada jam ke 36-60
inkubasi dengan aktivitas optimum pada jam ke-48. Aktivitas kitinase dari
S. marcescens KAHN 15.12 mulai terlihat pada jam ke-48 hingga 72 inkubasi
dengan aktivitas optimum pada jam ke-54.
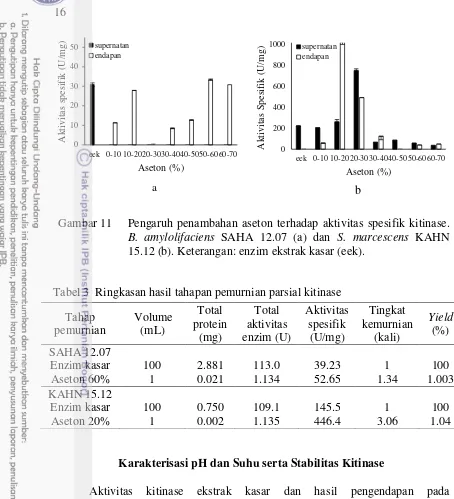
Pengendapan Kitinase
Kitinase ekstrak kasar pada B. amyloliquefaciens SAHA 12.07 mampu
ditingkatkan aktivitas spesifiknya hingga 33.372 U/mg menggunakan aseton pada konsentrasi 50-60% dan meningkatkan kemurniannya hingga 1.34 kali dari sebelumnya. Kitinase pada S. marcescens KAHN 15.12 mampu ditingkatkan
aktivitas spesifiknya hingga 1029.2 U/mg menggunakan aseton pada konsentrasi 10-20% dan meningkatkan kemurniannya hingga 3.06 (Gambar 11 dan Tabel 3).
0
Gambar 10 Pertumbuhan sel dan aktivitas kitinase dari B. amyloliquefaciens
SAHA 12.07 (a) dan S. marcescens KAHN 15.12 (b)
16
Tabel 3 Ringkasan hasil tahapan pemurnian parsial kitinase Tahap
Karakterisasi pH dan Suhu serta Stabilitas Kitinase
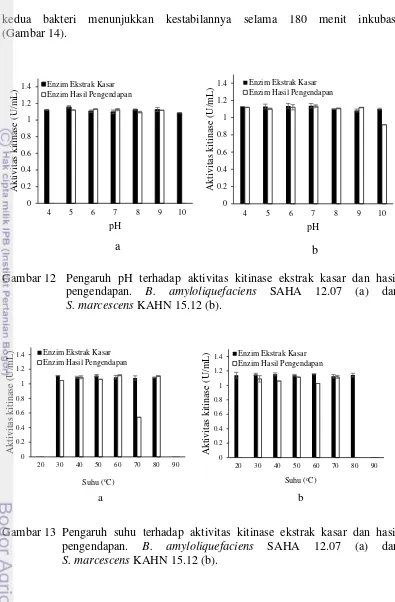
Aktivitas kitinase ekstrak kasar dan hasil pengendapan pada
B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 aktif pada
kisaran pH antara 4-10 dan suhu antara 20-80 °C. Kitinase ekstrak kasar dan hasil pengendapan pada B. amyloliquefaciens SAHA 12.07 masing-masing memiliki
aktivitas optimum pada pH 5 dan 6 dengan nilai aktivitas kitinase masing-masing sebesar 1.158 U/mL dan 1.130 U/mL. Kitinase ekstrak kasar dan hasil pengendapan pada S. marcescens KAHN 15.12 memiliki aktivitas optimum yang
sama yaitu pada pH 7 dengan nilai aktivitas kitinase masing-masing sebesar 1.136 U/mL dan 1.132 U/mL (Gambar 12). Suhu optimum pada kitinase ekstrak kasar dan hasil pengendapan pada B. amyloliquefaciens SAHA 12.07 yaitu pada suhu
50 °C dan 60 °C dengan nilai aktivitas masing-masing sebesar 1.114 U/mL dan 1.117 U/mL. Kitinase ekstrak kasar dan hasil pengendapan pada S. marcescens
KAHN 15.12 memiliki aktivitas kitinase optimum pada suhu 60 °C dan 70 °C
Gambar 11 Pengaruh penambahan aseton terhadap aktivitas spesifik kitinase.
B. amylolifaciens SAHA 12.07 (a) dan S. marcescens KAHN
17
Gambar 12 Pengaruh pH terhadap aktivitas kitinase ekstrak kasar dan hasil pengendapan. B. amyloliquefaciens SAHA 12.07 (a) dan S. marcescens KAHN 15.12 (b).
Gambar 13 Pengaruh suhu terhadap aktivitas kitinase ekstrak kasar dan hasil pengendapan. B. amyloliquefaciens SAHA 12.07 (a) dan S. marcescens KAHN 15.12 (b).
18
Uji Penghambatan In vitroG. boninense Menggunakan Kitinase
Kitinase ektrak kasar dan hasil pengendapan dari B. amyloliquefaciens
SAHA 12.07 dan S. marcescens KAHN 15.12 mampu menghambat pertumbuhan G. boninense jika dibandingkan kontrol tanpa perlakuan enzim (Gambar 15).
Enzim hasil pengendapan pada B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 memiliki persentase penghambatan lebih tinggi
terhadap pertumbuhan miselium G. boninense dibandingkan kitinase ekstrak kasar
(Tabel 4). Enzim hasil pengendapan dari B. amyloliquefaciens SAHA 12.07
memiliki persentase penghambatan tinggi terhadap pertumbuhan miselium
G. boninense dibandingkan S. marcescens KAHN 15.12.
1.135
Gambar 14 Stabilitas enzim ekstrak kasar dan pengendapan kitinase pada pH optimum (5 dan 6 untuk SAHA 12.07 dan 7 untuk KAHA 15.12) dan suhu optimum (50 dan 60 °C untuk SAHA 12.07 dan 70 dan 80 °C untuk KAHA 15.12).
B. amyloliquefaciens SAHA 12.07 (a) dan S. marcescens KAHN
15.12 (b).
Gambar 15 Penghambatan G. boninense menggunakan 100 µL kitinase setelah
inkubasi 7 hari. Kontrol (a), kitinase ekstrak kasar 12.07 (b), kitinase hasil pengendapan SAHA 12.07 (c), kitinase ekstrak kasar KAHN 15.12 (d) dan kitinase hasil pengendapan KAHN 15.12 (e).
a b c d e
19 Tabel 4 Persentase penghambatan kitinase terhadap pertumbuhan G. boninense
Lisis Dinding Sel G. boninense
Kitinase hasil pengendapan dari B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 mampu melisiskan dinding sel G. boninense yang
ditandai adanya peningkatan jumlah N-asetilglukosamin yang dihasilkan (Gambar 16). Kitinase B. amyloliquefaciens SAHA 12.07 melepaskan NAG tertinggi pada
waktu inkubasi optimum jam ke-4, yaitu 313.68 g/mL. Berbeda dengan kitinase
S. marcescens KAHN 15.12 yang melepaskan NAG lebih tinggi pada waktu
inkubasi optimum jam ke-2, yaitu 365.73 g/mL.
Pembahasan
Bakteri kitinolitik SAHA 12.07 dan KAHN 15.12 mampu menghambat pertumbuhan miselium G. boninense dengan persentase penghambatan tinggi
dibandingkan isolat lainnya yang ditandai dengan pembentukan zona hambat antara bakteri dengan G. boninense. Zona hambat di sekitar koloni bakteri tersebut
diduga karena hidrolisis kitin pada dinding sel G. boninense oleh kitinase yang
dikeluarkan oleh bakteri. Hal ini menyebabkan miselium G. boninense tidak dapat
0
Bakteri Kitinase Penghambatan (%)
Bacillus amyloliquefaciens
Enzim ekstrak kasar 50 µl Enzim ekstrak kasar 100 µl
12.67 15.49 Enzim hasil pengendapan 50 µl
Enzim hasil pengendapan 100 µl
50.70 Enzim hasil pengendapan 50 µl
Enzim hasil pengendapan 100 µl
21.12 40.84
Gambar 16 Pembebasan NAG dari dinding sel G. boninense menggunakan
kitinase hasil pengendapan. Bacillus amyloliquefaciens SAHA 12.07
20
tumbuh mendekati koloni bakteri dan terlihat mengalami kerusakan. Bakteri kitinolitik lainnya tidak dapat menghambat G. boninense, meskipun menghasilkan
kitinase. Hal ini karena setiap bakteri kitinolitik memiliki aktivitas dan tipe kitinase yang berbeda. Kitinase yang disandikan oleh gen chiA, chiB dan chiC
akan bekerja sinergis mendegradasi kitin sebagai antifungi yang banyak ditemukan pada Serratia marcescens. Kitinase dari gen chiA lebih berlimpah di
alam daripada chiB dan chiC (Hamid et al. 2013). Besarnya persentase
penghambatan tidak berkolerasi dengan besarnya indeks kitinolitik atau aktivitas spesifik kitinase. Hal ini diduga karena tidak hanya kitinase yang bekerja selama penghambatan pertumbuhan G. boninense tetapi adanya sinergisme antifungi
lainnya. Senyawa antifungi lainnya memiliki target kerja yang berbeda-beda, seperti antifungi dari golongan polien berfungsi merusak fungsi ergosterol pada membran cendawan, azol sebagai penghambat sintesis ergosterol, gliserofulvin sebagai penghambat pembelahan sel ketika metafase, fluorocytosin sebagai penghambat sintesis asam nukleat, sordadin sebagai penghambat sintesis protein, dan echinocardin sebagai penghambat sintesis glukan (Cowen 2008). Kitinase dan
enzim hidrolitik lainnya seperti β-glukanase merupakan enzim kunci dalam melisiskan dinding sel cendawan yang bekerja secara sinergis (Bormann et al.
1999). Penghambatan cendawan melalui sistem kitinolitik Streptomyces dan B. subtilis, mampu menghasilkan senyawa antifungi chitin-binding protein yang
akan berikatan kuat dengan α kitin yang baru dibentuk (nascent chitin) pada ujung
hifa sehingga akan berpengaruh pada pembentukan dinding sel yang ditandai dengan terbentuknya gelembung di ujung hifa (Scheilmann et al. 1999). Isolat
SAHA 12.07 diduga menghasilkan chitin-binding protein, atau β-glukanase
namun perlu penelitian lanjut terkait antifungi lain.
Bakteri kitinolitik seperti Enterobacter sp. KR05, Enterobacter cloacae
LK08, Bacillus sp. BK13, Enterobacter sp. BK15, dan Bacillus sp. BK17 juga
mampu menekan pertumbuhan G. boninense di media agar-agar kitin (Suryanto et al. 2012), tetapi dalam penelitian ini menggunakan media PDA sebagai media
yang baik untuk pertumbuhan cendawan. Hasil ini ditunjukkan dengan membandingkan pertumbuhan G. boninense pada media kitin saat uji antagonis
dengan bakteri yang memiliki kepadatan miselium yang lebih rendah (Suryanto et al. 2012), dibandingkan dengan pertumbuhan G. boninense pada media PDA
(kontrol) dalam penelitian ini. Upaya untuk mendapatkan agens biokontrol potensial selama uji antagonis diperlukan untuk menjaga semua kondisi pertumbuhan yang baik untuk patogen. Hal ini bertujuan untuk mengurangi efek penghambatan patogen kecuali oleh agens biokontrol.
Isolat SAHA 12.07 teridentifikasi sebagai Bacillus amyloliquefaciens dan
memiliki kekerabatan dekat dengan Bacillus siamensis. Hasil yang sama juga
dilaporkan bahwa analisis menggunakan kompleks sekuen dari berbagai spesies
Bacillus juga menunjukkan bahwa B. amyloliquefaciens berkerabat dekat dengan B. siamensis (Jeong et al. 2012). Bacillus amyloliquefaciens telah banyak
dilaporkan sebagai agens biokontrol pada Colletotrichum lagenarium, Sclerotinia sclerotiorum, Ralstonia solanacearum, Rhizopus stolonifer, Botritis cinerea, dan Penicillium expansum (Kim dan Chung 2004; Abdullah et al. 2008; Arrebola et al. 2010; Hu et al. 2010). Serratia marcescens juga dilaporkan sebagai agens
21
amyloliquefaciens dan S. marcescens tersebut tidak hanya menggunakan kitinase
sebagai antifungi, namun sebagian biokontrol tersebut menggunakan antifungi peptida dan lipopeptida sebagai antifungi melawan cendawan patogen. Mikrob yang memiliki spektrum penghambatan patogen yang luas sangat baik digunakan sebagai agen biokontrol (Wang et al. 2014).
Bacillus amyloliquefaciens SAHA 12.07 dan Serratia marcescens KAHN
15.12 memiliki pola pertumbuhan yang mirip di media koloidal kitin dan mampu memproduksi kitinase. Kemampuan tumbuh kedua bakteri tersebut di media kitin menunjukkan bahwa media tersebut mampu mensuplai nutrisi bagi pertumbuhan sel. Kitin tersebut selanjutnya akan dihidrolisis oleh ektraseluler kitinase yang merupakan metabolit primer dari kedua bakteri tersebut. Hasil hidrolisis kitin menghasilkan N-asetilglukosamin yang selanjutkan akan digunakan kembali oleh sel bakteri sebagai sumber karbon untuk pertumbuhannya. Produksi kitinase tertinggi oleh kedua bakteri tersebut berada pada fase stasioner. Hasil yang sama juga dilaporkan bahwa kitinase umumnya memproduksi oleh bakteri pada fase stasioner pada 36-72 jam inkubasi (Toharisman et al. 2005; Mubarik et al. 2010;
Nurdebyandaru et al. 2010; Asril et al. 2014).
Kitinase ekstrak kasar yang diperoleh dari produksi tertinggi pada
B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 mampu
ditingkatkan aktivitas spesifiknya menggunakan aseton. Persentase aseton tidak
sama dalam mengendapkan kitinase dari isolat yang berbeda. Kitinase
B. amyloliquefaciens SAHA 12.07 mampu ditingkatkan aktivitasnya secara
parsial menggunakan aseton 60%, sedangkan kitinase S. marcescens KAHN 15.12
menggunakan aseton 20%. Aseton yang ditambahkan akan menggantikan kandungan air di sekitar daerah hidrofobik dari permukaan protein. Protein dapat diendapkan menggunakan aseton karena adanya interaksi elektrostatis antara muatan yang berlawanan pada permukaan protein. Interaksi ini akan menyebabkan protein berada pada kondisi isoelektrik kemudian mengendap. Umumnya semua protein dapat diendapkan menggunakan aseton 20-50% (Scopes 1987). Kitinase Stenotrophomonas maltophilia dan Penicillium ochrochloron
berhasil diendapkan menggunakan aseton 30 dan 70% (Patil et al. 2013;
Jankiewicz dan Maria 2014). Total protein dan perolehan (yield) yang rendah
pada penelitian ini menunjukkan bahwa permurnian parsial kitinase dari kedua bakteri tersebut tidak cocok menggunakan aseton walaupun dapat meningkat aktivitas spesifiknya. Oleh karena itu jika pengendapan protein menggunakan pelarut organik dan amonium sulfat tidak cocok maka perlu dicari metode lainnya seperti dengan ultrafiltrasi atau menggunakan bahan pemekat enzim seperti polietilen glikol (Scopes 1987).
Aktivitas kitinase ekstrak kasar dan hasil pengendapan pada
B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 mempunyai
kisaran pH luas antara 4-10. Aktivitas optimum kitinase ekstrak dan hasil pengendapannya pada B. amyloliquefaciens SAHA 12.07 yaitu pada pH 5 dan 6,
dan pada S. marcescens KAHN 15.12 pH 7. Hasil yang sama juga dilaporkan
bahwa kitinase B. amyloliquefaciens V656 yang memiliki aktivitas optimum pada
pH 6 dan pH 7 (Wang et al. 2002). Demikian pula dengan kitinase S. marcescens
GEI dan Serratia marcescens MO-1 yang mempunyai aktivitas optimum
masing-masing pada pH 7 (Tu et al. 2010; Okay et al. 2013). Aktivitas optimum
22
enzim. Kitinase dari bakteri umumnya mempunyai kisaran pH asam hingga basa. Protein antifungi yang memiliki kisaran pH dan suhu yang luas sangat baik digunakan sebagai biokontrol (Bhattacharya et al. 2007; Wang et al. 2014). Oleh
karena itu, kitinase dapat digunakan secara luas dalam berbagai kondisi lingkungan untuk mengatasi penyakit tanaman (Ilyina et al. 2013).
Aktivitas kitinase ekstrak kasar dan hasil pengendapan pada
B. amyloliquefaciens SAHA 12.07 dan S. marcescens KAHN 15.12 juga
mempunyai kisaran suhu luas antara 20-80 oC. Aktivitas optimum kitinase ekstrak kasar dan hasil pengendapannya pada B. amyloliquefaciens SAHA 12.07
masing-masing pada suhu 50 dan 60 oC, sedangkan pada S. marcescens KAHN 15.12
masing-masing pada suhu 60 dan 70 oC. Aktivitas kitinase pada suhu 20 oC hanya ditemukan pada S. marcescens KAHN 15.12 meskipun lebih rendah dibandingkan
suhu optimum. Aktivitas kitinase ekstrak kasar dan hasil pengendapannya kedua bakteri tersebut tidak ditemukan lagi pada suhu 90 °C. Pada kondisi di atas suhu optimum, aktivitas enzim lebih rendah karena enzim mulai terdenaturasi. Hal ini menyebabkan rusaknya ikatan ionik yang berfungsi menstabilkan struktur tiga dimensi protein sehingga substrat tidak dapat lagi masuk ke dalam situs aktif enzim. Hasil yang sama juga dilaporkan bahwa kitinase memiliki aktivitas optimum antara 35-75 oC (Wang et al. 2002; Dai et al. 2010; Tu et al. 2010; Zarei et al. 2010; Asril et al. 2014; Habchi et al. 2015). Karakteristik lainnya dari
kitinase kedua bakteri tersebut ialah tetap stabil pada suhu optimum enzim sampai 180 menit inkubasi. Hal ini juga memberi kontribusi yang baik saat diaplikasikan di lapang karena aktivitas kitinase dapat dipertahankan dalam waktu yang cukup lama selain memiliki kelebihan dengan karakter kisaran pH dan suhu yang luas.
Kitinase ekstrak kasar dan hasil pengendapannya dari B. amyloliquefaciens
SAHA 12.07 dan S. marcescens KAHN 15.12 mampu menghambat pertumbuhan G. boninense, namun persentase penghambatannya lebih tinggi dengan
menggunakan hasil pengendapannya. Hal ini dapat terjadi karena konsentrasi protein kitinase lebih tinggi yang menyebabkan penghambatan lebih luas daripada enzim kasar. Enzim hasil pengendapan dari B. amyloliquefaciens SAHA 12.07
memiliki persentase penghambatan tinggi dibandingkan lainnya. Hal ini karena
B. amyloliquefaciens SAHA 12.07 memiliki kadar protein lebih tinggi setelah
pengendapan dibandingkan S. marcescens KAHN 15.12, sehingga diduga adanya
sinergime antara kitinase dengan protein atau metabolit sekunder antifungi lainnya. Bacillus amyloliquefaciens selain penghasil kitinase juga menghasilkan
antifungi seperti protein mirip β-glukosidase (Kim dan Chung 2004), iturin A, fengycin, surfactin sebagai metabolit sekunder (Arrebola et al. 2010), dan protein
antimikrob non-proteinaceous dengan molekul organik kecil (Hu et al. 2010). Bacillus selain menghasilkan enzim juga dikenal menghasilkan senyawa
antibiotik, termasuk volatil, lipopeptida, dan peptida. Bacillus juga memiliki
endospora yang dapat tahan terhadap panas dan kekeringan serta dapat berkolonisasi di lingkungan mikro tanaman untuk mencegah infeksi (Wang et al.
2014). Serratia marcescens KAHN 15.12, selain berpotensi tinggi penghasil
23 Rhizobakteri, seperti Bacillus dan Serratia, memiliki potensi sebagai pemacu
tumbuh tanaman, pencegahan infeksi patogen dan peningkatan kesehatan tanah (Raaijmakers et al. 2009).
Kitinase hasil pengendapan dari B. amyloliquefaciens SAHA 12.07 dan
S. marcescens KAHN 15.12 mampu melisiskan kitin pada dinding sel G. boninense yang ditandai dengan adanya peningkatan kadar N-asetilglukosamin
(NAG) yang dilepaskan dari miselium G. boninense. Kitinase dari S. marcescens
KAHN 15.12 lebih tinggi menghasilkan NAG dibandingkan kitinase dari
B. amyloliquefaciens SAHA 12.07, meskipun B. amyloliquefaciens SAHA 12.07
memiliki konsintensi penghambatan G. boninense yang lebih tinggi baik
menggunakan sel, kitinase ekstrak kasar dan hasil pengendapan. Hal ini karena
S. marcescens KAHN 15.12 memiliki nilai aktivitas spesifik kitinase yang lebih
tinggi dibandingkan B. amyloliquefaciens SAHA 12.07, sehingga diduga
kemampuan untuk melisiskan kitin pada G. boninense akan lebih tinggi dan
produk NAG yang dihasilkan juga lebih tinggi. Hasil ini didukung bahwa Serratia marcessens juga dikenal sebagai penghasil kitinase yang potensial yang sudah
banyak diaplikasikan sebagai biokontrol (Tu et al. 2010; Zarei et al. 2010; Okay et al. 2013; Fadhil et al. 2014). Pada kondisi di atas waktu optimum NAG
diproduksi, terjadi penurunan kadar NAG. Hal ini diduga disebabkan kehadiran NAG yang tinggi sehingga bersifat represi akibatnya produk NAG yang dihasilkan akan rendah. Hasil yang sama juga dilaporkan bahwa kitinase hasil pengendapan oleh Streptomyces sp. 285 dan Paenibacillus sp. 300 mampu
melisiskan kitin pada dinding sel Fusarium oxysporum yang ditandai adanya
NAG yang dibebaskan dari miseliumnya (Singh et al. 1999).
SIMPULAN
Bacillus amyloliquefaciens SAHA 12.07 dan Serratia marcescens KAHN
15.12 berhasil menghambat pertumbuhan G. boninense masing-masing 68,19 dan
40,29%. Serratia marcescens KAHN 15.12 mampu memproduksi kitinase lebih
tinggi dibandingkan B. amyloliquefaciens SAHA 12.07. Kitinase dapat
ditingkatkan aktivitas spesifiknya dengan aseton 60% pada B. amyloliquefaciens
SAHA 12.07 dan aseton 20% pada S. marcescens KAHN 15.12. Kitinase dari
kedua bakteri tersebut memiliki kisaran pH dan suhu yang luas serta stabilitas yang baik. Kitinase mampu menghambat pertumbuhan miselium G. boninense
24
DAFTAR PUSTAKA
Abadi AL, Dharmaputra OS. 1987. Identifikasi dan Isolasi Ganoderma boninense
pada kelapa sawit di Sumatra Utara. Didalam: Sastrahidayat IR, Machfud MC, Djauhari S, editor. Prosiding Seminar Ilmiah Ilmu Penyakit Tumbuhan dan Konges Nasional IX PFI; 1987 November; Surabaya,
Indonesia: Surabaya (ID): FPI-Surabaya. hlm 159-164.
Abdullah MT, Ali NY, Suleman P. 2008. Biological control of Sclerotinia sclerotiorum (Lib.) de Bary with Trichoderma harzianum and Bacillus amyloliquefaciens. Crop Protection. 27:1354-1359.
Álvarez SPO, Cadavid DAR, Sierra DMES, Orozco CPO, Vahos DFR, Ocampo PZ, Atehortúa L. 2014. Comparison of extraction methods of chitin from
Ganoderma lucidum mushroom obtained in submerged culture. Bio Med Res Inter. 10:1-7.
Arrebola E, Sivakumar D, Bacigalupo R, Korsten L. 2010. Combined application of antagonist Bacillus amyloliquefaciens and essential oils for the control
of peach postharvest diseases. Crop Protect. 29:369-377.
Asril M, Mubarik NR, Wahyudi AR. 2014. Partial purification of bacterial chitinase as biological of leaf bligth on oil palm. Res J Microbiol.
9:265-277.
Astriani M. 2015. Seleksi bakteri penghasil indole-3-acetic acid dan pengujiannya
pada bibit kelapa sawit (Elaeis quineensis Jacq [Tesis]. Bogor (ID):
Institut Pertanian Bogor.
Bhatnagar A, Sillanpaa M. 2009. Applications of chitin and chitosan derivatives for the detoxification of water and wastewater. Advan in Colloid Interface Sci. 152:26-38.
Bhattacharya D, Nagpure A, Gupta RK. 2007. Bacterial chitinases: properties and potential. Crit Rev Biotech. 27(1):21-28.
Bivi MR, Farhana MSN, Khairulmazmi A, Idris A, 2010. Control of Ganoderma boninense: a causal agent of basal stem rot disease in oil palm with
endophyte bacteria in vitro. Int J Agic Biol. 12:833-839.
Bormann C, Baier D, Ho I, Raps C, Berger J, Jung G, Schwarz H. 1999. Characterization of a novel, antifungal, chitin-binding protein from
streptomyces tendae Tu¨901 that interferes with gowth polarity. J Bacteriol. 181(24):7421-7429.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgam quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (2):248-254.
Cooper RM, Flood J, Rees RW. 2011. Ganoderma boninense in oil palm
plantations: current thinking on epidemiology, resistance and pathology.
Planter. 87 (1024):515-526.
Cowen LE. 2008. The evolution of fungal drug resistance: Modulating the trajectory from genotype to phenotype. Nat Rev Microbiol. 6:187-198.
25 Deacon JW. 1997. Modern Mycology. Ed Ke-3. Cambridge (GB): Blackwell
Science.
De la Vega LM, Barboza-Corona JE, Aguilar-Uscanga MG, Ramirez-lepe M. 2006. Purification and characterization of an exochitinase from Bacillus thuringiensis subsp. aizawai and its action against phytopathogenic fungi. Can J Microbiol. 52(7):651-657.
Fadhil L, Kadim A, Mahdi A. 2014. Production of chitinase by Serratia marcescens from soil and its antifungal activity. J Nat Sci Res. 4:80-86.
Habchi HL, Darenfed AB, Drouichea N, Pausse A, Mameri N. 2015. Purification, characterization, and molecular cloning of an extracellular chitinase from
Bacillus licheniformis stain LHH100 isolated from wastewater samples in
Algeria. Inter. J Biol Macromol. 72:1117–1128.
Hamid R, Khan MA, Ahmad M, Ahmad MM, Abdin MZ, Musarrat J, Javed S. 2013. Chitinases: An update. J Pharm Bioallied Sci. 5(1):21-29.
Harman GE. dan Tronsmo A. 1993. Detection and quantification of n-acetyl- β -d-glucosaminidase, chitobiosidase, and endochitinase in solutions and on gels.
Anal Biochem. 208:53-57.
Haryanto A. 2013. Isolation of chitinolytic bacteria used as biological control of suspected pathogenic fungi on oil palm seedlings [under tesis]. Bogor (ID): Institut Pertanian Bogor.
Hirano S, Nakahira T, Nakagawa M, Kim SK. 1999. The preparation and applications of functional fibers from crab shell chitin. J Biotechnol. 70:
373-380.
Huang CJ, Wang TK, Chung SC, Chen CY. 2005. Identification of an antifungal chitinase from a potential biocontrol agenst, Bacillus cereus 28-9. J Biochem Mol Biol. 38(1):82-88.
Hu HQ, Li S, He H. 2010. Characterization of an antimicrobial material from a newly isolated Bacillus amyloliquefaciens from mangove for biocontrol of Capsicum bacterial wilt. Biol Control. 54:359-365.
Idris AS, Arifurrahman R, Kushairi A. 2010. Hexacolane as a preventive treatment for managing Ganoderma in oil palm. MPOB Inform. ISSN
1511-7871. MPOB TT.No. 75.
Jaiganesh V, Eswaran A, Balabaskar P, Kannan C. 2007. Antagonistic activity of
Serratia marcescens against Pyricularia oryzae. Hort Agobot. 35(2):48-54.
Jankiewicz U, Maria SB. 2014. Purification, characterization, and gene cloning of a chitinase from Stenotrophomonas maltophilia N4. J Basic Microbiol. 54:
1-9.
Jeong H, Jeong DE, Kim SH, Song GC, Park SY, Ryu CM, Park SH, Choi SK. 2012. Draft genome sequence of the plant gowth-promoting bacterium
Bacillus siamensis KCTC 13613. J Bacteriol 194:4148-4149.
Ilyina A, León-Joublanc E, Balvantín-García C, Montañez-Sáenz JC, Rodríguez-Garza, Segura-Ceniceros MREP, Martínez-Hernández JL. 2013. Free and encapsulated chitinase and laminarinase as biological agents against
Fusarium oxysporum. Afr J Microbiol. 7:4501-4511.