KONSTRUKSI VEKTOR BINER DAN TRANSFORMASI GEN
LISOZIM PADA RUMPUT LAUT
Kappaphycus alvarezii
MENGGUNAKAN PERANTARA
Agrobacterium tumefaciens
TRI HANDAYANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Konstruksi Vektor Biner dan Transformasi Gen Lisozim Pada Rumput Laut Kappaphycus alvarezii
Menggunakan PerantaraAgrobacterium tumefaciens adalah benar karya bersama saya dan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2013
Tri Handayani
RINGKASAN
TRI HANDAYANI. Konstruksi Vektor Biner dan Transformasi GenLisozimpada Rumput Laut Kappaphycus alvarezii Menggunakan Perantara Agrobacerium tumefaciens. Dibimbing oleh ALIMUDDIN dan UTUT WIDYASTUTI.
Penyakitice-icemerupakan salah satu permasalahan besar dalam budidaya rumput laut Kappaphycus alvarezii. Penyakit ini diduga disebabkan oleh infeksi bakteri dan diinduksi oleh perubahan kualitas air secara drastis. Infeksi ice-ice
dapat menyebar luas, menyebabkan kerusakan talus hingga mencapai 60-80% dan menyebabkan penurunan produksi. Lisozim memiliki aktivitas bakterisidal yang mampu menghidrolisa ikatan -1,4-glikosida dari peptidoglikan yaitu antara asam N-asetil glukosamin dan asam N-asetil muramat yang merupakan penyusun dinding sel bakteri Gram positif dan beberapa bakteri Gram negatif.Lisozimayam telah dilaporkan memiliki aktivitas litik terhadap Micrococcus lysodeikticus, Flavobacterium columnare, Aeromonas hydrophilla dan Vibrio anguillarum. Penelitian ini bertujuan untuk mengkonstruksi plasmid biner pembawa gen
lisozim ayam dan mentransformasikan pada talus K. alvarezii melalui vektor A. tumefaciens. Konstruksi plasmid biner dilakukan dengan menggunakan pMSH1.
Gen lisozim diamplifikasi dari pJfKer-Lis menggunakan PCR dengan primer spesifik gen lisozimayam. Plasmid pMSH-1 dan gen lisozim produk PCR dipotong dengan enzim NotI dan SpeI. Gen lisozim diligasi ke dalam vektor ekspresi pMSH1 dan selanjutnya ditransformasi ke Escherichia coli DH5 menggunakan kejutan suhu. Plasmid pMSH1-Lis ditransformasi keA. tumefaciens
LBA4404 melalui triparental mating. Sebanyak 225 talus diinokulasikan dengan
A. tumefaciens yang membawa plasmid pMSH1-Lis di bawah kendali promoter 35S CaMV dan terminator Nos. Kokultivasi berlangsung selama 3 hari pada media PES (Prevasoli s Enriched Seawater) yang mengandung 200 mg/L asetosiringon. Talus transforman diseleksi pada media PES yang mengandung 20 mg/L higromisin.
Konstruksi plasmid biner pMSH1 yang mengandung gen lisozim telah berhasil dilakukan dan ditransformasikan ke E. coli DH5 dan A. tumefaciens
LBA4404. Jumlah talus K. alvarezii tahan higromisin sebanyak 53 talus atau 23,56% dari jumlah talus yang diinfeksi. Jumlah talus yang bertunas sebanyak 6 talus dengan efisiensi tunas putatif sebesar 11,32%. Analisis molekuler terhadap talus yang tahan higromisin dengan PCR menggunakan kombinasi primer spesifik gen lisozim, promoter 35S CaMV dan terminator Nos menunjukkan bahwa 3 tunas yang terbentuk dari 3 talus mengandung gen lisozim. Persentase transformasi dalam penelitian ini adalah 23,56%.
Berdasarkan nilai persentase transformasi, maka protokol transformasi masih perlu dimantapkan agar diperoleh transforman dan tunas putatif lebih banyak. Selanjutnya, rumput laut transforman perlu diuji untuk mengevaluasi tingkat toleransinya terhadap infeksi bakteri dan stres lingkungan.
Kata kunci: Kappaphycus alvarezii, lisozim, Agrobacterium tumefaciens,
SUMMARY
TRI HANDAYANI. Binary Vector Construction and Transformation of Lysozyme Gene in Seaweed Kappaphycus alvarezii Using Agrobacterium tumefaciens-mediated Transfer. Supervised by ALIMUDDIN and UTUT WIDYASTUTI.
Ice-ice disease is the biggest problem in the cultivation of seaweed
Kappaphycus alvarezii. The disease is caused by bacterial infection and induced by drastic changes of water quality. Lysozyme has the ability to break down bacterial cell wall. Lysozymes are well-characterized hydrolases, which cleave beta-1,4 linkages of N-acetylglucosamine (GlcNAc) homopolymers and beta-1,4 linkages of the bacterial cell wall component GlcNAc-N-acetylmuramic acid peptidoglycan. Chicken lysozyme had lytic activities against Micrococcus lysodeikticus, Flavobacterium columnare, Aeromonas hydrophilla and Vibrio anguillarum. The purpose of this research was to construct of a binary vector pMSH1-Lis carrying chickenlysozyme(Lis) gene and introduce pMSH1-Lis onK. alvarezii.
Lysozyme gene was amplified from pJfKer-Lis using PCR with specific primers for chicken lysozyme gene. Plasmid pMSH-1 and PCR product of lysozyme gene was cut with enzymes NotI and SpeI. Lysozyme gene was ligated into the expression vector pMSH1 to design a binary expression vector of pMSH1-Lis. The pMSH1-Lis was transformed toEscherichia coliDH5 by heat shock, cultured and then the plasmid was isolated. The binary vector expression was transformed into Agrobacterium tumefaciens LBA4404 by tri-parental mating. Thallus was inoculated withA. tumefacienscarrying pMSH1-Lis and then the transformed thallus was selected by adding 20 mg/L hygromycin to the culture medium.
PCR analysis showed that the construction of the binary plasmid pMSH1-Lis was established. Percentage of transformation of pMSH1-pMSH1-Lis on K. alvarezii
was 23.56%, while the efficiency of putative bud was 11.32%. PCR analysis showed that three of the regenerated thallus contained lysozyme gene. Thus, transgenic K. alvarezii was produced successfully and this can be useful for studying the mechanisms of seaweed defense against bacterial infection.
Based on the percentage of the transformation, the transformation protocols need to be established for increasing transformants and regenaration thallus. Test bacterial resistance and environmental stress is necessary to examine the transformants tolerance.
©Hak cipta milik IPB, tahun 2013
Hak cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
KONSTRUKSI VEKTOR BINER DAN TRANSFORMASI GEN
LISOZIM PADA RUMPUT LAUT
Kappaphycus alvarezii
MENGGUNAKAN PERANTARA
Agrobacterium tumefaciens
TRI HANDAYANI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Konstruksi Vektor Biner dan Transformasi Gen Lisozim pada Rumput Laut Kappaphycus alvarezii Menggunakan Perantara
Agrobacterium tumefaciens
Nama : Tri Handayani
NIM : C151100281
Disetujui oleh
Komisi Pembimbing
Dr Alimuddin, SPi MSc Ketua
Dr Ir Utut Widyastuti, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Prof Dr Ir Enang Harris, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat dan karunia-Nya, sehingga karya ilmiah ini dapat diselesaikan. Penelitian yang berjudul Konstruksi Vektor Biner dan Transformasi Gen Lisozim pada Rumput Laut Kappaphycus alvarezii Menggunakan Perantara Agrobacerium tumefaciens ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian ini dibiayai oleh proyek kerjasama Balai Riset Perikanan Budidaya Air Payau, Maros dengan Pusat Penelitian Sumberdaya Hayati dan Bioteknologi dan Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor, a.n. Dr. Ir. Utut Widyastuti, M.Si.
Penulis mengucapkan terima kasih kepada Dr. Alimuddin, S.Pi, M.Sc dan Dr. Ir. Utut Widyastuti, MSi. selaku pembimbing atas kesabarannya dalam memberikan saran, bimbingan, dukungan serta kesempatan dalam pelaksanaan penelitian dan penyempurnaan penyusunan karya ilmiah ini. Penulis mengucapkan terima kasih kepada Dr. Sri Nuryati, S.Pi, M.Si selaku penguji luar komisi atas saran dan masukan yang diberikan. Terima kasih juga penulis sampaikan kepada Prof. Dr. Ir. Enang Harris, MS. sebagai Ketua Program Studi/ Mayor Ilmu Akuakultur Pascasarjana IPB.
Terima kasih yang sebesar-besarnya penulis sampaikan kepada Kementerian Riset dan Teknologi Republik Indonesia yang telah memberikan beasiswa bagi penulis untuk menempuh program Pascasarjana (S2) bagi Peneliti. Penulis juga berterima kasih kepada rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik Departemen Budidaya Perairan FPIK, di Laboratorium Biorin PPSHB serta teman-teman AKU 2010 yang tidak dapat saya sebutkan satu per satu, penulis mengucapkan banyak terimakasih atas bantuan dan kebersamaannya.
Ucapan terima kasih juga saya sampaikan kepada suami Samino dan ananda Kamilia Salsabila atas dukungan, kekuatan, kesabaran, pengorbanan, dan ketulusannya dalam memberi motivasi dan semangat. Kepada Ibu dan Bapak yang senantiasa memberi inspirasi, semangat, dukungan dan do a untuk penulis dalam menyelesaikan tugas belajar di Pascasarjana IPB.
Sebagian dari tesis ini sudah ditulis dalam bentuk artikel dan dikirimkan ke BIOTROPIA dengan judul Binary Vector Construction and Transformation of Lysozyme Gene in Seaweed Kappaphycus alvarezii Using Agrobacterium tumefaciens-mediated Transfer .
Semoga hasil penelitian ini bermanfaat, terutama dapat memberikan informasi untuk kepentingan dan perkembangan ilmu pengetahuan dan kesejahteraan manusia terutama masyarakat Indonesia.
Bogor, Mei 2013
DAFTAR ISI
Transformasi pMSH1-Lis keA. tumefaciensdan Analisis PCR Transformasi pMSH1-Lis pada TalusKappaphycus alvarezii. Identifikasi Talus Transforman dengan Metode PCR
13
Transformasi pMSH1-LisozimkeAgrobacterium tumifaciens
Transformasi GenLisozimpada TalusKappaphycus alvarezii
DAFTAR GAMBAR
Halaman
1 Siklus hidup rumput lautKappaphycus alvarezii
2 Proses transformasi genetik menggunakan perantara
Agrobacterium tumifaciens
3 Peta daerah T-DNA plasmid pMSH1 (NAIST, Japan) 4 Peta plasmid pJfKer-Lis
5 Pola pemotongan plasmid pMSH1-Lis menggunakan enzim NotI dan SpeI dan identifikasi Escherichia coli DH5 transforman pembawa genlisozim
6 Triparental mating(TPM)
7 Identifikasi transforman Agrobacterium tumefaciens hasil tri-parental mating(TPM)
8 Tahapan transformasi genetik rumput lautKappaphycus alvarezii
9 Tahapan perkembangan talusKappaphycus alvarezii.
10 Hasil analisis PCR DNA rumput laut hasil transformasi dengan genLisozim
5 11
13 13
17 18
DAFTAR LAMPIRAN
Halaman
1 Kompisisi media PES (Prevasoli s Enriched Seawater) stok 2 Komposisi media Lurria Bertani (LB) Agar
3 Komposisi larutan 1, 2, dan 3 untuk isolasi plasmid 4 Komposisi bufer 1x TAE
5 Komposisi bufer ekstraksi CTAB
1
1 PENDAHULUAN
Latar Belakang
us v merupakan salah satu jenis rumput laut merah
(Rhodophyta) yang banyak dibudidayakan di Indonesia. Sentra produksinya mulai dari Bali, Lombok, Sumbawa, Sumba, Flores, Kupang, Maluku, Sulawesi Selatan, Sulawesi Tenggara, Sulawesi Tengah, Sulawesi Utara, Aceh, Riau, Lampung, Bangka-Belitung, Banten, Kepulauan Seribu, Karimun Jawa, Banyuwangi, dan Madura (Sulistijo 1998). Rumput laut ini merupakan sumber kappa-karaginan yang dimanfaatkan dalam berbagai industri, antara lain: makanan, tekstil, kosmetik, farmasi, dan fotografi (Yu t . 2002). Kappa-karaginan banyak
dimanfaatkan sebagai stabilisator, bahan pengental, pembentuk gel dan pengemulsi (Bixler 1996). Permintaan pasar terhadap v sekitar delapan
kali lebih banyak dari jenis lainnya (Sulistijo 2002).
Upaya peningkatan produksi dilakukan dengan memperluas penanaman rumput laut pada daerah pantai yang cocok untuk budidaya dan dengan divertifikasi teknologi budidaya. Namun demikian, serangan penyakit
merupakan kendala paling merugikan karena sulit ditanggulangi dan waktu penyebarannya relatif cepat. Infeksi dapat menyebar luas hanya dalam
waktu sekitar satu minggu, dan dapat menyebabkan kerusakan talus hingga mencapai 60-80% dalam waktu 1-2 bulan (Sulistijo 2002). Penyakit juga
menyebabkan penurunan kandungan karaginan (Amiluddin 2007). Fenomena demikian sangat merugikan bagi pembudidaya, bahkan dapat menyebabkan kebangkrutan dalam usaha budidaya rumput laut (Yulianto dan Mira 2009).
Bakteri yang diduga sebagai agen penyakit adalah
us us , dan
quefaciens. Hasil uji patogenitas terhadap kelima bakteri tersebut menunjukkan bahwa patogenitas tertinggi dimiliki oleh V. agarliquefaciens (Nasution 2005). Selain itu, Largo (2002) juga menemukan bakteri Vibrio pada talus yang terserangice-ice. Aris (2011) melaporkan lima jenis bakteri pada talus K. alvarezii yang terserang ice-ice, yaitu Flavobacterium meningosepticum, V. alginoliticus, Pseudomonas cepacia, P. diminuta, dan Plesiomonas shigelloides. Sementara itu, Nurjana (2008) mengidentifikasi bakteri pada rumput laut yang terserang ice-ice, yaitu Chromobacterium, Acinetobacter, Flavocytofaga dan Vibrio.
2
us v! "# $ $ (Rajamuddin 2010), %&! !y" # &"'( $s (Takahashi "t .
2010), danGracilaria gracilis(Huddyet al. 2012).
Metode yang umum digunakan dalam produksi tanaman transgenik adalah dengan bantuan Agrobacterium tumefaciens. Penggunaan A. tumefaciens dalam transformasi pada rumput laut telah berhasil dilakukan pada Porphyra yezoensis (Cheney et al. 2001). Namun demikian, hingga saat ini penggunaan A. tumefaciens dalam transformasi gen pada K. alvarezii belum ada yang melaporkan. Transformasi menggunakan A. tumefaciens memiliki beberapa keuntungan antara lain adalah biaya relatif lebih murah, jumlah salinan gen sedikit dan teknik pengulangan percobaan memberikan hasil serupa (reproducible) (Hiei et al. 1997). Agrobacterium tumefaciens mengandung vektor ekspresi biner. Vektor pertama merupakan bagian virulen dari A. tumefaciens, tetapi tanpa T-DNA, dan vektor kedua yang berukuran lebih kecil mengandung T-DNA dan gen yang akan disisipkan (Loeidin 1998).
Gen yang sudah banyak diteliti dalam usaha mengatasi infeksi bakteri pada organisme budidaya adalah gen lisozim. Lisozim dipergunakan untuk membuat transgenik ikan tahan infeksi bakteri, seperti ikan zebra (Yazawa et al. 2006), udang (Litopenaeus vannamei) (Burge et al. 2007) dan ikan salmon (Salmo salar L.) (Fletcher et al. 2011). Lisozim memiliki aktivitas bakterisidal yang mampu menghidrolisis ikatan -1,4-glikosida dari peptidoglikan yaitu antara asam N-asetil glukosamin dan asam N-N-asetil muramat yang merupakan penyusun dinding sel bakteri Gram positif (Liet al. 2008). Namun demikian, lisozim juga memiliki aktivitas litik pada beberapa bakteri Gram negatif.
Lisozim ayam telah dilaporkan memiliki aktivitas litik terhadap Micrococcus lysodeikticus, Flavobacterium columnare, Aeromonas hydrophilla danVibrio anguillarum(Yazawaet al. 2006). Lisozimmampu membunuh bakteri Gram negatif, yang ditemukan pada bivalvia dan udang (Liet al. 2008). Aktivitas litik darilisozimpada F2 ikan salmon transgenik adalah 40% lebih besar daripada ikan salmon bukan transgenik (Fletcher et al. 2011). Transgenik ikan zebra yang mengekspresikan lisozim ayam menunjukkan bahwa F2 ikan transgenik 65% tahan infeksi F. columnare dan 60% tahan terhadap infeksi Edwardsiella tarda, sedangkan 100% ikan zebra kontrol tidak tahan terhadap infeksi bakteri tersebut (Yazawaet al. 2006).
Kemampuan lisozim ayam dalam merusak dinding sel bakteri Gram positif dan beberapa bakteri Gram negatif ini merupakan potensi yang dapat dimanfaatkan dalam upaya meningkatkan resistensi rumput laut terhadap bakteri patogen, terutama infeksi bakteri yang diduga sebagai penyebab penyakitice-ice.
Tujuan Penelitian
Tujuan penelitian ini adalah:
1. Mengkonstruksi plasmid rekombinan pembawa gen lisozim untuk transformasi melaluiAgrobacterium tumefaciens
3
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai efektivitas
)*+,-./t0 +123 t230 4./1056 dalam transformasi dan integrasi gen 7 16, 8 13.
Selanjutnya rumput laut 9. ::. :;</us .7v. +0 8 11 yang dihasilkan dapat menjadi
4
2 TINJAUAN PUSTAKA
Rumput Laut=>??>?@yAuB> Cv> DEF G G
HIJJIJKLMus INvIO PQ R R merupakan salah satu jenis rumput laut merah
(Rhodophyta) yang banyak dibudidayakan. Rumput laut jenis ini dikenal juga dengan namaSTM KP TUIM VW VX RR(AtmadjaPt IN. 1996; Lewmanomont dan Ogawa
1995; Trono dan Ganzonfortes 1988; Wei dan Chin 1983) dan nama dagangnya adalah M VWVX R R. Berdasarkan pada karakter biokimia, dimana kandungan kappa
karaginan yang lebih dominan dari pada iota dan beta karaginan yang ditemukan oleh seorang ahli dari Filipina bernama alvares, maka nama ilmiah dariSYM VWtVX RR
berubah menjadi HIJJIJKLMus INIO P Q RRv (Atmadja Pt IN. 1996; SilvaPtIN. 1996).
AtmadjaPtIN. (1996) mengklasifikasikan rumput laut ini sebagai berikut:
Kingdom : Thalophyta
HIJJIJKLMus INvIOP Q RR memiliki talus silindris, permukaan licin, berduri
tidak teratur dan melingkari talus, duri-duri talus runcing dan agak memanjang (Doty 1973). Talus bersifatM IOWRN IZPX VT[, warna hijau, hijau kekuningan, abu-abu
atau merah. Penampakan talus bervariasi mulai dari bentuk sederhana sampai kompleks. Duri-duri pada talus terdapat juga sama seperti halnya dengan SY
\PX WRMTNIWTUtetapi tidak bersusun melingkari talus. Percabangan ke berbagai arah
dengan batang-batang utama keluar saling berdekatan di daerah basal. Tumbuh melekat ke substrat dengan alat pelekat berupa cakram. Cabang-cabang pertama dan kedua tumbuh membentuk rumpun yang rimbun dengan ciri khusus mengarah ke datangnya sinar matahari. Cabang-cabang tersebut tampak ada yang memanjang atau melengkung seperti tanduk (AtmadjaPtIN. 1996).
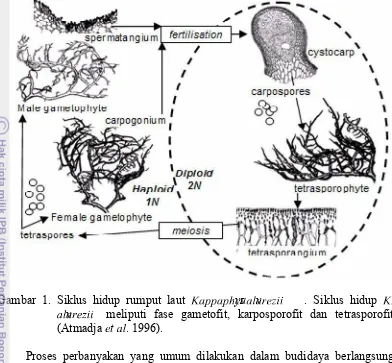
Perkembangbiakan HY INvIO PQ R R secara alami melalui proses pergantian
5
Gambar 1. Siklus hidup rumput laut ]^__^_`yaus ^bv^cde f f . Siklus hidup ]g ^bv^c d ef f meliputi fase gametofit, karposporofit dan tetrasporofit
(Atmadjadt^b. 1996).
Proses perbanyakan yang umum dilakukan dalam budidaya berlangsung tanpa melalui perkawinan. Setiap bagian rumput laut yang dipotong akan tumbuh menjadi rumput laut muda yang mempunyai sifat seperti induknya. Perkembangan dengan vegetatif lebih umum dilakukan dengan cara stek dari cabang-cabang talus yang muda, masih segar, warna cerah, dan memiliki percabangan yang rimbun serta terbebas dari penyakit (Parenrengi dan Sulaeman 2007).
Metabolit primer berupa senyawa hidrokoloid yang dihasilkan oleh ]g
^bv^c d ef f disebut karaginan (a ^c c ^hd d i^i) sehingga disebut pula rumput laut a ^cc^hdd ij _`ktd (karaginofit). Didasarkan pada stereotipe struktur molekul dan
posisi ion sulfatnya, karaginan dibedakan menjadi tiga macam yaitu: iota-karaginan, kappa-karaginan dan lambda-iota-karaginan, ketiganya berbeda dalam sifat gel dan reaksinya terhadap protein (Rajamuddin 2010). Karaginan yang terdapat pada ]g ^bv^cde f f termasuk dalam kelompok kappa-karaginan (Spagnoulo dt ^b .
2005).
Terdapat tiga strain pada ] g ^bv^cd e ff berdasarkan warnanya, yaitu strain
hijau, merah dan coklat. Masing-masing strain memiliki kandungan karaginan yang berbeda. Kandungan karaginan tertinggi ditemukan pada strain hijau (40,7±3,6%), selanjutnya strain coklat (37,5 ± 1,1 %), dan terendah pada strain merah (32,7 ± 3,9%) (Munoz dt ^b. 2004). Selain sebagai penghasil karaginan,
6
GenLisozim
l mn op mq termasuk kelompok ubiquitous dan merupakan enzim antibakteri
yang menghidrolisis ikatan -1,4 glikosida dari peptidoglikan penyusun dinding sel bakteri Gram positif (Li rt st. 2008). l m n op mq merupakan enzim yang
terdistribusi secara luas, ditemukan pada serum, mukus dan beberapa jaringan vertebrata tingkat tinggi (Yazawa rt st. 2006). Beberapa studi menunjukkan
bahwa t mnopm q juga mampu membunuh bakteri Gram negatif, yang ditemukan
pada bivalvia dan udang. Aktivitas anti protozoa dan anti fungi dari t mn op mq
disebabkan karena pemecahan N-asetil glukosamin pada khitin. l m p on m q mampu
membunuh bakteri dengan aktivitas enzimatis. Sehingga,t mnopm q disebut sebagai
komponen penting dalam pertahanan imun terhadap serangan infeksi mikrobia (Li
rtst. 2008).
Terdapat beberapa tipe t m n op m qyang telah berhasil dimurnikan, di antaranya
adalahuv mu wrx ytyzr(c -type), goose-type (g-type)daninvertebrate-type (i-type)(Li et al. 2008). Thammasiriraket al. (2006) mengklasifikasikanlisozimmenjadi tiga, yaituchicken-type (c-type), goose-type (g-type)danT4-type. Hikimaet al. (2003) membagilisozim menjadi 6 tipe, yaitu chicken-type (c-type), goose-type (g-type), invertebrate-type (i-type), plant, bacterial, T4 phage lysozyme (phage-type). Lisozim tipe c (chicken lysozyme) merupakan tipe lisozim yang paling banyak digunakan pada biota budidaya (Li et al. 2008). Lisozim tipe c disintesis oleh saluran telur ayam (Nguyen-Huuet al. 1979).
Aktivitas litik darilisozimpada F2 ikan salmon transgenik adalah 40% lebih besar daripada ikan salmon bukan transgenik (Fletcher et al. 2011). Aktivitas lisozim pada ikan zebra transgenik menunjukkan bahwa 65% generasi F2 ikan zebra transgenik tahan terhadap infeksiFlavobacterium columnaredan 60% tahan terhadap infeksi Edwardseilla tarda, sedangkan ikan zebra kontrol (non-transgenik) 100% tidak tahan terhadap infeksi bakteri tersebut (Yazawa et al. 2006). Aktivitas gen lisozim dalam merusak dinding sel bakteri bervariasi pada spesies yang berbeda dan variasi aktivitas setiap spesies kemungkinan berpengaruh terhadap ketahanan inang (Yazawa et al. 2006). Lisozim merupakan enzim antimikrobia yang diduga berperan penting pada imunitas ikan (Fletcher et al. 2011).
Lisozim yang diisolasi dari telur ayam (hen egg white lysozyme) menunjukkan aktivitas litik yang kuat terhadap E. tarda dan Streptococcus sp. Aktivitas lisozim pada ikan flounder sangat lemah pada E. tarda dan Streptococcus sp. Hasil ini menunjukkan bahwa aktivitas bakterial dari lisozim sangat bervariasi pada spesies yang berbeda. Variasi tersebut diduga dipengaruhi oleh hubungan antara inang dan patogen dalam pertahanan bawaan pada inang (Yazawa et al. 2006). Lisozim merupakan enzim antimikrobia yang diyakini memainkan peran penting dalam imunitas bawaan (innate immunity) (Fletcher et al. 2011).
Transgenesis
7
dan menggabungkannya ke genom inang. Teknik ini digunakan untuk mengintroduksi karakter-karakter genetik yang baru atau over-ekspresi ke suatu individu dan diharapkan dapat diwariskan ke keturunannya.
Analisis organisme transgenik dapat dilakukan dengan beberapa cara antara lain, visual, histokimia dan molekuler. Pengamatan secara visual antara lain dilakukan jika T-DNA yang terintegrasi memiliki gen pelopor seperti GFP ({| }}~
|}~}~ } p| } ~). Dengan menggunakan gen pelopor, pengamatan dapat
dilakukan tanpa merusak jaringan atau sel. Sedangkan analisis molekuler dapat dilakukan dengan menggunakan teknik PCR ( y }| } ~ r } t ~).
Keuntungan analisis dengan PCR antara lain: cepat, DNA yang diperlukan sedikit, dapat dilakukan pada tahap dini dan teknik isolasi DNA sederhana (Ananda 2004; Wulandari 2005). Teknik PCR ini dapat digunakan untuk mengetahui integrasi dan ekspresi gen sisipan pada organisme hasil transformasi.
Integrasi gen sisipan pada organisme hasil transformasi dapat dilakukan dengan teknik isolasi DNA (Ananda 2004; Wulandari 2005). Analisis ekspresi gen sisipan dapat dilakukan dengan isolasi RNA dan dilanjutkan dengan sintesis cDNA (Lubis 2008). Gen yang disisipkan ke dalam genom tanaman harus dapat diekspresikan sehingga menghasilkan protein yang diinginkan serta harus stabil diwariskan ke generasi berikutnya. Gen-gen yang diekspresikan pada tanaman pada awalnya adalah gen-gen asli dari sumbernya: bakteri, jamur, hewan, tetapi kebanyakan ekspresi dari gen tersebut di dalam tanaman sangat rendah. Penambahan }~ ~ }r dikombinasikan dengan penggunaan promoter kuat atau
promoter spesifik dapat meningkatkan ekspresi gen pada tanaman (Rajamuddin 2010).
Salah satu penentu keberhasilan transgenesis adalah kemampuan promoter yang digunakan untuk mengendalikan ekspresi gen yang diintroduksikan. Promoter yang umum digunakan dalam produksi rumput laut transgenik adalah promoter 35S CaMV ( }r vrus ), seperti pada Gracilaria gracilis
(Huddy et al. 2012), Kappaphycus alvarezii (Rajamuddin 2010), Laminaria japonica(Qinet al. 2005) danPorphyra yezoensis (Takahashiet al. 2010).
Konstruksi DNA Rekombinan
Teknologi DNA rekombinan (rekayasa genetika) pada prinsipnya adalah proses kloning gen. Kloning gen memungkinkan sejumlah gen dari sumber berbeda disatukan dan membentuk DNA rekombinan. Kegiatan ini meliputi beberapa tahap, yaitu penyisipan fragmen DNA yang mengandung gen target ke dalam molekul DNA vektor (pembentukan DNA rekombinan), vektor rekombinan dimasukkan ke dalam sel inang, perbanyakan DNA rekombinan di dalam sel inang melalui pembelahan sel inang. Pembelahan sel inang ini berlangsung terus menerus sehingga akan membentuk koloni yang masing-masing sel penyusunnya membawa DNA rekombinan (Brown 1996).
8
terhadap kedua jenis kultur. Prinsip isolasi ialah melakukan lisis sel dan memisahkan bagian plasmid dari RNA dan protein (Mullis 1990).
Langkah kedua ialah memotong kedua plasmid dengan enzim restriksi yang sama. Penggunaan enzim restriksi yang sama bertujuan untuk memudahkan ligasi DNA vektor dengan DNA sisipan melalui proses ligasi. Enzim yang mampu memotong utas DNA secara tepat dan konsisten digolongkan ke dalam tipe II endonuklease restriksi. Enzim ini mendegradasi DNA dengan memecah ikatan fosfodiester yang menghubungkan satu nukleotida dengan nukleotida lainnya pada untaian DNA. Hasil pemotongan DNA dengan menggunakan enzim ini ada dua yaitu ujung tumpul ( ) dan ujung lekat (st y ). Ujung tumpul
terjadi karena enzim membuat potongan untai ganda sederhana pada pertengahan urutan pengenal. Ujung lekat terjadi karena enzim restriksi menghasilkan potongan berbentuk zig-zag atau dengan belok tajam melampaui dua atau empat nukleotida. Fragmen DNA yang dihasilkan mempunyai tonjolan untai tunggal pendek pada tiap ujung (Brown 1996).
Langkah ketiga ialah rekombinasi DNA yaitu menggabungkan DNA vektor dengan DNA sisipan melalui proses ligasi menggunakan enzim T4 DNA ligase. Proses ligasi ini dipengaruhi oleh suhu, kemurnian dan konsentrasi DNA. Hasil ligasi berupa vektor yang telah membawa gen sisipan. Ligasi utas DNA berujung lekat jauh lebih efisien dibandingkan ligasi ujung tumpul. Hal ini disebabkan karena pada kedua ujung lekat terdapat pasangan basa yang sesuai. Kedua ujung dapat menyatu melalui ikatan hidrogen sehingga membentuk struktur yang lebih stabil. Pada DNA ujung tumpul enzim ligasi tidak mudah menyatukan keduanya. Untuk mendapatkan kemungkinan terjadinya penyambungan, jumlah DNA yang diligasi perlu diperbanyak (Brown 1996).
Langkah keempat ialah transformasi (memasukkan) DNA rekombinan ke dalam inang. Tujuan transformasi ini ialah untuk memperbanyak DNA plasmid rekombinan. Sel inang yang umum digunakan adalah . Alasan
penggunaan antara lain proses pembelahan selnya sangat cepat (setiap 22
menit) sehingga pada waktu kurang dari 11 jam akan dihasilkan milyaran sel bakteri, dan pada setiap sel dapat menghasilkan puluhan hingga ratusan copy DNA plasmid rekombinan (Mullis 1990).
Langkah kelima adalah seleksi terhadap sel inang hasil transformasi pada
. Seleksi ini berdasarkan pada keberadaan gen-gen penyeleksi dalam plasmid
(Mullis 1990). Gen penyeleksi pada plasmid pMSH1 ialah npt II ( y II) adalah gen marka seleksi terhadap antibiotik kanamisin
dan hpt (y y p ) adalah gen marka seleksi terhadap
antibiotik higromisin (Hannum 2013).
9
seleksi terhadap antibiotik dan herbisida, integrasi gen sisipan pada tanaman hasil transformasi dapat dianalisis secara molekuler menggunakan teknik PCR. Keuntungan analisis dengan PCR antara lain: cepat, DNA yang diperlukan sedikit, dapat dilakukan pada tahap dini dan teknik isolasi sederhana (Brown 1996).
Tansfer dengan sistem ¡¢£ ¤¥¦§t¨£ © ª« ini biasanya menggunakan vektor
ganda (¥© ¬¦£ ®v¨§t¤£ ). Sistem ini menggunakan 2 plasmid yaitu plasmid pertama
mengandung bagian virulen dari plasmid Ti dari ¡¢£ ¤¥¦§t¨£ © ª« tetapi tanpa
T-DNA dan plasmid kedua yang lebih kecil mengandung T-T-DNA dan gen yang disisipkan. Alasan penggunaan vektor ganda adalah sulitnya menemukan sisi pemotongan yang unik dengan enzim restriksi pada plasmid Ti yang berukuran sangat besar (Loedin 1994).
Transformasi Gen MelaluiAgrobacterium tumefaciens
¡¢£¤¥¦§t¨£ © ª« adalah bakteri Gram negatif yang hidup bebas dalam tanah.
Bakteri ini hidup optimum pada suhu 28-30oC, bakteri ini tidak dapat membentuk spora (endospora) (Buchanan dan Gibbons 1974), dan dapat menimbulkan penyakit pada tumbuhan yang terinfeksi. Dalam budidaya pertanian, penyakit ini tergolong penting dan sebagian besar terjadi pada tanaman dikotil (Draper ¨t ¦¯.
1993). Menurut Miller dan Bassler (2001) terdapat dua spesies ¡¢£ ¤¥ ¦§t¨£ © ª«
yang bersifat patogen yaitu ¡° tª«¨± ¦§©¨ ¬² sebagai penyebab penyakit tumor
(§£¤³¬ ¢ ¦¯¯) dan ¡° £ ´©µ ¤¢¨ ¬¨s sebagai penyebab penyakit akar rambut (´¦©ry £¤¤¶) pada berbagai tanaman dikotil yang peka. Escobar dan Dandekar (2003)
menyebutkan ada beberapa spesies ¡¢£¤¥¦§t¨£©ª« yang menyebabkan penyakit
pada tanaman, antara lain: ¡° tu«¨± ¦§© ¨¬² (§£¤³¬ ¢ ¦¯¯ ·© ²¨ ¦²¨), ¡ ° £ ´© µ¤¢¨ ¬¨s
(´¦©ry £ ¤¤¶·© ²¨ ¦²¨ ),¡°£ª¥©(§¦¬¨¢ ¦¯¯·© ²¨ ¦²¨) dan¡°¸©t©s (§£ ¤³¬¢ ¦¯ ¯¤±¢£ ¦¹¨).
Sistem transformasi yang paling umum digunakan pada tanaman adalah transformasi menggunakan ¡° tª«¨± ¦§©¨ ¬². Bakteri ini merupakan bakteri tanah
yang bersifat patogen dan dapat melakukan transformasi genetik ke sel inangnya, hingga menyebabkan tumor (§£¤³¬ ¢ ¦¯¯). Selama ini interaksi antara
¡¢£¤¥¦§t¨£©ª« dengan sel tanaman yang diketahui merupakan suatu fenomena
alami transpor T-DNA dari ¡¢£¤¥¦§t¨£ © ª« tipe liar ke dalam inti sel tanaman
(Songstad ¨t ¦¯ ° 1995). Ketika ¡¢£ ¤¥¦§t¨£ © ª« menginfeksi tanaman, bagian dari
molekul DNAnya yang disebut T-DNA terintegrasi pada DNA kromosom tanaman (Loedin 1994).
Transformasi menggunakan ¡¢£ ¤¥¦§t¨£ © ª« memiliki beberapa keuntungan
antara lain relatif lebih murah, jumlah salinan gen sedikit dan teknik pengulangan percobaan memberikan hasil serupa (r¨¹£¤· ª§© ¥¯ ¨ ) (Hiei ¨t ¦¯. 1997). Terdapat
tiga komponen utama pada ¡¢£¤¥¦§t¨£ © ª« yang berperan dalam transfer DNA ke
dalam sel tanaman (Sheng dan Citovsky 1996). Ketiga komponen tersebut adalah T-DNA, v©£ª¯¨ ¬§¨ (Vir: A, B, C, D, E, G,H) dan gen §´£ ¤«¤² ¤«¦¯ v© £ ª¯ ¨ ¬§¨
(chv), yang terdiri atas chvA, chvB, pscA dan att (Broek dan Vanderleyden 1995, Tzfira dan Citovsky 2003).
Kemampuan bakteri mentransformasi sel tanaman berhubungan dengan adanya plasmid penginduksi tumor (Ti) atau penginduksi akar (Ri) dalam
10
dimana sel tanaman yang luka menghasilkan suatu metabolit yang berperan sebagai isyarat bagi º» ¼ ½¾¿ÀtÁ¼  ÃÄ . Metabolit tersebut dapat berupa senyawa
gula, asam, asam amino atau senyawa fenol (Winans 1992). Adanya senyawa tersebut menginduksi º» ¼½¾¿ÀtÁ¼ÂÃÄ untuk bergerak aktif menuju ke sel sasaran.
Gerakan yang bersifat kemotaksis ini dipandu oleh senyawa yang disekresikan oleh sel tanaman rentan yang luka. Interaksi dilanjutkan dengan adanya kontak antara º»¼½¾¿ÀtÁ¼ÂÃÄ dengan sel tanaman sasaran. Untuk memperkuat kontak
tersebut º»¼½¾¿ÀtÁ¼  ÃÄ mengeluarkan suatu metabolit yaitu -1-2-glukan.
Beberapa gen dalam kromosom º»¼½¾¿ÀtÁr ÃÄ diketahui merupakan penyandi
enzim yang berperan dalam sintesis berbagai senyawa glukan, yaitu chvA, chvB, dan exoC. Gen lain pada kromosom yang berperan seperti ketiga gen tersebut adalah À ÁÅ, produk À ÁÅ berperan penting dalam sintesis senyawa selulosa fibril
(DouglasÁt ¿Å . 1985; Gelvin 2000).
Induksi faktor virulensi (vir) yang akan mengatur proses pemotongan dan transfer T-DNA ke sel tanaman. Beberapa metabolit yang disekresi oleh tanaman, akan menginduksi faktor virulensi. Metabolit tersebut adalah asetosiringon, hidroksi asetosiringon, koniferil alkohol dan etil piruvat (Winans 1992). Aktivasi gen vir dimulai dengan penerimaan sinyal oleh VirA. VirA merupakan protein sensor trans-membran yang berfungsi mendeteksi molekul sinyal berupa senyawa fenolik seperti asetosiringon. Selain itu, beberapa jenis monosakarida juga berfungsi sebagai sinyal. Deteksi monosakarida dimungkinkan oleh adanya interaksi dan asosiasi antara protein VirA dengan ChvE yang berfungsi sebagai protein pengikat gula (glukosa/galaktosa) pada periplasma (de la Riva Át ¿Å.
1998). Protein dari VirA ini akan menginduksi VirG melalui fosforilasi, yang selanjutnya VirG akan mengaktifkan ekspresi berbagai Vir lainnya (Winans 1992). Induksi protein-protein Vir dikontrol oleh dua komponen sistem yaitu VirA/G (Rosen & Ron 2011). Proses transformasi genetik menggunakan perantara
º»¼½¾¿ÀtÁ¼ÂÃÄ tÃÄÁÆ¿À ÁÇÈ dijelaskan pada Gambar 2.
Protein yang dihasilkan oleh gen Vir berperan untuk memotong dan mentransfer T-DNA ke inang. Proses perpindahan T-DNA ke sel tanaman diawali dengan pemotongan utas T-DNA dari plasmid Ti. Protein VirD1 dan VirD2 yang memiliki aktivitas endonuklease akan mengenali sekuen batas T-DNA dan memotong utas DNA pada posisi tersebut dan melepaskan utas tunggal T-DNA. Setelah pemotongan, protein VirD2 tetap terikat secara kovalen pada ujung 5 utas T-DNA (batas kanan). Asosiasi VirD2 melindungi T-DNA dari aktivitas eksonuklease pada ujung 5 DNA dan juga berfungsi membedakan ujung 5 T-DNA (batas kanan) sebagai ujung yang akan ditransfer terlebih dahulu ke sel tanaman. Sintesis utas T-DNA dimulai dari batas kanan T-DNA dan berlangsung dalam arah 5 ke 3 . Kompleks utas tunggal T-DNA-VirD2 diselubungi oleh VirE2. Asosiasi protein ini mencegah serangan nuklease dan berfungsi membentangkan utas kompleks T-DNA sehingga bentuknya menjadi lebih ramping dan mudah melintasi kanal membran (de la RivaÁt ¿Å. 1998).
Transpor kompleks T-DNA dan protein Vir lainnya (VirE2 dan VirF), dari bakteri menuju ke sel inang melalui sistem sekresi tipe IV. Sistem sekresi tipe IV adalah kanal penghubung bakteri-inang yang tersusun atas protein VirD4 dan 11 jenis protein VirB (Tzfira & Citovsky 2002; Judd Át ¿Å. 2005). Protein-protein
11
VirD4 berperan menunjang interaksi kompleks T-DNA-VirD2 dengan komponen sekresi VirB (Gelvin 2003). VirD2 pada kompleks T-DNA akan mengarahkan pergerakan kompleks menuju ke protein VirD4 pada kanal sekresi dan akhirnya menuju ke sitoplasma sel inang.
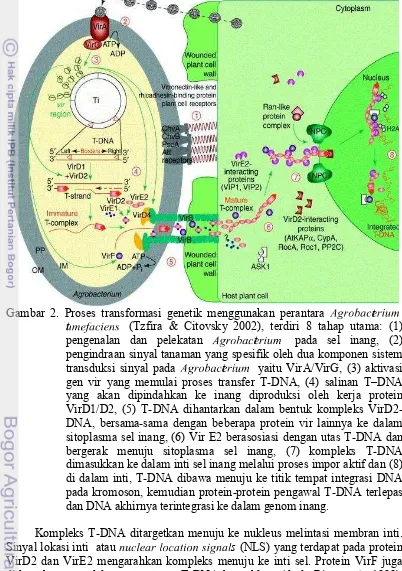
Gambar 2. Proses transformasi genetik menggunakan perantara ÉÊË ÌÍÎ ÏtÐËÑ ÒÓ
t
ÒÓ ÐÔ ÎÏÑ ÐÕÖ (Tzfira & Citovsky 2002), terdiri 8 tahap utama: (1)
pengenalan dan pelekatan ÉÊËÌÍÎÏtÐËÑ ÒÓ pada sel inang, (2)
pengindraan sinyal tanaman yang spesifik oleh dua komponen sistem transduksi sinyal pada ÉÊËÌÍÎÏtÐËÑ ÒÓ yaitu VirA/VirG, (3) aktivasi
gen vir yang memulai proses transfer T-DNA, (4) salinan T DNA yang akan dipindahkan ke inang diproduksi oleh kerja protein VirD1/D2, (5) T-DNA dihantarkan dalam bentuk kompleks VirD2-DNA, bersama-sama dengan beberapa protein vir lainnya ke dalam sitoplasma sel inang, (6) Vir E2 berasosiasi dengan utas T-DNA dan bergerak menuju sitoplasma sel inang, (7) kompleks T-DNA dimasukkan ke dalam inti sel inang melalui proses impor aktif dan (8) di dalam inti, T-DNA dibawa menuju ke titik tempat integrasi DNA pada kromoson, kemudian protein-protein pengawal T-DNA terlepas dan DNA akhirnya terintegrasi ke dalam genom inang.
Kompleks T-DNA ditargetkan menuju ke nukleus melintasi membran inti. Sinyal lokasi inti atauÕ ÒÏ× ÐÎË× ÌÏÎØÑÌÕÖÑÊÕÎ×s(NLS) yang terdapat pada protein
12
Penghantaran kompleks T-DNA menuju nukleus dibantu oleh perangkat transpor intraseluler yang dimiliki oleh sel inang. Dynein dan mikrotubula pada sel tanaman target diduga memfasilitasi transpor T-DNA melintasi sitoplasma. Kompleks T-DNA masuk ke dalam inti sel melalui kompleks pori nukleus atau
ÙÚÛÜ ÝÞß àáâßÝÛ âã áÜÝx(NPC) (Tzfira & Citovsky 2006). Proses masuknya T-DNA
ke dalam inti sel melibatkan kerja sama antara faktor-faktor inang seperti karyopherin (KAP ) dan protein interaksi VirE2 1 atau VirE2-interacting protein1 (VIP1); dengan faktor-faktor asal bakteri seperti VirD2, VirE2 dan VirE3 (Tzfiraet al. 2002).
Integrasi T-DNA ke dalam genom inang merupakan tahap paling menentukan dalam transformasi genetik. Mekanisme molekuler yang mendasari integrasi T-DNA masih belum jelas. Integrasi T-DNA diduga terjadi melalui rekombinasi yang difasilitasi oleh perangkat perbaikan DNA sel inang. Utas tunggal T-DNA diubah menjadi molekul intermediat berutas ganda. Molekul intermediat tersebut akan dikenali sebagai fragmen DNA yang putus, dan kemudian akan digabungkan kembali ke dalam genom inang (Tzfira & Citovsky 2006).
13
3 BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan April 2012 hingga Januari 2013, bertempat di Laboratorium Kultur Jaringan serta Laboratorium BIORIN (äå æçèéêëæì æíîResearch Indonesia-the Netherland) Pusat Penelitian Sumberdaya
Hayati dan Bioteknologi, Institut Pertanian Bogor.
Bahan Rumput Laut dan Bakteri
Talus K. alvarezii warna hijau dipotong sekitar 3 cm, disterilisasi menggunakan larutan iodin 1% dan detergen, kemudian dikultur dalam media Prevasoli s Enriched Seawater (PES) (Lampiran 1) cair hingga siap untuk ditransformasi. Bakteri yang digunakan adalah Escherichia coli DH5 yang membawa plasmid pMSH1 (Gambar 3), E. coli DH5 yang membawa plasmid pJfKer-Lis (Gambar 4),E. coliDH1 (pRK2013) danA. tumefaciensLBA4404.
Gambar 3. Peta daerah T-DNA plasmid pMSH1 (NAIST, Japan). NPT II adalah gen marka seleksi neomycin phosphotransferase II, HPT adalah gen marka seleksi hygromycin phosphotransferase, MCS adalah daerah penyisipan gen target yang dikontrol oleh promoter cauliflower mosaic virus 35S (CaMV 35S) dan terminator (T) nopaline synthase (Nos), menyandikanXbaI,XhoI,SacI,SmaI,KpnI,SpeI,NotI,BamHI.
14
Konstruksi Vektor Biner
Gen ï ðñ òó ðô diamplifikasi dari pJfKer-Lis (Yazawa õt öï. 2005)
menggunakan PCR dengan primer F: 5 -GCA CTA GTG GCA ACA TGA GGT CTT TGC-3 dan R: 5 - TTG CGG CCG CTC CTC ACA GCC GGC AGC-3 . Ujung 5 primer÷ òø ùöø úditambahkan situs restriksi (huruf tebal dan garis bawah)
ûü õI dan pada primerø õvõøñõ denganý òþI untuk membantu dalam ligasi ke vektor
biner pMSH-1 (pemberian Dr. Yokota, NAIST, Japan). Plasmid pMSH-1 dan gen
ï ðñ òó ðô produk PCR dipotong dengan enzim ý òþI dan ûü õI. Reaksi restriksi
diinkubasi pada suhu 37oC selama 16 jam.
Vektor pMSH-1 hasil restriksi diligasi dengan gen ïðñòó ðô mengikuti
metode Sambrook õt öï. (1989). Sebanyak 4 µL 80 ng/µL pMSH-1 dicampur
dengan 3 µL 40 ng/µL genï ðñ òó ðô, 1 µL larutan bufer ligasi 10x, 0,5 µL enzim T4
DNA ligase dan 1,5 µL ddH2O. Inkubasi reaksi ligasi dilakukan pada suhu 4oC
selama 16 jam, kemudian produk ligasi dipakai untuk proses transformasi.
Proses transformasi mengikuti metode Suharsono õt öï. (2002). Sebanyak 50
µL sel kompeten ÿ òï ð DH5 ditambahkan dengan 10 µL DNA plasmid hasil
ligasi, diinkubasi di dalam es selama 30 menit. Selanjutnya diberi kejutan panas pada suhu 42oC selama 45 detik dan diinkubasi lagi di dalam es selama 5 menit. Volume akhir dijadikan 160 µL dengan menambahkan 100 µL 2xYT cair dan dikocok menggunakanñ öõrpada suhu 37
o
C selama 60 menit. Sebanyak 160 µL campuran tersebut disebar secara merata di media LA (Lurria Bertani Agar) (Lampiran 2) yang ditambah dengan kanamisin 50 mg/L dan diinkubasi pada suhu 37oC selama 16 jam. Koloni bakteri yang terbentuk diambil dan selanjutnya digunakan dalam PCR untuk mendapatkan koloni transforman yang membawa pMSH1-Lis. Transforman dikultur kembali pada media LB (Lurria Bertani) (Lampiran 2) dengan penambahan antibiotik kanamisin 50 mg/L dan higromisin 50 mg/L.
Isolasi DNA plasmid dari kultur cair bakteri dilakukan dengan metode lisis alkalis (Sambrookõt öï. 1989). Bakteri ÿ òï ð yang membawa plasmid pMSH-1
dikultur dalam media LB (Lurria Bertani) selama 18 jam. Hasil kultur 1,5 mL disentrifugasi 5000 rpm (Jouan Centrifuge BR4i) 4oC selama 4 menit. Pelet ditambah dengan 150 L larutan I (Lampiran 3) dan diresuspensi kembali. Resuspen ditambahkan 200 L larutan II (Lampiran 3), bolak-balik 7-8 kali dan diinkubasi selama 5 menit di suhu ruang, kemudian ditambah dengan 250 L larutan III (Lampiran 3) dan dibolak-balik 7-8 kali, kemudian disimpan di atas es selama 10 menit dan dilanjutkan dengan sentrifugasi 10.000 rpm 4oC selama 15 menit. Supernatan dipindah ke tabung eppendorf baru, kemudian ditambah dengan fenol: kloroform: isoamilalkohol (PCI, 25:24:1) dan dilanjutkan dengan divorteks kuat dan disentrifugasi 10.000 rpm 4oC selama 10 menit. Pada tahap ini akan terbentuk 3 lapisan, lapisan atas diambil dan dipindahkan ke eppendorf baru, kemudian ditambah etanol absolut 2x volume lapisan atas dan dilanjutkan dengan inkubasi pada -20oC selama 3 jam. Tahap selanjutnya adalah sentrifugasi pada 10.000 rpm 4oC selama 15 menit. Endapan yang terbentuk dicuci dengan 1 mL etanol 70%, selanjutnya disentrifugasi pada 10.000 rpm 40C selama 15 menit. Supernatan dibuang, sedangkan plasmid (pelet) dikeringkan dengan cara divacum selama 15 menit. Plasmid dilarutkan dalam 20 L ddH2O dan RNAse 4 L 1
15
dengan inkubasi pada 70oC selama 10 menit. Plasmid yang diperoleh kemudian disimpan pada suhu -20oC untuk digunakan pada tahap selanjutnya. Keberhasilan penyisipan gen dalam pMSH1 diuji dengan memotong plasmid
menggunakan enzim restriksi I danI (Fermentas).
Transformasi pMSH1-Lis keA. tumefaciensdan Analisis PCR
Transformasi pMSH1-Lis ke t dilakukan dengan cara tr (TPM) (Liberty t . 2008). Transformasi menggunakan tiga
macam bakteri, yaitu yang membawa plasmid pMSH1-Lis, bakteri helper DH1 (pRK2013) dan t LBA4404. Setiap bakteri tersebut sebanyak
20 L dicampur, kemudian diinkubasi pada suhu ruang selama 36 jam. Bakteri yang tumbuh di media LA ini ditumbuhkan dalam media seleksi LA mengandung kanamisin 50 mg/L, higromisin 50 mg/L dan streptomisin 50 mg/L, diinkubasi pada suhu ruang selama 36 jam.
Analisis transforman t dilakukan dengan teknik PCR
menggunakan primer 35S-F: 5 -ATG GCT GGA GTA TTA GCT GGG-3 dan LisR: 5 TTG CGG CCG CTC CTC ACA GCC GGC AGC 3 serta LisF: 5 -GCA CTA GTG -GCA ACA TGA GGT CTT TGC-3 dan Nos-R: 5 -CTC ATA AAT AAC GTC ATG CAT TAC A-3 . Proses PCR dijalankan pada suhu predenaturasi 94oC selama 3 menit; 35 siklus untuk denaturasi 94oC selama 30 detik, annealing 64oC selama 30 detik, ekstensi 72oC selama 1 menit, dan final ekstensi 72oC selama 5 menit. Produk PCR diseparasi dengan teknik elektroforesis pada gel agarosa 2% (b/v) menggunakan bufer TAE 1x (Lampiran 4), dengan voltase 50 V selama 50 menit. Pengamatan dilakukan terhadap pola pita DNA hasil amplifikasi DNA dengan menggunakan DNA marker berukuran 100 pb.
Transformasi pMSH1-Lis pada TalusKappaphycus alvarezii
Kultur hasil konjugasi
Satu koloni t yang membawa plasmid pMSH1-Lis ditumbuhkan pada media LB mengandung streptomisin 50 mg/L, kanamisin 50 mg/L dan higromisin 50 mg/L, dikocok menggunakan r (kecepatan 200
rpm) selama 36 jam pada suhu ruang. Setelah dilakukan subkultur selama 18 jam, bakteri diendapkan dengan sentrifugasi pada kecepatan 4000 rpm selama 10 menit. Pelet bakteri kemudian dilarutkan dalam 25 mL media PES cair dan penambahan 100 µM asetosiringon hingga mencapai ty (OD) 0,5-1,0.
Transformasi dan regenerasi rumput laut
Transformasi dilakukan mengikuti metode Cheney (2000). Transformasi menggunakan talus rumput laut yang telah dipotong sepanjang 1-2 cm dan dikultur selama 3 hari, kemudian dilukai menggunakan jarum steril. Sampel direndam dalam media infeksi yang berisi t dan 100 µM
16
tisu steril dan dipindahkan ke media ko-kultivasi (media PES 0,8% dan 100 µM asetosiringon) selama 3 hari di ruang gelap. Eksplan hasil ko-kultivasi dicuci dengan cefotaxim 200 mg/L, dibilas dengan air laut steril sebanyak 3 kali. Eksplan dikeringkan di atas tisu steril, kemudian dipindahkan ke media !ry
(PES 0,5% tanpa asetosiringon) selama 7 hari. Selanjutnya eksplan dipindahkan ke media seleksi (PES 0,5% yang mengandung higromisin 20 mg/L) dan diinkubasi selama 2 minggu di ruang terang (intensitas cahaya antara 1000-1500 lux) pada suhu 26oC. Pengamatan dilakukan pada media seleksi yang mengandung higromisin. Variabel yang diukur adalah: 1) jumlah eksplan hidup pada media seleksi higromisin, dan 2) jumlah eksplan bertunas putatif.
Identifikasi Talus Transforman dengan MetodePolymerase Chain Reaction
DNA diisolasi menurut Doyle & Doyle (1987): 0,1 g sampel dihancurkan, kemudian ditambahkan 600 µL CTAB 2% (b/v) (Lampiran 5) dan 1,2 µL mercapto etanol 0,2% dan diinkubasi pada suhu 65oC selama 30 menit. Larutan ditambahkan 600 µL CI (chloroform : isopropanol; 24:1) dan disentrifugasi dengan kecepatan 10000 rpm (Jouan Centrifuge BR4i) selama 5 menit pada 4oC, kemudian ditambahkan dengan 600 µL PCI (phenol : chloroform : isopropanol; 25:24:1), dan disentrifugasi kembali pada 10000 rpm selama 5 menit pada 4oC. Supernatan ditambahkan dengan 0,1x volume dengan 2 M NaOAc pH 5,2 dan 2x volume dengan etanol absolut, kemudian diinkubasi pada suhu -20oC selama 3 jam. Selanjutnya disentrifugasi kembali pada 10000 rpm 4oC selama 5 menit. Pelet ditambahkan dengan 500 µL etanol 70% (v/v), selanjutnya disentrifugasi 10000 rpm 4oC selama 5 menit. Pelet dikeringkan dengan vacum, dilarutkan dalam 20 µL ddH2O dan 4 µL 1 mg/mL RNAse, dan kemudian diinkubasi pada
17
4 HASIL DAN PEMBAHASAN
Konstruksi plasmid biner pMSH1-Lisozim
Konstruksi plasmid biner dilakukan dengan meligasi gen"# $%&# ' ayam dan
pMSH1. Plasmid hasil ligasi berukuran 13.449 pb (Gambar 5A kolom 1). Bakteri transforman yang membawa plasmid pMSH1-Lis diidentifikasi menggunakan PCR dengan pasangan primer Lis-F dan Lis-R; 35S-F dan Lis-R; serta Lis-F dan Nos-R. Hasil analisis PCR dengan pasangan primer tersebut menghasilkan amplikon masing-masing berukuran 460 pb, 670 pb dan 580 pb (Gambar 5B).
Gambar 5. A. Pola pemotongan plasmid pMSH1-Lis menggunakan enzim (% )I
dan *+,I. M = marka DNA 1 kb ladder (Fermentas), kolom 1 =
pasmid pMSH1-Lis, kolom 2 = plasmid pMSH1-Lis yang sudah dipotong dengan (% )I dan *+,I, dan kolom 3 = gen "# $%& #' (Lis). B.
Identifikasi- $./,0 # ./# 1 .% "#DH5 transforman pembawa gen "# $%& #'
menggunakan PCR dengan primer Lis-F dan Lis-R (kolom 1, 2 dan 3), 35S-F dan Lis-R (kolom 4 dan 5) dan Lis-F dan Nos-R (kolom 6 dan 7). M = marka DNA 100 pb ladder (Fermentas), kolom 1, 4 dan 6 adalah DH5 hasil transformasi pMSH1-Lis, kolom 2 = kontrol plasmid pJfKer-2 #s, kolom 3, 5 dan 7 adalah kontrol negatif (DH5
non-transforman).
Verifikasi terhadap -3 .% "# yang mengandung plasmid biner (pMSH1 yang
mengandung gen "# $%& #') juga dilakukan dengan menggunakan enzim restriksi
terhadap sampel DNA plasmid yang membawa gen "# $%&# '. Berdasarkan hasil
restriksi dengan (% )I dan *+,I dihasilkan dua fragmen berukuran 12.986 pb dan
460 pb (Gambar 5A kolom 2). Fragmen 12.986 pb merupakan ukuran dari plasmid pMSH1, dan 460 pb merupakan fragmen gen "#$%&# '. Hal tersebut
membuktikan bahwa vektor biner pMSH1-Lis berhasil dibuat.
Transformasi gen "#$%&# ' yang terdapat pada plasmid pMSH1 ke dalam
bakteri- 3.% "#DH5 telah berhasil dilakukan. Keberhasilan transformasi ini dapat
dilihat dari transforman -3.% "# DH5 yang tumbuh pada media seleksi kanamisin
(50 mg/L) dan higromisin (50 mg/L). Kemampuan transforman ini tumbuh pada media seleksi tersebut dikarenakan adanya gen nptII (4,%'y.# 4 +/% $ +/% )014 $5 ,01$,) penyandi ketahanan terhadap antibiotik kanamisin dan hpt
18
higromisin pada plasmid pMSH1. Keberhasilan transformasi ini dilakukan dengan amplifikasi gen 8 9: ;< 9= yang dikendalikan oleh promoter 35S CaMV dan
terminator Nos menggunakan PCR, serta pengujian menggunakan enzim restriksi. Keberhasilan transformasi gen 89:;< 9= ke dalam >? @ ;8 9 DH5 , dapat digunakan
untuk transformasi ke dalamA?BC =DE F@ 9 DG:.
Transformasi pMSH1-LisozimkeAgrobacterium tumefaciens
Plasmid pMSH1-Lis ditransformasikan ke dalam A ? tC = DEF@ 9DG: dengan
cara tH 9IFH DG BF8 = FB9GJ (TPM). Proses TPM telah berhasil dilakukan untuk
mengintroduksikan plasmid pMSH1-Lis ke dalam A? tC = DE F@ 9DG: (Gambar 6).
Plasmid pMSH1-Lis yang terdapat pada> ?@;89 DH5 hasil transformasi (sebagai
donor) dipindahkan ke dalam A? C =DEF@9 DG:t (sebagai resipien) melalui proses
konjugasi dengan bantuan pRK2013 dalam >? @ ;89 DH1. Donor >? @ ;89 DH5
resisten terhadap antibiotik kanamisin dan higromisin, tetapi rentan terhadap antibiotik streptomisin dan resipien A ? tC = DEF@9 DG: yang resisten terhadap
antibiotik streptomisin, tetapi rentan terhadap antibiotik kanamisin dan higromisin. Bakteri yang mampu tumbuh pada media seleksi ini hanya A?
t
C = DEF@ 9DG: yang telah mengandung plasmid pMSH1-Lis hasil TPM (Gambar
6B). Kemampuan A? tu=DE F@ 9 DG: untuk tumbuh di media seleksi ini disebabkan
karena di dalam sel bakteri ini telah membawa gen resistensi terhadap antibiotik kanamisin dan higromisin yang terdapat pada pMSH1-Lis.
Gambar 6. K H 9 IFHDG BF8 LFB 9GJ (TPM). A. Hasil TPM yang tumbuh pada media
LA tanpa antibiotik. B. AJ H;MF@tDH 9C = tC = DE F@ 9 DG: LBA 4404
transforman pada media seleksi higromisin 50 mg/L, kanamisin 50 mg/L dan streptomisin 50 mg/L. C. LBA 4404 non-transforman pada media seleksi higromisin 50 mg/L, kanamisin 50 mg/L dan streptomisin 50 mg/L.
Hasil analisis PCR menunjukkan bahwa koloni dari hasil TPM positif membawa gen 89:;< 9=. PCR dengan primer Lis-F dan Lis-R menghasilkan
amplikon 460 pb, dengan primer 35S-F dan Lis-R menghasilkan amplikon sebesar 670 pb, sedangkan PCR dengan primer Lis-F dan Nos-R menghasilkan amplikon sebesar 580 pb (Gambar 7). Hal ini menunjukkan bahwa A?C = DE F@ 9DG:t tersebut
sudah mengandung gen 89:;< 9= dan dapat digunakan untuk percobaan
19
Gambar 7. Identifikasi transforman OPQ RST UtVQ WuX tYX VZ TUWV[\ hasil tQ W ]^ TQ V[_ T` XT_W[P (TPM) menggunakan tiga jenis primer untuk gen `W\RaWX
(kolom 1, 2 dan 3 dengan primer Lis-F dan Lis-R; 4, 5 dan 6 dengan primer 35S-F dan Lis-R; 7, 8 dan 9 dengan primer Lis-F dan Nos-R). M= marka DNA 100 pb ladder (Fermentas), 1 = 4 = 7 adalah Ob
t
YX VZ TUWV[\ LBA4404 pembawa pMSH1-Lis, 2 = 5= 8 adalah kontrol
positif (DH5 hasil transformasi pMSH1-Lis), 3 =6 =9 adalah kontrol negatif (LBA4404 non-transforman).
Transformasi genlisozimpada talusKappaphycus alvarezii
Transformasi gen ` W \ Ra WX pada talus cb T`vTQVaW W yang sebelumnya
diadaptasikan pada media kultur PES cair dan padat. Sebanyak 225 talus digunakan dalam transformasi. Talus yang telah diinfeksi dengan Ob tYX VZTUWV[\
diseleksi pada media PES yang mengandung higromisin 20 mg/L selama 2 bulan. Tahapan transformasi genetik cb T`vTQVaWW dapat dilihat pada Gambar 8. Talus
rumput laut yang mampu bertahan di media seleksi higromisin sebanyak 53 talus, dengan persentase sebesar 23,56%. Talus yang berhasil bertunas putatif berjumlah 6, dengan efisiensi sebesar 11,32% (Tabel 1). Efisiensi talus bertunas putatif ditentukan berdasarkan rasio jumlah talus bertunas putatif terhadap jumlah talus yang mampu bertahan di media seleksi higromisin. Efisiensi tunas putatif talus yang ditransformasi lebih rendah daripada efisiensi tunas pada talus kontrol positif yang tidak ditransformasi (22%). Rendahnya efisiensi tunas putatif diduga disebabkan oleh perlakuan infeksi OPQ RST UtVQ WYX dan seleksi antibiotik yang
mengakibatkan penurunan daya regenerasi talus untuk bertunas putatif. Hal ini sejalan dengan pendapat Suma Vt T`. (2008) penambahan antibiotik dalam media
seleksi dapat menyebabkan penurunan pertumbuhan dan perkembangan kalus. Pembentukan tunas dari talus yang tahan higromisin mulai teramati pada minggu keempat setelah infeksi. Pembentukan tunas diawali dengan munculnya titik-titik coklat pada talus. Setelah 2 minggu, titik coklat membesar dan membentuk tunas (Gambar 8C). Tunas yang terbentuk, secara umum muncul dari bagian talus yang dipotong. Talus yang mampu bertahan dimedia seleksi higromisin, selanjutnya diaklimatisasi skala kecil di media PES cair (Gambar 8D). Analisis molekuler terhadap talus yang tahan higromisin dengan PCR menggunakan kombinasi primer spesifik gen `WsRaWX , promoter 35S CaMV dan
terminator Nos menunjukkan bahwa tiga tunas yang terbentuk dari tiga talus mengandung gen ` W \ RaW X. Tidak semua tunas yang terbentuk mengandung gen
` W \ RaW X (Tabel 1), hal ini diduga disebabkan oleh tidak semua sel pada satu talus
20
yang berasal dari sel-sel yang mengandung gen lisozim akan mengandung gen lisozim juga. Sedangkan tunas yang secara molekuler tidak mengandung gen lisozim, kemungkinan berasal dari sel-sel yang tidak mengandung gen lisozim.
Persentase transformasi yang diperoleh pada penelitian ini sebesar 23,56% (Tabel 1). Persentase transformasi ini lebih rendah dibandingkan dengan persentase transformasi gen d efZ pada Gracilaria changii menggunakan metode
tembakan partikel (particle bombardment) yaitu sebesar 80-94%. Rendahnya persentase transformasi yang diperoleh pada penelitian ini diduga dipengaruhi oleh perbedaan metode yang digunakan dalam proses transformasi. Selain itu, kemungkinan juga disebabkan karena masih kurang optimalnya tahapan dalam proses transformasi menggunakanA. tumefaciens, terutama pada tahap infeksi dan ko-kutivasi.
Tabel 1. Persentase transformasi dan tunas putatif rumput laut Kappaphycus alvareziidengan genLisozim.
Transformasi 225 53 23,56% 6 3 11,32%b)
Kontrol -1) 50 0 0 0 0 0
Kontrol +2) 50 - 0 11 0 22%
a)
Jumlah talus tahan higromisin/jumlah kalus awal x 100%
b)
Jumlah talus yang bertunas putatif / jumlah kalus tahan higromisin x 100%
1)
Talus non-transgenik yang ditumbuhkan pada media seleksi higromisin
2)
Talus non-transgenik yang ditumbuhkan pada media PES tanpa higromisin
Hasil transformasi menunjukkan bahwa penambahan 100 µM asetosiringon dengan OD 0,5-0,8 selama masa infeksi 30 menit di media PES yang mengandung A. tumefaciens menunjukkan pertumbuhan eksplan pada media seleksi (Gambar 8). Menurut James et al. (1993), penambahan asetosiringon ke dalam media ko-kultivasi efektif meningkatkan efisiensi transformasi. Penambahan asetosiringon mampu menginduksi gen vir yang berfungsi mentransfer T-DNA ke dalam sel tanaman dan mempertinggi efektivitas infeksi A. tumefaciens sehingga meningkatkan jumlah sel transforman (Rashid et al. 2010). Selain itu, perlakuan lama ko-kultivasi (inkubasi) antara bakteri dan eksplan sangat mempengaruhi efektivitas infeksi bakteri. Inkubasi yang terlalu cepat dapat mempengaruhi keberhasilan transformasi, karena bakteri belum sempat menginfeksi sel-sel eksplan secara sempurna. Menurut Alimohammadi & Bagherieh-Najjar (2009) keberhasilan transfer gen olehA. tumefacienssangat ditentukan oleh ada tidaknya luka/perlukaan, kerapatan bakteri (optical density), lama inokulasi dan lama ko-kultivasi.
21
kematian. Talus non-transforman mengalami kematian secara bertahap pada media seleksi higromisin. Kematian talus non-transforman mulai teramati pada minggu ketiga di media seleksi higromisin 20 mg/L. Kematian talus diawali dengan memutihnya warna talus dan tekstur talus lebih rapuh. Setelah 12 minggu di media seleksi higromisin, seluruh talus non-transforman mengalami kematian (Gambar 9). Warna talus hijau menunjukkan talus masih hidup, sedangkan warna talus putih menunjukkan talus mengalami kematian (Gambar 9B, 9E dan 9H).
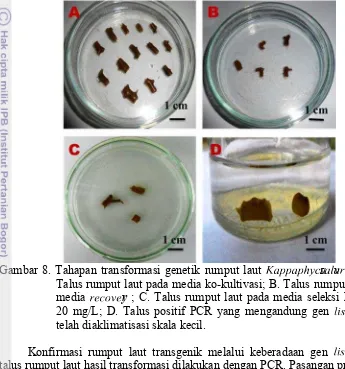
Gambar 8. Tahapan transformasi genetik rumput laut ghiihijklus hmvhn op q q . A.
Talus rumput laut pada media ko-kultivasi; B. Talus rumput laut pada media n o lrs ory ; C. Talus rumput laut pada media seleksi higromisin
20 mg/L; D. Talus positif PCR yang mengandung gen m qt rp qu yang
telah diaklimatisasi skala kecil.
Konfirmasi rumput laut transgenik melalui keberadaan gen mqt rp qu pada
22
Gambar 9. Tahapan perkembangan talus vwxxwxyz{us w|vw} ~ . Talus
transforman pada media seleksi higromisin 20 mg/L, masing-masing umur empat (A), delapan (D) dan 12 minggu (G). Talus non-transforman pada media seleksi higromisin 20 mg/L, masing-masing umur empat minggu (B), delapan minggu (E) dan 12 minggu (H). Talus non-transforman pada media tanpa higromisin, masing-masing umur empat minggu (C), delapan minggu (F) dan 12 minggu (I). Pada B, E, dan H, warna talus hijau menunjukkan talus hidup, sedangkan warna talus putih menunjukkan talus mati.
Keberhasilan transformasi genetik pada rumput laut ditandai dengan terintegrasinya gen yang diintroduksikan ke dalam genom rumput laut dan terekspresi serta tetap terpelihara dalam seluruh proses pembelahan sel sampai regenerasi rumput laut. Untuk mengetahui integrasi gen lisozim ke dalam rumput laut v w|vw} ~ dapat dilakukan dengan menggunakan marka seleksi terhadap
antibiotik higromisin dan dapat dianalisis secara molekuler menggunakan teknik PCR. Berdasarkan kemampuan talus vw|vw} ~ tumbuh di dalam media seleksi
(media PES dengan penambahan higromisin) (Tabel 1) dan konfirmasi rumput laut transgenik melalui keberadaan gen | pada talus rumput laut hasil
transformasi dengan PCR (Gambar 10), menunjukkan bahwa gen | telah
23
Gambar 10. Hasil analisis PCR DNA rumput laut hasil transformasi dengan gen
menggunakan tiga jenis primer (kolom 1, 2 dan 3 dengan
primer Lis-F dan Lis-R; 4, 5 dan 6 dengan primer 35S-F dan Lis-R; 7, 8 dan 9 dengan primer Lis-F dan Nos-R). M = marka DNA 100 pb ladder (Fermentas), 1 = 4 = 7 adalah rumput laut transgenik, 2 = 5= 8 adalah kontrol positif (plasmid pMSH1-Lis), 3 = 6 = 9 adalah kontrol negatif (rumput laut non-transforman).
us v transgenik ini dapat dimanfaatkan untuk
mempelajari mekanisme pertahanan rumput laut terhadap infeksi bakteri penyebab penyakit . Uji tantangv terhadap bakteri penyebab dapat dilakukan setelah diperoleh talus yang berasal dari subkultur tunas yang
mengandung gen . Selain itu, ketika v transgenik ini telah tahan
terhadap penyakit , dapat berguna untuk meningkatkan produksi rumput
laut di musim pada saat penyakit sering menginfeksi. Metode transformasi
24
5 SIMPULAN DAN SARAN
Simpulan
Vektor biner pMSH1 pembawa gen telah berhasil dikonstruksi
dengan ukuran sebesar 13.449 pb. Gen telah terintegrasi ke dalam genom
rumput laut v . Transformasi genetik pada v dengan gen menghasilkan 3 talus rumput laut transgenik. Efisiensi tunas putatif dari
talus tahan higromisin sebesar 11,32%, sedangkan persentase transformasi genetiknya sebesar 23,56%.
Saran
Protokol transformasi genetik pada rumput laut ¡¡¡¢£¤us v
masih perlu dimantapkan agar efisiensi transformasi dan jumlah talus transforman dapat ditingkatkan. Pegujian rumput laut transgenik dengan infeksi bakteri kandidat penyebab¤ ¥¤ dan stres lingkungan perlu dilakukan untuk mengetahui
25
DAFTAR PUSTAKA
Alimohammadi M, Bagherieh-Najjar M. 2009. ¦§¨ ©ª«¬t¨® ¯°-mediated
transformination of plants: basic principles and influencing factors. ¦±r J Biotechnol.8 (20): 5142-5148. doi: 10.5897/AJB09.011.
Amiluddin NM. 2007. Kajian pertumbuhan dan kandungan karaginan rumput laut Kappaphycus alvarezii yang terkena penyakit ice-icedi perairan Pulau Pari Kepulauan Seribu. [Tesis]. Institut Pertanian Bogor.
Ananda RRWU. 2004. Studi transformasi pada tebu dengan perantara Agrobacterium tumefaciens GV 2260 (pMA) serta regenerasi kalus transgenik. [Tesis]. Institut Pertanian Bogor.
Aris M. 2011. Identifikasi, patogenitas bakteri dan pemanfaatan gen 16S-rRNA untuk deteksi penyakit ice-ice pada budidaya rumput laut (Kappaphycus alvarezii). [Disertasi]. Institut Pertanian Bogor.
Atmadja WS, Kadi A, Sulistijo, Rachmaniar. 1996. Pengenalan jenis-jenis rumput laut di Indonesia. Pusat Penelitian dan Pengembangan Oseanologi-Lembaga Ilmu Pengetahuan Indonesia. Jakarta.
Bixler H. 1996. Recent developments in manufacturing and marketing carrageenan.Hydrobiologia.326/327: 35-57. Doi: 10.1007/BF00047785. Broek AV, Vanderleyden J. 1995. The role of bacterial motility, chemotaxis, and
attachment in bacteria-plant interactions.Mol Plant Microbe In. 8 (6): 800-810. doi: 10.1094/MPMI-8-0800.
Brown TA. 1996. Gene cloning an introduction. Chapman & Hall.
Buchanan RE, Gibbons NE. 1974. Bergeys manual of determination bacteriology. Eight edition. The Williams and Wilkins co.
Burge EJ, Madigan DJ, Burnett LE, Burnett KG. 2007. Lysozyme gene expression by hemocytes of Pacific white shrimp Litopenaeus vannamei, after injection with Vibrio. Fish Shellfish Immun. 22: 327-339. doi: 10.1016/j.fsi.2006.06.004.
Cheney D P. 2000. Agrobacterium-mediated genetic transformation of multicellular marine algae, resultant strains and their products. Northeastern University. United States. [internet]. [diacu 2012 Agustus 29]. Tersedia dari: http://www. patentlens.net/patentlens/patents.htmL?patnums.
Cheney DP, Metz B, Stiller J. 2001. Agrobacterium-mediated genetic transformation in the macroscopic marine red algae Porphyra yezoensis. J Phycol. 37: 11-12. doi/10.1111/j.1529-8817.2001.jpy37303-22.x.
de la Riva GA, Gonzalez-Cabrera J, Vazquez-Padron R, Ayro-pardo C. 1998. Agrobacterium tumefaciens: a natural tool for plant transformation.Electron J Biotechnol.1 (3): 1-16.doi: 10.2225/vol1-issue3-fulltext-1.
Doty MS. 1973. Eucheuma farming for carrageenan. Univ. Hawai Sea Grant Report. UNIHI SEAGRANT-AR. 73: 02-21.
26
Doyle JJ, Doyle JL. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. ²³yt´µ³¶· ¸ ¹º» » . 19: 11-15. [internet]. [diacu 2013
Januari 30]. Tersedia dari: http://www. Mendeley.com/research-papers/. Draper J, Scott R, Armitage P, Walden R. 1993. Plant genetic transformation and
gene expression. A laboratory manual hand book. Blackwel Sci. Publ. Escobar MA, Dandekar AM. 2003. ¼½¾ ´¿Àµt¶¾ Á º· tº·¶Â ÀµÁ ¶ÃÄ as an agent of
Gelvin SB. 2000. Agrobacterium and plant genes involved in T-DNA transfer and integration. Annu Rev Plant Physiol Mol Biol. 51: 223-256. doi: 10.1146/annurev.arplant.51.1.223.
Hannum S. 2012. Isolasi, pengklonan, dan analisis ekspresi gen penyandi Cooper/zinc superoxide dismutase (CuZn-SOD) dari Melastoma malabrathricumL. [Disertasi]. Institut Pertanian Bogor.
Hiei Y, Komari T, Kobu T. 1997. Transformation of rice mediated by Agrobacterium tumefaciens. Plant Mol Biol. 35: 205-218. doi: 10.1023/A:1005847615493
Hikima S, Hikima JI, Rojtinnakorn J, Hirono I, Aoki T. 2003. Characterization and function of kuruma shrimp lysozyme possessing lityc activity against Vibriospecies.Gene. 316: 187-195. doi: 10.1016/S0378-1119(03)00761-3. Huddy SM, Meyers AE, Coyne VE. 2012. Transformation oflacZ using different
promoters in the commercially important red alga,Gracilaria gracilis.Afr J Biotechnol.11(8): 1879-1885. doi: 10.5897/AJB11.2641.
James DJ, uratsu S, Cheng J, Negri P, Viss P, Dandekar AM. 1993. Acetosyringone and osmoprotectants like betaine or proline synergistically enhance Agrobacterium-mediated transformation of apple. Plant Cell Rep. 12: 559-563. doi: 10.1007/BF00233060.
Judd PK, Mahli D, Das A. 2005. Moleculer characterization of theAgrobacterium tumefaciens DNA transfer protein VirB6. Microbiology. 151: 3483-3492. doi: 10.1099/mic.0.28337-0.
Kotiya AS, Gunalan B, Parmar HV, Jaikumar M, Tushar D, Solanki JB, Makwana NP. 2011. Growth comparison of seaweed Kappaphycus alvarezii in nine different coastal areas of Gujarat Coast, India. Adv App Sci Res.2 (3): 99-106. [internet]. [diacu 2012 Maret 16]. Tersedia dari: http://www.pelagiaresearchlibrary.com.
Largo DB. 2002. Recent developments in seaweed diseases. Proceeding of the National Seaweed Planning Workshop. Pp 35-42.
Lewmanomont K, Ogawa H. 1995. Common seaweeds and seagrasses of Thailand. Faculty of Fisheries, Kasetsart University. Bangkok.