EFEKTIVITAS PENAMBAHAN SIMPLISIA RIMPANG
TEMULAWAK
Curcuma xanthorrhiza
Roxb. PADA PAKAN
IKAN NILA
Oreochromis niloticus
TERHADAP INFEKSI
Streptococcus agalactiae
SITA PANCA RINI
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul “Efektivitas Penambahan Simplisia Rimpang Temulawak Curcuma xanthorrhiza Roxb. pada Pakan Ikan Nila Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dan tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SITA PANCA RINI. Efektivitas Penambahan Simplisia Rimpang Temulawak Curcuma xanthorrhiza Roxb. pada Pakan Ikan Nila Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae. Dibimbing oleh MUNTI YUHANA dan ANGELA MARIANA LUSIASTUTI.
Streptococcus agalactiae adalah bakteri yang menyebabkan penyakit Streptococcosis pada ikan nila. Tujuan penelitian ini adalah menguji efektivitas pemberian simplisia rimpang temulawak melalui pakan terhadap respons imun ikan nila yang diinfeksi S. agalactiae. Pada penelitian ini, dosis simplisia rimpang temulawak, yaitu 25; 50; dan 200 gr/kg pakan. Ikan kontrol hanya diberi pakan komersial tanpa suplementasi rimpang temulawak. Setelah itu, ikan diuji tantang secara injeksi dengan kepadatan sel S. agalactiae 4.0x109 CFU/ml. Perlakuan simplisia rimpang temulawak tidak memberikan nilai kelangsungan hidup yang berbeda nyata (P>0.05) dengan kontrol positif pascauji tantang. Perlakuan 50 gr/kg pakan dan 200 gr/kg pakan dapat meningkatkan kadar lisozim pada prauji tantang (597 UI/ml/menit dan 717 UI/ml/menit) dan pascauji tantang (671 UI/ml/menit dan 1488 UI/ml/menit) ikan nila selama penelitian. Pemberian simplisia rimpang temulawak dapat menurunkan laju pertumbuhan spesifik harian pada perlakuan 25; 50; dan 200 gr/kg pakan (0.29%, 0.53%, dan 1.57%) dibandingkan dengan kontrol tapi cenderung meningkatkan tingkat konversi pakan ikan nila (0.01, 0.04, dan 0.15).
ABSTRACT
SITA PANCA RINI Efficacy of Curcuma xanthorrhiza Roxb. Simplicia as Feed Supplementation in Oreochromis niloticus against Streptococcus agalactiae Infection. Supervised by MUNTI YUHANA and ANGELA MARIANA LUSIASTUTI.
Streptococcus agalactiae is a common causative agent for Streptococcosis in tilapia. The purpose of this research was to evaluate the efficacy of Curcuma xanthorrhiza Roxb. simplicia feed supplementation tilapia immune systems against the S. agalactiae infection. This research applied different dosages of C. xanthorrhiza Roxb. ie 25; 50; and 200 gr/kg feed. The control treatment was fed only by commercial feed without C. xanthorrhiza Roxb. After that, the fish were challenged with pathogenic cells at concentration of 4.0 x 109 CFU/ml. Supp lementation of dietary treatments did not result significant (P>0.05) effect on the survival rate compared to positive control. Treatment of 50 gr/kg feed and 200 gr/kg feed improved the immune systems of tilapia especially on lysozyme before challange test (597 UI/ml/minute and 717 UI/ml/minute) and after challenge test (671 UI/ml/minute and 1488 UI/ml/minute). The C. xanthorrhiza Roxb. feed supplementation decreased the specific growth rate in treatment 25; 50; and 200 gr/kg feed (0.29%, 0.53%, and 1.57%) compared with control but increased the feed convertion ratio (0.01, 0.04, and 0.15) respectively.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Budidaya Perairan
EFEKTIVITAS PENAMBAHAN SIMPLISIA RIMPANG
TEMULAWAK
Curcuma xanthorrhiza
Roxb. PADA PAKAN
IKAN NILA
Oreochromis niloticus
TERHADAP INFEKSI
Streptococcus agalactiae
DEPARTEMEN BUDIDAYA PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
Judul Skripsi : Efektivitas Penambahan Simplisia Rimpang Temulawak
Curcuma xanthorrhiza Roxb. pada Pakan Ikan Nila Oreochromis niloticus Terhadap Infeksi Streptococcus agalactiae
Nama : Sita Panca Rini NIM : C14100054
Program Studi : Teknologi dan Manajemen Perikanan Budidaya
Disetujui oleh
Dr. Munti Yuhana, SPi, MSi Pembimbing I
Dr. drh. Angela Mariana Lusiastuti, MSi
Diketahui oleh
Pembimbing II
Dr. Ir. Sukenda, MSc Ketua Departemen
PRAKATA
Segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga penulisan dapat menyelesaikan penyusunan skripsi yang berjudul “Efektivitas penambahan simplisia rimpang temulawak Curcuma xanthorrhiza Roxb. pada pakan ikan nila Oreochromis niloticus terhadap infeksi Streptococcus agalactiae”. Penelitian ini dilaksanakan pada bulan November 2013 hingga Desember 2013 yang bertempat di Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor (BPPBAT).
Pada kesempatan ini, penulis mengucapkan terima kasih kepada:
1. Dr. Munti Yuhana, SPi, MSi dan Dr. drh. Angela Mariana Lusiastuti, MSi selaku dosen pembimbing yang telah memberikan bimbingan dan masukan kepada penulis.
2. Bapak Dr. Alimuddin SPi, MSc selaku dosen penguji utama dan ibu Dr. Ir. Mia Setiawati, MSi selaku dosen penguji dari komisi pendidikan atas kritik dan saran yang telah diberikan penulis untuk perbaikan skripsi ini.
3. Ir. Dadang Shafrudin, MSi selaku dosen pembimbing akademik yang telah memberikan masukan, semangat, dan motivasi.
4. Lembaga Institut de Recherce Pour le Developpement (IRD) dan Ethnobotany for Sustainable Therapy in Aquaculture and Food Safety (ESTAFS) Prancis yang telah mendanai penulis dalam penelitian ini.
5. Dr. Domenico Caruso yang mengikut sertakan penulis dalam proyek penelitian ini.
6. Para staff dan laboran patologi (P. Wahyu dan P. Edi) Balai Penelitian dan Pengembangan Budidaya Air Tawar Bogor (BPPBAT).
7. Papa, mama, kakak, dan kedua adik serta seluruh keluarga, atas segala doa, dukungan, dan kasih sayangnya.
8. Indriyani Anggi Pramesti dan Edwina D. yang menjadi partner penelitian 9. Teman-teman (Intan, Septi, Arum, Amal, Euis, Vani, Mungil, Ratna, Tiwi)
dan semua teman-teman BDP 47 atas segala dukungan dan bantuannya. 10. Pak Ranta dan teman-teman LKI atas bantuan dan kerjasamanya.
Diantara kelebihan dan kekurangannya, semoga skripsi ini dapat memberikan manfaat bagi yang memerlukannya.
DAFTAR ISI
DAFTAR TABEL... vi
DAFTAR GAMBAR... vi
DAFTAR LAMPIRAN... vi
PENDAHULUAN... 1
Latar Belakang... 1
Tujuan Penelitian... 1
METODE... 2
Prosedur Penelitian... 2
Rancangan Penelitian... 4
Parameter Penelitian dan Analisis Data... 5
HASIL DAN PEMBAHASAN... 7
Hasil... 7
Pembahasan... 11
KESIMPULAN DAN SARAN... 14
Kesimpulan... 14
Saran... 15
DAFTAR PUSTAKA... 15
LAMPIRAN... 18
DAFTAR TABEL
1 Rancangan perlakuan pemberian pakan simplisia rimpang temulawak
dengan dosis berbeda pada ikan nila (prauji tantang)... 4
2 Rancangan perlakuan pemberian pakan simplisia rimpang temulawak dengan dosis berbeda pada ikan nila (pascauji tantang)... 4
3 Parameter kualitas air, satuan, dan alat ukur selama pemeliharaan... 6
4 Hasil analisis histopatologi organ ikan uji... 10
5 Kisaran kua litas air dalam media pemeliharan ikan nila selama prauji tantang... 11
DAFTAR GAMBAR
1 Skema prosedur penelitian... 22 Kelangsungan hidup ikan nila (a) prauji tantang dan (b) pascauji tantang... 7
3 Laju pertumbuhan spesifik harian (specific growth rate/SGR) ikan nila prauji tantang... 8
4 Tingkat konversi pakan (feed conversion ratio/FCR) ikan nila prauji tantang... 8
5 Hasil uji respiratory burst activity ikan nila (a) prauji tantang dan (b) pascauji tantang... 9
6 Hasil uji lisozim ikan nila (a) prauji tantang dan (b) pascauji tantang... 10
DAFTAR LAMPIRAN
7 Komponen penyusun rimpang temulawak (Curcuma xanthorrhiza)... 188 Ikhtisar berbagai penelitian penanganan bakteri Streptococcus agalactiae... 18
9 Prosedur pengujian respiratory burst activity... 21
10 Prosedur pengujian lisozim... 21
11 Prosedur histopatologi... 22
6 a) Analisis statistik kelangsungan hidup ikan nila prauji tantang... 22
b) Analisis statistik kelangsungan hidup ikan nila pascauji tantang... 23
7 Analisis statistik laju pertumbuhan spesifik harian ikan nila selama 25 hari... 23
8 Analisis statistik tingkat konversi pakan ikan nila selama 25 hari... 23
9 a) Analisis statistik respiratory burst activity ikan nila pada hari ke-25... 24
b) Analisis statistik respiratory burst activity ikan nila pada hari ke-45... 24
10 a) Analisis statistik lisozim ikan nila pada hari ke-25... 25
b) Analisis statistik lisozim ikan nila pada hari ke-45... 25
11 Gambar histopatologi organ ikan nila... 26
PENDAHULUAN
Latar Belakang
Ikan nila (Oreochromis niloticus) merupakan komoditas perikanan air tawar unggulan di Indonesia hingga saat ini. Ikan nila memiliki pertumbuhan yang relatif cepat, namun mudah terserang penyakit Streptococcosis yang salah satunya diakibatkan oleh bakteri Streptococcus agalactiae.
Wabah penyakit Streptococcosis bersifat akut dan menyebabkan kematian yang tinggi hingga 100% pada ikan budidaya (Hernandez et al. 2009). Penyakit Streptococcosis muncul akibat ketahanan tubuh ikan yang rendah dalam menghadapi serangan penyakit bakterial (Yuasa et al. 2008). Penggunaan antibiotik merupakan alternatif yang mudah dan cepat untuk mencegah dan mengobati penyakit tersebut. Saat ini penggunaan antibiotik pada budidaya ikan konsumsi telah dilarang karena memiliki residu yang berbahaya. Menurut Noga (2000), penggunaan antibiotik sebagai obat dapat menimbulkan resistensi bakteri terhadap antibiotik tertentu. Sifat resisten ini dapat disebarkan oleh sesama bakteri, sehingga penggunaan antibiotik dengan intensitas yang relatif tinggi dapat menimbulkan berbagai permasalahan.
Fitofarmaka adalah obat yang berasal dari bahan alam terutama dari bahan nabati yang khasiatnya jelas, baik berupa simplisia maupun bahan yang telah diekstraksi (Dewoto 2007). Penggunaan fitofarmaka merupakan alternatif yang ramah lingkungan untuk menanggulangi penyakit Streptococcosis. Salah satu fitofarmaka yang dapat digunakan adalah temulawak (Curcuma xanthorrhiza Roxb.). Tanaman ini berasal dari Indonesia dan telah digunakan untuk meningkatkan kesehatan manusia maupun pada hewan (Mangunwardoyo et al. 2012). Rimpang temulawak mengandung protein, pati, zat warna kuning kurkuminoid, dan minyak atsiri (Lampiran 1). Minyak atsiri pada temulawak mengandung xanthorizol, kamfor, tumerol, feladren, tolilmetilkarbinol, ar-kurkumen, zingiberen, kuzerenon, germakron, dan b-tumeron (Rahardjo dan Rostiana 2003). Xanthorrizol dari rimpang temulawak dapat menghambat pertumbuhan bakteri Streptococcus mutans. Ekstrak temulawak dalam etanol 96% menghambat pertumbuhan Staphylococcus aureus dan Staphylococcus epidermidis (Mangunwardoyo et al. 2012).
Berbagai penelitian telah dilakukan untuk menanggulangi penyakit Streptococcosis yang diakibatkan oleh S. agalactiae (Lampiran 2), namun penggunaan fitofarmaka untuk penyakit ini masih belum dilakukan. Penelitian ini menggunakan simplisia rimpang temulawak (C. xanthorrhiza Roxb.) yang dicampurkan ke dalam pakan ikan uji dan diharapkan mampu meningkatkan sistem imun pada ikan uji selama pemeliharaan.
Tujuan Penelitian
2
METODE
Prosedur Penelitian
Gambar 1 merupakan skema dari kegiatan penelitian yang telah dilakukan. Karantina ikan, aklimatisasi ikan, dan pembuatan pakan uji dilakukan sebelum pemberian perlakuan, yaitu sebelum hari ke-0. Pemberian perlakuan dilakukan dari hari ke-0 hingga hari ke-45. Selama pemberian perlakuan juga dilakukan persiapan bakteri S. agalactiae, uji respiratory burst activity (RBA), uji lisozim, histopatologi, dan uji tantang dengan bakteri S. agalactiae.
Gambar 1. Skema prosedur penelitian
Persiapan Wadah
Persiapan wadah meliputi pencucian akuarium dan peralatan resirkulasi, penyusunan akuarium, pengisian air serta penyetingan aerasi. Akuarium plastik berukuran 45 x 35 x 30 cm3 dan akuarium kaca berukuran 99 x 49.5 x 60 cm3 serta peralatan resirkulasi dicuci bersih menggunakan disinfektan yang mengandung NaHClO3 5.25% sebanyak 100 ml dalam 30 liter air. Setelah itu, akuarium dan peralatan resirkulasi dikeringkan selama 3-4 jam, kemudian dilakukan penyusunan akuarium serta peralatan resirkulasi. Akuarium plastik dan akuarium kaca diisi dengan air tandon setinggi 25 cm dan 45 cm. Sistem aerasi dipasang menggunakan blower, selang aerasi, dan batu aerasi. Akuarium yang telah diisi air diaerasi kuat selama 24 jam.
Persiapan Ikan Uji
3 Setelah itu, ikan dianestesi menggunakan minyak cengkih sebanyak 0.02 ml/L air. Ikan uji dapat pingsan selama 2-3 menit. Bobot dan panjang total ikan uji diukur sebelum dipindahkan ke akuarium plastik dengan kepadatan 15 ekor/akuarium. Ikan uji diadaptasikan selama 7 hari di akuarium plastik. Selama masa pengadaptasian, ikan diberi pakan komersial dan dilakukan pergantian air setiap hari sebesar 25%. Ikan uji dipelihara dalam akuarium plastik yang menggunakan sistem resirkulasi dengan debit air 1.07 L/menit. Setelah 25 hari, ikan diuji tantang dan dipindahkan ke akuarium kaca tanpa sistem resirkulasi.
Pembuatan Pakan Temulawak (Curcuma xanthorriza Roxb.)
Rimpang temulawak diperoleh dari Balai Penelitian Tanaman Rempah dan Obat (BALITRO), Bogor. Rimpang temulawak dicuci bersih kemudian diparut dengan ketebalan seragam dan dikeringkan dengan oven bersuhu 50°C selama 2 hari. Rimpang yang telah kering dihaluskan dan diayak dengan mesin pengayak (amplitudo 1.5 mm/detik selama 2 menit) sehingga diperoleh partikel berukuran 425 µm. Setelah itu, dilakukan repelleting pakan dengan komposisi simplisia rimpang temulawak, pakan komersial 1 kg, tapioka (binder) 20 gram, dan air panas sebanyak 400 ml. Pakan dibentuk ulang dengan diameter 2 mm menggunakan alat pencetak pakan, kemudian dikeringkan dalam oven bersuhu 50°C selama 1 hari. Pakan yang telah jadi dikemas dan disimpan dalam refrigerator untuk menghindari kontaminasi seperti jamur.
Persiapan Bakteri Streptococcus agalactiae
Bakteri S. agalactiae digunakan untuk uji tantang pada hari ke-25. Sebelumnya S. agalactiae dilakukan postulat Koch yang bertujuan untuk meningkatkan patogenitas dari bakteri. Bakteri tersebut disuntikkan ke ikan dengan kepadatan 108 CFU/ml dengan volume 0.2 ml/ekor dan diamati gejala klinisnya selama 5-7 hari. Setelah gejala klinis muncul maka ikan tersebut diisolasi (mata dan otak) di media BHIA untuk mendapatkan bakteri patogen S. agalactiae. Postulat Koch dilakukan sebanyak 3 kali. Setelah itu, dilakukan uji tantang dengan cara bakteri S. agalactiae dikultur dalam media BHIB selama 36 jam pada suhu 32°C, kemudian disentrifugasi dan diambil endapan bakteri. Endapan bakteri diencerkan dengan PBS dan diukur turbiditasnya dengan spektrofotometer tipe genesys 10 uv pada panjang gelombang 625 nm hingga mendapatkan absorbansi 0.08-0.13. Nilai absorbansi tersebut setara dengan 4.0x109 CFU/ml dan digunakan untuk penyuntikan dalam uji tantang (Dernuet 1995). Volume bakteri yang disuntikkan ke ikan adalah 0.2 ml/ekor.
Pengambilan Darah Ikan Uji
4
Rancangan Penelitian
Penelitian ini terdiri dari dua tahap, yaitu prauji tantang dan pascauji tantang. Penelitian pada tahap prauji tantang terdapat 4 perlakuan dengan 3 kali ulangan. Rancangan perlakuan penelitian tahap prauji tantang dapat dilihat pada Tabel 1. Tabel 1 Rancangan perlakuan pemberian pakan simplisia rimpang temulawak
dengan dosis berbeda pada ikan nila (prauji tantang)
Perlakuan Keterangan
K Pemberian pakan komersial tanpa penambahan simplisia rimpang temulawak
A Pemberian pakan yang mengandung simplisia rimpang temulawak sebanyak 25 gram/kg pakan komersial
B Pemberian pakan yang mengandung simplisia rimpang temulawak sebanyak 50 gram/kg pakan komersial
C Pemberian pakan yang mengandung simplisia rimpang temulawak sebanyak 200 gram/kg pakan komersial
Ikan yang masih hidup dari 3 ulangan di penelitian tahap prauji tantang dijadikan 2 ulangan pada penelitian tahap pascauji tantang. Penelitian tahap pascauji tantang terdapat 5 perlakuan dengan 2 kali ulangan. Rancangan perlakuan penelitian tahap pascauji tantang dapat dilihat pada Tabel 2.
Tabel 2 Rancangan perlakuan pemberian pakan simplisia rimpang temulawak dengan dosis berbeda pada ikan nila (pascauji tantang)
Pelakuan Keterangan
KN (kontrol negatif)
Pemberian pakan komersial tanpa penambahan simplisia rimpang temulawak dan tidak diuji tantang. Ikan KN berasal dari semua perlakuan pada penelitian prauji tantang dengan jumlah ikan 4 ekor setiap perlakuan.
KP (kontrol positif)
Pemberian pakan komersial tanpa penambahan simplisia rimpang temulawak dan diuji tantang. Ikan KP berasal dari perlakuan K pada penelitian prauji tantang
A Pemberian pakan yang mengandung simplisia rimpang temulawak sebanyak 25 gram/kg pakan komersial dan diuji tantang
B Pemberian pakan yang mengandung simplisia rimpang temulawak sebanyak 50 gram/kg pakan komersial dan diuji tantang
C Pemberian pakan yang mengandung simplisia rimpang temulawak sebanyak 200 gram/kg pakan komersial dan diuji tantang
5
Parameter Penelitian dan Analisis Data
Kelangsungan hidup
Kelangsungan hidup pra dan pascauji tantang ikan uji dihitung dengan menggunakan rumus dari Effendi (1997):
Kelangsungan hidup = Nt
No
x100%
Keterangan:
Nt = Jumlah ikan akhir pemeliharaan No = Jumlah ikan awal pemeliharaan
Laju Pertumbuhan Spesifik Harian
Laju pertumbuhan spesifik harian (specific growth rate/SGR) dihitung menggunakan rumus Ricker (1958):
SGR = ((Ln Wt−Ln W0)/t) x100% Keterangan:
SGR = Laju pertumbuhan spesifik (%hari)
Wt = bobot rata-rata pada akhir perlakuan (gram) W0 = bobot rata-rata pada awal perlakuan (gram) t = lama pemeliharaan
Tingkat Konversi Pakan
Tingkat konversi pakan (feed conversion ratio/FCR) dihitung selama 25 hari pemeliharaan. Tingkat konversi pakan dihitung menggunakan rumus Zonneveld et al. (1991):
FCR = F
(Bt−Bo )+Bm Keterangan:
FCR : Tingkat konversi pakan Bm : Bobot ikan mati (gram) Bt : Bobot ikan akhir (gram) F : Jumlah pakan (gram) Bo : Bobot ikan awal (gram)
Respiratory Burst Activity
Respiratory burst acitivity merupakan oksigen radikal yang dikeluarkan oleh makrofag dan neutrofil yang bersifat toksik terhadap patogen (Irianto 2005). Uji ini berfungsi untuk mengetahui jumlah oksigen radikal yang dikeluarkan oleh sel-sel fagositik. Pengujian respiratory burst activity dilakukan menggunakan metode Secombes (1990) yang dimodifikasi oleh Stasiak dan Bauman (1996) (Lampiran 3).
Lisozim
6
Konsentrasi lisozim (UI/ml/menit) = [(OD30s – OD4.5m) x 1000] x (1/(t x s)) Keterangan:
1000 = Konversi hasil absorbansi (OD) menjadi unit internasional (UI) t = waktu (menit)
s = jumlah plasma (ml)
OD30s = Pembacaan optikal densitas detik ke-30 OD4.5m = Pembacaan optikal densitas menit ke-4.5
Histopatologi
Histopatologi adalah ilmu yang menelusuri penyakit secara mikroskopik dimana informasi yang diperoleh berupa gambaran perubahan organ atau jaringan (Pazra 2008). Metode yang digunakan, yaitu metode Humason (1967) yang terdapat pada Lampiran 5. Organ yang digunakan dalam histopatologi adalah hati dan ginjal.
Hasil histopatologi dianalisis secara deskriptif, yaitu berdasarkan jumlah kerusakan pada organ ikan uji. Jika jumlah kerusakan organ hanya di satu tempat (fokal), di beberapa tempat (multifokal), dan di semua tempat (difus) maka diberi tanda +, ++, +++ (Adinata et al. 2012).
Kualitas Air
Kualitas air yang diamati, yaitu suhu, DO, pH, nitrit, nitrat, TAN, dan ammonia. Suhu, DO, pH diukur setiap hari, sedangkan nitrit, nitrat, dan TAN diukur satu minggu sekali. Nilai TAN dikonversi menjadi ammonia melalui rumus dari El shafai et al. (2004).
Nilai pKa = 0.09018+2729.92 suhu +273
Nilai ammonia
=
nilai TAN 1+10��������−��
Tabel 3 di bawah ini merupakan parameter untuk mengukur kualitas air dan satuannya.
Tabel 3 Parameter kualitas air, satuan, dan alat ukur selama pemeliharaan
Parameter Satuan Alat ukur
Suhu °C DO meter
DO mg/l DO meter
pH - pH meter
nitrit mg/l Spektrofotometer
nitrat mg/l Spektrofotometer
TAN mg/l Spektrofotometer
Analisis Data
7
HASIL DAN PEMBAHASAN
Hasil Kelangsungan Hidup
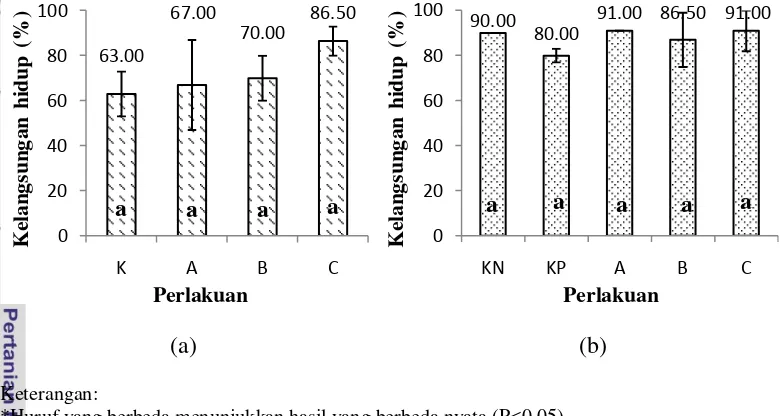
Data kelangsungan hidup ikan uji pada prauji tantang dan pascauji tantang diuji statistik pada Lampiran 6a dan 6b. Nilai kelangsungan hidup ikan uji disajikan pada Gambar 2.
(a) (b) Keterangan:
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
**K (kontrol), KN (kontrol negatif), KP (kontrol positif), A (dosis 25 gram/kg pakan), B (dosis 50 gram/kg pakan), C (dosis 200 gram/kg pakan)
Gambar 2. Kelangsungan hidup ikan nila (a) prauji tantang dan (b) pascauji tantang
Berdasarkan Gambar 2, kelangsungan hidup ikan uji pra dan pascauji tantang pada semua perlakuan tidak memiliki nilai yang berbeda nyata (P>0.05). Dari data ini menunjukkan bahwa penambahan simplisia rimpang temulawak tidak berpengaruh terhadap kelangsungan hidup ikan uji pra dan pascauji tantang.
Laju Pertumbuhan Spesifik Harian
Laju pertumbuhan spesifik harian (specific growth rate/SGR) dihitung selama 25 hari. Gambar 3 merupakan grafik laju pertumbuhan spesifik harian selama prauji tantang.
8
Keterangan
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
**K (kontrol), A (dosis 25 gram/kg pakan), B (Dosis 50 gram/kg pakan), C (Dosis 200 gram/kg pakan)
Gambar 3. Laju pertumbuhan spesifik harian (specific growth rate/SGR) ikan nila prauji tantang
Berdasarkan Gambar 3, SGR semua perlakuan memiliki nilai yang berbeda nyata (P<0.05) (Lampiran 7). Nilai SGR dari yang tertinggi hingga terendah, yaitu perlakuan K (3.08%), A (2.79%), B (2.53%), dan C (1.51%).
Tingkat Konversi Pakan
Tingkat konversi pakan (feed conversion ratio/FCR) ikan uji dihitung selama 25 hari. Nilai FCR disajikan pada Gambar 4.
Keterangan
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
**K (kontrol), A (dosis 25 gram/kg pakan), B (Dosis 50 gram/kg pakan), C (Dosis 200 gram/kg pakan)
Gambar 4. Tingkat konversi pakan (feed conversion ratio/FCR) ikan nila prauji tantang
Berdasarkan Gambar 4, perlakuan K (1.29), A (1.30), dan B (1.33) memiliki nilai FCR yang berbeda nyata (P<0.05) dengan perlakuan C (1.44) (Lampiran 8).
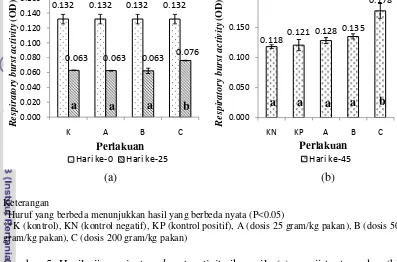
9 Respiratory Burst Activity
Data respiratory burst activity selama pemeliharaan diuji statistik pada Lampiran 9a dan 9b. Gambar 5 merupakan hasil uji respiratory burst activity.
(a) (b)
Keterangan
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
**K (kontrol), KN (kontrol negatif), KP (kontrol positif), A (dosis 25 gram/kg pakan), B (dosis 50 gram/kg pakan), C (dosis 200 gram/kg pakan)
Gambar 5. Hasil uji respiratory burst activity ikan nila (a) prauji tantang dan (b) pascauji tantang
Berdasarkan Gambar 5, semua perlakuan pada hari ke-0 memiliki nilai NBT 0.132 OD. Pada hari ke-25 perlakuan K, A, dan B memiliki nilai respiratory burst activity yang sama (0.063 OD) dan berbeda nyata (P<0.05) dengan perlakuan C, yaitu 0.076 OD. Hari ke-45, nilai respiratory burst activity perlakuan KN (0.118 OD), KP (0.121 OD), A (0.128 OD), dan B (0.135 OD) memiliki nilai yang berbeda nyata (P<0.05) dengan perlakuan C (0.178 OD).
Lisozim
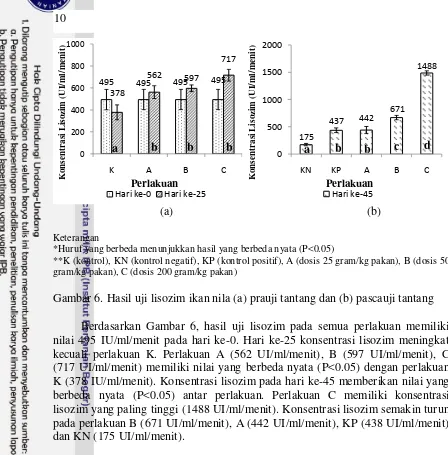
Data lisozim ikan uji selama pemeliharaan diuji statistik pada Lampiran 10a dan 10 b. Konsentrasi lisozim ikan uji disajikan pada Gambar 6.
0.132 0.132 0.132 0.132
0.063 0.063 0.063 0.076
0.000
Hari ke-0 Hari ke-25
10
(a) (b) Keterangan
*Huruf yang berbeda menunjukkan hasil yang berbeda nyata (P<0.05)
**K (kontrol), KN (kontrol negatif), KP (kontrol positif), A (dosis 25 gram/kg pakan), B (dosis 50 gram/kg pakan), C (dosis 200 gram/kg pakan)
Gambar 6. Hasil uji lisozim ikan nila (a) prauji tantang dan (b) pascauji tantang Berdasarkan Gambar 6, hasil uji lisozim pada semua perlakuan memiliki nilai 495 IU/ml/menit pada hari ke-0. Hari ke-25 konsentrasi lisozim meningkat kecuali perlakuan K. Perlakuan A (562 UI/ml/menit), B (597 UI/ml/menit), C (717 UI/ml/menit) memiliki nilai yang berbeda nyata (P<0.05) dengan perlakuan K (378 IU/ml/menit). Konsentrasi lisozim pada hari ke-45 memberikan nilai yang berbeda nyata (P<0.05) antar perlakuan. Perlakuan C memiliki konsentrasi lisozim yang paling tinggi (1488 UI/ml/menit). Konsentrasi lisozim semakin turun pada perlakuan B (671 UI/ml/menit), A (442 UI/ml/menit), KP (438 UI/ml/menit), dan KN (175 UI/ml/menit).
Histopatologi
Berikut ini merupakan hasil histopatologi ikan uji yang disajikan pada Tabel 4.
Tabel 4 Hasil analisis histopatologi organ ikan uji
Sampel Organ
Ginjal Hati
H0 Hiperplasia +, Hemoragi
++, Degenerasi ++
Nekrosis +
K H25 Degenerasi ++ Kongesti +, Hemoragi ++
C H25 Hiperplasia ++, Hemoragi ++, Nekrosis ++
Kongesti +, Hemoragi ++
K H45 Hiperplasia +, Hemoragi ++, Nekrosis +++
Kongesti ++, Hemoragi ++
C H45 Hemoragi ++, Nekrosis
+++
Kongesti ++, Hemoragi ++, Nekrosis ++
Keterangan
*H0 (hari ke-0), H25 (hari ke-25), H45 (hari ke-45), K (kontrol), C (dosis 200 gram/kg pakan), + (fokal/satu tempat), ++ (multifokal/beberapa tempat), +++ (difus/semua tempat)
495 495 495 495
378
Hari ke-0 Hari ke-25
11 Tabel 4 menunjukkan bahwa tingkat kerusakan organ ginjal dan hati pada perlakuan K dan C hari ke-25 di beberapa tempat (multifokal). Organ ginjal pada hari ke-0 mengalami kerusakan yang hampir sama dengan ginjal pada perlakuan C hari ke-25. Organ hati pada perlakuan K dan C hari ke-25 mengalami kerusakan yang sama. Pada perlakuan C hari ke-45, organ ginjal dan hati mengalami kerusakan yang lebih parah dibandingkan perlakuan C hari ke-25, yaitu terdapat nekrosis (Lampiran 11).
Kualitas Air
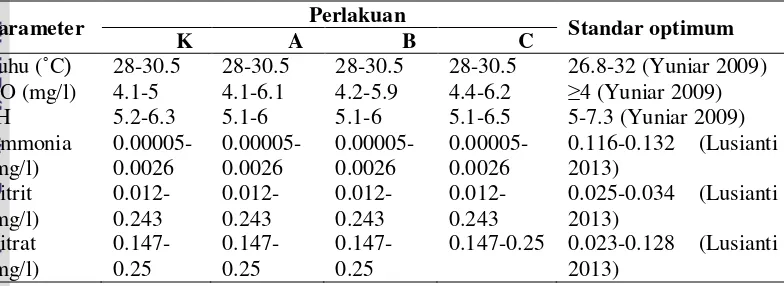
Data kisaran kualitas air ikan uji selama prauji tantang disajikan pada Tabel 5.
Tabel 5 Kisaran kualitas air dalam media pemeliharan ikan nila selama prauji tantang
Parameter Perlakuan Standar optimum
K A B C
0.147-0.25 0.023-0.128 (Lusianti 2013)
Keterangan
*K (kontrol), A (dosis 25 gram/kg pakan), B (Dosis 50 gram/kg pakan), C (Dosis 200 gram/kg pakan)
Berdasarkan Tabel 5, suhu, DO, dan pH berkisar antara 28-30.5˚C, 4.1-6.2 mg/l, dan 5.1-6.5. Semua perlakuan memiliki kisaran nilai ammonia, nitrit, dan nitrat yang sama, yaitu 0.00005-0.0026 mg/l, 0.012-0.243 mg/l, dan 0.147-0.25 mg/l. Semua parameter kualitas air memiliki nilai yang masih berada dalam kisaran normal, kecuali parameter nitrit.
Pembahasan
Penelitian tentang penggunaan fitofarmaka telah banyak dilakukan dalam kegiatan akuakultur untuk mengendalikan penyakit pada ikan. Penelitian ini menggunakan simplisia rimpang temulawak yang dicampurkan dalam pakan. Penggunaan fitofarmaka yang dicampurkan ke pakan yang telah dibentuk ulang dianggap lebih praktis dalam pemberiannya pada ikan karena dapat disimpan dalam jangka waktu yang relatif lama dan dapat digunakan oleh sejumlah ikan (Sartika 2011).
12
konsentrasi nitrit yang tinggi selama pemeliharaan. Konsentrasi nitrit yang tinggi disebabkan oleh penumpukan bahan organik dalam wadah baik dari sisa metabolisme ikan maupun sisa pakan yang terbuang (Djokosetiyanto et al. 2006). Faktor biologi yang berpengaruh adalah kualitas ikan yang tidak sehat. Ikan uji yang digunakan bukan benih yang SPF (specific-pathogen free) sehingga patogen tertentu dapat muncul kapan saja saat kondisi ikan stres.
Perlakuan KN (90.00%), KP (80.00%), A (91.00%), B (86.50%), dan C (91.00%) pada pascauji tantang memiliki nilai kelangsungan hidup yang tidak berbeda nyata (P>0.05). Ikan uji diuji tantang menggunakan bakteri S. agalactiae dengan volume 0.2 ml/ekor dan kepadatan sel 4.0x109 CFU/ml tetapi kelangsungan hidup ikan uji masih di atas 50% pada semua perlakuan. Bakteri S. agalactiae yang digunakan untuk uji tantang diduga bukan strain yang memiliki patogenitas yang tinggi. Ikan nila yang diinjeksi S. agalactiae dengan kepadatan sel 1.0x106 CFU/ml mengalami kematian 50% (Aryanto 2011). Kematian ikan yang diuji tantang menunjukkan gejala klinis (Lampiran 12) yang sama seperti ikan nila pada penelitian Hardi (2011), yaitu ikan nila mengalami opacity, eksoptalmia, pola renang abnormal (whirling), dan warna tubuh menjadi hitam.
Penambahan simplisia dari rimpang temulawak dalam pakan dengan berbagai dosis mempengaruhi laju pertumbuhan spesifik harian ikan uji selama pemeliharaan. Hasil SGR yang diperoleh menunjukkan nilai yang berbeda nyata (P<0.05) pada semua perlakuan. SGR perlakuan K (3.08%) memiliki nilai yang paling tinggi diantara perlakuan lainnya. Perlakuan C (1.51%) memiliki nilai SGR yang paling rendah. Hal ini diduga disebabkan adanya zat antinutrisi yang terkandung dalam rimpang temulawak. Tanin dan saponin ditemukan pada uji fitokimia ekstrak etanol rimpang temulawak (Kuntorini et al. 2011). Tanin menyebabkan gangguan pada proses kecernaan makanan dalam saluran pencernaan. Saponin meningkatkan permeabilitas sel mukosa usus halus yang menghambat transport nutrisi aktif dan menyebabkan penyerapan zat nutrisi dalam saluran pencernaan terganggu (Santoso 2008). Persentase tanin yang mencapai 1.35% dapat menurunkan bobot ayam broiler (Istirahayu 1993). Pada penelitian ini, diduga saponin dan tanin sebagai zat antinutrisi yang mengakibatkan ikan pada perlakuan C memiliki SGR terendah. Pada perlakuan K memiliki SGR yang paling tinggi dibandingkan perlakuan lain karena pada perlakuan K tidak ada saponin dan tanin dari rimpang temulawak sehingga semua pakan dapat tercerna dengan baik.
Tingkat konversi pakan pada perlakuan K (1.29), A (1.30), dan B (1.33) memiliki nilai FCR yang berbeda nyata (P<0.05) dengan perlakuan C (1.44). Hasil yang diperoleh menunjukkan bahwa perlakuan C memiliki nilai FCR yang paling tinggi. Nilai FCR yang tinggi disebabkan karena bobot ikan yang rendah. Hal ini dapat dilihat pada data SGR perlakuan C yang memiliki nilai SGR paling rendah. Kusriani et al. (2012) menyatakan bahwa penurunan laju pertumbuhan spesifik harian pada ikan mas yang diberi perlakuan pestisida Diazinon 60 EC mengakibatkan tingginya nilai rasio konversi pakan. Rendahnya bobot ikan uji pada perlakuan C disebabkan karena adanya zat antinutrisi yang lebih tinggi dalam pakan perlakuan simplisia rimpang temulawak.
13 laktoferin. Sistem imun spesifik meliputi sel T dan sel B (Iwama dan Nakanishi 1996).
Respiratory burst acitivity merupakan oksigen radikal yang dikeluarkan oleh makrofag dan neutrofil yang bersifat toksik terhadap patogen. Tahapan oksigen radikal terjadi karena pembentukan anion superoksida (O2-) oleh NADPH-oksidase. Oksigen radikal yang bersifat toksik dengan cepat diubah menjadi hidrogen peroksida (H2O2) yang memiliki sifat bakterisidal kuat dan memungkin oksigen radikal ini diubah menjadi hidroksi radikal (OH-) yang mampu mendegradasi membran lipid (Irianto 2005).
Respiratory burst acitivity hari ke-0 pada semua perlakuan memiliki nilai sebesar 0.132 OD. Perlakuan K, A, dan B prauji tantang (hari ke-25) memiliki nilai yang sama (0.063 OD) dan berbeda nyata (P<0.05) dengan perlakuan C (0.076 OD). Pascauji tantang (hari ke-45), perlakuan KN (0.118 OD), KP (0.121 OD), A (0.128 OD), dan B (0.135 OD) memiliki nilai yang berbeda nyata (P<0.05) dengan perlakuan C (0.178 OD). Perlakuan C memiliki nilai respiratory burst acitivity yang lebih tinggi daripada semua perlakuan baik pada hari ke-25 maupun 45. Hal ini disebabkan karena perlakuan C memiliki kandungan bahan aktif dari rimpang temulawak yang lebih banyak daripada perlakuan yang lain.
Temulawak mengandung kurkumin yang merupakan senyawa fraksi dari kurkuminoid yang memiliki aktivitas antiinflamasi, antiviral, antitumor, hipokolesterolemik, dan antihepatotoksik (Paryanto dan Srijanto 2006). Pemberian kurkumin dalam ekstrak temulawak 10.4 mg dapat mengaktifkan makrofag untuk meningkatkan sistem kekebalan tubuh pada tikus percobaan (Mardiawan 2006). Penurunan nilai respiratory burst activity pada hari ke-0 menuju ke hari 25 (prauji tantang) mengindikasikan adanya kontaminan dan infeksi yang kronis atau ikan sedang mengalami kondisi stres (Hastuti 2012). Hal ini dibuktikan dengan rendahnya nilai kelangsungan hidup ikan prauji tantang pada semua perlakuan.
Lisozim merupakan enzim hidrolitik yang terdapat di dalam lendir, serum, dan sel-sel fagositik dari berbagai spesies ikan (Ellis 1990). Gopalakannan (2006) menyatakan bahwa lisozim merupakan enzim kationik yang memutuskan ikatan P-1,4-glycosidic antara asam N-acetylmuramic dan N-acetyl glucosamine pada peptidoglikan dinding sel bakteri. Pemutusan ikatan ini digunakan sebagai serangan untuk bakteri Gram positif dan juga beberapa Gram negatif.
14
dengan dosis 10 g/kg pakan dapat meningkatkan respon imun non spesifik pada udang vanamei (Litopennaeus vannamei) (Setyati et al. 2007).
Parameter histopatologi digunakan sebagai parameter pendukung untuk melihat efek perlakuan atau kontrol pada jaringan ginjal dan hati ikan uji selama 25 dan 45 hari pemeliharaan. Pengamatan preparat histopatologi ginjal pada hari ke-0 mengalami kerusakan yang hampir sama dengan ginjal pada perlakuan C H25. Hal ini menandakan bahwa ikan uji yang digunakan untuk penelitian ini memiliki kualitas yang buruk. Ginjal ikan uji perlakuan C H25 mengalami kerusakan yang lebih parah dibandingkan perlakuan K H25 dengan adanya kerusakan nekrosis di beberapa tempat. Nekrosis adalah kerusakan jaringan yang berat karena bersifat irreversible. Jaringan yang mengalami nekrosis ditandai dengan pemudaran warna jaringan dari warna normal dan hilangnya jaringan tersebut (Price dan Wilson 2006). Temulawak menyebabkan kerusakan pada ginjal dan hati ikan uji tetapi tidak menyebabkan kematian. Perlakuan C hari ke-45 (pasca uji tantang) memiliki tingkat kerusakan ginjal dan hati yang lebih parah daripada perlakuan C hari ke-25. Infeksi S. agalactiae mempengaruhi metabolisme dan proses enzimatis dalam sel yang menyebabkan terjadinya degenerasi dan nekrosis pada tubulus ginjal (Hardi 2011).
Selama pemeliharaan ikan nila, suhu, DO, dan pH pada media pemeliharaan berkisar antara 28-30.5°C, 4.1-6.2 mg/l, dan 5.1-6.5. Parameter kualitas air ini sesuai dengan pernyataan Yuniar (2009), ikan nila hidup pada kondisi lingkungan yang memiliki kisaran suhu 26.8-32°C, oksigen terlarut ≥4 mg/l, dan pH 5-7.3. Kadar nitrat dalam media pemeliharaan ikan uji berkisar antara 0.147-0.25 mg/l. Kadar nitrat berkisar antara 0.023-0.128 mg/l pada penelitian Lusianti (2013). Kadar nitrit mengalami kenaikan setelah minggu ke-0 yang berkisar antara 0.012-0.243 mg/l. Kadar nitrit dalam penelitian ini lebih tinggi dari kadar nitrit dalam penelitian Lusianti (2013) yang berkisar antara 0.025-0.034 mg/l. Hal ini diduga menjadi penyebab tingginya tingkat stres pada ikan sehingga mengalami kematian yang tinggi pada prauji tantang. Kadar ammonia dalam penelitian ini berkisar antara 0.00005-0.0026 mg/l. Nilai ini masih berada pada kisaran normal, yaitu 0.116-0.132 mg/l (Lusianti 2013).
KESIMPULAN DAN SARAN
Kesimpulan
15
Saran
Penelitian selanjutnya disarankan untuk menggunakaan metode perendaman. Pakan perlakuan perlu dilakukan pengujian proksimat untuk mengetahui kandungan pakan setelah dibentuk ulang.
DAFTAR PUSTAKA
Adinata MO, Sudira IW, Berata IK. 2012. Efek ekstrak daun ashitaba (Angelica keiskei) terhadap gambaran histopatologi ginjal mencit (Mus musculus) jantan. Buletin Veteriner Udayana 4(2):55-62.
Aryanto EW. 2011. Patogenesitas Streptococcus agalactiae pada ikan nila (Oreochromis niloticus). [skripsi]. Bogor (ID). Institut Pertanian Bogor. Dernuet SR. 1995. Antibiotiques et antibiogrammes. Canada (US): Donnees de
catalogage avant publication.
Dewoto HR. 2007. Pengembangan obat tradisional Indonesia menjadi fitofarmaka. Majalah Kedokteran Indonesia 57(7):205-211.
Djokosetiyanto D, Sunarma A, Widanarni. 2006. Perubahan ammonia (NH3-N), nitrit (NO2-N) dan nitrat (NO3-N) pada media pemeliharaan ikan nila merah (Oreochromis sp.) di dalam sistem resirkulasi. Jurnal Akuakultur Indonesia 5(1):13-20.
Effendie MI. 1997. Biologi Perikanan. Yogyakarta (ID): Yayasan Pustaka Nusantara.
Ellis EA. 1990. Techniques in Fish Immunology. USA: Sos. Publications, Fair Haven.
El-Shafai SA, El-Gohary FA, Nasr FA, Steen PV, Gijzen HJ. 2004. Microbial quality of tilapia reared in fecal contaminated ponds. Journal Environmental Research 95:231–238.
Farouq A. 2011. Aplikasi probiotik, prebiotik, dan sinbiotik dalam pakan untuk meningkatkan respon imun dan kelangsungan hidup ikan nila (Oreochromis niloticus) yang diinfeksi Streptococcus agalactiae. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Febriansyah TR. 2013. Efikasi vaksin sel utuh Streptococcus agalactiae pada ikan nila (Oreochromis niloticus) melalui perendaman. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Gopalakannan A. 2006. Studies on the control of Aeromonas hydrophila infection in Cyprinus carpio and Tilapia Mossambicus by immunostimulants and probiotics. [tesis]. Pondicherry University. India.
Hardi EH. 2011. Kandidat vaksin potensial Streptococcus agalactiae untuk pencegahan penyakit Streptococcosis pada ikan nila (Oreochromis niloticus). [disertasi]. Bogor (ID). Institut Pertanian Bogor.
16
Hastuti SD. 2012. Suplementasi β-glucan dari ragi roti (Saccharomyces cerevisiae) dalam pakan terhadap aktivitas fagositosis, aktivitas NBT, total protein plasma dan aktivitas aglutinasi darah ikan nila (Orechromis niloticus). Depik. 1(3):149-155.
Hernandez E, Figueroa J, Ireguei C. 2009. Streptococcosis on red tilapia, (Oreochromis sp). Journal of Fish Disease 32:247-257.
Hidayatullah D. 2013. Efikasi vaksin dengan metode infiltrasi hiperosmotik untuk mencegah infeksi bakteri Streptococcus agalactiae pada ikan nila. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Humason G. 1967. Animal Tissues Techniques-2d ed. San Fransisico (US): W. H. Freeman.
Irianto A. 2005. Patologi Ikan Teleostei. Yogyakarta (ID): Gadjah Mada University Press.
Istirahayu DN. 1993. Pengaruh penggunaan ampas teh dalam ransum terhadap persentase karkas, giblet, limpa dan lemak abdominal broiler. Karya Ilmiah. Bogor (ID). Institut Pertanian Bogor.
Iwama G, Nakanishi T. 1996. The Fish Immune System: Organism, Pathogen, and Environment. USA: Academic Press, Inc.
Kristina NN, Bermawie N, Rahardjo M, Darwati I, Purwiyanti S, Lukman W, Sugandi T, Suryatna, Hendar, Ramdhan. 2010. Evaluasi 15 aksesi temulawak berdasarkan indikator geografis untuk meningkatkan produksi >20%. Laporan Teknis Penelitian. Balai Penelitian Tanaman Obat dan Aromatik. Bogor.
Kuntorini EM, Astuti MD, Milina N. 2011. Struktur anatomi dan kerapatan sel sekresi serta aktivitas antioksidan ekstrak etanol dari rimpang temulawak (Curcuma xanthorrhiza Roxb.) asal Kecamatan Pengaron Kabupaten Banjar Kalimantan Selatan. Bioscientiae 8(1):28-37.
Kusriani, Widjanarko P, Rohmawati N. 2012. Uji pengaruh sublethal pestisida Diazinon 60 EC terhadap rasio konversi pakan (FCR) dan pertumbuhan ikan mas (Cyprinus carpio L). Jurnal Penelitian Perikanan 1(1): 36-42. Listyanti AF. 2011. Aplikasi sinbiotik melalui pakan pada ikan nila merah
(Oreochromis niloticus) yang diinfeksi Streptococcus agalactiae. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Lusianti F. 2013. Efektifitas penggunaan sekam padi, jerami padi dan serabut kayu sebagi filter dalam sistem filter undergravel pada pemeliharaan ikan nila BEST (Oreochromis sp.) [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Lusiastuti AM. 2010. Isolasi bakteriofaga anti Streptococcus agalactiae dari ikan nila (Oreochromis niloticus). Jurnal Riset Akuakultur 5(2): 237-243. Mangunwardoyo W, Deasywaty, Usia T. 2012. Antimicrobial and identification
of active compound Curcuma xanthorriza Roxb. International Journal of Basic and Applied Sciences 12 (1):69-78.
17 Noga EJ. 2000. Fish Disease: Diagnosis and Treatment. Iowa: Iowa State
University Press.
Paryanto I, Srijanto B. 2006. Ekstraksi kurkuminoid dari temulawak (Curcuma xanthorrhiza Roxb.) secara perkolasi dengan pelarut etanol. Jurnal Ilmu Kefarmasian Indonesia 4(2):74-77.
Pazra DF. 2008. Gambaran histopatologi insang, otot, dan usus pada ikan lele (Clarias spp.) asal dari daerah Bogor. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Price SA, Wilson LM. 2006. Patofisiologi-Edisi VI, Volume I. Philadelphia: EGC. Rahardjo M, Rostiana O. 2003. Standar prosedur operasional budidaya temulawak
Sirkular No.8. Laporan Teknis Penelitian. Bogor (ID). Balai Penelitian Tanaman Obat dan Aromatik.
Ricker WE. 1958. Handbook Of Computations For Biological Statistics Of Fish Populations. Ottawa: Fisheries Research Board Of Canada.
Santoso RA. 2013. Aplikasi berbagai dosis bakteri proteolitik L1k dalam pakan untuk pengendalian Streptococcosis pada ikan nila (Oreochromis niloticus) dengan metode kohabitasi. [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Santoso U. 2008. Pengaruh penambahan ekstrak daun katuk terhadap kualitas telur dan berat organ dalam. [skripsi]. Bengkulu (ID). Universitas Bengkulu.
Sartika Y. 2011. Efektivitas fitofarmaka dalam pakan untuk pencegahan infeksi bakteri Aeromonas hydrophila pada ikan lele dumbo (Clarias sp.) [skripsi]. Bogor (ID). Institut Pertanian Bogor.
Secombes CJ. 1990. Isolation of salmonid macrophages and analysis of their killing activity. Di dalam Techniques of Fish Immunology-I. Fair Haven (US): Sos. Publications.
Setyati WA, Subagiyo, Slamet S. 2007. Pengaruh suplementasi ekstrak herbal (jahe, temulawak, dan kencur) terhadap jumlah total hemosit dan aktifitas fagositosis udang putih (Litopenaeus vannamei). Journal Aquaculture Indonesiana. 8 (3):155-161.
Stasiak SA, Bauman PC. 1996. Neutrophil activity as a potential bioindicator for contaminant analysis. Journal of Fish Shellfish Immune 6:537-539. Yuasa K, Kamaishi T, Hatai K, Bahnnan M, Borisuthpeth P. 2008. Two cases of
streptococcal infections of cultured tilapia in Asia. Deseases in Asian Aquaculture VI. pp. 259-268.
Yuniar V. 2009. Toksisitas merkuri (Hg) terhadap tingkat kelangsungan hidup, pertumbuhan, gambaran darah, dan kerusakan organ pada ikan nila (Oreochromis niloticus). [skripsi]. Bogor (ID). Institut Pertanian Bogor.
18
LAMPIRAN
Lampiran 1 Komponen penyusun rimpang temulawak (Curcuma xanthorrhiza)
Komponen Jumlah (%)
Pati 31.23-53.61
Kadar air 4.8-8.9
Kadar abu 4.34-7.68
Kurkumin 0.79-2.24
Minyak atsiri 5.03-7.87 Xanthorrizol 0.38-2.94
Sumber: Kristina et al. (2010)
Lampiran 2 Ikhtisar berbagai penelitian penanganan bakteri Streptococcus agalactiae
Pencegahan Ikan nila (Oreochromis
Pencegahan Ikan nila (Oreochromis antara sel utuh dan ECP ml/ekor di awal pemeliharaan
19 Lampiran 2 Lanjutan
Autor
diberikan 3 kali sehari secara at satiation
Listyanti (2011)
Pencegahan Ikan nila merah
diberikan 3 kali sehari secara at satiation
Febriansyah (2013)
Pencegahan Ikan nila (Oreochromis
20
Lampiran 2 Lanjutan
21 Lampiran 3 Prosedur pengujian respiratory burst activity
Lampiran 4 Prosedur pengujian lisozim
Larutan bakteri dibuat dengan cara mencampurkan 0.02 gram Micrococcus lysodeikticus dan 0.6 gram NaH2PO4 dalam 100 ml akuades steril pada suhu 25°C.
Darah 50 μlmikroplate (3x ulangan/sampel)
Inkubasi (37°C, 1 jam)
Bilas PBS 100 µl (3x)
Tambah NBT 0,2% (50 µl) dan inkubasi (37°C , 1 jam)
Fiksasi metanol 100% (100 µl, 2-3 menit). Metanol 30% (100 µl), bilas 3x
Tambah 60 µl KOH dan 70 µl dimethyl sulphoxide
Baca dengan ELISA readertipe Biotek instruments ELx808 (λ540 nm)
Darah 150 μl(sentrifugasi 3000 rpm, 5 menit)
Plasma (10 µl) + larutan bakteri Micrococcus lysodeikticus190 µl
22
Lampiran 5 Prosedur histopatologi
Lampiran 6a Analisis statistik kelangsungan hidup ikan nila prauji tantang Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. 3.081E15 3 4 .000 CV (KK) = 23.15%
Duncana
Perlakuan
N
Subset for alpha = 0.05
1 0 2 63.0000 25 2 67.0000 50 2 70.0000 200 2 86.5000 Sig. .265
Pengambilan ginjal dan hati ikan
Fiksasi: NBF 10% (24-48 jam)
Dehidrasi: Alkohol 70% (24 jam). Alkohol 80%, 90%, 95% (2 jam). Alkohol 100% (24 jam)
Clearing: Xylol 1 (30 menit), xylol 2 (1 jam), xylol 3 (1.5 jam)
Embedding(blocking): Parafin cair (2x perendaman, 2 jam). Jaringan dicetak dalam cetakan khusus
Pemotongan: Jaringan dipotong dengan mikrotom (4-5 µm). Jaringan diletakkan dalam waterbath (37°C). Jaringan diangkat dengan kaca preparat
Hidrasi: Xylol 1 dan 2 (2 menit). Alkohol 100% (2 menit). Alkohol 95% dan 80% (1 menit). Air bersih (1 menit)
Pewarnaan: Haematoxyllin (10 menit). Air bersih (30 detik). Eosin (2-3 menit). Air bersih (30-60 detik)
Dehidrasi: Alkohol 95% (2 menit). Alkohol absolut 1 (10 celupan). Alkohol absolut 2 (2 menit)
23 Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 2.000.
Lampiran 6b Analisis statistik kelangsungan hidup ikan nila pascauji tantang Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. 6.602E15 4 5 .000 CV (KK) = 10.20%
Duncana
Perlakuan
N
Subset for alpha = 0.05
1 2 2 80.00 50 2 86.50 1 2 90.00 25 2 91.00 200 2 91.00 Sig. .351
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 2.000.
Lampiran 7 Analisis statistik laju pertumbuhan spesifik harian ikan nila selama 25 hari
Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. 2.388 3 8 .145 Duncana
Perlakuan
N
Subset for alpha = 0.05
1 2 3 4 200 3 1.51
50 3 2.53
25 3 2.79
0 3 3.08
Sig. 1.000 1.000 1.000 1.000
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 8 Analisis statistik tingkat konversi pakan ikan nila selama 25 hari Test of Homogeneity of Variances
24
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 9a Analisis statistik respiratory burst activity ikan nila pada hari ke-25 Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig.
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 9b Analisis statistik respiratory burst activity ikan nila pada hari ke-45 Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig.
25 Lampiran 10a Analisis statistik lisozim ikan nila pada hari ke-25
Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. .623 3 8 .620
Duncana
Perlakuan
N
Subset for alpha = 0.05
1 2 0 3 378.33
25 3 561.67
50 3 597.33
200 3 716.67
Sig. 1.000 .093
Means for groups in homogeneous subsets are displayed. a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 10b Analisis statistik lisozim ikan nila pada hari ke-45 Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig. 1.184 4 10 .375
Duncana
Perlakuan
N
Subset for alpha = 0.05
1 2 3 4 1 3 175.00
2 3 437.33
25 3 441.67
50 3 670.67
200 3 1487.67
Sig. 1.000 .949 1.000 1.000
26
Lampiran 11 Gambar histopatologi organ ikan nila
Sampel Organ
Ginjal Hati
H0
Perbesaran 10x10 Perbesaran 4x10 K H25
Perbesaran 4x10 Perbesaran 4x10 C H25
Perbesaran 4x10 Perbesaran 4x10 K H45
Perbesaran 10x10 Perbesaran 4x10
H
27 Lampiran 11 Lanjutan
Sampel Organ
Ginjal Hati
C H45
Perbesaran 4x10 Perbesaran 4x10 Keterangan:
H0 : hari ke-0 H25 : hari ke-25 H45 : hari ke-45
K : kontrol (0 g/kg pakan) C : 200 g/kg pakan Hi : Hiperplasia He : Hemoragi Kg : Kongesti De : Degenerasi Ne : Nekrosis
28
RIWAYAT HIDUP
Penulis dilahirkan di Madiun, 10 Maret 1992 dari ayah Moch. Sobir dan ibu Aisyah Rini. Penulis merupakan anak kedua dari empat bersaudara. Pendidikan formal yang dilalui penulis adalah SMAN 1 Madiun dan lulus tahun 2010. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor dengan mayor Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan.