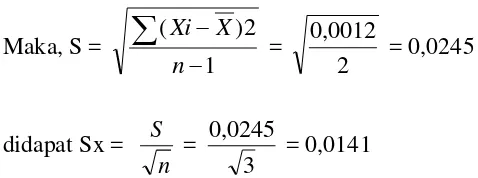STUDI PEMANFAATAN ZEOLIT ALAM AKTIF SEBAGAI
PENYERAP AMMONIA DIDALAM AKUARIUM
SEBAGAI MEDIUM BUDIDAYA
IKAN TAWAR
SKRIPSI
ROBERTA MARBUN 110802012
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
STUDI PEMANFAATAN ZEOLIT ALAM AKTIF SEBAGAI
PENYERAP AMMONIA DI DALAM AKUARIUM
SEBAGAI MEDIUM BUDIDAYA
IKAN TAWAR
SKRIPSI
Diajukanuntukmelengkapi tugasdanmemenuhisyaratmencapaigelarsarjanasains
ROBERTA MARBUN 110802012
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Studi Pemanfaatan Zeolit Alam Aktif Sebagai Penyerap Ammonia Didalam Akuarium Sebagai Media Budidaya Ikan Tawar
Kategori : Skripsi
Nama : Roberta Marbun
NIM : 110802012
Program : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di :
Medan, Juli 2015
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Jamahir Gultom, Ph.D Drs. Chairuddin, M.Sc
NIP. 195209251977031001 NIP. 195909171987011001
Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
STUDI PEMANFAATAN ZEOLIT ALAM AKTIF SEBAGAI PENYERAP AMMONIA DI DALAM AKUARIUM SEBAGAI MEDIUM
BUDIDAYA IKAN TAWAR
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2015
PENGHARGAAN
Segala pujian serta syukur penulis panjatkan kepada Allah Bapa di Surga, atas segala berkat dan rahmat terlebih atas cintaNya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi ini sebagai syarat untuk memperoleh gelar sarjana Kimia Universitas Sumatera Utara.
Dan dengan segala kerendahan hati, penulis mempersembahkan skripsi ini kepada Bapak tersayang J. Marbun dan Mama tersayang I.R Sibuea sebagai ucapan terima kasih yang tak mungkin sebanding dengan segala pengorbanan mereka dalam hidup penulis. Juga kepada keluarga besar yang telah memberikan dukungan moril dan doa restu kepada penulis terlebih atas segala harapan yang menjadi semangat bagi penulis selama masa perkuliahan sampai terselesaikannya skripsi ini.
Penulis juga mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Bapak Drs. Chairuddin , M.Sc selaku pembimbing I dan Bapak Jamahir Gultom , Ph.D selaku dosen pembimbing II yang penuh dengan kesabaran membimbing dan mengarahkan penulis selama melakukan penelitian hingga terselesaikannya skripsi ini.
2. Bapak Prof. Harlem Marpaung selaku Kepala Laboratorium Kimia Analitik FMIPA USU yang telah memberikan saran-saran kepada penulis 3. Ketua dan Sekretaris Departemen Kimia FMIPA USU, Ibu Dr.
Rumondang Bulan Nst, MS dan Bapak Dr. Albert Pasaribu yang turut memberikan pengarahan dan mensahkan skripsi ini.
4. Kepada keluarga besar Analitik FMIPA USU , Kak Tiwi selaku laboran dan kakak bagi penulis, K’Indah, K’Bella, K’Emil, K’Malem, K’Juli, K’Desta, Bg Royman, Bg Zul, Bg Beni, K’Dorkas, dan teman-teman terbaik penulis Andy, Wiwi, Bella, Emi, Fatya, serta adik-adik penulis Rosnani, Ruben, Dessi, Christina, Ranyco, Ayu dan Novi atas segala bantuan dan semangatnya serta kebersamaan yang berarti selama ini. 5. Kakak-abang stambuk 2008 yang tidak bisa disebutkan satu persatu,
teman-teman stambuk 2011 dan adik-adik paktikan atas doa dan semangatnya bagi penulis.
Semoga Tuhan selalu memberkati kita semua.
STUDI PEMANFAATAN ZEOLIT ALAM AKTIF SEBAGAI
PENYERAP AMMONIA DI DALAM AKUARIUM
SEBAGAI MEDIUM BUDIDAYA
IKAN TAWAR
ABSTRAK
Telah dilakukan studi pemanfaatan zeolit alam aktif sebagai penyerap ammonia didalam akuarium sebagai medium budidaya ikan tawar. Sampel air yang digunakan diambil dari permukaan Danau Toba, Pangururan Kabupaten Samosir. Zeolit alam Sarulla dihaluskan sampai berukuran 200 mesh dan diaktivasi secara fisika. Penentuan ammonia dilakukan dengan metode Nessler secara spektrofotometri pada panjang gelombang maksimum 410 nm. Dari hasil penelitian diperoleh penurunan pH dan kandungan ammonia dalam air setelah pemberian pakan ikan disebabkan oleh penyerapan zeolit alam aktif sampai pada hari ke sepuluh dengan konsentrasi ammonia yang diperoleh pada hari pertama dan hari kesepuluh adalah 1,2723 dan 2,4171 mg/L dengan persen penyerapan terbesar pada hari ke sepuluh yaitu 38,04 %.
STUDY OF USING NATURAL ZEOLITE ACTIVE AS
AMMONIA ADSORBENT IN AQUARIUM AS
THE FARMING MEDIUM FRESH FISH
ABSTRACT
The study of using natural zeolite active as ammonia adsorbent in aquarium as the farming medium fresh fish has been conducted. The water sample was taken from surface water of Toba Lake, Pangururan Kabupaten Samosir. Natural zeolite was refined untill measured 200 mesh and activated by physics. Determination of ammonia was performed spectrophotometrically with Nessler method at the maximum wavelength of 410 nm. The result of analysis of this study obtained that decrease in water pH and ammonia content in the water after feeding the fish is caused by the absorption of natural zeolite active until the tenth days which consentration of ammonia on the first and tenth day was 1,2168 and 2,4171 mg/L with the largest absorption percent on the day to ten is 38.04%.
DAFTAR ISI Bab 2. Tinjauan Pustaka 2.1. Amonia 5 2.2. Zeolit 7
Bab 3. Metodologi Penelitian
3.3.10 Pembuatan Kurva Kalibrasi Larutan Standar Ammonia 19
3.3.11 Pengukuran Contoh Air Akuarium 20
3.3.11.1 Pengukuran pH 20
3.3.11.2 Menghilangkan Flok pada Sampel 20
3.3.11.3 Penentuan Ammonia pada Contoh Air Akuarium 20
3.3.11.4 Penentuan Ammonia yang Diserap Zeolit Aktif 20
3.4. Bagan Penelitian 21
3.4.1. Pengolahan Zeolit 21
3.4.1.1 Preparasi Zeolit 21
3.4.1.2 Aktivasi Zeolit 21
3.4.2 Pembuatan Kurva Kalibrasi Larutan Standar Ammonia 22
3.4.3 Pengukuran pH 22
3.4.4 Penentuan Ammonia pada Contoh Air Akuarium 23
Bab 4 Hasil dan Pembahasan
4.1 Hasil Penelitian 25
4.2 Pengolahan Data 27
4.2.1 Pembuatan Kurva Kalibrasi Ammonia 27
4.2.2 Penentuan Koefisien Korelasi Ammonia 29
4.2.3 Penentuan Kandungan Ammonia di dalam Sampel 30
4.2.4 Penentuan Konsentrasi Ammonia di dalam Sampel dalam mg/L 30
4.2.5 Perhitungan Jumlah Ammonia Terserap 31
4.2.6 Persentase Penurunan Kandungan Ammonia dengan Menggunakan Zeolit Alam Aktif 32
4.3 Pembahasan 33
Bab 5 Kesimpulan dan Saran 5.1 Kesimpulan 35
5.2 Saran 35
Daftar Pustaka 36
DAFTAR TABEL
Nomor Judul Halaman
Tabel
4.1 Penentuan Absorbansi Larutan Standar Ammonia 25
4.2 Absorbansi Ammonia di dalam Contoh 26
4.3 Penurunan Persamaan Garis Regresi 28
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
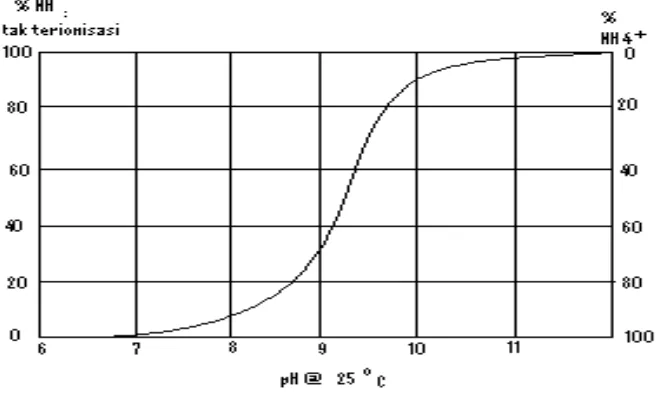
2.1 Hubungan (NH3) dan (NH4+) oleh pH 7
2.4 Reagen Nessler bereaksi dengan NH3 dalam larutan 14
yang bersifat basa
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
1 Data Hasil Penentuan Jumlah Ammonia yang
STUDI PEMANFAATAN ZEOLIT ALAM AKTIF SEBAGAI
PENYERAP AMMONIA DI DALAM AKUARIUM
SEBAGAI MEDIUM BUDIDAYA
IKAN TAWAR
ABSTRAK
Telah dilakukan studi pemanfaatan zeolit alam aktif sebagai penyerap ammonia didalam akuarium sebagai medium budidaya ikan tawar. Sampel air yang digunakan diambil dari permukaan Danau Toba, Pangururan Kabupaten Samosir. Zeolit alam Sarulla dihaluskan sampai berukuran 200 mesh dan diaktivasi secara fisika. Penentuan ammonia dilakukan dengan metode Nessler secara spektrofotometri pada panjang gelombang maksimum 410 nm. Dari hasil penelitian diperoleh penurunan pH dan kandungan ammonia dalam air setelah pemberian pakan ikan disebabkan oleh penyerapan zeolit alam aktif sampai pada hari ke sepuluh dengan konsentrasi ammonia yang diperoleh pada hari pertama dan hari kesepuluh adalah 1,2723 dan 2,4171 mg/L dengan persen penyerapan terbesar pada hari ke sepuluh yaitu 38,04 %.
STUDY OF USING NATURAL ZEOLITE ACTIVE AS
AMMONIA ADSORBENT IN AQUARIUM AS
THE FARMING MEDIUM FRESH FISH
ABSTRACT
The study of using natural zeolite active as ammonia adsorbent in aquarium as the farming medium fresh fish has been conducted. The water sample was taken from surface water of Toba Lake, Pangururan Kabupaten Samosir. Natural zeolite was refined untill measured 200 mesh and activated by physics. Determination of ammonia was performed spectrophotometrically with Nessler method at the maximum wavelength of 410 nm. The result of analysis of this study obtained that decrease in water pH and ammonia content in the water after feeding the fish is caused by the absorption of natural zeolite active until the tenth days which consentration of ammonia on the first and tenth day was 1,2168 and 2,4171 mg/L with the largest absorption percent on the day to ten is 38.04%.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Air merupakan salah satu senyawa kimia yang terdapat di alam secara
berlimpah-limpah. Namun, ketersediaan air yang memenuhi syarat bagi keperluan manusia
relatif sedikit karena dibatasi oleh berbagai faktor. Oleh karena itu, sumber daya
air harus dilindungi agar tetap dapat dimanfaatkan dengan baik oleh manusia serta
makhluk hidup lain. Kegiatan indutri , domestik dan kegiatan lain berdampak
negatif terhadap sumber daya air antara lain menyebabkan penurunan kualitas air
(Effendi, H. 2003).
Danau Toba merupakan suatu ekosistem air yang telah banyak mengalami
perubahan terutama akibat dari berbagai aktivitas manusia yang terdapat di sekitar
ekosistem air ini. Permasalahan yang dialami ekosistem Danau Toba terutama
adalah penurunan kualitas air akibat dari berbagai limbah yang dibuang ke dalam
danau sehingga menimbulkan pencemaran, seperti limbah rumah tangga, limbah
pertanian, limbah dari budidaya perikanan di dalam keramba serta limbah minyak
yang berasal dari aktivitas transportasi air (Barus, dkk., 2008).
Limbah amonia adalah salah satu permasalahan yang sering ditemui dalam
budidaya ikan. Budidaya ikan secara intensif dengan peningkatan padat
penyebaran dan peningkatan pemakaian pakan buatan kaya protein menyebabkan
meningkatnya limbah nitrogen toksik dan fosfat. Limbah nitrogen toksik dan
fosfat pada perairan budidaya umumnya berasal dari sisa pakan yang tidak
termakan dan feses ikan. Selama satu periode pemeliharaan ikan secara tidak
langsung selalu diperoleh limbah sisa-sisa pakan dan kotoran ikan . Limbah
nitrogen toksik dalam perairan pada umumnya dalam bentuk amonia atau nitrat
Kadar amonia pada perairan biasanya kurang dari 0,1 mg/L ( Mc Neely et
al., 1979). Kadar amonia bebas yang tidak terionisasi (NH3) pada perairan tawar
sebaiknya tidak lebih dari 0,02 mg/L. Jika kadar amonia bebas lebih dari 0,2
mg/L, perairan tersebut bersifat toksik bagi beberapa jenis ikan (Sawyer dan Mc
Carty, 1978).
Penelitian sebelumnya telah dilakukan untuk mengetahui kandungan
amonia pada budidaya ikan. Hulu, O (2013) melakukan penelitian pengaruh suhu
dan pH terhadap kandungan amonia di dalam medium air tawar budidaya ikan
dimana pH air meningkat 6,83 sampai 7,23 akibat pemberian pakan dan kenaikan
suhu pada pH > 7 menyebabkan pH turun 0,066 % dan kandungan amonia turun
0,010 % .
Simanjuntak,P (2002) melakukan penelitian penentuan kandungan amonia,
nitrit, nitrat, alkalinitas, suhu dan pH dalam air bak ikan nila. Dari penelitian
tersebut diperoleh kadar amonia meningkat dari hari ke hari disertai meningkatnya
nilai pH air bak yang menyebabkan alkalinitas terus bertambah, sedangkan kadar
nitrit dan nitrat berfluktuasi.
Dari uraian di atas, penulis merasa tertarik untuk memanfaatkan zeolit
alam aktif sebagai penyerap limbah ammonia yang berasal dari budidaya ikan
tawar sebagai simulasi terhadap kondisi air Danau Toba.
1.2 Permasalahan
Bagaimana perubahan kadar ammonia sebelum dan sesudah penambahan
zeolit serta perubahan nilai pH pada air Danau Toba khususnya yang digunakan
1.3 Pembatasan Masalah
1. Penelitian ini menggunakan zeolit alam Sarulla yang diaktivasi pada suhu
2500C selama 3 jam .
2. Pengukuran hanya dilakukan terhadap pH dan kandungan ammonia
sebelum dan sesudah penambahan zeolit pada air Danau Toba yang
digunakan sebagai media budidaya ikan nila .
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk mengukur perubahan kandungan ammonia
sebelum dan sesudah penambahan zeolit serta perubahan nilai pH pada air Danau
Toba sebagai media budidaya ikan nila.
1.5 Manfaat Penelitian
Hasil yang diperoleh dari penelitian ini diharapkan mampu memberikan
informasi pemanfaatan zeolit alam untuk menyerap ammonia dari air Danau Toba.
Bila pH air mencapai 8 kemungkinan besar udara disekitar Danau Toba
terkontaminasi dengan ammonia yang berbahaya bagi kesehatan .
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Analitik FMIPA USU ,
Medan .
1.7 Metodologi Penelitian
1. Penelitian ini merupakan penelitian laboratorium yang bersifat purposif .
2. Contoh air yang dijadikan sebagai sampel diambil dari air permukaan
dalam akuarium ukuran 30cm x 30 cm x 30 cm. Didalamnya dipelihara 5
ekor ikan nila dan diberi pakan industri merek Takari.
3. Waktu pemberian pakan ikan yaitu 09.00 WIB, 13.00 WIB dan 18.00 WIB
sebanyak 1 gram setiap pemberian pakan.
4. Zeolit yang digunakan diambil dari Sarulla Kecamatan Pahae Kabupaten
Tapanuli Utara.
5. Zeolit diayak 200 mesh kemudian diaktivasi secara fisika yaitu dengan
pemanasan pada suhu 2500C.
6. pH air diukur pada pagi dan sore hari sebelum pemberian pakan dan
kandungan ammonia ditentukan sebelum dan sesudah penambahan 2 gram
zeolit alam aktif pada air Danau Toba secara spektrofotometri pada λmaks =
BAB 2
TINJAUAN PUSTAKA
2.1 Amonia
Amoniak merupakan gas tajam yang tidak berwarna dengan titik didih
33,50C. Cairannya mempunyai panas penguapan sebesar 1,37 kJ g-1 pada titik
didihnya. Secara fisik cairan NH3 mirip dengan air dalam perilaku fisiknya
dimana bergabung sangat kuat melalui ikatan hiidrogen. (Cotton, 1989)
Nitrogen N dapat ditemui hampir di setiap badan air dalam
bermacam-macam bentuk. Bentuk dari unsur tersebut tergantung dari tingkat oksidasinya,
antara lain sebagai berikut :
-3 0 +3 +5
NH3 - N2 -NO2- -NO3
-Biasanya senyawa-senyawa nitrogen tersebut adalah senyawa terlarut .
Amoniak NH3 , merupakan senyawa nitrogen yang menjadi NH4+ pada pH
rendah dan disebut amonium, amoniak sendiri berada dalam keadaan tereduksi
(-3). Amoniak dalam air permukaan berasal dari air seni dan tinja , juga dari
oksidasi zat organis (HaObCcNd) secara mikrobiologis yang berasal dari air alam
atau air buangan industri dan penduduk
Air tanah hanya mengandung sedikit NH3 , karena NH3 dapat menempel
pada butir-butir tanah liat selama infiltrasi air ke dalam tanah dan sulit terlepas
dari butir-butir tanah liat tersebut. Kadar amoniak yang tinggi pada air sungai
selalu menunjukkan adanya pencemaran. Pada air minum kadarnya harus nol dan
pada air sungai harus dibawah 0,5 mg/L (syarat mutu air sungai di Indonesia) .
Di perairan alami pada suhu dan tekanan normal amoniak dalam bentuk
gas dan membentuk kesetimbangan dengan ion amonium. Selain terdapat dalam
bentuk gas amoniak juga membentuk kompleks dengan beberapa ion logam.
Amoniak juga dapat terserap ke dalam bahan-bahan tersuspensi dan koloid
sehingga mengendap di dasar peraiaran. Amoniak di perairan dapat menghilang
melalui proses volatilisasi karena tekanan parsial amoniak dalam larutan
meningkat dengan semakin meningkatnya pH. Amoniak dan garam-garamnya
bersifat mudah larut dalam air. Amoniak banyak digunakan dalam proses produksi
urea, industri bahan kimia serta industri bubur dan kertas (pulp & paper). Tinja
dari biota akuatik yang merupakan limbah aktivitas metabolisme juga banyak
mengeluarkan amoniak. Sumber amoniak yang lain adalah reduksi gas nitrogen
yang berasal dari proses difusi udara atmosfer, limbah industri dan kosmetik.
Amoniak yang terukur di perairan berupa amoniak total (NH3 dan NH4+).
Amoniak bebas tidak dapat terionisasi (amoniak) sedangkan amonium (NH4+)
dapat terionisasi. Persentase amoniak meningkat dengan meningkatnya nilai pH
dan suhu perairan. Pada pH 7 atau kurang, sebagian besar amoniak akan
mengalami ionisasi. Sebaliknya pada pH lebih besar dari 7 amoniak tak terionisasi
yang bersifat toksik terdapat dalam jumlah yang lebih banyak. Amoniak bebas
yang tak terionisasi bersifat toksik terhadap organisme akuatik. Toksisitas
amoniak terhadap organisme akuatik akan meningkat jika terjadi penurunan kadar
oksigen terlarut, pH, dan suhu (Effendi, 2003).
Gas amonia adalah larut dalam air, bereaksi dengan air membentuk
amonium hidroksida. Oleh karena ionisasi ini dalam air membentuk NH4+ + OH-,
pada pH tinggi, gas amonia bebas ada dalam bentuk tak terionisasi. Pada pH dari
pasokan air pada umumnya, amonia secara sempurna diionisasi.
NH3 + H2O NH4OH NH4+ + OH
Hubungan antara amoniak (NH3) dan amonium (NH4+) yang dipengaruhi oleh pH
ditunjukkan oleh gambar berikut:
(Kemmer. 1979)
Gambar 2.1 Hubungan (NH3) dan (NH4+) oleh pH
2.2 Zeolit
Zeolit merupakan persenyawaan alumino silikat dengan unsur utama
terdiri dari kation alkali dan alkali tanah, berstruktur tiga dimensi serta
mempunyai pori-pori yang dapat diisi oleh molekul air . Struktur yang berpori ini
menyebabkan zeolit mempunyai kemampuan menyerap dan menyaring molekul
dan bersifat sebagai penukar ion . Selain itu, zeolit memiliki sifat hidratasi dan
dehidratasi. Pada umumnya, zeolit mempunyai susunan kristal yang agak lunak,
Dengan sifat-sifat yang dimilikinya, zeolit mampu untuk secara selektif
menyerap air dan gas N2 , sebagai penukar ion misalnya NH4+ dan K+ , sehingga
dapat berfungsi sebagai media pengontrol dalam penggunaan pupuk-pupuk yang
mengandung potasium dan nitrogen yang diperlukan oleh tanah, sebagai
pengontrol kelembapan, penangkap logam-logam berat dari air limbah yang
digunakan dalam pertanian, pengontrol sifat radioaktif pada tanah yang tercemar
dan decaking agent untuk pupuk dan makanan (Djadjulie. 1998).
2.2.1 Pengaktifan Mineral Zeolit
Sebelum digunakan, zeolit terlebih dahulu diaktifkan untuk meningkatkan
kemampuan penyerapannya dimana pengaktifan bertujuan untuk memperbesar
volume rongga dan menghilangkan pengotor . Pengaktifan dapat dilakukan secara
fisika yaitu dengan pemanasan dan secara kimia yaitu dengan penambahan asam .
Pengaktifan zeolit secara fisika berupa pemanasan zeolit untuk menghilangkan
molekul air yang terperangkap dalam pori-pori zeolit sehingga luas permukaan
pori-pori bertambah. Pemanasan dilakukan dalam oven biasa pada suhu
300-400°C (untuk skala laboratorium). Pengaktifan secara kimia dilakukan dengan
penambahan larutan asam H2SO4 atau basa NaOH dengan tujuan untuk
membersihkan permukaan pori, membuang senyawa pengotor dan mengatur
kembali letak atom yang dipertukarkan. Zeolit yang cocok untuk adsorben yaitu
apabila diaktifkan akan memberikan rasio Si/Al yang tinggi (10-100). Zeolit
dengan rasio Si/Al tinggi bersifat hidrofob (Sutarti. 1994) .
Sembiring,dkk (1995) melakukan penelitian “ Pengaruh Pemanasan dan Pengaktifan dengan Natrium Hidroksida dan Asam Klorida terhadap Kemampuan
Zeolit Alam Sarulla-Sumatera Utara sebagai Bahan Pemucat Minyak Kelapa
Sawit Mentah (CPO), hasil yang diperoleh yaitu pengaktifan zeolit dengan
pemanasan menunjukkan bahwa pada suhu 2000C sampai 3000C daya serap zeolit
meningkat tetapi bila suhu meningkat menjadi 4000C daya serap zeolit menurun .
Hal ini disebabkan karena pada pengaktifan dengan pemanasan, tujuannya adalah
sehingga larutan kation, gas ataupun molekul-molekul yang mempunyai ukuran
yang lebih kecil dari diameter saluran dapat masuk ke bagian dalam rongga zeolit.
Dari hasil yang diperoleh suhu 2000C sampai 3000C adalah sangat baik karena
struktur zeolit dimana hingga suhu ini tidak mengalami kerusakan . Sedangkan
pada pemanasan 4000C daya serap zeolit menurun karena pada keadaan ini
struktur zeolit telah mengalami kerusakan sehingga rongga-rongganya sebagian
tertutup . Pengaktifan zeolit dengan asam (pengaktifan secara kimiawi) bertujuan
untuk mengurangi efek hambatan dari pertukaran kation dengan cara pencucian
kation. Pemberian suatu larutan asam mineral pada mineral zeolit yang kaya silika
menyebabkan Al pada struktur molekul akan terlepas dan membentuk hidrogen
zeolit serta membuka saluran dari struktur zeolit .
2.2.2 Penyerapan Amonia oleh Zeolit Alam
Menurut Rabo. (1996) dan Suharto. (1999) mekanisme penyerapan amonia
oleh zeolit terjadi melalui pertukaran kation. Molekul amonia akan mengisi
pori-pori zeolit dimana pada permukaan zeolit sendiri terdapat ion-ion alkali atau
hidrogen . Molekul-molekul amonia akan berinteraksi secara kimia dengan sisi
aktif dari permukaan zeolit dan menggantikan ion-ion alkali atau hidrogen
sehingga dibentuk gugus amonium di permukaan zeolit aktif.
2.3 Parameter Fisika dan Kimia Air
2.3.1 Parameter Fisika
Parameter-parameter fisika yang biasa digunakan untuk menentukan
2.3.1.1 Suhu
Suhu sangat berperan dalam mengendalikan kondisi ekosistem perairan.
Perubahan suhu berpengaruh terhadap proses fisika, kimia dan biologi badan air.
Peningkatan suhu menyebabkan menurunnya kelarutan gas dalam air, misalnya
gas O2, CO2, N2 dan CH4. Selain itu peningkatan suhu juga menyebabkan
peningkatan kecepatan metabolisme dan respirasi organisme air, dan selanjutnya
meningkatkan konsumsi oksigen.
2.3.1.2 Kecerahan dan Kekeruhan
Kecerahan air bergabung pada warna dan kekeruhan. Kecerahan
merupakan ukuran transparansi perairan, yang ditentukan secara visual.
Kekeruhan menggambarkan sifat optik air yang ditentukan berdasarkan
banyaknya cahaya yang diserap dan dipancarkan oleh bahan-bahan yang terdapat
dalam air. Kekeruhan yang tinggi dapat mengakibatkan terganggunya sistem
osmoregulasi, misalnya pernafasan dan daya lihat organisme akuatik, serta dapat
menghambat penetrasi cahaya ke dalam air.
2.3.1.3 Warna
Warna perairan ditentukan oleh adanya bahan organik dan bahan
anorganik, karena keberadaan plankton, humus, dan ion-ion logam. Perairan alami
tidak berwarna. Sumber air untuk kepentingan air minum sebaiknya memiliki nilai
2.3.1.4 Cahaya
Cahaya merupakan sumber energi utama dalam ekosistem perairan. Dalam
perairan, cahaya memiliki dua fungsi utama yaitu; memanasi air sehingga terjadi
perubahan suhu dan berat jenis dan selanjutnya menyebabkan terjadinya
percampuran massa dan kimia air. Dan merupakan sumber energi bagi proses
fotosintesis algae dan tumbuhan air. Cahaya sangat mempengaruhi tingkah laku
organisme akuatik .
2.3.2 Parameter Kimia
Beberapa parameter kimia yang digunakan untuk menentukan kualitas air
yaitu pH, oksigen terlarut, kesadahan dan alkalinitas. Sebagian besar biota akuatik
sensitif terhadap perubahan pH dan menyukai nilai pH sekitar 7-8,5. Nilai pH
sangat mempengaruhi proses biokimiawi perairan misalnya proses nitrifikasi akan
berakhir jika pH rendah.
Sumber oksigen terlarut dapat berasal dari difusi oksigen yang terdapat di
atmosfer dan aktivitas fotosintesis oleh tumbuhan air dan fitoplankton. Kadar
oksigen terlarut yang tinggi tidak menimbulkan pengaruh fisiologis bagi manusia.
Ikan dan organisme akuatik lain membutuhkan oksigen terlarut dengan jumlah
yang cukup. Kebutuhan oksigen sangat dipengaruhi oleh suhu dan bervariasi antar
organisme. Keberadaan logam berat yang berlebihan di perairan mempengaruhi
sistem respirasi organisme akuatik sehingga pada saat kadar oksigen terlarut
rendah dan terdapat logam berat dengan konsentrasi tinggi, organisme akuatik
Kesadahan adalah gambaran kation logam divalen. Kesadahan perairan
berasal dari kontak air dengan tanah dan bebatuan. Perairan dengan nilai
kesadahan tinggi pada umumnya merupakan perairan yang berada di wilayah
yang memilki lapisan tanah pucuk (top soil) tebal dan batuan kapur. Nilai
kesadahan air diperlukan dalam penilaian kelayakan perairan untuk kepentingan
domestik dan industri. Kesadahan yang tinggi dapat menghambat sifat toksik dari
logam berat karena kation-kation penyusun kesadahan membentuk senyawa
kompleks dengan logam tersebut.
Alkalinitas merupakan gambaran kapasitas air untuk menetralkan asam.
Nilai alkalinitas perairan alami hampir tidak pernah melebihi 500 mg/liter CaCO3.
Perairan dengan nilai alkalinitas yang terlalu tinggi tidak disukai oleh organisme
akuatik karena biasanya di ikuti oleh nilai kesadahan yang tinggi atau kadar garam
natrium yang tinggi. Nilai alkalinitas berkaitan erat dengan korosivitas logam dan
dapat menimbulkan permasalahan kesehatan pada manusia terutama yang
berhubungan dengan iritasi pada sistem pencernaan (Effendi.2003).
2.4 Spektrofotometri
Spektrofotometer adalah alat untuk mengukur transmitansi atau absorbansi
suatu contoh sebagai fungsi panjang gelombang, pengukuran terhadap suatu
deretan contoh pada suatu panjang gelombang tunggal mungkin juga dapat
dilakukan.
adalah fraksi yang ditransmisi oleh suatu contoh .
Karena dari hukum Beer, absorbansi adalah berbanding langsung terhadap
konsentrasi maka jelas bahwa transmitansi tidak demikian, log T harus
digambarkan terhadap c untuk memperoleh suatu grafik lurus .
Hukum Bouguer (Lambert) : Jika suatu sinar radiasi monokhromatik (yaitu
radiasi dari satu panjang gelombang tunggal) diarahkan melewati medium,
diketahui bahwa tiap lapisan menyerap bagian yang sama dari radiasi atau tiap
lapisan mengurangi tenaga radiasi sinar dengan bagian yang sama.
Hukum Beer : Intensitas berkas cahaya monokhromatik berkurang secara
eksponensial dengan bertambahnya konsentrasi zat penyerap secara linier (Day.
1983)
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh
larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan.
(Rohman. 2007).
Spektrofotometer digunakan untuk mengukur energi secara relatif jika
energi itu ditransmisikan, direfleksikan atau diemisikan sebagai fungsi panjang
gelombang. Kelebihan spektrofotometer adalah panjang gelombang dari sinar
putih dapat terseleksi dan diperoleh dengan alat pengurai prisma, grafting ataupun
celah optis. Suatu spektrofotometer tersusun dari sumber spektrum tampak yang
kontinu, monokromator, sel pengabsorpsi untuk larutan sampel atau blanko dan
suatu alat untuk mengukur perbedaan absorpsi antara sampel dan blanko ataupun
pembanding (Khopkar.2008).
2.4.1 Penentuan Amoniak secara Spektrofotometri
Nitrogen-amoniak dapat ditentukan dengan atau tanpa didahului oleh suatu
pengolahan pendahuluan (destilasi). Bila destilasi tidak dilakukan, maka amoniak
ditentukan langsung dengan analisa Nessler atau melalui titrasi. Destilasi tidak
dilakukan bila sampel cukup jernih yaitu tidak melebihi batas kekeruhan 10 Ntu
Pada tahun 1856 Nessler pertama sekali, mengusulkan larutan basa
merkurium (II) iodida dalam kalium iodida sebagai reagensia untuk penetapan
amonia secara kolorimetri. Pelbagai modifikasi reagensia dilakukan sejak itu. Bila
reagensia Nessler ditambahkan ke dalam larutan garam amonium encer, amonia
yang terbebas akan beraksi dengan reagensia cukup cepat namun tidak sekejap
membentuk produk jingga-coklat yang tetap dalam larutan koloidal, tetapi
menggumpal bila dibiarkan lama.(Basset. 1994)
Bila perkiraan kadar amoniak dalam sampel antara 1 sampai 25 mg NH3
-N/L maka digunakan titrasi dengan standard asam sulfat, bila kadar amoniak
antara 0,05 sampai 5,0 mg NH3-N/L dapat ditentukan dengan metode Nessler;
kadar NH3-N > 5 mg/L dapat juga ditentukan dengan metode Nessler dengan
pengenceran .
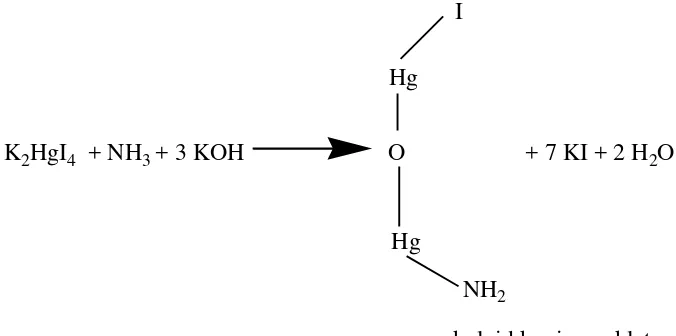
Metode Nessler terdiri dari suatu analisa kimiawi dengan menggunakan
spektrofotometer. Reagen Nessler K2HgI4 akan bereaksi dengan NH3 dalam
larutan yang bersifat basa , sesuai dengan reaksi pada gambar dibawah:
2 K2HgI4 + NH3 + 3 KOH O + 7 KI + 2 H2O Hg
Hg
NH2 I
koloid kuning coklat
Gambar 2.4 Reagen Nesler bereaksi dengan NH3 dalam larutan yang bersifat basa
Reaksi menghasilkan larutan berwarna kuning-coklat yang mengikuti
hukum Beer-Lambert. Intensitas warna yang terjadi berbanding lurus dengan
konsentrasi NH3 yang ada dalam sampel yang kemudian ditentukan secara
Gangguan pada analisa Nessler adalah kekeruhan dan warna. Pada analisa
Nessler tanpa destilasi harus ditambahkan larutan basa dan ZnSO4 untuk
mencegah gangguan ion Ca, Mg, Fe dan Sn yang dapat menimbulkan kekeruhan ,
dengan penambahan larutan tersebut ion-ion diatas akan mengendap. Larutan
sampel harus bebas gangguan, setelah pengendapan 15 sampai 30 menit.
Kemudian penambahan EDTA membantu agar sisa ion-ion Ca, Mg dan Fe dalam
larutan tidak ikut mengendap. Gangguan lainnya adalah NH3 yang dikandung
dalam udara yang mudah diserap oleh air (Alaerts.1984).
2.5 Ikan Nila dan Pakan Ikan
Ikan nila bukanlah ikan asli Indonesia, tetapi berasal dari sungai Nil di
Mesir. Baru pada tahun1969 ikan ini didatangkan dari Taiwan ke Indonesia. Jenis
lain yang telah ada di Indonesia sejak tahun 1939 adalah ikan mujair. Dalam dunia
ilmu pengetahuan ikan nila telah dikenal sejak tahun 1766, sedangkan mujair baru
ditemukan tahun1852.
Walaupun mirip ikan mujair, nila mudah dibedakan sebab sirip ekor nila
mempunyai garis-garis tegak dan pada sirip punggungnya terdapat garis-garis
miring. Masa perkawinannya berlangsung sepanjang tahun, bukan pada bulan
tertentu saja akan tetapi tidak sesering mujair. Di kolam pemeliharaan, ikan ini
dapat berkembang biak tanpa perawatan khusus. Apabila masa perkawinan telah
tiba, induk-induk nila mencari tempat yang aman. Mereka membuat lubang atau
cekungan-cekungan bulat didasar kolam seperti yang dilakukan mujair, telurnya
dijaga oleh induknya (Evy.2001).
Pakan merupakan faktor yang penting dalam usaha pembesaran ikan.
Dalam usaha pembesaran, ikan diharuskan tumbuh hingga mencapai ukuran pasar.
Untuk itu, ikan harus makan, tidak sekedar untuk mempertahankan kondisi tubuh
(maintenance), tetapi juga untuk menumbuhkan jaringan otot atau daging
(pertumbuhan somatis). Jumlah dan jenis pakan yang dikonsumsi oleh ikan akan
Jenis pakan di dalam akuakultur terdiri dari empat kelompok, yaitu pakan
hidup, pakan segar, pakan tambahan dan pakan buatan . Pakan hidup adalah jenis
pakan yang pada umumnya dalam keadaan hidup ketika diberikan kepada ikan
kultur. Pakan segar diberikan kepada ikan kultu dalam bentuk segar atau yang
telah dibekukan dalam freezer dan bentuk asli dari pakan ini sama seperti ketika
masih hidup. Pakan buatan adalah pakan yang dibuat dari berbagai bahan
makanan kemudian diramu menggunakan formula tertentu sehingga bisa
memenuhi kebutuhan gizi ikan secara lengkap. Kandungan air pakan buatan
biasanya sekitar 15 % sehingga bisa disimpan diruangan kering dalam waktu
realtif lama. Pakan buatan bisa berbentuk pelet, granule (butiran), crumble (remah), pasta dan dust (tepung).
Ada kalanya pakan yang diberikan kepada ikan berupa dedak, daun,
bungkil atau ampas tahu. Kandungan gizi pakan tersebut tidak lengkap atau
mengandung unsur yang dominan saja. Oleh karena itu, pemberian pakan kepada
ikan kultur bersifat tambahan. Sebagai contoh, dedak banyak mengandung
karbohidrat diberikan kepada ikan untuk menutupi kebutuhan karbohidrat ikan
BAB 3
METODE PENELITIAN
3.1 Alat
- Spektrofotometer Spektronik 20
- Aquarium
- pH meter
- Furnance Fisher
- Aerator
- Neraca Analitik Mettler AE 200
- Oven Fisher
- Siever (Ayakan) 200 Mesh
- Labu Ukur Pyrex
- Gelas Ukur Pyrex
- Beaker Glass Pyrex
- Corong Pyrex
- Kuvet
- Pipet Volume Fischer Brand
- Tabung Reaksi Pyrex
- Alu dan Lumpang
- Karet Penghisap Fischer Brand
- Magnetic Stirrer
3.2 Bahan
- Zeolit Alam Sarulla
- Air Danau Toba
- Ikan Nila
- Pakan Ikan Takari
- ZnSO4(s) p.a (E Merck)
- HgI2(s) p.a.(E Merck)
- KI(s) p.a.(E Merck)
- NaOH(s) p.a.(E Merck)
- EDTA(s) p.a.(E Merck)
3.3. Prosedur Penelitian
3.3.1. Pengolahan Zeolit
3.3.1.1. Preparasi Zeolit
Batuan zeolit alam Sarulla yang masih berbentuk granula dipanaskan dalam oven
pada suhu 100 ± 100C selama 3 jam , lalu didinginkan dan dihaluskan . Kemudian
diayak dengan ayakan 200 mesh .
3.3.1.2. Aktivasi Zeolit
Sebanyak 100 gram zeolit alam Sarulla yang telah dipreparasi kemudian
dipanaskan sampai suhu 2500C selama 3 jam lalu didinginkan di dalam desikator .
3.3.2. Larutan ZnSO4 10 %
Sebanyak 10 gram ZnSO4.7H2O dilarutkan dalam 50 mL aquadest kemudian
3.3.3. Pembuatan Reagen Nessler
Sebanyak 160 gram NaOH dilarutkan dengan 500 mL aquadest dalam beaker
glass 1L dan didinginkan dalam suhu kamar. Sebanyak 100 gram HgI2 dan 70
gram KI dimasukkan kedalam beaker glass 100 mL berisi 50 mL aquadest,
kemudian diaduk dengan magnetik stirrer sampai kristal larut. Dicampurkan
kedua larutan secara perlahan lalu dimasukkan larutan dalam labu ukur 1000 mL
dan diencerkan dengan aquadest sampai garis tanda. Dihomogenkan .
3.3.4. Larutan NaOH 6 N
Sebanyak 24 gram NaOH dilarutkan dalam 50 mL aquadest, didinginkan sampai
suhu kamar. Selanjutnya dimasukkan ke dalam labu ukur 100 mL, diencerkan
sampai garis tanda dan dihomogenkan .
3.3.5. Larutan NaOH 5 N
Sebanyak 20 gram NaOH dilarutkan dalam 50 mL aquadest , didinginkan sampai
suhu kamar. Selanjutnya dimasukkan ke dalam labu ukur 100 mL, diencerkan
sampai garis tanda dan dihomogenkan .
3.3.6. Larutan Induk Ammonia 1000 mg/L
Sebanyak 3,819 gram NH4Cl (terlebih dahulu kristal dikeringkan pada suhu
konstan 1000 C dan didinginkan dalam desikator ) dimasukkan ke dalam beaker
glass lalu dilarutkan dengan 100 mL aquadest. Kemudian diencerkan dalam labu
3.3.7.Larutan Standar Ammonia 100 mg/L
Sebanyak 10 mL dipipet larutan induk amonia 1000 mg/L, dimasukkan ke dalam
labu ukur 100 mL lalu diencerkan dengan aquadest sampai garis tanda dan
dihomogenkan.
3.3.8.Larutan Standar Ammonia 10 mg/L
Sebanyak 10 mL dipipet larutan ammonia 100 mg/L, dimasukkan ke dalam labu
ukur 100 mL lalu diencerkan dengan aquadest sampai garis tanda dan
dihomogenkan.
3.3.9. Larutan Standar Ammonia 1,0 ; 2,0 ; 3,0 ; 4,0 ; 5,0 mg/L
Sebanyak 0,0 ; 5,0 ; 10,0 ; 15,0 ; 20,0 ; 25,0 mL larutan standar ammonia 10 mg/L
dimasukkan kedalam 5 buah labu ukur 50 mL kemudian diencerkan dengan
aquadest sampai garis tanda dan dihomogenkan .
3.3.10. Pembuatan Kurva Kalibrasi Larutan Standar Ammonia
Sebanyak 10 mL dipipet dari masing-masing larutan ammonia dengan konsentrasi
0,0 ; 1,0 ; 2,0 ; 3,0 ; 4,0 ; 5,0 mg/L , dimasukkan kedalam 5 buah labu erlenmeyer
3.3.11. Pengukuran Contoh Air Akuarium
3.3.11.1. Pengukuran pH
Sebanyak 100 mL contoh air akuarium dimasukkan kedalam beaker glass. Diukur
pH larutan menggunakan pH meter.
3.3.11.2 . Menghilangkan Flok Pada Sampel
Ke dalam 100 mL sampel ditambahkan 1 mL ZnSO4 10 % dan diatur pH 10-11
dengan penambahan NaOH 6 N lalu diaduk menggunakan magnetik stirrer .
Setelah flok terbentuk maka disaring dan ditambahkan 1 tetes EDTA ke dalam
filtrat.
3.3.11.3. Penentuan Ammonia Pada Contoh Air Akuarium
Sebanyak 100 mL contoh air akuarium disaring kemudian filtratnya diambil 10
mL dan dimasukkan ke dalam labu erlenmeyer, ditambahkan 0,5 mL reagen
Nessler lalu diaduk dan didiamkan selama 10 menit . Diukur % transmitansinya pada λmaks = 410 nm dengan spektrofotometer visibel.
3.3.11.4. Penentuan Ammonia yang diserap oleh Zeolit Aktif
Diambil contoh air akuarium yang telah ditaburkan zeolit aktif sebanyak 100 mL
lalu disaring kemudian filtratnya diambil 10 mL dan dimasukkan ke dalam labu
3.4. Bagan Penelitian
3.4.1.Pengolahan Zeolit
3.4.1.1. Preparasi Zeolit
dipanaskan di dalam oven pada suhu 100 sampai
110 0C selama 3 jam
didinginkan
dihaluskan
diayak dengan ayakan 200 mesh
3.4.1.2. Aktivasi Zeolit
dipanaskan pada suhu 2500C selama 3 jam 100 gram serbuk zeolit alam
sarulla 200 mesh
Zeolit Aktif Batuan Zeolit Alam
Sarulla
3.4.2. Pembuatan Kurva Kalibrasi Larutan Standar Ammonia
dimasukkan kedalam labu ukur 50 mL
ditambahkan 0,5 mL reagen Nessler
diaduk dan didiamkan selama 10 menit
diukur % transmitansinya pada λmaks = 410 nm
Catatan : 1. Dilakukan prosedur yang sama untuk larutan standar 2,0 ; 3,0 ;
4,0 ; 5,0 mg/L
2. Pengukuran juga dilakukan untuk blanko yang mendapat perlakuan
yang sama
3.4.3. Pengukuran pH
dimasukkan kedalam beaker glass
diukur pH menggunakan pH meter 100 mL Contoh Air
Akuarium
Hasil 10 mL larutan standar 1,0 mg/L
3.4.4. Penentuan Kandungan Ammonia di dalam Contoh Air Akuarium
ditambahkan 1 mL ZnSO4 10 %
ditambahkan NaOH 6 N sampai
pH±10
diaduk
disaring
dipipet 10 mL
dimasukkan ke dalam tabung reaksi
ditambahkan 0,5 mL reagen Nessler
diaduk dan didiamkan selama 10 menit
diukur % transmitansinya pada λmaks = 410 nm *
Catatan : * Dilakuan perlakuan yang sama sebanyak 3 kali . 100 mL Contoh Air Akuarium
Endapan Filtrat
10 mL filtrat
Hasil
3.4.5. Penentuan Ammonia yang Diserap oleh Zeolit Aktif
disaring
dipipet 10 mL
dimasukkan ke dalam tabung reaksi
ditambahkan 0,5 mL reagen Nessler
diaduk dan didiamkan selama 10 menit
diukur % transmitansinya pada λmaks = 410 nm *
Catatan : * Dilakuan perlakuan yang sama sebanyak 3 kali . 100 mL Contoh Air Akuarium
yang telah ditaburkan zeolit
Endapan Filtrat
10 mL filtrat
BAB 4
HASIL DAN PEMBAHASAN
4 .1. Hasil Penelitian
Dari penelitian yang telah dilakukan diperoleh absorbansi dari larutan standar
ammonia pada tabel 4.1 berikut :
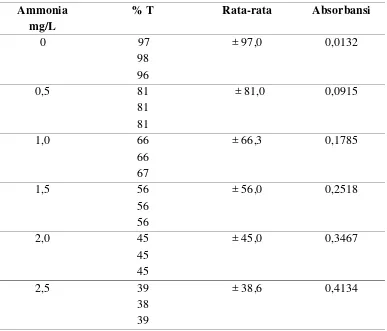
Tabel 4.1 Penentuan Absorbansi Larutan Standar Ammonia
Ammonia mg/L
% T Rata-rata Absorbansi
0 97 ± 97,0 0,0132
98 96
0,5 81 ± 81,0 0,0915
81 81
1,0 66 ± 66,3 0,1785
66 67
1,5 56 ± 56,0 0,2518
56 56
2,0 45 ± 45,0 0,3467
45 45
2,5 39 ± 38,6 0,4134
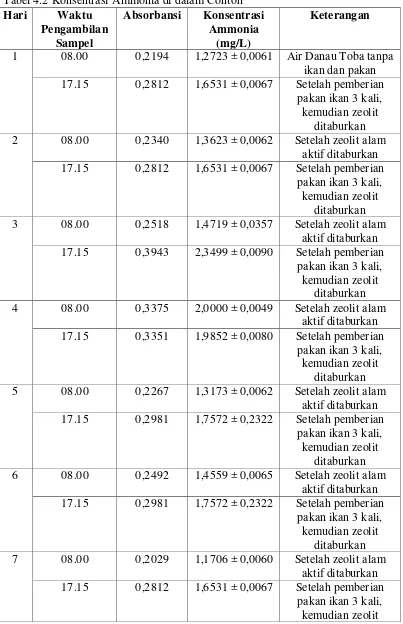
Dari penelitian yang telah dilakukan diperoleh data konsentrasi ammonia dalam contoh pada tabel 4.2 berikut :
Tabel 4.2 Konsentrasi Ammonia di dalam Contoh Hari Waktu 17.15 0,2812 1,6531 ± 0,0067 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 2 08.00 0,2340 1,3623 ± 0,0062 Setelah zeolit alam
aktif ditaburkan 17.15 0,2812 1,6531 ± 0,0067 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 3 08.00 0,2518 1,4719 ± 0,0357 Setelah zeolit alam
aktif ditaburkan 17.15 0,3943 2,3499 ± 0,0090 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 4 08.00 0,3375 2,0000 ± 0,0049 Setelah zeolit alam
aktif ditaburkan 17.15 0,3351 1,9852 ± 0,0080 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 5 08.00 0,2267 1,3173 ± 0,0062 Setelah zeolit alam
aktif ditaburkan 17.15 0,2981 1,7572 ± 0,2322 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 6 08.00 0,2492 1,4559 ± 0,0065 Setelah zeolit alam
aktif ditaburkan 17.15 0,2981 1,7572 ± 0,2322 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 7 08.00 0,2029 1,1706 ± 0,0060 Setelah zeolit alam
aktif ditaburkan 17.15 0,2812 1,6531 ± 0,0067 Setelah pemberian
ditaburkan 8 08.00 0,2785 1,6364 ± 0,0067 Setelah zeolit alam
aktif ditaburkan 17.15 0,3532 2,0967 ± 0,0085 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 9 08.00 0,2730 1,6025 ± 0,0067 Setelah zeolit alam
aktif ditaburkan 17.15 0,3943 2,3499 ± 0,0090 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan 10 08.00 0,2492 1,4559 ± 0,0065 Setelah zeolit alam
aktif ditaburkan 17.15 0,4052 2,4171 ± 0,0095 Setelah pemberian
pakan ikan 3 kali, kemudian zeolit
ditaburkan
4.2 Pengolahan Data
4.2.1 Pembuatan Kurva Kalibrasi Ammonia
Data yang diperoleh dari pengukuran transmitansi larutan standar
ammonia dikonversikan kedalam bentuk absorbansi dengan menggunakan
persamaan
A = 2 - log %T.
Data absorbansi yang diperoleh diplotkan terhadap konsentrasi larutan
Gambar 4.1. Kurva Kalibrasi Larutan Seri Standar Ammonia
Persamaan garis regresi untuk kurva kalibrasi ini dapat diturunkan dengan
menggunakan metode Least Square dimana konsentrasi dinyatakan sebagai Xi dan
absorbansi sebagai Yi , sebagai berikut:
Tabel 4.3 Penurunan Persamaan Garis Regresi untuk Kurva Kalibrasi
Xi Yi Xi - X Yi - Y (Xi - X )2
Dari tabel diatas dapat diperoleh :
X = ∑ � = ,
Y= ∑ �
� = , = ,
Persamaan garis regresi untuk kurva kalibrasi dinyatakan dengan Y = ax + b
dimana : a = slope
b = intersept
Harga slope (a) dapat ditentukan dengan persamaan sebagai berikut :
a =
Sedangkan harga intersept (b) dapat diperoleh melalui persamaan :
b = Y aX
= 0,2158 – 0,1623(1,25)
= 0,0129
Dengan demikian persamaan garis regresi untuk kurva kalibrasi ammonia adalah :
Y= 0,1623X + 0,0129
4.2.2. Penentuan koefisien korelasi Ammonia
Koefisien korelasi (r) untuk kurva kalibrasi ammonia dapat ditentukan :
4.2.3. Penentuan Konsentrasi Ammonia di dalam Sampel
Konsentrasi ammonia dapat ditentukan dengan menggunakan metode kurva
kalibrasi dengan mensubstitusi nilai absorbansi yang diperoleh dari hasil
pengukuran terhadap persamaan garis regresi dari kurva kalibrasi .
4.2.4. Penentuan Konsentrasi Ammonia di dalam Sampel dalam mg/L
Dari data pengukuran absorbansi ammonia dalam air diperoleh absorbansi sebagai
berikut:
A1 = 0,2218
A2 = 0,2218
A3 = 0,2146
Dengan mensubstitusi nilai Y (absorbansi) kepersamaan garis regresi
Y = 0,1623X + 0,0129 :
X1 = 1,2871
X2 = 1,2871
X3 = 1,2427
Sehingga diperoleh :
n Xi
X
= 1,2723(X1- X )2 = (1,2871 – 1,2723)2 = 0,0002
(X2- X )2 = ( 1,2871 – 1,2723)2 = 0,0002 (X3- X )2 = (1,2427 – 1,2723)2 = 0,0008
Maka, S =
dari data hasil distribusi t student untuk n=3, dengan dengan derajat kebebasan
(dk) = n-1= 2 untuk derajat kepercayaan 95 % (p- 0,05), t = 4,3 maka:
Hasil perhitungan untuk kandungan ammonia pada sampel dapat dilihat pada
Tabel 4.2.
4.2.5. Perhitungan Jumlah Ammonia Terserap
Jumlah ammonia yang terserap oleh zeolit dihitung dengan menggunakan
persamaan :
[Ammonia]terserap = [Ammonia]awal– [Ammonia]sisa
Untuk penentuan ammonia yang tersisa dapat ditentukan sebagai berikut:
Contoh perhitungan:
Konsentrasi awal ammonia = 1,6531 mg/L
Penyerapan ammonia oleh 2 gram zeolit aktif yaitu:
Absorbansi ammonia sisa = 0,2340 , maka disubstitusikan harga A terhadap Y
pada persamaan garis regresi : Y = 0,1623 X + 0,0129
atau X =
1623 , 0
0129 , 0 2340 ,
0
= 1,3622 mg/L
Maka dapat diperoleh ammonia yang terserap :
[Ammonia]terserap = [Ammonia]awal– [Ammonia]sisa
[Ammonia ]terserap = 1,6531 mg/L – 1,3622 mg/L
[Ammonia ]terserap = 0,2909 mg/L
Data jumlah ammonia yang terserap dapat dilihat pada Lampiran 1.
4.2.6 Persentase Penurunan Kandungan Ammonia dengan menggunakan
Zeolit Alam Aktif
Persentase penurunan kandungan ammonia dalam sampel air sebelum dan sesudah
diserap oleh zeolit aktif ditentukan dengan menggunakan persamaan berikut :
% Penyerapan = � � � � ��� − � � � � � ℎ�
� � � � ��� x 100 %
% Penyerapan = , − ,
, x 100 % = 17,5 %
Data % penyerapan pada penurunan kandungan ammonia dapat dilihat pada
Lampiran 1
4.2 Pembahasan
Penelitian ini merupakan penelitian lanjutan yang telah dilakukan oleh
Oktavianus Hulu pada tahun 2013 tentang pengaruh suhu dan pH terhadap
kandungan ammonia di dalam medium air tawar budidaya ikan. Subyek pada
penelitian ini adalah pengaruh penambahan zeolit alam aktif ke dalam akuarium
sebagai medium budidaya ikan nila terhadap perubahan pH dan kandungan
ammonia yang selanjutnya berdampak bagi kelangsungan hidup ikan.
Studi pemanfaatan zeolit alam aktif sebagai penyerap ammonia di dalam
akuarium sebagai medium budidaya ikan tawar ini adalah bersifat purposif. Air
Danau Toba yang dijadikan sebagai sampel diambil dari permukaan Danau Toba,
Pangururan Kabupaten Samosir. Sebanyak 20 L air ini dimasukkan ke dalam
akuarium berukuran 30 cm x 30 cm x 30 cm, dimana di dalam akuarium tersebut
di pelihara 5 ekor ikan nila. Penelitian ini dilakukan dengan menentukan pH dan
kandungan ammonia dalam air Danau Toba tanpa ikan dan pakan terlebih dahulu .
Kemudian setelah akuarium diisi dengan sampel air dan ikan, pemberian pakan
dilakukan pada pukul 09.00 WIB, 13.00 WIB dan 18.00 WIB sebanyak 1,68
gram. Setelah pemberian pakan pada sore hari, selanjutnya ditentukan lagi
perubahan pH dan kandungan ammonia pada sampel air. Kemudian zeolit alam
yang telah diaktivasi dengan pemanasan pada suhu 2500 C ditambahkan ke dalam
akuarium sebanyak 2 gram dan didiamkan selama satu malam. Pada hari kedua,
ditentukan kembali perubahan pH dan kandungan ammonia pada sampel air yang
telah diserap oleh zeolit alam aktif dan setelah pemberian pakan 3 kali. Hal yang
sama dilakukan selama 10 hari berturut-turut. Perubahan pH diukur menggunakan
pH meter sedangkan kandungan ammonia ditentukan menggunakan metode
spektrofotometri.
Dari hasil penelitian yang telah dilakukan, kandungan ammonia yang
berasal dari feses ikan dan sisa pakan meningkat seiring dengan meningkatnya
pH. Dalam keadaan ini, bila pH air semakin meningkat dan kontribusi ammonia
bertambah maka ikan tidak akan dapat bertahan hidup. Dari penelitian yang telah
dilakukan oleh Oktavianus Hulu, ikan hanya dapat bertahan hidup selama 4
selama 10 (sepuluh) hari. Penambahan zeolit aktif ke dalam air diketahui dapat
menurunkan pH air dan mampu menyerap ammonia yang berasal dari feses ikan.
Kandungan ammonia pada air Danau Toba tanpa ikan dan pakan diperoleh 1,2723
mg/L pada pH = 6,85. Setelah pemberian pakan ikan, jumlah tersebut bertambah
menjadi 1,6531 mg/L pada pH 7,03. Sebanyak 2 gram zeolit aktif ditambahkan ke
dalam air dan menunjukkan hasil bahwa pH air menurun menjadi 6,83 dan
konsentrasi ammonia menjadi 1,3632 mg/L. Semakin bertambahnya kandungan
ammonia dalam air dapat dikendalikan dengan penambahan zeolit aktif sehingga
ikan dapat bertahan hidup dalam kondisi pH tinggi.
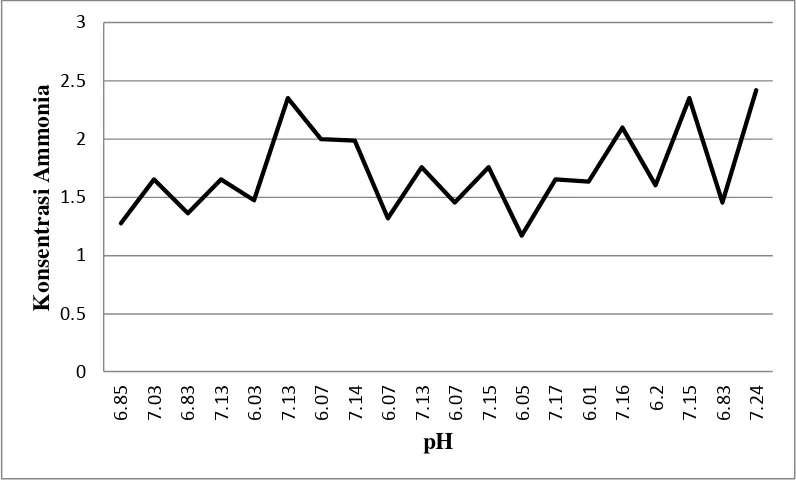
Dari hasil penelitian yang telah dilakukan diperoleh grafik yang
menunjukkan pengaruh pH terhadap konsentrasi ammonia dari sampel selama 10
hari berturut-turut. Pada hari ke-3 terjadi peningkatan konsentrasi ammonia yang
cukup tajam. Hal ini diduga terjadi akumulasi pakan yang cukup banyak yang
mengandung protein.
Gambar 4.2. Grafik Perubahan Konsentrasi Ammonia terhadap pH
Dan penyerapan ammonia terbesar terdapat pada hari ke-10, ini
disebabkan adanya akumulasi zeolit di dasar akuarium sehingga mempengaruhi
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penellitian yang telah dilakukan diperoleh hasil yang menunjukkan
bahwa budidaya ikan dengan pemberian pakan buatan menyebabkan pH air
Danau Toba meningkat dari 6,85 menjadi 7,03. Disamping itu, kandungan
ammonia dalam air juga meningkat dari 1,2723 mg/L menjadi 1,6531 mg/L.
Pemberian zeolit alam aktif dapat menurunkan kandungan ammonia sampai
38,04% pada hari ke-10 .
5.2 Saran
1. Disarankan kepada peneliti selanjutnya untuk memvariasikan massa zeolit
aktif untuk mendapatkan penyerapan yang optimum
2. Disarankan kepada peneliti selanjutnya untuk mengukur perubahan kadar
oksigen terlarut serta TSS dan TDS yang disebabkan oleh akumulasi zeolit
DAFTAR PUSTAKA
Alaerts, G. dan Sri, S.S. 1984. Metoda Penelitian Air. Surabaya : Usaha Nasional
Barus, T. A, S. S. Sinaga, R. Tarigan. 2008. Produktivitas Primer Fitoplankton Dan Hubungannya Dengan Faktor Fisik-Kimia Air di Perairan Parapat Danau Toba. Jurnal Biologi Sumatera Vol.3 No. 1 2008
Basset, J. 1994. Buku Ajar Vogel : Kimia Analisa Kuantitatif Anorganik. Terjemahan A. Handayana Pudjaatmakadan L. Setiono.Jakarta : ECG
Cotton dan Wilkinson. 1989. Kimia Anorganik Dasar . Jakarta : UI press
Day, R. A. Jr, A. L. Underwood . 1998. Analisa Kimia Kuantitatif. Jakarta : Erlangga
Djadjulie, A. 1998. Pemanfaatan Batu Kapur & Zeolit untuk Pertanian. Pusat Penelitian dan Pengembangan Teknologi Mineral
Effendi, I . 2009. Pengantar Akuakultur. Jakarta : Penebar Swadaya
Effendi, H . 2003 . Telaah Kualitas Air Bagi Pengelolaan Sumber Daya Dan Lingkungan Perairan . Yogyakarta : Kanisius
Hulu,O. 2013. Studi Pengaruh Suhu dan pH terhadap Kandungan Ammonia di dalam Medium Air Tawar Budidaya Ikan. Skripsi. FMIPA USU
K, Evy. R. 2001. Usaha Perikanan di Indonesia .Jakarta : Mutiara Sumber Widya
Kemmer, F. 1979. The Nalco Handbook Water. USA : Mc Graw Hill Book Company
Khopkar, S. M . 2003. Konsep Dasar Kimia Analitik . Jakarta : UI Press
Rabo, J.A., Angell, C.L., Kasai, P.H., Shomaker, V. 1996. Discuss. Faraday Soc.
Rohman, A. 2007. Kimia Farmasi Analisis . Yogyakarta : UGM
Sembiring, T. dkk. 1995. Pengaruh Pemanasan dan Pengaktifan dengan Natrium Hidroksida dan Asam Klorida terhadap Kemampuan Zeolit Alam Sarulla- Sumatera Utara sebagai Bahan Pemucat Minyak Kelapa Sawit Mentah
(CPO). Bogor : Prosiding Seminar Nasional Hasil Penelitian Perguruan Tinggi
Simanjuntak, Eva.P. 2002. Penentuan Kandungan Ammonia(NH3), Nitrit(NO2),
Nitrat(NO3), Alkalinitas, Suhu dan pH Dalam Air Bak Ikan Nila
(Oreochromis niloticus). Skripsi. FMIPA USU