APLIKASI IgY SPESIFIK
Staphylococcus aureus
SEBAGAI
PENCEGAHAN STAPHYLOCOCCOSIS PADA KELINCI
TRIWARDHANI CAHYANINGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
ii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Aplikasi IgY Spesifik
Staphylococcus aureus Sebagai Pencegahan Staphylococcosis Pada Kelinci adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
ii
RINGKASAN
TRIWARDHANI CAHYANINGSIH. Aplikasi IgY Spesifik Staphylococcus aureus Sebagai Pencegahan Staphylococcosis Pada Kelinci. Dibimbing oleh FACHRIYAN HASMI PASARIBU dan AGUSTIN INDRAWATI
Telur ayam telah lama diketahui sebagai salah satu sumber nutrisi yang sangat baik untuk manusia. Telur juga sebagai sumber penting antibodi terutama disebut sebagai immunoglobulin Y (IgY). Transfer alami antibodi yang muncul pada induk ayam ke anak ayam melalui kuning telur dapat dieksploitasi untuk memproduksi antibodi spesifik terhadap patogen tertentu yang diberikan melalui imunisasi pada ayam petelur. Dengan memberikan antibodi spesifik ini kepada hewan lain bertujuan sebagai perlindungan pasif maternal terhadap patogen tertentu.
Penelitian ini bertujuan untuk mempelajari pengaruh IgY spesifik S. aureus sebagai pencegahan staphylococcosis pada kelinci. IgY spesifik dikoleksi dari telur ayam Single Comb Brown Leghorn yang telah diimunisasi dengan antigen utuh S. aureus. Imunisasi diberikan secara intravena dengan dosis antigen utuh S. aureus 0,5 ml (109 CFU) selama tiga hari berturut-turut pada minggu pertama. Pengulangan imunisasi dilakukan sebanyak 3 kali dengan interval waktu satu minggu secara subcutan dengan dosis antigen utuh S. aureus 1 ml (109 CFU) dalam Freund’s adjuvant complete pada minggu kedua dan dalam Freund’s
adjuvant incomplete pada minggu ketiga dan keempat. Uji agar gel presipitasi (AGP) dilakukan untuk mengetahui terbentuknya IgY spesifik S. aureus. Ekstraksi IgY S.aureus dari kuning telur menggunakan metode PEG-Ammonium sulfat. Konsentrasi IgY S. aureus diukur dengan spektrofotometer UV, sedangkan berat molekul IgY ditentukan dengan metode SDS Page menggunakan pewarnaan perak nitrat. Kuning telur yang telah positif mengandung IgY spesifik S. aureus
dicampurkan kedalam pakan kelinci dengan dosis 5%, 10% dan 20%, parameter yang diamati adalah mortalitas, bobot badan, dan perubahan histopatologi.
Hasil penelitian yang diperoleh adalah IgY S. aureus terbentuk dalam serum pada minggu kelima sedangkan dalam telur pada minggu ke 6 setelah imunisasi pertama. Konsentrasi IgY didapatkan sebesar 1,696 mg/ml. Tingkat morbiditas kelinci yang mendapat dosis IgY 10% dan 20% menunjukkan penurunan dibandingkan dengan perlakuan kontrol, yaitu 40% dan 20%, hasil histopatologi menunjukkan penurunan tingkat keparahan pneumonia seiring dengan peningkatan dosis IgY yang diberikan. Kesimpulan dari penelitian ini adalah ayam mampu memproduksi IgY spesifik S. aureus pada serum dan kuning telur. Imunisasi pasif menggunakan dosis IgY 10% dan 20% mampu menurunkan tingkat morbiditas dan mortalitas kelinci.
iii
SUMMARY
TRIWARDHANI CAHYANINGSIH. Application of Specific IgY
Staphylococcus aureus as a Prevention of Rabbit Staphylococcosis. Supervised by FACHRIYAN HASMI PASARIBU and AGUSTIN INDRAWATI
Chicken eggs have long been known as a very good source of nutrition for humans. Eggs are also an important source of antibodies known as immunoglobulin Y (IgY). Transfer of natural antibodies that appear on a hen to chicks through the egg yolk can be exploited to produce specific antibodies against specific pathogens provided through immunization in laying hens. By providing these specific antibodies to other animals intended as maternal passive protection against specific pathogens. This study aimed to study the effect of specific IgY S. aureus as prevention staphylococcosis in rabbits.
Specific IgY is collected from hens eggs of Single Comb Brown Leghorn chickens that were immunized with S. aureus antigens. Immunizations administered intravenously at a dose of 0.5 ml of antigen S. aureus (109 CFU) for three consecutive days in the first week. Repetition immunization performed 3 times at intervals of 10 days subcutan with antigen dose 1 ml of S. aureus (109 CFU) in Freund's complete adjuvant in the second week and in incomplete Freund's adjuvant in the third and fourth weeks. Agar gel precipitation test (AGP) was conducted to determine the formation of specific IgY S. aureus. Chickens and eggs had positive serum on AGP test then their eggs were collected for extraction.
S.aureus IgY extraction from egg yolk using PEG-Ammonium sulfate. S.aureus
IgY concentration was measured by UV, while IgY molecular weight is determined by SDS Page method using silver nitrate staining. Egg yolks that have been positive for S. aureus specific IgY mixed into feed rabbits at doses of 5%, and 20% showed a decrease compared to the control treatment, histopathological results showed a decrease in the severity of pneumonia in line with increasing doses of IgY given. The conclusion of this study were capable of producing chicken IgY specific S. aureus on serum and egg yolk. Passive immunization using a dose of IgY 10% and 20% were able to decrease the morbidity and
mortality. .
iv
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Aplikasi IgY Spesifik
Staphylococcus aureus
Sebagai Pencegahan
Staphylococcosis Pada Kelinci
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
TRIWARDHANI CAHYANINGSIH
viii
PRAKATA
Segala puji dan syukur penulis panjatkan ke hadirat Allah SWT karena atas ridho dan kekuatannya penulis mampu menyelesaikan tesis ini sebagai salah satu syarat kelulusan dari program pasca sarjana pada program studi Mikrobiologi Medik dengan judul “Aplikasi IgY Spesifik Staphylococcus aureus Sebagai Pencegahan Staphylococcosis Pada Kelinci”
Rasa terima kasih dan penghargaan penulis sampaikan kepada Prof.Dr.Drh. Fachriyan H Pasaribu dan Dr. Drh. Agustin Indrawati sebagai pembimbing, serta Prof. Dr. Drh. I Wayan T Wibawan dan Prof. Dr. Drh. Retno D. Soejoedono yang telah banyak memberi saran. Terima kasih kepada Badan Litbang Pertanian yang telah memberi kesempatan dan dana dalam menyelesaikan penelitian ini, Balai Penelitian Ternak yang memberikan kemudahan dalam menggunakan berbagai fasilitas yang menunjang penelitian. Ungkapan terima kasih juga disampaikan kepada Ibu, Suami, anak-anak serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Februari 2016
ix
2.6 Staphylococcosis pada kelinci 5
2.7 Epidemiologi 6
2.8 Gejala Klinis 7
2.9 Pengendalian 7
2.10 Immunoglobulin Y 8
2.11 Immunoglobulin Y sebagai imunoterapi 10
III METODOLOGI PENELITIAN 11
3.1 Waktu dan Tempat Penelitian 11
x
4.1 Isolasi dan Identifikasi S. aureus 14
4.2 Konsentrasi dan Bobot Molekul IgY 16
4.3 Imunisasi Pasif IgY Spesifik S. aureus per Oral 17
V KESIMPULAN DAN SARAN 22
5.1 Kesimpulan 22
5.2 Saran 22
DAFTAR PUSTAKA 23
LAMPIRAN 27
xi
DAFTAR TABEL
1. Hasil uji AGP pada serum dan kuning telur 16
2. Pertambahan bobot badan kelinci 17
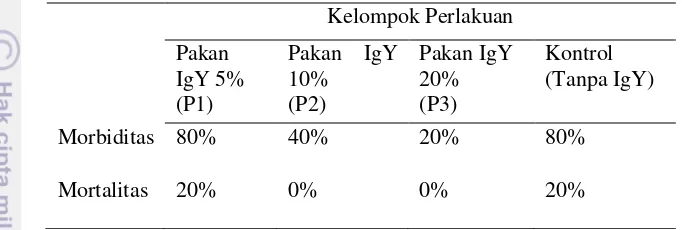
3. Persentase morbiditas dan mortalitas 18
DAFTAR GAMBAR
1. Staphylococcus aureus dengan pewarnaan gram 3 2.Bentuk pododermatitis, mastitis dan abses pada paru kelinci akibat
infeksi S.aureus 7
3. Struktur Immunoglobulin 8
4. Immunoglobulin Y ditransfer dari serum induk ke dalam kuning telur,
sedikit IgA dan IgM terdapat dalam putih telur 9
5. a S. aureus pada media agar darah 14
b S. aureus pada media MSA 14
6. a S. aureus pada media Baird parker agar 14
b Organ paru kelinci terinfeksi S. aureus 14
7. a Hasil uji AGPT pada Kuning Telur 15
b Hasil uji AGPT Serum 15
8. Profil pita protein IgY S. aureus yang telah dipurifikasi 17
9. Paru Kelinci grup kontrol 19
10. Paru Kelinci grup kontrol 19
11. Paru kelinci grup P1 (IgY 5%) 19
12. Paru-paru kelinci grup P2 (IgY 10%) 19
13. Paru-paru kelinci grup P3 (IgY 20%) 20
DAFTAR LAMPIRAN
1 Data Pertambahan Bobot Badan Kelinci
27
xii
PENDAHULUAN
1.1 Latar Belakang
Staphylococcus aureus adalah bakteri oportunistik yang mampu bertahan dan memperbanyak diri pada berbagai kondisi lingkungan, dan menyebabkan penyakit baik pada manusia dan hewan. S. aureus umum ditemukan pada kulit dan hidung manusia maupun hewan. Bakteri ini dapat menginfeksi kelinci pada berbagai umur, dengan gejala dermatitis supuratif, abses multisistemik, pododermatitis dan mastitis (Mahde 2011). Pada anak kelinci yang masih menyusu pada induknya, tipe lesi yang umum adalah dermatitis eksudatif sedangkan pada kelinci pedaging, sering ditemui abses pada paru, hepar, dan uterus, sehingga menyebabkan penurunan produksi, infertilitas serta kematian. Mastitis merupakan gambaran patologi yang paling banyak ditemukan pada induk kelinci, diikuti abses subkutan dan pyometra, akibat gejala tersebut akhirnya kelinci diculling. Secara umum, staphylococcosis pada kelinci yang disebabkan oleh S. aureus mempunyai ciri khas berupa septicaemia atau inflamasi supuratif yang dapat muncul pada berbagai organ (Bien et al. 2011).
Pencegahan terhadap staphylococcosis pada kelinci merupakan hal yang penting, namun sulit untuk dilakukan. Pengendalian dapat dilakukan dengan melakukan pemeriksaan pada hewan baru yang datang sebelum dimasukkan kedalam flok. Penggunaan antibiotik sebagai pencegahan terhadap penyakit (dosis profilaksis) maupun sebagai growth promotor (dosis subterapi) dan sebagai pengobatan (dosis terapi) telah digunakan sejak berpuluh tahun silam. Banyak penelitian maupun penggunaan di lapangan menunjukkan bahwa penggunaan antibiotik mampu meningkatkan performa ternak secara signifikan (Diraviyam et al. 2014). Namun penggunaan antibiotika pada pakan menimbulkan masalah serius berupa residu pada produk hewan dan peningkatan resistensi bakteri. Oleh karena itu dibutuhkan suatu strategi pada peternakan yang dapat mengurangi kejadian penyakit maupun resistensi obat akibat penggunaan antibiotika.
Imunisasi pasif menjadi pondasi dasar kesehatan manusia dan hewan, salah satunya dengan penggunaan antibodi. Kemampuan antibodi untuk mengikat antigen dengan tingkat afinitas dan spesifisitas yang tinggi menjadikannya bermanfaat untuk digunakan pada sumber yang bervariasi. Penggunaan antibodi pada pengujian diagnostik maupun sebagai terapeutik memiliki pengaruh nyata terhadap kesehatan manusia maupun hewan (Prabudhas et al. 2011).
xiii Terdapat beberapa keuntungan dari immunoglobulinY jika dibandingkan dengan immunoglobulin G mamalia. IgY mempunyai afinitas terhadap banyak epitope dari protein mamalia dibandingkan antibodi mamalia. Tidak ada reaksi silang antara Ig G dengan IgY, serta IgY memiliki struktur molekul lebih stabil dibandingkan dengan IgG mamalia. Sangat mungkin untuk memperoleh antibodi 5-10 kali lebih banyak pada ayam dibandingkan kelinci pada satu periode yang sama. Produksi antibodi unggas jauh lebih murah dibandingkan dengan antibodi mamalia. Immunoglobulin Y lebih sering dipilih karena jumlah hewan yang dibutuhkan hanya sedikit, dan tidak perlu menyakiti hewan untuk mendapatkan antibodi, karena lebih mudah untuk mengumpulkan telur daripada darah, dan lebih aman bagi hewan. Selain itu, lebih mudah memurnikan IgY dari kuning telur, karena dalam kuning telur tidak mengandung immunoglobulin lain selain IgY, dibandingkan dengan purifikasi IgG dari serum darah karena didalam serum mengandung immunoglobulin kelas lain (Christopher et al. 2013).
Pemanfaatan imunoglobulin Y (IgY) spesifik sebagai imunisasi pasif telah banyak diteliti dan diterapkan, antara lain dalam pengendalian penyakit bakteri, virus, dan protozoa. Penggunaan IgY spesifik sebagai imunoterapi terhadap bakteri antara lain Streptococcus mutan penyebab karies pada gigi (Sentila et al.
2013), Campylobacter jejuni penyebab diare pada manusia (Hermans et al. 2014),
S. aureus dan Eschericia coli (Tobias et al. 2012) serta Helicobacter pylori
(Wang et al. 2014). Beberapa virus yang dilaporkan dapat dikendalikan menggunakan IgY spesifik antara lain Infectious Bursal Disease Virus (IBDV) pada ayam broiler (Farooq et al. 2012), rotavirus dan norovirus penyebab gastroenteritis (Ying et al. 2013). Menurut Indrawati (2010) IgY juga dapat digunakan sebagai anti flu burung dan anti diare yang disebabkan oleh E. coli dan
S. enteritidis . Manfaat yang hendak diperoleh dari penelitian ini adalah untuk mengetahui pengaruh IgY spesifik S. aureus sebagai pencegahan staphylococcosis pada kelinci.
1.2 Tujuan Penelitian
Penelitian yang dilakukan untuk mengetahui pengaruh pemberian IgY spesifik S. aureus terhadap kejadian staphylococcosis pada kelinci
1.3 Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan produk nutritional food IgY spesifik S. aureus untuk pencegahan penyakit staphylococcosis pada kelinci
1.4 Hipotesa
xiv
BAB II
TINJAUAN PUSTAKA
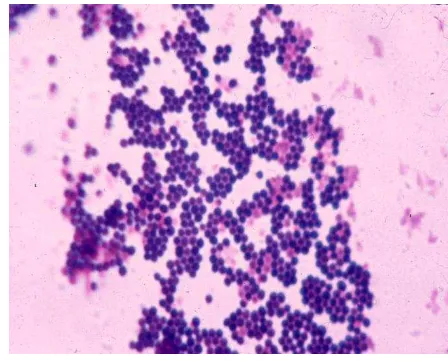
Gambar 1. Staphylococcus aureus dengan pewarnaan Gram
2.1 Klasifikasi
Staphylococcus aureus Ordo : Eubacteriales
Famili : Micrococcaceae
Genus : Staphylococcus
Spesies: Staphylococcus aureus 2.2 Morfologi
Genus Staphylococcus adalah bakteri Gram positif, berbentuk kokus/sferis (bulat), umumnya membentuk formasi ireguler seperti buah anggur. Mudah tumbuh dalam berbagai media, memfermentasi karbohidrat dan menghasilkan pigmen berwarna putih hingga kuning tua (keemasan). Sebagian merupakan bagian dari flora normal kulit dan mukosa yang jika dalam keadaan inang yang lemah imunitasnya dapat menimbulkan infeksi oportunistik berupa radang supuratif, abses, dan septikemia yang fatal. Staphylococcus yang patogen mampu menghemolisis darah, mengkoagulasi plasma, dan memproduksi berbagai enzim serta toksin (Jawetz, 2008)
Pada media cair, bakteri ini dapat membentuk formasi sel tunggal, berpasangan, tetrad dan rantai. Staphylococcus mudah tumbuh dalam berbagai media pada kondisi aerobik dan suhu 37°C. Bila kita ingin mendapatkan koloni yang berpigmen maka paling baik ditumbuhkan pada suhu suhu 20 – 25°C. Koloni pada media padat berbentuk bulat, permukaannya menonjol, halus dan sedikit berkilauan. S. aureus umumnya membentuk koloni berwarna putih hingga kuning keemasan. S. aureus mampu memfermentasi karbohidrat dan menghasilkan asam laktat serta gas dan menghasilkan enzim proteolitik. S. aureus
xv
2.3 Sifat Kultur
Staphylococcus aureus tumbuh dengan baik pada berbagai media bakteriologik dibawah suasana aerobik atau mikroaerofilik. Tumbuh dengan cepat pada temperatur 37°C namun pembentukan pigmen yang terbaik adalah pada temperatur kamar (20 - 35°C). Koloni pada media yang padat akan berbentuk bulat, halus, menonjol, dan berkilauan, membentuk berbagai pigmen berwarna kuning keemasan (Jawetz, 2008). Pada pembenihan cair menyebabkan kekeruhan yang merata tidak membentuk pigmen. Pada nutrient agar setelah diinkubasi selama 24 jam koloni berpigmen kuning emas, ukuran 2-4 mm, bulat, cembung tepi rata. Pada agar darah atau media BAP sekeliling koloni akan terlihat zona beta hemolisa (zona jernih) yang lebar.
2.4 Antigen
Staphylococcus aureus memiliki antigen pada dinding sel berupa polisakarida dan protein. Peptidoglykan yaitu suatu polimer polisakarida merupakan pembentuk dinding sel sehingga dinding sel kuat dan kaku. Materi ini dapat dirusak oleh zat asam kuat atau oleh lisozim. Peptidoglykan penting dalam patogenesis infeksi yaitu memicu produksi interleukin-1 (endogenous pyrogen) dan opsonicantibodies oleh sel monosit. Zat tersebut dapat menjadi kemoatraktan bagi sel lekosit polimorfonuklear (PMN), menyerupai endotoksin dan mengaktivasi komplemen. Teichoic acids yaitu polimer gliserol atau ribitol phosphat terikat dengan peptidoglycan dan berperan sebagai antigen. Antibodi terhadap antigen ini dijumpai pada pasien endokarditis karena infeksi S. aureus. Protein A merupakan komponen dinding sel S. aureus yang mampu berikatan dengan Fc portion IgG sedangkan Fab portion IgG mampu mengikat protein A dan tetap bebas atau mampu berikatan dengan antigen spesifik lainnya. Protein A merupakan reagensia penting dalam imunologi dan diagnostik misalnya ikatan protein A dengan IgG akan terjadi aglutinasi yang disebut koaglutinasi. Sebagian galur S. aureus memiliki kapsul yang dapat menghambat fagositosis oleh sel PMN. Mayoritas galur S. aureus memiliki koagulase dan clumping factor pada permukaan dinding selnya (Silva et al. 2000)
2.5 Patogenesis
xvi Enzim lainnya adalah lipase, -laktamase dan hyaluronidase atau spreading factor. Hyaluronidase adalah suatu staphylokinase yang menghasilkan fibrinolisis tetapi lebih lemah dibanding streptokinase (Jawetz, 2008)
Toksin alfa (α) merupakan protein heterogen yang memiliki efek broad spectrum terhadap permukaan sel eukariot, poten sebagai hemolisin. Toksin mampu mendegradasi sphingomyelin sehingga toksik bagi berbagai sel termasuk sel darah merah. Toksin delta (δ) bersifat heterogen, dapat dipisahkan menjadi subunit-subunit dalam larutan detergen non ionik. Secara medis toksin ini dapat merusak membran sel dan terlibat dalam diare yang disebabkan S. aureus.
Hemolisin gama ( ) merupakan substansi yang dapat berinteraksi dengan Panton- Valentine leukocidin yang efektif melisis lekosit dengan cara pembentukan lubang pada membran sel akibat peningkatan permeabilitas kation. Panton-Valentine leukocidin dapat melisis sel lekosit manusia dan kelinci. Toksin ini menjadifactor virulen penting pada galur Community Associated MRSA (CA-MRSA).
Epidermolytic toxins atau exfoliative toxins adalah superantigen yang memiliki dua bentuk yaitu Epidermolytic toxins A dan B yang memiliki berat molekul sama tetapi asal gen penyandinya berbeda. Epidermolytic toxin A disandi di kromosom, toksin bersifat heat-stable atau tahan pada suhu mendidih selama 20 menit. Epidermolytic toxin B disandi di plasmid dan toksinnya bersifat heat-labile. Kedua toksin ini mampu mengakibatkan deskuamasi pada pasien Staphylococcal Scalded Skin Syndrome (S4) karena merusak matriks mucopolysaccharide pada epidermis. Superantigen lainnya adalah toxic shock syndrome toxin-1 (TSST-1), yang serupa enterotoxin F. Toksin ini mengikat molekul MHC class II yang akan merangsang sel T sehingga timbul manifestasi toxic shock syndrome yaitu demam, syok multiorgan serta deskuamasi kulit. Gen penyandi TSST-1 ditemukan pada sekitar 20% isolate S. aureus (Jawetz, 2008).
Beberapa enterotoksin adalah enterotoksin A, B, C, D, E, G, H, I, K, L, M. Sekitar 50% galur S. aureus mampu memproduksi satu atau beberapa toksin tersebut. Semua enterotoksin adalah superantigen, heat-stable dan resisten terhadap enzim di saluran cerna. Pada kasus food poisoning, S. aureus akan memproduksi enterotoksin jika tumbuh dalam media karbohidrat dan protein. Seorang yang menelan β5 g enterotoksin B akan mengakibatkan muntah dan diare. Gen penyandi exfoliative toxins A, TSST-1, dan enterotoksin berada dalam kromosom dan disebut pathogenicity island.
Manifestasi klinis infeksi Staphylococcus adalah radang supuratif atau abses. Infeksi diakibatkan oleh kontaminasi pada luka misalnya luka pasca operatif atau akibat trauma seperti osteomielitis yang terjadi setelah fraktur atau meningitis setelah trauma kepala. S. aureus dapat menyebar karena bakteriemia yang dapat mengakibatkan endokarditis, acute hematogenous osteomyelitis, meningitis atau infeksi pulmonal.
2.6 Staphylococcosis Pada Kelinci
xvii menyerang peternakan kelinci, biasanya disebabkan oleh strain yang berasal dari biotype lain. Biotype ini berbeda dari strain manusia dan strain ayam pada umumnya, berdasarkan produksi beta hemolisinnya. S. aureus strain high virulent
pada kelinci, memiliki ciri hemolisin positif, staphylokinase negatif dan tipe pertumbuhan koloni berwarna ungu pada media agar crystal violet (Vancreynest et al. 2006).
2.7 Epidemiologi
Prevalensi dari S. aureus strain low virulence pada kelinci sulit untuk diperkirakan, mengingat bahwa infeksi yang disebabkan strain ini hanya menyerang sebagian kecil kelinci, dan bukan flok, beberapa infeksi mungkin ditemukan pada kelinci peliharaan maupun kelinci komersial. Masalah
staphylococcosis pada kelinci domestik pertama kali ditemukan di USA tahun 1963. Infeksi staphylococcosis pada kelinci menjadi penting di daerah Eropa barat sejak tahun 1980, ketika wabah mulai sering dilaporkan di beberapa negara Eropa (Corpa et al. 2009).
Hal ini mungkin berhubungan dengan konsekuensi yang terjadi akibat peningkatan pekerjaan yang berhubungan dengan peternakan kelinci komersial skala besar. Karena permintaan yang meningkat, produksi kelinci skala tradisional berkembang menjadi tingkat industrial atau semi industri. Peningkatan populasi ternak, meningkatkan kejadian infeksi penyakit, karena agen patogen mempunyai peluang lebih besar dalam penyebarannya ke seluruh flok.
Penyebaran Staphylococcosis pada peternakan kelinci dapat ditemukan baik pada kondisi sanitasi yang bagus maupun kondisi buruk. Hal ini mengindikasikan bahwa faktor management tidak mempengaruhi penyebaran penyakit pada peternakan kelinci, melainkan akibat interaksi bakteri dengan inangnya. Menurut Hermans et al. (2003) bahwa strain high virulence memiliki kemampuan lebih baik dalam membentuk koloni pada epitel inang. Koloni yang baik akan menyebabkan peningkatan infeksi, yang akhirnya akan menginduksi penampakan penyakit pada flok.
Transmisi dari S. aureus strain high maupun low virulence dari manusia ke kelinci atau dari kelinci ke kelinci dapat secara langsung maupun tidak langsung, melalui kandang, rambut maupun makanan. Penularan secara langsung dari bakteri S. aureus dapat melalui kontak langsung antara induk dengan anak yang masih menyusu, antara sesama anak kelinci dalam satu litter maupun dalam litter yang berbeda. Hamed & Youssef (2013) menemukan bahwa peternakan kelinci yang terinfeksi dengan strain S. aureus yang identik seringkali memiliki riwayat kontak langsung maupun tidak langsung, dan pengambilan kelinci baru pada flok kemungkinan menjadi sumber utama dari infeksi. Sperma yang diambil pada saat inseminasi buatan juga memunculkan potensi resiko infeksi S. aureus strain high virulence pada kelinci.
xviii
2.8 Gejala Klinis
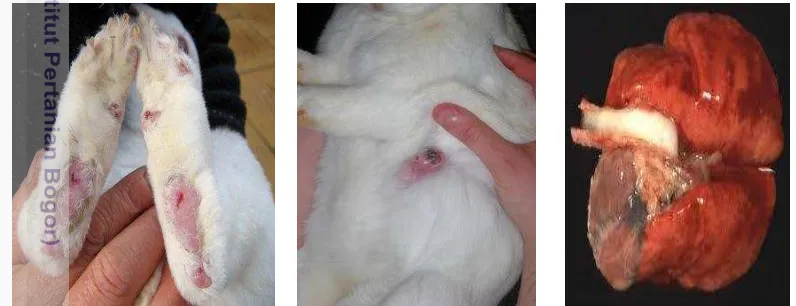
Secara umum, infeksi S. aureus menyebabkan lesi suppuratif atau bentukan abses pada lokasi infeksi. Menurut Vancreynest et al. 2004 bahwa lesi yang disebabkan oleh S. aureus terutama berupa abses subkutan, pododermatitis dan mastitis. Gambar lesi ditunjukkan pada Gambar 2. Dari lesi primer, septicaemia dapat muncul, disertai abses pada organ dalam seperti hepar, paru, dan uterus. Gejala klinis yang muncul dapat berbeda sesuai dengan umur dari hewan yang terinfeksi. Kelinci baru lahir yang belum mempunyai bulu dapat menderita dermatitis exudative dengan pustula superfisial. Seringkali, dapat menginfeksi seluruh kelinci dalam satu litter, dan diikuti jumlah kematian yang tinggi, terutama pada dua minggu pertama setelah lahir. Pada kelinci muda, abses subcutan, konjungtivitis dan rhinitis purulen seringkali ditemukan. Abses subkutan dan pododermatitis sering menyerang kelinci pedaging maupun indukan. Sedangkan pada kelinci dari segala umur, dapat dijumpai abses internal seperti pada paru dan hepar, arthritis, parodontitis, sinusitis dan otitis media (Hermans et al. 2003).
Pada penelitian yang dilakukan oleh Rossel & de La Fuente (2009) ada sedikitnya 15% dari calon induk yang harus direplacement sebelum mereka mencapai usia satu tahun, sebagai akibat dari staphylococcosis. Sering ditemukan kematian induk akibat staphylococcosis dapat menyebabkan kematian seluruh anak dalam satu litter.
Gambar 2. Bentuk pododermatitis, mastitis dan abses pada paru kelinci akibat infeksi S. aureus
2.9 Pengendalian
Pada kelinci yang terinfeksi S. aureus strain low virulence, terapi dapat dilakukan dengan cara draining dan pembersihan abses subkutan dan dengan terapi antibiotik. Terapi tersebut hanya umum dilakukan pada kelinci peliharaan, bukan kelinci ternak.
xix
Immunoglobulin
adalah dengan cara memotong seluruh ternak dalam satu flok, kemudian melakukan pembersihan dan desinfeksi menyeluruh, dan memulai dari awal lagi dengan kelinci yang baru, yang berasal dari peternakan kelinci yang tidak terinfeksi.
2.10 Imunoglobulin Y
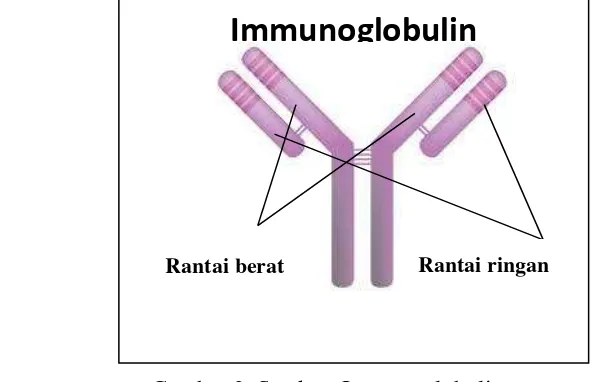
Imunoglobulin atau antibodi adalah sekelompok glikoprotein yang terdapat dalam serum atau cairan tubuh pada hampir semua mamalia. Satu unit struktur antibodi adalah glikoprotein yang terdiri dari empat rantai polipeptida. Semua antibodi memiliki struktur yang sama yaitu dua rantai pendek (VL) dan dua rantai panjang (VH), kedua bentuk tersebut dihubungkan dengan bentuk kovalen (disulfida).
Gambar 3. Struktur Immunoglobulin
Imunoglobulin utama yang terdapat pada kuning telur ayam adalah Imunoglobulin Y (IgY) yang merupakan salah satu kelas antibodi di dalam serum darah dan kuning telur kelompok amfibi, reptil dan unggas. Immunoglobulin Y memiliki beberapa sifat unik namun memiliki fungsi yang sama dengan IgG pada mamalia. Tiga kelas immunoglobulin yang sama seperti Ig mamalia yaitu Ig A, IgM dan IgY (Carlender 2002). IgY menyusun sekitar 75% dari total immunoglobulin, konsentrasi serum dari IgY, IgA dan IgM yaitu 5.0, 1.25 dan 0.61 mg/ml. Secara keseluruhan struktur IgY menyerupai IgG mamalia dengan dua rantai ringan dan rantai berat. Molekul ini memiliki masa 167.259 kDa, sedikit lebih besar dari IgG (160 kDa) (Carlender 2002).
Pada tahun 1893 Klemperer menyatakan bahwa imunisasi terhadap ayam petelur menghasilkan transfer antibodi spesifik dari serum ke kuning telur. Mekanisme transfer IgY dari serum ke dalam kuning telur berlangsung seperti proses transfer antibodi lintas plasenta pada mamalia. IgY yang telah diproduksi oleh limfosit B akan mengalir dalam pembuluh darah ke seluruh bagian tubuh termasuk ke dalam ovarium. IgY didepositkan melalui jaringan arteri kecil ovarium-oosit ke dalam kuning telur sebagai bahan perlindungan bagi embrio yang akan berkembang (Carlander 2002).
xx Gambar 4. Immunoglobulin Y ditransfer dari serum induk ke dalam kuning telur, sedikit IgA dan IgM terdapat dalam putih telur. (IgY biotek.inc)
Ayam mentransfer antibodi protektifnya kepada calon anak melalui telur, seperti halnya mamalia melalui kolostrum maupun plasenta. IgY ditransfer melalui dua cara, yaitu melalui epitel folikel dari ovarium selama masa oogenesis, serupa transfer IgG melalui plasenta pada mamalia (transplacenta), dan melalui kantung kuning telur selama masa embrio Tiga jenis immunoglobulin ditransfer melalui jalur tersebut. IgA dan IgM terdapat dalam putih telur dalam konsentrasi yang sangat rendah, sedangkan IgY dalam jumlah besar (8-25 mg/ml) terdapat dalam kuning telur (Lee et al. 2009) atau 100 sampai 150 mg / butir telur. Hal ini sejalan dengan penelitian Rawendra (2005) yang menyatakan bahwa konsentrasi IgY kuning telur segar sebesar 105 mg / kuning telur, dimana setiap butir kuning telur menghasilkan 170 ml larutan WSF kuning telur, dan terkandung 0,19 gram IgY WSF kuning telur kering beku.
Seperti protein pada umumnya, IgY juga mudah mengalami denaturasi suhu, pH maupun aktivitas enzim protease. Stabilitas aktivitas netralisasi terhadap peningkatan keasaman dan suhu Ig Y lebih rendah dibandingkan Ig G (Pauly et al. 2011). Aktivitas IgY dapat dipertahankan cukup lama pada suhu 37 ºC. menurun dengan cepat, penurunan aktivitas tersebut disebabkan oleh perubahan konformasi (Michael et al. 2010).
2.11 Imunoglobulin Y Sebagai Imunoterapi
xxi profilaksis pada pakan ternak sebagai pencegahan terhadap serangan mikroba patogen.
Terapi peroral menggunakan IgY kuning telur bermanfaat sebagai imunoterapi, karena IgY akan berperan seperti secretory IgA (sIgA) untuk melindungi mukosa terhadap adhesi patogen enteric dengan cara membentuk ikatan spesifik. Ikatan spesifik tersebut memudahkan musin untuk mengeluarkannya melalui saluran pencernaan. Immunoglobulin Y tidak menimbulkan resistensi sebagaimana antibiotik dan dapat digunakan untuk pengobatan patogen yang telah resisten terhadap antibiotik.
Immunoglobulin Y banyak dimanfaatkan sebagai imunisasi pasif untuk melawan penyakit berasal dari bakteri, virus, maupun antigen lainnya. Hu et al.
xxii
III METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian dilakukan pada bulan Desember 2014 sampai dengan Mei 2015 bertempat di Laboratorium Mikrobiologi Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran Hewan, Institut Pertanian Bogor, dan Unit Kandang Percobaan Balai Penelitian Ternak Ciawi.
3.2 Bahan dan Metode pakan ayam komersial, spuit 1 ml, spuit 3 ml, kapas, alkohol 70%, akuades, mili-Q, pewarnaan Gram.
Alat yang digunakan adalah kandang ayam lengkap dengan tempat makan dan minum, mikrotube, inkubator, sentrifus, tabung, penangas air, perlengkapan AGPT, mikroskop, magnetic stirrer, vortex, spektrofotometer UV (Hitachi).
3.2.2 Metode Penelitian
Penelitian ini dilakukan dalam dua tahap yaitu :
1. Tahap pertama yaitu produksi IgY spesifik S. aureus
2. Tahap kedua yaitu aplikasi IgY spesifik S. aureus pada kelinci
Tahap 1. Produksi IgY spesifik Staphylococcus aureus 1) Isolat Bakteri
Sampel diambil dari organ paru kelinci yang dipelihara di kandang percobaan Balai Penelitian Ternak Ciawi yang menderita gangguan pernafasan, kemudian digoreskan pada media mannitol agar dan agar darah serta diinkubasi 18 jam pada suhu 37°C. Koloni yang diduga S. aureus pada media agar mannitol dan agar darah diidentifikasi dengan pewarnaan Gram, morfologi koloni, dan tipe hemolisisnya. Strain dikonfirmasi dengan uji koagulase dengan plasma kelinci.
2) Kultur Biakan Antigen Murni untuk Dijadikan Vaksin Inaktif
Antigen yang digunakan untuk vaksinasi adalah bakteri S. aureus yang telah dibiakkan pada media agar darah (Blood Agar).Isolat bakteri kemudian dibiakkan pada media Brain Heart Infusion Broth sebanyak 50 ml pada suhu 37°C selama 24 jam. Suspensi disentrifugasi pada kecepatan 10000 rpm selama 10 menit kemudian pelet diresuspensikan dengan 5 ml NaCl fisiologis, disentrifugasi pada 10000 rpm 10 menit dan dilakukan 2 kali (Lawrence et al. 2012). Pelet dilarutkan dalam 5 ml NaCl fisiologis kemudian dihomogenkan dan diukur pada
xxiii 3) Produksi Antibodi S.aureus pada ayam
Enam ekor ayam petelur Single Comb Brown Leghorn berumur 16 minggu dibagi menjadi 2 kelompok yaitu 5 ekor ayam disuntikkan antigen dan 1 ekor ayam sebagai kontrol. Pemberian antigen dilakukan sebanyak 4 kali, minggu pertama, disuntikkan antigen S. aureus secara intravena sebanyak 0,5 ml (109 CFU) per ekor (Carlender 2002). Sepuluh hari setelah penyuntikan pertama, antigen dicampur dengan Freund’s Adjuvant Complete, dan disuntikkan secara subkutan sebanyak 1 ml (109 CFU), sedangkan minggu ketiga dan keempat menggunakan Freund’s Adjuvant Incomplete diberikan sebanyak 1 ml (109 CFU) per ekor subkutan (Hermans et al. 2014). Satu minggu setelah imunisasi pertama, dilakukan pengambilan darah untuk koleksi serum.Keberadaan antibodi diuji menggunakan teknik Agar Gel Precipitation Test.
4) Persiapan Antigen Terlarut untuk Uji Agar Gel Presipitasi
Isolat bakteri ditumbuhkan pada 50 ml media BHI, diinkubasi pada suhu 37 °C selama 18 jam. Suspensi disentrifugasi pada kecepatan 10000 rpm selama 10 menit. Pelet yang dihasilkan diresuspensikan dengan 5 ml NaCl, dan dilakukan 2 kali pencucian. Pelet ditambahkan dengan 0,5 ml HCl 0,2 N kemudian ditangas pada suhu 52 °C selama 1 jam. Selanjutnya homogenat dititrasi dengan NaOH 1 N, menggunakan indikator Phenol Red.Suspensi disentrifugasi pada 10000 rpm selama 10 menit, dilakukan 2 kali. Supernatan yang dihasilkan nantinya digunakan sebagai antigen terlarut (Wibawan & Laemmler1992).
5) Agar Gel Presipitation Test (AGPT)
Pengujian keberadaan IgY pada serum darah sebagai respon vaksinasi S. aureus dilakukan dengan teknik agar gel presipitation test (AGPT). Sebanyak 0,4 gr agarose dan 1,2 gr polietilen glikol dilarutkan dalam 20 ml PBS pH 7,2 dan 20 ml aquades. Larutan agar ditangas dalam air mendidih sampai larut, dituang pada gelas objek sebanyak 4 ml dan dibiarkan mengeras pada suhu ruang. Sumuran dibuat dengan puncher, pada sumur tengah diteteskan antigen S. aureus sebanyak 25µl sedangkan sumur-sumur bagian tepi diisi serum masing-masing sebanyak 25 µl, kemudian disimpan di tempat lembab pada suhu ruang. Pengamatan dilakukan setelah 24 sampai 48 jam. Garis presipitasi akan terbentuk pada daerah antara sumur tengah dan tepi apabila terdapat ikatan antigen-antibodi spesifik.
6) Ektraksi Immunoglobulin Y (IgY)
xxiv PBS pH 7,4 sebanyak 5 ml dan ditambahkan 2 tetes Na acid 0,02%. Suspensi ini didialisis dalam larutan PBS pH 8 selama 24 jam (Polson et al. 1980). Setelah di ekstraksi IgY dihitung konsentrasinya dengan spektrofotometer pada panjang gelombang 280 nm.
7) Penentuan konsentrasi dan berat molekul IgY
Konsentrasi protein IgY ditentukan dengan menggunakan metode
Bradford (Priyanka et al. 2013). Absorbansi sampel ditentukan dengan pembacaan pada UV spektrofotometer pada 595 nm. Konsentrasi sampel dihitung berdasarkan kurva larutan standar dengan bovine serum albumin. Penentuan berat molekul IgY dilakukan dengan SDS-PAGE (Sodium Dodecyl Sulfate Polyacrylamide Gel Electrophoresis) menggunakan konsentrasi gel pemisah 12% dan gel pengumpul 14%. Perwarnaan gel menggunakan silver staining, dan perkiraan bobot molekul protein berdasarkan perbandingan dengan bobot molekul marker umum fermentas life science.
8) Produksi pellet plus IgY S. aureus
Dalam penelitian ini digunakan 3 macam perlakuan dosis IgY yaitu 5%, 10% dan 20%. Pakan kelinci dihaluskan dengan blender kemudian dimasukkan ke dalam gelas beker dan ditambahkan kuning telur yang mengandung IgY spesifik anti S. aureus. Perbandingan jumlah antara kuning telur yang mengandung IgY spesifik S. aureus dengan pakan komersial untuk membuat pakan dengan Ig Y 5% (w/w) adalah 50 gr : 1000 gr, 10%(w/w) adalah 100gr : 1000 gr dan 20% (w/w) adalah 200 gr : 1000 gr. Masing-masing campuran ditambahkan PBS 1x sebanyak 5 ml sedikit demi sedikit sambil diaduk hingga homogen. Setelah homogen, campuran pakan tersebut digiling dan dicetak dengan alat penggiling sehingga ukuran pakannya 2 mm. Kemudian pakan dikeringkan dalam oven pada suhu 60°C selama 30 menit.
Tahap 2. Aplikasi IgY spesifik S. aureus pada kelinci
9) Imunisasi pasif dengan Ig Y spesifik S.aureus
Kelinci jenis New Zealand White umur 2 bulan, diadaptasi selama 1 (satu) minggu dengan pakan standar sebelum dilakukan perlakuan. Perlakuan dikelompokkan pada kelompok dosis IgY 5%, 10%, 20%, dan kelompok kontrol (tanpa IgY) , masing-masing kelompok perlakuan terdiri dari 5 ekor kelinci.
10) Uji Tantang
Minggu kedua pasca pemberian pakan perlakuan, kelinci disuntikkan sediaan S. aureus dengan dosis sebesar 109CFU secara sub kutan. Pengamatan dilakukan selama 7 hari yang meliputi beberapa parameter yaitu gejala klinis, jumlah kematian, perubahan patologi anatomi dan histopatologi.
3.3 Analisa Data
xxv
IV HASIL DAN PEMBAHASAN 4.1 Isolasi dan Identifikasi S. aureus
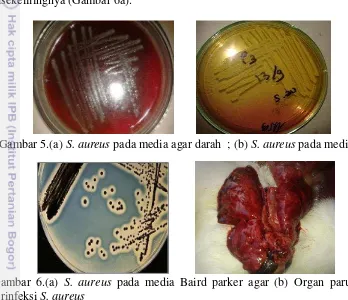
Hasil identifikasi menunjukkan bahwa semua isolat yang berasal dari organ paru kelinci yang diduga menderita staphylococcosis mampu menfermentasi MSA, bersifat Gram positif, berbentuk kokus, positif pada uji: koagulase, katalase, uji fermentasi glukosa dan laktosa. Isolat bakteri pada biakan agar darah menunjukkan dengan adanya pertumbuhan sel bakteri berukuran ± 2 mm berwarna putih, hemolise dan koloni berwarna kuning pada biakan agar manitol (Gambar 5a dan b), sedangkan pada media baird parker agar menunjukkan pertumbuhan koloni hitam mengkilap dengan zona bening disekelilingnya (Gambar 6a).
Gambar 5.(a) S. aureus pada media agar darah ; (b) S. aureus pada media MSA
Gambar 6.(a) S. aureus pada media Baird parker agar (b) Organ paru kelinci terinfeksi S. aureus
Lesi post mortem dari kelinci yang dinekropsi yaitu berupa gejala hemoragi, serta abses pada organ paru (Gambar 6b). Menurut Ferreira et al. (2014) bahwa gambaran patologis paru kelinci penderita pneumonia yang diakibatkan oleh S. aureus memiliki gejala berupa penumpukan exudat mukopurulen pada trakea dan abses pada paru maupun hati.
xxvi dilakukan pada umur 14 minggu, 30 hari sebelum periode awal bertelur tidak ditemukan penurunan kemampuan bertelur maupun efek samping selama proses imunisasi.
Hasil percobaan menunjukkan bahwa kombinasi penyuntikan antigen dengan Freund Adjuvant Complete (FCA) maupun Freund Adjuvant Incomplete
(FAI) tidak mempengaruhi kapasitas bertelur ayam selama proses imunisasi. Lin
et al. (2014) menunjukkan hasil yang sama, menggunakan FCA pada imunisasi pertama dilanjutkan FAI pada dua imunisasi berikutnya dan menghasilkan produksi immunoglobulin yang tinggi dengan puncak produksi dua bulan setelah imunisasi lengkap berakhir.
Molekul IgY spesifik S. aureus pada kuning telur dan serum ayam dideteksi dengan menggunakan uji agar gel presipitasi (AGP). Keberadaan IgY spesifik S. aureus ditandai dengan pembentukan garis presipitasi pada agar gel (Gambar 3a dan b.)
Gambar 7. Hasil uji AGPT pada Kuning Telur (a); hasil uji AGPT Serum (b)
Garis presipitasi yang terbentuk pada media agar terjadi karena adanya keseimbangan antara konsentrasi antigen dan antibodi dalam kuning telur maupun serum. Perbandingan konsentrasi antigen dan antibodi adalah faktor penting dalam reaksi presipitasi. Pada rasio yang seimbang, akan terbentuk ikatan silang yang ekstensif dan terjadi bentukan kisi-kisi. Kisi kisi ini berkembang menjadi lebih besar, tidak larut dan akhirnya mengendap. Ikatan kompleks antigen-antibodi yang mengendap dan terlihat seperti garis berwarna putih ini disebut garis presipitasi (presipitat).
Molekul IgY S. aureus terdeteksi di dalam serum tujuh hari setelah imunisasi terakhir. Molekul IgY S. aureus yang terbentuk di dalam serum pada minggu ke 5 merupakan antibodi spesifik terhadap S. aureus, hal ini sejalan dengan Hidayat & Pasaribu(2010)yang menyatakan bahwa injeksi dosis pertama akan menghasilkan antibodi spesifik didalam serum dan injeksi dengan sel-sel bakteri akan memunculkan reaksi antibodi sepuluh sampai empat belas hari pasca injeksi. IgY dalam telur mulai terdeteksi pada minggu ke-6 setelah imunisasi pertama, dan 7 hari setelah ditemukannya IgY dalam serum, hal ini terjadi karena diperlukan waktu dari sirkulasi darah sampai terakumulasi dalam telur (Tabel 1).
xxvii Tabel 1. Hasil uji AGP pada serum dan kuning telur
Status Vaksinasi Serum Kuning Telur
Pra Vaksinasi - -
minggu 1 - -
minggu 2 - -
minggu 3 - -
minggu 4 - -
minggu 5 + -
minggu 6 + +
minggu 7 + +
Minggu 8 + +
Minggu 9 + +
Minggu 10 + +
Minggu 11 + +
Minggu 12 + +
4.2 Konsentrasi dan Bobot Molekul IgY
Ig Y yang didapatkan memiliki konsentrasi rata-rata sebesar 1,696 mg/ml. Hasil ini relatif lebih rendah dibandingkan dengan hasil IgY WSF yang dihasilkan oleh Poetri et al. (2008) yaitu 3,95 mg/ml. Rendahnya Ig Y yang dihasilkan kemungkinan diakibatkan oleh tertinggalnya Ig Y pada saat proses purifikasi akibat protein tidak terpisah dengan baik sehingga tidak di dapat konsentrasi maksimal. Proses dan lama penyimpanan juga dapat mempengaruhi konsentrasi protein dalam telur.
xxviii Gambar 8. Profil pita protein IgY S. aureus yang telah dipurifikasi (a) IgY rantai berat 60kDa (b) IgY rantai ringan 25kDa
4.3 Imunisasi Pasif IgY Spesifik S.aureus per Oral
Pemberian pakan yang mengandung IgY S. aureus diharapkan mampu meningkatkan daya tahan tubuh kelinci ketika terinfeksi bakteri ini. Cara pemberian imunisasi pasif melalui pakan formula akan mengurangi stres pada kelinci jika dibandingkan dengan pemberian melalui injeksi.
Imunoglobulin Y yang masuk dalam bentuk pellet ke dalam saluran pencernaan kelinci baik utuh maupun yang telah terdenaturasi tetap memberikan kontribusi terhadap pertambahan bobot badan kelinci, karena aplikasinya berupa kuning telur utuh yang dicampurkan kedalam pelet ternak. Terdapat perbedaan pertambahan berat badan diantara kelompok perlakuan, khususnya pada kelompok dosis 20% (P3). (Tabel 2) nyata pada taraf uji 5% (uji selang berganda Duncan)
xxix Selama percobaan berlangsung terjadi kematian pada kelompok kontrol maupun perlakuan, namun tidak memberi perbedaan nyata pada gejala perubahan suhu badan, nafsu makan, frekuensi pernafasan dan luka superfisial. Kelompok perlakuan P2 dan P3 memiliki angka morbiditas lebih rendah dibandingkan P1, pada kelompok P2 dan P3 tidak terjadi kematian selama percobaan, sedangkan tingkat mortalitas P1 sebanding dengan kelompok kontrol yang tidak mendapat IgY pada pakan. (Tabel 3)
Percobaan yang dilakukan oleh Hang & Kim (2013) menunjukkan bahwa Ig Y yang terdapat pada kuning telur gagal meningkatkan performa babi. Penjelasan yang mungkin adalah Ig Y gagal menembus saluran gastrointestinal, karena strukturnya yang memiliki berat molekul yang besar, sehingga kurang stabil dan tidak fleksibel. Aktivitas Ig Y menurun pada pH 3,5 atau kurang dan kehilangan kemampuannya sama sekali pada pH 3. Immunoglobulin Y juga sangat sensitif terhadap enzim pepsin, oleh karena itu beberapa percobaan dilakukan dengan mengkapsulasi Ig Y agar dapat terlindung dari inaktivasi oleh lambung.
Fenomena berbeda ditunjukkan oleh Farooq et al. (2012) yang menyatakan bahwa pemberian IgY spesifik Infectious Bursal Disease Virus (IBD) secara subkutan pada ayam yang diuji tantang dengan virus IBD menurunkan tingkat morbiditas dan mortalitas. Begitu pula yang dilakukan oleh You et al. (2014) yang memberikan imunisasi pasif menggunakan IgY secara parenteral dan intraperitoneal pada mencit dapat memberikan efek sistemik pada uji tantang.
xxx
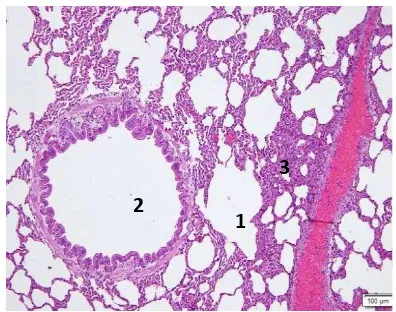
Gambar 9. Paru Kelinci grup kontrol yang diuji tantang dengan S. aureus tanpa pakan IgY mengalami pneumonia, oede-ma pulmonum dan peribroncheolitis. 1. Alveolar, 2. Broncheolus, 3. Pneumonia, 4. Oedema HE. x100.
Gambar 10. Paru kelinci grup kontrol yang diuji tantang dengan S. aureus mengalami Pneumonia. 1. Alveolar dan 2. Broncheo-lus berisi sel darah merah. HE. x200
Gambar 11. Paru – paru kelinci grup P1 (IgY 5%) yang diuji tantang dengan S.
aureus mengalami pneumonia, 1.
xxxi
Gambar 13. Paru-paru kelinci grup P3 (IgY 20%) yang diuji tantang dengan S. aureus mengalami peribronchiolitis ringan. 1. Broncheolus dan 2. Infiltrasi sel mononuclear. HE. x200.
Hasil penelitian menunjukkan bahwa masing-masing kelompok perlakuan P1 (IgY 5%), P2 (IgY 10%) dan P3 (IgY 20%) organ paru mengalami pneumonia, dengan derajat keparahan berbeda dan masing-masing terdapat sebaran sel-sel mononuklear neutrofil, sebagai tanda terjadinya infeksi bakteri. Neutrofil adalah sel darah putih yang merespon pada infeksi bakteri, terutama infeksi pyogenik. Neutrofil biasa muncul pada saat inisiasi sistem imun non spesifik atau innate immunity dan merupakan bagian penting mekanisme pertahanan pertama terhadap infeksi. Pernyataan ini didukung oleh Ferreira et al. (2014) yang menyatakan bahwa karakteristik dari pneumonia yang disebabkan oleh S. aureus adalah tingginya respon imun dari host yang ditandai dengan proses penarikan neutrophil ke tempat infeksi khususnya paru-paru.
Pemberian dosis IgY 10% (grup P2) dan 20% (grup P3) pada pakan selama 14 hari memberikan hasil yang lebih baik dibandingkan dosis IgY 5% (grup P1), ditunjukkan dengan penurunan keparahan pneumonia pada pemeriksaan histopatologis paru. Pneumonia yang terjadi pada kelompok perlakuan P2 dan P3 (Gambar 8 & 9) lebih ringan dibandingkan dengan kelompok perlakuan P1 (Gambar 7).
Efikasi pemberian IgY peroral lebih banyak diteliti pada jenis bakteri-bakteri yang menyerang saluran pencernaan, karena mekanisme IgY sebagai antibodi yang dapat menempel pada berbagai patogen enterik yang terdapat pada permukaan mukosa pencernaan sehingga dapat mencegah perlekatan dan pertumbuhan bakteri lebih lanjut. Hasil yang didapatkan oleh Herman et al.
(2014) dengan melakukan imunisasi pasif pada ayam broiler menggunakan IgY secara peroral mampu mengurangi kolonisasi bakteri Campylobacter jejuni pada mukosa usus. Suartini et al. (2014) menyatakan pemberian IgY spesifik parvovirus secara parenteral sebagai imunisasi pasif pada anjing dapat menurunkan sekresi virus parvo dan meningkatkan survival rate pada uji tantang.
IgY yang diproduksi dalam penelitian ini merupakan IgY spesifik S. aureus, dimana bakteri tersebut merupakan patogen yang umum ditemukan dalam kasus gangguan pernafasan. Pemberian IgY peroral pada percobaan ini
1
xxxiii
V KESIMPULAN DAN SARAN Kesimpulan
Imunisasi pasif menggunakan IgY spesifik S. aureus dengan dosis 10% dan 20% berhasil menurunkan tingkat morbiditas dan mortalitas pada kelinci yang menderita staphylococcosis.
Saran
1. Perlu dilakukan penelitian lebih lanjut tentang aplikasi IgY S. aureus
dengan dosis pemberian diatas 20% dan rute aplikasi yang berbeda untuk meningkatkan perlindungan terhadap staphylococcosis.
xxxiv
Bien J, Sokolova O, and Bozko P. 2011. Characterization of Virulence Factors of
Staphylococcus aureus: Novel Function of Known Virulence Factors That Are Implicated in Activation of Airway Epithelial Proinflammatory Response. J Pathogens Volume 2011, Article ID 601905, 13 pages doi:10.4061/2011/601905
Carlander D. 2002. Avian Immunoglobulin Y Antibodi In Vitro and In Vivo.Dissertation. Universities Upsaliensis. Upsala
Christopher M, André T, Daniel P, Yves B. 2013. Refinement of the production of antigen-specific hen egg yolk antibodies (IgY) intended for passive dietary immunization in animals. Review. Biotechnol. Agron. Soc. Environ. 17(3), 483-493
Corpa JM., Hermans K., Haesebrouck F. 2009. Main pathologies associated with
Staphylococcus aureus infections in rabbits: a review. World Rabbit Sci., 17: 115-125. doi: 10.4995/wrs.2009.651
de Paula VS, da Silva AS, de Vasconcelos GA, Iff ET, Silva ME, Kappel LA. 2011. Applied biotechnology for production of immunoglobulin Y specific to hepatitis A virus. J Virol Methods ; 171 (1): 102-106. Dubie T, Yimer S, Adugna M and Sisay T. 2014. The potential application of
avian egg antibodies with emphasis on immunotherapeutic and immunodiagnostic purpose. Advanced Research Journal of Biochemistry and Biotechnology: Vol. 1(3): pp 018-030
Diraviyam T, Zhao B , Wang Y , Schade Ru,Antonysamy M and Zhang X . 2014. Effect of Chicken Egg Yolk Antibodies (IgY) against Diarrhea in Domesticated Animals: A Systematic Review and Meta-Analysis
PLoS One; 9(5): e97716
Farooq A, Rabbani M, Muhammad K, Akram Z, Ahad A, Fatima Z, Kamal T and Anwar Z. 2012. Passive immunization in infectious bursal disease virus infected birds using chemically purified immune yolk immunoglobulins (IgY). Afrc J Micr Research Vol. 6(12), pp. 2993-2998
Ferreira A, Monteiro J.M, Vieira-Pinto M. 2014. The importance of subcutaneous abscess infection by Pasteurella spp. And Staphylococcus aureus as a cause of meat condemnation in slaughtered commercial rabbits.
World Rabbit Sci. 2014, 22: 311-317. doi:10.4995/wrs.2014.2238 Hamed DM. and Youssef AI. 2013. Clinical Features of Methicillin-Resistant
Staphylococcus aureus (MRSA) Infection in Rabbits and its Zoonotic Potentials.Pakistan Journal of Nutrition 12 (3): 244-249, ISSN 1680-5194
xxxv titer in pre-and post-weaned pigs. Wayamba J Anim Sci 578X: 590– 597.
Hermans D, Steendam K, Verbrugghe E, Verlinden M, Martel A, Seliwiorstow T, Heyndrickx M, Haesebrouck F, Zutter L ,Deforce D, Pasmans F. 2014. Passive immunization to reduce Campylobacter jejuni colonization and transmission in broiler chickens. Veterinary Research 2014, 45:27
Hermans K., Devriese L.A., Haesebrouck F., 2003. Rabbit staphylococcosis: difficult solutions for serious problems. Vet. Microbiol., 91: 57-64. doi:10.1016/S0378-1135(02)00260-2
Hidayat R, Pasaribu FH. 2010. Formulasi Susu Berkhasiat Anti Flu Burung Dan Anti Diare; Produksi Imunoglobulin Y Dalam Berbagai Bentuk.
Jurnal Ilmu Pertanian Indonesia Vol. 15 No.2 hlm 65-70
Hu QX , Zhang L, Li F, Xu. 2014. Production of Egg Yolk Antibody (IgY) against Recombinant Porcine Epidemic Diarrhea Virus COE Protein.
Acta Scientiae Veterinariae. 42: 1181.
Indrawati A 2010. Telur Ayam 3 in one dan Anti Diare : Produksi, Efikasi, dan Aplikasinya. Laporan Akhir Penelitian Institut Pertanian Bogor. Jawetz M, Adelberg. 2008. Mikrobiologi Kedokteran. Jakarta : EGC.p.199 – 200 :
233.
Kovacs- Nolan J, Mine Y. 2012. Egg yolk antibodies for passive immunity. Annu. Rev. Food Sci. Technol., 3, 163-182.
Lawrence PK, Bachra R, Barbe NA, Eric LS, Junzo Norimine, Lahmers KK, Brown WC. 2012. CD4 T Cell Antigens from Staphylococcus aureus
Newman Strain Identified following Immunization with Heat-Killed Bacteria. Clin Vaccine Immunol 19(4): 477–489. doi: 10.1128/CVI.05642-11
Lee SH, Lillehoj HS, Park DW. 2009. Induction of passive immunity in broiler chickens against Eimeria acervulina by hyperimmune egg yolk immunoglobulin Y. Poultry Science ;88:562-6.
Lin YF, Liou JF, Chen LR, Lien TF. 2014. IgY Production by Taiwan Native Tsaiya Ducks and White Leghorn Laying Hens. J Agri Sci; Vol. 6, No. 9; ISSN 1916-9752 E-ISSN 1916-9760
Lu, Y.N, Liu, J.J, Jin, L.J. 2009. Passive immunization of crayfish (Procambius clarkiaii) with chicken egg yolk immunoglobulin (IgY) against white spot syndrome virus (WSSV). Appl Biochem Biotechnol.;159:750-8. M.E. Cook and D.L. Troot 2010. IgY Immune component of eggs as a source of
passive immunity for animals and humans. World's Poultry Science Journal, 66, pp 215-226. doi:10.1017/S0043933910000279.
Mahde N K. 2011. The pathogenesis of experimental infection by Staphylococcus aureus in rabbits. Kufa J Vet Med Sci Vol. (2) No. (2)
Matheis W, Schade R. 2011. Development of an IgY-based rocket-immunoelectrophoresis for identity monitoring of Pertussis vaccines.
J Immunol Methods.; 369 (1-2): 125-132.
xxxvi Poetri ON, Retno DS, Indrawati A, Wibawan IWT. 2008. Peran Antibodi Kuning Telur (IgY) Sebagai Opsonin Untuk Pencegahan Serangan Mutan Streptococcus Serotipe D (Streptococcus sobrinus) Berk. Penel. Hayati: 13 (129–134)
Polson A, Von WM Van RM.1980. Isolation of Viral IgY Antibodies from Yolks of Immunized Hens. Immunol Commun. 9:475-493.
Prabhudas M, Adkins B, Gans H. 2011. Challenges in infant immunity: implications for responses to infection and vaccines. Nat Immunol
12:189-194
Priyanka BS , Abhijith KS , Navin KR , Raghavarao MS & Thakur MS . 2013. Integrated Approach for the Extraction and Purification of IgY from Chicken Egg Yolk. Separation Science and Technology Volume 49, Issue 4 pages 562-568 DOI:10.1080/01496395.2013.855231
Rawendra R. 2005. Prospek pengembangan Imunoglobulin Y (IgY) kering bekusebagai nutraceutical food anti Enteropathogenic Escherichia coli (ETEC).[Disertasi]. Bogor(ID): Institut Pertanian Bogor.
Rosell JM, de la Fuente LF. 2009. Culling and mortality in breeding rabbits. Prev. Vet. Med., 88: 120-127.
Sentila R, Karthika S, Michael A and Gandhimathi A. 2013. Protection against Dental Carries by Passive Immunization with Hen Egg Yolk Antibody Using Cell Associated Glucosyltransferase of Streptococcus mutans. J Med Microb Diagn, 2:3 http://dx.doi.org/10.4172/2161-0703.1000125
Silva, Wladimir PD, Teresa M, Landgraf, Mariza, Bernadette D.G.M. 2000. Biochemical characteristics of typical and atypical Staphylococcus aureus in mastitic milk and environmental samples of Brazilian dairy farms. Brazilian Journal of Microbiology, 31(2), 103-106.
Suartini GAA, Suprayogi A, Wibawan IWT, Sendow I, Mahardika GNK. 2014. Intravenous administration of chicken immunoglobulin has a curative effect in experimental infection of canine parvovirus. Glob Vet. 13:801-808.
Sunwoo HH, Lee EN, Menninen K,Suresh MR, Sim JS. 2002. Growth inhibitory effect of chicken egg yolk antibodi (lgY) on Escherichia coli 0157:H7. Journal of Food Sci. 67:1486-1494
Tobias F L, Garcia L N N, Kanashiro M M, Acosta E M, João G, Vieira-da- Motta O. 2012. Growth Inhibition of Staphylococcus aureus and Escherichia coli Strains by Neutralizing IgY Antibodies From Ostrich Egg Yolk. Brazilian J Micro : 544-551 ISSN 1517-8382
Vancraeynest D, Hermans K, Haesebrouck F. 2004. Genotypic and phenotypic screening of high and low virulence Staphylococcus aureus isolates from rabbits for biofilm formation and MSCRAMMs. Vet. Microbiol., 103 : 241-247.doi:10.1016/j.vetmic.2004.09.002
Vancraeynest D, Hermans K, Haesebrouck F. 2006. Prevalence of genes encoding exfoliative toxins, leucotoxins and superantigens among high and low virulence rabbit Staphylococcus aureus strains. Vet. Microbiol., 117: 211-218.doi:10.1016/j.vetmic.2006.05.009
xxxvii and their antibacterial effects Int J Clin Exp Pathol.; 7(10): 6430– 6437
Wibawan IWT, Laemler Ch. 1992. Relationship between group B Streptococcal serotypes and cell surface hidrophobicity. J Vet. 39 : 376-282
Wibawan IWT, Sri Murtini, Retno Damajanti Soejoedono, I Gusti Ngurah Kade Mahardika. 2009. Produksi IgY Antivirus Avian Influenza H5N1dan Prospek Pemanfaatannya dalam Pengebalan Pasif. Jurnal Veteriner
Vol. 10 No. 3 : 118-124.
Ying CD, Xu-Fu Z, Ming Tan, Pengwei H, Wen L, Hao F, Weiming Z, Xi J. 2013. A dual chicken IgY against rotavirus and norovirus. Antiviral Research Volume 97, Issue 3, Pages 293-300, ISSN 0166-3542
You Z, Yang H, Xin W, Lin K, Shan G, Junhong W, Tao Z, and Wang J. 2014. Preparation of egg yolk antibodies against BoNT/B and their passive protection in mouse models.Human Vaccines & Immunotherapeutics
10:8, 2321–2327
Zhen YH, Jin LJ, Li XY, GuoJ, Li Z, Zhang BJ. 2009. Efficacy of specific egg yolk immunoglobulin (IgY) to bovine mastitis caused by
xxxviii
xxxix LAMPIRAN 1. Data Pertambahan Bobot Badan Kelinci
BB awal BB mgg 1 PBB 1 BB mgg 2 PBB 2
p1.1 1133 1370 237 1626 256
p1.2 1086 1340 254 1568 228
p1.3 1095 1343 248 1572 229
p1.4 1095 1322 227 1585 263
p1.5 1108 1309 201 1549 240
233.4 243.2
p2.1 1505 1742 237 2013 271
p2.2 1511 1737 226 1987 250
p2.3 1532 1789 257 2023 234
p2.4 1543 1791 248 2028 237
p2.5 1552 1781 229 2014 233
239.4 245
p3.1 1101 1324 223 1618 294
p3.2 1170 1382 212 1679 297
p3.3 1046 1325 279 1565 240
p3.4 1080 1326 246 1595 269
p3.5 1054 1309 255 1592 283
243 276.6
k1 1531 1768 237 2018 250
k2 1501 1796 295 2031 235
k3 1571 1766 195 2029 263
k4 1583 1783 200 2022 239
k5 1502 1768 266 2020 252
xli
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 14 Agustus 1981 di Surabaya dari pasangan Ayahanda Bambang Digdio Santoso dan Ibunda Amelia Herawati. Penulis merupakan putri kedua dari dua bersaudara.
Pendidikan dasar diselesaikan pada tahun 1994 di SDN 601 Menanggal Surabaya, selanjutnya tahun 1997 menyelesaikan pendidikan menengah pertama di SMPN 1 Surabaya. Pendidikan menengah keatas diselesaikan di SMUN 2 Surabaya pada tahun 2000. Gelar Sarjana Kedokteran Hewan dan Dokter Hewan diperoleh penulis di Fakultas Kedokteran Hewan Universitas Airlangga Surabaya berturut-turut pada tahun 2005 dan 2006.