ISOLASI, KARAKTERISASI DAN PRODUKSI LIPASE
DARI KAPANG INDIGENOUS
LISA PRATAMA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi, Karakterisasi dan Produksi Lipase dari Kapang Indigenous adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
LISA PRATAMA. Isolasi, Karakterisasi dan Produksi Lipase dari Kapang Indigenous. Dibimbing oleh ANI SURYANI dan BUDIASIH WAHYUNTARI.
Ketergantungan beberapa industri di Indonesia dalam memanfaatkan enzim yang diperoleh atau diproduksi dari luar negeri, mendorong para ahli enzim atau peneliti untuk mengisolasi enzim yang diperoleh dari mikroorgasnisme indigenous. Salah satu enzim yang digunakan di industri pangan adalah lipase. Lipase merupakan biokatalisator yang mempunyai kemampuan mengkatalisis reaksi hidrolisis minyak/lemak menjadi asam lemak dan gliserol. Salah satu pemanfaatan lipase yaitu sebagai biokatalis dalam interesterifikasi enzimatik pada pembuatan margarin. Untuk memodifikasi lemak pada campuran bahan baku margarin melalui intereseterifikasi enzimatik, maka dibutuhkan mikroorganisme penghasil lipase dengan aktivitas tinggi. Salah satu mikrorganisme yang potensial dan mampu menghasilkan lipase adalah kapang. Penelitian ini bertujuan untuk mendapatkan isolat kapang indigenous penghasil lipase, mengetahui morfologi dan spesies kapang, stabilitas enzim, kondisi suhu dan pH optimum. Penelitian dilakukan melalui beberapa tahap yaitu isolasi kapang penghasil lipase, identifikasi morfologi dan spesies kapang, uji aktivitas lipase secara kualitatif dan kuantitatif, penentuan media dan waktu produksi enzim, serta karakterisasi enzim.
Hasil percobaan menunjukkan bahwa ketiga kapang hasil isolasi dari isolat BPPT, tempe dan oncom positif menghasilkan lipase setelah diuji secara kualitatif menggunakan media dengan penambahan Rhodamin B olive oil dan PVA. Ketiga isolat mampu menghasilan pendaran berwarna orange dan membentuk zona bening disekitar koloni isolat. Berdasarkan hasil penentuan konsentrasi suspensi spora dengan konsentrasi 5% dan 10% (v/v) dengan tingkat kepadatan spora berkisar 105-4.3x108 selama 4 hari fermentasi, konsentrasi suspensi spora 10% menghasilkan aktivitas spesifik lebih tinggi dibandingkan dengan konsentrasi spora 5% pada ketiga kapang. Berdasarkan kurva pertumbuhan kapang dan enzim yang dihasilkannya dapat dijelaskan bahwa lipase dihasilkan pada awal pertumbuhan. Secara kuantitatif, penentuan media dan waktu produksi dari hasil perbandingan aktivitas spesifik enzim ketiga kapang pada media produksi PDB dan olive oil 2%, PDB dan crude palm oil (CPO) 2% serta media Blain (1978) yang mengandung KH2PO4 0.3%, NaNO3 0.1%, MgSO4.7H2O 0.05%, pepton 4%,
SUMMARY
LISA PRATAMA. Isolation, Characterization and Production of Lipase from Indigenous Fungal. Supervised by ANI SURYANI and BUDIASIH WAHYUNTARI
Dependence of imported enzymes in some industries in Indonesia encourages researchers to isolate the enzyme or enzymes derived from Indigenous microorgasnisme. One of the enzymes used in the food industry is lipase. Lipase is a biocatalyst that catalyses oil/fat hydrolysis becomes fatty acids and glycerol. One of the lipase application is for enzymatic interesterification process in margarine. To modify fats in margarine mixture of raw materials through enzymatic interseterifikasi, needs high activity lipase. One of the potential microorganisms and producing lipase are fungi. Dependence of enzyme utilizing industries in Indonesia imported enzymes only encourages researchers to isolate Indigenous enzyme producing mikroorgasnisms. One of the enzymes used in the food industry is lipase.The purpose of this research was to get lipase produced by indigenous fungi, identify the selected fungi, observe enzyme stability, optimum temperature and pH. The study was done through six steps of experiment. First step was to isolate lipase producing fungi, identify the selected fungi, qualitative and quantitative lipase activity assay, determine the media and the time production of enzymes and characterization of enzymes.
The results showed that the three fungi isolated from BPPT, tempeh (food made from soybeans fermentation) and oncom (traditional staple food fermentation of West Java) were recognized as positive lipase producing isolates basec on qualitative assay using Rhodamine B, olive oil and PVA. Three Isolates showed orange luminescence and formed a clear zone around the media. The results showed that spore suspension of 10% (v / v) for 4 days of fermentation, produces a higher specific activity than that of the spore concentration of 5% on all isolates. Based on the growth curve and enzymes produced by the fungus it can be concluded that the lipase was produced at the beginning of growth. Using Potato dextro broth (PDB) with olive oil 2%, PDB and crude palm oil (CPO) 2% and medium of Blain (1978) showed that the highest specific activity of the enzyme was in PDB medium containing 2% olive oil after 48 hours. Optimum activity of the lipase produced from three isolate was at pH 4, temperatures at 40°C and interesterification reaction was stable at (55°C) for 30-40 minutes. Ten times (v/v) concentrated enzyme with polyethylene glycol (PEG) was able to increase activity up to 2.9 to 5.1 times higher than that of the original activity. While the results of concentration using acetone with various concentrations, indice that the specific activity of the concentration enzyme decreased. Based on morphological and molecular identification, isolate R (from BPPT isolate) was indicated as genus Aspergillus, isolates T (from tempeh) was as a genus Rhizopus sp and O isolates (from oncom) was a genus of Neurospora sp.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
ISOLASI, KARAKTERISASI DAN PRODUKSI LIPASE
DARI KAPANG INDIGENOUS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia Nya, sehingga penulis dapat menyelesaikan tesis ini. Tesis yang berjudul “Isolasi, Karakterisasi dan Produksi Lipase dari Kapang Indigenous” ini ditujukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Bioteknologi Sekolah Pascasarjana IPB.
Terima kasih penulis ucapkan kepada Prof Dr Ir Ani Suryani, DEA sebagai Ketua komisi pembimbing dan Dr Ir Budiasih Wahyuntari, MSc sebagai anggota pembimbing atas bimbingan, pengarahan dan saran yang telah diberikan. Penulis juga berterima kasih kepada Ibu Dr Is Helianti, MSc dan seluruh staf Biokatalis di Laboratorium Pengembangan Teknologi Industri Agro-Biomedika (LABTIAB), Badan Pengkajian dan Penerapan Teknologi (BPPT) Kawasan Pusat Riset dan Teknologi (PUSPITEK) Serpong, Tangerang Selatan, serta semua pihak yang telah membantu baik langsung maupun tidak langsung dalam penyelesaian tesis ini. Ucapan terima kasih juga penulis sampaikan kepada keluarga atas segala perhatian, doa restu, serta dukungan baik material maupun spiritual, dan kepada teman-teman Pascasarjana Bioteknologi 2013.
Penulis menyadari masih banyak kekurangan dalam penyusunan tesis ini. Oleh karena itu, penulis mengharapkan saran dan kritik yang bersifat membangun. Penulis juga berharap semoga penyusunan tesis ini dapat bermanfaat bagi semua pihak yang membutuhkannya.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Lipase 3
Reaksi yang dikatalisis Lipase 3
Lipase yang dihasilkan dari Kapang 6
Produksi Lipase 7
3 METODE 8
Waktu dan Tempat Penelitian 8
Bahan 8
Alat 8
Prosedur Kerja 8
4 HASIL DAN PEMBAHASAN 15
Isolasi Kapang Penghasil Lipase 15
Uji Aktivitas Lipase (Kualitatif) 15
Identifikasi Morfologi Kapang 18
Perhitungan Jumlah Spora 19
Kurva Pertumbuhan Kapang 19
Penentuan Media dan Waktu Produksi 22
Pengaruh pH, Suhu terhadap Aktivitas dan Stabilitas Enzim 25
Produksi Enzim 28
Pemekatan Enzim dengan Polietilen Glikol (PEG) dan Aseton 29
Identifikasi Molekular 31
5 SIMPULAN DAN SARAN 31
Simpulan 31
Saran 31
DAFTAR PUSTAKA 32
LAMPIRAN 36
DAFTAR TABEL
1 Lipase diproduksi dari kapang 6
2 Diameter zona bening dan intensitas pendaran enzim ekstrak kasar dari tiga isolat kapang dibawah sinar UV pada media ROA 16 3 Hasil Identifikasi morfologi kapang secara mikroskopis dan
makroskopis 18
4 Hasil perhitungan spora masing - masing isolat kapang pada larutan
akuades selama tiga hari 19
5 Aktivitas enzim dari ketiga isolat sebelum dan sesudah pemekatan
dengan polietilen glikol (PEG) 30
6 Perubahan aktivitas enzim dari ketiga isolat sebelum dan sesudah
pemekatan dengan aseton pada konsentrasi 20%, 40% dan 60% 30
DAFTAR GAMBAR
1 Reaksi katalitik lipase pada reaksi hidrolisis dan sistesis 4
2 Hidrolisis lemak dengan lipase 4
3 Jalur reaksi hidrolisis menggunakan lipase spesifik dan non spesifik 5 4 Hasil isolasi kapang penghasil lipase dari beberapa sumber setelah
dimurnikan 15
5 Uji aktivitas enzim ekstrak kasar lipase secara kualitatif dari tiga isolat
kapang dibawah sinar UV pada media ROA 16
6 Hasil pengamatan karakter morfologi pada tiga isolat kapang murni umur 2 hari secara mikroskopis menggunakan mikroskop 17 7 Aktivitas enzim dari tiga isolat kapang pada berbagai jenis konsentrasi
spora 20
8 Kurva pertumbuhan kapang dalam media PDB olive oil 2% selama 6
hari fermentasi pada suhu ruang 20
9 Aktivitas enzim dari ketiga isolat dalam media PDB olive oil 2%
selama 6 hari fermentasi pada suhu ruang 21
10 Perubahan pH dalam media PDB olive oil 2% selama 6 hari fermentasi 22 11 Perbandingan aktivitas enzim terhadap berbagai media 23 12 Aktivitas enzim pada berbagai kondisi pH dengan a) metode titrasi dan
b) metode Silva 26
13 Aktivitas enzim pada berbagai suhu dengan a) metode titrasi dan b)
metode Silva 26
14 Stabilitas enzim ketiga isolat terhadap berbagai suhu 27
DAFTAR LAMPIRAN
1 Alur Kegiatan Penelitian 36
2 Kurva standar p-Nitropenol (pNP) 37
3 Kurva standar bovine serum albumin (BSA) 37
4 Perbandingan aktivitas enzim dari ketiga isolat terhadap berbagai media produksi dari jam ke 24 sampai dengan jam ke 96 38 5 Perbandingan aktivitas enzim dari ketiga isolat terhadap berbagai
1
PENDAHULUAN
Latar Belakang
Perkembangan teknologi di dalam industri telah banyak memanfaatkan enzim. Dalam aplikasi teknologi saat ini, enzim banyak dimanfaatkan pada pengolahan produk tradisional maupun modern. Enzim memiliki potensi yang tinggi dibidang bioteknologi karena memiliki sifat yang cocok untuk dimanfaatkan dalam proses industri yaitu efisiensi yang tinggi, spesifitas dan kerja yang selektif, reaksi yang tanpa produk samping, dan dapat tumbuh pada suhu kamar serta pH normal (Suhartono 1989). Kendala pengembangannya dalam proses biokonversi enzimatis di bidang industri adalah ketersediaan dan harga lipase impor yang mahal karena hanya sedikit produsen lipase di dunia (Suzuki et al.1988; Panji et al. 2008). Ketergantungan beberapa industri di Indonesia dalam memanfaatkan enzim yang diperoleh atau diproduksi dari luar negeri, mendorong para ahli enzim atau peneliti untuk mengisolasi enzim yang diperoleh dari mikroorgasnisme indigenous. Dengan kekayaan alam dan keanekaragaman mikroorganisme yang dimiliki Indonesia diharapkan dapat diperoleh enzim yang memiliki aktivitas tinggi dan dapat digunakan dalam proses industri.
Enzim semakin banyak diaplikasikan secara luas dalam proses pengolahan pangan. Salah satu enzim yang mempunyai peranan di dalam industri pangan adalah lipase. Lipase (triasilgliserol hidrolase) merupakan biokatalisator yang mempunyai kemampuan mengkatalisis reaksi hidrolisis lipid menjadi asam lemak dan gliserol. Lipase secara luas dapat ditemukan pada hewan, tanaman dan mikroorganisme (Damaso 2008). Pada mikroorganisme, lipase dapat diproduksi oleh bakteri, kapang dan khamir (Faloni et al. 2006). Penggunaan lipase yang diproduksi dari mikroorganisme dianggap lebih cepat dan murah. Beberapa mikroorganisme penghasil lipase dari bakteri adalah Bacillus sp, Pseudomonas sp, Burkholderia sp, dan Staphylococcus sp, dari kapang diantaranya adalah Rhizopus sp, Aspergillus sp, Geothricum sp, Mucor sp, Thricoderma reseei, Fusarium sp dan Rhizomucor sp (Treichel et al. 2010), sedangkan diproduksi dari khamir diantaranya adalah Candida rugosa (CRL) dan Candida antarctica (CAL) (Bussamara et al. 2010).
Beberapa reaksi yang dikatalisis oleh lipase diantaranya adalah reaksi hidrolisis, alkoholisis, esterifikasi, dan interesterifikasi (Dosanjh dan Kaur 2002). Dalam industri pembuatan margarin, lipase digunakan sebagai biokatalis dalam reaksi interesterifikasi enzimatik untuk memodifikasi karakteristik fisokimia lemak yang akan menyebabkan perubahan komposisi penyusun tri asil gliserol (TAG) sehingga diperoleh sifat - sifat yang diinginkan pada pembuatan margarin. Salah satu sifat yang diinginkan oleh industri margarin adalah spreadable atau mudah dioleskan. Untuk memproduksi lipase sendiri tanpa mengandalkan lipase dari produsen luar negeri, dibutuhkan eksplorasi dan penapisan mikroorgasnisme indigenous yang berpotensi tinggi sebagai penghasil lipase.
2
mengeksplorasi jenis kapang yang mampu menghasilkan lipase. Nuraida et al. (2000) mengisolasi kapang Rhizopus sp dan Mucor sp dari makanan lokal di Indonesia seperti tempe dan oncom, sedangkan Panji et al. (2008) telah memfermentasikan crude palm oil (CPO) dengan Neurospora sitophila dan mampu memproduksi lipase spesifik 1.3-gliserida.
Eksplorasi dan penapisan kapang indigenous yang berpotensi tinggi sebagai penghasil lipase dapat diketahui dengan menguji aktivitas enzimnya terhadap suatu substrat. Aktivitas enzim merupakan kemampuan enzim dalam mengubah suatu substrat menjadi produk. Produksi lipase dari kapang yang tinggi dipengaruhi oleh beberapa faktor, antara lain adalah jenis kapang, kondisi atau lingkungan (seperti suhu dan pH) dan media produksi yang digunakan. Setiap lipase yang diproduksi dari kapang memiliki kondisi optimum yang berbeda - beda. Oleh karena itu, agar lipase yang diproduksi memiliki aktivitas tinggi maka dalam produksinya dibutuhkan pemilihan media produksi yang paling baik, serta penentuan kondisi terbaik enzim terhadap stabilitas suhu dan pH optimum.
Perumusan Masalah
Salah satu mikrorganisme yang potensial dan mampu menghasilkan lipase adalah kapang. Isolasi kapang indigenous dapat diperoleh dari berbagai sumber. Permasalahan yang diambil dari penelitian ini adalah belum diperolehnya kapang penghasil lipase dengan aktivitas tinggi, kapang penghasil lipase belum diketahui karakter morfologi dan spesiesnya, belum diketahui komposisi media yang digunakan dalam produksi lipase dari kapang, belum diketahui stabilitas enzimnya pada kondisi suhu dan pH.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan isolat kapang indigenous penghasil lipase yang diisolasi dari beberapa sumber dengan menguji aktivitas enzimnya baik secara kualitatif maupun kuantitatif, mengidentifikasi morfologi dan spesies kapang penghasil lipase, mengkarakterisasi enzim dengan mengetahui kondisi terbaiknya terhadap stabilitas suhu dan pH.
Manfaat Penelitian
Hasil yang diharapkan dari penelitian ini adalah diperolehnya isolat kapang indigenous penghasil lipase dengan aktivitas tinggi yang nantinya dapat digunakan untuk memodifikasi lemak secara enzimatik pada pembuatan margarin dalam industri pangan.
3
2
TINJAUAN PUSTAKA
Lipase
Menurut International Union of Biochemistry (IUB), enzim dibagi menjadi enam golongan yaitu golongan enzim oksidoreduktase, transferase, hidrolase, liase, isomerase dan ligase. Lipase merupakan enzim lipolitik yang digolongkan ke dalam golongan hidrolase dengan nama sistematis gliserol ester hidrolase (EC 3.1.1.3). Lipase memiliki beberapa aplikasi dalam reaksi sintesis bioorganik, hidrolisis, modifikasi lemak dan minyak serta transesterifikasi pada triasilgliserol (Gardilo et al. 1998).
Lipase dapat diperoleh dari mikroba seperti Pseudomonas sp, Aspergillus niger, Mucor miehei, Candida rugosa. Candida sp dan Rhizopus sp merupakan organisme yang paling sering dipakai sebagai sumber penghasil lipase (Pandey et al. 1999). Pada mikroorganisme, lipase dapat diperoleh dari intraseluler maupun ekstraseluler. Namun secara umum aktivitas lipase yang paling tinggi diperoleh dari lipase eksraselular (Hiol et al.1999; Kristanti 2001). Aktivitas enzim merupakan kemampuan enzim dalam mengubah suatu substrat menjadi produk. Uji aktivitas lipase secara kualitatif juga merupakan suatu uji konfirmasi penghasil lipase bedasarkan penampakannya. Beberapa metode yang telah digunakan untuk menguji aktivitas lipase adalah metode Vorderwiilbecke et al. (1992) dengan menghitung aktivitas enzim lipase berdasarkan p-nitrofenol yang terbentuk dari hasil hidrolisis oleh lipase terhadap substrat p-nitrofenilbutirat, metode kolorimetri dengan mengamati perubahan warna tembaga piridinasetat sebagai reagen warna (Kwon dan Rhee, 1986), metode dengan menambahkan Rhodamine B ke dalam media pertumbuhan dengan mengamati zona bening dan pendaran yang dihasilkan (Kouker and Jaeger 1986) dan metode Silva (2005) menggunakan p-nitrophenyl palmitate (pNPP) sebagai substratnya. Uji aktivitas lipase dapat dilakukan dengan metode potensiometri. Pengujian tersebut dilakukan dengan cara membuat substrat olive oil dalam bentuk emulsi kemudian diberi enzim yang belum diketahui aktivitasnya dan diinkubasi pada suhu 35oC dan pH 5 dan 6 (Crueger dan Crueger 1984). Aktivitas lipase dipengaruhi oleh beberapa faktor yaitu pH, kadar air, suhu, komposisi substrat, konsentrasi produk, dan kandungan lipase. Aktivitas lipase produksi dari Trichoderma reesei optimum pada kondisi pH 5 dan suhu 50oC (Rajesh et al. 2010). Lipase yang dihasilkan dari bakteri mempunyai pH optimum pada kondisi netral atau mendekati kisaran basa, sedangkan lipase yang dihasilkan dari kapang pH optimumnya pada kondisi netral atau mendekati asam (August 2000). Suhu optimum lipase pada umumnya berkisar antara 30oC dan 400C.
Reaksi yang dikatalisis Lipase
4
bahan kimia (sintesis ester), deterjen (hidrolisis lemak), pengolahan air limbah (dekomposisi), kosmetik (pengangkatan lipid), obat-obatan (pencernaan minyak dan lemak dalam makanan) (Salihu et al. 2012). Kegunaan lipase baru-baru ini adalah untuk memodifikasi karakteristik fisokimia lemak yang akan menyebabkan perubahan komposisi penyusun TAG.
Reaksi katalitik oleh lipase diklasifikasikan dalam dua kategori yaitu hidrolisis dan sintesis. Reaksi yang masuk ke dalam sintesis terdiri atas reaksi esterifikasi, interesterifikasi, alkoholisis dan asidoslisis (Gambar 1) (Dosanjh dan Kaur 2002). Lipase menghidrolisis trigliserida menjadi gliserida (digliserida atau monogliserida) dan asam lemak bebas (Joseph et al. 2008) seperti terlihat pada Gambar 2.
Gambar 1 Reaksi katalitik lipase pada reaksi hidrolisis dan sistesis
Gambar 2 Hidrolisis lemak dengan lipase (Kurnia 2010)
Trigliserida Gliserol Asam lemak
(i) Hidrolisis
(ii) Sintesis (a) Esterifikasi
(b) Interseterifikasi
(c) Alkoholisis
5 Berdasarkan spesifitasnya, lipase dapat dibagi menjadi lipase spesifik dan lipase non spesifik. Lipase spesifik akan menghidrolisis ester pada posisi 1.3 atau hanya pada posisi 2 sehingga hasil yang akan terbentuk adalah asam lemak dengan monoasilgliserol atau diasilgliserol, sedangkan lipase non spesifik akan menghidrolisis triasilgliserol pada ketiga posisi ikatan ester dengan sempurna sehingga akan membentuk asam lemak bebas dan gliserol (Macrae 1983). Penggunaan lipase yang memiliki spesifisitas pada posisi 1.3 dapat memberikan kontribusi dalam memodifikasi lemak. Beberapa penggunaan lipase spesifik 1.3 antara lain adalah untuk pembuatan margarin sebagai alternatif pengganti mentega dengan reaksi interesterifikasi enzimatik. Selain itu lipase spesifik 1.3 juga digunakan untuk mensubsitusi lemak kakao pada Cocoa Butter Substitute (CBS) dengan penambahan asam lemak (asidolisis) dari luar seperti palmitat dan stearat. Salah satu lipase komersial yang telah banyak digunakan dalam industri adalah Lypozime IM ® yang berasal dari lipase mikrobial Rhizomucor miehei yang mempunyai kespesifitasan posisional molekul trigliserol yaitu pada posisi pimer (sn-1 dan sn-3) (Yang et al. 2014). Spesifisitas enzim sangat bermanfaat untuk menghasilkan produk dan tujuan yang diinginkan.
6
Menurut Saktiwansyah (2001) dan Kurnia (2010) spesifisitas lipase terhadap substrat dapat dikelompokkan menjadi: 1) spesifisitas jenis lipid, yaitu kemampuan suatu lipase untuk bereaksi dengan jenis lipid tertentu; 2) spesifisitas posisi, yaitu kemampuan lipase untuk membedakan substrat berdasarkan posisi ikatan ester pada triasilgliserol; 3) spesifisitas asam lemak, yaitu kemampuan lipase untuk membedakan substrat berdasarkan panjang rantai dan derajat kejenuhan dari asam lemak; 4) spesifisitas alkohol, yaitu spesifisitas yang berhubungan dengan reaksi sintesis ester, dimana dalam aktifitas esterifikasinya setiap jenis lipase memiliki perbedaan terhadap jenis alkohol selain terhadap jenis asam lemaknya; dan 5) spesifisitas gabungan, yaitu gabungan dari beberapa jenis spesifisitas yang menyebabkan suatu lipase dapat mempunyai lebih dari satu spesifisitas.
Lipase yang dihasilkan dari Kapang
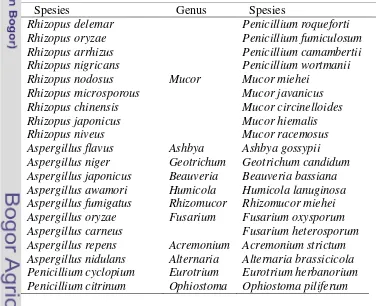
Lipase yang dihasilkan dari mikroorganisme lebih banyak ditemukan pada eukariot. Kapang merupakan sumber lipase yang biasanya disekresikan secara ekstraseluler (Sumathy et al. 2012). Penggunaan kapang merupakan salah satu agen produksi lipase yang potensial (Rajesh et al. 2010). Beberapa lipase yang diproduksi dari kapang terdapat pada Tabel 1. Lipase yang diproduksi dari kapang dan telah dikomersialkan antara lain Lipozyme RM-IM (dari kapang Rhizomucor miehei) dan Lipozyme TL-IM (dari kapang Thermomyces lanuginosus). Di Indonesia kapang indigenous yang memproduksi lipase banyak diperoleh dari genus Aspergillus sp, Mucor sp, dan Rhizopus sp.
Tabel 1. Lipase diproduksi dari kapang (Sharma et al. 2001)
Genus Spesies Genus Spesies
Rhizopus Rhizopus delemar Penicillium roqueforti
Rhizopus oryzae Penicillium fumiculosum
Rhizopus arrhizus Penicillium camambertii
Rhizopus nigricans Penicillium wortmanii
Rhizopus nodosus Mucor Mucor miehei Rhizopus microsporous Mucor javanicus
Rhizopus chinensis Mucor circinelloides
Rhizopus japonicus Mucor hiemalis
Rhizopus niveus Mucor racemosus
Aspergillus Aspergillus flavus Ashbya Ashbya gossypii Aspergillus niger Geotrichum Geotrichum candidum Aspergillus japonicus Beauveria Beauveria bassiana Aspergillus awamori Humicola Humicola lanuginosa Aspergillus fumigatus Rhizomucor Rhizomucor miehei Aspergillus oryzae Fusarium Fusarium oxysporum
Aspergillus carneus Fusarium heterosporum
Aspergillus repens Acremonium Acremonium strictum Aspergillus nidulans Alternaria Alternaria brassicicola Penicillium Penicillium cyclopium Eurotrium Eurotrium herbanorium
7 Untuk memproduksi lipase dari kapang diperlukan pengamatan perubahan miselia dan pertumbuhan kapang terlebih dahulu karena akan mempengaruhi produktivitas lipase yang dihasilkan (Stergiou et al. 2013). Pada proses fermentasi menggunakan kapang sebagai penghasil lipase, pembentukan misellium selalu diikuti oleh pembentukan spora yang berguna untuk pembuatan inokulum. Pada proses fermentasi, inokulum yang berupa spora merupakan starter yang baik dalam fermentasi (Anggirasti 2008). Hasil penelitian Colin et al. (2010) menunjukkan bahwa produksi lipase ekstraseluler tertinggi dari A. niger MYA 135 adalah setelah kapang membentuk miselia. Produksi lipase tertinggi dari Rhizopus chinensis juga menunjukkan kondisi yang sama (Teng et al. 2009).
Produksi Lipase
Dalam produksi enzim dari mikroorganisme seperti kapang, beberapa yang perlu diperhatikan adalah pemilihan strain dan pengaturan kondisi proses. Pemilihan strain dimaksudkan untuk memilih kapang yang memiliki keunggulan dengan menghasilkan enzim ekstraselular yang memiliki aktivitas tinggi, sedangkan pengaturan kondisi yang perlu diperhatikan antara lain adalah komposisi media, induser, suhu, pH, aerasi dan pengadukan (Murni et al. 2011). Selain beberapa faktor tersebut, dalam fermentasi produksi enzim yang perlu diperhatikan lainnya adalah pola pertumbuhan mikroorganismenya. Pertumbuhan kapang mengikuti pola pertumbuhan pada umumnya. Biasanya pada saat awal fermentasi, aktivitas enzim yang dihasilkan masih rendah dan akan meningkat seperti pada pola pertumbuhannya. Metode yang umum digunakan untuk memproduksi enzim adalah metode fermentasi semi padat atau fermentasi medium cair. Fermentasi medium cair merupakan suatu fermentasi dengan menggunakan media cair yang substratnya terlarut atau terdispersi dalam cairan dan mikroorganismenya berada dibawah permukaan cairan pada kondisi aerob dengan bantuan aerasi dan agitasi (Saktiwansyah 2001).
8
3
METODE
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan pada bulan Agustus 2014 sampai dengan Mei 2015 di Laboratorium Teknologi Bioindustri, Laboratoria Pengembangan Teknologi Industri Agro Biomedika (LAPTIAB), Badan Pengkajian dan Penerapan Teknologi (BPPT), Kawasan Pusat Riset dan Teknologi (PUSPITEK) Serpong, Tangerang Selatan.
Bahan
Bahan - bahan yang digunakan dalam penelitian ini meliputi tempe kedelai, oncom, margarin berjamur dan isolat koleksi BPPT (Badan Pengkajian dan Penerapan Teknologi) dari ragi. Bahan kimia yang digunakan untuk media pertumbuhan dan uji aktivitas kapang meliputi potato dextrose agar (PDA), potato dextrose broth (PDB), chloramphenicol, rhodamine-B, polivynil alcohol (PVA), olive oil, crude palm oil (CPO), alkohol 70% dan 96%, glycerol 10%, NaCl 1M, mili-Q water, p-nitrophenyl palmitate (pNPP), gum arabic, 2-propanol, triton X-100, glukosa, pepton, CaCl2, agar, MgSO4, KH2PO4, NaNO3, NaH2PO4,
C6H8O7H2O, C6H5Na3O7.2H2O, methanol, NaOH 0.05M, maltodextrin, indikator
penolpthalein (pp), bovine serum albumin (BSA), tubing/kantong dialisis 33 mm, polyethylene glycol 20.000, aseton serta bahan lain seperti kapas, kertas saring dan lainnya.
Alat
Peralatan yang digunakan dalam penelitian ini adalah gelas ukur, cawan petri, tabung reaksi, autoklaf, erlenmeyer 100 mL, 300 mL dan 500 mL (Iwaky PYREX ®), neraca analitik, mikropipet 1mL, inkubator shaker (Siemens), magnetic stirrer, oven, laminar airflow cabinet (ESCO), mikroskop (Olympus Vanox), hemasitometer, centrifuge (Sorvall Fresco), refrigerated centrifuge (Hitachi CR266), cold microsentrifuge sorvall, inlab pH meter (USA), autoklaf untuk sterelisasi (ALP KT- 40), inkubator shaker (Kuhner UNIMAX), spectrophotometer (Genesys UV-10), gelas beaker 500 mL (Iwaky PYREX ®), rotor RIOA2, deep freezer -80oC (LG Expresscool) pH meter.
Prosedur Kerja
9 enzim (5) karakterisasi enzim akibat pengaruh suhu, pH dan stabilitasnya (6) produksi dan pemekatan enzim (Lampiran 1).
Isolasi Kapang dan Pemurnian Kapang Penghasil Lipase
Kapang penghasil lipase diisolasi dari beberapa sumber yaitu, tempe kedelai, oncom dan margarin yang telah tumbuh jamur. Selain itu juga digunakan isolat kapang murni BPPT (Badan Pengkajian dan Penerapan Teknologi). Penapisan kapang penghasil lipase dilakukan menggunakan cawan petri yang berisi media Potato Dextrose Agar (PDA) sebanyak 39 g/L dengan kandungan bahan di dalamnya yaitu ekstrak kentang 40 g/L, dextrose 10 g/L dan agar 15 g/L. Media dihomogenkan dan dipanaskan hingga mendidih dan disterilkan menggunakan autoklaf selama 15 menit pada suhu 121oC dengan tekanan 1 atm, dan didinginkan hingga suhu sekitar 40oC. Setelah media mencapai suhu tersebut, media ditambahkan chloramphenicol 500 mg/L. Media yang telah diinokulasi kapang dari empat macam sumber, selanjutnya diinkubasi pada suhu ruang (30oC) selama 2-3 hari. Kapang yang tumbuh pada media kemudian dimurnikan kembali dengan cara menggoreskan spora pada media baru menggunakan jarum ose.
Kapang yang telah tumbuh pada media penapisan selanjutnya dilakukan pemurnian dengan pengenceran 10-2 sampai dengan 10-5 menggunakan larutan NaCl 0.85% dan ditumbuhkan kembali pada media PDA dengan metode sebar permukaan (surface). Setelah 3 hari diinkubasi, kapang yang membentuk koloni tunggal diinokulasikan kembali ke dalam media PDA untuk memperoleh isolat kapang yang murni.
Pembuatan Original, Stok dan Working Culture
Isolat kapang dari berbagai sumber yang tumbuh pada media seleksi disimpan dalam gliserol stok 10% pada suhu -80oC. Selanjutnya isolat di refresh/ diremajakan dengan cara mengambil spora kapang dan digoreskan pada media PDA miring sebagai working culture dan digoreskan pada media PDA plate sebagai stock culture dengan inkubasi selama 2 - 3 hari pada suhu 30oC. Kapang yang tumbuh pada media PDA miring dan PDA plate selanjutnya disimpan dalam ruang penyimpanan dingin (coldroom) pada suhu 8oC.
Karakterisasi Morfologi dan Spesies Kapang
Identifikasi Morfologi Kapang
10
pada potongan media PDA di atas object glass secara aseptis yang diinkubasi di dalam cawan petri selama 2-3 hari. Hasil pengamatan selanjutnya dibandingkan dengan buku panduan untuk mengetahui identitas kapang tersebut.
Uji Aktivitas Lipase Kualitatif dan Kuantitatif
Uji Aktivitas Lipase secara Kualitatif
Uji aktivitas lipase secara kualitatif dilakukan dengan menggunakan metode Rhodamin olive oil berdasarkan Koeker dan Jaeger (1987). Isolat kapang yang diperoleh dari isolat BPPT, tempe kedelai, dan oncom, diseleksi kemampuannya dalam menghasilkan lipase. Identifikasi dan penapisan kapang penghasil lipase serta penentuan aktivitas lipase dilakukan menggunakan media seleksi plate Rhodamin B agar (modifiasi Kouker dan Jaeger 1987) yang mengandung PDA 39 g/L, Rhodamin B 0.01%, PVA 1.5% dan substrat olive oil 4%. Kapang yang telah diperoleh dari isolasi menggunakan media PDA yang mengandung 500 mg/L chloramphenicol diinokulasikan ke dalam cawan petri yang berisi media seleksi. Kapang yang tumbuh diseleksi berdasarkan pada zona yang terbentuk disekeliling koloni yang tumbuh pada media. Rhodamin B merupakan pewarna yang akan membentuk kompleks dengan asam lemak bebas, sehingga ketika koloni penghasil lipase di bawah sinar ultraviolet (UV) akan memberikan zona berpendar, sedangkan olive oil berfungsi sebagai sumber lipida (Gupta et al. 2003).
Uji Aktivitas Lipase (Kuantitatif)
Pengukuran aktivitas kapang penghasil lipase dilakukan secara kuantitatif menggunakan metode modifikasi Silva (2005) dan metode titrasi (Yang et al. 2006).
Modifikasi metode Silva (2005), bahan - bahan yang digunakan dalam uji aktivitas lipase dengan modifikasi metode ini adalah p-nitrophenyl palmitate (pNPP), 2-propanol, 50 mM buffer dan stabilizer yang sesuai. Pengujian aktivitas enzim lipase dilakukan dengan cara membuat terlebih dahulu larutan A dan larutan B dengan cara 3 mg pNPP dilarutkan dalam 1 mL 2-propanol (Larutan A). 10 mg stabilizer dan 40 mg Triton X-100 dilarutkan dalam 9 mL buffer 50 mM (Larutan B). Kemudian larutan A dan larutan B dicampurkan. Selanjutnya pengujian dilakukan dengan cara mengambil 0.1 mL sampel enzim dan dicampurkan dengan 0.9 mL larutan substrat dan diinkubasi selama 30 menit pada suhu 37oC (pada suhu yang sesuai). Setelah diinkubasi, sampel diukur serapan pada panjang gelombang 410 nm terhadap kontrol bebas enzim dan dihitung berdasarkan kurva standar p-nitrophenol (Lampiran 2) dengan nilai absorbansi pada panjang gelombang 410 nm.
11 Selanjutkan dilakukan titrasi dengan NaOH 0.05 M. Aktivitas lipase dapat dihitung menggunakan rumus sebagi berikut:
V2-V1. n NaOH.1000
Aktivitas lipase (U/mL) = t (menit) Keterangan:
V1 = volume yang dibutuhkan untuk titrasi kontrol
V2 = volume yang dibutuhkan untuk titrasi sampel
n = konsentrasi NaOH t = waktu inkubasi
Satu unit aktivitas lipase didefinisikan sebagai jumlah lipase yang mampu melepaskan / membebaskan 1 μmol asam lemak per mL/menit yang disimbolkan dengan U/mL. Aktivitas lipase yang semakin tinggi ditunjukkan oleh semakin banyaknya volume NaOH yang dibutuhkan untuk titrasi.
Penentuan Kadar Protein
Pembuatan kurva standar: Pembuatan kurva standar bovine serum albumin (BSA) dilakukan dengan cara membuat variasi konsentrasi BSA di dalam larutan Tris - HCl pH 9. Setiap variasi konsentrasi BSA diambil sebanyak 30 µL kemudian dicampur dengan 1.5 mL larutan Bradford dalam tabung reaksi. Larutan yang telah dicampur kemudian dihomogenkan menggunakan vortex, kemudian diinkubasi selama 20 menit pada suhu kamar. Pengukuran absorbansi dilakukakn pada panjang gelombang 595 nm. Kurva standar BSA adalah grafik hubungan konsentrasi protein standar (BSA dengan berbagai variasi) dengan nilai absorbansi pada panjang gelombang 595 nm (Lampiran 3).
Pengukuran kadar protein.: Kadar protein enzim yang dihasilkan oleh kapang ditentukan berdasarkan metode Bradford (1976) dengan menggunakan larutan standar bovine serum albumin (BSA). Selanjutnya 0.1 mL larutan enzim ekstrak kasar ditambahkan dengan 5 mL reagen Bradford dan diinkubasi pada suhu ruang selama 10-60 menit. Absorbansi larutan sampel protein dibaca pada panjang gelombang 595 nm. Dengan persamaan matematik dari kurva standar protein, akan didapatkan kadar protein terlarut yang terkandung dalam larutan ekstrak enzim kasar.
Pengukuran Aktivitas Spesifik Lipase
Pengukuran aktivitas spesifik lipase diukur dengan menggunakan rumus sebagai berikut:
Aktifitas spesifik lipase (unit/mg) = aktivitas lipase (unit/mL)
kadar protein (mg/mL)
Perhitungan Jumlah Spora, Penentuan Konsentrasi Suspensi Spora
12
Penentuan konsentrasi suspensi spora dilakukan sebelum penentuan kurva pertumbuhan kapang. Konsentrasi suspensi spora yang diuji adalah 5% dan 10% dari volume media. Pengujian dilakukan dengan cara menumbuhkan kapang terlebih dahulu pada media PDA miring. Setelah berumur 3 hari, masing-masing isolat pada media miring ditambahkan dengan akuades steril sebanyak 10 ml dan digosok-gosok menggunakan ose hingga terbentuk suspensi spora. Hasil suspensi spora pada masing-masing isolat selanjutnya dimasukkan kedalam erelenmeyer baru. Dari erelenmeyer yang berisi suspensi spora tersebut, pada masing-masing isolat diambil sebanyak 5% dan 10% dari volume media fermentasi (PDB dan 2% olive oil) untuk dilakukan pengujian. Pengujian dilakukan selama 4 hari, dengan pengambilan sampel setiap hari untuk dianalisis aktivitas enzimnya berdasarkan metode Silva (2005) dan kadar protein berdasarkan metode Bradford (1976). Kurva Pertumbuhan Kapang
Sebelum penentuan media dan waktu produksi dari kapang, perlu diketahui terlebih dahulu pola pertumbuhan kapang yaitu dengan cara membuat kurva pertumbuhan dari masing-masing kapang. Kurva pertumbuhan kapang dilakukan dengan cara menumbuhkan kapang pada dua media kultivasi (PDB dan olive oil 2% dan PDB dan crude palm oil 2%) sebanyak 150 mL dalam erlenmeyer 300 mL. Kapang yang akan ditumbuhkan pada masing-masing media kultivasi diambil dari stock culture yang telah diremajakan dan berumur 3 hari. Selanjutnya, isolat disuspensikan dengan akuades steril secara aseptik dalam laminar airflow (LAF). Pada konsentrasi yang telah ditetapkan, suspensi spora dengan jumlah spora berkisar 4.0x106 - 7.28x107 kemudian dimasukkan ke dalam masing-masing media kultivasi pada shaker incubator dalam suhu ruang selama 6 hari. Pengambilan sampel dilakukan setiap 1 hari pada masing-masing erlenmeyer. Sampel disaring menggunakan kertas Whatman (sebelumnya telah dioven pada suhu 105oC selama 1 jam dan ditimbang) untuk memisahkan miselia kapang. Setelah disaring, miselia ditimbang untuk memperoleh berat basahnya (berat b). miselia kapang selanjutnya dikeringkan dalam oven pada suhu 80oC selama 1 jam sampai berat konstan (berat c). Berat kering kapang yang konstan digunakan untuk mengukur berat kering miselianya dengan rumus: Berat miselia (g/mL) = [berat b] - [berat c]. Hubungan antara berat kering sel kapang dan waktu pertumbuhan digunakan untuk membuat kurva pertumbuhan.
Penentuan Media Kultivasi dan Waktu Produksi Enzim
Untuk melihat kesesuaian/kecocokan media kultivasi maka isolat kapang ditumbuhkan pada berbagai media dengan volume media sebanyak 250 mL dalam erlenmeyer 500 mL. Media kultivasi yang digunakan yaitu (1) media PDB dan olive oil mengandung PDB 24 g/L dan olive oil 2%; (2) media PDB dan crude palm oil (CPO) mengandung PDB 24 g/L dan CPO 2% dan (3) media Blain et al. (1978) yang mengandung KH2PO4 0.3%, NaNO3 0.1%, MgSO4.7H2O 0.05%,
pepton 4%, glukosa 2% dan olive oil 2%. Penentuan media kultivasi ini juga sekaligus dilakukan untuk melihat waktu optimum untuk produksi enzim. Pengambilan sampel dilakukan selama 24 jam sekali dengan mengamati perubahan pH, aktivitas enzim, dan kadar protein.
13 laminar airflow (LAF), kemudian dimasukkan ke dalam media kultivasi. Kapang ditumbuhan dalam media fermentasi pada shaker incubator dengan kecepatan 150 rpm pada suhu 30oC (suhu ruang). Setelah hari ke 6, kultivasi masing - masing isolat dipanen dengan cara mengambil masing - masing sampel sebanyak 15 mL dan dimasukkan ke dalam tabung sentrifugasi/falcon centrifuge 50 mL. Sampel selanjutnya disentrifuse pada kecepatan 4000 rpm dalam suhu 4oC selama 15 menit. Hasil Supernatan dipisahkan dengan pellet ke dalam tabung sentrifugasi baru. Selanjutnya supernatan diambil sebanyak 1 mL dan dicampurkan dengan substrat untuk diukur aktivitas enzimnya menggunakan metode Silva (2005) dan 20µL untuk mengukur kadar proteinnya berdasarkan metode Bradford (1976). Karakterisasi Enzim
Pengaruh pH, Suhu terhadap Aktivitas Enzim
Penentuan pH optimum enzim dilakukan pada berbagai kondisi yaitu pH 4 & 5 (buffer Sitrat), 6 & 7 (buffer Fosfat) dan pH 8 (buffer Tris-HCl). Setelah mendapat pH optimum enzim selanjutnya dilakukan penentuan suhu optimum pada suhu 25, 30, 35, 40, 45 oC dengan metode Silva (2005) dan metode titrasi (Yang et al. 2006) sebagai pembanding. Selain itu, dilakukan juga pengujian aktivitas enzim terhadap suhu reaksi interesterifikasi pada suhu 40, 50 dan 60 oC. Stabilitas Enzim
Pengujian stabilitas lipase dilakukan dari hasil pengujian suhu reaksi interesterifikasi. Masing-masing enzim ekstrak kasar lipase sebanyak 25 mL diinkubasi pada berbagai kondisi suhu tersebut tanpa menggunakan substrat. Pengamatan dilakukan dengan pengambilan sampel setiap lima belas menit setelah inkubasi selama 1, 2 dan 3 jam. Aktivitas spesifik lipase dihitung berdasarkan aktivitas enzim metode Silva (2005) dan kadar protein metode Bradford (1976).
Produksi dan Pemekatan Enzim
Produksi Enzim
Setelah penentuan media produksi, produksi enzim dilakukan dengan medium terpilih dengan waktu optimum produksi yang telah diperoleh. Sebanyak 10% suspensi spora hasil peremajaan pada media PDA miring (berumur 3 hari) sebagai inokulum dimasukkan ke dalam media produksi steril 1000 mL dalam erlenmeyer 2000 mL dan diinkubasi pada pada inkubator bergoyang (shaker incubator) dengan kecepatan 150 rpm pada suhu 30oC (suhu ruang). Setelah sampai pada waktu optimum produksi, miselia kapang disaring menggunakan kertas Whatman untuk memisahkannya dengan selnya. Selanjutnya hasil saringan disentrifugasi dengan kecepatan 8000 rpm pada suhu 4oC selama 20 menit. Supernatan hasil sentrifugasi diambil sebagai enzim ekstrak kasar (EEK).
Pemekatan Enzim
Pemekatan dengan Polietilen Glikol (PEG)
14
menggunakan metode Bradford (1976). Pemekatan enzim dilakukan dengan cara mencuci tubing/kantong dialisis menggunakan air RO mengalir selama 3-4 jam, selanjutnya kantong dialisis dicuci kembali dengan Sodium Sulfide pada suhu 80oC selama 1 menit (0.3% b/v) dan cuci kembali dengan air RO dengan suhu 60oC selama 2 menit. Setelah dicuci dengan RO, kantong dicuci dengan asam sulfat 0.2 % (v/v) selama ± 1 menit pada suhu 60oC dan dibilas kembali dengan air RO dengan suhu 60oC selama 2 menit untuk menghilangkan sisa asam pada kantong dialisis. Enzim yang akan dipekatkan kemudian dimasukkan ke dalam kantong dialisis yang telah dicuci dan ditaburi polietilen glikol diatasnya. Untuk peningkatan 10 kali, pemekatan membutuhkan waktu ± 4 jam diinkubasi pada lemari pendingin. Hasil pemekatan enzim dibandingkan dengan aktivitas enzim dan kadar protein sebelum dan sesudah dipekatkan menggunakan polietilen glikon (PEG).
Pemekatan dengan Aseton:
Untuk membandingkan metode pemekatan enzim terhadap aktivitasnya maka enzim ekstrak kasar yang diperoleh dari ketiga kapang dipekatkan menggunakan aseton pada konsentrasi. Sebanyak 250 mL enzim ekstrak kasar ditambahkan aseton pada suhu -20oC dengan konsentrasi 20, 40, dan 60 % (v/v), kemudian diaduk menggunakan magnet stirrer selama 30 menit. Setelah itu, enzim disentrifuge dengan kecepatan 8000 rpm selama 20 menit dan diambil pelletnya. Selanjutnya, pellet hasil sentrifugasi dilarutkan menggunakan buffer fosfat 0.05 M pH 7 dan diuji aktivitasnya menggunakan metode Silva (2005) dan diuji kadar proteinnya dengan metode Bradford (1976). Hasil pengujian enzim dibandingkan dengan aktivitas enzim dan kadar protein sebelum dipekatkan menggunakan aseton.
Identifikasi Molekular
15
4
HASIL DAN PEMBAHASAN
Isolasi Kapang Penghasil Lipase
Kapang penghasil lipase diisolasi dari berbagai sumber makanan lokal Indonesia diantaranya adalah ragi, tempe, margarin, dan oncom. Isolasi kapang ini merupakan suatu proses pengambilan kapang dari lingkungan asalnya dan ditumbuhkan pada medium buatan untuk memperoleh kapang yang lebih murni. Pemurnian kapang bertujuan untuk memisahkan hasil inokulasi yang terdiri atas berbagai jenis kapang sehingga didapatkan kapang yang murni pada setiap biakan kapang. Pemurnian dilakukan menggunakan metode quadrant streak yaitu suatu metode sebaran sel menggunakan teknik gores dengan membagi beberapa daerah, umumnya adalah empat daerah pada media agar di dalam cawan petri.
Gambar 4 Hasil isolasi kapang penghasil lipase dari beberapa sumber setelah dimurnikan; a) Isolat R dari BPPT, b) Isolat T dari tempe kedelai, c) Isolat O dari oncom.
Hasil isolasi kapang dari beberapa sumber setelah diinkubasi selama 2-3 hari tersebut didapatkan 4 (empat) isolat murni yang terdiri dari 1(satu) kelompok khamir yang diperoleh dari margarin yang telah berjamur dan 3 (tiga) kelompok kapang yang diperoleh dari isolat BPPT, tempe dan oncom (Gambar 4). Tiga kapang yang telah murni tersebut selanjutnya dilakukan untuk pengujian aktivitas enzim.
Uji Aktivitas Lipase (Kualitatif)
Uji aktivitas lipase dilakukan untuk mendeteksi dan mengetahui kemampuan isolat kapang yang telah murni dalam menghasilkan lipase. Metode ini hanya dapat mengkonfirmasi lipase yang dihasilkan saja tetapi tidak bisa melihat besarnya aktivitas enzim yang dihasilkannya.
16
berwarna orange ketika kapang yang menghasilkan lipase berada dibawah sinar UV. Rhodamin B akan membentuk kompleks dimer dengan monoasilgliserol (MAG), diasilgliserol (DAG) dan asam lemak bebas (ALB) (Koeker dan Jaeger 1987). Olive oil berfungsi sebagai sumber lipid (Gupta et al. 2003). Penggunaan media pertumbuhan dalam cawan petri ini digunakan untuk mendeteksi adanya asam lemak bebas dari hidrolisis lipid. Penambahan PVA berfungsi sebagai pengemulsi yang dapat membantu menstabilkan antara larutan minyak dan air (Ota dan Yamada 1966).
Tabel 2 Diameter zona bening dan intensitas pendaran enzim ekstrak kasar dari tiga isolat kapang dibawah sinar UV pada media ROA modifikasi dari Koeker dan Jaeger (1987)
Pengamatan Isolat
R T O
Diameter zona (cm) 0.2 0.3 0.3
Pendaran + +++ ++++
Keterangan : [+] intensitas rendah [++] intensitas sedang [+++]intensitas tinggi [++++] intensitas sangat tinggi
Gambar 5 Uji aktivitas enzim ekstrak kasar lipase secara kualitatif dari tiga isolat kapang dibawah sinar UV pada media modifikasi dari Koeker dan Jaeger (1987) setelah 2 hari diinkubasi pada suhu ruang; a) isolat R dari BPPT-CC, b) isolat T dari tempe, c) isolat O dari oncom
17 hasil pengujian tersebut tidak memastikan bahwa aktivitas lipase yang dihasilkan dari kapang isolat O memberikan aktivitas yang paling tinggi. Oleh karena itu, untuk mengetahui aktivitas lipase dalam mendegradasi lemak menjadi mono/digliserida dan asam lemak dibutuhkan pengujian hidrolisis menggunakan substrat asam lemak secara kuantitatif.
Isolasi dan penapisan untuk mendapatkan kapang penghasil lipase spesifik 1.3 gliserida dari pangan lokal tempe segar dari berbagai daerah di Indonesia juga dilakukan oleh Panji et al. (2008). Dari seluruh kapang yang diisolasi dari tempe seluruhnya menghasilkan zona fluoresens pada media seleksi yang mengandung CPO (crude palm oil) sebagai sumber lipida. Menurut Hou & Johnston (1992) terbentuknya zona fluoresens pada media seleksi yang mengandung CPO sebagai sumber lipida juga menunjukkan bahwa isolat tersebut memiliki kemampuan menghasilkan lipase yang memecah triasilgliserol (TAG) pada CPO menjadi DAG, MAG atau ALB dan berikatan dengan Rhodamin B membentuk senyawa berpendar. Lipase spesifik akan menghidrolisis ikatan ester pada posisi 1.3 sehingga hasil yang terbentuk adalah asam lemak, monoasilgliserol dan diasilgliserol (Suharyanto et al. 2011).
Identifikasi Morfologi Kapang
Karakterisasi morfologi dari kapang hasil isolasi dapat digunakan untuk identifikasi sampai pada tingkat genus, sedangkan untuk identifikasi spesies masih membutuhkan identifikasi biokimia dan molekuler. Tujuan dari pengamatan ini adalah untuk memperoleh deskripsi dan mengetahui identitas kapang melalui morfologinya secara mikroskopik dan makroskopik.
Gambar 6 Hasil pengamatan karakter morfologi pada tiga isolat kapang murni umur 2 hari secara mikroskopis menggunakan mikroskop; a) Isolat R, b) Isolat T dan c) Isolat O
18
dan dicocokkan dengan buku panduan Gandjar et al. (1999) dan Watanabe (1937), kapang isolat R dan O termasuk dalam filum Ascomycota, sedangkan kapang isolat T termasuk dalam filum Zygomycota. Perbedaan antara keduanya adalah terletak pada struktur alat reproduksinya. Struktur reproduksi Ascomycota adalah spora aseksual yang disebut askospora, sedangkan pada Zygomycota disebut zigospora (Benson 2001). Kapang Isolat R dan O memiliki konidiospora berbentuk bulat dan memiliki hifa sekat atau septate sedangkan spora pada kapang isolat T berbentuk bulat dengan struktur kantung yang disebut sporangium serta hifa yang tidak bersekat atau hifa aseptate. Selain pengamatan secara mikroskopik, hasil pengamatan secara makroskopik seperti warna, permukaan, tekstur, zona pertumbuhan (growing zone) koloni dan lainnya juga menghasilkan perbedaaan pada karakter morfologinya seperti yang tersaji pada Tabel 3.
Tabel 3 Hasil identifikasi morfologi kapang secara mikroskopis dan makroskopis Identikasi
Mikroskopis
Isolat
R T O
Jenis hifa hifa bersekat
(septate) bersekat hifa tidak (aseptate)
Bentuk konidia bulat bulat bulat
Ornamentasi spora
Warna koloni hitam putih putih kuning
Permukaan koloni rata berserabut berserabut
Tekstur koloni bergranula beludru beludru
Zona pertumbuhan
19 Perhitungan Jumlah Spora
Perhitungan jumlah spora dilakukan untuk mengetahui jumlah spora yang akan digunakan pada fermentasi kapang dalam bentuk suspensi spora. Untuk memproduksi lipase dari kapang diperlukan pengamatan perubahan miselia dan pertumbuhan kapang terlebih dahulu, karena akan mempengaruhi produktivitas lipase yang dihasilkan (Stergiou et al. 2013). Pada proses fermentasi, pembentukan miselia selalu diikuti oleh pembentukan spora yang berguna untuk pembuatan inokulum. Inokulum yang berupa spora merupakan starter yang baik dalam fermentasi (Anggirasti 2008). Menurut Kurnia (2010), jumlah spora kapang yang paling baik digunakan untuk suspensi pada media fermentasi untuk produksi enzim adalah pada kisaran 105-4.3x108 spora/mL, sedangkan Suryanto et al. (2015) menggunakan suspensi dengan konsentrasi spora kapang sebesar 1x106 spora/mL.
Perhitungan spora selama tiga hari pada ketiga isolat kapang menunjukkan bahwa jumlah spora yang dihasilkan pada masing-masing kapang berbeda-beda. Perbedaan jumlah spora ini disebabkan oleh perbedaan siklus hidup pada ketiga kapang, sehingga proses terbentuknya hifa yang membentuk miselium yang berfungsi dalam menghasilkan alat reproduksi berupa spora pada ketiga kapang juga mengalami perbedaan. Hasil perhitungan spora pada ketiga isolat kapang untuk dapat digunakan sebagai inokulum pada waktu yang sama dan telah masuk dalam kisaran jumlah spora yang ditentukan, menunjukkan bahwa jumlah spora pada hari ketiga dari masing-masing isolat telah dapat digunakan untuk pembuatan inokulum dalam fermentasi kapang untuk produksi lipase (Tabel 4).
Kurva Pertumbuhan Kapang
20
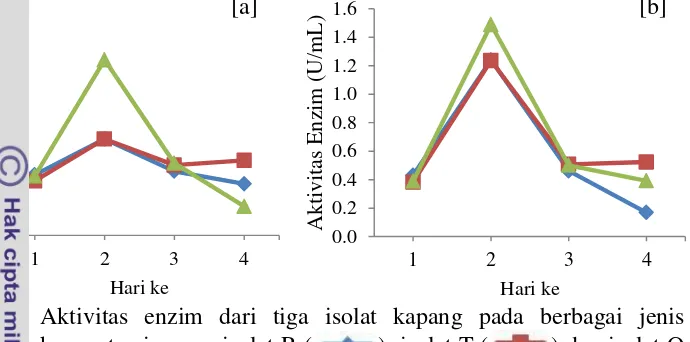
fermentasi menyebabkan banyaknya enzim yang dihasilkan sehingga aktivitas enzim cenderung lebih tinggi. Dari hasil tersebut, maka konsentrasi suspensi spora yang digunakan untuk produksi enzim adalah dengan konsentrasi 10% (v/v) dengan jumlah spora ± 16.00x106 - 29.12 x 107 /mL.
Gambar 7 Aktivitas enzim dari tiga isolat kapang pada berbagai jenis konsentrasi spora; isolat R ( ), isolat T ( ) dan isolat O ( ); a) konsentrasi suspensi spora 5% dan b) konsentrasi suspensi 10 % selama 4 hari fermentasi
Kurva pertumbuhan kapang dapat digunakan untuk melihat dan menggambarkan tahap-tahap dari siklus pertumbuhannya yang dibuat dengan memplotkan peningkatan jumlah selnya terhadap waktu yang digunakan untuk inkubasi. Pertumbuhan kapang berpengaruh terhadap peningkatan jumlah atau biomassa sel. Berat kering massa sel/biomassa sel merupakan salah satu metode tidak langsung dalam penentuan kurva pertumbuhan. Kurva pertumbuhan kapang diperlukan untuk mengetahui waktu optimum aktivitas enzim yang dihasilkan. Titik optimum aktivitas enzim diperlukan untuk mengetahui waktu produksi lipase tertinggi yang dihasilkannya. Hubungan dari pertumbuhan kapang dan aktivitas enzim dari ketiga isolat dapat dilihat pada Gambar 8 dan Gambar 9. Ketiga isolat kapang mengalami pertumbuhan dan perkembangbiakan sel dalam memproduksi enzim hingga mencapai puncaknya.
Gambar 8 Kurva pertumbuhan kapang dalam media PDB olive oil 2% selama
21
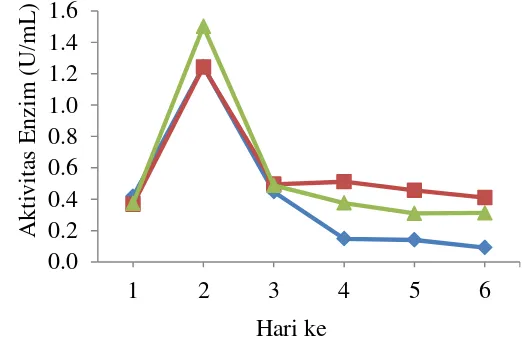
Gambar 9 Aktivitas enzim dari ketiga isolat dalam media PDB olive oil 2% selama 6 hari fermentasi pada suhu ruang; isolat R ( ), isolat T ( ) dan isolat O ( )
Selama pertumbuhan, peningkatan biomassa sel pada ketiga kapang selama proses fermentasi tidak diikuti dengan peningkatan aktivitas enzim yang dihasilkan. Aktivitas enzim paling tinggi yang dihasilkan dari ketiga kapang pada media fermentasi adalah diawal pertumbuhan yaitu pada hari ke 2 fermentasi dengan aktivitas enzim isolat R sebanyak 1.24 U/mL, isolat T 1.24 U/mL dan isolat O 1.49 U/mL. Aktivitas enzim selanjutnya mengalami penurunan selama proses fermentasi berlanjut. Namun, penurunan aktivitas lipase tidak diikuti dengan penurunan biomassa dari ketiga kapang.
22
Gambar 10 Perubahan pH dalam media PDB olive oil 2% selama 6 hari fermentasi; isolat R ( ), isolat T ( ) dan isolat O( ) Aktivitas kapang dalam memproduksi enzim diawal pertumbuhan kapang mengakibatkan penurunan pH pada media fermentasi sehingga kondisi berubah menjadi lebih asam dari dari pH 5 diawal pertumbuhan menjadi pH sekitar 3-4 (Gambar 10). Kapang memiliki berbagai aktivitas biokimia dalam pertumbuhan dan perbanyakannya dengan menggunakan nutrisi dari lingkungannya. Setiap kapang memiliki kemampuan dalam menggunakan enzim yang dimilikinya dalam mendegradasi karbohidrat, lemak yang terdapat dalam media digunakan untuk aktivitas metabolismenya. Media fermentasi yang digunakan dalam pengujian ini adalah PDB dan olive oil 2%. Media tersebut mengandung ekstrak kentang (sebagai karbohidrat) dan dextrose (glukosa) yang merupakan senyawa yang paling sering digunakan oleh mikroorganisme dalam proses fermentasi. Selama proses fermentasi terutama diawal pertumbuhan, kapang menggunakan glukosa untuk pertumbuhan dan perbanyakan sehingga aktivitas enzim meningkat dan pH media pertumbuhan mengalami penurunan.
Penentuan Media dan Waktu Produksi
Penentuan media dan waktu produksi enzim dilakukan berdasarkan kurva aktivitas enzim spesifik jam ke-24 sampai dengan jam ke-96 pada berbagai media produksi dan induser. Aktivitas enzim menunjukkan kemampuan suatu enzim dalam mengkatalisis perubahan suatu substrat menjadi produk dalam satuan unit. Dari hasil penelitian Nuraida (2003), penggunaan media pra-inokulasi tidak dapat meningkatan aktivitas hidrolisis lipase yang dihasilkan. Hasil penelitian Kurnia (2010) juga menunjukkan bahwa aktivitas lipase yang dihasilkan pada fermentasi Aspergillus niger dengan inkubasi PDB 24 jam dan tanpa pra-inkubasi memberikan hasil yang tidak jauh berbeda. Pada A.niger strain ITBCC L76 aktivitas lipase dengan pra-inkubasi PDB 24 jam adalah 0.2320 µ
mol/mL.menit dan 0.2278 µ mol/mL.menit untuk aktivitas lipase tanpa pra-inkubasi. Dari hasil penelitian-penelitian tersebut maka dalam penentuan media dan waktu produksi ini, kapang yang telah ditumbuhkan pada media PDA miring dengan umur 3 hari langsung dimasukkan ke dalam media produksi dalam bentuk suspensi spora untuk proses fermentasi tanpa menggunakan media pra-inkubasi.
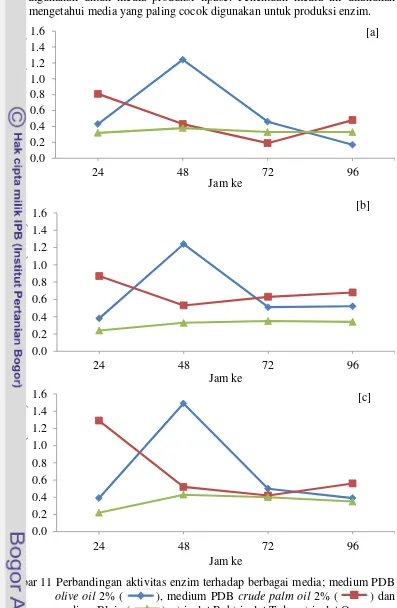
23 Media PDB merupakan medium yang sering digunakan untuk medium pra-inkubasi (media starter), sedangkan medium Blain (1978) merupakan medium yang digunakan untuk media produksi lipase. Penentuan media ini dilakukan untuk mengetahui media yang paling cocok digunakan untuk produksi enzim.
24
Medium fermentasi kapang yang baik untuk memproduksi lipase adalah medium yang mengandung sumber karbon seperti fruktosa, sumber nitrogen seperti pepton dan penambahan minyak seperti palm oil dan olive oil sebagai induser (Sharma et al. 2001). Rendah dan tingginya konsentrasi induser sangat mempengaruhi jumlah enzim yang diproduksi. Penggunaan minyak yang terlalu tinggi sebagai induser pada medium produksi dapat menyebabkan aktivitas lipase yang diproduksi justru lebih rendah karena perpindahan oksigen yang sedikit ke medium (Lima et al. 2003). Pramitasari et al. (2012) menggunakan induser minyak zaitun (olive oil) untuk memproduksi lipase dengan konsentrasi 2% dan Suharyanto et al. (2011) menggunakan crude palm oil (CPO) sebagai induser untuk memproduksi lipase spesifik 1.3 gliserida dari Rhizopus oryzae TP-2 dengan konsentrasi 2%. Oleh karena itu dalam penelitian ini, konsentrasi induser yang digunakan juga sebanyak 2% dari volume medium.
Hasil penentuan medium dan waktu produksi berdasarkan hasil perbandingan aktivitas pada Lampiran 4, dapat disimpulkan bahwa dari ketiga media produksi tersebut, medium yang memiliki aktivitas enzim paling tinggi/optimum adalah medium PDB dan olive oil 2% pada jam ke 48 yang menghasilkan aktivitas enzim pada isolat R sebesar 1.24 U/mL, isolat T 1.24 U/mL dan isolat T 1.49 U/mL. Pada medium produksi PDB dan crude palm oil 2%, waktu optimum yang menghasilkan aktivitas enzim paling tinggi adalah pada jam ke 24 dengan kisaran aktivitas ketiga isolat yaitu 0.81-1.29 U/mL, sedangkan pada medium Blain (1978) aktivitas enzim paling tinggi dari ketiga isolat hanya mencapai 0.33-0.43 U/mL dengan waktu optimum produksi pada jam ke 48 (Gambar 11).
Aktivitas enzim yang tinggi dari ketiga isolat pada medium PDB dan olive oil 2% kemungkinan disebabkan oleh kandungan pada mediumnya. Medium pertumbuhan mikrobia adalah suatu bahan yang terdiri dari campuran nutrien yang diperlukan mikrobia untuk pertumbuhannya. Dengan menggunakan bahan medium pertumbuhan yang sesuai, aktivitas mikrobia dapat menghasilkan enzim yang tinggi. Beberapa mikroorganisme dapat hidup baik pada medium yang sangat sederhana yang hanya mengandung garam anargonik di tambah sumber karbon organik seperti gula, sedangkan mikroorganime lainnya memerlukan suatu medium yang sangat kompleks. Ketiga kapang tersebut dalam memproduksi lipase kemungkinan hanya membutuhkan media sederhana seperti pada medium PDB dan tidak membutuhkan medium kompleks seperti Blain (1978). Oleh karena itu, fermentasi kapang dalam memproduksi lipase lebih sesuai menggunakan medium PDB. Pada medium tersebut, penggunaan induser olive oil juga lebih sesuai dibandingkan menggunakan crude palm oil. Hal ini disebabkan karena spesifisitas lipase pada jenis lipid dan asam lemak tertentu (Saktiwansyah 2001). Lipase dari ketiga isolat kapang tersebut memiliki tingkat hidrolitik yang tinggi pada asam lemak tak jenuh rantai panjang. Olive oil mengandung trigliserida yang tinggi dan merupakan asam lemak tak jenuh, sedangkan crude palm oil merupakan bentuk semi padat (fraksi padat dan cair) yang masih mengandung campuran asam lemak jenuh dan tak jenuh. Komposisi asam lemak pada crude palm oil adalah miristat (C14H28O2) 1.1-2.5%, palmitat (C16H32O2)
40-46%, stearat (C18H36O2) 3.6-4.7%, oleat (C18H34O2) 39-45% dan linoleat
25 Pengaruh pH, Suhu terhadap Aktivitas dan Stabilitas Enzim
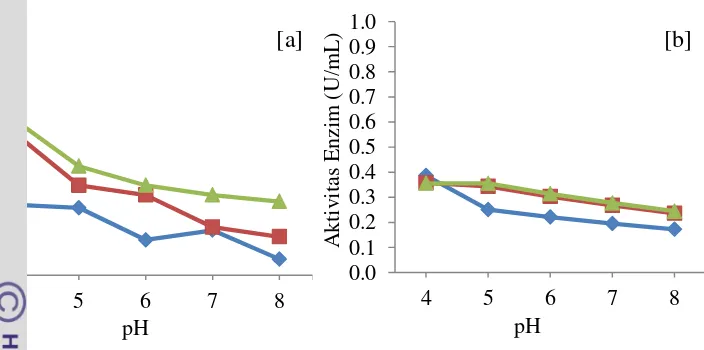
Salah satu karakter enzim adalah bekerja pada kondisi yang spesifik. Laju reaksi katalitik enzim sebagai biokatalisator sangat dipengaruhi oleh kondisi lingkungan. Faktor - faktor yang mempengaruhi aktivitas dari suatu enzim adalah konsentrasi enzim, substrat, produk, senyawa inhibitor dan aktivator, pH dan suhu (Suhartono 1989). Faktor yang penting diperhatikan pada enzim yang akan diapliksikan alam industri dan akan mempengaruhi kestabilannya adalah suhu dan pH. Untuk menentukan aktivitas optimum lipase yang dihasilkan ketiga isolat kapang diperlukan pengukuran aktivitas enzim pada variasi pH dan suhu. Setiap enzim memiliki karakter yang berbeda dan akan mengkatalis suatu reaksi pada kondisi optimum. Karakterisasi enzim dilakukan dengan melihat kondisi terbaik enzim pada berbagai kondisi pH, suhu dan stabilitasnya.
Kondisi pH yang tidak optimum akan membuat enzim mengalami inaktivasi dan akan merusak struktur proteinnya, sedangkan suhu yang terlalu rendah akan menyebabkan aktivitas enzim menurun. Pada suhu di atas dan di bawah optimalnya, aktivitas enzim berkurang. Ketika enzim dibawah suhu optimum terjadi perubahan konformasi substrat sehingga sisi reaktif substrat mengalami hambatan untuk memasuki sisi aktif enzim dan menyebabkan turunnya aktivitas enzim. Laju reaksi akan meningkat sejalan dengan kenaikan suhu sampai pada batas optimal, kemudian aktivitas akan menurun setelah melewati kondisi tersebut karena enzim akan mengalami denaturasi (Lehninger 1995).
Perubahan pH dapat mengubah penyebaran muatan pada sisi aktif molekul protein (Illanes 2008). Enzim akan mencapai aktivitas maksimumnya ketika struktur dan sisi aktif enzim berikatan dengan substrat pada pH optimum. Selain pH, aktivitas enzim juga dipengaruhi oleh suhu. Enzim merupakan suatu protein yang sensitif terhadap suhu tinggi karena dapat menyebabkan terjadinya denaturasi pada tingkat suhu tertentu. Denaturasi pada protein dapat merusak struktur sekunder protein. Struktur sekunder protein berupa ikatan hidrogen yang terbentuk dari ujung-ujung polar dari suatu rantai protein. Kerusakan struktur sekunder menyebabkan struktur tiga dimensi protein berubah dan menyebabkan kerja enzim terganggu sehingga konsentrasi enzim menjadi berkurang dan kecepatan reaksinya menurun (Murni et al 2011).
26 bahwa aktivitas enzim terbaik yang dihasilkan oleh ketiga isolat kapang adalah pada kondisi pH 4. Aktivitas enzim akan semakin menurun pada kondisi pH yang semakin tinggi (Gambar 12). Enzim merupakan suatu protein, dengan peningkatan pH akan menyebabkan ionisasi pada molekul protein sehingga menyebabkan perubahan pada struktur tiga dimensi protein. Enzim yang dihasilkan oleh kapang biasanya lebih cenderung bersifat lebih asam. Crueger dan Crueger (1984) menyebutkan bahwa kondisi pH lipase yang dihasilkan dari Aspergillus niger optimum pada pH 3-5.
Gambar 13 Aktivitas enzim pada berbagai suhu dengan a) metode titrasi dan b) metode Silva; isolat R ( ), isolat T ( ) dan isolat O
( ).
Pengaruh suhu terhadap respon aktivitas enzim pada rentang suhu 25oC sampai 45oC menunjukkan bahwa aktivitas enzim naik secara perlahan mengikuti kenaikan suhu, namun setelah mencapai puncaknya aktivitas kembali menurun
27 (Gambar 13). Peningkatan suhu menyebabkan kinetik molekul-molekul yang bereaksi bertambah sehingga molekul yang bereaksi semakin banyak dan produk yang dihasilkan semakin banyak. Aktivitas enzim terbaik yang dihasilkan ketiga isolat kapang pada metode titrasi (Yang et al. 2006) dan metode Silva (2005) menunjukkan hasil yang sama yaitu aktivitas enzim optimum pada kisaran suhu 40oC. Hasil penelitian lain juga menunjukkan hal yang sama, aktivitas optimum lipase yang dihasilkan Aspergilus niger dari strain ITBCC L51, ITBCC L161,
ITBCC L74, dan ITBCC L76 oleh Kurnia (2010) serta Aspergilus niger MTCC
adalah pada kisaran suhu 35-40oC.
Perbedaan kondisi optimum tersebut memperlihatkan bahwa kondisi optimum suhu dan pH pada dipengaruhi oleh jenis kapang yang digunakan (Lampiran 5). Perbedaan aktivitas enzim terhadap suhu dan pH optimum yang digunakan dapat terjadi karena adanya perbedaan interaksi kimia yang terjadi pada protein dan menyebabkan perubahan konformasi protein yang berpengaruh terhadap stabilitas dan aktivitas suatu protein.
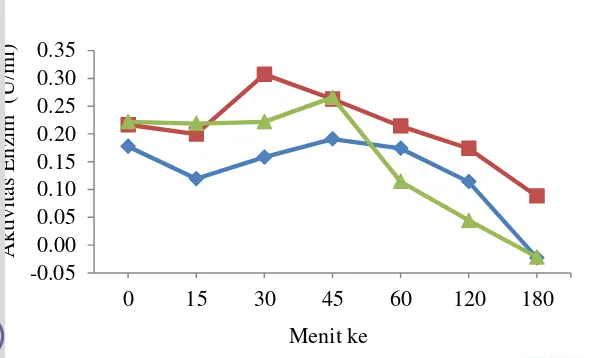
Suhu yang biasa digunakan untuk reaksi interesterifikasi enzimatik pada lipase adalah berkisar 55-75oC, dengan suhu yang optimum adalah 70oC (Pandiangan 2008). Aktivitas enzim setelah proses pemanasan disebut dengan aktivitas sisa enzim (residual activity). Aktivitas awal enzim (suhu optimum lipase pada suhu 40oC) diberi nilai 100%, lipase mengalami penurunan aktivitas disuhu 50oC sehingga sisa aktivitas lipase dari isolat R menjadi 73.33%, isolat T sebanyak 72.8% dan isolat O sebanyak 77.37% (Gambar 14). Penurunan aktivitas dihitung dari sisa aktivitas lipase tersebut dianggap tidak terlalu besar, sehingga pengujian stabilitas enzim untuk reaksi interesterifikasi digunakan suhu yang mendekati yaitu pada suhu 55oC.
Gambar 14 Stabilitas enzim ketiga isolat terhadap berbagai suhu; suhu 40oC ( ), suhu 50oC ( ) dan suhu 60oC ( )
Stabilitas merupakan sifat penting yang harus dimiliki oleh enzim dalam aplikasinya sebagai biokatalis. Stabilitas enzim dapat didefinisikan sebagai kestabilan aktivitas enzim selama penyimpanan dan penggunaan enzim tersebut. Selain pH dan suhu, stabilitas enzim terhadap suhu reaksi juga penting dalam karakterisasi suatu enzim. Suhu memiliki pengaruh yang cukup besar bukan hanya pada aktivitas enzim melainkan juga pada stabilitas enzim (Illanes 2008).
28
Gambar 15 Stabilitas enzim pada suhu reaksi (55oC); isolat R ( ), isolat T ( ) dan isolat O ( )
Suhu memberikan efek yang berbeda terhadap stabilitas lipase ketika di inkubasi pada suhu yang lebih tinggi dari kondisi optimalnya. Lipase dari ketiga isolat kapang diinkubasi pada suhu 55oC. Inkubasi lipase pada suhu reaksi (55 C) tidak dapat mempertahankan aktivitas katalitik enzim. Mulai menit ke-15 hingga menit ke-180 aktivitas enzim berangsur turun (Gambar 15). Waktu paruh merupakan waktu pemaparan enzim pada suhu tertentu yang menyebabkan penurunan aktivitas hingga 50% dari aktivitas semula. Semakin lama waktu paruh yang dimiliki enzim, maka kestabilannya juga akan semakin baik. Kestabilan lipase yang dihasilkan oleh ketiga kapang memiliki waktu paruh yaitu isolat R selama 180 menit, isolat T selama 140 menit dan isolat O selama 70 menit. Sisa aktivitas enzim setelah diinkubasi selama 180 menit pada suhu 55 oC yaitu isolat R sebanyak 48.2 %, isolat T sebanyak 4.02% dan isolat O sebanyak 3.79%. Hasil tersebut menunjukkan bahwa semakin lama enzim diinkubasi pada suhu 55 C, maka stabilitas enzim semakin menurun. Enzim yang dihasilkan ketiga kapang bukan termasuk termostabil yang tahan terhadap suhu tinggi. Ketika enzim diinkubasi pada suhu lebih tinggi (suhu 55 C) dalam waktu yang lama menyebabkan terjadinya denaturasi pada enzim. Kerusakan struktur sekunder menyebabkan struktur tiga dimensi protein berubah dan menyebabkan kerja enzim terganggu sehingga konsentrasi enzim menjadi berkurang dan kecepatan reaksinya menurun.
Produksi Enzim