STABILITAS SISIPAN KANDIDAT GEN TOLERAN
ALUMINIUM (
B11
) PADA PADI TRANSGENIK ASAL IR64
HASIL INFEKSI
IN-PLANTA
SYASTI HASTRIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Stabilitas Sisipan Kandidat Gen Toleran Aluminium (B11) pada Padi Transgenik Asal IR64 Hasil Infeksi In-Planta adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SYASTI HASTRIANI. Stabilitas Sisipan Kandidat Gen Toleran Aluminium (B11) pada Padi Transgenik Asal IR64 Hasil Infeksi In-Planta. Dibimbing oleh MIFTAHUDIN dan ARIEF PAMBUDI.
Padi varietas IR64 tergolong sensitif terhadap toksisitas Aluminium (Al). Pengembangan padi varietas toleran Al dapat dilakukan dengan menyisipkan gen toleran Al, yang salah satunya adalah gen B11 yang berhasil diisolasi dari genotipe padi toleran Al, Hawara Bunar. Penyisipan gen B11 pada padi varietas IR64 telah dilakukan dengan teknik in-planta dan telah diperoleh generasi T1. Penelitian ini bertujuan mengevaluasi stabilitas sisipan gen B11 pada generasi T1, T2, dan T3 padi IR64 hasil infeksi in-planta melalui seleksi antibiotik, analisis molekuler, dan pengamatan fenotipe tanaman. Seleksi antibiotik dilakukan menggunakan antibiotik higromisin pada konsentrasi 20 mg/l. Analisis sisipan gen dilakukan dengan teknik Polymerase Chain Reaction (PCR). Hasil menunjukkan bahwa gen B11 telah terintegrasi pada tanaman transgenik IR64 generasi T0, T1, dan T2. Integrasi gen B11 pada T0 tidak mengalami kimera. Hasil seleksi antibiotik memperlihatkan bahwa rasio toleran dan sensitif antibiotik pada T1 dan beberapa populasi T2 dan T3 adalah 3:1. Beberapa nomor pada populasi T2 dan T3 sudah homozigot terhadap gen B11. Karakter vegetatif dan reproduktif tanaman transgenik tidak berbeda dengan tipe liarnya.
Kata kunci: Gen B11, IR64, padi transgenik, tanah masam
ABSTRACT
SYASTI HASTRIANI. Stability of Tolerant Aluminum Candidate Gene (B11) in IR64 Transgenic Rice Result of In-Planta Infection. Supervised by MIFTAHUDIN and ARIEF PAMBUDI.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
STABILITAS SISIPAN KANDIDAT GEN TOLERAN
ALUMINIUM (
B11
) PADA PADI TRANSGENIK ASAL IR64
HASIL INFEKSI
IN-PLANTA
SYASTI HASTRIANI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Stabilitas Sisipan Kandidat Gen Toleran Aluminium (B11) pada Padi Transgenik Asal IR64 Hasil Infeksi In-Planta
Nama : Syasti Hastriani NIM : G34090054
Disetujui oleh
Dr Ir Miftahudin, MSi Pembimbing I
Arief Pambudi, SSi, MSi Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat meyelesaikan karya ilmiah dengan judul “Stabilitas Sisipan Kandidat Gen Toleran Aluminium (B11) pada Padi Transgenik Asal IR64 Hasil Infeksi In-Planta” dengan baik dan lancar. Penelitian ini telah dilaksanakan sejak November 2012 sampai dengan Januari 2014 di Laboratorium Penelitian Fisiologi dan Biologi Molekular Tumbuhan serta Rumah Kaca, Departemen Biologi.
Penulis mengucapkan terima kasih kepada Bapak Dr Ir Miftahudin, MSi dan Bapak Arief Pambudi, SSi, MSi selaku dosen pembimbing yang telah memberikan bimbingan dan saran kepada penulis selama pelaksanaan penelitian dan penulisan karya ilmiah. Terima kasih kepada Bapak Dr. Berry Juliandi, M.Si yang telah berkenan menjadi penguji luar pembimbing dan memberikan saran dan masukan untuk perbaikan karya ilmiah ini. Terima kasih penulis ucapkan kepada seluruh staf dosen pengajar Departemen Biologi yang telah memberikan ilmu yang bermanfaat kepada penulis. Terima kasih kepada BB BIOGEN Bogor yang telah memberikan biji padi IR64 tipe liar sebagai bahan penelitian. Terima kasih juga penulis ucapkan kepada rekan-rekan di Laboratorium Penelitian Fisiologi dan Biologi Molekular Tumbuhan (Pak Piet Riupasa, Pak Abi, Pak Aka, Pak Adeel, Ibu Dasumiati, Mbak Winda, Mbak Ratna, Mbak Jumi, Mbak Nurul, Mas Kifli, Kak Jun, Kak Garuda, Kak Eko) atas bantuan, konsultasi dan canda tawanya selama ini. Terima kasih kepada teman seperjuangan Firdha Junita Widiastuti dan teman-teman seangkatan Wulan, Yusi, Sheli, Sandi, Dian, Uni, Heca, Mirna, Upi, Yuli yang telah menemani dan menyemangati penulis selama penelitian. Terima kasih kepada Bapak, Ibu, adik, dan nenek tercinta di rumah yang senantiasa memberikan doa dan dukungannya.
Penulis berharap karya ilmiah ini dapat memberikan informasi yang berguna dan bermanfaat bagi perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat 2
Bahan dan Alat 2
HASIL 4
Verifikasi Ulang Sisipan Gen B11 pada Tanaman Generasi T0 dan T1 4
Penapisan Biji Transgenik 5
Segregasi Gen hpt dan Gen B11 6
Verifikasi Sisipan Gen pada Tanaman T1 dan T2 8
Karakter Vegetatif dan Reproduktif Tanaman T1 dan T2 9
PEMBAHASAN 10
SIMPULAN 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
DAFTAR TABEL
1 Segregasi biji IR64-4 generasi T1 yang diseleksi dengan antibiotik
higromisin 6
2 Segregasi biji IR64-4 generasi T2 yang diseleksi dengan antibiotik
higromisin 7
3 Segregasi biji IR64-4 generasi T3 yang diseleksi dengan antibiotik
higromisin 7
4 Karakter pertumbuhan tanaman transgenik generasi T1 dan T2 yang mendekati homozigot dan yang memenuhi nisbah 3:1 pada seleksi
antibiotik 10
DAFTAR GAMBAR
1 Hasil amplifikasi DNA tanaman T0 IR64-4 dan T1 IR64-4-7-4 dengan menggunakan primer yang didesain dari sekuen promoter 35S
CaMV dan gen B11 5
2 Perbedaan pertumbuhan biji padi IR64 tipe liar dan biji padi IR64
transgenik pada hari ke-9 setelah perlakuan 6
3 Hasil amplifikasi DNA tanaman transgenik IR64 generasi T1 dan T2 dengan menggunakan primer yang didesain dari sekuen gen hpt 8 4 Hasil amplifikasi DNA tanaman transgenik IR64 generasi T1 dan T2
dengan menggunakan primer yang didesain dari sekuen promoter 35S
CaMV dan gen B11 9
DAFTAR LAMPIRAN
1 Peta linier daerah T-DNA pembawa gen B11 pada plasmid
pGWB5-B11 19
2 Data hasil verifikasi sisipan gen hpt dan gen B11 20 3 Hasil penyejajaran sekuen primer 35S Nakajima-F dengan sekuen
target promoter 35S CaMV dan gen B11 21
4 Hasil penyejajaran sekuen primer HPT-F dan HPT-R dengan sekuen
PENDAHULUAN
Latar Belakang
Padi (Oryza sativa L). merupakan tanaman pangan sumber karbohidrat utama penduduk Indonesia. Produksi padi perlu ditingkatkan guna mencukupi kebutuhan pangan yang semakin meningkat seiring dengan pertambahan jumlah penduduk. Ekstensifikasi merupakan salah satu cara untuk peningkatan produksi padi. Usaha ekstensifikasi terkendala oleh keterbatasan lahan subur terutama di Pulau Jawa karena maraknya alih fungsi lahan. Dengan demikian, usaha ekstensifikasi harus segera dialihkan ke luar Jawa yang lahannya masih cukup luas (Hikmatullah et al. 2002).
Lahan di luar Jawa sebagian besar merupakan lahan marginal, yaitu lahan yang mempunyai kendala fisik dan atau kimia dalam pemanfaatannya untuk pertanian. Ultisol atau yang populer sebagai tanah podsolik adalah salah satu jenis tanah marginal yang penyebarannya cukup melimpah di Sumatera dan Kalimantan. Ultisol tergolong tanah miskin unsur hara dan bereaksi masam (Hikmatullah et al. 2002) serta memiliki kelarutan Al dalam bentuk Al3+ cukup tinggi yang dapat menyebabkan keracunan pada tanaman (Hartatik et al. 2007). Keracunan Al pada tanaman padi merupakan faktor utama pembatas produksi padi pada tanah masam (Roslim et al. 2010).
Penggunaan varietas padi toleran Al dapat digunakan sebagai salah satu solusi dalam usaha ekstensifikasi pertanian pada lahan masam. Namun, petani kurang menyukai padi-padi varietas toleran Al karena sifat agronomisnya yang tidak sebaik varietas populer. Padi varietas IR64 merupakan salah satu contoh padi varietas populer dengan sifat agronomis yang baik (Suprihatno et al. 2009). Padi IR64 tergolong sensitif terhadap cekaman Al, yang mengalami penghambatan pertumbuhan akar cukup besar selama perlakuan cekaman Al (Roslim et al. 2010).
Teknik rekayasa genetika dapat menjadi salah satu solusi untuk perbaikan sifat tanaman padi. Teknik ini memungkinkan untuk menghasilkan tanaman dengan karakter agronomis yang baik sekaligus toleran Al. Rekayasa dilakukan dengan meningkatkan ekspresi gen yang berperan dalam toleransi Al. Salah satu kandidat gen yang diduga berperan dalam toleransi Al adalah gen B11 yang berhasil diisolasi dari genotipe padi toleran Al, Hawara Bunar (Roslim 2011). Penyisipan gen pada padi dapat dilakukan salah satunya melalui infeksi Agrobacterium tumefaciens secara in-planta. Padi T0 IR64-4 hasil infeksi in-planta dan T1 IR64-4-7-4 hasil penelitian Pambudi (2012) memberikan hasil positif pada uji insersi gen dengan primer yang didesain dari sekuen gen B11 dan sekuen gen higromycin fosfotransferase (hpt).
2
hpt, promoter 35S CaMV juga diikutsertakan sebagai sekuen DNA sasaran pengecekan keberadaan gen B11 karena konstruksi gen B11 diletakkan setelah promoter 35S CaMV (Lampiran 1). Daerah promoter 35S CaMV dapat digunakan sebagai marka seleksi tanaman transgenik karena daerah tersebut tidak memiliki homologi dengan urutan DNA padi (Pambudi 2012).
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi stabilitas sisipan gen B11 pada generasi T1, T2, dan T3 padi IR64 hasil infeksi in-planta melalui seleksi antibiotik, analisis molekuler, dan pengamatan fenotipe tanaman.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan mulai November 2012 sampai dengan Januari 2014 di Laboratorium Penelitian Fisiologi dan Biologi molekuler Tumbuhan. Penanaman dan pengamatan fenotipe tanaman dilakukan di rumah kaca Departemen Biologi, IPB, Dramaga, Bogor.
Bahan dan Alat
Bahan tanaman yang digunakan dalam penelitian ini antara lain biji padi transgenik generasi T1, T2, dan T3 hasil infeksi in-planta pada padi IR64 (Pambudi 2012), biji padi IR64 tipe liar yang berasal dari Balai Besar Penelitian Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian Bogor, antibiotik higromisin, air steril, bahan-bahan untuk isolasi DNA, PCR kit KAPA2G Fast Readymix, primer 35S Nakajima-F (5’ -GAT-GTG-ATA-TCT-CCA-CTG-ACG-TAA-G-3’), primer B11 check-R (5’ -GAA-CGA-TTG-GGC-CTC-TGT-GA-3’), primer HPT-F (5’-GAT-GTT-GGC-GAC-CTC-GTA-TT-3’), primer HPT-R (5’-GAT-GTA-GGA-GGG-CGT-GGA-TA-3’), agarose, dan etidium bromida. Alat yang digunakan antara lain autoklaf, inkubator, laminar air flow cabinet (LAFC), growth environmental chamber, sentrifuse, waterbath, pipet mikro, mesin PCR (Esco Swift Maxi, Singapura), perangkat elektroforesis (BIO-RAD, USA), UV transluminator, WiseDoc gel documentation system (Daihan Scientific, Korea Selatan), dan alat-alat gelas.
Penapisan Biji Transgenik dengan Antibiotik
3 sudah disterilkan direndam di dalam larutan antibiotik higromisin 20 mg/l selama 24 jam pada suhu 4oC. Setelah itu biji dipindahkan pada air steril dan diletakkan pada ruang gelap selama 48 jam. Biji yang sudah berkecambah kemudian dipindahkan pada ruang kultur dengan kondisi pencahayaan 12 jam terang dan 12 jam gelap. Jumlah biji yang toleran dan sensitif dihitung untuk mengetahui pola segregasi gen. Penghitungan biji dilakukan pada hari ke-5. Biji padi yang mampu berkecambah merupakan biji putatif transgenik.
Analisis Data. Data hasil seleksi biji dianalisis menggunakan uji khi-kuadrat pada taraf uji α=5% untuk mengetahui pola segregasi gen sisipan. Penanaman di Rumah Kaca
Biji padi yang lolos seleksi antibiotik ditanam di rumah kaca pada pot berupa ember plastik. Media yang digunakan adalah tanah dan pupuk kandang dengan perbandingan 3:1 (v/v). Tanah sebelumnya diolah dan dilumpurkan selama 1 minggu. Perawatan dilakukan dengan penyiraman secara rutin, pemupukan dan pengendalian hama dan penyakit. Pupuk yang digunakan adalah pupuk NPK dan diaplikasikan sebanyak 3 kali yaitu 1 minggu setelah tanam (MST), 3 MST, dan 7 MST. Pengendalian hama dilakukan dengan menggunakan pestisida sesuai jenis hama yang menyerang. dimigrasikan pada 75V selama 45 menit dan didokumentasikan menggunakan UV transluminator dan gel documentation system.
4
Pengamatan Karakter Vegetatif dan Reproduktif Tanaman
Karakter Vegetatif. Pengamatan karakter vegetatif dilakukan 2 minggu setelah penanaman. Peubah yang diamati adalah tinggi tanaman dan jumlah anakan. Tinggi tanaman diukur mulai dari pangkal tanaman pada permukaan tanah sampai pucuk tertinggi dengan menggunakan meteran. Pengukuran tinggi tanaman dimulai saat tanaman berumur 2 minggu. Pengukuran dilakukan setiap 2 minggu sekali sampai tanaman masuk masa berbunga. Jumlah anakan dihitung secara langsung. Waktu penghitungan anakan dilakukan bersamaan dengan pengukuran tinggi tanaman.
Karakter Reproduktif. Karakter reproduktif diamati ketika tanaman masuk masa berbunga. Peubah yang diamati adalah umur berbunga, jumlah anakan produktif, panjang malai, jumlah biji bernas dan hampa per malai, bobot per malai, dan bobot per 100 biji. Umur berbunga dihitung sejak tanggal awal penanaman hingga malai muncul sempurna dan berbunga. Jumlah anakan produktif dihitung secara manual pada saat panen. Panjang malai diukur dari buku terakhir malai sampai gabah di ujung malai menggunakan penggaris. Pengukuran dilakukan sebelum biji dirontokkan dan dilakukan untuk semua malai pada satu rumpun. Setelah biji dirontokkan, biji bernas dipisahkan dari biji hampa kemudian dihitung secara terpisah. Biji bernas per malai setelah dihitung kemudian disatukan untuk satu rumpun. Bobot 100 biji ditimbang dengan mengambil 100 biji secara acak pada satu rumpun.
HASIL
Verifikasi Ulang Sisipan Gen B11 pada Tanaman Generasi T0 dan T1
Pambudi (2012) telah melakukan transformasi gen B11 secara in-planta pada padi T0 IR64-4 dan telah mendapatkan generasi T1. Sisipan gen B11 dan gen hpt pada padi T0 IR64-4 dan T1 IR64-4-7-4 telah diverifikasi dan memberikan hasil yang positif. Verifikasi ulang sisipan gen B11 dilakukan menggunakan pasangan primer 35S Nakajima-F dan B11 Check-R. Primer 35S Nakajima-F akan mengamplifikasi sebagian daerah dari promoter 35S CaMV sedangkan primer B11 Check-R akan mengamplifikasi sebagian daerah gen B11.
Hasil verifikasi ulang sisipan gen B11 pada T0 IR64-4 dan T1 IR64-4-7-4 dapat dilihat pada Gambar 1. Hasil amplifikasi DNA tanaman transgenik memunculkan pita dengan posisi migrasi yang sama dengan hasil amplifikasi plasmid pGWB5-B11 sebagai kontrol positif. Pita tersebut tidak terdapat pada hasil amplifikasi DNA IR64 tipe liar. Dengan demikian gen B11 telah terintegrasi beserta dengan promoter 35S CaMV pada kedua tanaman tersebut.
5
Penapisan Biji Transgenik
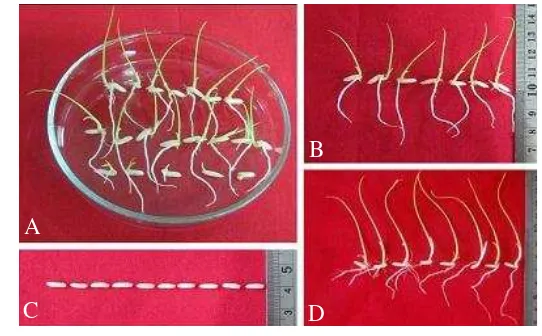
Seleksi dilakukan untuk memilah biji yang transgenik dan biji yang non-transgenik. Seleksi dilakukan dengan menggunakan agen seleksi dari marka seleksi gen hpt yaitu antibiotik higromisin. Sebelumnya telah dilakukan percobaan seleksi dengan menggunakan biji padi IR64 tipe liar yang direndam pada larutan higromisin konsentrasi 10 sampai 35 mg/l (gambar tidak dicantumkan). Pada konsentrasi 10 mg/l biji padi IR64 tipe liar masih mampu berkecambah dan menumbuhkan tajuk dan akar, sedangkan pada konsentrasi 15 mg/l biji padi hanya menumbuhkan tajuk saja. Pada konsentrasi 20 mg/l biji padi IR64 tipe liar tidak berkecambah sama sekali, begitu juga kondisi pada biji padi tipe liar yang direndam dengan higromisin 25 mg/l, 30 mg/l, dan 35 mg/l. Dengan demikian, konsentrasi higromisin terendah yang mampu menghambat pertumbuhan biji padi IR64 tipe liar adalah 20 mg/l.
Biji padi transgenik dan biji padi tipe liar memperlihatkan perbedaan pertumbuhan pada saat seleksi (Gambar 2). Biji padi transgenik pada perlakuan higromisin 20 mg/l tumbuh bervariasi. Biji transgenik ada yang menumbuhkan tajuk dan akar, tumbuh tajuknya saja, tumbuh akarnya saja atau tidak tumbuh sama sekali (Gambar 2A). Kriteria biji yang dianggap toleran adalah biji yang mampu menumbuhkan tajuk dan akar secara sempurna pada hari ke-5. Biji padi tipe liar pada perlakuan higromisin 20 mg/l tidak ada yang berkecambah (Gambar 2C). Biji padi tipe liar pada perlakuan higromisin 0 mg/l berkecambah normal, tajuknya berwarna hijau, akarnya tumbuh dengan baik dan memiliki akar seminal dan lateral yang cukup banyak (Gambar 2D). Pertumbuhan kecambah padi transgenik tidak sebaik padi tipe liar. Tajuk padi transgenik berwarna hijau kekuningan, ukurannya lebih pendek dibandingkan tajuk padi tipe liar. Sebagian besar kecambah padi transgenik hanya menumbuhkan akar utama saja yang ukurannya lebih pendek dibandingkan dengan padi tipe liar, akar lateral dan akar seminalnya sedikit dan ukurannya sangat pendek (Gambar 2B). Keadaan yang demikian berlaku untuk seleksi biji pada generasi T1, T2, dan T3.
T0 IR64-4 anakan ke- T1 IR64-4-7-4 anakan ke-
M D A TL 1 2 3 4 5 6 7 8 D M A TL 1 2 3 4 5 6 7 M 8 9 10 11 12 13 14
Gambar 1 Hasil amplifikasi DNA tanaman T0 IR64-4 dan T1 IR64-4-7-4 dengan menggunakan primer yang didesain dari sekuen promoter 35S CaMV dan gen B11.
Tanda panah menunjukkan ukuran target; M: DNA ladder 100 pb, D: ddH2O, A: plasmid pGWB5-B11, TL: DNA padi IR64 tipe liar.
A B
300pb
6
Segregasi Gen hpt dan Gen B11
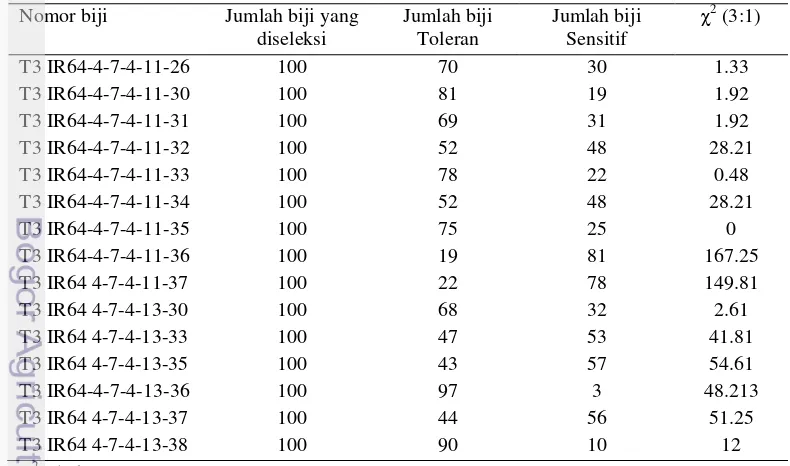
Pola segregasi pada generasi T1
Analisis pola segregasi gen B11 dilakukan secara tidak langsung dengan melihat segregasi dari gen hpt. Apabila gen sisipan terintegrasi satu copy pada kromosom tanaman, maka segregrasi gen tersebut akan mengikuti model pewarisan gen tunggal dengan rasio kecambah toleran banding sensitif adalah 3:1
(nilai χ2 hitung lebih kecil dari χ2
tabel). Pada biji T1 diharapkan akan mendapatkan nomor yang memenuhi perbandingan 3:1. Hasil uji khi-kuadrat pada Tabel 1 menunjukkan bahwa T1 IR64-4-7 (biji dari malai ke-7 T0 IR64-4) dan T1 IR64-4-8 (biji dari malai ke-8 T0 IR64-4) memenuhi nisbah 3:1.
Tabel 1 Segregasi biji IR64-4 generasi T1 yang diseleksi dengan antibiotik higromisin Nomor Biji Jumlah biji yang
Seleksi biji pada generasi T2 diharapkan akan mendapatkan nomor biji yang homozigot dominan. Segregasi biji generasi T2 ditampilkan pada Tabel 2. Empat nomor T2 yaitu T2 7-23, T2 8-2, T2 8-12, dan T2 IR64-4-8-15 sekitar 90% dari total bijinya yang diseleksi toleran. Empat nomor tersebut diduga memiliki gen B11 yang homozigot walaupun masih terdapat beberapa bijinya yang sensitif. Selain nomor diatas, terdapat lima nomor T2 yang memenuhi nisbah 3:1 yaitu T2 IR64-4-7-4, T2 IR64-4-7-8, T2 IR64-4-7-19, T2 IR64-4-7-22, dan T2 IR64-4-8-14. Nomor-nomor tersebut masih dengan gen B11 dalam kondisi heterozigot.
A
B
C D
7 Tabel 2 Segregasi biji IR64-4 generasi T2 yang diseleksi dengan antibiotik higromisin
Nomor Biji Jumlah biji yang tanaman T2 IR64-4-7-4 masih heterozigot karena bersegregasi dengan nisbah 3:1, hanya dua nomor biji yang mendekati homozigot yaitu T3 IR64-4-7-4-13-36 dan T3 IR64-4-7-4-13-38. Hasil uji khi-kuadrat 3:1 generasi T3 dapat dilihat pada Tabel 3. Terdapat enam nomor yang memenuhi perbandingan 3:1 yaitu T3 IR64 4-7-4-11-26, T3 IR64 4-7-4-11-30, T3 IR64 4-7-4-11-31, T3 IR64 4-7-4-11-33, T3 IR64 4-7-4-11-35, dan T3 IR64 4-7-4-13-30.
8
Verifikasi Sisipan Gen pada Tanaman T1 dan T2
Verifikasi sisipan gen hpt
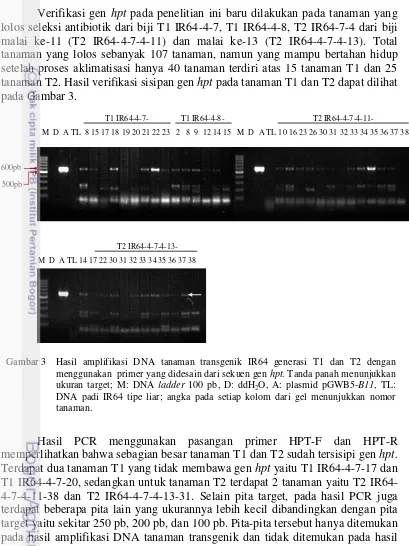
Verifikasi gen hpt pada penelitian ini baru dilakukan pada tanaman yang lolos seleksi antibiotik dari biji T1 IR64-4-7, T1 IR64-4-8, T2 IR64-7-4 dari biji malai ke-11 (T2 IR64-4-7-4-11) dan malai ke-13 (T2 IR64-4-7-4-13). Total tanaman yang lolos sebanyak 107 tanaman, namun yang mampu bertahan hidup setelah proses aklimatisasi hanya 40 tanaman terdiri atas 15 tanaman T1 dan 25 tanaman T2. Hasil verifikasi sisipan gen hpt pada tanaman T1 dan T2 dapat dilihat pada Gambar 3.
Hasil PCR menggunakan pasangan primer HPT-F dan HPT-R memperlihatkan bahwa sebagian besar tanaman T1 dan T2 sudah tersisipi gen hpt. Terdapat dua tanaman T1 yang tidak membawa gen hpt yaitu T1 IR64-4-7-17 dan T1 4-7-20, sedangkan untuk tanaman T2 terdapat 2 tanaman yaitu T2 IR64-4-7-4-11-38 dan T2 IR64-4-7-4-13-31. Selain pita target, pada hasil PCR juga terdapat beberapa pita lain yang ukurannya lebih kecil dibandingkan dengan pita target yaitu sekitar 250 pb, 200 pb, dan 100 pb. Pita-pita tersebut hanya ditemukan pada hasil amplifikasi DNA tanaman transgenik dan tidak ditemukan pada hasil amplifikasi DNA tanaman tipe liar maupun pada plasmid pGWB5-B11.
M D A TL 8 15 17 18 19 20 21 22 23 2 8 9 12 14 15 M D A TL 10 16 23 26 30 31 32 33 34 35 36 37 38 T1 IR64-4-7- T1 IR64-4-8- T2 IR64-4-7-4-11-
Gambar 3 Hasil amplifikasi DNA tanaman transgenik IR64 generasi T1 dan T2 dengan menggunakan primer yang didesain dari sekuen gen hpt. Tanda panah menunjukkan ukuran target; M: DNA ladder 100 pb, D: ddH2O, A: plasmid pGWB5-B11, TL: DNA padi IR64 tipe liar; angka pada setiap kolom dari gel menunjukkan nomor tanaman.
T2 IR64-4-7-4-13- M D A TL 14 17 22 30 31 32 33 34 35 36 37 38 600pb
9 Verifikasi sisipan gen B11
Hasil verifikasi sisipan gen B11 dapat dilihat pada Gambar 4. Sebagian besar tanaman T1 dan T2 sudah tersisipi gen B11. Terdapat satu tanaman T1 yang tidak positif yaitu T1 IR64-4-7-17, sedangkan tanaman T2 terdapat 9 tanaman. Tanaman T2 yang tidak membawa sisipan gen B11 adalah T2 IR64-4-7-4-11-10, T2 4-11-16, T2 4-11-23, T2 4-13-14, T2 IR64-4-7-4-13-17, T2 IR64-4-7-4-13-22, T2 IR64-4-7-4-13-31, T2 IR64-4-7-4-13-32, dan T2 IR64-4-7-4-13-34. Pita DNA bukan target juga ditemukan pada hasil amplifikasi DNA tanaman transgenik dengan ukuran sekitar 100 pb dan 80 pb. Keadaannya sama dengan hasil verifikasi gen hpt, pita tersebut tidak ditemukan pada hasil amplifikasi DNA tanaman tipe liar maupun pada plasmid pGWB5-B11.
Apabila hasil verifikasi digabungkan maka terdapat 13 tanaman T1 dan 15 tanaman T2 yang membawa gen hpt dan gen B11, sedangkan yang tidak membawa kedua gen tersebut ada dua tanaman yaitu T1 IR64-4-7-17 dan T2 IR64-4-7-4-13-31. Sisa tanaman lainnya hanya membawa gen hpt atau gen B11 saja. Delapan tanaman yang hanya membawa gen hpt, yaitu T2 IR64-4-7-4-11-10, T2 4-11-16, T2 4-11-23, T2 4-13-14, T2 IR64-4-7-4-13-17, T2 IR64-4-7-4-13-22, T2 IR64-4-7-4-13-32, dan T2 IR64-4-7-4-13-34, sedangkan yang hanya membawa gen B11 terdapat 2 tanaman yaitu T1 IR64-4-7-20 dan T2 IR64-4-7-4-11-38.
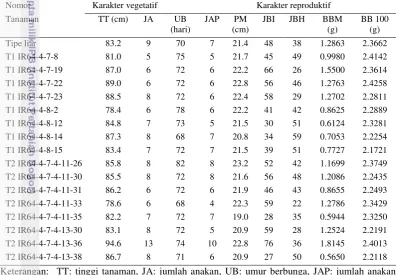
Karakter Vegetatif dan Reproduktif Tanaman T1 dan T2
Karakter vegetatif dan reproduktif tanaman transgenik tidak berbeda dengan tipe liarnya. Secara keseluruhan tinggi tanaman transgenik relatif lebih tinggi. Tanaman transgenik memiliki jumlah anakan yang lebih sedikit dibandingkan tanaman tipe liar, tetapi jumlah anakan produktifnya relatif sama. Umur berbunga tanaman transgenik relatif lebih lama, walaupun beberapa nomor
T1 IR64-4-7- T1 IR64-4-8- T2 IR64-4-7-4-11-
M D A TL 8 15 17 18 19 20 21 22 23 2 8 9 12 14 15 M D A TL 10 16 23 26 30 31 32 33 34 35 36 37 38
Gambar 4 Hasil amplifikasi DNA tanaman transgenik IR64 generasi T1 dan T2 dengan menggunakan primer yang didesain dari sekuen promoter 35S CaMV dan gen B11. Tanda panah menunjukkan ukuran target; M: DNA ladder 100 pb, D: ddH2O, A: plasmid pGWB5-B11, TL: DNA padi IR64 tipe liar; angka pada setiap kolom dari gel menunjukkan nomor tanaman.
T2 IR64-4-7-4-13-
M D A TL 14 17 22 30 31 32 33 34 35 36 37 38 300pb
10
berbunga lebih cepat. Panjang malai tanaman transgenik relatif sama dengan tanaman tipe liar. Rata-rata jumlah biji bernas per malai tanaman transgenik relatif lebih tinggi dan jumlah biji hampa per malainya relatif lebih rendah. Rata-rata bobot biji per malai tanaman transgenik secara keseluruhan relatif sama dengan tanaman tipe liar. Pada beberapa nomor rata-rata bobot biji per malainya rendah karena jumlah biji bernas per malainya rendah, namun bobot per 100 bijinya secara keseluruhan relatif sama dibandingkan tanaman tipe liar. Karakter vegetatif dan reproduktif tanaman padi transgenik generasi T1 dan T2 yang mendekati homozigot dan yang memenuhi nisbah 3:1 pada seleksi antibiotik disajikan pada Tabel 4.
Tabel 4 Karakter pertumbuhan tanaman transgenik generasi T1 dan T2 yang mendekati homozigot dan yang memenuhi nisbah 3:1 pada seleksi antibiotik
Nomor Karakter vegetatif Karakter reproduktif Tanaman TT (cm) JA UB
produktif, PM: rata-rata panjang malai, JBI: rata-rata jumlah biji isi per malai, JBH: rata-rata jumlah biji hampa per malai, BBM: rata-rata bobot biji per malai, BB 100: bobot per 100 biji.
PEMBAHASAN
11 indigenous adalah pada promoter gennya. Gen B11 yang disisipkan menggunakan promoter 35S CaMV yang tidak terdapat pada tanaman tipe liar. Promoter ini bersifat konstitutif sehingga gen tersebut akan diekspresikan secara terus menerus dan tidak tergantung kondisi lingkungan (Kay et al. 1987).
Analisis sisipan per anakan diperlukan pada tanaman generasi T0 karena adanya potensi kimera. Hasil penelitian Pambudi (2012) memperlihatkan bahwa sebagian besar tanaman transgenik generasi T0 beberapa varietas padi hasil infeksi in-planta kimera. Kimera merupakan salah satu kelemahan dari proses transformasi secara in-planta pada padi. Kimera adalah kondisi dimana tanaman hasil transformasi sebagian transgenik dan sebagian tidak. Hal ini terjadi karena jarum infeksi melukai sel bukan pada bagian meristem melainkan sel yang sudah terdiferensiasi (Supartana et al. 2005).
Tanaman T1 sebenarnya tidak diperlukan uji sisipan per anakan karena bukan tanaman yang berasal dari biji yang ditransformasi langsung melainkan dari biji yang dihasilkan dari tanaman T0. Adanya anakan yang tidak positif pada tanaman T1 kemungkinan disebabkan karena konsentrasi DNA yang digunakan untuk PCR tidak cukup. Teknik analisis menggunakan PCR membutuhkan DNA dalam jumlah yang cukup dengan kualitas yang baik. Kualitas dan kuantitas DNA yang yang kurang baik dapat mempengaruhi hasil amplifikasi dan intensitas pita DNA pada elektroforesis menjadi tidak jelas (Restu et al. 2012). Kuantitas DNA T1 yang kurang mungkin disebabkan karena daun yang digunakan untuk bahan isolasi DNA sudah tua dan mulai menguning. Prayitno dan Nuryandani (2011) menyebutkan bahwa semakin tua daun yang digunakan untuk bahan isolasi maka kuantitas DNA yang didapatkan semakin menurun. Pada daun tua proses pembelahan sel sudah menurun, sedangkan pada daun yang mulai menguning proses pembelahan mungkin telah berhenti dan sel-selnya telah mati (Salisbury dan Ross 1995). Hal tersebut menyebabkan jumlah DNA genom yang terisolasi sangat sedikit.
Higromisin 20 mg/l efektif digunakan untuk seleksi biji transgenik IR64. Higromisin merupakan agen seleksi dari marka seleksi gen hpt yang disisipkan pada konstruksi gen B11. Gen hpt merupakan contoh marka seleksi negatif yang dapat mematikan sel-sel peka sedangkan sel yang tertransformasi akan bertahan hidup. Efektifitas dari suatu agen seleksi salah satunya dipengaruhi oleh konsentrasi. Menurut Bashir et al. (2004), konsentrasi yang efektif digunakan untuk seleksi adalah konsentrasi toksik terendah yang mampu menekan pertumbuhan sel-sel peka sehingga tidak menyebabkan efek yang negatif untuk pertumbuhan sel-sel yang tertransformasi.
Biji padi transgenik mampu berkecambah pada media higromisin 20 mg/l sedangkan yang non-transgenik tidak berkecambah sama sekali. Antibiotik higromisin bekerja dengan cara menghambat sintesis protein, mengganggu translokasi dan menyebabkan kesalahan penerjemahan di ribosom 80S sehingga menyebabkan kematian pada biji non-transgenik (Bashir et al. 2004). Tanaman transgenik mampu tumbuh karena mengekspresikan gen hpt yang mengkode enzim hygromycin phosphotransferase (HPT) (Zalacain et al. 1986). Enzim HPT dapat menginaktivasi antibiotik higromisin dengan mekanisme fosforilasi (Pardo et al. 1985).
12
pada tajuk dan panjang akar yang pendek diduga disebabkan karena pengaruh higromisin. Bibi et al. (2013) melaporkan bahwa perlakuan antibiotik higromisin mengakibatkan perubahan warna daun kapas dari hijau menjadi kuning serta mengakibatkan penurunan panjang akar. Pertumbuhan tanaman transgenik yang terhambat kemungkinan disebabkan karena ATP yang digunakan untuk pertumbuhan kecambah sebagian digunakan untuk fosforilasi pada proses inaktivasi higromisin. ATP pada biji digunakan untuk mendukung proses metabolisme yang penting untuk perkecambahan yang mulai dibentuk ketika biji mengalami imbibisi. Alokasi ATP untuk inaktivasi higromisin dapat menyebabkan proses metabolisme seperti sintesis RNA dan protein menurun. Pada biji, penurunan kapasitas sintesis RNA dan protein dapat mengakibatkan penurunan pertumbuhan setelah perkecambahan salah satunya penurunan panjang akar (Bewley dan Black 1985).
Apabila gen sisipan terintegrasi satu copy pada tanaman T0 IR64-4 maka segregasi gen sisipan akan mengikuti model monohibrid mendel. Biji T1 yang dihasilkan akan memenuhi perbandingan 3:1 ketika diseleksi dengan antibiotik. Biji T1 yang lolos seleksi memiliki 2 macam kemungkinan genotipe gen sisipan, homozigot dominan atau heterozigot. Apabila biji tersebut bergenotipe homozigot dominan, maka akan menghasilkan biji T2 dengan genotipe homozigot dominan. Biji yang dihasilkan dari tanaman yang bergenotipe homozigot dominan akan tumbuh 100% dari total biji saat diseleksi. Apabila biji T1 bergenotipe heterozigot, maka biji T2 akan bersegregasi kembali dengan nisbah 3:1. Biji T1 yang dihasilkan tanaman T0 IR64-4 memenuhi perbandingan 3:1 pada saat seleksi antibiotik. Beberapa biji T1 yang lolos seleksi diduga bergenotipe homozigot dominan karena empat nomor biji T2 yang dihasilkan sekitar 90% bijinya toleran. Lima nomor T2 lain dihasilkan dari biji T1 yang heterozigot karena masih bersegregasi dengan nisbah 3:1. Salah satu nomor biji T2 yang memenuhi nisbah 3:1 adalah T2 IR64-4-7-4. Biji generasi T3 yang dihasilkan T2 IR64-4-7-4 sebagian besar masih heterozigot, hanya dua nomor yang mendekati homozigot yaitu T3 IR64-4-7-4-13-36 dan T3 IR64-4-7-4-13-38.
13 Beberapa nomor tanaman hanya positif pada uji insersi salah satu gen target. Hal ini menandakan bahwa T-DNA tersisip secara parsial pada tanaman tersebut. Proses pemindahan T-DNA dari Agrobacterium tumefaciens ke tanaman inang merupakan proses yang kompleks yang melibatkan banyak gen pengatur virulensi (vir) dalam operon vir dan interaksinya dengan gen dari tanaman inang (Nester et al. 2005). Ketika dipindahkan ke sel inang, T-DNA akan mengalami beberapa proses penataan ulang seperti rekombinasi, replikasi, dan aktivitas perbaikan sebelum terintegrasi ke genom tanaman (Zambryski 1988). Proses tersebut berpotensi mengakibatkan bagian-bagian T-DNA menjadi tidak utuh sehingga gen sisipan terintegrasi sebagian.
Analisis sisipan gen B11 dan gen hpt memperlihatkan bahwa lebih banyak tanaman yang tidak positif membawa gen B11. Gen B11 pada konstruk T-DNA berada pada daerah right border (RB) sedangkan gen hpt berada pada daerah left border (LB). Kehilangan basa pada daerah RB T-DNA jarang dilaporkan. Pada sebagian besar tanaman transgenik, peluang terjadinya kehilangan basa pada daerah LB biasanya lebih besar dibandingkan dengan daerah RB (Windels et al. 2008). Kehilangan sekuen basa pada daerah RB dilaporkan oleh Chen et al. (2011) dari hasil analisis sekuen pengapit pada tanaman transgenik Brassica napus,memperlihatkan bahwa telah terjadi delesi 62 basa pada daerah RB. Selain delesi juga terjadi substitusi basa pada daerah LB. Hal serupa juga dilaporkan oleh Krizkova dan Hrouda (1988), pada tanaman tembakau. Bagian daerah RB T-DNA yang hilang pada tembakau lebih besar daripada daerah LB. Delesi dan substitusi pada T-DNA dapat berpengaruh pada proses amplifikasi. Amplifikasi dapat mengalami kegagalan apabila delesi atau substitusi tersebut terjadi pada DNA target terutama pada daerah penempelan primer.
Hasil amplifikasi DNA tanaman transgenik pada uji sisipan gen hpt maupun gen B11 menghasilkan pita DNA yang tidak spesifik. Pita tersebut diduga merupakan hasil amplifikasi tidak spesifik pada DNA target karena pita tersebut tidak ditemukan pada hasil amplifikasi DNA tanaman tipe liar. Amplifikasi tidak spesifik terjadi salah satunya karena primer menempel pada situs yang tidak tepat (Cha dan Thilly 1993). Hal ini dapat terjadi apabila sekuen basa primer memiliki
homologi dengan sekuen DNA target terutama pada bagian ujung 3’. Dugaan ini
dapat diperjelas dengan cara menyejajarkan sekuen DNA target dengan sekuen primer. Hasil penyejajaran dengan menggunakan program Clustal X memperlihatkan bahwa sekuen primer 35S Nakajima-F memiliki kemiripan pada basa ke-157 sampai 182 dan basa ke-188 sampai 212 gen B11 (Lampiran 3). Apabila primer 35S Nakajima-F menempel pada situs tersebut maka akan dihasilkan pita dengan ukuran sekitar 112 pb an 81 pb. Begitu juga yang terjadi pada hasil amplifikasi gen hpt. Primer HPT-F dan HPT-R memiliki kemiripan pada beberapa situs gen hpt (Lampiran 4). Hasil amplifikasi beberapa kombinasi situs penempelan primer yang tidak spesifik berukuran sekitar 250 pb, 200 pb, dan 100 pb.
14
DNA cetakan merupakan salah satu faktor yang mempengaruhi efisiensi PCR. PCR dengan DNA cetakan yang berukuran kecil seperti plasmid akan lebih efisien dibandingkan dengan PCR menggunakan DNA cetakan yang berukuran besar seperti DNA genom tanaman.
Hasil verifikasi sisipan gen hpt memperlihatkan bahwa terdapat tanaman yang lolos seleksi antibiotik namun tidak positif membawa gen hpt. Tanaman non-transgenik yang lolos seleksi dihasilkan pada proses penapisan sebelum menggunakan metode seperti yang diuraikan Yanagisawa et al. (2004). Hal ini kemungkinan terjadi karena pemberian perlakuan higromisin pada tahap perkecambahan yang tidak tepat. Pada metode yang diuraikan Yanagisawa et al. (2004), higromisin diberikan ketika biji melakukan imbibisi. Higromisin yang terserap embrio bersama air akan menghambat proses sintesis protein sehingga biji non-transgenik akan mengalami kegagalan perkecambahan. Pada metode yang digunakan sebelumnya, higromisin diberikan ketika biji sudah berkecambah. Pada tahap ini kecambah sudah memiliki cukup energi untuk tumbuh sehingga walaupun ditumbuhkan dalam media yang mengandung higromisin tidak akan langsung mengalami kematian. Dengan demikian, seleksi menggunakan higromisin yang diaplikasikan pada saat awal perkecambahan ini lebih efektif. Menurut Htwe et al. (2014), konsentrasi higromisin 20 mg/l tergolong konsentrasi yang rendah sehingga membutuhkan waktu yang lama untuk menyeleksi. Seleksi hanya dilakukan hingga hari ke-7 karena tanaman yang sudah berkecambah mulai mengalami klorosis. Waktu seleksi yang singkat tersebut memberikan peluang tanaman non-transgenik untuk lolos, bahkan beberapa padi tipe liar masih tumbuh hingga hari ke-7 walaupun pertumbuhannya tidak sebaik kecambah padi transgenik.
Karakter vegetatif dan generatif perlu diamati untuk membandingkan pertumbuhan tanaman transgenik dengan tipe liarnya. Padi transgenik diharapkan akan memiliki pertumbuhan yang lebih baik dari tipe liarnya. Fase vegetatif pada tanaman padi dimulai dari perkecambahan hingga inisiasi pembentukan malai. Pertumbuhan pada fase vegetatif dicirikan dengan peningkatan tinggi tanaman dan pembentukan anakan. Pertumbuhan pada fase ini penting diamati karena mempengaruhi tiga komponen hasil yaitu jumlah malai, produksi biji per malai, dan bobot per biji (Moldenhauer dan Slaton 2014). Tinggi tanaman transgenik relatif lebih tinggi, namun jumlah anakannya lebih sedikit dibandingkan tipe liar. Hal ini sesuai dengan yang dilaporkan Rahayu & Harjoso (2010) bahwa tinggi tanaman pada padi menunjukkan nilai yang bertolak belakang dengan jumlah anakan, tanaman padi yang tinggi cenderung memiliki jumlah anakan yang sedikit begitu juga sebaliknya.
15 yang penting karena berpengaruh terhadap produksi yang mampu dihasilkan oleh tanaman padi (Chandrasari et al. 2012).
Selain jumlah anakan produktif, produksi suatu tanaman padi juga didukung oleh panjang dari malai padi, jumlah biji, dan bobot biji. Panjang malai menentukan seberapa banyak biji yang mampu dihasilkan per malainya. Malai yang lebih panjang dapat menampung biji lebih banyak sehingga produksi biji per malainya lebih banyak. Biji hampa dihasilkan apabila suplai asimilat ke biji berkurang karena kemampuan metabolisme tanaman yang menurun. Kurangnya suplai asimilat ke biji juga dapat mengakibatkan bobot biji menjadi rendah (Manurung dan Ismunadji 1988). Kehampaan biji padi transgenik yang tinggi pada penelitian ini kemungkinan bukan disebabkan karena pertumbuhan tanaman yang terganggu melainkan karena serangan hama walang sangit. Hal ini diperkuat dengan nilai bobot biji padi transgenik yang hampir sama dengan bobot biji padi IR64 tipe liar.
SIMPULAN
Gen B11 telah terintegrasi pada tanaman transgenik IR64 generasi T0, T1, dan T2. Integrasi gen B11 pada padi T0 IR64-4 tidak kimera. Higromisin 20 mg/l efektif digunakan sebagai agen seleksi padi transgenik IR64. Seleksi biji transgenik dengan higromisin efektif dilakukan pada saat biji melakukan imbibisi. Pertumbuhan tanaman transgenik pada media higromisin 20 mg/l tidak sebaik tanaman kontrol pada media higromisin 0 mg/l. Rasio toleran dan sensitif antibiotik pada T1 dan beberapa populasi T2 dan T3 adalah 3:1. Beberapa nomor pada populasi T2 dan T3 sudah homozigot terhadap gen B11. Uji sisipan gen B11 dan gen hpt masih terjadi amplifikasi yang tidak spesifik. Pertumbuhan padi transgenik tidak berbeda dengan padi IR64 tipe liar berdasarkan karakter vegetatif dan reproduktifnya.
DAFTAR PUSTAKA
Bashir K, Rafiq M, Fatima T, Husnain T, Riazuddin S. 2004. Hygromycin based selection of transformants in a local inbred line of Zea mays (L). Pak J Biol Sci. 7(3): 318-323.
Bewley JD, Black M. 1985. Seeds Physiology of Development and Germination. New York (USA): Plenum Press.
Bibi N, Fan K, Yuan S, Ni M, Ahmed IM, Malik W, Wang X. 2013. An efficient and highly reproducible approach for selection of upland transgenic cotton produced by pollen tube pathway method. AJCS. 7(11): 1714-1722.
Cha RS, Thilly WG. 1993. Specificity, efficiency, and fidelity of PCR. Genome Res. 3: 18-29.
16
Chen S, Zhang J, Pu H, Shen A, Zhou X, Long W, Hu M, Qi C. 2011. Analysis of insertion copy number and integration site of T-DNA in the genome of transgenic high oleic rapeseed (Brassica napus L.). Plant Gene Trait. 2(3): 15-22. doi 10.5376/ptg.2011.02.0003.
Hartatik W, Sulaeman, Kasno A. 2007. Perubahan sifat kimia tanah dan ameliorasi sawah bukaan baru. Di dalam: Agus F, Santoso D, Wahyunto, editor. Lahan Sawah Bukaan Baru. Bogor (ID): Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian. hlm 53-75.
Hikmatullah, Sawiyo, Suharta N. 2002. Potensi dan kendala pengembangan sumber daya lahan untuk pencetakan sawah irigasi di luar jawa. Litbang Pertanian. 21(4): 115-123.
Htwe NN, Ling HC, Zaman FQ, Maziah M. 2014. Plant genetic transformation efficiency of selected malaysian rice based on selectable marker gene (hptII). Pak J Biol Sci. 17(4): 472-481. doi 10.3923/pjbs.2014.472.481. Kay R, Chan A, Mark D, McPherson JM. 1987. Duplication of CaMV 35S
promoter sequences creates a strong enhancer for plant genes. Science. 236(4806): 1299-1302. doi 10.1126_science.236.4806.1299.
Krizkova L, Hrouda M. 1998. Direct repeats of T-DNA integrated in tobacco chromosome characterization of junction regions. Plant J. 16(6): 673-680. doi 1046/j.1365-313x.1998.00330.x.
Manurung SO, Ismunadji M. 1988. Morfologi dan fisiologi padi. Di dalam: Ismunadji M, Soetjipto P, Mahyuddin S, Adi W, editor. Padi. Bogor (ID): Badan Penelitian dan Pengembangan Tanaman Pangan. hlm. 55-102.
Miftahudin, Scoles GJ, Gustafson JP. 2004. Development of PCR-based co-dominant markers flanking the Alt3 gene in rye. Genome. 47:231–238. doi: 10.1139/G03-093.
Moldenhauer K, Slaton N. 2014. Rice growth and development [internet]. [diunduh 2014 15 Feb]. Tersedia pada www.antiessays.com/free-essays/412 872.html
Nester G, Wood D, Lu P. 2005. Global analysis of Agrobacterium-plant interaction. Di dalam: Tsuyumu S, Leach JE, Shiraishi T, Wolpert, editor. Genomic and Genetic Analysis of Plant Parasitism and Defence. Minnesota (USA): American Phytopathological Society. hlm 1-10.
Pambudi A. 2012. Transformasi genetik padi (Oryza sativa L.) dengan kandidat gen toleran aluminium [tesis]. Bogor (ID): Institut Pertanian Bogor.
Pardo JM, Malpartida F, Rico ML, Jimenes A. 1985. Biochemical basis of resistance to hygromycin B in Streptomyces hygroscopicus-the producing organism. J General Microbiol. 131(6): 1289-1298. doi 10.1099/00221287-131-6-1289.
Prayitno E, Nuryandani E. 2011. Optimization of DNA extraction of physic nut (Jatropha curcas) by selecting the appropriate leaf. Nusantara Biosci. 3(1): 1-6.
Rahayu AY, Harjoso T. 2010. Karakter agronomis dan fisiologis padi gogo yang ditanam pada media tanah bersekam pada kondisi air di bawah kapasitas lapang. Akta Agrosia. 13(1): 40-49.
17 berdasarkan Random Amplified Polymorphic DNA (RAPD). J Natur Indones. 14(2): 138-142.
Roslim DI, Miftahudin, Suharsono U, Aswidinnoor H, Hartana A. 2010. Karakter root re-growth sebagai parameter toleransi aluminium pada tanaman padi. Natur Indones. 13(1): 82-88.
Roslim DI. 2011. Isolasi dan karakterisasi gen toleran aluminium pada padi [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Salisbury FB, Ross CW. 1995. Fisiologi Tumbuhan Ed ke-2. Lukman DR, Sumaryono, penerjemah. Bandung (ID): ITB Press. Terjemahan dari: Plant Physiology.
Supartana P, Shimizu T, Shioiri H, Nogawa M, Nozue M, Kojima M. 2005. Development of simple and efficient in-planta transformation method for rice (Oryza sativa L.) using Agrobacterium tumefacient. J Biosci Bioeng. 100(4): 391-397. doi 10.1263/jbb.100.391.
Suprihatno B, Daradjat AA, Satoto, Baehaki SE, Widiarta IN, Setyono A, Indrasari SD, Lesmana OS, Sembiring H. 2009. Deskripsi Varietas Padi. Subang (ID): Balai Besar Penelitian Tanaman Padi.
Windels P, Buck SD, Depicker A. 2008. Agrobacterium tumefacient-mediated transformation: patterns of T-DNA integration into the host genome. Di dalam: Tzafira T, Citovsky V, editor. Agrobacterium from Biology to Biotechnology. New York (USA): Springer Science. hlm 441-481.
Yanagisawa S, Akiyama A, Kisaka H, Uchimiya H, Miwa T. 2004. Metabolic engineering with Doft1 transcription factor in plant: improved nitrogen assimilation and growth under low-nitrogen condition. PNAS. 101(20): 7833-7838. doi 10.1073/pnas.0402267101.
Zalacain M, Gonzales A, Guerrero MC, Mattaliano RJ, Malpartida F, Jimenez A. 1986. Nucleotide sequence of the hygromycin B phosphotransferase gene from Streptomyces hygroscopicus. Nucleic Acids Research. 14 (4): 1565-1581. doi 10.1093_nar_14.4.1565.
18
19
Lampiran 1 Peta linier daerah T-DNA pembawa gen B11 pada plasmid pGWB5-B11 (Roslim 2011).
Pita target (579 pb) Pita target (268 pb)
Keterangan:
: primer HPT-F : primer HPT-R
: primer 35S Nakajima-F : primer B11 check-R
20
Lampiran 2 Data hasil verifikasi sisipan gen hpt dan gen B11. Nomor Tanaman Uji sisipan promoter 35S
21 Lampiran 3 Hasil penyejajaran sekuen primer 35S Nakajima-F dengan sekuen target
promoter 35S CaMV dan gen B11.
Sekuen target (ukuran 268 pb):
5’GATGTGATATCTCCACTGACGTAAGGGATGACGCACAATCCCACTATCCTTCGCAAGA
GATGTGATATCTCCACTGACGTAAGGGATGACGCACAATCCCACTATCCTTCGCAAGA *************************GGATGACGCACAATCCCACTATCCTTCGCAAGA
CCCTTCCTCTATATAAGGAAGTTCATTTCATTTGGAGAGAACACGGGGGACTCTAATCAA ACAAGTTTGTACAAAAAAGCAGGCTCCATGGCGGCGGCGGCGGGTTGGCTCCGGCGAGCG
ACAAGTTTGTACAAAAAAGCAGGCTCCATGGCGGCGGCGATGTGATATCTCCACTGA-CG
ACAAGTTTGTACAAAAAAGCAGGCTCCATGGCGGCGGC**********************
GCAGCGGCGGCGGCGGCGCCTCGCCTGCCTTCAGGCCTTCCTATACTACCTACTCCCCCT
TAAGCGGCGGATGTGATATCTCCACTGACGTAAGGCCTTCCTATACTACCTACTCCCCCT
**********************************
CCAGCCCCTCTCACAGAGGCCCAATCGTTC’3
CCAGCCCCTCTCACAGAGGCCCAATCGTTC
CCAGCCCCTC********************
Keterangan:
5’GATGTGATATCTCCACTGACGTAAG’3 : Sekuen primer 35S Nakajima-F
5’TCACAGAGGCCCAATCGTTC’3 :Reverse complement dari sekuen primer B11 Check-R
GATGTGATATCTCCACTGACGTAAG : Situs penempelan spesifik primer 35S Nakajima-F (F)
GCGGCGGCGCCTCGCCTGCCTTCAG : Situs 1 penempelan tidak spesifik primer 35S Nakajima-F (F1)
GGCGGGTTGGCTCCGGCGAGCGGCAG : Situs 2 penempelan tidak spesifik primer 35S Nakajima-F (F2)
TCACAGAGGCCCAATCGTTC : Situs penempelan spesifik primer B11 Check-R (R)
Kombinasi hasil pita:
F dan R menghasilkan pita dengan ukuran 268 pb F1 dan R menghasilkan pita dengan ukuran 81 pb F2 dan R menghasilkan pita dengan ukuran 112 pb
1
268
182 188 212
22
Lampiran 4 Hasil penyejajaran sekuen primer HPT-F dan HPT-R dengan sekuen target gen hpt.
5’GATGTTGGCGACCTCGTATT’3 : Sekuen primer HPT-F
5’TATCCACGCCCTCCTACATC’3 : Reverse complement dari sekuen primer HPT-R
GATGTTGGCGACCTCGTATT : Situs penempelan spesifik primer HPT-F (F)
GGGATCAGCAATCGCGCAT : Situs 1 penempelan tidak spesifik primer HPT-F (F1)
23 CATCCATGGCCTCCGCGACC : Situs 1 penempelan tidak spesifik primer HPT-R (R1)
CACTGACGGTGTCGTCCATC : Situs 2 penempelan tidak spesifik primer HPT (R2)
TGTCAAGCACTTCCGGAATC : Situs 3 penempelan tidak spesifik primer HPT (R3)
Kombinasi hasil pita:
24
RIWAYAT HIDUP
Penulis dilahirkan di Batang tanggal 3 November 1991 dari pasangan Bapak Mukhari dan Ibu Susyanti. Penulis adalah anak pertama dari dua bersaudara. Penulis lulus dari SMA N 1 Subah pada tahun 2009 dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam IPB melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjadi mahasiswa IPB, penulis pernah menjadi anggota Divisi Advokasi dan Kesejahteraan Mahasiswa BEM FMIPA periode 2010-2011. Penulis pernah menjadi asisten praktikum mata kuliah Biologi Dasar, Genetika Dasar, Fisiologi Tumbuhan Dasar dan Botani Umum. Selain itu penulis pernah
menjadi peserta pada pelatihan dengan tema “Implementation IGN for TTR Biodivercity Curricula: Training of Trainers and Students Course of Module III
on Plants Population Genetics by Nuclear Microsatellite Analysis” pada tanggal
22-27 Juli 2013 di Universitas Brawijaya, Malang. Penulis melaksanakan kegiatan Studi Lapangan di Hutan Pendidikan Gunung Walat, Sukabumi dengan judul
“Keanekaragaman Tanaman Pekarangan di Desa-Desa sekitar Gunung Walat” sedangkan Kegiatan Praktik Lapangan dilakukan di Taman Safari Indonesia