PELAPISAN BENIH KELAPA SAWIT DENGAN
PENGAYAAN
Trichoderma asperellum
(T13) UNTUK
MENEKAN INFEKSI
Ganoderma boninense
Pat.
DI PRE NURSERI
GANI JAWAK
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pelapisan Benih Kelapa Sawit dengan Pengayaan Trichoderma asperellum (T13) untuk Menekan Infeksi Ganoderma boninense Pat. di Pre Nurseri adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
RINGKASAN
GANI JAWAK. Pelapisan Benih Kelapa Sawit dengan Pengayaan Trichoderma asperellum (T13) untuk Menekan Infeksi Ganoderma boninense Pat. di Pre Nurseri. Dibimbing oleh ENY WIDAJATI, ENDAH RETNO PALUPI dan NURITA TORUAN-MATHIUS.
Trichoderma asperellum merupakan cendawan yang bersifat antagonis terhadap Ganoderma boninense penyebab penyakit busuk pangkal batang pada kelapa sawit. Tujuan penelitian ini adalah mendapatkan jenis dan formula bahan pelapis terbaik yang kompatibel untuk perkembangan T. asperellum (T13) serta dapat menekan serangan G. boninense pada bibit kelapa sawit.. Penelitian terdiri atas dua percobaan, yaitu: 1) viabilitas dan efektivitas T. asperellum dengan berbagai bahan pelapis dan (2) uji efektitivitas formula bahan pelapis dengan T. asperellum untuk menekan infeksi G. boninense di pre nurseri.
Percobaan I terdiri dari dua percobaan, yaitu: Ia) Viabilitas dan efektivitas T. asperellum dengan berbagai bahan pelapis melalui teknik pencampuran dengan bahan pelapis dan Ib) Viabilitas dan efektivitas T. asperellum dengan berbagai bahan pelapis melalui teknik pelapisan benih diawali dengan perendaman T. asperellum. Percobaan Ia dirancang secara acak kelompok (RAK) yang terdiri atas sembilan perlakuan, yaitu: pelapisan dengan talk 1%, CMC 1%, tapioka 5%, Arabic gum 25%, Na. alginat 8.3%, Arabic gum 3% + gipsum 1%, CMC 1.5% + gipsum 1%, CMC 1.5% + talk 1%, kontrol (tanpa pelapisan dan tanpa T. asperellum). Hasil percobaan menunjukkan bahwa pada 13 minggu setelah tanam (MST) tidak ada T. asperellum yang masuk ke dalam jaringan akar. Pelapisan dengan Arabic gum 25%, CMC 1% dan Arabic gum 3% + gipsum 1% menghasilkan bobot kering tertinggi dibandingkan dengan bahan pelapisan lainnya dengan nilai berturut-turut 10.95 g, 11.89 g dan 11.97 g.
Percobaan 1b dirancang dengan rancangan tersarang dua faktor yaitu perlakuan pelapisan dan periode simpan. Pada percobaan ini, tiga bahan pelapis terbaik dari percobaan Ia diformulasikan menjadi 11 perlakuan, yaitu; tanpa perendaman T. asperellum + tanpa pelapisan, perendaman dengan T. asperellum + tanpa pelapisan, perlakuan selanjutnya adalah perendaman + pelapisan dengan Arabic gum 10%, + Arabic gum 25%, + Arabic gum 40%, + CMC 0.5%, + CMC 1%, + CMC 1.5%, + Arabic gum 1.5% + gipsum 0.5% , + Arabic gum 3% + gipsum 1%, dan + Arabic gum 4.5% + gipsum 1.5%. Semua perlakuan disimpan dengan periode 0, 3, 6, 9 dan 12 hari setelah pelapisan.
pelapisan dengan CMC 1%, CMC 1.5% dan Arabic gum 4.5% + gipsum 1.5% selanjutnya digunakan pada percobaan II berdasarkan panjang akar dan tinggi tajuk serta sifat fisik dan kimia bahan pelapis.
Percobaan II dirancang dengan RAK. Perlakuan terdiri atas: benih tanpa pelapisan dan tanpa perendaman T. asperellum, pelapisan CMC 1%, CMC 1.5%, Arabic gum 4.5% + gipsum 1.5%, perendaman T. asperellum, perendaman + CMC 1%, perendaman + CMC 1.5%, perendaman + Arabic gum 4.5% + gipsum 1.5%, dan tanpa pelapisan + tanpa perendaman. Media tanam yang digunakan diinokulasi dengan G. boninense kecuali pada perlakuan tanpa pelapisan dan tanpa perendaman. Hasil percobaan menunjukkan bahwa perlakuan perendaman + pelapisan CMC 1.5% dan Arabic gum 4.5% + gipsum 1.5% dapat meningkatkan daya tumbuh 16.67% namun belum efektif menurunkan infeksi serangan G. boninense di pre nurseri dengan insidensi penyakit yang masih tinggi (≥ 93.33 %) dan tingkat keparahan penyakit masing masing 84.17% dan 90%.
SUMMARY
Trichoderma asperellum is an antagonistic fungus towards Ganodema boninense which causes basal stem rot disease on palm oil. The aims of this study were to obtain the best coating formula compatible to T. asperellum (T13) and inhibited the infection of G. boninense on oil palm seedlings. The research consisted of two experiments, i.e. the viability and effectiveness of T. asperellum to various coating materials and evaluate effectiveness of coating material formulas with T. asperellum to suppress G. boninense infection in pre nursery.
First experiment consisted of two trials, the viability and effectiveness of T. asperellum to various coating materials through mixing technique with coating material and through soaking techniques followed by coating the seed. First trial designed in randomized block design (RBD) consisted of nine treatments, i.e; coating with talc 1%, CMC 1%, tapioca 5%, Arabic gum 25%, Na. alginate 8.3%, Arabic gum 3% + gypsum 1%, CMC 1.5% + gypsum 1%, CMC 1.5% + talc 1%, control (without coating and T. asperellum). The result showed that there was no T. asperellum which get in to the root tissue on 13 weeks after planting (MST). Coating with Arabic gum 25 %, CMC 1 % and Arabic gum 3 % + gypsum 1 % produced the highest dry weight compared to other coating materials, respectively 10.95 g , 11.89 g and 11.97 g.
The second experiment was arranged in RBD. The treatment consisted of; seeds without coating and without soaking T. asperellum, coating CMC 1%, CMC 1.5%, Arabic gum 4.5% + gypsum 1.5%, soaking T. asperellum, soaking + CMC 1%, soaking + CMC 1.5%, soaking + Arabic gum 4.5 % + 1.5% gypsum, and without coating + without soaking. Planting medium was inoculated with G. boninense except on treatment without coating and soaking. The results showed that soaking treatment + coating CMC 1.5% and Arabic gum 4.5% + gypsum 1.5% enhanced the germination 16.67% but ineffective in decreasing the infection of G. boninense in pre nursery with disease of incidence still high (≥ 93.33%) and disease severity, respectively 84.17% and 90%.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
PELAPISAN BENIH KELAPA SAWIT DENGAN
PENGAYAAN
Trichoderma asperellum
(T13) UNTUK
MENEKAN INFEKSI
Ganoderma boninense
Pat.
DI PRE NURSERI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu dan Teknologi Benih
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Pelapisan benih kelapa sawit dengan pengayaan Trichoderma asperellum (T13) untuk menekan infeksi Ganoderma boninense Pat. di pre nurseri
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang telah dilaksanakan pada bulan Juli 2014 - Agustus 2015 ini berjudul “Pelapisan Benih Kelapa Sawit dengan Pengayaan Trichoderma asperellum (T13) untuk Menekan Infeksi Ganoderma boninense Pat. di Pre Nurseri”. Tesis ini dibuat sebagai salah satu syarat untuk menyelesaikan studi di Program Studi Ilmu dan Teknologi Benih, Sekolah Pascasarjana IPB.
Terima kasih penulis ucapkan kepada Dr Ir Eny Widajati, MS, Dr Ir Endah Retno Palupi, MSc dan Dr Nurita Toruan-Mathius, MS selaku komisi pembimbing atas bimbingan, saran, dan waktu yang telah dicurahkan dalam penyelesaian tesis ini. Terimakasih kepada Dr Ir Giyanto, MSi selaku penguji luar komisi atas saran dan masukannya dalam penyempurnaan tulisan ini. Terimakasih kepada Dr Ir M. Rahmat Suhartanto, MS selaku perwakilan Program Studi Ilmu dan Teknologi Benih dalam ujian tesis. Penulis juga mengucapkan terimakasih kepada PT SMART Tbk. atas dana dan fasilitas penelitian yang telah disediakan. Terimakasih kepada seluruh staf dan teknisi Laboratorium Microbiome Technology, dan Plant Production and Biotechnology PT SMART Tbk. atas bantuan dan kerjasamanya selama penelitian. Ucapan terima kasih juga penulis sampaikan kepada kedua orang tua penulis Bapak MS Jawak dan Ibu M br Sipayung serta Kakak dan Adikku atas dukungan dan doa yang diberikan. Terimakasih kepada teman-teman mahasiswa Program Studi Ilmu dan Teknologi Benih angkatan 2012, 2013 dan 2014 atas bantuan, dorongan dan semangat yang telah diberikan. Semoga tesis ini bermanfaat bagi masyarakat dan perkembangan ilmu pengetahuan.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
2 TINJAUAN PUSTAKA 2
Kelapa Sawit 2
Trichoderma spp. 3
Ganoderma spp. 4
Pelapisan Benih 5
Bahan Pelapis Benih 7
3 BAHAN DAN METODE 11
Tempat dan Waktu Penelitian 11
Sumber Bahan 11
Percobaan I. Viabilitas dan Efektivitas T. asperellum dengan Berbagai
Bahan Pelapis 11
Percobaan II. Uji Efektivitas Formula Bahan Pelapis dengan T. asperellum untuk Menekan Infeksi G. boninense di
Pre Nurseri 13
Penyiapan Cendawan T. asperellum dan G. boninense 14
Pelapisan Benih 15
Penanaman dan Pemeliharaan 15
Isolasi Trichoderma sp. dari Sampel Akar Tanaman 16
Analisis Data 16
4 HASIL DAN PEMBAHASAN 16
Percobaan I. Viabilitas dan Efektivitas T. asperellum dengan Berbagai
Bahan Pelapis 16
Percobaan II. Uji Efektivitas Formula Bahan Pelapis dengan T. asperellum untuk Menekan Infeksi G. boninense di
Pre Nurseri 22
5 KESIMPULAN 23
Kesimpulan 23
6 DAFTAR PUSTAKA 24
LAMPIRAN 29
DAFTAR TABEL
1 Pemupukan bibit kelapa sawit di pre nurseri 15
2 Pengaruh pencampuran T. asperellum dengan bahan pelapis terhadap
vigor bibit kelapa sawit pada 13 MST 17
3 Pengaruh pencampuran T. asperellum dengan bahan pelapis terhadap pertambahan tinggi bibit kelapa sawit pada 2-12 MST 18 4 Pengaruh periode simpan dan perendaman + pelapisan terhadap vigor
bibit kelapa sawit dan jumlah koloni T. asperellum (colony form unit)
dalam akar tanaman pada 12 MST 19
5 Pengaruh periode simpan dan perendaman + pelapisan benih terhadap pertambahan tinggi bibit kelapa sawit pada 2-12 MST 21 6 Pengaruh perendaman T. asperellum + pelapisan benih terhadap bibit
kelapa sawit pada media tanam yang diinokulasi Ganoderma pada 12
MST 22
DAFTAR GAMBAR
1 Buah kelapa sawit dan bagian-bagiannya 3
2 Tubuh buah G. boninense pada batang tanaman kelapa sawit yang
terserang penyakit busuk pangkal batang 5
3 Koloni T. asperellum hasil pour plate sampel akar 20 4 Morfologi kecambah setelah pelapisan dan penyimpanan 12 hari 21
5 Infeksi Ganoderma pada kelapa sawit 23
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Kelapa sawit (Elaeis quinensis Jacq.) merupakan sumber penghasil minyak makanan, minyak industri, maupun bahan bakar nabati (biodiesel) (BBPPTP 2008). Pada tahun 2008 produksi minyak sawit Indonesia adalah 17 539 788 ton dan meningkat menjadi 24 431 640 ton pada tahun 2013 (Ditjenbun 2014). Peningkatan produksi ini selain dikarenakan semakin luasnya areal produksi juga tingginya rendemen yang dihasilkan oleh kelapa sawit (21% atau 6-8 ton minyak per hektar) jika dibandingkan dengan minyak nabati lainnya yang kurang dari 2.5 ton minyak per hektar (Sunarko 2009). Hal ini menjadikan tanaman kelapa sawit menjadi salah satu komoditas perkebunan yang sangat diminati oleh petani.
Salah satu masalah yang dihadapi untuk keberlanjutan produksi tanaman kelapa sawit di Asia Tenggara termasuk Indonesia adalah penyakit busuk
pangkal batang (BPB) yang disebabkan oleh cendawan G. boninense.
G. boninense merupakan patogen tular tanah yang keberadaannya dipengaruhi oleh berbagai faktor yang sangat kompleks dan bersifat sistemik.
Ganoderma secara eksklusif dapat mendegradasi lignin menjadi air, CO2, dan selulosa sehingga tersedia sebagai nutrisi bagi jamur tersebut (Paterson 2007). Menurut Goh et al. (2014) G. boninense memproduksi enzim ligninolitik atau lignin peroxidase, manganase peroxidase dan lakkase untuk mendegradasi komposisi lignin pada dinding sel tanaman. Ommelna et al. (2012) menyatakan bahwa Indonesia dan Malaysia mengalami kerugian hingga US$ 500 juta per tahun akibat penyakit BPB.
Trichoderma spp. merupakan fungi indigenous yang berpotensi sebagai biokontrol dalam menekan pertumbuhan Ganoderma penyebab penyakit BPB. Menurut Wicaksono dan Situmorang (2010a) T. asperellum mampu mengkolonisasi akar (rizosfer) dan membentuk hubungan endofitik dengan akar tanaman kelapa sawit. Chantrapromma et al. (2014) dan Geraldine et al. (2013) menyatakan bahwa T. asperellum menghasilkan antibiotik trichodermaerin dan beberapa enzim yang mampu melisis dinding sel fungi seperti lipase, NAGase, B-1.3-glukanase, B-glukosidase, dan protease.
Naher et al. (2014) menyatakan bahwa T. asperellum dapat merangsang ketahanan tanaman terhadap penyakit melalui mekanisme mikoparasit dimana hifa Trichoderma akan melilit cendawan patogen tanaman dengan membentuk struktur seperti appresoria. Nur Ain Izzati dan Abdullah (2008) dan Naher et al. (2012) menyatakan bahwa T. harzianumdapat meningkatkan resistensi tanaman terhadap penyakit BPB dan meningkatkan pertumbuhan bibit kelapa sawit.
2
nilai tambah terhadap benih, dan memudahkan pemberian mikroba antagonis yang menekan perkembangan Ganoderma pada daerah akar. Mukhtar et al. (2012); Islam et al. (2011); Asaduzzaman et al. (2010) menyatakan bahwa benih yang dilapisi dengan tapioka 2% + T. harzianum dapat meningkatkan nilai indeks vigor dan daya berkecambah benih.
Tujuan
Tujuan penelitian ini adalah:
1. Mendapatkan formula bahan pelapis terbaik yang kompatibel untuk perkembangan T. asperellum (T13)
2. Mendapatkan formula bahan pelapis terbaik sebagai bahan pembawa T. asperellum (T13) untuk menekan infeksi G. boninense.
2
TINJAUAN PUSTAKA
Kelapa Sawit
Kelapa sawit (Elaeis guineensis Jacq.), berasal dari pantai Guinea Afrika Barat, yang ditemukan oleh Nicolaus Josef von Jacquin, orang yang memberi nama kelapa sawit secara botani (Hartley 1977; Corley dan Tinker 2003). Kelapa sawit memiliki genom diploid dengan 16 pasang kromosom homolog (2n = 32). Kelapa sawit merupakan tanaman monokotil yang berakar serabut dimana sebagian besar akarnya berada dekat permukaan tanah dengan kedalaman 15-30 cm. Batang tanaman ini tegak tidak bercabang, diameter 40-75 cm, tinggi batang dalam pembudidayaan tidak lebih dari 15-18 m. Daunnya merupakan daun majemuk dengan pelepah daun tersusun melingkari batang berbentuk spiral. Panjang pelepah daun bisa mencapai ± 9 m dan panjang helai daun ± 1.2 m dengan jumlah 100-160 pasang (Hartley 1977; Corley dan Tinker 2003).
Kelapa sawit adalah tipe tanaman monoecious, dalam hal mana bunga jantan dan betina ada pada satu tanaman, tetapi pada tandan yang berbeda. Rasio bunga jantan terhadap betina selain dipengaruhi secara genetik juga dapat dipengaruhi keadaan iklim. Pada setiap ketiak pelepah daun kelapa sawit hanya tumbuh satu tandan bunga, dapat berupa bunga jantan maupun bunga betina.
3 Berdasarkan ketebalan cangkangnya kelapa sawit dibedakan menjadi Dura, Pisifera, dan Tenera (BBPPTP 2008). Dura memiliki buah yang bercangkang tebal, tandan buah besar dan kandungan minyak berkisar 18%. Pisifera buahnya bercangkang tipis dan bunga betinanya steril sehingga sangat jarang menghasilkan buah. Tenera adalah persilangan antara induk Dura dan Pisifera. Tenera dianggap bibit unggul karena memiliki cangkang buah yang tipis dan bunga betinanya fertil. Tenera memiliki persentase daging per buah mencapai 90% dan kandungan minyak pertandannya dapat mencapai 28%.
Menurut BBPPTP (2008) pengecambahan benih kelapa sawit membutuhkan waktu yang panjang. Buah yang telah masak dikupas dengan mesin pengupas untuk memperoleh benih yang terlepas dari sabutnya. Benih kemudian direndam dalam air bersih selama 5 hari dan setiap hari harus diganti dengan air yang baru. Benih diangkat dan dikering-anginkan di tempat teduh selama 24 jam. Kadar air dalam benih harus dipertahankan 17%. Pematahan dormansi benih dilakukan dengan memasukkan benih ke dalam kantong plastik polietilen dan ditutup rapat dengan merekat ujungnya. Kantong plastik kemudian dimasukkan dalam peti berukuran 30 cm x 20 cm x 10 cm dan diletakkan dalam hot room dengan suhu 39 0C selama 80 hari. Benih diperiksa 3 hari sekali (2 kali per minggu) dengan membuka kantong plastiknya dan disemprot dengan air agar kelembaban terjaga. Bila telah ada benih yang berkecambah, segera semaikan pada pesemaian perkecambahan. Setelah pematahan dormansi, kantong dikeluarkan dari peti dan diletakkan di tempat yang dingin. Kandungan air harus diusahakan tetap seperti semula. Setelah 15-20 hari benih berkecambah dan siap dipindahkan ke pre nurseri. Benih yang tidak berkecambah dalam waktu tersebut di atas sebaiknya tidak digunakan untuk bibit.
Tricoderma spp.
Berdasarkan cara reproduksi dan struktur tubuhnya T. asperellum termasuk dalam kingdom fungi divisi Deuteromycetes dengan konidiofor tegak tidak menyolok mata dan kecil, bentuknya globus, subglobus dan sedikit kerucut, bercabang banyak dan teratur (berpasangan), dan dapat membentuk klamidospora (Samuels et al. 1999). Pada umumnya koloni dalam biakan tumbuh dengan cepat, berwarna putih sampai hijau gelap.
4
T. asperellum terdapat secara alami dalam tanah pertanian, hutan atau kebun. T. asperellum melimpah di rizosfer dan bersifat saprotrof (memanfaatkan sisa jasad renik untuk pertumbuhannya) sehingga secara ekologis mampu berkompetisi dengan cendawan lain dan mampu mengkolonisasi berbagai substrat yang ada di sekitar tanaman (EFSA 2013). T. asperellum mampu berkembang secara endofit dalam jaringan akar sehingga dapat dikembangkan sebagai agensia pengendali hayati cendawan patogen tular tanah (Bayley et al. 2008). T. asperellum menghasilkan tiga tipe propagul yang dapat digunakan sebagai bahan formula, yaitu hifa, klamidiospora dan konidia. T. asperellum mempunyai daya antagonis yang tinggi dan dapat menghasilkan racun (trichotoxin), sehingga dapat menghambat dan mematikan cendawan patogen (Chutrakul et al. 2005).
T. asperellum dapat tumbuh pada pH antara 5.5-7.5 ºC (Singh et al. 2014). Singh et al. (2014) dan Watanabe et al. (2005) menyatakan bahwa suhu optimum untuk pertumbuhan T. asperellum adalah 25-30 °C, dengan suhu maksimum 35 °C. Konidia Trichoderma spp. optimum pada kelembaban 30% di dalam tanah.
Galur-galur Trichoderma memproduksi senyawa metabolit sekunder yang bersifat antibakteri, antinematoda, antifungi, dan antikhamir. T. asperellum menghasilkan antibiotik trichodermaerin dan beberapa enzim yang mampu melisis dinding sel seperti lipase, NAGase, B-1.3-glukanase, B-glukosidase, dan
protease (Chantrapromma et al. 2014; Geraldine et al. 2013). Selain itu T. asperellum dapat merangsang ketahanan, pertumbuhan dan perkembangan
tanaman yang mengakibatkan peningkatan produksi tanaman (Naher et al. 2014). Antibiotik dan antifungi yang telah diisolasi dari Trichoderma antara lain peptaibol (Chutrakul et al. 2005), azafilon dan harzionolide (Vinale et al. 2006)
Pengendalian penyakit yang disebabkan cendawan patogen dengan menggunakan cendawan Trichoderma sp. selain dapat menekan pertumbuhan penyakit, juga dapat mempengaruhi keragaman serta kepadatan populasi cendawan tanah. Mekanisme pengendalian oleh Trichoderma sp., yaitu dengan cara membelit atau tumbuh disepanjang hifa inang dan membentuk sruktur semacam kait yang membentuk penetrasi ke dalam dinding sel inang (Chet et al. 2006).
Ganoderma spp.
Cendawan Ganoderma spp. merupakan anggota Basidiomycetes yang merupakan penyebab penyakit BPB yang umum menyerang akar dengan kisaran inang yang cukup luas. Menurut Idris et al. (2000) jenis Ganoderma yang umum
menyerang tanaman kelapa sawit adalah G. boninense, G. zonatum, G. moniatocinctum dan G. tomatum. Baby et al. (2015) menyatakan bahwa
cendawan Ganoderma yang ada di alam yang sudah terindentifikasi berjumlah 428 spesies.
5 Ho dan Nawawi (1985) dan Treu (1998) melaporkan ciri-ciri umum Ganoderma sp., yaitu memiliki sebuah lapisan himenium yang terdiri atas struktur yang disebut basidium (suatu sel berbentuk tabung atau seperti pemukul bola yang mempunyai empat buah basidiospora di bagian luarnya). Himenium yang dimiliki dapat menutupi permukaan, berpori, tubuh buah berkayu, keras dan ulet, serta mempunyai lapisan-lapisan membran, permukaan atas tubuh buah (konus) rata dan halus, dan spora pipih di bagian bawahnya. Ganoderma sp. dapat tumbuh baik pada medium dengan pH 6.0-7.0, mampu bertahan lebih lama pada akar tanaman dan tonggak-tonggak kayu di dalam tanah dibandingkan dengan cendawan patogen lainnya.
Gejala serangan Ganoderma sp. tingkat ringan pada tanaman secara umum adalah tanaman layu, tidak berkembang, dan kehilangan helai daun. Pada serangan tingkat lanjut, penyakit dapat diidentifikasi dengan kemunculan tubuh buah. Tubuh buah ini keras dan berkayu dengan ukuran yang cukup besar (Gambar 2). Ukuran tubuh buah dapat mencapai diameter ± 15 cm dan ketebalan ± 5 cm. Warna tubuh buah dari coklat muda hingga coklat tua dan bahkan jingga. Bagian atas tubuh buah dapat agak mengkilat dengan bagian bawah berwarna putih (Henessy dan Daly 2007).
Ganoderma sp. menginfeksi akar tanaman terjadi karena kontak antara akar yang sehat dengan akar yang sakit (Cooper et al. 2011). Cendawan ini akan membentuk rizomorf, namun rizomorfnya tidak dapat bergerak bebas dalam tanah terlepas dari alas nutrisi. Spora Ganoderma sp. tidak dapat menginfeksi tanaman yang sehat, tetapi dapat menginfeksi tunggul-tunggul yang segar dari tanaman yang rentan dan menjadi sumber infeksi baru. Kelapa sawit dapat terinfeksi dari tunggul dan sisa-sisa akar pohon atau pohon-pohon yang tua.
Gambar 2 Tubuh buah G. boninense pada batang tanaman yang terserang penyakit busuk pangkal batang ( ). Sumber: Rakib et al. (2014)
Pelapisan Benih
6
Pelapisan benih bertujuan untuk merubah bentuk, ukuran dan berat benih sehingga mudah dalam penanaman menggunakan mesin dan memperbaiki perkecambahan. Pelapisan benih meningkatkan bobot benih dengan faktor 0.1-2.0 kali lipat dari bobot awal tanpa perlakuan pelapisan (Ilyas 2012). Perlakuan pelapisan juga dapat melindungi benih dari serangan hama dilapangan (Defang at al. 2012).
Copeland dan McDonald (2001) dan Kuswanto (2003) menyatakan bahwa bahan pelapis yang tepat digunakan melapisi benih memiliki persyaratan antara lain: (1) dapat mempertahankan kadar air benih selama penyimpanan, (2) dapat menghambat laju respirasi seminimal mungkin, (3) tidak bersifat toksik terhadap benih, (4) bersifat mudah pecah dan larut apabila terkena air sehingga tidak menghambat proses imbibisi untuk perkecambahan, (5) bersifat porous sehingga benih masih dapat memperoleh oksigen untuk proses respirasi, dan (6) tidak mudah mencair.
Hasil penelitian menunjukkan bahwa pelapisan benih bermanfaat dalam memperbaiki mutu benih. Avelar et al. (2012) menyatakan bahwa perlakuan benih dengan polimer pada jagung dapat memperbaiki kemampuan tumbuh tanaman, mengurangi persentase ketidakseragaman benih, meminimalkan pencucian insektisida dari benih yang diberi perlakuan insektisida dan efisiensi perlakuan berbeda-beda berkaitan dengan dosis polimer yang digunakan. Bailey et al. (2009 ) menyatakan bahwa T. ovalisporum-DIS 70a, T. hamatum-DIS 219b, T. koningiopsis-DIS 172ai dan T. harzianum-DIS 219f yang diaplikasikan pada tanaman kakao mampu mengkolonisasi jaringan tanaman dan bersimbiosis dengan tanaman, membentuk hubungan endofitik, dan meningkatkan pertumbuhan tanaman.
Thobunluepop (2009) menyatakan bahwa pelapisan benih padi dengan eugenol sangat efektif untuk menghambat cendawan terbawa benih dan dapat digunakan sebagai alternatif pengganti untuk bahan kimia sintetik untuk perlakuan benih. Pelapisan dengan eugenol yang digabung dengan polimer kitosan lignosulfate adalah antifungi potensial untuk melawan aktivitas cendawan terbawa benih seperti F. manilforme, A. solani, B. oryzae, R. solani, Curvularia sp., A. flavus dan A. niger. Perlakuan pelapisan benih padi dengan eugenol dan kitosan lignosulfate dapat menghambat pertumbuhan B. oryzae sampai dengan 11 bulan penyimpanan.
7
Bahan Pelapis Benih
Beberapa bahan pelapis benih yang sudah banyak digunakan secara luas diantaranya tapioka, natrium alginat, Arabic gum, talk, gipsum, dan Carboximethilcellulose (CMC).
Tapioka
Tapioka terbuat dari ubi kayu yang banyak digunakan dalam berbagai industri sebagai bahan pengental, bahan pengisi dan bahan pengikat. Tapioka adalah pati yang dihasilkan dari hasil ekstraksi singkong yang telah mengalami pencucian dan pengeringan. Pati tapioka umumnya berwarna putih dan mempunyai sifat yang menguntungkan dalam pengolahan pangan seperti; kandungan kotoran dan airnya rendah, kemurnian larutan yang tinggi, kekuatan gel yang baik, dan daya rekat tinggi sehingga banyak digunakan sebagai bahan perekat.
Raharjo (1997) menyatakan bahwa komposisi pati yang tinggi memungkinkan pati digunakan sebagai sumber karbohidrat. Kadar amilosa tepung tapioka yang tinggi (sekitar 23%) menjadi alasan yang kuat tapioka digunakan sebagai bahan pengikat dimana amilosa berperan besar dalam gelatinisasi.
Komposisi kimia pati tapioka (per 100 g bahan) adalah energi 307 kalori, kadar air 9.1%, karbohidrat 88.2%, protein 1.1%, lemak 0.5%, fosfor 125 mg, kalsium 84 mg, dan besi 1 mg (Yengkokpam et al. 2007). Tapioka merupakan bahan yang sering digunakan sebagai perekat karena mudah diperoleh dan harganya relatif murah. Kelemahan penggunaan tapioka sebagai perekat, yaitu akan sedikit berpengaruh pada penurunan nilai kalori produk dibandingkan dengan bahan bakunya. Selain itu, produk yang dihasilkan tidak tahan terhadap kelembaban. Hal ini disebabkan tapioka memiliki sifat dapat menyerap air dari udara. Penambahan optimal perekat sebaiknya tidak lebih dari 5% (Sudrajat dan Soleh 1994).
Fleche (1985) menyatakan bahwa granula pati tidak larut dalam air di bawah 50 0C, dan apabila suspensi pati dipanaskan di bawah suhu kritis maka granula akan menyerap air dan mengembang membentuk pasta kental. Kemampuan pati menghasilkan pasta kental ketika dipanaskan dalam air, yang disebut dengan sifat hidrokoloid, membuatnya sesuai untuk berbagai aplikasi seperti pada pembuatan makanan, kertas, tekstil, perekat, dan obat-obatan.
8
Gipsum
Gipsum adalah suatu mineral alam yang ditambang pertama kalinya pada tahun 1770 di daerah Montmart (bagian dari Paris), oleh karena itu gipsum dinamakan juga plaster of Paris. Bentuk murni gipsum adalah berupa kristal dan berwarna putih (Soempeno 1984).
Menurut Memed et al. (1992), gipsum memiliki sifat mudah mengikat dan melepas air. Gipsum terdiri atas dua molekul hidrat dengan rumus kimia CaSO4.2H2O. Gipsum dalam bentuk murni berupa kristal berwarna putih. Dalam penggunaannya gipsum dapat digolongkan menjadi dua macam, yaitu: (1) gipsum yang belum mengalami proses kalsinasi, yaitu gipsum yang dipergunakan dalam pembuatan semen Portland dan sebagai pupuk dan (2) gipsum yang mengalami proses kalsinasi, yaitu gipsum yang digunakan sebagai bahan bangunan, plaster of Paris, bahan dasar untuk pembuatan kapur, cetakan alat keramik dan tuangan logam.
Gipsum yang dikenal dalam perdagangan adalah gips yang telah mengalami pemanasan yang menghasilkan hemyhidrat atau lebih dikenal dengan rumus CaSO4.1/2H2O. Gipsum berfungsi sebagai sumber mineral dan sebagai lapisan pelindung. Gipsum mempunyai waktu pengerasan yang relatif pendek, yaitu sekitar 10 menit, tergantung pada kandungan bahan dan airnya (Purwadi 1993). Gipsum sebagai perekat mineral mempunyai sifat yang lebih baik dibandingkan dengan perekat organik lainnya karena tidak menimbulkan pencemaran udara, murah, tahan api, tahan deteriorasi oleh faktor biologis dan tahan terhadap zat kimia (Purwadi 1993).
Arabic gum
Arabic gum berasal dari getah atau eksudat yang dihasilkan oleh pohon akasia (Acacia sp.) sebagai respon tanaman karena adanya pelukaan yang disebut dengan gummosis (Chaplin 2008). Gum dapat berupa gum alamiah, gum termodifikasi dan gum sintetik. Beberapa negara produsen Arabic gum antara lain: Chad, Eritrea, Kenya, Mali, Mauritania, Niger, Nigeria, Senegal, dan Sudan. Di Afrika, penggunaan Arabic gum telah dikenal sejak zaman dahulu sebagai campuran bahan dalam pembuatan tinta maupun untuk pengawetan mayat (mumifikasi). Pada era abat 21, penggunaan Arabic gum sudah semakin luas antara lain digunakan sebagai bahan perekat, bahan industri pangan (minuman ringan, sirup, permen karet), kosmetik, bahan emulsi, pelapis, percetakan dan industri tekstil (Ali et al. 2009).
Arabic gum tersusun atas monosakarida (D-galaktosa dan D-glucoronic acid) dan polisakarida. Polimer penyusun Arabic gum antara lain Beta-D-galactose, L-arabinose, D-gluconic acid, L-rhamnose, dan 4-O-methyl-D-glucoronic acid. Arabic gum mengandung ion kalsium, magnesium, dan kalium. Struktur utama molekulnya adalah 1,3 galaktopiranosa dengan rantai cabang 1,6 galaktopiranosa (Krishnan et al. 2005). Arabic gum dapat larut dalam air dingin (kelarutan lebih dari 50%), viskositas relatif rendah pada konsentrasi tinggi, dan pH berkisar antara 4.0–4.8.
9 cabai adalah 0.05 g mL-1. Pada konsentrasi tersebut nilai daya berkecambah dan potensi tumbuh maksimum masing-masing sebesar 95% dan 98.5%.
Sari (2009) menemukan bahwa penggunaan perekat Arabic gum lebih baik dari pada Na. alginat, yang ditandai dengan rata-rata indeks vigor dan viabilitas benih kacang panjang yang masih tinggi di periode penyimpanan 12 minggu. Namun hasil yang berbeda ditunjukkan oleh Yuningsih (2009), dalam hal pelapisan benih dengan bahan perekat Arabic gum dan isolat Methylobacterium spp. belum menunjukkan pengaruh yang nyata terhadap vigor benih buncis selama periode penyimpanan 20 minggu.
Natrium alginat
Natrium alginat merupakan salah satu bahan kimia yang banyak digunakan sebagai bahan baku makanan, minuman, obat-obatan, kosmetik, kertas, detergen, cat, tekstil, vernis, fotografi, kulit buatan dan lain-lain. Pada skala perdagangan natrium alginat merupakan salah satu komoditas ekonomi yang sedang meningkat permintaannya dari tahun ke tahun (Prasetya 2009).
Alginat adalah suatu polisakarida murni dari asam uronat yang tersusun dalam bentuk asam alginat rantai linier panjang. Polimer murni ini tidak bercabang dan mengandung ikatan 1,4 β asam D-manuronat dan ikatan 1,4 α asam-L-guluronat. Senyawa polimer ini dalam dunia industri dikenal sebagai bahan yang memiliki manfaat cukup penting, diantaranya dapat digunakan dalam industri farmasi, makanan, kosmetik, tekstil dan pertanian maupun untuk kesehatan.
Alginat digunakan sebagai biokatalis pada beberapa proses industri diantaranya produksi etanol oleh ragi, produksi antibodi monoklonal dari sel hybridoma, penstimulus imunitas sel untuk mensekresi sitokinin seperti faktor α nekrosis tumor (TNF-α), interleukin-1 (IL-1) dan interleukin-6 (Nurosid 2008). Industri tekstil dan kertas menggunakan alginat untuk pengembang pada permukaan kertas dan pakaian. Alginat dalam industri makanan dimanfaatkan sebagai pengental, misalnya pada es krim, puding, bir, pengembang foam dan minuman rasa buah. Alginat dalam bidang farmasi dimanfatkan sebagai pengemulsi, pemadat dan pembungkus kapsul (Nurosid 2008).
Bentuk alginat pada umumnya adalah Na. alginat, yaitu garam alginat yang dapat larut dalam air. Bentuk alginat lain yang larut dalam air adalah kalium alginat atau amonium alginat, sedangkan alginat yang tidak larut dalam air adalah kalsium alginat (Nurosid 2008).
Menurut Riyanto (2007) Na. alginat (Na. Alginat/alginat/algin) merupakan zat yang terdapat pada rumput laut cokelat (Phaeophyceae). Rumput laut cokelat penghasil alginat (alginofit) biasanya tumbuh di perairan subtropis terutama untuk jenis Macrocytis, Laminaria, Aschophyllum, Nerocytis, Ecklonia, Fucus, dan Sargassum. Sedangkan rumput laut cokelat yang tumbuh di perairan tropis seperti di Indonesia terutama jenis-jenis Sargassum, Turbinaria, Padina, Dyctyota, dan yang paling banyak ditemukan adalah jenis Sargassum dan Turbinaria.
10
stabilising agensiat), pensuspensi (suspending agensiat), pengikat (binding agensiat), penghalus (finishing agensiat), pengeras kain (stiffening agensiat), pembentuk struktur (sizing agensiat), penjernih (clarifing agensiat), dan sebagainya (Rhama 2007).
Putri (2012) menyatakan bahwa natrium alginat juga dapat digunakan sebagai pelapis benih atau sebagai karier mikroba yang akan diaplikasikan ke tanaman khususnya benih. Hasil penelitian Putri (2012) menunjukkan bahwa perlakuan bahan perekat natrium alginat, tapioka, dan Arabic gum memberikan pengaruh yang sama terhadap daya berkecambah benih dimana daya berkecambah menurun secara nyata pada 12 minggu setelah simpan. Pada tolok ukur kecepatan tumbuh, natrium alginat menghasilkan kecepatan tumbuh yang nyata lebih rendah namun alginat merupakan bahan perekat terbaik untuk mempertahankan daya berkecambah spora CMA. Daya berkecambah spora dapat dipertahankan sampai dengan 16 minggu sebesar 70%.
Talk
Talk merupakan bahan mineral dengan rumus kimia H2Mg3(SiO3)4 atau Mg3Si4O10(OH)2. Talk mengandung 31.88% MgO, 63.37% SiO2, dan 4.75% air. Talk bersifat dapat larut dalam air. Talk banyak digunakan sebagai bahan baku dalam industri seperti industri kertas, plastik, cat tembok dan pelapis, industri kayu, industri makanan, kabel elektrik, farmasi, kosmetik, keramik, pertanian, karier insektisida dan bedak bayi. Talk selain memberi keuntungan buat manusia juga dapat bersifat merugikan karena dapat menyebabkan berbagai penyakit seperti kanker paru-paru (Bhagia 2013), kanker kulit dan kanker ovari (Gertig et al. 2000).
Talk umunya berwarna putih walapun ada talk yang berwarna selain putih seperti hijau atau abu-abu. Talk banyak diproduksi di negara seperti China, Belanda, Francis, Finlandia, Belgia, Austria, Italia, USA, Kanada dan Jepang. Talk dapat digunakan sebagai bahan pembawa mikroba untuk diaplikasikan pada tanaman atau tanah.
Carboximethilcellulose (CMC)
Carboximethylcellulose (CMC) merupakan gum selulosa anionik yang dapat larut dalam air. CMC pertama kali diproduksi di Jerman pada tahun 1930 (Boruvkova dan Wiener 2011). CMC mengandung bahan organik selulosa yang dibutuhkan oleh tanaman dalam proses fotosintesis. CMC memiliki rumus kimia (C6H10O5)n dengan komposisi selulosa yang terdiri dari 44.4% C, 6.17% H dan 49.39 O (Boruvkova dan Wiener 2011).
CMC digunakan sebagai bahan baku dalam industri farmasi, makanan, tekstil dan pascapanen. Keuntungan lain penggunaan CMC dalam industri adalah harganya murah, bisa diproduksi dalam jumlah banyak, aman, ramah lingkungan, dan mudah larut dalam air (Minami et al. 2006).
11
3
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Seluruh percobaan dalam penelitian ini dilakukan di Laboratorium Ilmu dan Teknologi Benih Fakultas Pertanian, Institut Pertanian Bogor, Laboratorium Microbiome Technology dan Pre Nurseri PT SMART Tbk., Sentul. Penelitian dimulai dari bulan Juli 2014 sampai dengan Agustus 2015.
Sumber Bahan
Kecambah kelapa sawit yang digunakan dalam penelitian ini adalah kecambah Tenera (DxP) yang diperoleh dari PT Dami Mas Sejahtera, Kandista-Riau, berumur ± 21 hari. Cendawan T. asperellum (T13) dan G. boninense yang digunakan merupakan koleksi dari PT SMART Tbk.. T. asperellum yang digunakan berumur tujuh hari dengan ciri berwarna hijau tua dengan ciri hifa bersepta, konidiospora hialin, bercabang dan berbentuk piraid, konidia uniseluler, berbentuk bulat berwarna hijau dan halus dengan diameter 3µm (Wicaksono et al. 2010)
Pelaksanaan Percobaan
Penelitian ini terdiri dari dua percobaan, yaitu (1)Viabilitas dan efektivitas T. asperellum pada berbagai bahan pelapis dan (2) Uji efektivitas formula bahan pelapis dengan T. asperellum untuk menekan infeksi G. boninense di pre nurseri. Diagram alir kegiatan penelitian disajikan dalam Lampiran 1.
Percobaan 1 Viabilitas dan Efektivitas T. asperellum pada Berbagai Bahan Pelapis
a. Teknik Pencampuran T. asperellum dengan Bahan Pelapis
Percobaan disusun menggunakan Rancangan Acak Kelompok (RAK) dengan tiga ulangan. Perlakuan pelapisan benih terdiri atas: talk 1%, CMC 1%, tapioka 5%, Arabic gum 25%, Na. alginat 8.3%, Arabic gum 3% + gipsum 1%, CMC 1.5% + gipsum 1%, CMC 1.5% + talk 1%, dan kontrol (tanpa pelapisan dan tanpa T. asperellum). Konsentrasi bahan Na. alginat 8.3%, tapioka 5%, dan Arabic gum 25% berdasarkan hasil penelitian Putri (2012). Konsentrasi bahan Arabic gum 3% + gipsum 1%, CMC 1.5% + talk 1%, CMC 1.5% + gipsum 1% berdasarkan hasil penelitian Palupi et al. (2013).
Semua bahan pelapis sesuai perlakuan dicampur dengan suspensi T. asperellum. Jumlah benih masing-masing satuan percobaan sebanyak tiga buah. Setelah diberikan perlakuan bahan pelapis benih, dilakukan uji perkecambahan pada polibag yang berisi media top soil, di pre nurseri.
Rumus rancangan yang digunakan adalah:
12
Yij : nilai pengamatan pada perlakuan ke- i ulangan ke-j µ : rataan umum
αi : pengaruh perlakuan ke-i βj : pengaruh ulangan ke-j
εij : pengaruh acak yang menyebar normal
b. Teknik Pelapisan Benih dengan Perendaman T. asperellum.
Percobaan disusun menggunakan RAK yang didesain secara tersarang dengan tiga ulangan. Tiga bahan pelapis terbaik dari percobaan 1a digunakan untuk formulasi bahan pelapis pada percobaan ini.
Benih direndam dalam suspensi cendawan selama 1 jam (Wicaksono et al. 2010b). Setelah perendaman kecambah dikering-anginkan selama 1-2 jam, kemudian dilapisi dengan bahan pelapis sesuai perlakuan. Perlakuan terdiri atas dua faktor yaitu pelapisan dan periode simpan. Perlakuan pelapisan terdiri atas: (Kontrol 1) tanpa perendaman T. asperellum dan tanpa pelapisan, (Kontrol 2) perendaman dengan T. asperellum dan tanpa pelapisan, perlakuan lainnya menggunakan kecambah yang direndam dalam suspensi T. asperellum dilanjutkan dengan pelapisan Arabic gum 10%, + Arabic gum 25%, + Arabic gum 40%, + CMC 0.5%, + CMC 1%, + CMC 1.5%, + Arabic gum 1.5% + gipsum 0.5%, + Arabic gum 3% + gipsum 1%, + Arabic gum 4.5% + gipsum 1.5%. Perlakuan periode simpan terdiri atas penyimpanan selama 0, 3, 6, 9, dan 12 hari. Benih yang sudah diberi perlakuan disimpan dalam ruangan dengan suhu 18±2 0C sebelum dikecambahkan. Jumlah benih masing-masing satuan percobaan sebanyak 10 buah.
Rumus rancangan yang digunakan adalah:
Keterangan :
ij : nilai pengamatan pada faktor A taraf -i dan faktor B taraf ke-j dan ulangan ke-k
µ : rataan umum
αi : pengaruh faktor A pada taraf ke-i ulangan ke-k βj(i) : pengaruh faktor B pada taraf ke-j pada αi pk : pengaruh ulangan ke-k
ijk : pengaruh galat pada pada faktor A taraf –i, faktor B taraf ke-j dan ulangan ke-k
Peubah yang diamati pada percobaan I antara lain:
Daya tumbuh (DT, %). Dihitung berdasarkan persentase kecambah normal dengan kriteria minimal satu daun membuka penuh pada hitungan pertama 20 hari setelah tanam (HST) dan kedua 40 HST dengan rumus:
13 dioven selama 3 jam pada suhu 105 0C sesuai Standar Operasional Prosedur (SOP) Sinar Mas.
Vigor tanaman. Meliputi pertambahan tinggi tanaman per dua minggu, panjang akar dan tajuk pada akhir pengamatan
Deteksi jumlah T. asperellum dalam akar. Pada akhir pengamatan dilakukan penghitungan jumlah T. asperellum dalam akar dengan pour plate.
Percobaan II Uji Efektitivitas Formula Bahan Pelapis dengan T. asperellum
untuk Menekan Infeksi G.boninense di Pre Nurseri
Percobaan disusun menggunakan rancangan RAK dengan tiga ulangan. Tiga jenis bahan pelapis dari percobaan Ib digunakan pada percobaan II. Perlakuan benih terdiri atas: benih tanpa pelapisan dan tanpa perendaman T. asperellum (P1), pelapisan benih dengan CMC 1% (P2), CMC 1.5% (P3), Arabic gum 4.5% + gipsum 1.5% (P4), perlakuan lainnya benih direndam dalam suspensi T. asperellum (P5), + pelapisan CMC 1% (P6), + pelapisan CMC 1.5% (P7), + Arabic gum 4.5% + gipsum 1.5% (P8) dan tanpa pelapisan, tanpa perendaman T. asperellum dan media tanam tanpa G. boninense (P9). Perlakuan P1 s.d P8 media tanam diinokulasi dengan G. boninense.
Rumus rancangan yang digunakan adalah:
Keterangan:
ij : nilai pengamatan perlakuan A ulangan ke-j µ : rataan umum
αi : pengaruh faktor perlakuan A βj : pengaruh ulangan ke-j
ij : pengaruh acak yang menyebar normal
Persiapan benih, suspensi larutan dan pelapisan benih sama dengan prosedur pada percobaan pertama. Setelah diberi perlakuan, perkecambahan diuji pada media tanah dalam polibag di pre nurseri. Jumlah benih untuk masing-masing satuan percobaan adalah 10 buah.
Pengamatan pada percobaan ini meliputi daya tumbuh, insidensi penyakit dan indeks keparahan penyakit.
Insidensi penyakit (IP) dihitung dengan rumus: Keterangan :
IP : insidensi penyakit (%)
n : jumlah tanaman yang terserang G. boninense N : jumlah seluruh tanaman
14
1 : terdapat cendawan G. boninense pada akar dan atau penyebaran nekrotik akar pada satu kuadran (5< x ≤25%)
2 : terdapat cendawan G. boninense pada akar dan atau penyebaran nekrotik akar pada dua kuadran (25< x ≤ 50%)
3 : terdapat cendawan G. boninense pada akar dan atau penyebaran nekrotik akar pada tiga kuadran 50< x ≤ 75%
4 : terdapat cendawan G. boninense pada akar dan atau penyebaran nekrotik akar pada empat kuadran (> 75%) atau tanaman mati
Penyiapan cendawan T. asperellum dan G. boninense
Cendawan T. asperellum koleksi terlebih dahulu diperbanyak dengan membiakannya dalam cawan Petri. Sebanyak 10 µ L suspensi koleksi dipipet ke dalam cawan Petri berisi 15 mL media PDA. Kemudian disimpan dalam inkubator suhu 28±1 0C selama 7 hari. Cendawan yang digunakan untuk perlakuan sudah menghasilkan spora dan berwarna hijau tua. Sebanyak dua cawan Petri T. asperellum yang telah tumbuh dan menghasilkan spora dilarutkan dalam 100 mL akuades steril. Kemudian dikocok selama 1 jam menggunakan mesin pengocok.
Suspensi disaring dengan kain kasa agar sisa-sisa media PDA tidak tercampur kedalam larutan. Sebelum digunakan dilakukan penghitungan populasi spora cendawan dengan melakukan pengenceran sampai dengan 10-2. Populasi cendawan dihitung dengan membuat preparat hemasitometer. Jumlah spora yang dihasilkan dalam larutan untuk digunakan adalah 107. Preparat kemudian diamati dibawah mikroskop cahaya dan jumlah spora dihitung dengan rumus:
15 1210C, selama 1 jam. Rakis yang telah diinokulasi dengan isolat Ganoderma kemudian diinkubasi dalam inkubator dengan suhu 28±2 0C selama 10 minggu (Sinarmas Agibisnis and Food 2007).
Pelapisan benih
Sebelum pelapisan dilakukan, kecambah terlebih dahulu diseleksi untuk membuang yang rusak, abnormal, poliembrioni dan yang terbaik dipertahankan. Kecambah hasil seleksi kemudian dicuci bersih di bawah air mengalir dan dikering-anginkan selama 2 jam. Kecambah dikemas dalam plastik PE dan disimpan dalam ruang berpendingin (20 ± 2 0C) sebelum digunakan.
Pelapisan kecambah dilakukan sesuai dengan taraf perlakuan dengan pelarut bahan pelapis menggunakan suspensi cendawan. Pelapisan kecambah dilakukan secara manual. Setelah pelapisan kecambah dikering-anginkan selama 3-6 jam tergantung jenis bahan pelapis yang digunakan. Kecambah yang telah kering ditanam langsung di pre nurseri.
Penanaman dan pemeliharaan
Penanaman dilakukan dengan mengacu pada Pedoman Teknis Budidaya Tanaman Kelapa Sawit (Sinarmas Agribusiness and Food 2007). Polibag hitam dengan ukuran diameter 10 cm dan tinggi 17.5 cm diisi dengan media tanam. Syarat media tanam yang digunakan adalah top soil tanah mineral dengan tekstur lempung dan tidak terserang Ganoderma (diperoleh dari desa Cijayanti, Bogor).
Media tanam terlebih dahulu diayak dengan saringan 1 cm x 1 cm dan dicampur dengan 50 kg pupuk rockphospate per ± 2 m3 tanah. Media tanam dalam polibag dipadatkan dengan cara diguncang-guncangkan sampai dengan 1 cm dari bibir polibag. Polibag yang telah diisi media ditempatkan dan disusun pada bedengan dengan lebar 120 cm dan panjang 12 m. Tinggi bedengan ± 5 cm dan jarak antar bedengan 70 cm.
Media dalam polibag disiram sampai jenuh air sebelum penanaman dilakukan. Kecambah ditanam dengan kedalaman 2 cm dari permukaan tanah dengan posisi radikula mengarah ke bawah dan plumula mengarah ke atas. Setelah penanaman polibag disiram kembali sampai dengan jenuh dan ditempatkan dalam pre nurseri dengan naungan paranet 60%. Penyiraman dilakukan hingga media dalam polibag basah. Pemupukan kelapa sawit yang telah ditanam dilakukan saat tanaman mulai berumur 5 minggu setelah tanam (MST) (Tabel 1).
Tabel 1 Pemupukan bibit kelapa sawit di pre nurseri No. Umur tanaman
(MST)
Cara
16
Pemeliharaan tanaman berupa pengendalian gulma dilakukan secara manual pada setiap pengamatan. Pengendalian hama penyakit dilakukan apabila ada serangan.
Isolasi Trichoderma sp. dari sampel akar tanaman
Sebanyak dua tanaman contoh dipanen pada akhir pengamatan. Akar tanaman dibersihkan terlebih dahulu dibawah air mengalir hingga bersih, kemudian dikering-anginkan. Kemudian rambut akar tanaman contoh dipotong-potong dan dicampur merata, kemudian ditimbang sebanyak 1 g untuk pour plate. Sampel akar disterilisasi permukaannya secara bertahap dengan kloroks 3% selama 3 menit, alkohol 90% selama 2 menit, alkohol 70% selama 2 menit, alkohol 50% selama 2 menit, akuades steril sebanyak tiga kali masing-masing 1 menit.
Akar yang sudah steril digerus dengan mortar dan ditambahkan 9 mL akuades steril, kemudian dikocok selama ± 1 jam. Suspensi yang telah dikocok diencerkan secara berseri (10-2, 10-3, 10-4). Setiap pengenceran berseri diambil 1 mL untuk dituang dalam cawan Petri dengan menambahkan 15 mL media PDA. Hasil tuangan (pour plate) kemudian ditempatkan dalam inkubator (28±1 0C) selama 7 hari. Pada hari ke-7 dilakukan pengamatan terhadap jumlah koloni cendawan T. asperellum yang dapat tumbuh. Data koloni yang tumbuh diambil pada pengenceran 10-2.
Analisis Data
Semua data pada setiap percobaan dianalisis dengan analisis sidik ragam (ANOVA). Bila perlakuan menunjukan perbedaan yang nyata maka akan dilanjutkan dengan uji beda nyata Duncan Multiple Range Test (DMRT) pada taraf 5%.
4
HASIL DAN PEMBAHASAN
Percobaan I Viabilitas dan Efektivitas T. asperellum pada Berbagai Bahan Pelapis
a. Teknik Pencampuran T. asperellum dengan Bahan Pelapis
T. asperellum tidak ada yang masuk kedalam jaringan akar pada 13 MST setelah perlakuan. Hasil ini menunjukkan bahwa T. asperellum tidak viabel pada bahan pelapis yang digunakan. Tidak viabelnya T. asperellum dengan bahan pelapis diduga akibat adanya pengeringan setelah proses pelapisan yang menyebabkan spora sulit tumbuh dan berkembang. Ketiadaan T. asperellum dalam jaringan akar diduga menyebabkan peran T. asperellum sebagai pemacu pertumbuhan tanaman menjadi kurang efektif.
17 melaporkan bahwa Arabic gum, CMC dan gipsum dapat digunakan sabagai pelapis benih karena tidak bersifat racun dan tidak berpengaruh buruk terhadap mutu fisiologis benih.
Sifat fisik dan kimia yang dimiliki oleh CMC, Arabic gum dan gipsum diduga menjadikan bahan-bahan ini dapat berperan sebagai sumber nutrisi bagi pertumbuhan bibit kelapa sawit di lapang. Hal ini dapat dilihat dari bobot kering, panjang akar dan tinggi tajuk yang tidak berbeda nyata dengan kontrol walaupun benih yang digunakan telah mengalami cekaman pada proses pengeringan (Tabel 2).
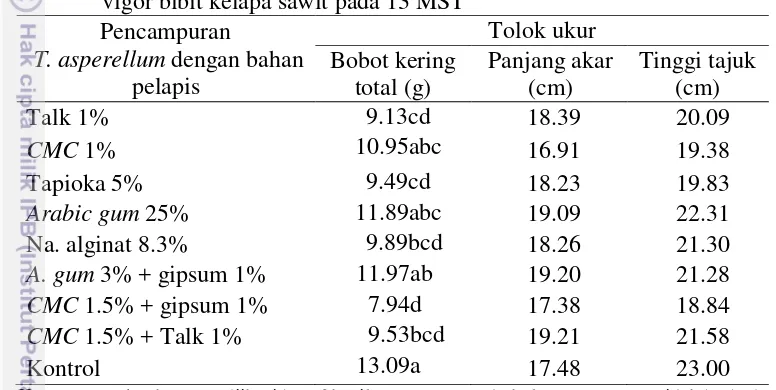
Tabel 2 Pengaruh pencampuran T. asperellum dengan bahan pelapis terhadap vigor bibit kelapa sawit pada 13 MST
Pencampuran
Keterangan: Angka yang diikuti huruf kecil yang sama pada kolom yang sama tidak berbeda nyata pada DMRT taraf α=5% (*)
Dauqan dan Abdullah (2013) menyatakan bahwa Arabic gum mengandung ion kalsium, magnesium, dan kalium dan bersifat mudah larut dalam air. Boruvkova dan Wiener (2011) menyatakan bahwa CMC merupakan gum selulosa yang mudah larut dalam air dan mengandung selulosa yang dibutuhkan oleh tanaman dalam fotosintesis. CMC dan Arabic gum memiliki daya rekat yang tinggi dan sangat baik digunakan untuk melapisi benih. Walworth (2006) menyatakan bahwa gipsum mengandung kalsium yang dapat menjadi sumber hara organik pada tanaman. Pengaplikasian gipsum tunggal tanpa bahan perekat sebagai bahan pelapis benih sulit dilakukan karena gipsum pada konsentrai rendah sangat mudah tercuci oleh air sehingga sulit menempel pada benih. Menurut Fleche (1985) granula tapioka tidak dapat larut dalam air dibawah 50 0
C. Hal ini menyebabkan tapioka sulit menempel pada benih yang dilapisi dan mudah tercuci oleh air. Talk mengandung mineral dan mudah tercuci sehingga kurang efektif digunakan sebagai bahan pelapis benih tanpa menambahkan perekat.
18
serapan unsur hara sehingga hara menjadi tersedia pada fotosintesis. Hasil fotosintat yang tinggi diduga akan ditranslokasikan pada organ tanaman. Sehingga secara tidak langsung pertambahan panjang akar dan tinggi tajuk dapat meningkatkan bobot kering total.
Hasanah dan Setiari (2007) menyatakan bahwa biomassa tanaman mengindikasikan banyaknya senyawa kimia yang terkandung dalam tanaman, semakin tinggi biomassa maka senyawa kimia yang terkandung di dalamnya lebih banyak sehingga meningkatkan bobot kering tanaman. Bobot kering tertinggi diperoleh dari perlakuan CMC 1%, Arabic gum 25% dan Arabic gum 3% + gipsum 1% walaupun lebih rendah dan tidak nyata dibandingkan dengan kontrol (Tabel 2).
Pencampuran T. asperellum dengan bahan pelapis hanya berpengaruh nyata terhadap pertambahan tinggi tanaman pada 2 dan 6 MST (Tabel 3). Pertambahan tinggi tanaman tertinggi pada semua perlakuan pelapisan terjadi pada 8 MST.
Tabel 3 Pengaruh pencampuran T. asperellum dengan bahan pelapis terhadap pertambahan tinggi bibit kelapa sawit pada 2-12 MST
Perlakuan pelapisan Pertambahan tinggi tanaman (cm ) 2 MST 4 MST 6 MST 8 MST 10 MST 12 MST
Keterangan: angka yang menunjukkan huruf yang sama pada kolom yang sama tidak berbeda
nyata pada DMRT taraf α=5%
Pertambahan tinggi yang berbeda nyata diduga karena pengeringan setelah pelapisan menyebabkan cekaman pada benih yang menggangu laju pertumbuhan. Selain itu pemupukan pada 5 MST dapat menimbulkan respon yang berbeda terhadap pertambahan tinggi tanaman pada 6 MST. Berdasarkan bobot kering yang dihasilkan dan sifat bahan pelapis yang digunakan maka dipilih CMC 1%, Arabic gum 25%, dan Arabic gum 3% + gipsum 1% sebagai bahan pelapis untuk percobaan 1b.
b. Teknik Pelapisan Benih dengan Perendaman T. asperellum
19 pada permukaan benih selama proses pengeringan. Gambar 3 menunjukkan koloni T. asperellum yang dapat berkembang biak dalam jaringan akar setelah perendaman.
Tabel 4 Pengaruh periode simpan dan perendaman + pelapisan terhadap vigor bibit kelapa sawit dan jumlah T. asperellum (T13) (colony form unit (cfu)) dalam akar tanaman pada 12 MST
Perlakuan sifat endofit memungkinkan T. asperellum berperan sebagai agen biokontrol melalui mekanisme mikoparasit, produksi antibiotik, kompetisi ruang dan nutrisi, kolonisasi akar, dan induksi resistensi sistemik dan memacu pertumbuhan. T. asperellum yang endofit dalam akar dapat meningkatkan efisiensi penyerapan hara bagi pertumbuhan tanaman sehingga dapat meningkatkan laju pertumbuhan tinggi tanaman, panjang akar, biomassa dan fotosintesis tanaman.
20
tinggi tajuk, jumlah T. asperellum dalam akar. Periode simpan hanya berpengaruh nyata terhadap bobot kering tanaman dan tinggi tajuk (Tabel 4).
Periode simpan 12 hari nyata meningkatkan bobot kering tanaman dan tinggi tajuk dibandingkan dengan tanpa simpan. Semakin lama periode simpan bobot kering tanaman, tinggi tajuk dan panjang akar semakin meningkat. Hal ini karena benih berupa kecambah mengalami pertumbuhan selama di penyimpanan sehingga saat di tanaman di lapang dapat tumbuh lebih baik. Selain itu perendaman + pelapisan memungkinkan T. asperellum untuk tumbuh dan berkembang selama penyimpanan benih dan bahan pelapis yang digunakan memiliki daya rekat dan antioksidan yang tinggi sehingga kecambah tidak rusak (browning) dan tetap hidup. CMC dan Arabic gum yang digunakan tidak meracuni kecambah selama penyimpanan. Hal ini sejalan dengan Ali et al. (2009) yang menyatakan bahwa Arabic gum mengandung antioksidan dan dapat mempertahankan kesegaran buah yang dilapisi Arabic gum.
Gambar 3 Koloni T. asperellum hasil pour plate sampel akar, a) –perendaman -pelapisan, b) +perendaman --pelapisan, c - k: dengan perendaman T. asperellum + pelapisan, c) +Arabic gum 10%, d) +Arabic gum 25%, e) +Arabic gum 40%, f) +CMC 0.5%, g) +CMC 1%, h) +CMC 1.5%, i) +Arabic gum 1.5% + gipsum 0.5%, j) +Arabic gum 3% + gipsum 1%, k) +Arabic gum 4.5% + gipsum 1.5%, l) aquades steril. : koloni T. asperellum
Perendaman + pelapisan hanya berpengaruh nyata pada panjang akar dan tinggi tajuk. Tinggi tajuk dan panjang akar tertinggi diperoleh dari perlakuan perendaman tanpa pelapisan. Bekembangnya T. asperellum dalam jaringan akar seharusnya dapat meningkatkan bobot kering tanaman, dimana menurut de Santiago et al. (2013) T. asperellum memiliki kemampuan melarutkan nutrisi anorganik sehingga Fe dan Cu menjadi tersedia bagi pertumbuhan tanaman.
Beberapa hasil penelitian menunjukkan bahwa Trichoderma spp. tidak memberikan respon yang baik terhadap tanaman tahunan. Perazzolli et al. (2011) melaporkan bahwa perlakuan T. harzianum tidak berpengaruh terhadap bobot basah dan kering tajuk dan akar tanaman anggur dan kontrol memiliki bobot basah dan kering tajuk/akar lebih tinggi dan berbeda nyata dibandingkan dengan perlakuan T. harzianum. Tchameni et al. (2011) menyatakan bahwa perlakuan T. asperellum pada media tanam cokelat menghasilkan bobot basah tajuk dan rasio tajuk/akar yang lebih kecil dibandingkan dengan kontrol.
a
b
c
d
e
f
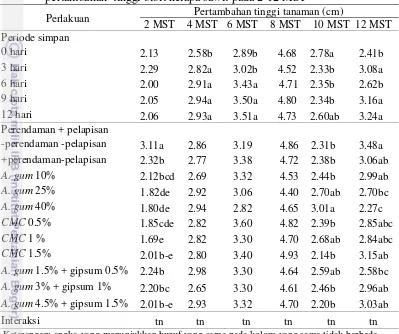
21 Interaksi periode simpan dan perendaman + pelapisan benih pertambahan tinggi tanaman (Tabel 5). Periode simpan nyata meningkatkan pertambahan tinggi tanaman pada 4, 6, 10, dan 12 MST. Perendaman + pelapisan benih berpengaruh nyata terhadap pertambahan tinggi tanaman hanya pada 2, 10, dan 12 MST (Tabel 5).
Tabel 5 Pengaruh periode simpan dan perendaman + pelapisan benih terhadap pertambahan tinggi bibit kelapa sawit pada 2-12 MST
Perlakuan Pertambahan tinggi tanaman (cm)
2 MST 4 MST 6 MST 8 MST 10 MST 12 MST Periode simpan
0 hari 2.13 2.58b 2.89b 4.68 2.78a 2.41b 3 hari 2.29 2.82a 3.02b 4.52 2.33b 3.08a 6 hari 2.00 2.91a 3.43a 4.71 2.35b 2.62b 9 hari 2.05 2.94a 3.50a 4.80 2.34b 3.16a 12 hari 2.06 2.93a 3.51a 4.73 2.60ab 3.24a Perendaman + pelapisan
-perendaman -pelapisan 3.11a 2.86 3.19 4.86 2.31b 3.48a +perendaman-pelapisan 2.32b 2.77 3.38 4.72 2.38b 3.06ab A. gum 10% 2.12bcd 2.69 3.32 4.53 2.44b 2.99ab A. gum 25% 1.82de 2.92 3.06 4.40 2.70ab 2.70bc A. gum 40% 1.80de 2.94 2.82 4.65 3.01a 2.27c CMC 0.5% 1.85cde 2.82 3.60 4.82 2.39b 2.85abc CMC 1 % 1.69e 2.82 3.30 4.70 2.68ab 2.84abc CMC 1.5% 2.01b-e 2.80 3.40 4.93 2.14b 3.15ab A. gum 1.5% + gipsum 0.5% 2.24b 2.98 3.30 4.64 2.59ab 2.58bc A. gum 3% + gipsum 1% 2.20bc 2.65 3.30 4.61 2.46b 2.96ab A. gum 4.5% + gipsum 1.5% 2.01b-e 2.93 3.32 4.70 2.20b 3.03ab
Interaksi tn tn tn tn tn tn
Keterangan: angka yang menunjukkan huruf yang sama pada kolom yang sama tidak berbeda
nyata pada DMRT taraf α=5%, tn : tidak berbeda nyata pada taraf α=5%
Selama periode simpan kecambah umumnya dalam kondisi baik walaupun terjadi sedikit perubahan warna dari putih menjadi kecoklatan (browning) (Gambar 4). Perubahan warna terutama terjadi pada pelapisan dengan Arabic gum.
Gambar 4 Morfologi kecambah setelah pelapisan dan penyimpanan 12 hari, a) -perendaman –pelapisan, b) Arabic gum 40%, c) CMC 1.5%, d) Arabic gum 4.5% + gipsum 1.5%
d c
22
Perubahan warna kecambah yang terjadi umumnya karena proses pelapisan menyebabkan terjadinya gesekan antara alat pelapis yang digunakan dengan kecambah yang sangat sensitif kerusakan terutama bila dilakukan secara manual. Browning pada kecambah tidak mengganggu pertumbuhan benih dimana pada saat ditanam benih masih memiliki daya tumbuh yang tinggi dan tidak berbeda nyata dengan kontrol.
Percobaan II Uji Efektitivitas Formula Bahan Pelapis dengan T. asperellum
untuk Menekan Infeksi G.boninense di Pre Nurseri
Inokulasi G. boninense pada media tanam menurunkan daya tumbuh bila dibandingkan dengan yang tidak diinokulasi G. boninense. Pada media yang diinokulasi Ganoderma, perendaman T. asperellum + pelapisan benih dapat meningkatkan daya tumbuh dan mempertahankan bibit tetap hidup dibandingkan dengan yang tidak direndam T. asperellum (Tabel 6).
Tabel 6 Pengaruh perendaman T. asperellum + pelapisan benih terhadap bibit kelapa sawit pada media tanam yang diinokulasi Ganoderma pada 12 MST nyata pada DMRT taraf α=5% *: media tanam diinokulasi G.boninense; **: media
tanam tidak diinokulasi G. boninense, IP: Insidensi Penyakit, DSI: Desease
Severity Indeks
Insidensi penyakit pada semua perlakuan yang diinokulasi G. boninense
sangat tinggi (>93.33%) dan berbeda sangat nyata dengan yang tanpa inokulasi G. boninense (Tabel 6). Indeks keparahan penyakit berbeda nyata untuk semua
perlakuan. Perlakuan perendaman T. asperellum + CMC 1% merupakan perlakuan yang paling efektif menekan Ganoderma dengan tingkat keparahan 84.17% (Tabel 6). Namun tingkat keparahan ini masih tergolong tinggi menurut Kok et al. (2013) yang menyatakan tingkat keparahan penyakit > 80% tergolong dalam tingkat serangan tinggi (high virulance).
23 berkembang pada rakis akan menekan pertumbuhan dan perkembangan T. asperellum yang menyebabkan kecambah mati pada minggu pertama penanaman (Gambar 5a) dan akar tanaman terinfeksi walaupun dapat tumbuh dan bertahan hingga 12 MST (Gambar 5b).
Gambar 5 Infeksi Ganoderma pada kelapa sawit, a) kecambah, b) akar tanaman Infeksi Ganoderma pada kecambah dapat diamati dengan adanya massa Ganoderma pada kecambah dalam waktu satu minggu. Hal ini lebih cepat bila dibandingkan dengan hasil penelitian Kok et al. (2013) yang menyatakan bahwa massa Ganoderma dapat dilihat tanpa menunjukkan gejala pada kecambah 10 minggu setelah inokulasi dengan persentase kejadian penyakit 100% dan tingkat keparahan penyakit 36.7% (less virulance).
Pada penelitian ini, penggunaan T. asperellum endofit belum mampu meningkatkan resistensi terhadap Ganoderma. Kelebihan sifat T. asperellum endofit menurut Bailey et al. (2009) adalah dapat meningkatkan sistem resistensi tanaman. Selain itu Lopes et al. (2012) menyatakan bahwa Glukanase dan β-1,3 glukanase yang dihasilkan T. asperellum mampu mendegradasi dinding sel fungi dan meningkatkan pelepasan dinding sel dari elisitor fungi patogen. Bailey et al. (2008) menyatakan bahwa T. asperellum yang disemprotkan pada buah kakao secara nyata menurunkan persentase penyakit busuk hitam pada buah.
Perlakuan perendaman T. asperellum + CMC 1.5% merupakan perlakuan terbaik dengan tingkat keparahan penyakit dan insidensi penyakit yang lebih rendah dibandingkan dengan perlakuan lainnya yang diinokulasi Ganoderma (Tabel 5). Formula ini berpotensi sebagai bahan pelapis yang dapat meningkatkan ketahanan terhadap tingkat infeksi Ganoderma di pre nurseri. Uji kontras ortogonal menunjukkan bahwa perlakuan perendaman T. asperellum nyata meningkatkan daya tumbuh bibit kelapa sawit (P-value = 0.01) namun tidak berpengaruh nyata pada kejadian penyakit (P-value = 0.44) dan tingkat keparahan penyakit (P-value = 0.09) dibandingkan dengan tanpa perendaman.
5
KESIMPULAN
Aplikasi T. asperellum yang efektif pada benih kelapa sawit adalah dengan perendaman dilanjutkan dengan pelapisan CMC 1%, CMC 1.5% dan Arabic gum 4.5% + gipsum 1.5%. Aplikasi perendaman T. asperellum + pelapisan dengan CMC 1.5% efektif meningkatkan daya tumbuh tetapi belum efektif untuk menekan infeksi Ganoderma di pre nurseri.
24
6
DAFTAR PUSTAKA
Abdullah F, Ilias GNM, Nelson M, Nur Ain Izzati MZ, Yusuf UK. 2003. Disease assessment and the efficacy of Trichoderma as biocontrol agent of basal stem rot of oil palms. Research Bulletin Science Putra. 1:31-33. Alexopoulos CJ, Mims CW. Blackwell M. 1979. Introductory Mycology. New
York (US): John Wiley & Sons. Inc.
Ali BH, Ziada A, Blunden G. 2009. Biological Effect of gum arabic: a review of some recent research. Food Chem Toxicol. 47:1-8.
Asaduzzaman M, Alam MJ, Islami MM. 2010. Effect of Trichoderma on seed germination and seedlings parameters of chili. J Sci Foundation. 8(1&2):141-150.
Bailey BA, Strem MD, Wood D. 2009. Trichoderma species form endophytic associations within Theobroma cacao trichomes. Mycological research. 113:1365–1376.
Bailey BA, Bae H, Strem MD, Crozier J, Thomas SE, Samuels GJ, Vinyard BT, Holmes KA. 2008. Antibiosis, mycoparasitism, and colonization success for endophytic Trichoderma isolates with biological control potential in Theobroma cacao. Biological Control. 46:24–35.
[BBPPTP] Balai Besar Pengkajian dan Pengembangan Teknologi Pertanian. 2008. Teknologi Budidaya Kelapa Sawit. Bogor (ID): Balai Besar Pengkajian dan Teknologi Pertanian.
Bhagia LJ. 2013. Occupational exposure to talc. Indian J of Applied Research. 3(12):238-240.
Boruvkova K, Wiener J. 2011. Water absorption carboxymethyl cellulose. Autex Research J. 11(4):110-113.
Chantrapromma S, Jeerapong C, Phupong W, Quah CK, Fun HK. 2014. Trichodermaerin: a diterpene lactone from Trichoderma asperellum. Acta Crystallographica. 70:408–409.
Chaplin M. 2008. Gum arabic [internet]. [ di unduh 3 September 2014]. Tersedia pada: http://www.arabicgum.hyarabic.html.
Chet I. Viterbo A. Brotman Y. Lousky T. 2006. Enhancement of plant disease resistance by the biocontrol agent Trichoderma [internet]. [di unduh tanggal 4 September 2014]. Tersedia pada: www.weizmann.ac.il.
Chutrakul C, Peberdy JF. 2005. Isolation and characterisation of a partial peptide synthetase gene from Trichoderma asperellum. FEMS Microbiology Letters. 252:257–265.
Cooper RM, Flood J, Rees RW. 2011. Ganoderma boninense in oil palm plantations: current thinking on epidemiology, resistance and pathology.
The Planter. 87(1024):515-526.