SINTESIS DAN APLIKASI SELULOSA-
g
-POLIAKRILAMIDA
DARI SERABUT AMPAS SAGU SEBAGAI FASE DIAM
KROMATOGRAFI KOLOM
ANDRIA SETYORINI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ANDRIA SETYORINI. Sintesis dan Aplikasi Selulosa-
g
-Poliakrilamida dari
Serabut Ampas Sagu sebagai Fase Diam Kromatografi Kolom. Dibimbing oleh
TUN TEDJA IRAWADI dan MUHAMMAD FARID.
Serabut ampas sagu merupakan salah satu bahan yang mengandung
lignoselulosa. Selulosa dapat dimodifikasi untuk memperbaiki sifat-sifatnya, salah
satunya dengan teknik pencangkokan-taut-silang. Produk modifikasi akan
memiliki struktur makromolekular yang dapat diaplikasikan untuk teknologi
pemisahan. Tahapan penelitian yang dilakukan terdiri atas isolasi selulosa, sintesis
selulosa-
g
-poliakrilamida, dan aplikasi produk sebagai fase diam dalam
kromatografi kolom. Isolasi selulosa menghasilkan isolat dengan kadar lignin
0.37%. Sintesis fase diam selulosa-
g
-poliakrilamida diaplikasikan dengan ragam
jumlah penaut-silang 0.1, 0.5, dan 1.0 g. Pencirian menggunakan FTIR
membuktikan telah terjadi pencangkokan akrilamida ke selulosa. Ketiga
diaplikasikan pada kromatografi kolom untuk memisahkan xantorizol dari ekstrak
kasar temu lawak. Berdasarkan profil kromatografi lapis tipis, xantorizol berada
pada fraksi heksana pertama dan dibuktikan pula dengan kromatografi cair kinerja
tinggi. Kolom terbaik untuk pemisahan xantorizol ialah selulosa-
g
-poliakrilamida
dengan penaut-silang sebanyak 0.5 g.
ABSTRACT
ANDRIA SETYORINI. Synthesis and Application of Cellulose-
g
-Polyacrylamide
from Sago Waste Fiber as Column Chromatography Stationary Phase. Under the
direction of TUN TEDJA IRAWADI and MUHAMMAD FARID.
SINTESIS DAN APLIKASI SELULOSA-
g
-POLIAKRILAMIDA
DARI SERABUT AMPAS SAGU SEBAGAI FASE DIAM
KROMATOGRAFI KOLOM
ANDRIA SETYORINI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Sintesis dan Aplikasi Selulosa-
g
-poliakrilamida dari Serabut Ampas
Sagu sebagai Fase Diam Kromatografi Kolom
Nama : Andria Setyorini
NIM
: G44070076
Disetujui
Pembimbing I
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
Pembimbing II
Drs Muhammad Farid, MSi
NIP 19640525 199203 1 003
Diketahui
Ketua Departemen
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
ix
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas berkat limpahan
rahmat dan hidayah-Nya penulis dapat menyelesaikan karya ilmiah dengan judul
Sintesis dan Aplikasi Selulosa-
g
-poliakrilamida dari Serabut Ampas Sagu sebagai
Fase Diam Kromatografi Kolom. Salawat serta salam semoga selalu tercurahkan
kepada Nabi Muhammad SAW, keluarganya, dan semoga kita semua menjadi
pengikutnya hingga akhir zaman.
Penulis mengucapkan terima kasih kepada Ibu Prof Dr Ir Tun Tedja Irawadi,
MS dan Bapak Drs Muhammad Farid, MSi selaku pembimbing yang senantiasa
memberikan arahan, dorongan semangat, dan doa kepada penulis selama
melaksanakan penelitian. Penulis juga mengucapkan terima kasih kepada staf
Laboratorium Terpadu, Indah, Baim, Sarah, dan Mas Yono atas bantuan serta
masukan selama penelitian berlangsung.
Terima kasih tak terhingga penulis ucapkan kepada Ayah, Ibu, Adik, serta
seluruh keluarga, atas doa dan kasih sayangnya. Kepada Septia Dian Putra, Randi,
Rona, Adi, Danang, Astari, teman-teman LT (Pertiwi, Siti, Icha, Jali, Bayu,
Niken), dan teman-teman Kimia 44 yang telah membantu memberi masukan dan
saran, penulis ucapkan terima kasih.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, Desember 2011
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 12 Januari 1990 dari ayah
Bambang Trisaptono dan ibu Sri Widiningsih. Penulis adalah putri pertama dari
dua bersaudara. Tahun 2007 penulis lulus dari SMA Negeri 2 Depok dan pada
tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB)
melalui jalur Seleksi Penerimaan Mahasiswa Baru (SPMB) dan diterima di
Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
METODE ... 2
Bahan dan Alat ... 2
Lingkup Kerja ... 2
Isolasi Selulosa... 2
Sintesis ... 2
Kromatografi ... 3
HASIL DAN PEMBAHASAN ... 4
Isolasi Selulosa... 4
Sintesis Selulosa-
g
-poliakrilamida ... 4
Kromatografi ... 6
SIMPULAN DAN SARAN ... 8
Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 8
DAFTAR TABEL
Halaman
1 Analisis proksimat awal dan akhir isolasi selulosa serabut ampas sagu ... 4
2 Rendemen dari tiap tahap proses isolasi selulosa ... 4
3 Hasil uji kadar N dan daya adsorpsi air (AA) ... 5
4 Indeks bias fase diam dalam berbagai pelarut... 6
DAFTAR GAMBAR
Halaman
1
Spektrum FTIR isolat
selulosa dan kopolimer cangkok………
.
………6
2
Struktur xantorizol
………
.
……….7
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 11
2 Hasil analisis proksimat selulosa sebelum dan setelah isolasi ... 12
3 Mekanisme reaksi kopolimerisasi ... 13
4 Hasil uji kadar N ... 15
5 Hasil uji daya adsorpsi air ... 16
6 Indeks bias hasil uji daya tahan berbagai pelarut ... 17
7 Kromatogram lapis tipis ... 18
PENDAHULUAN
Pemanfaatan tanaman sagu sejauh ini cenderung terfokus pada patinya. Industri pati sagu menghasilkan 3 jenis limbah, yaitu ampas, kulit batang, dan air buangan (Kiat 2006). Pengolahan sagu umumnya menghasilkan ampas sagu sebanyak 6 kali jumlah pati sagu yang dihasilkan (Matitaputty & Alfons 2006). Namun, pemanfaatan ampas sagu belum optimum sehingga banyak terbuang dan mencemari lingkungan karena menimbulkan bau yang tidak sedap.
Ampas sagu merupakan salah satu limbah yang mengandung lignoselulosa dan tidak memiliki nilai ekonomi. Upaya penelitian dalam menangani limbah ampas sagu terus dikembangkan untuk meningkatkan nilai ekonominya. Ampas sagu telah digunakan sebagai pakan ternak, sebagai pupuk dan media tumbuh tanaman (Matitaputty & Alfons 2006; Singhal et al. 2008), sebagai arang briket, sumber bahan organik bagi tanah, dan pengisi adonan perekat dalam kayu lapis (Kumaran et al. 1997; Matitaputty & Alfons 2006).
Ampas sagu tersusun atas lignin, selulosa, dan hemiselulosa. Selulosa ampas sagu dapat dimodifikasi secara kimia menjadi bahan yang lebih bermanfaat. Ester selulosa seperti selulosa nitrat, sulfat, dan fosfat bermanfaat dalam bidang industri. Eter selulosa seperti selulosa xantat berguna dalam produk pertanian, produk pangan, keramik, farmasi, tekstil, dan kertas (Achmadi 1990).
Irfana (2010) telah melakukan modifikasi sederhana asetilasi selulosa ampas sagu menggunakan katalis I2 untuk dimanfaatkan
sebagai fase diam kromatografi kolom dalam pemisahan ekstrak temu lawak. Di dalam kromatografi berbasis senyawa polisakarida, salah satu polimer tulang punggungnya untuk fase diam adalah selulosa. Selulosa merupakan penyusun utama sebagian besar jaringan tanaman dan jumlahnya yang cukup banyak menjadikan selulosa sebagai bahan baku potensial untuk berbagai industri.
Selulosa dapat pula dimodifikasi dengan pencangkokan dan taut-silang. Pada pencangkokan, cabang-cabang polimer dibuat pada selulosa sebagai tulang punggung, tanpa menghancurkan sifat yang baik dari serat selulosa. Sementara, modifikasi taut-silang memperbaiki sifat tertentu, misalnya tahan kusut atau mengerut. Karena jaringan yang terbentuk berdimensi tiga, struktur selulosa menjadi lebih kaku (Achmadi 1990).
Berbagai jenis polimer dapat dicangkokkan ke rantai selulosa melalui gugus hidroksil pada posisi C2, C3, dan C6 (Enomoto-Rogers et al. 2009). Dengan memilih monomer yang tepat, kekuatan mekanik dan stabilitas termal material berbasis selulosa yang dimodifikasi dengan teknik pencangkokan dan taut-silang juga dapat ditingkatkan (Princi et al. 2005). Selain itu, produk yang dihasilkan akan memiliki struktur makromolekular seperti gel atau hidrogel, resin polimer, membran atau material komposit yang dapat diaplikasikan untuk teknologi pemisahan (Crini 2005).
Aplikasi selulosa modifikasi sebagai fase diam telah banyak dilakukan, di antaranya sebagai penukar ion pada kromatografi lapis tipis (TLC), yang dilaporkan cepat dan akurat dalam pemisahan ion-ion anorganik pada konsentrasi rendah. Beberapa kajian terkait dengan pemisahan ion logam ini telah dilaporkan di antaranya menggunakan selulosa fosfat (Shimizu et al. 1980) dan polietilenimina-selulosa (Shimizu et al. 1989). Lipka et al. (2005) melakukan pemisahan secara kiral pada derivat senyawa melatoninergat menggunakan kolom kiral berbasis selulosa. Su-lian et al. (2007) menggunakan etil selulosa (EC) pada paduan etil selulosa/selulosa asetat (EC/CA) sebagai bahan pengemas kolom kromatografi cair kinerja tinggi (HPLC).
Uji kinerja fase diam berbasis selulosa modifikasi dilakukan dengan mengaplikasikannya untuk pemisahan senyawa aktif dari ekstrak temu lawak dengan teknik kromatografi. Temu lawak (Curcuma xanthorriza) adalah tanaman obat-obatan yang tergolong keluarga Zingiberaceae. Temu lawak merupakan salah satu tanaman obat yang memiliki potensi sebagai antibakteri (Hwang et al. 2000) dan sebagai antioksidan (Batubara et al. 2008). Temu lawak memiliki 2 bahan aktif, yaitu kurkuminoid dan xantorizol. Pemisahan terhadap kelompok kurkuminoid telah banyak dilakukan, namun pada penelitian ini, dilakukan pemisahan xantorizol dari ekstrak etanol temu lawak. Xantorizol merupakan salah satu senyawa aktif yang memiliki kemampuan sebagai antibakteri (Hwang et al. 2000). Kandungan senyawa xantorizol dalam temu lawak juga tinggi, yakni sebesar 21% (Darusman et al.
2006).
pengaruh variasi jumlah penaut-silang terhadap aplikasinya sebagai fase diam kromatografi kolom pada pemisahan xantorizol dari ekstrak temu lawak. Setiap fraksi diuji keterpisahannya dengan menggunakan HPLC dan TLC.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah serabut ampas sagu, HCl, iodin, NaOH, H2O2, amonium persulfat (APS),
akrilamida, metilena-bis-akrilamida (MBA), KBr, H2SO4 pekat, etil asetat, asam borat, n
-heksana, asam fosfat, metanol, etanol, aseton, dan toluena (p.a Merck), gas N2, standar
xantorizol, indikator hijau bromkresol, dan merah metil.
Alat-alat analisis yang digunakan adalah radas reaktor sintesis, blade stirrer, alat-alat kaca, shaker, hot plate, kromatografi kolom, radas Kjeldahl, HPLC Shimadzu, pelat TLC, dan spektrofotometer inframerah transformasi Fourier (FTIR) Perkin-Elmer Spectrum One.
Lingkup Kerja
Penelitian ini dilakukan dalam beberapa tahapan (Lampiran 1), di antaranya isolasi selulosa (pulping dan delignifikasi), sintesis selulosa-g-poliakrilamida, uji daya tahan terhadap berbagai pelarut, pemisahan xantorizol dari ekstrak temu lawak dengan kolom selulosa-g-poliakrilamida, kromatografi lapis tipis, dan pencirian fase diam yang dihasilkan dengan FTIR.
Isolasi Selulosa
Preparasi Ampas Sagu
Ampas sagu yang diambil dari pabrik tepung sagu di Cimahpar, Bogor dikeringkan di bawah sinar matahari selama 2 hari. Serabut ampas sagu yang telah dikeringkan kemudian diayak agar serabut kasarnya terpisah dari serbuk halus ampas sagu. Serabut ampas sagu hasil ayakan kemudian digiling hingga berukuran 60 mesh. Analisis proksimat yang terdiri atas kadar total selulosa, kadar α -selulosa dan kadar lignin selanjutnya dilakukan pada contoh serabut ampas sagu ini.
Pulping
Sebanyak 50 g serabut kasar ampas sagu yang telah digiling ditambahkan dengan 1 L larutan HCl 3% kemudian dipanaskan dalam penangas air hingga mencapai suhu 80 C dan suhu dijaga konstan selama 90 menit. Setelah
90 menit, contoh lignoselulosa dicuci hingga bebas asam dan dikeringkan dalam oven dengan suhu 60 C.
Sebanyak 50 g contoh lignoselulosa ditambahkan 1 L larutan NaOH 20% kemudian dipanaskan dalam penangas air hingga mencapai suhu 80 C dan suhu dijaga konstan selama 2 jam. Setelah 2 jam, dicuci hingga bebas basa dan dikeringkan dalam oven dengan suhu 60 C.
Delignifikasi (modifikasi Sun et al. 2005) Sebanyak 20 g contoh lignoselulosa hasil
pulping ditambahkan 500 mL larutan H2O2
5% pH 12 dan dipanaskan dalam penangas air bersuhu 70 C yang dijaga konstan selama 2 jam. Setelah 2 jam, contoh dicuci hingga bebas basa. Proses ini diulangi sebanyak 2 kali lagi dengan larutan H2O2 baru,
masing-masing dipanaskan selama 3 jam. Kemudian contoh dikeringkan dalam oven bersuhu 60 C. Analisis proksimat kadar total selulosa, kadar α-selulosa, dan kadar lignin juga dilakukan pada isolat selulosa ini.
Sintesis
Sintesis Selulosa-g-poliakrilamida (Liang et al. 2009)
Isolat selulosa sebanyak 15 g dimasukkan ke dalam reaktor labu leher tiga, ditambahkan 150 mL akuades, lalu dipanaskan dan diaduk dengan kecepatan 200 rpm hingga mencapai suhu 90─95 C. Setelah mencapai suhu 90 C, gas N2 dialirkan dan dibiarkan konstan selama
30 menit. Setelah 30 menit, suhu diturunkan menjadi 60─65 C lalu ditambahkan 0.25 g ammonium persulfat yang dilarutkan dengan 12.5 mL akuades dan pemanasan dilanjutkan sampai 15 menit. Setelah itu, ditambahkan penaut-silang MBA dengan variasi 0.1; 0.5; dan 1.0 g serta 15 g monomer akrilamida yang dilarutkan dalam 200 mL akuades dengan laju penambahan 2 tetes/detik. Suhu pemanasan dinaikkan menjadi 70 C dan dijaga konstan selama 3 jam.
Pencucian Gel (Al Kawari et al. 2011; Teli & Waghmare 2009)
3
oven pada suhu 60
C hingga mencapai bobot konstan kemudian dihaluskan.Uji Kadar N (Cara Kjeldahl)
Sebanyak 0.1 g produk selulosa-
g-poliakrilamida dan 2 g selen dimasukkan dalam labu Kjeldahl, kemudian ditambahkan 10 mL larutan H2SO4 pekat. Sampel
didestruksi dengan dipanaskan menggunakan pembakar bunsen sampai berwarna hijau bening kekuningan dan tidak ada lagi asap putih yang terbentuk, kemudian didinginkan. Radas distilasi Kjeldahl dirangkai dan larutan asam borat 2% yang ditambahkan indikator hijau bromkresol dan merah metil diletakkan di bagian penampung gas NH3 pada radas
distilasi. Larutan hasil destruksi kemudian dimasukkan ke dalam labu Kjeldahl 500 mL dan ditambahkan batu didih, 150 mL akuades, dan 50 mL larutan NaOH 40% untuk kemudian didistilasi dengan pemanasan menggunakan pembakar Bunsen. Distilat yang diperoleh dititrasi menggunakan HCl 0.1 N sampai berubah warna menjadi merah.
(V1-V0) = Volume HCl terpakai (mL)
NHCl = Normalitas HCl
BEN = Bobot ekuivalen N (14.007 g/mol)
W = Bobot sampel (g)
Uji Daya Adsorpsi Air (Liu et al. 2007) Sebanyak 0.1 g produk selulosa-g -poliakrilamida ditambahkan 200 mL akuades dan didiamkan pada suhu kamar selama 24 jam. Setelah 24 jam, produk yang telah maksimum mengadsorpsi air disaring dengan penyaring 100 mesh hingga tidak ada lagi air yang menetes. Kapasitas adsorpsi dihitung dengan menggunakan persamaan:
Keterangan:
W0 = bobot awal polimer (g)
W1 = bobot polimer yang mengembang (g)
Analisis FTIR
Sebanyak 0.01 g selulosa-g-poliakrilamida dicampurkan dengan 0.1 g KBr. Campuran digerus sampai halus kemudian dipanaskan dalam oven 40 C selama 24 jam untuk menghilangkan uap air. Setelah 24 jam, campuran dianalisis dengan spektrometer FTIR Perkin Elmer Spectrum One dengan resolusi 4 cm-1.
Kromatografi Uji Ketahanan Berbagai Pelarut
Sebanyak 0.5 g produk selulosa-
g-poliakrilamida dalam tabung vial 15 mL ditambahkan masing-masing 10 mL pelarut p.a metanol, etanol, aseton, etil asetat,
n-heksana, dan toluena kemudian didiamkan selama 3 24 jam sambil sesekali diaduk. Setelah 3 hari, masing-masing diukur indeks biasnya menggunakan refraktometer.
Preparasi Ekstrak Temu Lawak
Serbuk temu lawak yang telah dihaluskan diekstraksi secara maserasi di dalam pelarut etanol p.a. Serbuk kering rimpang temu lawak sebanyak 25 g dimasukkan ke dalam labu Erlenmeyer 250 mL, kemudian direndam dengan 100 mL etanol p.a selama 24 jam sambil sesekali diaduk. Maserat dipisahkan dan proses maserasi diulangi 2 kali dengan jenis dan jumlah pelarut yang sama. Semua maserat dikumpulkan dalam labu bulat lalu dipekatkan dengan penguap putar pada suhu 40 °C.
Kromatografi Kolom
Kolom kromatografi yang berisi 6.5 g fase diam produk selulosa-g-poliakrilamida disiapkan. Tinggi fase diam di dalam setiap kolom dibuat seragam (20 cm), laju alir diatur ± 1 mL/menit, dan ekstrak kasar temu lawak yang digunakan sebanyak 0.5 mL. Fase gerak yang digunakan adalah pelarut-pelarut terbaik yang diperoleh dari hasil uji daya tahan berbagai pelarut. Ekstrak dielusi dengan mengalirkan fase gerak sampai semua fraksi keluar dari kolom. Setiap fraksi yang keluar dari kolom ditampung sebanyak 5 mL di dalam tabung gelap. Fraksi yang diperoleh diuji dengan kromatografi lapis tipis dan nilai
retardation factor (Rf) yang diperoleh dibandingkan dengan nilai Rf standar xantorizol.
Kromatografi Lapis Tipis
TLC dilakukan dengan menotolkan ekstrak yang diperoleh, standar xantorizol, dan fraksi-fraksi hasil kolom, pada lempeng TLC gel silika GF 254 dengan bantuan pipa kapiler. Selanjutnya dielusi dengan fase gerak
Kromatografi Cair Kinerja Tinggi
Fraksi kromatografi kolom yang diduga terdapat xantorizol kemudian diamati menggunakan HPLC. Sejumlah 10 L fraksi kromatografi kolom dan larutan standar xantorizol 0.29% diinjeksikan ke dalam HPLC Shimadzu.
HASIL DAN PEMBAHASAN
Isolasi Selulosa
Analisis proksimat serabut ampas sagu sebelum isolasi selulosa menunjukkan kadar lignin sebesar 31.09%. Isolasi selulosa dilakukan dengan beberapa tahapan, yaitu hidrolisis pati menggunakan HCl, pulping
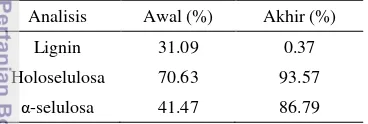
dengan NaOH, dan delignifikasi dengan peroksida. Dihasilkan selulosa yang secara fisik sama dengan selulosa murni (Lampiran 2), dengan kadar lignin yang tersisa sebesar 0.37% (Tabel 1).
Tabel 1 Analisis proksimat awal dan akhir isolasi selulosa serabut ampas sagu
Analisis Awal (%) Akhir (%)
Lignin 31.09 0.37
Holoselulosa 70.63 93.57
α-selulosa 41.47 86.79
Kemurnian selulosa sering dinyatakan melalui parameter α-selulosa. Semakin tinggi kadar selulosa, semakin baik mutu bahan. Serabut ampas sagu sebelum isolasi memiliki kadar α-selulosa sebesar 41.47% yang setelah tahap isolasi meningkat menjadi 86.79%. Dapat disimpulkan bahwa dengan kadar lignin di bawah 0.5%, contoh tersebut adalah murni selulosa. Serabut ampas sagu sangat berpotensi untuk diisolasi selulosanya karena rendemen total isolat selulosa yang didapatkan dari sampel awal adalah 21% selulosa (Tabel 2).
Tabel 2 Rendemen dari tiap tahap proses isolasi selulosa
Perlakuan Rendemen (%)
Hidrolisis HCl 60
Pulping NaOH 50
Delignifikasi 70
Rendemen total 21
Serabut ampas sagu memiliki kandungan selulosa dan lignin yang lebih tinggi dibandingkan dengan ampas sagu. Oleh
karena itu, tahap isolasi, khususnya dalam proses delignifikasi, dilakukan lebih lama, yaitu 8 jam. Sebelum delignifikasi, serabut diberi perlakuan dengan HCl dan pulping
menggunakan larutan NaOH. HCl berfungsi menghilangkan pati, karena untuk sintesis fase diam berbasis-selulosa, senyawa lain dalam serabut ampas sagu harus dihilangkan. Merebus contoh dalam asam encer (HCl 3%) juga dapat menghidrolisis sebagian besar hemiselulosa menjadi gula, tetapi hanya sebagian selulosa yang terserang (Achmadi 1990). Rendemen tahap hidrolisis HCl adalah 60%. Pengurangan bobot diduga karena terhidrolisisnya hemiselulosa terutama unit galaktosa dan arabinosa sehingga terjadi penurunan derajat polimerisasi dan penyusutan rantai hemiselulosa (Achmadi 1990).
Sebelum delignifikasi, contoh perlu dimasak dengan NaOH untuk membentuk pulp. Rendemen tahap ini sebesar 50%. Pengurangan bobot dikarenakan larutan basa memiliki kemampuan untuk mengurangi ikatan hidrogen di dalam molekul selulosa sehingga membengkak dan mengubah struktur dinding sel yang meliputi larutnya hemiselulosa terutama unit asam 4-O -metilglukuronat dan hidrolisis ikatan antara lignin dan selulosa (Achmadi 1990). Pelemahan ikatan antara selulosa dan lignin akan mempermudah reaksi delignifikasi selanjutnya.
Tahap delignifikasi menggunakan larutan hidrogen peroksida karena kemampuannya bereaksi dengan gugus karbonil lignin. Hidrogen peroksida bereaksi optimum pada kondisi pH tinggi (basa) yang merupakan syarat utama proses pemutihan menggunakan hidrogen peroksida (Yokoyama & Matsumoto 2002). Rendemen tahap ini cukup besar, yakni 70%. Delignifikasi merupakan reaksi oksidasi yang kompleks dengan mekanisme radikal. Anion perhidroksil (OOH) adalah bahan aktif yang bereaksi dengan struktur karbonil dan gugus kromofor pada lignin sehingga lignin terpecah-pecah, dan larut dalam larutan NaOH (Ulia 2007).
5
kondisi gas nitrogen. Gas nitrogen berfungsi menghilangkan oksigen dari sistem reaksi dan meminimumkan radikal peroksida yang dapat menghambat reaksi kopolimerisasi karena membentuk homopolimer (Kurniadi 2010). Suhu kopolimerisasi yang digunakan adalah 70 ⁰C yang telah dilakukan oleh Lanthong et al. (2006); Li et al. (2007). Produk kopolimer dicuci dengan metanol dan etanol untuk mengikat air dalam produk serta direfluks dengan aseton untuk menghilangkan homopolimer (Behari et al. 2001).
Mekanisme reaksi radikal dalam kopolimerisasi cangkok terdiri atas beberapa tahap, yakni pembentukan radikal bebas dari inisiator, inisiasi pada rantai utama selulosa, dan tahap kopolimeriasi yang mencakup propagasi (penumbuhan) rantai monomer dan penautan-silang (Lampiran 3) (Cowd 1991). Radikal sulfat SO4
-• dihasilkan dari inisiator
APS yang terdekomposisi saat pemanasan pada suhu 60 C (da Silva et al. 2007). Radikal tersebut selanjutnya menginisiasi pembentukan radikal selulosa dengan menyerang atom H pada –OH di posisi C6 yang merupakan tapak paling reaktif dari selulosa karena halangan sterik yang rendah (Achmadi 1990).
Tahap inisiasi rantai polimer menghasilkan makroradikal selulosa. Makroradikal selulosa kemudian menyerang ikatan rangkap C=C pada akrilamida membentuk kopolimer selulosa-O-CH-CH•-CONH2. Atom radikal
yang baru terbentuk lebih lanjut akan menyerang gugus C=C pada akrilamida berikutnya secara berkelanjutan hingga membentuk rantai cangkok yang panjang.
Radikal C• tersebut juga dapat menyerang
gugus C=C pada penaut-silang MBA hingga terjadi taut-silang di antara kopolimer-kopolimer tersebut (Silvianita et al. 2004).
Ketiga kopolimer selulosa-g-akrilamida dicirikan dengan pengujian kadar N (Lampiran 4) dan daya adsorpsi air (Lampiran 5). Penentuan kadar N menggunakan metode Kjeldahl dengan tahap destruksi, distilasi, dan titrasi. Pada tahap destruksi, asam sulfat pekat mendestruksi sampel menjadi unsur-unsurnya. Senyawa organik terdestruksi menjadi CO, CO2 dan H2O, sedangkan unsur nitrogen akan
berubah menjadi amonium sulfat yang selanjutnya dipecah menjadi NH3 pada tahap
distilasi. NH3 yang terbentuk selanjutnya
ditangkap oleh asam borat dan dititrasi dengan HCl.
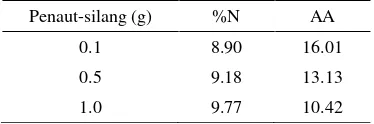
Berdasarkan hasil uji Kjeldahl pada Tabel 3, kadar N meningkat seiring dengan meningkatnya jumlah penaut-silang yang
digunakan untuk jumlah monomer yang sama. Kadar N meningkat karena penaut-silang MBA mengandung gugus amida.
Tabel 3 Hasil uji kadar N dan daya adsorpsi air (AA)
Penaut-silang (g) %N AA
0.1 8.90 16.01
0.5 9.18 13.13
1.0 9.77 10.42
Daya adsorpsi air (AA) juga berhubungan dengan jumlah penaut-silang yang digunakan. Selulosa yang tercangkok dan tertaut-silang akan membentuk rongga dan berstruktur tiga dimensi. Menurut Lanthong et al. (2006), penaut-silang yang semakin banyak akan semakin meningkatkan kekuatan gel dan menurunkan kapasitas penyerapan air, karena kekakuan rantai menurunkan tekanan osmosis gel tersebut. Semakin banyak penaut-silang digunakan, rongga yang terbentuk akan semakin kecil. Uji kapasitas menyerap air menunjukkan bahwa polimer dengan penaut-silang terbanyak akan paling sedikit menyerap air, karena ruang yang tersedia untuk bisa diisi dengan air semakin sempit.
Secara keseluruhan, kopolimer dengan penaut-silang sebanyak 0.1; 0.5 dan 1.0 g memiliki kemampuan mengadsorpsi air berturut-turut sebanyak 16, 13, dan 10 kali dari bobot awalnya. Hasil ini sejalan dengan perubahan kepolaran tiap kopolimer tersebut. Semakin banyak penaut-silang yang digunakan, kepolaran akan semakin menurun kepolarannya karena gugus hidroksil pada selulosa semakin banyak tersubstitusi oleh monomer akrilamida. Hal ini menurunkan kemampuannya dalam menyerap air.
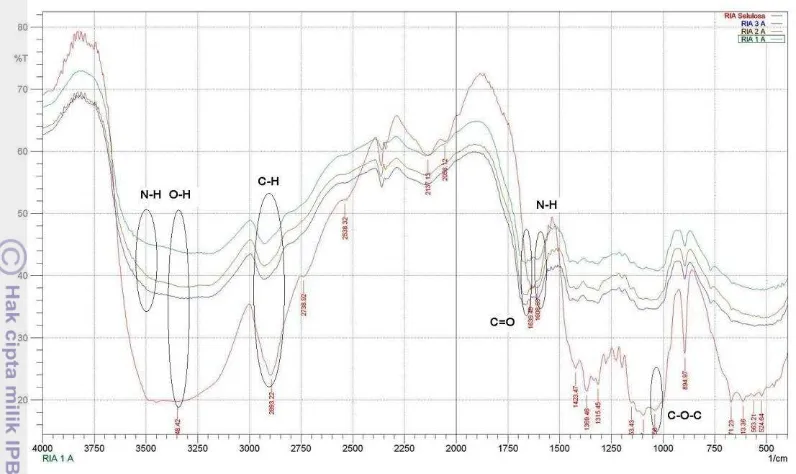
Keberhasilan tahap sintesis selain ditunjukkan oleh kadar N dan daya adsorpsi air, juga dibuktikan dengan analisis FTIR terhadap isolat selulosa dan kopolimer selulosa-g-poliakrilamida (Gambar 1). Spektrum FTIR isolat selulosa menunjukkan absorpsi ulur O-H di daerah bilangan gelombang 3550─3200 cm-1 dan ulur C-H pada 2930 cm-1. Sementara serapan kuat pada 1041.56 cm-1 mengindikasikan ikatan C-O-C yang merupakan ciri selulosa (Lanthong et al.
2006).
Gambar 1 Spektrum FTIR isolat selulosa (---), selulosa-g-poliakrilamida dengan penaut-silang 0.1 g (---), 0.5 g (---) dan 1.0 g (---).
yang khas untuk –CONH2 dalam akrilamida.
Hasil tersebut membuktikan telah terjadinya pencangkokan akrilamida pada selulosa. Gugus OH pada isolat selulosa terbaca dari absorpsi ulur pada bilangan gelombang 3348.42 cm-1. Setelah pencangkokan, serapan N-H tidak terlalu jelas terlihat, tetapi terlihat adanya pergeseran serapan dari O-H ke N-H pada bilangan gelombang 3278.99 cm-1.
Kromatografi
Selulosa-g-poliakrilamida hasil sintesis diaplikasikan sebagai fase diam kromatografi kolom. Sebagai syarat utama menjadi fase diam, dilakukan uji daya tahan terhadap berbagai pelarut (Lampiran 6). Diujikan pelarut dari polar hingga nonpolar seperti metanol, etanol, aseton, etil asetat, toluena, dan heksana. Pelarut terbaik adalah yang paling sedikit dan bahkan tidak bereaksi sama sekali dengan fase diam, dilihat dari indeks biasnya menggunakan refraktometer (Tabel 4).
Tabel 4 Indeks bias fase diam dalam berbagai pelarut
Pelarut Blangko 0.1 g 0.5 g 1.0 g
Toluena 1.4919 1.4923 1.4924 1.4924
Heksana 1.3766 1.3768 1.3766 1.3774
EtOAc 1.3699 1.3699 1.3699 1.3698
Aseton 1.3566 1.3561 1.3567 1.3561
Metanol 1.3272 1.3276 1.3272 1.3272
Etanol 1.3602 1.3599 1.3606 1.3596
Berdasarkan hasil uji pada Tabel 4, metanol, heksana, dan etil asetat merupakan pelarut terbaik karena fase diam yang telah 3 hari dimaserasi dengan pelarut tersebut menunjukkan indeks bias tidak jauh berbeda dengan indeks bias blangko pelarut. Pelarut terbaik inilah yang digunakan sebagai eluen untuk aplikasi fase diam tersebut ke kromatografi kolom.
Toluena tidak dapat dijadikan sebagai eluen karena perbedaan indeks bias awal dan akhirnya cukup jauh. Toluena merupakan molekul nonpolar, tetapi pada strukturnya ada gugus benzena yang jika didekati molekul polar, dalam hal ini adalah kopolimer selulosa-g-poliakrilamida, terjadi induksi kepolaran dari ikatan rangkap terkonjugasi yang dimiliki toluena. Interaksi dengan fase diam tersebut membuat indeks biasnya naik cukup jauh. Etanol dan aseton juga tidak dapat digunakan sebagai eluen karena kedua pelarut tersebut memberikan perbedaan indeks bias yang cukup besar terhadap blangko. Kemungkinan masih terdapat sisa homopolimer yang larut dalam etanol dan aseton.
7
dengan cara basah menggunakan eluen heksana. Selain heksana, etil asetat, dan metanol, gradien eluen digunakan agar diperoleh pemisahan yang baik, yakni heksana:etil asetat (90:10, 75:25, 50:50, 25:75). Eluat ditampung dalam vial sebanyak masing-masing 5 mL.
Teknik pemisahan kromatografi berdasarkan mekanisme retensinya dibagi menjadi 4 macam, yakni partisi, adsorpsi, eksklusi, dan pertukaran ion. Kromatografi adsorpsi didasarkan pada kemampuan fase diam dalam mengadsorpsi analit. Xantorizol merupakan salah satu komponen aktif pada ekstrak temu lawak dan dilihat dari strukturnya (Gambar 2) bersifat nonpolar. Hal ini berkebalikan dengan sifat fase diam yaitu polar, karena pada kopolimer banyak terdapat gugus –NH2 yang menambah
kepolaran sehingga mampu mengadsorpsi senyawa polar pada komponen ekstrak temu lawak melalui interaksi ikatan hidrogen. Karena itu, xantorizol akan kurang berinteraksi dengan fase diam, dan dengan elusi menggunakan eluen nonpolar seperti heksana, diperkirakan xantorizol muncul di fraksi pertama heksana.
Gambar 2 Struktur xantorizol.
Setiap fraksi dari masing-masing eluen pada kromatografi kolom diaplikasikan ke KLT, yaitu fraksi heksana, heksana:etil asetat (90:10), heksana:etil asetat (75:25), heksana:etil asetat (50:50), heksana:etil asetat (25:75), etil asetat, dan metanol. Penotolan dilakukan sebanyak 20 kali untuk tiap-tiap fraksi dan standar xantorizol 2% di atas pelat gel silika GF254. Elusi dilakukan menggunakan eluen heksana:etil asetat (10:1), dan didapatkan bahwa xantorizol berada pada fraksi heksana, karena hanya pada fraksi tersebut muncul noda di bawah sinar UV 254 nm. Xantorizol merupakan minyak atsiri temu lawak yang termasuk ke dalam golongan seskuiterpena yang tidak berwarna. Sifat tersebut membuatnya tidak dapat dideteksi pada daerah tampak, tetapi di daerah UV. Hal tersebut dibuktikan dengan perhitungan λmaks xantorizol. Xantorizol
memiliki λmaks sekitar 220 nm yang berada
dalam daerah UV dekat (200–380 nm) (Creswell et al. 2005).
Standar xantorizol pada TLC memberikan nilai Rf sebesar 0.17. Fraksi heksana hasil kolom dengan penaut-silang 0.1 g (Lampiran 7) menghasilkan 3 noda yang salah satu Rf -nya 0.17 sama dengan standar xantorizol. Hal ini menunjukkan bahwa fraksi tersebut mengandung xantorizol yang terpisahkan dari ekstrak kasar temu lawak melalui kromatografi kolom. Fraksi heksana hasil kolom dengan penaut-silang 0.5 dan 1.0 g juga menghasilkan 3 noda yang salah satunya memiliki Rf 0.18, mendekati Rf standar xantorizol. Hal ini membuktikan bahwa ketiga kolom, dengan variasi penaut-silang pada fase diamnya, dapat memisahkan xantorizol dari ekstrak kasar temu lawak.
Setiap fraksi pertama eluat heksana dari kromatografi kolom selanjutnya dianalisis dengan HPLC untuk membuktikan keberadaan xantorizol. Standar xantorizol 0.29% digunakan sebagai pembanding dengan waktu retensi 4.264 menit.
Pendekatan analisis kualitatif HPLC ialah dengan membandingkan waktu retensi zat terlarut dengan waktu retensi baku senyawa yang sudah diketahui, dalam hal ini adalah larutan standar xantorizol pada kondisi yang sama (Gritter et al. 1991). Kromatogram yang didapatkan dari ketiga fraksi eluat heksana (Lampiran 8), memperlihatkan keberadaan xantorizol berdasarkan kedekatan waktu retensi terhadap standar. Pemisahan terbaik didapatkan pada fraksi dari kolom dengan penaut-silang sebesar 0.5 g, karena pada kromatogram terlihat jelas puncak xantorizol terpisah dari puncak yang lainnya dengan resolusi 1.681 dan waktu retensinya 4.887.
Penaut-silang digunakan untuk menciptakan rongga pada kopolimer cangkok sehingga pemisahan yang terjadi di kolom bisa juga berdasarkan besarnya molekul. Molekul-molekul dengan ukuran yang lebih besar akan tertahan lebih lama di dalam kolom dibandingkan dengan molekul yang berukuran lebih kecil.
SIMPULAN DAN SARAN
Simpulan
Sintesis dan aplikasi selulosa-g -poliakrilamida sebagai fase diam kromatografi kolom dari serabut ampas sagu telah berhasil dilakukan. Isolasi selulosa yang dilakukan berhasil menghilangkan lignin hingga tersisa 0.37%. Sintesis dengan variasi jumlah peanut-silang menggunakan teknik cangkok-taut-silang memberikan hasil daya adsorpsi air yang menurun seiring dengan peningkatan jumlah peanut-silang yang digunakan. Aplikasi selulosa-g -poliakrilamida sebagai fase diam kromatografi kolom memberikan pemisahan terbaik untuk xantorizol dari ekstrak temu lawak pada penaut-silang 0.5 g. Xantorizol berada pada fraksi heksana dari kromatografi kolom yang dibuktikan dengan TLC dan HPLC.
Saran
Aplikasi lain dari selulosa-g -poliakrilamida sebagai fase diam kolom dapat dilakukan juga untuk memisahkan kelompok kurkuminoid dan juga senyawa lainnya. Analisis morfologi permukaan kopolimer cangkok juga diperlukan untuk mengetahui ukuran pori dari selulosa-g-poliakrilamida.
DAFTAR PUSTAKA
Achmadi SS. 1990. Kimia Kayu. Bogor: IPB Press.
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medicinal plants: Antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55:230-235.
Behari K, Pandey PK, Kumar R, Taunk K. 2001. Graft copolymerization of acrylamide onto xanthan gum. Carbohydr Polym 46: 185-189.
Creswell CJ, Runquist OA, Campbell MM. 2005. Analisis Spektrum Senyawa Organik. Padmawinata K, penerjemah. Bandung: Penerbit ITB. Terjemahan dari:
Spectrum Analysis of Organic Compound. An Introductory Programmed Text.
Crini G. 2005. Recent development in polysaccharide-based materials used as adsorbents in wastewater treatment.
Polymer Sci 30:38-70.
Cowd MA. 1991. Kimia Polimer. Firman H, penerjemah. Bandung: ITB. Terjemahan dari: Polymer Chemistry.
Darusman LK, Djauhari E, Nurcholis W. 2006. Kandungan xantorizol temu lawak (Curcuma xanthorrizha Roxb.) pada berbagai cara budi daya dan masa tanam. Di dalam: Peranan Kimia Memacu Kemajuan Industri. Prosiding Seminar Nasional Himpunan Kimia Indonesia. Bogor, 12 September 2006. Bogor: Auditorium Rektorat IPB Darmaga. Hlm 279-287.
da Silva DA, de Paula RC, Fitosa J. 2007. Graft copolymerization of acrylamide onto cashew gum. European Polym J 43:2620-2629.
Enomoto-Rogers Y, Kamitakahara H, Nakayama K, Takano T, Nakatsubo F. 2009. Synthesis and thermal properties of poly(methyl methacrylate)-graft-(cellobiosylamine-C15). Cellulose 16:519-530.
Gritter RJ, Robbit JM< SChawrting AE. 1991. Pengantar kromatografi. Padmawinata K, penerjemah. Bandung: Penertbit ITB. Terjemahan dari: Introduction to Chromatography.
Hwang JK, Shim JS, Pyun YR. 2000. Antibacterial activity of xanthorrhizol from Curcuma xanthorriza against oral pathogens. Fitoterapia 71:321-323. Irfana L. 2010. Asetilasi selulosa ampas sagu
dengan katalis I2 dan aplikasinya sebagai
fase diam kromatografi kolom [skripsi] Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kiat LJ. 2006. Preparation and characterization of carboxymethyl sago waste and it’s hydrogel [tesis]. Malaysia: Master of Science, Universiti Putra Malaysia.
Kumaran S, Sastry CA, Vikineswary S. 1997. Laccase, cellulase, and xylanase activities during growth of Pleurotus sajor-caju on sago hampas. World J Microbiol Biotechnol 13:43-49.
9
Lanthong P, Nuisin R, Kiatkamjornwong S. 2006. Graft copolymerization, characterization, and degradation of cassava starch-g-acrylamide/itaconic acid superabsorbents. Carbohydr Polym
66:229-245.
Li A, Zhang J, Wang A. 2007. Utilization of starch and clay for the preparation of superabsorbent composite. Biores Technol
98:327-332.
Liang R, Yuan H, Xi G, Zhou Q. 2009. Synthesis of wheat straw-g-poly(acrylic acid) superabsorbent composites and release of urea from it. Carbohydr Polym
77:181-187.
Lipka E, Descamps C, Vaccher C, Bonte JP. 2005. Reversed-phase liquid chromato-graphic separation, on cellulose chiral stationary phases, of the stereoisomers of methoxytetrahydronaphtalene derivatives, New agonist and antagonist ligands for melatonin receptors. Chromatographia
61:143-149.
Matitaputty PR, Alfons JB. 2006. Inovasi teknologi pakan berbahan dasar “ela sagu” untuk ternak. Di dalam: Revitalisasi Pertanian Maluku. Prosiding Lokakarya Sagu. Ambon, 29-31 Mei 2006. Ambon: Fakultas Pertanian Universitas Pattimura. Hlm 100-106.
Princi E, Vicini S, Proietti N, Capitani D. 2005. Grafting polymerization on cellulose based textiles: A 13C solid state NMR characterization. European Polym J
41:1196-1203.
Shimizu T, Miyazaki A, Saitoh I. 1980. Thin-layer chromatography of inorganic ions phosphate on cellulose in acetic acid and in acetic acid-amonium acetate media.
Chromatographia 13:119-121.
Shimizu T, Hirata H, Nakajima K. 1989. Thin layer chromatographic behavior of a number of metals on carboxymethyl-cellulose in sulfuric acid and ammonium sulfate media. Chromatographia 28:620-622.
Silvianita S, Nurmutia I, Sulistio A, Kurniawan F, Sumarno. 2004. Kopolimerisasi dari poliakrilamida pada pati dengan metode grafting. Di dalam: Prosiding Seminar Nasional Rekayasa Kimia dan Proses; Semarang, 21-22 Apr 2004. Surabaya: Institut Teknologi Sepuluh November.
Singhal RS, Kennedy JF, Gopalakrishnan SM, Kaczmarek A, Knill CJ, Akmar PF. 2008. Industrial production, processing, and utilization of sago palm-derived products. Carbohydrat Polym 72: 1-20.
Su-lian G, Ning-guo Z, Xiu-zhen Z, Wei Z. 2007. Interfacial properties of ethyl cellulose/cellulose acetate blends by HPLC. Chinese J Proc Eng 7:152-154. Sun RC, Jones GL, Tomkinson J, Bolton J.
1998. Fractional isolation and partial characterization of non-starch polysaccharides and lignin from sago pith.
Industrial Crops and Products 19:211-220.
Ulia H. 2007. Alternatif penggunaan hidrogen peroksida pada tahap akhir proses pemutihan pulp [tesis]. Medan: Fakultas Teknik Kimia, Universitas Sumatera Utara. Yokoyama T, Matsumoto Y. 2002. Enhancement of the reaction between pulp components and hydroxyl radical produced by the decomposition of hydrogen peroxide under alkaline conditions. J Wood Sci
11
Lampiran 1 Diagram alir penelitian
Serabut Analisis Proksimat:
Ampas sagu Kadar -selulosa, holoselulosa, lignin.
Pulping
Analisis proksimat:
Isolasi Delignifikasi Kadar -selulosa, holoselulosa,
selulosa lignin.
Isolat selulosa Analisis FTIR
Cangkok-taut-silang
MBA: 0.1; 0.5; 1.0 g
Sintesis
Pencucian gel Analisis FTIR
Uji daya absorpsi air
Selulosa-g-poliakrilamida Uji kadar nitrogen
Uji daya tahan terhadap
berbagai pelarut
Kromatografi kolom
Kromatografi *) Kromatografi lapis tipis
Kromatografi cair kinerja tinggi
Lampiran 2 Hasil analisis proksimat selulosa sebelum dan setelah isolasi
Analisis
Sebelum isolasi (%)
Setelah isolasi (%)
Lignin
31.09
0.37
Holoselulosa
70.63
93.57
α
-Selulosa
41.47
86.79
Perlakuan
Gambar
Rendemen (%)
Hidrolisis HCl
60
Pulping NaOH
50
Delignifikasi
70
13
Lampiran 3 Mekanisme reaksi kopolimerisasi
Tahap inisiasi
O S O
O
O
O S O
O O
NH4+
NH4
+
O S O
O
O
NH4+
2
Amonium peroksidisulfat
O S O
O
O
NH4+
O H OH H O CH2 H OH H O OH O OH H O CH2 H OH H O O
O S OH
O
O
NH4+
Selulosa
Tahap propagasi
O OH H O CH2 H OH H O O CH NH2 O H2CO OH H O CH2 H OH H O O HC NH2 O H2C
Akrilamida O OH H O CH2 H OH H O O CH NH2 O
H2C
HC NH2 O CH2 CH NH2 O
H2C
O OH H O CH2 H OH H O O HC NH2 O CH2 O OH H O CH2 H OH H O O CH NH2 O H2C
HC NH2
O CH2
CH
NH2
O H2C
n O OH H O CH2 H OH H O O CH NH2 O CH2 CH NH2 O CH2 HC NH2 O
Tahap terminasi
O H OH H OH2C
H OH H O O H H OH H OH CH2 H H O O H OH H
H2C
H OH H H O O H H OH O H OH CH2 H O O O O O H OH H O
H2C
H OH H O O H H OH H OH CH2 H H O O H OH H
H2C
H OH H H O O H H OH O H OH CH2 H O O O O CH
H2N
O
H2C
CH
H2N
O
H2C
CH
H2N
O CH2
n
CH
H2N
O
H2C
CH
H2N
O
H2C
CH
H2N
O CH2
n
CH
NH2
O
H2C
CH
NH2
O
H2C
HC
NH2
O
H2C n
CH
NH2
O
H2C
CH
NH2
O
H2C
HC
NH2
O
H2C
n C H C N H O
H2C
H2 C N H C C H O CH2 N,N'-Metilena-bis-akrilamida O H OH H OH CH2 H OH H O O H H HO H OH CH2 H H O O H OH H CH2 H OH H H O O H H HO H OH CH2 H O O O O CH H2N
O CH2
n
CH H2N
O H2C
n
H2C
CH2
H2C
CH2 O H HO H CH2 H OH H O O H H OH H OH CH2 H H O O H HO H CH2 H OH H H O O H H OH HO H OH CH2 H O O O O HC NH2 O CH2 n CH NH2 O CH2 n
H2C
C HN O CH2 HN C H2C
O
H2C
C HN O CH2 HN C H2C
O O O H OH H CH2 H OH H H O O H H HO OH H OH CH2 H O O CH H2N
O H2C
n CH2 CH2 O H HO H OH CH2 H OH H O O H H OH H OH CH2 H H O O O HC NH2 O CH2 n
H2C
C HN O CH2 HN C H2C
O
H H
H H
15
Lampiran 4 Hasil uji kadar N
Penaut-silang
Bobot (g)
HCl terpakai (mL)
%N
0.1 g
0.1027
6.40
8.90
0.5 g
0.1012
6.55
9.18
1.0 g
0.1031
7.10
9.77
Contoh perhitungan:
Lampiran 5 Hasil uji daya adsorpsi air
Penaut-silang
Bobot polimer (g)
Bobot polimer+air (g)
KA
0.1 g
0.1018
1.7313
16.01
0.5 g
0.1002
1.4158
13.13
1.0 g
0.1012
1.1556
10.42
Contoh perhitungan:
17
Lampiran 6 Indeks bias hasil uji daya tahan berbagai pelarut
Penaut-silang 0.1 g 0.5 g 1.0 g
Pelarut Awal Akhir Selisih Awal Akhir Selisih Awal Akhir Selisih
Toluena 1.4919 1.4923 0.0004 1.4919 1.4924 0.0005 1.4919 1.4924 0.0005 1.4918 1.4921 0.0003 1.4918 1.4923 0.0005 1.4918 1.4922 0.0004
Heksana 1.3766 1.3768 0.0002 1.3766 1.3766 0.0000 1.3766 1.3774 0.0008 1.3766 1.3768 0.0002 1.3766 1.3766 0.0000 1.3766 1.3774 0.0008
Etil asetat 1.3699 1.3700 0.0001 1.3699 1.3699 0.0000 1.3699 1.3698 0.0001 1.3699 1.3699 0.0000 1.3699 1.3699 0.0000 1.3699 1.3697 0.0002
Metanol 1.3272 1.3276 0.0004 1.3272 1.3273 0.0001 1.3272 1.3272 0.0000 1.3272 1.3276 0.0004 1.3272 1.3272 0.0000 1.3272 1.3271 0.0001
Etanol 1.3602 1.3599 0.0003 1.3602 1.3606 0.0004 1.3602 1.3596 0.0006 1.3601 1.3598 0.0003 1.3601 1.3604 0.0003 1.3601 1.3594 0.0007
Lampiran 7 Kromatogram lapis tipis
Bercak Eluat Rf1 Rf2 Rf3
1 standar xantorizol 0.17 - -
2 fraksi heksana, penaut-silang 0.1 g 0.13 0.17 0.30 3 fraksi heksana : etil asetat 90:10, penaut-silang 0.1 g - - -
4 fraksi heksana : etil asetat 75:25, penaut-silang 0.1 g - - - 5 fraksi heksana : etil asetat 50:50, penaut-silang 0.1 g - - -
6 fraksi heksana : etil asetat 25:75, penaut-silang 0.1 g - - -
7 fraksi etil asetat, penaut-silang 0.1 g - - - 8 fraksi metanol, penaut-silang 0.1 g - - -
9 fraksi heksana, penaut-silang 0.5 g 0.13 0.18 0.29
10 fraksi heksana : etil asetat 90:10, penaut-silang 0.5 g - - - 11 fraksi heksana : etil asetat 75:25, penaut-silang 0.5 g - - -
12 fraksi heksana : etil asetat 50:50, penaut-silang 0.5 g - - - 13 fraksi heksana : etil asetat 25:75, penaut-silang 0.5 g - - -
14 fraksi etil asetat, penaut-silang 0.5 g - - -
15 fraksi metanol, penaut-silang 0.5 g - - - 16 fraksi heksana, penaut-silang 1.0 g 0.13 0.18 0.29
17 fraksi heksana : etil asetat 90:10, penaut-silang 1.0 g - - -
18 fraksi heksana : etil asetat 75:25, penaut-silang 1.0 g - - - 19 fraksi heksana : etil asetat 50:50, penaut-silang 1.0 g - - -
20 fraksi heksana : etil asetat 25:75, penaut-silang 1.0 g - - -
21 fraksi etil asetat, penaut-silang 1.0 g - - - 22 fraksi metanol, penaut-silang 1.0 g - - -
23 ekstrak kasar temu lawak 0.13 0.18 0.39
19
Lampiran 8 Kromatogram cair kinerja tinggi
Ekstrak kasar temu lawak
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 1.036 4171008 2.276 0.833 1.183 0.000
2 1.406 7041001 3.841 1.183 1.542 1.036
3 1.612 3167237 1.728 1.542 1.758 0.335
4 1.983 6573040 3.586 1.758 2.050 0.432
5 2.099 5908352 3.223 2.050 2.383 0.138
6 2.796 9611061 5.243 2.383 3.008 0.831
7 3.279 4352375 2.374 3.142 3.483 0.494
8 3.573 2691880 1.469 3.483 3.733 0.276
9 4.023 7100059 3.874 3.733 4.133 0.541
10 xantorizol 4.378 36009860 19.646 4.133 4.558 0.790
11 4.766 64962820 35.441 4.558 8.750 1.005
12 7.888 2598440 1.418 7.617 8.075 7.525
13 8.230 2160386 1.179 8.075 8.750 0.769
14 9.217 20062875 10.945 8.750 9.858 2.118
15 10.176 2026165 1.105 9.858 10.708 1.733
16 11.382 2698087 1.472 11.050 12.033 2.017
lanjutan Lampiran 8
Standar xantorizol
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 2.357 4100300 10.002 2.100 2.700 0.000
21
lanjutan Lampiran 8
Fraksi 1 heksana, penaut-silang 0.1 g
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 1.499 1376032 2.401 1.100 1.692 0.664
2 1.916 1492616 2.604 1.692 2.017 0.518
3 2.082 705632 1.231 2.017 2.175 0.395
4 2.278 1037642 1.810 2.175 2.350 0.457
5 2.389 684543 1.194 2.350 2.483 0.194
6 2.861 6117564 10.672 2.608 3.158 0.374
7 3.368 746137 1.302 3.300 3.517 0.147
8 3.670 5484079 9.567 3.517 3.858 0.534
9 Xantorizol 4.053 25922039 45.222 3.858 8.708 1.453
10 5.809 1307956 2.282 5.567 6.317 5.826
11 9.172 6395111 11.157 8.708 9.858 4.948
12 10.279 1224173 2.136 9.858 10.883 1.945
13 12.305 673227 1.174 11.917 12.583 0.243
lanjutan Lampiran 8
Fraksi 2 heksana, penaut-silang 0.1 g
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 0.961 193701 7.519 0.758 1.158 0.000
2 1.484 280798 10.889 1.158 1.675 1.298
3 2.333 113729 4.415 2.208 2.567 2.532
4 Xantorizol 4.045 428381 16.628 3.800 4.675 7.075
5 4.946 260431 10.109 4.675 6.567 0.902
6 7.041 215536 8.366 6.567 7.442 2.015
23
lanjutan Lampiran 8
Fraksi 1 heksana, penaut-silang 0.5 g
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 1.384 548664 1.665 1.250 1.550 1.064
2 2.002 818271 2.484 1.733 2.150 0.780
3 2.433 519478 1.577 2.308 2.517 0.617
4 2.566 339659 1.031 2.517 2.658 0.327
5 2.955 459704 1.395 2.825 3.000 0.310
6 3.152 3140615 9.533 3.000 3.375 0.341
7 3.466 446946 1.357 3.375 3.625 0.951
8 3.910 525591 1.595 3.625 4.042 0.729
9 4.293 3637552 11.041 4.042 4.617 0.656
10 Xantorizol 4.887 19529445 59.277 4.617 9.617 1.681
lanjutan Lampiran 8
Fraksi 2 heksana, penaut-silang 0.5 g
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 0.985 119934 4.477 0.817 1.133 0.000
2 1.461 297195 11.095 1.133 1.658 1.385
3 1.872 362151 13.520 1.658 2.158 1.327
4 2.305 157355 5.874 2.158 2.533 2.169
5 2.818 216077 8.067 2.533 3.125 2.269
6 Xantorizol 3.968 1394756 52.069 3.767 11.967 4.791
25
lanjutan Lampiran 8
Fraksi 1 heksana, penaut-silang 1.0 g
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 1.458 3647049 3.848 1.058 1.692 0.670
2 1.894 3255097 3.435 1.692 1.992 0.611
3 2.058 1742613 1.839 1.992 2.150 0.377
4 2.242 2119063 2.236 2.150 2.325 0.407
5 2.356 1144629 1.208 2.325 2.442 0.208
6 2.523 1363461 1.439 2.442 2.600 0.250
7 2.815 9885727 10.431 2.600 3.108 0.666
8 3.315 1368692 1.444 3.250 3.450 0.111
9 3.598 9408583 9.928 3.450 3.775 0.447
10 Xantorizol 3.958 33510149 35.360 3.775 8.492 1.275
11 5.667 1139605 1.203 5.442 6.150 5.452
12 8.936 18725424 19.759 8.492 9.658 8.760
13 9.996 1125161 1.187 9.658 10.467 2.000
14 11.955 1622923 1.713 11.533 12.258 0.102
lanjutan Lampiran 8
Fraksi 2 heksana, penaut-silang 1,0 g
Puncak Nama Waktu retensi Area % Area Puncak awal Puncak akhir Resolusi
1 0.972 162906 6.883 0.800 1.150 0.000
2 1.478 315348 13.324 1.150 1.658 1.348
3 1.867 103457 4.371 1.792 1.992 1.040
4 2.300 131690 5.564 2.133 2.492 1.832
5 3.122 173077 7.313 2.933 3.492 0.384
6 Xantorizol 3.960 1244183 52.568 3.725 6.192 0.386
7 7.312 236152 9.978 6.192 8.608 3.781
Konsentrasi xantorizol hasil fraksionasi
Xantorizol
Area
Konsentrasi (ppm)
Standar
34 165 238
2 900
Ekstrak kasar
36 009 860
3 056
Fraksi heksana 0.1
25 922 039
2 037
Fraksi heksana 0.5
19 529 445
1 535
Fraksi heksana 1.0
33 510 149
2 634
Contoh perhitungan:
Konsentrasi standar xantorizol yang digunakan 0.29%
[ antori ol]standar . 9 6 9 ppm
Perhitungan konsentrasi xantorizol hasil fraksinasi
[ antori ol]heksana . uas antori ol heksana . uas antori ol standar 9 ppm