PEMANFAATAN BAKTERI PROBIOTIK UNTUK
MENEKAN INFEKSI
Colletotrichum acutatum
DAN
MENINGKATKAN MUTU BENIH CABAI
(
Capsicum annuum
L.) SELAMA PENYIMPANAN
ANNA TEFA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Pemanfaatan Bakteri Probiotik untuk Menekan Infeksi Colletotrichum acutatum dan Meningkatkan Mutu Benih Cabai (Capsicum annuum L.) Selama Penyimpanan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2015
Anna Tefa
RINGKASAN
ANNA TEFA. Pemanfaatan Bakteri Probiotik untuk Menekan Infeksi
Colletotrichum acutatum dan Meningkatkan Mutu Benih Cabai (Capsicum annuum L.) Selama Penyimpanan. Dibimbing oleh ENY WIDAJATI, MUHAMAD SYUKUR dan GIYANTO.
Cabai merah (Capsicum annuum L.) adalah salah satu tanaman hortikultura yang mempunyai peranan penting di Indonesia. Salah satu penyakit yang menyerang pertanaman cabai adalah penyakit antraknosa. Penyakit ini disebabkan oleh cendawan genus Colletotrichum yaitu species Colletotrichum acutatum.
Penelitian ini bertujuan untuk memperoleh bakteri yang bersifat antagonis terhadap cendawan C. acutatum, meningkatkan mutu benih cabai melalui aplikasi
coating benih dan mengetahui kemampuan bakteri probiotik selama penyimpanan dan pembibitan untuk mengendalikan C. acutatum.
Penelitian ini terdiri atas dua percobaan. Percobaan pertama yaitu uji antagonis untuk memperoleh bakteri probiotik yang bersifat antagonis terhadap C. acutatum dengan metode biakan ganda (dual cultura). Pengujian percobaan pertama dilakukan di Laboratorium menggunakan Rancangan Acak Lengkap (RAL) satu faktor. Percobaan kedua yaitu efektivitas seed coating menggunakan bakteri probiotik terhadap viabilitas potensial, vigor dan kesehatan benih cabai. Pengujian percobaan kedua dilakukan di laboratorium dengan metode uji di atas kertas (UDK) dan pengujian di Rumah Kaca. Rancangan pada percobaan kedua adalah Rancangan Acak Lengkap (RAL) faktorial dengan dua faktor. Faktor pertama adalah perlakuan coating benih yang terdiri atas enam taraf yaitu kontrol,
coating benih tanpa bakteri, coating benih dengan bakteri Bacillus sp., coating
benih dengan Pseudomonas sp., coating benih dengan Actinomycetes sp., dan
coating benih dengan fungisida. Faktor kedua adalah periode simpan yang terdiri atas enam taraf yaitu 0, 1, 2, 3, 4 dan 5 bulan. Setiap periode simpan dilakukan pengujian.
Hasil penelitian menunjukkan bahwa terdapat tiga bakteri yang bersifat antagonis terhadap C. acutatum dilihat dari persentase penghambatan yang paling tinggi yaitu Actinomycetes sp. (ATS6) 56.8%, Bacillus sp. (B48) 56.7% dan
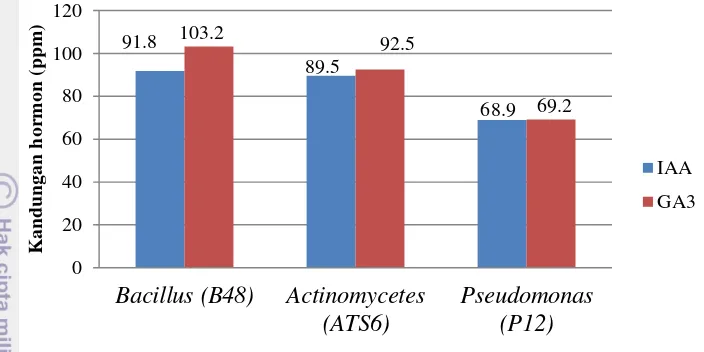
Pseudomonas sp. (P12) 46.7%. Aplikasi bakteri probiotik meningkatkan viabilitas dan kesehatan benih cabai pada periode simpan 5 bulan, pada tolok ukur potensi tumbuh maksimum 80-84%, daya berkecambah (DB) 76-78.7%, benih terinfeksi pada coating Actinomycetes sp. 2.67% dan Bacillus sp. 6.7% serta meningkatkan jumlah daun pada bibit cabai. Bacillus sp. mengandung indole acetic acid (IAA) 91.8 ppm dan giberelin (GA3) 103.2 ppm. Actinomycetes sp. mengandung 89.6 ppm IAA dan GA3 92.5 ppm, dan Pseudomonas sp. mengandung 68.9 ppm IAA dan GA3 69.2 ppm.
SUMMARY
ANNA TEFA.
Use of Probiotic Bacteria to Suppress Colletotrichum acutatum Infections and Improve Chilli (Capsicum annuum L.) Seeds Quality During Storage. Supervised by ENY WIDAJATI, MUHAMAD SYUKUR and GIYANTOChilli (Capsicum annuum L.) is one of important horticultural plant in Indonesia. One of diseases attacking chilli is anthracnose disease, caused by fungi from Colletotrichum genus namely Colletotrichum acutatum species. This research aimed to obtain antagonistic bacteria against C. acutatum, increase chilli seed quality through seed coating application and determine the ability of the probiotic bacteria during storage and nursery to control C. acutatum.
This research consisted of two experiment. The first experiment was antagonistic test to obtain probiotic bacteria against C. acutatum using dual-culture method. Testing of the first experiment was conducted in laboratory using single-factor completely randomize design. The second experiment was the efficacy of seed coating using probiotic on the potential viability, vigor and the health of chilli seed. Testing for the second experiment was conducted in Laboratory using top of paper method and testing in Green House. Design for the second experiment was factorial completely randomized design with two factor. The first factor was seed coating treatment consisting of six levels, i.e. control, seed coating without bacteria, seed coating with Bacillus sp. seed coating with
Pseudomonas sp. seed coating with Actinomycetes sp. and seed coating with fungicide. The second factor was storage period consisting of six level, i.e. 0, 1, 2, 3, 4 and 5 months. Testing was carried out for each storage period.
The result revealed that there were three antagonistic bacteria isolates against C. acutatum, seen from the highest percentage of inhibition, i.e. isolates of
Actinomycetes sp. (ATS6) 56.8%, Bacillus sp. (B48) 56.7% and Pseudomonas sp. (P12) 46.7%. Application of probiotic bacteria increased viability and the health of chilli seed for storage period of 5 months, seen from maximum growth potential 80-84%, germination capacity 76-78.7%, infected seeds in coating of
Actinomycetes sp. 2.6% and Bacillus sp. 6.7% in addition to increase of leaves chilli seedling. Bacillus sp. contained 91.8 ppm indole acetic acid (IAA) and 103.2 ppm giberelins (GA3), Actinomycetes sp. contained 89.6 ppm IAA and 92.5 ppm giberelin and Pseudomonas sp. contained 68.9 ppm IAA and 69.2 ppm giberelin.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu dan Teknologi Benih
PEMANFAATAN BAKTERI PROBIOTIK UNTUK
MENEKAN INFEKSI
Colletotrichum acutatum
DAN
MENINGKATKAN MUTU BENIH CABAI
(
Capsicum annuum
L.) SELAMA PENYIMPANAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas segala Karunia-Nya sehingga tesis ini berhasil diselesaikan dengan baik. Judul tesis ini adalah Pemanfaatan Bakteri Probiotik untuk Menekan Infeksi
Colletotrichum acutatum dan Meningkatkan Mutu Benih Cabai (Capsicum annuum L.) Selama Penyimpanan. Tesis ini menyumbang pengetahuan yang besar bagi saya khususnya dalam meningkatkan kesehatan benih cabai menggunakan bakteri probiotik.
Ucapan terima kasih penulis berikan kepada Ibu Dr Ir Eny Widajati, MS, Bapak Prof Dr Muhamad Syukur, SP, MSi dan Bapak Dr Ir Giyanto, MSi yang telah banyak membantu dan memberi saran kepada penulis. Penulis juga menyampaikan terimakasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) atas Beasiswa Pendidikan Pascasarjana (BPPS) yang telah penulis terima selama ini. Terimakasih juga penulis ucapkan kepada Rektor Universitas Timor yang telah membantu penulis dalam memberikan dana penelitian. Ungkapan terimakasih juga penulis sampaikan kepada Orang Tua, Suami serta seluruh keluarga atas doa, dukungan dan kasih sayangnya. Semoga tesis ini bermanfaat untuk kemajuan bidang pertanian di Indonesia.
Bogor, Maret 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
Colletotrichum acutatum Penyebab Penyakit Antraknosa 3
Bakteri Probiotik 4
Penyimpanan dan Coating Benih 5
3 METODE 6
Waktu dan Tempat 6
Sumber Benih 6
Metode Percobaan 6
Percobaan 1 6
Pelaksanaan Percobaan 7
Rancangan Percobaan 8
Percobaan 2 8
Pelaksanaan Percobaan 8
Rancangan Percobaan 9
Peubah Pengamatan 10
4 HASIL DAN PEMBAHASAN 14
5 SIMPULAN DAN SARAN 28
Simpulan 28
Saran 28
DAFTAR PUSTAKA 29
LAMPIRAN 34
DAFTAR TABEL
1 Pengaruh interaksi perlakuan coating dan periode simpan terhadap
PTM,DB dan KCT pada benih cabai 18
2 Pengaruh perlakuan periode simpan terhadap bobot kering kecambah normal (BKKN) (g) dan hipokotil terinfeksi (HT) (%) 20 3 Pengaruh perlakuan coating terhadap bobot kering kecambah normal
(BKKN) (g) dan hipokotil terinfeksi (%) 20
4 Pengaruh interaksi perlakuan coating dan periode simpan terhadap benih terinfeksi (%) dan populasi cendawan (cfu/g) 21 5 Pengaruh interaksi perlakuan coating dan periode simpan terhadap
kecepatan tumbuh (%KN/etmal) pada pengamatan di rumah kaca 23 6 Pengaruh perlakuan periode simpan terhadap tinggi tanaman (cm) umur
4 minggu setelah semai 24
7 Pengaruh interaksi perlakuan coating dan periode simpan terhadap
jumlah daun (helai) umur 4 minggu setelah semai 25 8 Pengaruh perlakuan coating terhadap hipokotil terinfeksi (%) di rumah
kaca 25
9 Pengaruh interaksi perlakuan coating dan periode simpan terhadap
kejadian serangan antraknosa (%) 26
10 Pengaruh perlakuan periode simpan terhadap rebah bibit (%) 27
DAFTAR GAMBAR
1 Skema uji antagonis 7
2 Bagan alir penelitian 13
3 Persentase uji antagonis bakteri probiotik terhadap C. acutatum 14 4 Uji antagonis terhadap C. acutatum yang ditandai adanya zona hambat
(tanda panah) (a) dan hifa C. acutatum yang mengalami lisis (tanda
panah) pembesaran 100x (b) 15
5 Benih cabai sebelum dicoating (a) dan benih cabai yang dicoating
dengan bakteri probiotik (b) 17
6 Hasil analisis kandungan IAA dan GA3 pada bakteri probiotik 19 7 Benih terinfeksi C. acutatum (a) dan konidia C. acutatum pembesaran
100x (b) 22
8 Hipokotil terinfeksi C. acutatum (a), rebah kecambah (b) dan mati
pucuk (c) 26
DAFTAR LAMPIRAN
1 Deskripsi Cabai Varietas Seloka IPB 34
2 Komposisi media TSA 36
3 Komposisi media King's B 36
4 Komposisi media YCED 36
5 Komposisi media PDA 36
1
PENDAHULUAN
Latar Belakang
Keberhasilan produksi tanaman di lapangan salah satunya ditentukan oleh mutu kesehatan atau patologis benih. Penggunaan benih bermutu rendah dan terinfeksi penyakit merupakan penyebab rendahnya produktivitas tanaman cabai (Capsicum annuum L.). Status kesehatan benih belum merupakan prioritas dalam manajemen perbenihan nasional. Penyakit terbawa benih atau tular benih (seed borne diseases) merupakan masalah utama dalam pertanaman karena dapat menurunkan produksi secara nyata (Siregar et al.2007).
Penyakit antraknosa merupakan penyakit terbawa benih dan dapat berkembang di penyimpanan. Serangan antraknosa dapat menyebabkan kerugian hasil hingga mencapai 75% (Bernadiknus & Wiranta 2006), oleh karena itu penyakit antraknosa dijadikan salah satu kriteria standar mutu benih cabai di Indonesia. Penyakit ini menyerang pertanaman di daerah tropis dan subtropis. Ivanovic (2007) mengatakan, penyakit antraknosa cepat berkembang dan menimbulkan kerugian yang parah terutama kondisi cuaca yang panas dan hujan yang berkepanjangan. Penyakit antraknosa disebabkan oleh cendawan genus
Colletotrichum. Menurut AVRDC (2004), Colletotrichum terdiri dari empat species utama yaitu Colletotrichum gloeosporioides, Colletotrichum capsici,
Colletotrichum acutatum dan Colletotrichum coccodes.
Di Indonesia, diketahui bahwa C. acutatum banyak menyerang tanaman cabai. Syukur et al. (2007) melakukan isolasi 13 isolat Colletotrichum yang dikoleksi dari Bogor, Brebes, Bandung, Pasir Sarongge, Payakumbuh dan Mojokerto. Hasil isolasi menunjukkan bahwa enam isolat yang berasal dari tujuh daerah tersebut merupakan C. acutatum. Hasil penelitian Syukur et al. (2013) tentang eksplorasi cendawan penyebab antraknosa di Pulau Sumatera, Jawa dan Papua, sebanyak 42 isolat dari 67 isolat adalah C. capsici dan 25 isolat adalah
C. acutatum/C. gloeosporioides.
Penggunaan agens hayati berupa aplikasi bakteri probiotik merupakan salah satu cara yang ditempuh untuk mengendalikan penyakit antraknosa. Menurut FAO & WHO (2001), probiotik adalah mikroorganisme hidup yang ketika digunakan dalam jumlah yang cukup dapat memberi kesehatan/manfaat untuk inangnya.
Bakteri probiotik memiliki kemampuan antagonis tinggi terhadap patogen, serta memiliki beberapa keuntungan yaitu tidak berdampak negatif pada lingkungan, mencegah ledakan organisme pengganggu tanaman sekunder, menghasilkan produk yang bebas residu senyawa kimia, aman bagi kesehatan manusia, terdapat disekitar pertanaman sehingga mencegah ketergantungan petani pada pestisida kimiawi sintesis serta dapat menurunkan biaya produksi. Kelemahan penggunaan agens hayati adalah reaksi efikasi terhadap jasad sasaran lebih lambat dan daya simpan produk lebih singkat dibandingkan dengan pestisida kimiawi sintesis (Hanudin & Marwoto 2012).
2
probiotik yang digunakan sebagai agens pengendali hayati antara lain Bacillus sp.,
Pseudomonas sp., dan Actinomycetes sp. Menurut Noviana & Raharjo (2009),
Bacillus sp. telah terbukti dapat melarutkan fosfat, yang berperan dalam pertumbuhan tanaman, sehingga bakteri ini dapat dimanfaatkan sebagai agen yang diinokulasikan dalam pupuk hayati. Actinomycetes diketahui menghasilkan antibiotik dan enzim kitinase yang dapat merusak dinding sel cendawan yang mengandung kitin (Mujoko et al. 2005). Sallytha et al. (2006) melakukan pengujian antibiosis terhadap Erwinia carotovora. Hasil pengujian menunjukkan bahwa isolat Actinomycetes memiliki sifat antagonis, ditunjukkan dengan terbentuknya zona penghambatan meskipun terdapat variasi diameter penghambatan pada masing-masing isolat.Hasil penelitian Handoko et al. (2014),
Bacillus sp. (UB-ABL1) dan Bacillus subtilis (UB-ABS1) efektif menghambat pertumbuhan Fusarium sp. secara in vitro. Hasil penelitian Gunawan (2006), tentang penggunaan mikroba antagonis menunjukkan bahwa biopestisida
Pseudomonas fluorescens PFMBO 001 50 WP dan Bacillus subtilis BSBE 001 50 WP dapat digunakan sebagai fungisida biologis untuk mengendalikan penyakit antraknosa pada cabai merah.
Berbagai metode pengendalian penyakit tanaman sangat bervariasi dari satu penyakit ke penyakit lainnya, tergantung dari jenis patogen, jenis inang dan interaksi antara keduanya. Berdasarkan keadaan ini, uji antagonis bakteri probiotik perlu dilakukan dalam rangka menemukan agens hayati baru yang berpotensi sebagai pengendali hayati penyakit tanaman yang ramah lingkungan. Bakteri probiotik yang potensial selanjutnya diaplikasikan melalui proses coating
benih untuk memperbaiki mutu dan mengurangi penyebaran penyakit antraknosa melalui benih selama penyimpanan.
Tujuan
1. Menguji isolat bakteri probiotik yang bersifat antagonis terhadap
C. acutatum;
2. Meningkatkan mutu benih cabai melalui proses coating benih;
3
Colletotrichum acutatum adalah patogen utama tanaman buah yang menyebabkan kerugian ekonomi besar terhadap buah-buahan pada iklim sedang,
tropis, dan sub-tropis di seluruh dunia. Colletotrichum acutatum dapat merusak
hampir semua bagian tanaman, mulai dari akar, daun, bunga, ranting, buah dan menyebabkan berbagai penyakit seperti busuk akar, mati pucuk, defoliasi, hawar
bunga, dan busuk buah. Ada dua jenis serangan Colletotrichum yang berbeda
yang menyerang buah yaitu yang menyebabkan penyakit pada buah yang belum matang dan masih berkembang di kebun (sebelum panen) dan yang merusak buah matang pada saat panen dan selama penyimpanan (pascapanen). Buah yang
dirusak oleh spesies Colletotrichum pasca panen sering tampak benar-benar sehat
ketika dipanen, dengan gejala penyakit yang hanya muncul ketika dalam masa
penyimpanan. Hal ini disebabkan oleh kemampuan banyak spesies Colletotrichum
untuk menyebabkan infeksi laten atau infeksi pasif dimana cendawan menginfeksi buah belum matang di kebunnya dan menjadi dorman sampai buah masak, kemudian cendawan tersebut melanjutkan pertumbuhannya untuk menyebabkan
penyakit pada buah tersebut. Di lapangan C. acutatum disebar oleh percikan air
hujan. Konidia sekunder dihasilkan dari perkecambahan konidia primer, bentuknya lebih kecil dan bervariasi. Proses penetrasi patogen khususnya cendawan pada benih dapat melalui luka-luka atau lubang-lubang alami maupun penetrasi langsung (direct penetration) ke permukaan kulit melalui pembentukan suatu badan khusus yang disebut appresoria (Wharton & Uribeondo 2004).
4
Bakteri Probiotik
Bakteri probiotik adalah bakteri baik yang menghasilkan efek kesehatan pada organisme lain atau inangnya. Bakteri probiotik menghasilkan metabolit yaitu asam organik, hidrogen peroksida, karbohidrat dan senyawa yang bersifat antimikroba terhadap patogen. Bakteri ini mampu mengikat senyawa racun hasil metabolisme protein dan lemak serta hasil pemecahan enzim tertentu. Probiotik juga merupakan bakteri hidup yang dapat diberikan sebagai suplemen makanan. Pemberian probiotik dapat berpengaruh menguntungkan bagi kesehatan karena probiotik dapat menghasilkan asam lemak rantai pendek sehingga menekan pertumbuhan patogen serta memperbaiki keseimbangan mikroba (Irianto 2003).
Menurut Hatmanti (2000), bakteri merupakan organisme yang mempunyai penyebaran terluas di alam. Hal tersebut karena bakteri mampu hidup pada berbagai habitat dan mampu menguraikan senyawa-senyawa yang lebih sederhana untuk memperoleh zat-zat tertentu yang dibutuhkan dalam rangka mempertahankan hidupnya. Selain itu bakteri merupakan organisme terpenting yang berperan dalam proses penguraian dan dekomposisi unsur hara. Kelompok bakteri yang termasuk probiotik antara lain Bacillus sp. Pseudomonas sp. dan
Actinomycetes sp. Bacillus sp.
Bacillus sp. ialah kelompok bakteri yang umum ditemukan di berbagai lingkungan ekologi, baik di tanah, air, maupun udara. Bakteri ini merupakan bakteri gram positif, dapat membentuk endospora yang berbentuk oval di bagian sentral sel. Spesies Bacillus sangat cocok digunakan karena mudah ditumbuhkan, tidak memerlukan substrat yang mahal, kemampuan Bacillus untuk bertahan hidup pada temperatur tinggi dan tidak adanya hasil samping metabolik (Sulistiani 2009).
Hasil penelitian Arwiyanto et al. (2007) tentang aktivitas Bacillus spp. sebagai agensia hayati penyakit lincat pada tembakau Temanggung menunjukkan bahwa tiga isolat Bacillus spp. yaitu Ba-4, Ba-22, dan Ba-24 mampu menghambat tiga isolat Ralstonia Solanacearum yang diuji. Penelitian Benny et al. (2013) menunjukkan bahwa dosis biofungisida Bacillus sp. (40 ml Bacillus sp. dalam 1 liter air/polibag) efektif menekan perkembangan jamur akar putih pada tanaman karet di pembibitan yaitu penurunan sampai pada intensitas serangan 20.8%. Hasil penelitian Nurjanani (2011) tentang pengendalian penyakit layu bakteri pada tanaman tomat menunjukkan bahwa dalam menekan intensitas penyakit layu bakteri, aplikasi Bacillus subtilis cenderung lebih baik dibanding Pseudomonas fluorescens GI-19 dan Trichoderma Viride serta nyata lebih baik daripada streptomisin sulfat 20%.
Pseudomonas sp.
5 dan perkembangan Fusarium oxysporum patogen penyakit layu pada pisang. Hasil penelitian Baharuddin et al. (2005), penggunaan Pseudomonas spp. kelompok
fluorescensdan “Effective Microorganisme 4” dapat menekan intensitas serangan
bakteri layu R. Solanacearum serta dapat meningkatkan pertumbuhan tanaman .
Actinomycetes sp.
Actinomycetes sp. menghasilkan enzim kitinase dan glukanase yang menyebabkan dinding sel cendawan tidak dapat tumbuh. Ambarwati et al. (2013) mengisolasi 17 isolat Actinomycetes sp., delapan isolat diantaranya mampu menghasilkan zat antibakteri, dan satu isolat diantara delapan isolat tersebut mampu menghambat pertumbuhan kedua bakteri uji yaitu NRPR 13 yang menghambat Salmonella typhosa dengan diammeter daerah hambatan 14 mm dan
Staphylococcus aureus 12 mm dan berdasarkan ciri koloni dan hasil pewarnaan gram, isolat Actinomycetes menunjukkan morfologi batang bercabang, warna ungu dan termasuk bakteri gram positif. Actinomycetes sp. merupakan anggota bakteri penghasil zat antimikrobial terbesar yaitu 85% dan hampir 2/3 anggotanya diketahui memproduksi antibiotik di dalam tanah. Nurkanto et al. (2012) berhasil melakukan penapisan aktivitas antimikroba dari Actinomycetes sp. yang diisolasi dari Raja Ampat, Papua Barat, Indonesia. Hasil penelitian menunjukkan beberapa ekstrak Actinomycetes sp. memiliki aktivitas anti bakteri gram negatif 1.5%, anti bakteri gram positif 17%, dan anti fungi 17%.
Penyimpanan dan Coating Benih
Penyimpanan benih dilakukan terhadap benih-benih yang tidak langsung digunakan setelah diproduksi dengan modifikasi ruang simpan sedemikian rupa agar benih bisa diperlambat kemundurannya. Selama penyimpanan, benih akan mengalami kemunduran. Besarnya laju kemunduran benih untuk setiap jenis benih berbeda-beda antara satu dengan yang lainnya. Menurut Justice & Bass (2002) proses oksidasi yang terjadi selama penyimpanan dapat memutuskan ikatan rangkap asam lemak tak jenuh sehingga menghasilkan radikal-radikal bebas yang dapat bereaksi dengan lipida lainnya sehingga menyebabkan rusaknya struktur membran sel.
Pelapisan benih dengan polimer (coating) merupakan salah satu pra-perlakuan penyimpanan yang dapat digunakan baik secara tunggal atau dalam kombinasi dengan pestisida lainnya untuk melindungi benih terhadap serangan hama dan penyakit. Coating benih merupakan pelapisan benih menggunakan material tertentu yang bertujuan untuk memperbaiki dan meningkatkan perkecambahan benih tanpa merubah bentuk dasar benih tersebut. Tujuan dari pelapisan ini adalah untuk mengaplikasikan manfaat dari suatu zat terhadap benih seperti mikroba antagonis, insektisida, fungisida, hara mikro dan komponen lainnya yang dapat membantu mengoptimalkan perkecambahan benih disemua kondisi lingkungan. Coating benih merupakan salah satu pendekatan yang paling ekonomis untuk meningkatkan kinerja benih (Copeland & Mc Donald 2001).
6
penelitian Manggung et al. (2014), perlakuan pelapisan benih kedelai dengan cendawan Mikoriza arbuskula (CMA) dapat mempertahankan viabilitas benih dan CMA selama penyimpanan 6 bulan baik pada suhu kamar maupun AC. Hasil penelitian Palupi et al. (2012), penampilan fisik benih padi lebih menarik setelah dicoating. Widajati et al. (2013) menggunakan isolat Methylobacterium spp. dan tepung curcuma pada perlakuan coating untuk meningkatkan daya simpan benih padi hibrida. Hasil penelitian menunjukkan benih yang dicoating masih memiliki viabilitas yang tinggi setelah penyimpanan 15 minggu untuk tiga varietas benih padi hibrida yaitu DG-1 SHS, SL-8 SHS dan Intnani-2. Penelitian Ilyas et al. (2015), tentang biomatriconditioning dengan Trichoderma harzianum atau
Trichoderma pseudokoningii dapat mengurangi tingkat infeksi C. capsici pada benih cabai dan meningkatkan persen perkecambahan dan indeks vigor.
3
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan di Laboratorium Fisiologi dan Kesehatan Benih Departemen Agronomi dan Hortikultura Fakultas Pertanian, Institut Pertanian Bogor (IPB) dan Rumah Kaca Cikabayan pada bulan September 2013 sampai dengan Juli 2014.
Sumber Benih
Benih yang digunakan adalah benih dari buah cabai varietas Seloka IPB yang merupakan hasil penanaman dari Kebun Percobaan Leuwikopo, IPB. Deskripsi varietas Seloka dapat dilihat pada Lampiran 1. Buah cabai ini dipanen pada bulan Juli 2013. Benih dipilih dari buah yang sehat, dikeringkan hingga kadar air 10.1%. Benih sebelum digunakan telah disimpan pada suhu AC 16 0C dengan kelembaban 70% selama empat bulan. Viabilitas awal adalah daya berkecambah 84.7%, indeks vigor 41.7% dan kecepatan tumbuh 11.4%.
Metode Percobaan
Penelitian ini terdiri atas dua percobaan. Percobaan pertama adalah uji antagonis bakteri probiotik terhadap C. acutatum. Percobaan kedua adalah efektivitas seed coating menggunakan bakteri probiotik terhadap viabilitas potensial, vigor dan kesehatan benih cabai selama penyimpanan.
Percobaan 1 : Uji antagonis bakteri probiotik terhadap cendawan
Colletotrichum acutatum.
Percobaan ini menggunakan 30 isolat bakteri yaitu 10 isolat dari genus
Bacillus sp., 10 isolat dari genus Pseudomonas sp., dan 10 isolat dari genus
7
Pelaksanaan Percobaan
Perbanyakan bakteri probiotik dan cendawan C. acutatum
Bakteri probiotik yang digunakan merupakan koleksi dari Laboratorium Bakteri, Departemen Proteksi Tanaman, IPB. Cendawan C. acutatum yang digunakan merupakan hasil isolasi Klinik Tanaman, Departemen Proteksi Tanaman, IPB.
Sebelum dilakukan penanaman, media dan cawan petri yang akan digunakan disterilisasi dalam autoclave pada suhu 121 0C dengan tekanan 1 atm selama 20 menit. Perbanyakan bakteri menggunakan metode gores dengan cara mengambil satu ose dari isolat bakteri kemudian digoreskan pada cawan yang berisi media khusus sesuai dengan karakteristik bakteri yang akan diuji, dan dilakukan secara aseptik di laminar air flow cabinet. Kelompok Bacillus sp. ditumbuhkan pada media tryptone soy agar (TSA), kelompok Pseudomonas sp.
ditumbuhkan pada media king’s B dan kelompok Actinomycetes sp. ditumbuhkan pada media casamino acid-yeast extract-glucose-agar (YCED). Colletotrichum acutatum diperbanyak pada media potato dextrose agar (PDA) (Atlas 2010). Komposisi media dapat dilihat pada Lampiran 2, 3, 4 dan 5. Setelah penanaman, cawan petri diseal dan diinkubasi pada suhu ruang 30 0C.
Uji antagonis
Uji antagonis dilakukan dengan metode biakan ganda (dual culture) yaitu menumbuhkan bakteri dan cendawan pada media PDA dalam cawan petri berdiameter 9 cm. Pembiakkan bakteri dilakukan terlebih dahulu untuk memicu pertumbuhan bakteri karena pertumbuhan bakteri cenderung lebih lambat daripada cendawan. Selanjutnya dilakukan penanaman cendawan dengan jarak cendawan dan bakteri adalah 3 cm (Gambar 1) (Muharni & Widjajanti 2011), kemudian diinkubasi pada suhu ruang 30 0C selama 14 hari. Selanjutnya dihitung persentase penghambatan dengan rumus :
ersentase engham atan
Keterangan :
R1 = panjang jari-jari cendawan yang menuju ke tepi cawan petri R2 = panjang jari-jari cendawan yang menuju ke koloni bakteri probiotik
8
Keterangan:
a : Isolat bakteri probiotik
b : Isolat cendawan C. acutatum
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) satu faktor, dengan tiga ulangan untuk tiap bakteri probiotik, sehingga seluruhnya terdapat 90 percobaan. Data persentase uji antagonis dianalisis dengan program statistical analysis sistem (SAS). Jika berpengaruh nyata, dilanjutkan dengan uji duncan multiple range test (DMRT). Hasil analisis percobaan ini, dipilih tiga bakteri yang paling tinggi persentase antagonisnya untuk dilanjutkan pada percobaan 2 dan dianalisis kandungan indole acetic acid (IAA) dan giberelin (GA3). Analisis IAA menggunakan spektrofotometer sedangkan GA3 menggunakan HPLC (High Performance Liquid
Chromatograph).
Percobaan 2 : Efektivitas seed coating menggunakan bakteri probiotik terhadap viabilitas potensial, vigor dan kesehatan benih cabai (Capsicum annuum L.) selama penyimpanan
Pelaksanaan Percobaan
Inokulasi Patogen pada Benih Cabai
Benih cabai yang akan digunakan sebelum inokulasi disterilisasi menggunakan larutan NaOCl 1 % selama 10 menit kemudian dibilas tiga kali dengan aquadest steril dan dikeringanginkan dalam laminar air flow cabinet
selama 1 jam. Benih steril kemudian direndam dalam suspensi C. acutatum
dengan kerapatan 106 konidia/ml (Nurhayati 2011), selama 30 menit, kemudian diinkubasi pada suhu ruang 30 0C dengan RH 56% selama empat hari untuk mencapai infeksi tertinggi. Pada hari ke-5 setelah inokulasi, benih dicoating dan disimpan sesuai perlakuan.
Teknik Coating pada Benih Cabai
9 Benih dimasukkan ke dalam suspensi sambil diaduk selama 20 menit hingga tercampur merata, lalu disaring dengan saringan teh untuk menghilangkan larutan yang tersisa (Setiowaty et al. 2007). Kemudian benih dikeringanginkan dalam
laminar air flow selama 24 jam. Untuk membedakan setiap perlakuan, diberikan pewarna makanan merk koepoe-koepeo dengan komposisi air, propilen glikol dan pewarna (eritrosin CI45432). Warna merah muda untuk perlakuan coating Pseudomonas sp., warna kuning untuk perlakuan coating Actinomycetes sp., warna hijau untuk perlakuan coating Bacillus sp., dan warna biru untuk perlakuan
coating fungisida.
Penyimpanan benih
Benih cabai yang telah dicoating dikemas dalam plastik polypropilen 0.8 mm sesuai perlakuan dan ulangan. Selanjutnya benih disimpan pada suhu kamar 30 ºC dengan RH 56% selama periode simpan 0, 1, 2, 3, 4 dan 5 bulan dengan kadar air benih 10.11%. Setiap bulan dilakukan pengujian viabilitas potensial, vigor, dan kesehatan benih di Laboratorium dan pengujian vigor bibit di Rumah Kaca.
Rancangan Percobaan
Percobaan ini menggunakan metode Rancangan Acak Lengkap (RAL) pola faktorial dengan dua faktor. Faktor pertama adalah perlakuan coating benih (C) yang terdiri atas 6 perlakuan yaitu C0 = tanpa coating (kontrol) C1= coating benih tanpa bakteri, C2 = coating benih dengan Bacillus sp. C3 = coating benih dengan
Pseudomonas sp. C4 = coating benih dengan Actinomycetes sp. C5= coating benih dengan fungisida antracol yang bersifat kontak dengan kandungan bahan aktif propineb 70%. Faktor kedua adalah periode simpan (P) yang terdiri dari 6 perlakuan yaitu 0, 1, 2, 3, 4 dan 5 bulan. Percobaan ini diulang 4 kali, masing-masing ulangan ditanam 25 butir benih. Data yang diperoleh dianalisis dengan program statistical analysis system (SAS). Perlakuan yang berpengaruh nyata diuji lanjut dengan DMRT taraf α , 5 (Mattjik & Sumertajaya 2006).
Model linear dalam Rancangan Acak Lengkap Faktorial sebagai berikut:
Yijk = µ + αi+ βj+ (αβ)ij + εijk
Keterangan:
Yijk = nilai pengamatan pada perlakuan coating benih taraf ke-i, perlakuan periode simpan taraf ke-j, dan ulangan ke-k μ = nilai tengah pengamatan karakter yang diamati
αi = pengaruh utama dari faktor coating benih ke-i βj = pengaruh utama dari faktor periode simpan ke-j
(αβ)ij = komponen interaksi dari faktor coating benih dan faktor periode simpan εijk = pengaruh acak yang menyebar normal
i = perlakuan aplikasi coating
10
Peubah Pengamatan
a. Pengamatan di Laboratorium
Pengujian di laboratorium menggunakan metode uji di atas kertas (UDK) di dalam ekogerminator tipe IPB 73-2A/B. Peubah yang diamati yaitu :
1. Potensi tumbuh maksimum (PTM) (%).
Pengamatan meliputi jumlah kecambah normal dan abnormal pada 14 hari setelah tanam. Potensi tumbuh maksimum dihitung dengan rumus :
enih yang ditanam enih yang tum uh
2. Daya berkecambah (DB) (%).
Pengamatan dilakukan terhadap jumlah kecambah normal pada hitungan pertama (hari ke-7) dan hitungan kedua (hari ke-14) (ISTA 2010). Daya
berkecambah benih dihitung dengan rumus:
itungan itung enih yang ditanam
Keterangan :
KN = Kecambah Normal
3. Bobot kering kecambah normal (BKKN) (g)
Bobot kering kecambah diperoleh dengan menimbang kecambah normal yang telah dikeringkan di dalam oven bersuhu 60 0C selama 72 jam (Kartika & Ilyas 1994).
4. Kecepatan tumbuh (KCT) (%KN/etmal)
Kecepatan tumbuh dihitung setiap hari selama 14 hari pada benih yang tumbuh normal. Kecepatan tumbuh dihitung dengan rumus :
KCT
etmal ∑tnt Keterangan :
t = waktu pengamatan ke- i
N = persentase kecambah normal setiap waktu pengamatan tn = waktu akhir pengamatan (hari ke 14)
5. Deteksi benih terinfeksi C. acutatum (%)
11 berdasarkan pedoman kunci identifikasi (Mathur & Kongsdal 2003). Persentase benih infeksi C. acutatum pada benih cabai dihitung dengan rumus :
ingkat infeksi enih yang ditanam enih terinfeksi
6. Deteksi hipokotil terinfeksi C. acutatum (%)
Hipokotil yang digunakan berasal dari kecambah normal pada pengamatan di laboratorium. Hipokotil direndam dalam larutan NaOCl 1 % selama 3 menit kemudian dibilas dengan air steril, lalu diletakkan dalam cawan petri yang berisi tiga lembar kertas saring lembab. Cawan petri diseal dengan plastik wrap kemudian diletakkan dalam ruang inkubasi dengan suhu ruang di bawah penyinaran lampu near ultra violet (NUV) dengan 12 jam terang dan 12 jam gelap secara bergantian sampai hari ketujuh. Pada hari kedelapan dilakukan pengamatan menggunakan mikroskop stereo dan mikroskop compound (Setiyowati et al. 2007) dan berdasarkan pedoman
kunci identifikasi (Mathur & Kongsdal 2003). Persentasi infeksi
C. acutatum pada hipokotil dihitung dengan rumus : ingkat infeksi ( ) hipokotil yang diamati hipokotil terinfeksi
7. Populasi cendawan C. acutatum selama periode simpan (cfu/g)
Populasi cendawan merupakan jumlah spora cendawan yang tumbuh selama periode simpan dan selanjutnya dikonversi ke satuan cfu/g (Indahwardani 2013). Populasi cendawan dihitung dengan rumus :
opulasi endawan x
Keterangan :
X = Jumlah spora yang tumbuh pada cawan dengan faktor pengenceran ke-(cfu/g)
P = Faktor pengenceran ke-i
V = Volume suspensi yang disebar pada cawan (ml)
b. Pengamatan di Rumah Kaca
12
1. Kecepatan tumbuh (%KN/etmal)
Perhitungan kecepatan tumbuh dilakukan pada benih yang berkecambah normal setiap hari selama 14 hari (ISTA 2010). Kecepatan tumbuh dihitung dengan rumus :
KCT( etmal) ⁄ ∑tn t
Keterangan :
t = waktu pengamatan ke- i
KN = persentase kecambah normal setiap waktu pengamatan tn = waktu akhir pengamatan (hari ke 14)
2. Tinggi bibit (cm)
Tinggi bibit diukur mulai dari pangkal batang di permukaan tanah sampai titik tumbuh. Pengukuran dilakukan saat bibit berumur 4 minggu setelah tanam. 3. Jumlah daun (helai)
Perhitungan jumlah daun dilakukan saat bibit berumur 4 minggu setelah tanam. 4. Kejadian serangan antraknosa (%).
Penghitungan kejadian serangan dilakukan setiap hari hingga bibit berumur 4 minggu setelah semai. Penghitungan kejadian serangan menggunakan rumus :
n
Keterangan :
KS = kejadian serangan (%)
n = jumlah tanaman yang terinfeksi patogen N = jumlah seluruh tanaman
5. Rebah bibit (%).
Pengamatan rebah bibit dilakukan dengan menghitung persentase jumlah bibit yang rebah setiap hari selama 4 minggu. Perhitungan ini dilakukan dengan rumus :
e ah i it i it yang ditanam i it yang re ah
6. Persentase hipokotil terinfeksi C. acutatum (%)
Hipokotil yang digunakan berasal dari kecambah normal saat bibit berumur 2 minggu setelah semai. Persentasi hipokotil terinfeksi C. acutatum dihitung dengan rumus :
13
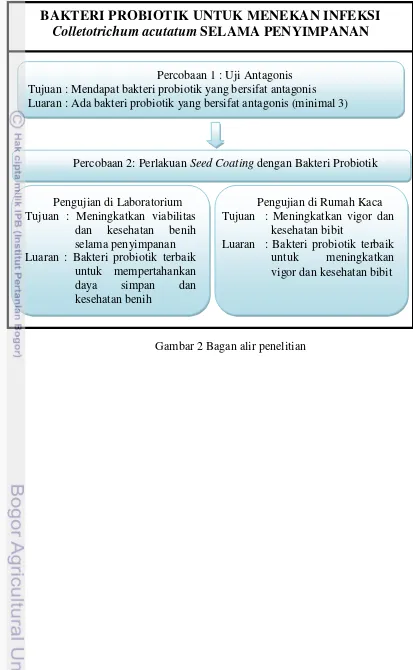
Gambar 2 Bagan alir penelitian
BAKTERI PROBIOTIK UNTUK MENEKAN INFEKSI
Colletotrichum acutatum
SELAMA PENYIMPANAN
Percobaan 1 : Uji Antagonis Tujuan : Mendapat bakteri probiotik yang bersifat antagonis Luaran : Ada bakteri probiotik yang bersifat antagonis (minimal 3)
Pengujian di Laboratorium Tujuan : Meningkatkan viabilitas
dan kesehatan benih selama penyimpanan Luaran : Bakteri probiotik terbaik
untuk mempertahankan daya simpan dan kesehatan benih
Pengujian di Rumah Kaca Tujuan : Meningkatkan vigor dan
kesehatan bibit
14
4 HASIL DAN PEMBAHASAN
Percobaan 1.Uji antagonis bakteri probiotik terhadap C. acutatum
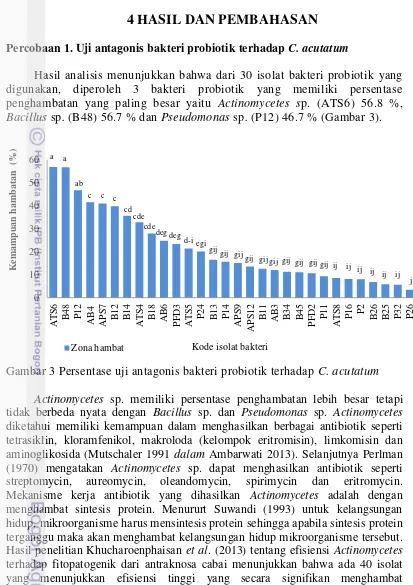
Hasil analisis menunjukkan bahwa dari 30 isolat bakteri probiotik yang digunakan, diperoleh 3 bakteri probiotik yang memiliki persentase penghambatan yang paling besar yaitu Actinomycetes sp. (ATS6) 56.8 %,
Bacillus sp. (B48) 56.7 % dan Pseudomonas sp. (P12) 46.7 % (Gambar 3).
Gambar 3 Persentase uji antagonis bakteri probiotik terhadap C. acutatum Actinomycetes sp. memiliki persentase penghambatan lebih besar tetapi tidak berbeda nyata dengan Bacillus sp. dan Pseudomonas sp. Actinomycetes
diketahui memiliki kemampuan dalam menghasilkan berbagai antibiotik seperti tetrasiklin, kloramfenikol, makroloda (kelompok eritromisin), limkomisin dan aminoglikosida (Mutschaler 1991 dalam Ambarwati 2013). Selanjutnya Perlman (1970) mengatakan Actinomycetes sp. dapat menghasilkan antibiotik seperti streptomycin, aureomycin, oleandomycin, spirimycin dan eritromycin. Mekanisme kerja antibiotik yang dihasilkan Actinomycetes adalah dengan menghambat sintesis protein. Menururt Suwandi (1993) untuk kelangsungan hidup, mikroorganisme harus mensintesis protein sehingga apabila sintesis protein terganggu maka akan menghambat kelangsungan hidup mikroorganisme tersebut. Hasil penelitian Khucharoenphaisan et al. (2013) tentang efisiensi Actinomycetes
terhadap fitopatogenik dari antraknosa cabai menunjukkan bahwa ada 40 isolat yang menunjukkan efisiensi tinggi yang secara signifikan menghambat pertumbuhan C. gloeosporioides lebih dari 60%.
15 Zona hambat yang terbentuk disekitar koloni menandakan bahwa agens hayati tersebut kemungkinan memproduksi suatu senyawa antimikrobial, baik berupa enzim, toksin maupun antibiotik. Antibiotik merupakan suatu substansi yang dihasilkan oleh organisme hidup yang dapat menghambat atau membunuh organisme lainnya. Antibiotik digolongkan sebagai metabolit sekunder yang dihasilkan oleh bakteri probiotik dalam jalur metabolisme. Adanya senyawa antibiotik yang dihasilkan bakteri antagonis menyebabkan terjadinya penekanan pada pertumbuhan patogen (Asnawi et al. 2012). Hasil penelitian Nabti et al. (2013), Bacillus sp. menghasilkan siderofor dan beberapa enzim seperti selulase, kitinase, protease dan lipase. Menurut Compant et al. (2005), mekanisme biokontrol Pseudomonas terhadap cendawan patogen disebabkan oleh kemampuan Pseudomonas dalam menghasilkan enzim hidrolitik dan senyawa antibiosis. Enzim hidrolitik yang memiliki kemampuan antifungi yang dapat diproduksi Pseudomonas diantaranya adalah enzim kitinase dan glukanase, sedangkan untuk senyawa antibiosis, Pseudomonas diketahui mampu memprodukisi senyawa antifungi seperti 2,4-diacetylphloroglucinol (DAPG), pirolnitrin, pyoluterin, dan phenazin.
Gambar 4 Uji antagonis bakteri probiotik terhadap C. acutatum yang ditandai adanya zona hambat (tanda panah) (a) dan hifa C. acutatum yang mengalami lisis (tanda panah) (pembesaran 100x) (b)
Pertumbuhan bakteri probiotik untuk menekan cendawan patogen dengan cara berkompetisi untuk mendapatkan makanan dan ruang untuk tumbuh dengan memproduksi suatu susbtansi yang dapat menghambat atau membunuh patogen lain (Agustono et al. 2012). Penghambatan cendawan patogen yang ditunjukkan oleh bakteri probiotik diduga melibatkan beberapa mekanisme diantaranya senyawa bioaktif seperti siderofor atau enzim kitinase. Namun demikian mekanisme penghambatan C. acutatum perlu diteliti lebih jauh karena dari hasil uji ini belum dapat ditentukan mekanisme yang terlibat secara pasti dalam menghambat cendawan patogen.
Bakteri probiotik dikenal sebagai penghasil antibiotik. Antibiotik umumnya adalah senyawa organik dengan berat molekul rendah yang dikeluarkan oleh mikroorganisme. Antibiotik dapat merusak pertumbuhan atau aktivitas metabolit mikroorganisme lain. Selain itu, bakteri juga menghasilkan siderofor. Siderofor adalah senyawa organik selain antibiotik yang dapat berperan dalam pengendalian penyakit tumbuhan. Kemampuan siderofor mengikat besi merupakan pesaing terhadap mikroorganisme lain, terbukti bahwa siderofor berperan aktif dalam menekan pertumbuhan patogen (Soekarno et al. 2013). Pseudomonas sp.
16
menghasilkan metabolit sekunder yang berfungsi sebagai siderofor. Siderofor tersebut berkembang dengan cepat menyelubungi akar tanaman dan memindahkan Fe dalam zona akar sehingga dapat meningkatkan pertumbuhan tanaman (Baharuddin et al. 2005).
Berdasarkan uji antagonis diketahui 27 isolat bakteri lainnya tidak memiliki aktivitas penghambatan terhadap C. acutatum. Variasi diameter zona hambat yang terbentuk diduga karena adanya perbedaan daya antagonisme untuk menghasilkan antibiotik dari masing-masing isolat bakteri probiotik dalam menghambat pertumbuhan patogen (Sallytha et al. 2014). Hasil penelitian Feliatra et al. (2012) tentang antagonis bakteri probiotik yang diisolasi dari usus dan lambung ikan kerapu bebek terhadap bakteri patogen menunjukkan bahwa kemampuan antagonis bakteri probiotik pada bakteri patogen berbeda-beda, tergantung kepada isolatnya. Bakteri probiotik Bacillus cereus
merupakan bakteri probiotik yang mampu menghambat pertumbuhan bakteri patogen Vibrio sp. dan Aeromonas sp. tetapi tidak dapat menghambat bakteri
Pseudomonas beteli. Muharni & Widjajanti (2011), dalam penelitiannya tentang skrining bakteri kitinolitik antagonis terhadap jamur akar putih menunjukkan bahwa aktivitas penghambatan tergantung pada indeks kitinolitik dari tiap isolat dimana isolat BRK5 paling tinggi menghasilkan indeks kitinolitik yaitu 0.52 dengan zona hambat 5.57 mm sedangkan yang paling rendah pada isolat BRK11 yaitu 0.21 tidak memiliki zona hambat.
Efektivitas bakteri probiotik yang digunakan untuk coating benih dilihat melalui persentase penghambatan terhadap C. acutatum (Gambar 3) dan kandungan zat pengatur tumbuh yang terdapat dalam bakteri tersebut (Gambar 6). Hal ini sesuai pernyataan Saraswati & Sumarno (2008) yang menyatakan penggunaan mikroorganisme sebagai agens hayati memberikan manfaat karena selain menghasilkan enzim kitinolitik juga dapat menghasilkan zat pengatur tumbuh yang menyediakan nutrisi bagi tanaman untuk perkecambahan.
Berdasarkan hasil analisis, bakteri probiotik memiliki kandungan hormon indole acetic acid (IAA) dan giberelin (GA3). Hormon IAA merupakan salah satu hormon pertumbuhan tanaman yang berperan dalam mengendalikan proses fisiologi dalam pertumbuhan tanaman, meliputi pembesaran dan pembelahan sel, merangsang benih untuk berkecambah, diferensiasi jaringan, mengontrol proses pertumbuhan vegetatif, memulai pembentukan akar lateral dan adventif, tanggapan terhadap cahaya dan gravitasi, dan ketahanan terhadap kondisi stres (Shahab et al. 2009).
17
Percobaan 2. Efektivitas seed coating menggunakan bakteri probiotik terhadap viabilitas potensial, vigor dan kesehatan benih cabai selama penyimpanan
Benih cabai yang dicoating dengan bakteri probiotik diberikan pewarna makanan untuk memberikan efek warna yang menarik, seragam, lebih mengkilat, dapat menghilangkan noda hitam pada benih, menutupi perubahan warna pada benih akibat paparan cahaya, udara atau temperatur yang ekstrim selama penyimpanan (Gambar 5). Siregar et al. (2007) mengatakan pewarnaan pada benih dimaksudkan untuk memudahkan dalam penanaman karena warna benih sangat kontras dengan warna tanah sehingga walaupun benih cabai berukuran kecil dapat dengan mudah terlihat, begitupun jika benih tercampur dengan perlakuan lainnya dapat dengan mudah dibedakan. Selain itu pewarnaan pada benih bertujuan untuk menarik konsumen, membantu produsen dan pedagang benih mengembangkan reputasi atau kesan positif untuk mempertahankan kesinambungan usaha. Beberapa warna diketahui dapat menghalau hama yang dapat merusak benih. Disamping itu pewarnaan merupakan petunjuk perlakuan benih.
Gambar 5 Benih cabai sebelum dicoating (a) dan benih cabai yang dicoating
dengan bakteri probiotik (b)
a. Pengamatan di Laboratorium
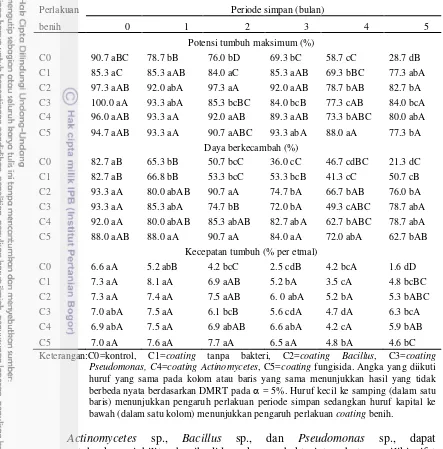
Aplikasi bakteri probiotik pada coating benih terhadap viabilitas potensial (tolok ukur PTM, DB, BKKN), vigor (tolok ukur KCT) dan kesehatan benih cabai (tolok ukur benih terinfeksi, hipokotil terinfeksi dan populasi cendawan) dapat dilihat pada Tabel 1, 2, 3 dan 4. Pelapisan benih dengan bakteri probitik mampu mempertahankan viabilitas potensial dan vigor benih cabai selama penyimpanan. Hal ini dapat dilihat dari tingginya nilai PTM yang mencapai 80-84%, DB 76-78.7% dan KCT 5.3-6.3%KN/etmal pada periode simpan 5 bulan (Tabel 1).
18
Tabel 1 Pengaruh interaksi perlakuan coating dan periode simpan terhadap PTM, DB dan KCT pada benih cabai
Keterangan:C0=kontrol, C1=coating tanpa bakteri, C2=coating Bacillus, C3=coating Pseudomonas, C4=coatingActinomycetes, C5=coating fungisida. Angka yang diikuti huruf yang sama pada kolom atau baris yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada = 5%. Huruf kecil ke samping (dalam satu baris) menunjukkan pengaruh perlakuan periode simpan sedangkan huruf kapital ke bawah (dalam satu kolom) menunjukkan pengaruh perlakuan coating benih.
Actinomycetes sp., Bacillus sp., dan Pseudomonas sp., dapat mempertahankan viabilitas benih diduga karena bakteri tersebut memiliki sifat antagonis terhadap C. acutatum dan dapat memacu perkecambahan karena kemampuannya memproduksi hormon indole acetic acid (IAA) dan giberelin (GA3) (Gambar 6). Hal ini sesuai pernyataan Copeland & McDonald (2001), bahwa giberelin berperan dalam memacu perkecambahan benih pada berbagai species sedangkan hormon IAA berfungsi merangsang pembelahan sel, menginduksi pemanjangan akar dan mempengaruhi pertumbuhan pucuk.
19
Gambar 6 Hasil analisis kandungan IAA dan GA3 pada bakteri probiotik
Perlakuan coating Pseudomonas sp. mengalami penurunan DB dan KCT pada periode simpan 4 bulan, kemudian meningkat pada periode simpan 5 bulan, sedangkan coating Actinomycetes sp. terjadi penurunan KCT pada periode simpan 4 bulan kemudian meningkat pada periode simpan 5 bulan. Hal ini menunjukkan bahwa terjadi variasi viabilitas antar individu benih. Mugnisjah & Setiawan (2004) menyatakan bahwa kemampuan tanaman untuk dapat mempertahankan mutu benih berbeda-beda jika dipandang dari individu benih yang membentuk kelompok (lot).
Salah satu tolok ukur vigor kekuatan tumbuh benih adalah kecepatan tumbuh (KCT) (Tabel 1). Kecepatan tumbuh ditunjukkan dengan jumlah benih yang tumbuh normal pada setiap harinya. Berdasarkan hasil penelitian, perlakuan
coating dengan bakteri probiotik dan fungisida mengalami penurunan KCT mulai periode simpan 4 bulan, perlakuan tanpa coating mengalami penurunan mulai periode simpan 2 bulan dan perlakuan coating tanpa bakteri pada periode simpan 3 bulan. Kecepatan tumbuh pada perlakuan coating bakteri probiotik mampu dipertahankan hingga mencapai 5.3-6.3%KN/etmal pada periode simpan 5 bulan. Hasil penelitian Setiyowati et al. (2007) tentang pengaruh perlakuan seed coating
menggunakan benomil dan tepung curcuma pada benih cabai besar menunjukkan bahwa kecepatan tumbuh berkisar antara 2.3-3.7%KN/etmal.
Viabilitas potensial benih pada tolok ukur bobot kering kecambah normal, mengalami penurunan mulai periode simpan 2 bulan. Pada tolok ukur hipokotil terinfeksi terjadi peningkatan infeksi secara nyata mulai periode simpan 3 bulan (Tabel 2). Periode simpan berpengaruh terhadap viabilitas benih, dimana penurunan viabilitas seiring dengan pertambahan waktu.
20
Tabel 2 Pengaruh perlakuan periode simpan terhadap bobot kering kecambah normal (BKKN) (g) dan hipokotil terinfeksi (HT) (%)
Peubah Periode simpan (bulan)
0 1 2 3 4 5
BKKN (g) 0.17 a 0.17 a 0.15 b 0.14 b 0.14 b 0.11 c HT (%) 0.97 c 1.34 b 1.17 bc 1.97 a 1.91 a 1.92 a
Keterangan: Angka yang diikuti huruf yang sama pada baris yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada = 5%.
Perlakuan kontrol dan coating tanpa bakteri menunjukkan nilai BKKN yang lebih kecil dibandingkan coating dengan bakteri probiotik. Infeksi C. acutatum
dapat ditekan dengan perlakuan coating bakteri probiotik dan fungisida yang ditunjukkan oleh penurunan persentase hipokotil terinfeksi (Tabel 3).
Tabel 3 Pengaruh perlakuan coating terhadap bobot kering kecambah normal (BKKN) (g) dan hipokotil terinfeksi (HT) (%)
Peubah Coating
C0 C1 C2 C3 C4 C5
BKKN (g) 0.12 c 1.13 bc 0.15 ab 0.16 a 0.15 ab 0.15 ab HT (%) 2.11 a 1.77 b 1.46 bc 1.52 bc 1.19 c 1.22 c
Keterangan:C0=kontrol, C1=coating tanpa bakteri, C2=coating Bacillus, C3=coating Pseudomonas, C4=coatingActinomycetes, C5=coating fungisida. Angka yang diikuti huruf yang sama pada baris yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada = 5%.
Keefektivan perlakuan coating dengan bakteri probiotik dan fungisida dalam mempertahankan kecepatan tumbuh benih dikarenakan adanya sifat antagonis pada bakteri probiotik sehingga menghambat pertumbuhan C. acutatum. Salah satu akibat dari infeksi C. acutatum pada benih adalah penghambatan perkecambahan atau benih tumbuh abnormal.
Vigor benih sewaktu disimpan merupakan faktor penting yang mempengaruhi umur simpannya. Proses kemunduran benih berlangsung terus-menerus dengan semakin lamanya benih disimpan sampai akhirnya benih mati (Justice & Bass 2002). Julianty et al. (2005) melakukan analisis kinetika pendugaan umur simpan benih cabai merah, hasil penelitian menunjukkan bahwa benih cabai yang disimpan pada suhu kamar (27 0C-30 0C) dan kadar air 6.5-10.6 % umur simpannya dapat mencapai 5-26 bulan. Pada penelitian ini, umur simpan benih cabai mencapai 5 bulan dikarenakan benih yang digunakan sudah diinfeksi patogen dan sebelum benih digunakan sudah melalui penyimpanan selama ± 4 bulan pada suhu AC 16 0C.
Bakteri probiotik Pseudomonas sp., Bacillus sp., dan Actinomycetes sp. menghasilkan IAA dan GA3 sehingga secara signifikan meningkatkan PTM, BKKN dan DB pada perlakuan tanpa penyimpanan. Hormon IAA yang disekresikan oleh bakteri probiotik dapat memacu pertumbuhan tanaman secara langsung yakni dengan menstimulasi pemanjangan sel atau pembelahan sel.
21 benomil dan tepung curcuma menekan tingkat infeksi C. capsici pada benih cabai hingga 2% dibandingkan kontrol yang mencapai 26%.
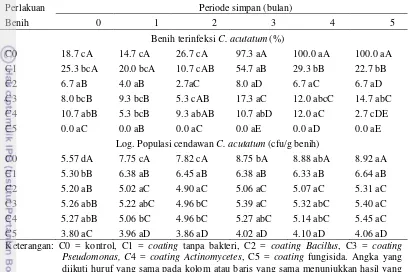
Tabel 4 Pengaruh interaksi perlakuan coating dan periode simpan terhadap benih terinfeksi (%) dan populasi cendawan (cfu/g)
Perlakuan Periode simpan (bulan)
Benih 0 1 2 3 4 5
Benih terinfeksi C. acutatum (%)
C0 18.7 cA 14.7 cA 26.7 cA 97.3 aA 100.0 aA 100.0 aA
Log. Populasi cendawan C. acutatum (cfu/g benih)
C0 5.57 dA 7.75 cA 7.82 cA 8.75 bA 8.88 abA 8.92 aA diikuti huruf yang sama pada kolom atau baris yang sama menunjukkan hasil yang tidak berbeda nyata berdasarkan DMRT pada = 5%. Huruf kecil ke samping (dalam satu baris) menunjukkan pengaruh perlakuan periode simpan sedangkan huruf kapital ke bawah (dalam satu kolom) menunjukkan pengaruh coating benih.
Tingkat infeksi benih pada perlakuan coating Pseudomonas sp. semakin tinggi mulai periode simpan 3 bulan, sedangkan tingkat infeksi benih pada perlakuan coating Bacillus sp. tidak mengalami peningkatan hingga periode simpan 5 bulan. Coating Actinomycetes sp. mengalami penurunan persentase benih terinfeksi pada periode simpan 5 bulan yaitu 2.67%.
Peningkatan persentase benih terinfeksi pada perlakuan coating Pseudomonas sp. diduga karena terjadinya penurunan aktivitas antibiosis. Salah satu kekurangan bakteri probiotik yaitu tidak dapat disimpan dalam waktu lama, dibandingkan dengan fungisida sintetik. Semakin lama bakteri disimpan, semakin berkurang aktivitas, densitas dan efektivitas dari bakteri probiotik tersebut. Hal ini sesuai hasil penelitian Muchtar et al. (2014) yang menyatakan bahwa bakteri
Pseudomonas kelompok fluorescens tidak mampu bertahan hidup lebih lama sampai periode simpan 24 minggu, dibandingkan dengan Bacillus subtilis.
22
adalah berbentuk hialin (oval), lurus, ujung runcing (Gambar 7b), panjang konidia 8.5-16.5µm dan lebar 2.5-4µm (Akhtur et al. 2009).
Gambar 7 Benih terinfeksi C. acutatum (a) dan konidia C. acutatum
pembesaran 100 x (b)
Aplikasi bakteri probiotik pada coating benih akan memberikan kesempatan kepada bakteri tersebut untuk mengkolonisasi lebih awal pada permukaan benih sehingga lebih efektif dalam menghambat kolonisasi dan perkembangan patogen (Susanna 2006).
Pada tolok ukur persentase benih terinfeksi terlihat bahwa coating fungisida lebih efektif menurunkan persentase benih terinfeksi dibandingkan dengan
coating bakteri probiotik. Hal ini terjadi karena fungisida antracol yang berbahan aktif propineb 70% termasuk dalam kelompok dithiokarbamat dan tergolong dalam fungisida non sistemik (fungisida kontak). Fungisida kontak bekerja melalui paparan langsung pada cendawan sasaran. Selain itu jumlah populasi cendawan pada coating fungisida lebih sedikit dibandingkan perlakuan coating
dengan bakteri sehingga sifat patogenesitasnya juga menurun. Rendahnya populasi C. acutatum pada benih yang dicoating dengan bakteri probiotik dan fungisida menunjukkan bahwa dengan adanya aplikasi bakteri probiotik mampu menekan populasi cendawan. Kemampuan antagonisme bakteri probiotik tentunya berdampak positif untuk menekan keberadaan cendawan patogen. Bakteri probiotik dapat menekan cendawan patogen melalui mekanisme antibiosis, kompetisi dan produksi enzim.
Benih yang dicoating tanpa bakteri atau hanya menggunakan bahan perekat natrium alginat dan xantan gum tidak mampu menurunkan persentase benih terinfeksi dan populasi cendawan pada setiap periode simpan. Hal ini dapat dilihat pada Tabel 4, dimana perlakuan coating tanpa bakteri berbeda nyata dengan kontrol dan berbeda nyata dengan coating bakteri probiotik dan fungisida. Natrium alginat yang digunakan sebagai bahan coating mengandung residu asam mannuronat serta asam guluronat tetapi tidak bersifat toksin terhadap benih, sehingga banyak digunakan untuk bahan pengawetan pangan karena dapat melindungi bahan pangan dari udara sehingga proses oksidasi dihambat. Xantan gum merupakan bahan eksopolisakarida yang dihasilkan oleh bakteri
Xanthomonas campestris pv. campestris (Ramirez et al. 1988). Xantan gum banyak digunakan sebagai bahan pengental pada pembuatan makanan dan dalam industri kosmetik.
23 cendawannya tidak mengalami peningkatan pada setiap periode simpan (Tabel 4). Menurut Syarif et al. (2003), kompetisi yang dilakukan oleh bakteri probiotik yaitu dengan cara mengeluarkan metabolit sekunder yang bisa menghambat pertumbuhan cendawan sehingga cendawan ini tidak dapat mengabsorbsi nutrisi yang lebih banyak dan menyebabkan pertumbuhan cendawan lebih lambat. Hal ini sesuai dengan karakteristik bakteri probiotik yaitu mendorong terjadinya kompetisi dan memungkinkan bakteri terpacu untuk melepaskan senyawa metabolit sekunder sebagai bentuk pertahanan bakteri (Wartono et al. 2012). Toksin yang dihasilkan oleh bakteri probiotik dapat menekan, menghambat atau memusnahkan mikroba lainnya (Feliatra et al. 2012).
Pengamatan di Rumah Kaca
Hasil analisis pengaruh interaksi perlakuan coating dan periode simpan terhadap kecepatan tumbuh di rumah kaca (Tabel 5) menunjukkan bahwa perlakuan coating benih dengan Actinomycetes sp. mampu mempertahankan kecepatan tumbuh hingga periode simpan 4 bulan yaitu 8.9%KN/etmal, dibandingkan perlakuan coating Bacillus sp., coating Pseudomonas sp., coating
fungisida, coating tanpa bakteri maupun kontrol. Penurunan vigor benih pada tolok ukur kecepatan tumbuh selama periode simpan dikarenakan benih mengalami proses penuaan. Proses ini tidak pernah berhenti sampai akhirnya benih mati (Justice & Bass 2002).
Kecepatan tumbuh pada benih yang dicoating dengan Pseudomonas sp. mengalami penurunan kecepatan tumbuh selama periode simpan. Yulianti et al.
(2012) menyatakan bahwa senyawa toksik yang dihasilkan oleh mikroorganisme antagonis diduga dapat menghambat perkecambahan benih.
Tabel 5 Pengaruh interaksi perlakuan coating dan periode simpan terhadap kecepatan tumbuh (%KN/etmal) pada pengamatan di rumah kaca
Perlakuan Periode simpan (bulan) berbeda nyata berdasarkan DMRT pada = 5%. Huruf kecil ke samping (dalam satu baris) menunjukkan pengaruh perlakuan periode simpan sedangkan huruf kapital ke bawah (dalam satu kolom) menunjukkan pengaruh perlakuan coating benih.
24
mempertahankan tinggi bibit lebih baik yaitu 10.34-10.87 cm dibandingkan perlakuan periode simpan 0, 3, 4 dan 5 bulan.
Hasil penelitian menunjukkan bahwa pada periode simpan 0 bulan diduga benih masih mengalami dormansi sehingga terjadi keterlambatan pertumbuhan yang berdampak pada rendahnya tinggi tanaman. Setelah penyimpanan 1 dan 2 bulan, telah terjadi pematahan dormansi sehingga benih tumbuh cepat dan pertumbuhan bibit lebih tinggi. Pada periode simpan 3 bulan, mulai terjadi penurunan vigor bibit. Akibatnya benih mulai mengalami penghambatan pertumbuhan yang ditandai rendahnya tinggi tanaman.
Tabel 6 Pengaruh perlakuan periode simpan terhadap tinggi bibit cabai (cm) umur 4 minggu setelah semai
Perlakuan Periode simpan (bulan) Rata-rata
benih 0 1 2 3 4 5
Hasil interaksi perlakuan coating dan periode simpan terhadap jumlah daun menunjukkan bahwa perlakuan bakteri probiotik mampu meningkatkan jumlah daun selama periode simpan 5 bulan (Tabel 7) dibandingkan perlakuan kontrol dan coating tanpa bakteri. Peningkatan jumlah daun pada tanaman cabai di duga karena adanya zat pengatur tumbuh yang dihasilkan oleh bakteri probiotik. Kusuma et al. (2012) melaporkan bahwa giberelin merupakan zat pengatur tumbuh yang berperan dalam pertumbuhan daun, mempengaruhi pertumbuhan dan diferensiasi akar.
25 Tabel 7 Pengaruh interaksi perlakuan coating dan periode simpan terhadap jumlah
daun (helai) umur 4 minggu setelah semai
Perlakuan Periode simpan (bulan) berbeda nyata berdasarkan DMRT pada = 5%. Huruf kecil ke samping (dalam satu baris) menunjukkan pengaruh perlakuan periode simpan sedangkan huruf kapital ke bawah (dalam satu kolom) menunjukkan pengaruh perlakuan coating benih.
Perlakuan coating dengan fungisida (antracol 70 WP) dan bakteri probiotik lebih tinggi menurunkan persentase hipokotil terinfeksi di rumah kaca (Tabel 8). Salah satu sifat dari fungisida sintetik adalah dapat menurunkan populasi patogen dengan cepat sehingga meluasnya serangan patogen dapat dicegah (Munarso et al. 2006). Fungisida antracol mengandung bahan aktif propineb 70%, berbentuk tepung dan bersifat kontak, sehingga lebih tinggi menurunkan persentase hipokotil terinfeksi pada bibit tanaman cabai, sedangkan bakteri probiotik bersifat antagonis diduga menghasilkan toksin, antibiosis dan enzim kitinase sehingga menekan infeksi hipokotil. berbeda nyata berdasarkan DMRT pada = 5%. Data yang digunakan adalah data yang sudah ditransformasi (x+0.5)^0.5
26
(Tabel 4) juga meningkatkan persentase kejadian serangan. Mahartha et al. 2013 menyatakan semakin banyak tanaman terserang penyakit, maka populasi cendawan juga semakin banyak masuk ke dalam jaringan tanaman dan kemudian berkembang biak sehingga menyebabkan serangan penyakit semakin tinggi. Hasil penelitian Nugraheni (2010), isolat Fusarium sp. memiliki sifat patogenik tinggi pada tanaman cabai dengan populasi antara 7.2-7.3 spora/ml.
Tabel 9 Pengaruh interaksi perlakuan coating dan periode simpan terhadap kejadian serangan antraknosa (%) berbeda nyata berdasarkan DMRT pada = 5%. Huruf kecil ke samping (dalam satu baris) menunjukkan pengaruh perlakuan periode simpan sedangkan huruf kapital ke bawah (dalam satu kolom) menunjukkan pengaruh perlakuan coating benih. Data yang digunakan sudah ditransformasi (x+0.5)^0.5.
Benih yang hipokotilnya terinfeksi ditandai dengan adanya pertumbuhan
C. acutatum pada seluruh badan hipokotil (Gambar 8a). Gejala penyakit yang paling banyak menyerang bibit tanaman cabai di rumah kaca dalam penelitian ini adalah rebah kecambah (Gambar 8b) dan mati pucuk (Gambar 8c) serta kegagalan perkecambahan atau benih banyak yang tumbuh abnormal.
Gambar 8 Hipokotil terinfeksi C. acutatum (a), rebah kecambah (b) dan mati pucuk (c)
Hasil penelitian Setiyowati et al. (2007) menunjukkan keefektifan perlakuan
seed coating dengan benomil dan tepung curcuma dalam menekan tingkat infeksi
C. capsici pada hipokotil terinfeksi yang nyata lebih kecil dibandingkan kontrol. Hasil penelitian Ilyas et al. (2015) menunjukkan di lapangan, perlakuan biopriming dengan campuran Bacillus polymixa BG25 atau Pseudomonas fluorescence PG01 mengurangi kejadian penyakit antraknosa dari 80% menurun 9% pada benih kontrol yang terinfeksi. Suwan et al. (2012) mengatakan penyakit
27 antraknosa dapat menginfeksi setiap bagian tanaman dan gejala yang khas seperti mati pucuk, hawar daun, bercak daun, kegagalan perkecambahan dan rebah kecambah.
Periode simpan berpengaruh nyata terhadap rebah kecambah. Hasil analisis menunjukkan bahwa semakin lama benih itu disimpan, semakin tinggi kecambah yang rebah, dilihat dari peningkatan jumlah kecambah yang rebah dari periode simpan 0 bulan 1.7% kemudian meningkat setiap bulannya hingga mencapai 2.7% pada periode simpan 5 bulan (Tabel 10). Hal ini terjadi karena C. acutatum
penyebab antraknosa dapat berkembang saat benih dalam tempat penyimpanan dan konidia cendawan dapat bertahan dalam waktu yang lama.
Serangan patogen pada cendawan dapat terjadi secara langsung maupun tidak langsung. Benih yang digunakan dalam penelitian ini sudah diinfeksi patogen C. acutatum secara buatan. Akibatnya, benih mengalami kegagalan dalam perkecambahan atau terjadinya rebah kecambah. Pada saat benih tumbuh, tunas dan akarnya adalah fase paling rentan bagi tanaman terhadap serangan patogen yang virulen dan saat yang tepat bagi patogen untuk melakukan penetrasi. Benih yang baru tumbuh memiliki jaringan muda yang rentan terjadi rebah kecambah (damping off) (Soekarno et al. 2013). Keberadaan patogen pada benih dapat menyebabkan benih tidak dapat tumbuh. Patogen akan berkembang sejalan dengan perkecambahan benih. Walaupun terdapat patogen lain tetapi jumlahnya lebih sedikit, sehingga pengendalian C. acutatum dengan bakteri probiotik pada benih cabai yang terserang patogen cukup efektif.
Tabel 10 Pengaruh perlakuan periode simpan terhadap rebah bibit (%) Perlakuan Periode simpan (bulan)
Hasil pengamatan pada percobaan ini menunjukkan bahwa persentase benih terinfeksi pada perlakuan coating fungisida mencapai 0% pada periode simpan 0, 1, 2, 3, 4 dan 5 bulan, namun saat ditanam di rumah kaca, terdapat hipokotil terinfeksi, kejadian serangan dan rebah kecambah (Tabel 8, 9 dan 10). Hal ini terjadi karena C. acutatum bersifat laten dan sistemik artinya cendawan ini tidak terlihat pada bagian-bagian benih tetapi dapat menimbulkan gejala setelah
28
Keefektifan perlakuan coating dengan bakteri probiotik mampu menekan tingkat infeksi hipokotil, kejadian penyakit dan rebah kecambah di rumah kaca. Hal ini mengindikasikan bahwa perlakuan benih dengan bakteri probiotik mampu mengendalikan patogen terbawa benih, baik patogen yang berada di permukaan benih maupun patogen yang berada di luar benih.
5
SIMPULAN DAN SARAN
Simpulan
Pengujian antagonis bakteri probiotik terhadap C. acutatum terdapat tiga bakteri yang memiliki sifat antagonis yaitu Actinomycetes sp. (ATS6), Bacillus sp. (B48), dan Pseudomonas sp. (P12). Aplikasi bakteri probiotik mempertahankan viabilitas benih, ditunjukkan oleh potensi tumbuh maksimum 80-84%, daya berkecambah 76-78.7%, kecepatan tumbuh 5.3-6.3%KN/etmal dan meningkatkan kesehatan benih tercermin dari menurunnya benih terinfeksi 2.7-14.7%, populasi cendawan 5.31-5.45 cfu/g benih dan persentase kejadian serangan antraknosa pada periode simpan 5 bulan. Aplikasi bakteri probiotik meningkatkan vigor bibit berdasarkan tolok ukur jumlah daun pada bibit tanaman cabai.
Saran