PRODUKSI EMBRIO KLONING MENCIT DENGAN
PENGEMBANGAN TEKNIK TRANSFER INTI SEL SOMATIS
HARRY MURTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Produksi Embrio Kloning Mencit dengan Pengembangan Teknik Transfer Inti Sel Somatis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Harry Murti
RINGKASAN
HARRY MURTI. Produksi Embrio Kloning Mencit dengan Pengembangan Teknik Transfer Inti Sel Somatis. Dibimbing oleh ARIEF BOEDIONO, MOKHAMAD FAHRUDIN dan MOHAMAD AGUS SETIADI.
Sel punca embrionik pada umumnya diperoleh dari embrio hasil fertilisasi, namun sekarang dilaporkan bahwa embrio juga dapat diperoleh dari hasil Transfer Inti Sel Somatis (TISS). Prosedur ini diharapkan dapat mengatasi masalah etik dalam penggunaan embrio yang sebelumnya dihasilkan untuk tujuan reproduksi. Tingkat efisiensi kloning reproduksi yang relatif sangat rendah menjadi salah satu alasan menjajaki pemanfaatan TISS untuk kepentingan biomedis yaitu memproduksi ntESC. Embrio kloning mengalami hipermetilasi DNA yang diduga merupakan salah satu penyebab perkembangannya tidak bisa optimal
Penelitian memiliki lima tujuan utama, yaitu: (1) melakukan optimasi perlakuan superovulasi, metode aktivasi, dan enukleasi pada mencit sebagai hewan model; (2) untuk memproduksi embrio kloning, embrio partenogenetik, dan embrio fertilisasi in vivo mencit; (3) mempelajari tahapan perkembangan pra-implantasi pada kultur in vitro; (4) menentukan tahap siklus sel kumulus dengan menggunakan analisa flowcytometri; (5) mengkaji pengembangan teknik TISS dengan perlakuan penambahan Scriptaid sebagai senyawa penghambat enzim HDAC (histones deacetylases).
Hasil penelitian ini menunjukkan bahwa dosis PMSG dan hCG 7,5 IU dapat meningkatkan jumlah oosit pada aplikasi superovulasi. Perlakuan dengan medium CZB & CB & SrCl2 (medium segar) selama enam jam (perlakuan C)
merupakan metode aktivasi yang paling optimal dan dapat mencapai tingkat aktivasi 97,21%. Penambahan sukrosa 3% dapat meningkatkan keberhasilan enukleasi. Hasil menunjukkan bahwa aplikasi TISS dapat menghasilkan embrio kloning yang mampu berkembang hingga mencapai tahap blastosis (3,2%). Embrio partenogenetik yang dihasilkan oleh aktivasi buatan dapat berkembang hingga tahap blastosis (8,6%). Hasil penelitian menunjukkan bahwa sel kumulus yang dipakai sebagai donor inti berada pada tahap siklus sel G0/G1. Sel kumulus ini yang berukuran 5-7µm dan populasinya sebesar 70,84% dari total sel kumulus yang diisolasi. Tahap enukleasi dapat mencapai tingkat efisiensi sebesar 49%, sedangkan tahap transfer inti dapat mencapai tingkat efisiensi 40,8%. Penambahan Scriptaid berhasil meningkatkan efisiensi embrio kloning yang mencapai tahap blastosis menjadi 10,8%. Tingkat efisiensi tersebut naik lebih dari 3 kali lipat dibandingkan dengan kontrol (3,2%).
Optimasi terhadap perlakuan superovulasi, enukleasi, dan metode aktivasi dapat meningkatkan efisiensi aplikasi TISS untuk memproduksi embrio kloning mencit. Sel kumulus yang digunakan sebagai donor inti telah dipastikan pada tahap siklus sel G0 atau G1. Embrio kloning mencit dapat dihasilkan melalui
aplikasi TISS. Perkembangan praimplantasi secara in vitro embrio fertilisasi dan partenogenetik masih lebih baik dibandingkan dengan embrio kloning. Penambahan HDACi (Scriptaid dan TSA) dapat meningkatkan tingkat efisiensi hingga tiga kali lipat dibandingkan dengan kontrol.
SUMMARY
HARRY MURTI. Production of mice cloned embryo by development of Somatic Cell Nuclear Transfer Technique. Supervised by ARIEF BOEDIONO, MOKHAMAD FAHRUDIN and MOHAMAD AGUS SETIADI.
Embryonic stem cells can be obtained from an embryo generated through fertilization, recently it has been reported that an embryo can also be generated asexually through Somatic Cell Nuclear Transfer (SCNT). This procedure will overcome the ethical issue regarding the usage of embryo that was initially generated for reproductive purposes. The low efficiency of reproductive cloning is one of the reasons to explore the use of SCNT for biomedical purpose, specifically through nuclear transfer Embryonic Stem Cell (ntESC) production. Cloned embryos undergo DNA hypermethylation, which is thought to be one of the causes of sub-optimal growth.
This study has five main objective that include the following: (1) to obtain an optimized oocyte superovulation, activation method, and enucleation using mice oocytes as a model; (2) to produce mouse cloned embryo, parthenogenetic embryo, and in vivo fertilized embryo; (3) to study the stages of pre-implantation development in vitro culture; (4) to determined the cumulus cell cycle using flow cytometry; (5) to study the development of SCNT technique by adding Scriptaid as an inhibitory enzyme HDAC (histone deacetylase).
This study showed that using doses of 7.5 IU PMSG and hCG hormones can increase the oocyte cell production optimization through superovulation treatment. The most optimal method of activation is medium CZB & CB & SrCl2
(fresh medium) for six hours (method C) to activate oocyte cells until it reaches the level of activation of 97.21%. The addition of 3% sucrose able to increase the enucleation rate. The result of the research indicated that SCNT application is able to produce cloned embryos which are capable to develop to blastocyst stage (3,2%). In addition artificial activation of oocytes could produce parthenogenetic embryos which are capable to develop up to the blastocyst stage (8,6%). The results show that cumulus cells used as nuclei donors are in the G0/G1 cell cycle
phase. The cumulus cells measure at 5-7 µm in diameter and accounts for 70,84% of the total isolated cumulus cell population. The enucleation process could achieve an efficiency rate of 49%, while the nuclear transfer achieves a 40,8% efficiency rate. The addition of Scriptaid successfully increase the embryonic cloning at the blastocyst stage’s success rate to 10,8%. This efficiency rate is three times higher compared to the control, which only shows a 3,2% success rate.
Optimization of the superovulation treatment, enucleation, and the activation method could improve the efficiency of SCNT application to produce cloned mice embryos. Cumulus cells were used as donor nuclei has been confirmed at G0 or G1 stage of the cell cycle. Embryos cloned mice could be
generated through the SCNT application. Preimplantation development of fertilized and parthenogenetic embryos still better than the cloned embryos. The addition of Scriptaid and TSA could increase the level of efficiency of up to three-fold compared with controls.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Biologi Reproduksi
PRODUKSI EMBRIO KLONING MENCIT DENGAN
PENGEMBANGAN TEKNIK TRANSFER INTI SEL SOMATIS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR BOGOR
2013
Penguji pada Ujian Tertutup: Prof. Dr. Ir. Cece Sumantri, MAgr.Sc Drh. Ni Wayan Kurniani Karja, MP, Ph.D.
PRAKATA
Assalamu’alaikum warrohmatullohi wabarokatuh,
Puji dan syukur Alhamdulillah penulis panjatkan kepada Alloh Subhanahu Wa Ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Karya ilmiah ini merupakan hasil dari penelitian jenjang doktoral yang dilakukan di Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Prof. Dr. drh. Arief Boediono selaku ketua komisi pembimbing, Dr. drh. Mokhamad Fahrudin dan Prof. Dr. drh. M. Agus Setiadi selaku anggota komisi pembimbing yang dengan penuh ketulusan memberikan arahan dan saran selama penulis melaksanakan penelitian hingga penulisan disertasi.
Ucapan terima kasih juga disampaikan kepada Prof. Dr. Ir. Cece Sumantri, MAgr.Sc dan Drh. Ni Wayan Kurniani Karja, MP, Ph.D selaku penguji luar komisi pada Ujian Tertutup, Prof. Amin Soebandrio W.K. Ph.D, dr., Sp.MK (K) dan Dr. drh. Bambang Purwantara, M.Sc, selaku penguji luar komisi pada Ujian Terbuka, atas segala kritik dan saran yang sangat bermanfaat untuk menyempurnakan tulisan ini.
Penulis juga mengucapkan terima kasih kepada Rektor, Dekan Sekolah Pascasarjana, Dekan Fakultas Kedokteran Hewan, Ketua Departemen Klinik, Reproduksi dan Patologi, Ketua Program Studi, staf pengajar dan staf administrasi Biologi Reproduksi, serta seluruh staf Pascasarjana IPB yang telah menerima penulis untuk melanjutkan studi di IPB serta membantu kelancaran proses penyelesaian studi penulis. Ucapan yang sama juga disampaikan kepada jajaran direksi PT. Kalbe Farma, Tbk. yang telah memberikan ijin studi dan dukungan finansial (beasiswa) dalam rangka penyelesaian studi penulis.
Ucapan terima kasih juga disampaikan kepada Dr. drh. Ita Djuwita, M. Phil, sebagai Kepala Laboratorium Embriologi, Bagian Anatomi, Histologi dan Embriologi, Depertemen Anatomi, Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor yang telah memberi ijin kepada penulis untuk melakukan penelitian dan menggunakan berbagai fasilitas yang ada di laboratorium tersebut, kepada drh. Kusdiantoro Muhammad, drh. Wahono Esti Prasetyaningtias, M.Si, atas dukungan dan bantuan dalam bentuk informasi ilmiah yang diterima penulis selama studi di Bogor. Kepada rekan-rekan senior, Dr. Ir. Thomas Mata Hine, MS, Dr. drh. I Wayan Batan, MS, Bayu Rosadi, S.Pt, M.Si atas segala dukungan dan bantuannya. Kepada laboran, Mas Wahyu dan Ibu Yani atas segala kebaikan dan bantuannya selama penulis melakukan penelitian di Laboratorium Embriologi.
Noveka, Wireni Ayuningtyas S.Si atas dukungan yang diberikan kepada penulis selama menyelesaikan pendidikan program doktor di SPs IPB.
Kepada rekan-rekan saya, Dwi Agustina, S.Si, M.Si, Dini Budiharko, S.Si, M.Si, Riris Lindiawati Puspitasari, S.Si, M.Si, Dr. Enny T. Setiatin, Nuril Farizah, S.Pi, M.Si, Sigit Prastowo, S.Pt, M.Si, Adkhilni Utami, S.KH, dan Dr. Irma Andriani, S.Pi, M.Si. Kepada rekan satu angkatan BRP 2008 yaitu Dr. drh. Sri Wahyuni, M.Si, Dra. Ekayanti M. Kaiin, M.Si, Dr. Tatan Kostaman, S.Si, MP serta semua rekan-rekan mahasiswa BRP atas hubungan baik dan kerjasamanya selama studi.
Ungkapan terima kasih juga disampaikan kepada ayahanda Drs. Mardjoko Muljono, ibunda drg. Djauhar Harini, istri tercinta Laura Angelia, Amd., adinda Handaka Murti & Bayu Murti, keluarga besar bapak Ferry Firdaus Salindeho & ibu Komala Gandasamita, keluarga besar Alm. Widyoharsono & Alm. Moh. Tarom serta seluruh keluarga, atas segala doa dan kasih sayangnya. Semoga karya ilmiah ini bermanfaat.
Wassalamu’alaikum warrohmatullohi wabarokatuh
Bogor, Juli 2013
Harry Murti
DAFTAR ISI
DAFTAR TABEL xiii
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
TINJAUAN PUSTAKA 3
Transfer Inti Sel Somatis 3
Siklus Sel Resipien dan Donor Inti 4
Sinkronisasi Siklus Sel dan Aktivasi 5
Modifikasi Epigenetik pada Embrio Kloning 6
Perkembangan Embrionik Praimplantasi 7
OPTIMASI SUPEROVULASI, METODE AKTIVASI, DAN ENUKLEASI PADA PENGEMBANGAN TEKNIK
TRANSFER INTI SEL SOMATIS 8
Abstract 8
Abstrak 8
Pendahuluan 9
Metode Penelitian 10
Hasil dan Pembahasan 12
Simpulan 17
PRODUKSI DAN KULTUR IN VITRO EMBRIO
KLONING DAN EMBRIO PARTENOGENETIK MENCIT 18
Abstract 18
Abstrak 18
Pendahuluan 19
Metode Penelitian 21
Hasil dan Pembahasan 24
PRODUKSI EMBRIO KLONING MENCIT DENGAN PENAMBAHAN SCRIPTAID PADA APLIKASI
TRANSFER INTI SEL SOMATIS 30
Abstract 30
Abstrak 30
Pendahuluan 31
Metode Penelitian 32
Hasil dan Pembahasan 36
Simpulan 39
PEMBAHASAN UMUM 41
SIMPULAN DAN SARAN 44
DAFTAR PUSTAKA 45
LAMPIRAN 51
DAFTAR TABEL
1. Perlakuan superovulasi untuk menghasilkan sel oosit 12
2. Perlakuan metode aktivasi sel oosit 15
3. Keberhasilan enukleasi inti oosit (sel resipien) 16
4. Tahapan perkembangan kultur embrio secara in vitro 27
DAFTAR GAMBAR
1. Sel oosit mencit hasil superovulasi 14
2. Sel oosit setelah diaktivasi 15
3. Enukleasi dengan menggunakan sukrosa 3% 17
4. Isolasi sel oosit dan sel cumulus 25
5. Aplikasi Transfer Inti Sel Somatik 26
6. Tahapan perkembangan embrio kloning 28
7. Grafik hasil analisa flowcytometri sel kumulus setelah isolasi 36
8. Sel kumulus setelah isolasi 37
DAFTAR LAMPIRAN
1. Komposisi larutan stok CZB 52
2. Larutan stok CZB- PVA 52
3. Larutan stok kalsium 52
4. Larutan stok strontium 52
5. Larutan stok cytochalasin B 52
6. Larutan stok hyaluronidase 53
7. Resep Medium CZB 53
PENDAHULUAN
Latar Belakang
Perkembangan teknik Transfer Inti Sel Somatis (TISS) telah menjadi tren baru dalam kemajuan ilmu embriologi dan biomedis (McLaren 2000). Aplikasi ini menjadi sangat populer setelah terungkap dari beberapa hasil studi yang meneliti tentang kemungkinan pemanfaatan teknik transfer inti untuk memproduksi ntESC (nuclear transfer Embryonic Stem Cell) dan pemanfaatannya untuk terapi penyakit degeneratif (Hochedlinger & Jaenisch 2003). Teknik TISS pada dasarnya meliputi enukleasi (pengeluaran inti oosit resipien), transfer inti (inti sel somatis dimasukkan ke dalam sitoplasma oosit resipien), dan aktivasi (menginduksi oosit hasil rekontruksi untuk mengalami
nuclear reprogramming dan berkembang seperti embrio yang normal) (Colman 2000).
Aplikasi TISS untuk memproduksi ntESC memberi harapan baru dalam pengembangan therapeutic cloning sebagai alternatif pengobatan berbagai penyakit degeneratif. Secara teoritis ntESC memiliki beberapa keunggulan dibandingkan dengan sel punca (stem cell) dari sumber yang lain. Transplantasi ntESC yang bersifat autologous diharapkan mampu mengatasi masalah penolakan sistem imun pada penderita (Cibelli et al. 2001). Ketidakcocokan karakter HLA (Human Lymphocyte Antigen), antara sel donor dengan sel pasien menyebabkan sel donor dianggap sebagai substansi asing yang dapat menimbulkan reaksi penolakan yang dikenal dengan “graft versus host diseases” (Wobus & Boheler 2005). Pemanfaatan ntESC dalam terapi berbasis sel (cell replacement therapy) berpotensi dapat mengatasi permasalahan penolakan sistem imunitas tersebut karena memiliki genom yang sama dengan sel-sel dari individu yang sakit (Moon et al. 2006). Berdasarkan hasil penelitian sebelumnya telah dilaporkan bahwa ESC dapat diarahkan menjadi sel-sel neuron (Wakayama et al. 2001), ginjal (Hipp & Atala 2004), otot jantung (Kodifis et al. 2004), dan pankreas (Paek et al. 2005).
Keberhasilan kloning dengan teknik TISS telah mengubah pandangan tentang pola ekpresi gen yang ternyata bersifat reversibel. Inti sel somatis yang telah memiliki pola ekspresi gen tertentu sesuai dengan jenis dan fungsinya, setelah mengalami nuclear reprogramming dapat mengalami perubahan pola ekspresi gen menjadi seperti pada tahap perkembangan embrionik (Wilmut et al. 2002).
Perumusan Masalah
sel belum sepenuhnya dapat berubah pola ekspresi genetiknya menjadi seperti pola perkembangan embrionik (Hochedlinger & Jaenisch 2003). Berbagai pengembangan teknik TISS telah dilakukan, namun hingga saat ini belum diperoleh hasil yang memuaskan. Selain itu aplikasi TISS pada manusia masih menjadi perdebatan dalam masalah etika, sehingga pengembangan teknik ini lebih banyak dikaji pada hewan coba (Murti et al. 2008).
Materi genetik (genom) dan urutan DNA pada sel somatik yang menyusun satu individu pada dasarnya sama. Dinamika perubahan gen yang aktif dan non aktif merupakan penyebab terjadinya modifikasi epigenetik. Teknik kloning dapat memfasilitasi modifikasi epigenetik yaitu memprogram kembali sel yang telah berdiferensiasi (sel somatik) menjadi ke tahapan awal embrionik yang bersifat totipoten (Wang et al. 2007). Modifikasi epigenetik diduga memegang peranan penting pada proses nuclear reprogramming, walaupun hingga saat ini mekanisme pemrograman belum diketahui (Humpherys et al. 2001). Pada embrio kloning telah diketahui bahwa setelah aktivasi, akan terjadi peningkatan hipermetilasi DNA dan deasetilasi histon (Wang et al. 2007). Asetilasi histon juga berperan dalam modifikasi epigenetik karena dapat mempengaruhi metilasi DNA dan ekspresi protein (Enright et al. 2003). Penelitian ini akan mengkaji pengembangan teknik TISS meliputi optimasi superovulasi, optimasi enukleasi, optimasi metode aktivasi, penentuan siklus sel donor inti, dan perlakuan penambahan Scriptaid sebagai senyawa penghambat enzim HDAC (histones deacetylases), sehingga diharapkan dapat meningkatkan efisiensi perkembangan embrio kloning hasil TISS.
Tujuan Penelitian
Secara umum, tujuan penelitian ini adalah mengembangkan teknik TISS dengan perlakuan penambahan Scriptaid untuk meningkatkan efisiensi produksi embrio kloning pada mencit. Tujuan khususnya adalah:
1. Melakukan optimasi superovulasi, enukleasi dan metode aktivasi untuk pengembangan aplikasi TISS
2. Menentukan tahap siklus sel donor inti
3. Memproduksi embrio kloning dengan menggunakan aplikasi TISS
4. Mempelajari perkembangan embrio kloning secara in vitro dibandingkan dengan embrio partenogenetik dan embrio fertilisasi in vivo
5. Mempelajari pengaruh penambahan Scriptaid dan Trichostatin A terhadap perkembangan embrio kloning pada tahapan praimplantasi
Manfaat Penelitian
Ruang Lingkup Penelitian
Penelitian ini menggunakan oosit mencit hasil superovulasi dengan penyuntikan hormon PMSG dan hCG secara intraperitonial. Produksi embrio kloning menggunakan teknik TISS yang meliputi: enukleasi, transfer inti dan aktivasi. Sel resipien adalah oosit pada tahap metaphase II sedangkan sel donor inti adalah sel kumulus. Optimasi dilakukan untuk menentukan dosis hormon PMSG dan hCG, metode aktivasi, dan enukleasi yang paling efektif. Siklus sel donor inti dianalisa dengan menggunakan teknik flowcytometri. Perkembangan praimplantasi embrio kloning secara in vitro dibandingkan dengan embrio hasil fertilisasi in vivo dan embrio partenogenetik. Penambahan senyawa inhibitor enzim Histone Deacetylase yaitu Scriptaid dilakukan sebagai upaya untuk meningkatkan efisiensi aplikasi teknik TISS dalam menghasilkan embrio kloning yang mampu berkembang hingga tahap blastosis.
TINJAUAN PUSTAKA
Transfer Inti Sel Somatis
Pada tahun 1997, Wilmut dan koleganya di Roslin Institute telah berhasil memanfaatkan teknik TISS untuk memproduksi domba kloning yang pertama di dunia. Domba Dolly adalah mamalia pertama yang dihasilkan bukan dari proses fertilisasi, namun berasal dari inti sel somatis yang ditransfer ke oosit dan selanjutnya dapat melakukan perkembangan embrionik seperti embrio normal. Ada tiga fakta baru yang terungkap dari hasil penelitian tersebut, yaitu (1) sel somatis yang telah berdiferensiasi masih menyimpan potensi untuk dilakukan reprogramming setelah dikultur selama kurun waktu tertentu, (2) sel somatis yang dikultur dengan kondisi rendah/tanpa serum dapat masuk ke dalam tahap G0 dalam siklus sel, dan (3) aplikasi teknik TISS dapat
memprogram inti sel somatis dewasa kembali ke perkembangan tahap embrionik (Wilmut et al. 1997).
Keberhasilan kloning Dolly memacu aplikasi TISS pada hewan mamalia lainnya. Beberapa mamalia yang telah berhasil dikloning adalah mencit (Wakayama et al. 1998 ), babi (Tomii et al. 2005), sapi (Kasinathan et al. 2001), ferret (Li et al. 2003; Li et al. 2005), anjing (Lee et al. 2005), tikus (Iannacone et al. 2001), dan kambing (Baguisi et al. 1999). Tingkat efisiensi hasil kloning yang relatif sangat rendah (<5%) menjadi salah satu alasan menjajaki pemanfaatan TISS untuk kepentingan biomedis yaitu memproduksi ntESC. Embrio hasil TISS dikultur secara in vitro hingga mencapai tahap blastosis, namun tidak diimplantasikan melainkan diisolasi ICM-nya dan kemudian dikultur sebagai sel lestari ntESC (Hochedlinger & Jaenisch 2003).
Jaenisch 2006). Hasil penelitian menunjukkan bahwa ntESC yang berasal dari inti sel somatis mempunyai sifat pluripoten dan dapat berdiferensiasi menjadi berbagai macam sel, seperti dopaminergic & seronergic neuron dan germ cells
(Wakayama et al. 2001). Namun ntESC masih berpotensi memiliki beberapa karakter yang berbeda dengan Embryonic Stem Cell (ESC) alami (bukan hasil TISS). Hal ini diduga dipengaruhi oleh memori epigenetik yang tidak sepenuhnya dapat dihapus dalam proses nuclear reprogramming (Ng & Gurdon 2005).
Siklus Sel Resipien dan Donor Inti
Keberhasilan nuclear reprogramming pada TISS sangat dipengaruhi oleh sinkronisasi tahapan siklus sel antara sel somatis sebagai donor inti dan sel oosit sebagai resipien. Hal ini menjadi faktor penting karena interaksi antara inti sel somatis dengan sitoplasma oosit merupakan kunci sukses pada awal perkembangan embrionik (Stice et al. 1998).
Pada teknik transfer inti, salah satu faktor yang harus diperhatikan dari sel donor inti adalah jumlah kromosom (Kato & Tsunoda 1993). Sel somatis pada tahap G0/G1 mempunyai kromosom diploid (2n), tahap G2 mempunyai
kromosom tetraploid (4n) karena telah mengalami replikasi DNA pada tahap S, dan tahap S mempunyai jumlah kromosom yang bervariasi antara diploid-tetraploid (2n-4n) karena bergantung pada posisi awal (sebelum replikasi) atau akhir (setelah replikasi).
Perbedaan kandungan protein yang terekspresi pada tiap tahap siklus sel, menjadi faktor penentu untuk memprogram kembali inti sel donor (Dinnyes & Szmolenszky 2005). Oosit yang telah mengalami ovulasi biasanya berada pada metafase II tahap M (MII). Pada tahap tersebut konsentrasi
Maturation Promoting Factor (MPF) yaitu kompleks cyclin B-Cdk1 mencapai tingkatan maksimal. Selain itu Cytostatic Factor (CSF) juga memegang kendali regulasi siklus sel dengan mempertahankan kondisi stabil pada MII dan menghambat masuk ke tahap anafase (Schimidt et al. 2006). Konsentrasi MPF sitoplasma oosit pada tahap MII juga dipengaruhi oleh aktivasi (Campbell et al.
1993). Setelah oosit diaktivasi baik secara elektrik maupun secara kimiawi dengan SrCl2 maka konsentrasi MPF akan menurun secara drastis. Hal ini
diduga disebabkan oleh osilasi ion Ca2+ intraseluler (pasca aktivasi) menginduksi serangkaian reaksi biokimia sehingga CSF akan terdegradasi oleh sistem ubiquitin/ proteosome (Schimidt et al. 2006). CSF yang inaktif akan menyebabkan Anaphase Promoting Complex (APC) aktif dan menghancurkan
cyclin A dan B sehingga MPF menjadi tidak aktif (konsentrasi menurun) (McGowan 2003).
Sinkronisasi Siklus Sel dan Aktivasi
menunjukkan bahwa diduga membran inti mempunyai andil dalam terjadinya replikasi DNA (Campbell et al. 1993). Pada transfer inti dengan resipien pada tahap MII, konsentrasi MPF yang tinggi dapat menyebabkan inti donor mengalami Nuclear Envelope Breakdwon (NEBD) dan Premature Chromosome Condensation (PCC) (Wakayama & Yanagimachi 2001). Hasil penelitian menunjukkan bahwa semua inti sel pada semua tahap siklus sel akan mengalami NEBD dan PCC bila ditansfer ke sitoplasma oosit yang konsentrasi MPFnya tinggi (Campbell et al. 1993). Namun bagaimana efek PCC terhadap proses nuclear reprogramming belum diketahui secara tuntas hingga saat ini (Sung et al. 2006).
Inti donor pada tahap G0, dan G1 yang masing-masing jumlah
kromosomnya diploid (2n) bila ditransfer ke dalam oosit resipien pada MII akan terjadi PCC pada kromatid tunggal, lalu mengalami Nuclear Reformation
(2n) dan akan terjadi replikasi DNA (menjadi 4n) kemudian akan membelah menjadi dua sel dengan masing-masing kromosom diploid (Campbell et al. 1996).
Inti donor pada tahap G2 yang jumlah kromosomnya tetraploid (4n)
bila ditransfer ke dalam sel oosit resipien pada MII akan terjadi PCC pada kromatid ganda, lalu mengalami Nuclear Reformation (4n) dan akan terjadi replikasi DNA (menjadi 8n) kemudian akan membelah menjadi dua sel dengan masing-masing kromosom tetraploid (4n). Hal ini menunjukkan bahwa inti donor tahap G2 tidak sinkron apabila ditransfer pada tahap MII oosit resipien
(Campbell et al. 1996).
Pada transfer inti ke dalam sel oosit dengan MPF rendah (menurun drastis setelah diaktivasi), menunjukkan bahwa inti donor sel tahap G0, G1, dan
S akan mengalami replikasi DNA, sehingga sel anakan mempunyai kromosom diploid (2n). Sedangkan inti donor tahap G2 tidak melakukan replikasi DNA,
sehingga pada kromosom sel anakannya menjadi 2n. Hal ini juga memperkuat dugaan bahwa faktor yang mempengaruhi replikasi DNA bukan sekedar karena membran inti yang pecah dan terjadi kondensasi prematur (PCC), tapi diduga juga disebabkan oleh kandungan DNA (kromosom) pada inti donor (Campbell
et al. 1996).
Ada beberapa cara untuk memperoleh kultur sel pada tahap-tahap tertentu dalam siklus sel. Untuk memperoleh sel pada tahap G0/G1, dapat
dilakukan dengan cara mengkultur sel dengan medium tanpa/rendah serum (Wakayama & Yanagimachi 2001). Sinkronisasi tahap G2 dapat dilakukan
dengan cara menambahkan cycloheximide pada medium kultur (Campbell et al.
1993). Tahap metafase dapat diperoleh dengan menambahkan demecolcine (Li
et al. 2005) atau nocodazole (senyawa penghambat polimerisasi mikrotubuli) pada medium kultur (Ono et al. 2001).
Oosit pada tahap metafase II (MII) digunakan sebagai resipen setelah dikeluarkan intinya. Pada tahap MII, oosit akan tetap berada dalam kondisi stabil dan bertahan pada kondisi tersebut karena adanya pengaruh dari CSF (cytostatic factor) (Schimidt et al. 2006). CSF juga menghambat aktivitas APC (Anaphase-Promoting Complex) yang berperan memicu masuk ke tahap anafase (Heuvel 2005). MPF (Maturation Promoting Factor) mencapai konsentrasi tertinggi pada tahap MII (Piotrowska et al. 2000).
Hasil penelitian terdahulu menunjukkan bahwa semua inti donor sel somatis yang ditransfer ke dalam sitoplasma sel oosit pada saat konsentrasi MPF tinggi akan mengalami NEBD (Nuclear Envelope Breakdown) dan PCC (Premature Chromosome Condensation) (Campbell et al. 1993). Pecahnya membran inti sel donor akan menyebabkan materi genetik yang terkandung di dalamnya kontak langsung dengan sitoplasma oosit (Chung et al. 2002). MPF aktif yang merupakan kompleks cyclin B-Cdk1 yang terfosforilasi dan dapat menginduksi sel masuk ke tahap pembelahan mitosis atau meiosis, menyebabkan NEBD, kondensasi kromosom dan perubahan pada sitoskeleton dan morfologi sel (Campbell et al. 1996).
Aktivasi pada oosit tahap MII merupakan modifikasi dari proses fertilisasi secara alami. Osilasi ion Ca2+ intraseluler mutlak diperlukan untuk menginduksi proses aktivasi (Vincent et al. 1992). Pada fertilisasi, masuknya sperma ke dalam oosit akan menginduksi sinyal Ca2+ (Schimidt et al. 2006). Pada aplikasi TISS, aktivasi oosit tahap MII dapat dilakukan secara elektrik maupun secara kimiawi dengan SrCl2 maka konsentrasi MPF akan menurun
secara drastis. Hal ini diduga disebabkan oleh osilasi ion Ca2+ intraseluler (pasca aktivasi) menginduksi serangkaian reaksi biokimia sehingga CSF akan terdegradasi oleh sistem ubiquitin/proteosome. CSF yang inaktif akan menyebabkan APC aktif dan menghancurkan cyclin A dan B sehingga MPF menjadi tidak aktif (konsentrasi menurun) (Elzen & Pines 2001).
Setelah aktivasi, inti sel somatis akan berinteraksi dengan faktor-faktor di sitoplasma dan terjadi proses reformasi inti. Selanjutnya akan terbentuk
Pseudopronucleus (pPN). Penambahan Cytochalasin B merupakan upaya untuk mencegah terbentuknya polar body II (PBII) (Wakayama & Yanagimachi 2001). Hal ini perlu dilakukan untuk mempertahankan jumlah kromosom tetap diploid (2n). Keberhasilan nuclear reprogramming sangat menentukan pola ekspresi genetik selama proses perkembangan dan pertumbuhan embrio kloning (Piedrahita et al. 2004).
Modifikasi Epigenetik pada Embrio Kloning
Materi genetik (genom) dan urutan DNA pada sel somatik yang menyusun satu individu pada dasarnya sama. Dinamika perubahan gen yang aktif dan non aktif merupakan penyebab terjadinya modifikasi epigenetik. Teknik kloning dapat memfasilitasi modifikasi epigenetik yaitu memprogram kembali sel yang telah berdiferensiasi (sel somatik) menjadi ke tahapan awal embrionik yang bersifat totipoten (Wang et al. 2007).
proses nuclear reprogramming inti sel donor. Beberapa penelitian sebelumnya menunjukkan bahwa penambahan Trichostatin A (TSA) berhasil meningkatkan keberhasilan perkembangan embrio kloning mencapai tahap blastosis (Enright
et al. 2003; Kishigami et al. 2006; Li et al. 2008). Scriptaid merupakan senyawa penghambat deasetilasi histon yang memiliki beberapa kelebihan dibandingkan TSA, yaitu toksisitas yang lebih rendah dan dapat memfasilitasi aktivasi transkripsional (Monneret 2005).
Perkembangan Embrionik Praimplantasi Pada Mencit
Siklus sel yang pertama setelah terjadi baik secara fertilisasi (alami) maupun aktivasi (pada aplikasi TISS) akan menghasilkan tahap pembelahan 2 sel dengan terbentuk 2 blastomer (Ng et al. 2004). Tahap ini sangat penting untuk perkembangan embrionik pada mencit karena terjadi transisi dari genom maternal menjadi genom embrionik (Hogan et al. 1986). Proses yang terjadi meliputi berkurangnya mRNA maternal, genom embrionik mulai aktif melakukan transkripsi, dan terjadi perubahan pola sintesis protein. Khusus pada mencit, peristiwa gagalnya proses perkembangan pada tahap 2 sel sering disebut dengan two cell block (Heindryckx et al. 2001).
Setelah melewati pembelahan tahap 8 sel, embrio mamalia umumnya akan mulai mengalami kompaksi (morula). Perkembangan embrio mencit akan mencapai tahap morula pada interval waktu 2-3 hari setelah fertilisasi (Hogan
OPTIMASI SUPEROVULASI, METODE AKTIVASI, DAN
ENUKLEASI PADA PENGEMBANGAN TEKNIK
TRANSFER INTI SEL SOMATIS
Abstract
Embryonic stem cells can be obtained from an embryo generated through fertilization, recently it has been reported that an embryo can also be generated asexually through Somatic Cell Nuclear Transfer (SCNT). This procedure will overcome the ethical issue regarding the usage of embryo that was initially generated for reproductive purposes. The aim of this study was to obtain an optimized oocyte superovulation, activation method, and enucleation using mice oocytes as a model. Mouse oocytes were produced by superovulation method with 5-7.5 IU Pregnant Mare’s Serum Gonadotropin (PMSG) and 5-7.5 IU human Chorionic Gonadotropin (hCG) intraperitoneal (i.p.) injection. Treatment combination for oocytes activation methods were (A) activation in CZB & SrCl2 (prepared in stock) for two hours and in CZB &
CB for four hours; (B) activation in CZB & SrCl2 (fresh medium) for two
hours and in CZB & CB for four hours; (C) activation in CZB & CB & SrCl2
(fresh medium) for six hours. The optimation of enucleation was conducted with sucrose addition in the enucleation medium. Results showed that using doses of 7.5 IU PMSG and hCG hormones can increase the oocyte cell production optimization through superovulation treatment. The most optimal method of activation is medium CZB & CB & SrCl2 (fresh medium) for six
hours (method C) to activate oocyte cells until it reaches the level of activation of 97.21%. The addition of 3% sucrose able to increase the enucleation rate.
Keywords: superovulation, activation, enucleation, oocyte
Abstrak
Sel punca embrionik pada umumnya diperoleh dari embrio hasil fertilisasi, namun sekarang dilaporkan bahwa embrio juga dapat diperoleh dari hasil Transfer Inti Sel Somatis (TISS). Prosedur ini diharapkan dapat mengatasi masalah etik dalam penggunaan embrio yang sebelumnya dihasilkan untuk tujuan reproduksi. Tujuan dari penelitian ini adalah untuk melakukan optimasi perlakuan superovulasi, metode aktivasi, dan enukleasi pada mencit sebagai hewan model. Oosit mencit diproduksi menggunakan teknik superovulasi dengan penyuntikan Pregnant Mare’s Serum Gonadotropin (PMSG) 5 - 7.5 IU dan human Chorionic Gonadotropin (hCG) 5 - 7.5 IU secara intraperitoneal (i.p.). Kombinasi perlakuan untuk metode aktivasi oosit adalah (A) aktivasi di medium CZB & SrCl2 (medium stok) selama dua jam
empat jam; (C) aktivasi di medium CZB & CB & SrCl2 (medium segar) selama
enam jam. Optimasi teknik enukleasi dilakukan dengan penambahan sukrosa ke dalam medium. Hasil penelitian ini menunjukkan bahwa dosis PMSG dan hCG 7,5 IU dapat meningkatkan jumlah oosit pada aplikasi superovulasi. Perlakuan dengan medium CZB & CB & SrCl2 (medium segar) selama enam
jam (perlakuan C) merupakan metode aktivasi yang paling optimal dan dapat mencapai tingkat aktivasi 97,21%. Penambahan sukrosa 3% dapat meningkatkan keberhasilan enukleasi.
Kata kunci: superovulasi, aktivasi, enukleasi, oosit
Pendahuluan
Tahapan penting pada aplikasi SCNT adalah pada saat terjadi nuclear reprogramming. Inti sel somatis yang telah ditransfer ke dalam sitoplasma oosit akan mengalami perubahan baik secara morfologi maupun molekuler (Choi et al. 2004). Beberapa hipotesis menyatakan bahwa perlakuan aktivasi pada oosit pasca transfer inti merupakan awal dari proses nuclear reprogramming (Loi et al. 2003).
Oosit pada tahap metafase II (MII) digunakan sebagai resipien setelah dikeluarkan intinya. Pada tahap MII, oosit akan tetap berada dalam kondisi stabil dan bertahan pada kondisi tersebut karena adanya pengaruh dari
cytostatic factor (CSF) (Schimidt et al. 2006). CSF juga menghambat aktivitas
Anaphase Promoting Complex (APC) yang berperan memicu masuk ke tahap anafase (van den Heuvel 2005). Maturation Promoting Factor (MPF) mencapai konsentrasi tertinggi pada tahap MII (Piotrowska et al. 2000).
Menurut Campbell et al. (1993) Nuclear Envelope Breakdown (NEBD) dan Premature Chromosome Condensation (PCC) akan dialami oleh semua inti donor sel yang ditransfer ke dalam sitoplasma sel oosit pada saat konsentrasi MPF tinggi. Mekanisme tersebut dapat menyebabkan membran inti sel donor pecah dan materi genetik yang terkandung didalamnya berinteraksi dengan sitoplasma sel oosit (Chung et al. 2002). MPF aktif yang merupakan kompleks cyclin B-Cdk1 yang mengalami fosforilasi. Konsentrasi Cdk1 cenderung stabil, namun konsentrasi cyclin B yang bervariasi (Campbell et al.
1996).
Aktivasi pada oosit tahap MII merupakan modifikasi dari proses fertilisasi secara alami. Osilasi ion Ca2+ intraseluler mutlak diperlukan untuk menginduksi proses aktivasi (Vincent et al. 1992). Pada fertilisasi, masuknya sperma ke dalam oosit akan menginduksi sinyal Ca2+ (Schimidt et al. 2006). Pada aplikasi SCNT, aktivasi oosit tahap MII dapat dilakukan secara elektrik maupun secara kimiawi dengan SrCl2 maka konsentrasi MPF akan menurun
menyebabkan APC aktif dan menghancurkan cyclin A dan B sehingga MPF menjadi tidak aktif (konsentrasi menurun) (den Elzen and Pines 2001).
Setelah aktivasi, inti sel somatis akan berinteraksi dengan faktor-faktor di sitoplasma dan terjadi proses reformasi inti. Selanjutnya akan terbentuk
Pseudopronucleus (pPN). Penambahan Cytochalasin B merupakan upaya untuk mencegah terbentuknya polar body II (PBII) (Wakayama and
Yanagimachi, 2001). Hal ini perlu dilakukan untuk mempertahankan jumlah kromosom tetap diploid (2n). Keberhasilan nuclear reprogramming sangat menentukan pola ekspresi genetik selama proses perkembangan dan pertumbuhan sel embrio kloning (Piedrahita et al., 2004).
Metode Penelitian
Penyiapan Sel Oosit
Superovulasi dilakukan menurut Kishigami et al. (2006) dengan sedikit modifikasi. Oosit diisolasi dari mencit betina galur ddy yang berumur 8-12 minggu. Mencit betina distimulasi untuk mengalami superovulasi dengan menyuntikan hormon Pregnant Mare’s Serum Gonadotrophin/PMSG (Intervet International BV, Folligon, Boxmeer, Holland) 7.5 IU dan human Chorionic Gonadotrophin/ hCG (Intervet International BV, Chorulon, Boxmeer, Holland) 7.5 IU menggunakan syringe (Terumo, SS+01T2613, Philippines) 1ml dengan interval waktu 46-48 jam. Enam belas jam setelah penyuntikan hCG, COC (Cumulus Oocyte Complexes) diisolasi dari oviduct dengan menggunakan mikroskop stereo (Nikon, SMZ-2T, Japan). Setelah diisolasi dari sel kumulus maka oosit dikultur dalam medium CZB tanpa glukosa yang mengandung BSA (Sigma, A3311, St. Louis, MO, USA) 1mg/ml, ditutup dengan mineral oil
(Sigma, M8410, St. Lois, MO, USA) dan disimpan dalam suhu 37°C dan kadar CO2 5% di dalam inkubator (Sanyo, MCO-95, Japan).
Manipulasi Embrio Mencit
Pembuatan Pipet Mikromanipulasi Injeksi dan Holding
Bahan pipet mikromanipulasi adalah tabung borosilikat gelas kapiler tanpa filamen (Sutter Instrument, B100-75-10). Pipet mikromanipulasi injeksi dibuat dengan menggunakan alat micro-puller (Sutter Instrument, P-87) dan
micro-forge (Narishige, MF-79, Japan). Ujung pipet mikromanipulasi injeksi berdiameter bagian luar ~ 15!m untuk enukleasi dan 5-6!m untuk transfer inti.
Mercury (Madespa MA, 0561, Spain) dimasukkan ke dalam pipet mikromanipulasi injeksi melalui bagian belakang menggunakan syringe
(Terumo, SS+01T2613, Philippines) 1ml. Ujung pipet mikromanipulasi
Enukleasi Kromosom MII dari Sel Oosit
Enukleasi dilakukan menurut Kishigami et al. (2006) dan Wakayama et al. (2001) dengan sedikit modifikasi. Kumpulan oosit (biasanya berjumlah 20) dipindahkan ke dalam drop medium M2 (± 10 !l) yang mengandung cytochalasin B (Sigma, C6762, St. Louis, MO, USA) 5 !l/ml. Tutup cawan petri 35mm (Nunc, 153066, Roskilde, Denmark) digunakan sebagai tempat membuat drop medium untuk mikromanipulasi. Mikroskop inverted (Olympus, IX70, Japan) dengan Thermoplate (Tokai Hit, MATS-U55R30, Japan) dan satu perangkat micromanipulator (Narishige, Japan) digunakan untuk melakukan manipulasi oosit. Oosit diposisikan tidak bergerak dengan ditahan menggunakan pipet holding. Zona pelusida oosit lalu ditembus dengan menggunakan Piezo (Prime Tech, PMAS-CT150, Japan) yang menggetarkan ujung pipet mikromanipulasi injeksi yang digunakan untuk enukleasi (dengan diameter bagian dalam ± 15 !m). Komplek benang spindel kromosom MII, dapat ditandai sebagai spot yang dapat ditembus cahaya di dalam ooplasma dengan perbesaran 20x Optik Hoffman Modulation Contrast (Modulation Optics Inc, Greenvale, New York, USA). Kromosom MII dihisap dengan mikropipet injeksi dan hanya sedikit cairan ooplasma yang terhisap. Setelah itu, pipet ditarik dengan halus dan perlahan hingga melewati zona pelusida. Konfirmasi keberadaan inti/kromosom MII dilakukan dengan cara mewarnai oosit pasca enukleasi dengan Hoechst 33342 (Invitrogen, H1399, Eugene, USA) 10 !g/ml dalam PBS (Gibco, 21600-010, Grand Island, NY, USA) tanpa serum selama 10 menit, lalu oosit diletakkan ke dalam sumur-sumur di dalam cawan Terazaki dan diamati di mikroskop fluorescent (Nikon, E600, Japan) dengan panjang gelombang 380nm. Oosit yang masih berinti akan terlihat lebih berpendar karena Hoechst 33342 akan berikatan dengan DNA inti. Setelah dipilih yang enukleasinya berhasil, maka oosit dipindahkan ke dalam CZB tanpa cytochalasin B dan disimpan selama lebih dari 2 jam pada 37°C dan kadar CO2 5%.
Rancangan Percobaan
Pada tahap ini, variabel respon yang diukur dalam optimasi produksi oosit adalah jumlah oosit yang dihasilkan dari perlakuan superovulasi dengan dosis PMSG & HCG masing-masing sebesar 5 IU dan 7.5 IU per mencit. Optimasi enukleasi dilakukan dengan perlakuan penambahan sukrosa 3% dengan variabel respon yang diamati adalah terbentuknya spot transparan dan tingkat keberhasilan enukleasi. Sedangkan variabel respon yang diukur dalam optimasi perlakuan aktivasi oosit adalah tingkat aktivasi oosit hingga mengalami pembelahan tahap dua sel berdasarkan perbedaan perlakuan aktivasi yaitu: (1) oosit dikultur dalam kombinasi campuran medium CZB dan SrCl2 (dibuat stok/ bukan medium segar) selama 2 jam, lalu dikultur dalam
campuran medium CZB dan Cytochalasin B selama 4 jam; (2) oosit dikultur dalam kombinasi campuran medium CZB dan SrCl2 (dibuat sebelum dipakai/
campuran medium CZB dan Cytochalasin B (dibuat stok/ bukan medium segar) dan ditambahkan SrCl2 sebelum digunakan.
Analisa Data
Setiap perlakuan dilakukan tiga kali ulangan. Data kuantitatif yang diperoleh lalu diuji secara statistik dengan uji ANOVA dengan tingkat kepercayaan 95% dan apabila ada beda nyata maka dilanjutkan dengan uji DMRT (Duncan Multiple Range Test). Data kualitatif disajikan dalam bentuk foto atau gambar.
Hasil dan Pembahasan
Aplikasi TISS (Transfer Inti Sel Somatik) membutuhkan oosit dalam jumlah yang relatif cukup banyak sehingga diperlukan usaha untuk meningkatkan produksi oosit. Perlakuan yang banyak diterapkan adalah superovulasi, yaitu dengan menggunakan hormon PMSG untuk menginduksi terjadinya folikulogenesis dan hormon hCG untuk menginduksi terjadinya pematangan dan pelepasan oosit dari ovarium ke oviduk.
Berdasarkan tabel 1 terlihat bahwa perlakuan superovulasi dengan menggunakan hormon PMSG dan hCG dosis 7.5 IU menunjukkan produksi oosit berkualitas baik lebih tinggi daripada dengan dosis 5 IU. Rata-rata oosit berkualitas baik yang diperoleh dengan dosis 7.5 IU adalah 20.61/ mencit sedangkan dengan dosis 5 IU adalah 11.61/ mencit. Namun penambahan dosis juga mempunyai efek samping yaitu jumlah oosit berkualitas buruk menjadi meningkat secara signifikan. Hal ini dapat dilihat dari prosentasenya yang naik secara signifikan yaitu 9.22% pada dosis 5 IU menjadi 14.27% pada dosis 7.5 IU. Penambahan hormon yang terlalu tinggi dapat mempengaruhi keseimbangan hormonal yang ada di dalam sistem reproduksi mencit sehingga diperlukan optimasi agar dapat diperoleh hasil superovulasi yang optimal yaitu jumlah oosit yang berkualitas baik meningkat secara signifikan.
Tabel 1. Perlakuan superovulasi untuk menghasilkan oosit
Dosis PMSG & hCG Jumlah Mencit Total Jumlah Oosit Rata – rata (oosit / mencit) Kualitas oosit berdasarkan pengamatan morfologi (%) Baik (oosit / mencit) Buruk
(oosit / mencit)
5 IU 28 358 12.79a 11.61 (90.78)a 1.18 (9.22)a
7.5 IU 28 673 24.03b 20.61 (85.74)b 3.43 (14.27)b Keterangan: huruf superscript yang berbeda pada kolom yang sama
Menurut Martin-Coello et al. (2008), pada mencit normal jumlah oosit yang diovulasikan berkisar antara delapan hingga dua belas tergantung pada jenis strain. Jumlah tersebut dapat ditingkatkan dengan menggunakan tambahan hormon dari luar (eksogenus). Keberhasilan meningkatkan jumlah oosit dapat menurunkan jumlah hewan yang diperlukan dalam penelitian. perlakuan superovulasi tidak meningkatkan kadar gonadotropin endogenus. Variasi respon ovarium terhadap hormon eksogenus tergantung pada perbedaan genetik di antara strain. Respon perlakuan superovulation dapat dipengaruhi oleh umur, berat badan, status nutrisi, kesehatan, dan kondisi perawatan hewan.
Menurut Lim et al. (1985), PMSG tidak meningkatkan jumlah folikel yang berukuran besar, namun PMSG merubah keseimbangan antara folikel yang berkembang dan folikel atresia dengan cara mencegah atau memperlambat proses atresia. Reseptor hormon PMSG (FSH) paling banyak terdapat pada sel-sel granulosa yang ada pada folikel sekunder. Oleh karena itu penambahan FSH akan meningkatkan proliferasi dari sel granulosa sehingga produksi estrogen akan semakin meningkat dan sel oosit akan semakin matang. Perlakuan superovulasi pada mencit mempunyai dampak negatif yaitu dapat menyebabkan perlambatan perkembangan embrionik baik secara in vitro
maupun in vivo, dan meningkatkan abnormalitas pembentukan blastosis (Van der Auwera and D'Hooghe 2001).
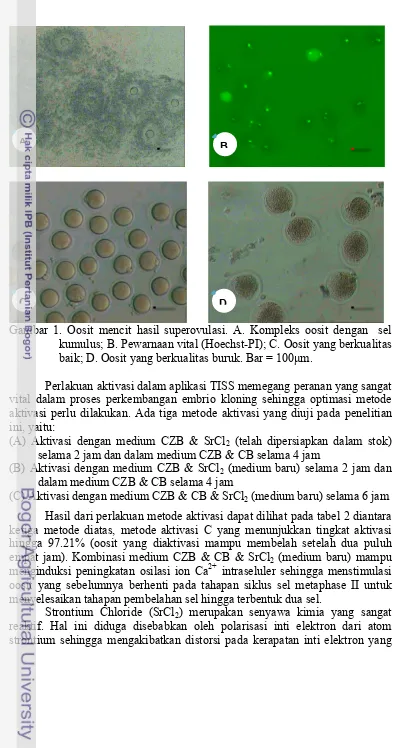
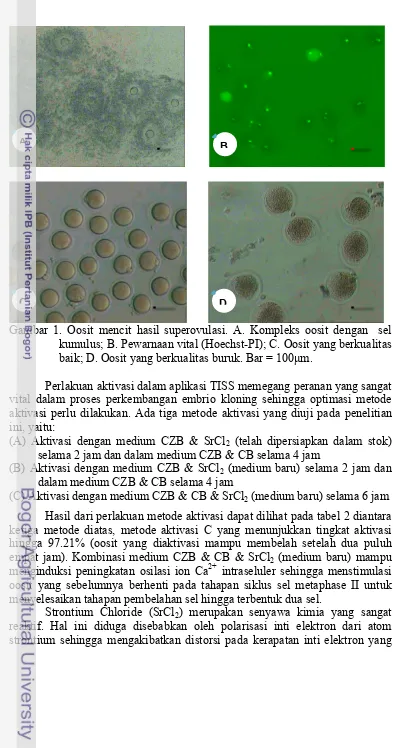
Dalam penelitian aplikasi TISS ini menggunakan sel donor inti yaitu sel kumulus. Pada saat oosit diisolasi dari oviduk, oosit masih dikelilingi oleh sel kumulus (gambar 1), sehingga untuk memisahkan oosit dengan sel kumulus harus menggunakan cara enzimatik yaitu dengan enzim hyaluronidase.
Gambar 1. Oosit mencit hasil superovulasi. A. Kompleks oosit dengan sel kumulus; B. Pewarnaan vital (Hoechst-PI); C. Oosit yang berkualitas baik; D. Oosit yang berkualitas buruk. Bar = 100µm.
Perlakuan aktivasi dalam aplikasi TISS memegang peranan yang sangat vital dalam proses perkembangan embrio kloning sehingga optimasi metode aktivasi perlu dilakukan. Ada tiga metode aktivasi yang diuji pada penelitian ini, yaitu:
(A) Aktivasi dengan medium CZB & SrCl2 (telah dipersiapkan dalam stok)
selama 2 jam dan dalam medium CZB & CB selama 4 jam
(B) Aktivasi dengan medium CZB & SrCl2 (medium baru) selama 2 jam dan
dalam medium CZB & CB selama 4 jam
(C) Aktivasi dengan medium CZB & CB & SrCl2 (medium baru) selama 6 jam
Hasil dari perlakuan metode aktivasi dapat dilihat pada tabel 2 diantara ketiga metode diatas, metode aktivasi C yang menunjukkan tingkat aktivasi hingga 97.21% (oosit yang diaktivasi mampu membelah setelah dua puluh empat jam). Kombinasi medium CZB & CB & SrCl2 (medium baru) mampu
menginduksi peningkatan osilasi ion Ca2+ intraseluler sehingga menstimulasi oosit yang sebelumnya berhenti pada tahapan siklus sel metaphase II untuk menyelesaikan tahapan pembelahan sel hingga terbentuk dua sel.
Strontium Chloride (SrCl2) merupakan senyawa kimia yang sangat
reaktif. Hal ini diduga disebabkan oleh polarisasi inti elektron dari atom strontium sehingga mengakibatkan distorsi pada kerapatan inti elektron yang
!
A
!
B
!
C
!
[image:30.595.90.483.94.842.2] [image:30.595.97.475.118.430.2]berinteraksi dengan ikatan Sr dan Cl (Guido and Gigli, 1976). Pembuatan medium stok akan membuat strontium terpapar dan berinteraksi dengan beberapa senyawa lain yang menjadi komponen medium tersebut. Dengan demikian, hal tersebut akan mengurangi sifat reaktif dari strontium yang diharapkan dapat meningkatkan osilasi ion Ca2+ di dalam sitoplasma oosit sehingga mampu menginduksi sel oosit untuk melanjutkan proses pembelahan yang sebelumnya terhenti pada MII.
Salah satu parameter keberhasilan aktivasi adalah terbentuknya pronukleus sekitar enam jam setelah aktivasi (gambar 2). Cytochalasin B yang ditambahkan dalam komposisi medium aktivasi berperan untuk menghambat keluarnya materi genetik pada proses pembelahan sel, sehingga pada sel yang diaktivasi tetap memiliki dua pronukleus dan bersifat diploid (Wakayama and
Yanagimachi 2001).
Gambar 2. Sel oosit setelah diaktivasi. A. Sel oosit setelah diaktivasi selama 6 jam menunjukkan terbentuknya pronukleus; B. Sel oosit yang telah diaktivasi dan dikultur in vitro selama 24 jam membelah ke tahap dua sel. Bar = 100µm.
Hasil penelitian ini juga menunjukkan bahwa aktivasi menggunakan medium segar (metode B dan C) lebih baik daripada medium stok (metode A). Menurut Jones (2005), secara alami oosit mamalia yang difertilisasi/ diaktivasi
!
A
!
B
Tabel 2. Perlakuan metode aktivasi sel oosit
Metode Aktivasi
! Sel Oosit yang Diaktivasi
Tingkat Aktivasi (%)
Tidak Membelah Membelah
(A) medium stok; 2 jam 250 169 (67.60)a 81 (32.40)a
(B) medum baru; 2 jam 146 36 (24.66)b 110 (75.34)b
(C) medium baru; 6jam 215 6 (2.79)c 209 (97.21)c
oleh sperma akan mengalami peningkatan ion Ca2+ intraseluler selama enam jam. Hal ini juga terlihat pada hasil aktivasi dengan menggunakan metode C (enam jam) yang lebih tinggi daripada metode B (dua jam). Karakter strontium sebagai aktivator buatan adalah dapat berulang-ulang menginduksi peningkatan osilasi Ca2+, menggantikan ikatan Ca2+ di dalam oosit, dan menginduksi peningkatan Ca2+ intraseluler (Alberio et al., 2001).
Salah satu kendala dalam tahapan enukleasi adalah kesulitan untuk menentukan dimana letak inti sel (materi genetik) berada di dalam sitoplasma oosit. Oleh karena itu dalam penelitian ini, dicoba penambahan sukrosa sebanyak 3% untuk membuat oosit menjadi terbentuk spot transparan pada daerah yang mengandung materi genetik (gambar 3).
Tabel 3. Keberhasilan enukleasi inti oosit (sel resipien)
PERLAKUAN ! Oosit Swelling
(spot transparan) Tingkat Enukleasi
kontrol 73 19 (26.02%)a 13 (17.8%)a
sukrosa 3% 87 52 (59.77%)b 36 (41.37%)b
Keterangan: huruf superscript yang berbeda pada kolom yang sama menunjukkan ada perbedaan signifikan (p " 0.05).
Berdasarkan tabel 3 terlihat bahwa perlakuan penambahan sukrosa sebesar 3% dapat meningkatkan keberhasilan enukleasi hingga mencapai 41.37% dari sebelumnya hanya sebesar 17.8%. Selain itu, penambahan sukrosa 3% juga berhasil menstimulasi terbentuknya spot transparan sebesar 59.77% sehingga hal ini mempermudah proses enukleasi. Penambahan sukrosa 3% membuat inti sel lebih tervisualisasi dengan lebih jelas. Oosit yang telah berhasil dienukleasi lalu dilakukan pewarnaan Hoechst 33342 untuk mengkonfirmasi bahwa inti sel benar-benar telah berhasil dikeluarkan (gambar 3).
Menurut Liu et al. (2002), material genetik (inti oosit) yang letaknya berdekatan dengan Polar Body I hanya sekitar 31% dari seluruh total populasi oosit yang diteliti. Oleh karena itu diperlukan suatu modifikasi agar dapat diperoleh cara terbaik untuk menentukan letak inti di dalam sitoplasma oosit. Salah satu caranya adalah dengan penambahan sukrosa 3% pada medium praenukleasi. Larutan hipertonik sukrosa akan menyebabkan oosit mengkerut, mengubah konsentrasi protein sitoplasma yang dapat merubah sifat membran dan mempengaruhi dinamika sitoskeleton (Wang et al., 2001). Sukrosa menginduksi proyeksi yang dihasilkan dari interaksi antara cortical actin
pembengkakan di sekeliling kromomosom dan terbentuk spot transparan pada daerah spindle. Dengan demikian, penambahan sukrosa dapat mempermudah untuk menentukan lokasi inti oosit dan dapat meningkatkan tingkat keberhasilan enukleasi.
Gambar 3. Enukleasi dengan menggunakan sukrosa 3%. A. Anak panah menunjukkan bagian sitoplasma oosit yang mengalami swelling. B. Oosit yang telah dienukleasi dikonfirmasi dengan pewarnaan Hoecsht 33342 untuk mendeteksi keberadaan inti sel. Bar = 100µm.
Simpulan
Dosis PMSG dan hCG 7,5 IU dapat meningkatkan jumlah oosit pada aplikasi superovulasi. Perlakuan dengan medium CZB & CB & SrCl2 (medium
PRODUKSI DAN KULTUR IN VITRO EMBRIO KLONING
DAN EMBRIO PARTENOGENETIK MENCIT
Abstract
Cloned embryo and parthenogenetic embryo are a potential source of stem cells for regenerative medicine. Stem cells derived from those embryos is expected to overcome the ethical issues to the use of fertilization embryos for therapeutic purposes. The pre-implantation development is a critical step for developing embryos reaches the blastocyst stage. The objective of the research is to produce mouse cloned embryo, parthenogenetic embryo, and in vivo
fertilized embryo and study the stages of pre-implantation development in vitro
culture. In vivo Fertilized embryos, mouse oocytes, and cumulus cells were used in this study. Treatment was performed on female mice superovulated by PMSG and hCG hormone injections. In vivo Fertilized embryos two-cell stage were collected on the second day post hCG injection. Cloned embryos were produced through Somatic Cell Nuclear Transfer (SCNT), which includes enucleation, nuclear transfer and artificial activation. Parthenogenetic embryos were produced by artificial activation technique. The result of the research indicated that SCNT application is able to produce cloned embryos which are capable to develop to blastocyst stage (3,2%). In addition artificial activation of oocytes could produce parthenogenetic embryos which are capable to develop up to the blastocyst stage (8,6%). In conclusion, efficiency level of parthenogenetic embryos that is able to reach the blastocyst stage was higher than in the cloned embryos. Fertilized embryos showed a better development and more efficient compared with cloned embryos and parthenogenetic embryos in vitro culture.
Keywords: Embryo, Fertilization, Cloned, Parthenogenetic, In Vitro Culture
Abstrak
dari aplikasi Transfer Inti Sel Somatis (TISS) yang meliputi enukleasi, transfer inti dan aktivasi buatan. Embrio partenogenetik dihasilkan dengan teknik aktivasi buatan. Hasil menunjukkan bahwa aplikasi TISS dapat menghasilkan embrio kloning yang mampu berkembang hingga mencapai tahap blastosis (3,2%). Embrio partenogenetik yang dihasilkan oleh aktivasi buatan dapat berkembang hingga tahap blastosis (8,6%). Tingkat efisiensi embrio partenogenetik yang mampu mencapai tahap blastosis lebih tinggi dari pada embrio kloning. Embrio fertilisasi menunjukkan perkembangan yang lebih baik dan efisien dibandingkan dengan embrio kloning dan embrio partenogenetik pada kultur in vitro.
Kata Kunci: Embrio, Fertilisasi, Kloning, Partenogenetik, Kultur In Vitro
Pendahuluan
Perkembangan teknologi Transfer Inti Sel Somatik (TISS) / Somatic Cell Nuclear Transfer telah menjadi tren baru dalam kemajuan embriologi dan biomedis (McLaren 2000). Teknik TISS menjadi sangat populer setelah terungkap dari beberapa hasil studi yang meneliti tentang potensi pemanfaatan teknik transfer inti untuk memproduksi ntESC (nuclear transfer Embryonic Stem Cell) dan pemanfaatannya untuk terapi penyakit degeneratif (Hochedlinger & Jaenisch 2003). Teknik TISS pada dasarnya meliputi enukleasi (pengeluaran inti oosit resipien), transfer inti (inti sel somatik dimasukkan ke dalam sitoplasma sel oosit resipien), dan aktivasi (menginduksi oosit hasil rekontruksi untuk mengalami nuclear reprogramming dan berkembang seperti embrio yang normal) (Colman 2000).
Aplikasi TISS untuk memproduksi ntESC memberi harapan baru dalam pengembangan therapeutic cloning sebagai alternatif pengobatan berbagai penyakit degeneratif. Secara teoritis ntESC memiliki beberapa keunggulan dibandingkan dengan sel punca (stem cell) dari sumber yang lain. Transplantasi ntESC yang bersifat autologous diharapkan mampu mengatasi masalah penolakan sistem imun pada penderita (Cibelli et al. 2001). Ketidakcocokan karakter HLA (Human Lymphocyte Antigen), antara sel donor dengan sel pasien menyebabkan sel donor dianggap sebagai substansi asing yang dapat menimbulkan reaksi penolakan yang dikenal dengan GvHD (graft versus host diseases) (Wobus & Boheler 2005). Berdasarkan hasil penelitian sebelumnya telah dilaporkan bahwa ESC dapat diarahkan menjadi sel-sel neuron (Wakayama et al. 2001), ginjal (Hipp & Atala 2004), otot jantung (Kodifis et al. 2004), dan pankreas (Paek et al. 2005).
adalah proses nuclear reprogramming belum diketahui secara sempurna, sehingga inti sel belum sepenuhnya dapat berubah pola ekspresi genetiknya menjadi seperti pola perkembangan embrionik (Hochedlinger & Jaenisch 2003). Berbagai pengembangan teknik TISS telah dilakukan, namun hingga saat ini belum diperoleh hasil yang memuaskan. Selain itu aplikasi TISS pada manusia masih menjadi perdebatan dalam masalah etika, sehingga pengembangan teknik ini lebih banyak dikaji pada hewan coba (Murti et al. 2008).
Tahapan penting pada aplikasi TISS adalah pada saat terjadi nuclear reprogramming. Inti sel somatis yang telah ditransfer ke dalam sitoplasma oosit akan mengalami perubahan baik secara morfologi maupun molekuler (Choi et al. 2004). Beberapa hipotesis menyatakan bahwa perlakuan aktivasi pada oosit pasca transfer inti merupakan awal dari proses nuclear reprogramming (Loi et al. 2003). Aktivasi pada oosit tahap Metafase II (MII) merupakan modifikasi dari proses fertilisasi secara alami. Osilasi ion Ca2+ intraseluler mutlak diperlukan untuk menginduksi proses aktivasi (Vincent et al. 1992).
Pada transfer inti dengan resipien pada tahap MII, konsentrasi MPF yang tinggi dapat menyebabkan inti donor mengalami NEBD (Nuclear Envelope Breakdown) dan PCC (Premature Chromosome Condensation) (Wakayama & Yanagimachi 2001). Secara molekuler, akan terjadi hipermetilasi DNA dan deasetilasi histon. Asetilasi histon juga berperan dalam modifikasi epigenetik karena dapat mempengaruhi metilasi DNA dan ekspresi protein (Enright et al. 2003). Keberhasilan nuclear reprogramming sangat menentukan pola ekspresi genetik selama proses perkembangan dan pertumbuhan sel embrio kloning (Piedrahita et al. 2004).
Metode Penelitian
Donor Inti Sel
Isolasi sel kumulus dilakukan menurut Kishigami et al. (2006) dan Wakayama et al. (1998) dengan sedikit modifikasi. Sel-sel kumulus dipisahkan dengan penambahan hyaluronidase0.1% (Sigma, H4272, St. Louis, MO, USA) dalam medium M2 (Specialty media, MR-015P-D, Phillipsburg, New Jersey, USA). Perlakuan tersebut dilakukan selama 10 menit. Lalu 2 !l dari suspensi sel-sel kumulus dipindahkan ke dalam 10 !l CZB-tanpa glukosa yang mengandung polyvinylpyrrolidone (Mr 360 x 103;Sigma, PVP360, St. Louis,
MO, USA) 10% (w/v). Sel kumulus yang dipilih sebagai donor untuk transfer inti adalah yang berukuran 5-7 µm. Sel-sel kumulus dikultur dalam CZB –PVP pada suhu 37°C dengan kadar CO2 5% selama minimal 1 jam sebelum
perlakuan lebih lanjut.
Resipien Sel
Superovulasi dilakukan menurut Kishigami et al. (2006) dengan sedikit modifikasi. Oosit diisolasi dari mencit betina galur ddy yang berumur 8-12 minggu. Mencit betina distimulasi untuk mengalami superovulasi dengan menyuntikan hormon Pregnant Mare’s Serum Gonadotrophin/PMSG (Intervet International BV, Folligon, Boxmeer, Holland) 7.5 IU dan human Chorionic Gonadotrophin/ hCG (Intervet International BV, Chorulon, Boxmeer, Holland) 7.5 IU menggunakan syringe (Terumo, SS+01T2613, Philippines) 1ml dengan interval waktu 46-48 jam. Enam belas jam setelah penyuntikan hCG, COC (Cumulus Oocyte Complexes) diisolasi dari oviduct dengan menggunakan mikroskop stereo (Nikon, SMZ-2T, Japan). Setelah diisolasi dari sel kumulus maka oosit dikultur dalam medium CZB tanpa glukosa yang mengandung BSA (Sigma, A3311, St. Louis, MO, USA) 1mg/ml, ditutup dengan mineral oil
(Sigma, M8410, St. Lois, MO, USA) dan disimpan dalam suhu 37°C dan kadar CO2 5% di dalam inkubator (Sanyo, MCO-95, Japan).
Manipulasi Embrio Mencit
Pembuatan Pipet Mikromanipulasi Injeksi dan Holding
Bahan pipet mikromanipulasi adalah tabung borosilikat gelas kapiler tanpa filamen (Sutter Instrument, B100-75-10). Pipet mikromanipulasi injeksi dibuat dengan menggunakan alat micro-puller (Sutter Instrument, P-87) dan
micro-forge (Narishige, MF-79, Japan). Ujung pipet mikromanipulasi injeksi berdiameter bagian luar ~ 15!m untuk enukleasi dan 5-6!m untuk transfer inti.
Mercury (Madespa MA, 0561, Spain) dimasukkan ke dalam pipet mikromanipulasi injeksi melalui bagian belakang menggunakan syringe
(Terumo, SS+01T2613, Philippines) 1ml. Ujung pipet mikromanipulasi
Enukleasi Kromosom MII dari Sel Oosit
Enukleasi dilakukan menurut Kishigami et al. (2006) dan Wakayama et al. (2001) dengan sedikit modifikasi. Kumpulan oosit (biasanya berjumlah 20) dipindahkan ke dalam drop medium M2 (± 10 !l) yang mengandung cytochalasin B (Sigma, C6762, St. Louis, MO, USA) 5 !l/ml. Tutup cawan petri 35mm (Nunc, 153066, Roskilde, Denmark) digunakan sebagai tempat membuat drop medium untuk mikromanipulasi. Mikroskop inverted (Olympus, IX70, Japan) dengan Thermoplate (Tokai Hit, MATS-U55R30, Japan) dan satu perangkat micromanipulator (Narishige, Japan) digunakan untuk melakukan manipulasi oosit. Oosit diposisikan tidak bergerak dengan ditahan menggunakan pipet holding. Zona pelusida oosit lalu ditembus dengan menggunakan Piezo (Prime Tech, PMAS-CT150, Japan) yang menggetarkan ujung pipet mikromanipulasi injeksi yang digunakan untuk enukleasi (dengan diameter bagian dalam ± 15 !m). Komplek benang spindel kromosom MII, dapat ditandai sebagai spot yang dapat ditembus cahaya di dalam ooplasma dengan perbesaran 20x Optik Hoffman Modulation Contrast (Modulation Optics Inc, Greenvale, New York, USA). Kromosom MII dihisap dengan mikropipet injeksi dan hanya sedikit cairan ooplasma yang terhisap. Setelah itu, pipet ditarik dengan halus dan perlahan hingga melewati zona pelusida. Konfirmasi keberadaan inti/kromosom MII dilakukan dengan cara mewarnai oosit pasca enukleasi dengan Hoechst 33342 (Invitrogen, H1399, Eugene, USA) 10 !g/ml dalam PBS (Gibco, 21600-010, Grand Island, NY, USA) tanpa serum selama 10 menit, lalu oosit diletakkan ke dalam sumur-sumur di dalam cawan Terazaki dan diamati di mikroskop fluorescent (Nikon, E600, Japan) dengan panjang gelombang 380nm. Oosit yang masih berinti akan terlihat lebih berpendar karena Hoechst 33342 akan berikatan dengan DNA inti. Setelah dipilih yang enukleasinya berhasil, maka oosit dipindahkan ke dalam CZB tanpa cytochalasin B dan disimpan selama lebih dari 2 jam pada 37°C dan kadar CO2 5%.
Transfer Inti
telah disuntik kemudian dipindahkan dan disimpan dalam media CZB pada suhu 37°C selama 1–3 jam sebelum perlakuan aktivasi.
Aktivasi Oosit Pasca Transfer Inti
Aktivasi embrio pasca transfer inti dilakukan menurut Kishigami et al. (2006) dan Wakayama et al. (2001) dengan sedikit modifikasi. Embrio kloning diaktivasi selama enam jam dalam media CZB tanpa Ca2+ mengandung Sr2+ 10 mM (Sigma, 255521, St.Louis, USA) dan cytochalasin B 5 !g/ml (Sigma, C6762, St. Louis, MO, USA).
Produksi Embrio Partenogenetik
Produksi embrio partenogenetik dilakukan menurut Murti et al. (2009). Oosit hasil isolasi diaktivasi menggunakan kombinasi medium CZB tanpa Ca2+ dan Mg2+ dengan cytochalasin B (Sigma, C6762, St. Louis, MO, USA) 5 !g/ ml dan strontium chlorida (SrCl2) (Sigma, 255521, St. Louis, MO, USA) 10
mM selama enam jam di dalam inkubator (37°C; kadar CO2 5%)
Produksi Embrio Fertilisasi
Mencit betina yang telah dilakukan superovulasi digabungkan dengan mencit jantan dengan perbandingan 1:1. Identifikasi mencit betina yang telah melakukan perkawinan dengan mencit jantan dilakukan dengan memeriksa sumbat vagina (vaginal plug) 15-18 jam setelah penyuntikan hCG (MataHine 2008). Koleksi embrio dilakukan pada hari kedua setelah penyuntikan hCG dengan mencacah oviduk di dalam medium M2 menggunakan mikroskop stereo (Nikon, SMZ-2T, Japan). Embrio tahap dua sel atau lebih dimasukkan ke dalam cawan petri dan dicuci sebanyak tiga kali dalam medium CZB tanpa glukosa.
Kultur In Vitro Embrio
Rancangan Penelitian
Penelitian ini membandingkan perkembangan praimplantasi embrio yang dihasilkan dari TISS (embrio kloning) dengan embrio partenogenetik dan embrio hasil fertilisasi in vivo. Pengamatan mulai dilakukan pada embrio tahap satu sel (embrio kloning dan partenogenetik), sedangkan pada embrio hasil fertilisasi mulai dilakukan pada tahap dua sel. Perkembangan embrio diamati hingga kultur hari ketiga dengan asumsi embrio berkembang hingga tahap blastosis.
Hasil dan Pembahasan
Penelitian ini menggunakan embrio dari sumber yang berbeda, yaitu fertilisasi in vivo (embrio hasil fertilisasi), TISS (embrio kloning), dan partenogenesis (embrio partenogenetik). Embrio fertilisasi merupakan hasil dari pertemuan spermatozoa dengan oosit di dalam oviduk sehingga memiliki materi genetik yang lengkap yaitu paternal dan maternal. Embrio kloning memiliki materi genetik yang berasal dari inti sel somatik yang diploid (2n). Hal ini disebabkan oleh perlakuan enukleasi sebelum dilakukan transfer inti sel somatik. Embrio partenogenetik hanya memiliki materi genetik yang berasal dari maternal tanpa ada komponen genetik paternal sedikitpun. Walaupun status materi genetik ketiga jenis embrio tersebut berbeda-beda, namun ketiganya memiliki jumlah ploidi yang sama yaitu diploid. Pada TISS dan partenogenetik menggunakan cytochalasin B untuk menghambat pembelahan sitoplasma dengan cara menghalangi pembentukan mikrofilamen kontraktil (Wakayama and Yanagimachi 2001).
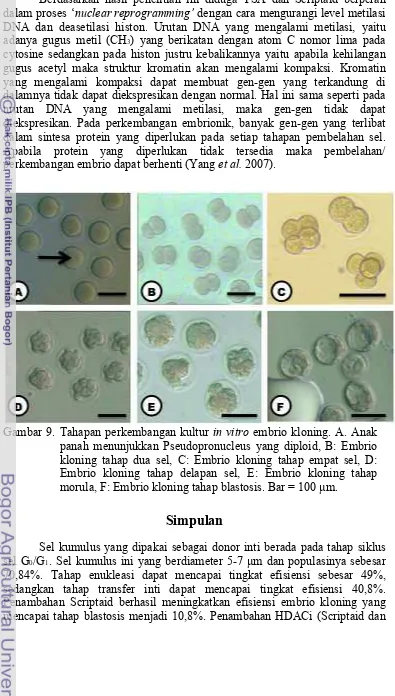
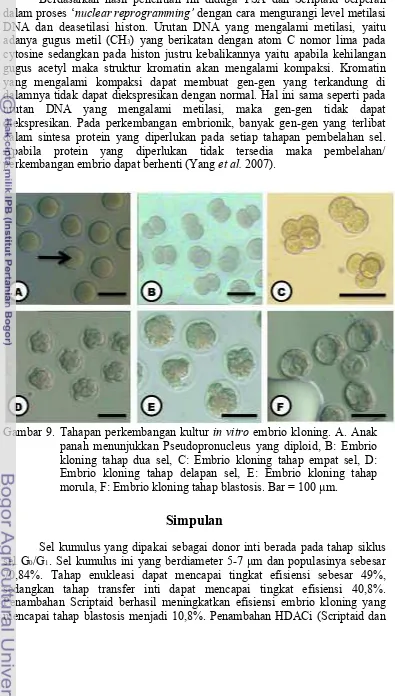
Gambar 4. Isolasi sel oosit dan sel kumulus. A: Anak panah menunjukkan oviduk yang membesar (tempat COC berkumpul), B: Cumulus-Oocyte Complex (COC) yang telah dikeluarkan dari oviduk, C: Sel oosit mencit, D Sel Kumulus. Bar = 50 µm.
Aktivasi Buatan
Tahap akhir dalam produksi embrio kloning dan partenogenetik adalah aktivasi buatan (artificial activation) menggunakan bahan kimia strontium chloride (SrCl2). Senyawa tersebut dapat menginduksi osilasi ion Ca2+ secara
berulang baik dengan menggantikan ikatan Ca2+ di dalam sitoplasma maupun dengan menginduksi pelepasan ion Ca2+ intraseluler (Alberio et al., 2001). Setelah enam jam diaktivasi maka dapat diamati mulai terbentuknya
Pseudopronucleus (pPN). Apabila nampak ada dua pPN pada sitoplasma embrio maka dapat diketegorikan sebagai embrio diploid (gambar 6A).
Pada fertilisasi, masuknya spermatozoa ke dalam oosit akan menginduksi sinyal Ca2+ (Schimidt et al., 2006). Pada TISS dan partenogenetik, aktivasi oosit tahap MII dapat dilakukan secara elektrik maupun secara kimiawi dengan SrCl2 maka konsentrasi MPF akan menurun secara drastis. Hal
[image:41.595.108.514.88.452.2]akan terdegradasi oleh sistem ubiquitin/proteosome. Kompleks CSF yang inaktif akan menyebabkan Anaphase Promoting Complex (APC) aktif dan menghancurkan cyclin A dan B sehingga MPF menjadi tidak aktif (konsentrasi menurun) (Elzen dan Pines 2001).
Gambar 5. Aplikasi Transfer Inti Sel Somatik. A: Proses enukl