POTENSI EKSTRAK BAKAU (
Rhizophora
spp.) SEBAGAI
INHIBITOR ASETILKOLINESTERASE
DAN ANTIOKSIDAN
NURZAKIAH KAHFI SURYA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini, Saya menyatakan bahwa skripsi Potensi Ekstrak Bakau (Rhizophora spp.) sebagai Inhibitor Asetilkolinesterase dan Antioksidan adalah karya Saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini, Saya melimpahkan hak cipta dari karya tulis Saya kepada Institut Pertanian Bogor.
Bogor, Desember 2013
iii
ABSTRAK
NURZAKIAH KAHFI SURYA. Potensi Ekstrak Bakau (Rhizophora spp.) sebagai Inhibitor Asetilkolinesterase dan Antioksidan. Dibimbing oleh LATIFAH K DARUSMAN dan WULAN TRI WAHYUNI.
Penapisan tanaman sebagai inhibitor asetilkolinesterase (AChE) untuk pengobatan penyakit Alzheimer telah banyak dilakukan. Penelitian ini menguji potensi ekstrak bakau sebagai inhibitor AChE dan antioksidan. Sampel daun dan buah bakau diekstraksi dengan bantuan sonikasi dengan peningkatan kepolaran pelarut, yaitu n-heksana, etil asetat, dan metanol. Hasil pengujian inhibisi AChE menggunakan metode Ellman menunjukkan bahwa ekstrak metanol buah R. mucronata memiliki aktivitas inhibisi terbaik dengan konsentrasi inhibisi 50% (IC50) 1 mg/L sementara IC50 kontrol positif fisostigmina sebesar 0.06 mg/L. Uji
antioksidan melalui penangkapan radikal bebas 2,2-difenil-2-pikrilhidrazil menunjukkan bahwa ekstrak tersebut memiliki aktivitas antioksidan yang baik dengan IC50 sebesar 3.74 mg/L saat asam askorbat memiliki IC50 sebesar 1.31
mg/L. Komponen ekstrak dipisahkan dengan kromatografi kolom menggunakan kloroform, etil asetat, dan metanol secara gradient bertahap. Pemisahan ini tidak dapat dilakukan karena terjadi penggumpalan ekstrak yang diduga disebabkan oleh kandungan karbohidrat yang cukup tinggi.
Kata kunci: antioksidan, asetilkolinesterase, Rhizophora spp.
ABSTRACT
NURZAKIAH KAHFI SURYA. Potency of Rhizophora spp. Extract as Inhibitor of Acetylcholinesterase and Antioxidant. Supervised by LATIFAH K DARUSMAN and WULAN TRI WAHYUNI.
Screening on plants as inhibitor of acetylcholinesterase (AChE) for the treatment of Alzheimer has been intensively done. This study examined the potential of Rhizophora spp. extract as inhibitor of AChE and antioxidant. Leaves and fruits of Rhizophora spp. were extracted by sonication using gradual polarity solvents, namely n-hexane, ethyl acetate, and methanol. AChE inhibition assay was measured using Ellman method and showed that methanol extract of R. mucronata fruit gave the best inhibitory activity with 50% inhibitory concentration (IC50) of 1 mg/L, whereas the IC50 of physostigmine was 0.06 mg/L.
Antioxidant assay against 2,2-diphenyl-pikrylhydrazyl showed that the extract was a good antioxidant with IC50 of 3.74 mg/L whereas the IC50 of ascorbic acid
was 1.31 mg/L. Components of the extract were chromatographed with chloroform, ethyl acetate, and methanol as eluents using step gradient elution. The chemical constituent could not be separated due to agglomeration, presumably by the high content of carbohydrate.
Key words: acetylcholinesterase, antioxidant, Rhizophora spp.
ii
POTENSI EKSTRAK BAKAU (
Rhizhophora
spp.) SEBAGAI
INHIBITOR ASETILKOLINESTERASE
DAN ANTIOKSIDAN
NURZAKIAH KAHFI SURYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Potensi Ekstrak Bakau (Rhizophora spp.) sebagai Inhibitor Asetilkolinesterase dan Antioksidan
Nama : Nurzakiah Kahfi Surya NIM : G44090043
Disetujui oleh
Prof Dr Ir Latifah K Darusman, MS Wulan Tri Wahyuni, SSi, MSi Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2013 hingga Agustus 2013 ini ialah inhibitor asetilkolinesterase, dengan judul Potensi Ekstrak Bakau (Rhizophora spp.) sebagai Inhibitor Asetilkolinesterase dan Antioksidan.
Terima kasih penulis sampaikan kepada Ibu Prof Dr Ir Latifah K Darusman, MS dan Ibu Wulan Tri Wahyuni SSi, MSi selaku pembimbing. Di samping itu, penghargaan penulis sampaikan kepada ayah, ibu, serta seluruh keluarga, atas doa dan kasih sayangnya. Ungkapan terima kasih juga disampaikan kepada Bapak Eman, Ibu Nunung, dan Bapak Dede dari Laboratorium Kimia Analitik, serta Ibu Nunuk, Ibu Salina, Kak Antonio, Mas Endi, dan Kak Laela dari Pusat Studi Biofarmaka yang telah membantu selama pelaksanaan penelitian di laboratorium.
Semoga karya ilmiah ini bermanfaat.
Bogor, Desember 2013
viii
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode 2
Pengumpulan dan Pengeringan Sampel 2 Penentuan Kadar Air dan Abu 3
Ekstraksi Sampel 3
Uji Fitokimia (Harborne 1987) 3
Uji Inhibisi AChE 3
Uji Aktivitas Antioksidan (Salazar-Aranda et al. 2011) 4 Penentuan Eluen Terbaik (Houghton dan Raman 1998) 4 Fraksionasi dengan Kromatografi Kolom 4
HASIL DAN PEMBAHASAN 5
Kadar Air dan Abu 5
Ekstraksi 6
Fitokimia Simplisia 7
Aktivitas Inhibisi AChE dan Antioksidan 8
Eluen Terbaik 9
Fraksionasi dengan Kromatografi Kolom 11
SIMPULAN DAN SARAN 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
DAFTAR TABEL
1 Hasil penentuan kadar air dan kadar abu 6 2 Rendemen ekstrak daun dan buah bakau 6 3 Kandungan metabolit sekunder ekstrak sampel 7 4 Perbandingan hasil uji inhibisi AChE dan antioksidan 8
DAFTAR GAMBAR
1 Tanaman bakau 5
2 Profil KLT ekstrak metanol R. mucronata dengan eluen tunggal dari kiri ke kanan: n-heksana, diklorometana, kloroform, n-butanol, etil asetat,
aseton, dietil eter, asam asetat, etanol, dan metanol 9 3 Profil KLT ekstrak metanol R. mucronata dengen komposisi eluen dari
kiri ke kanan: metanol-kloroform (9:1), metanol-etil asetat (9:1),
metanol:kloroform (7:3), metanol:etil asetat (7:3) 10 4 Profil KLT ekstrak metanol R. mucronata dengen komposisi eluen dari
kiri ke kanan: metanol-etil kloroform (6:3:1), metanol-etil
asetat-kloroform (6:2:2) 10
5 Profil KLT ekstrak metanol R. mucronata dengen komposisi eluen dari kiri ke kanan: metanol-etil asetat-n-heksana (6:3:1) (Abdullah 2011),
metanol-etil asetat-kloroform (6:1:3) 11 6 Hasil KLT dari 20 mL eluat pertama dan 80 mL eluat selanjutnya 12
DAFTAR LAMPIRAN
1 Bagan alir penelitian 13
2 Hasil determinasi tanaman bakau 14 3 Penentuan kadar air simplisia bakau 15 4 Penentuan kadar abu simplisia bakau 16 5 Hasil ekstraksi dengan pelarut n-heksana 17 6 Hasil ekstraksi dengan pelarut etil asetat 18 7 Hasil ekstraksi dengan pelarut metanol 19 8 Pengolahan data hasil ekstraksi menggunakan Rancangan Acak
Kelompok (RAK) 20
9 Hasil Uji Inhibisi AChE dan Antioksidan 22
1
PENDAHULUAN
Demensia merupakan penyakit yang ditemukan pada orang tua dan ditandai dengan hilangnya memori secara progresif serta kemampuan mental lainnya seperti bahasa, penilaian, perencanaan, gangguan aktivitas sehari-hari serta kekurangan dalam interaksi sosial (Das et al. 2012). Penyakit Alzheimer (AD) merupakan bentuk paling umum dari demensia. Dua pendekatan utama digunakan untuk mengidentifikasi penyebab penyakit tersebut, yaitu kolinergik dan nonkolinergik (Kitphati et al. 2012). Salah satu strategi pengobatan AD adalah melalui peningkatan fungsi kolinergik dengan penggunaan inhibitor asetilkolinesterase (AChE) untuk meningkatkan jumlah asetilkolin dalam sinapsis antara saraf kolinergik. Menurut Wollen (2010), obat komersial yang telah banyak digunakan untuk pengobatan AD merupakan inhibitor AChE, yaitu donepezil, rivastigmina, galantamina, dan takrin. Namun, inhibitor AChE seperti takrin diketahui memiliki keterbatasan berupa efek samping seperti hepatotoksisitas (Jung dan Park 2007). Oleh karena itu, penelitian untuk menemukan inhibitor AChE terus dilakukan, terutama inhibitor berbasis tanaman obat dengan harapan dapat mengurangi atau menghindari efek samping yang dapat ditimbulkan.
Beberapa penelitian mengenai inhibitor AChE berbasis tanaman pernah dilaporkan. Jung dan Park (2007) melakukan penapisan pada 180 tanaman obat yang diduga berpotensi sebagai inhibitor AChE. Ekstrak etil asetat dari tanaman Agrimonia pilosa ledeb ditemukan memiliki aktivitas yang signifikan dalam menginhibisi AChE. Uji hayati terhadap hasil isolasi senyawa kimia dari tanaman tersebut menunjukkan bahwa 4 senyawa flavonol, yaitu tilirosida, 3-metoksikuersetin, kuersitrin, dan kuersetin menunjukkan efek inhibisi 2 kali lebih baik dibandingkan dengan inhibisi yang diakibatkan oleh dehidroevodiamina (DHED). Darusman et al. (2013) melakukan penapisan pada 3 tanaman dari genus Syzygium. Ekstrak n-heksana, etil asetat, dan metanol daun Syzygium polyanthum (cengkih) memiliki potensi sebagai inhibitor AChE dengan konsentrasi penghambatan 50% (IC50) berturut-turut 60.35, 56.03, dan 42.13 mg/L. Khan et al. (2012) melakukan uji inhibisi AChE terhadap ekstrak daun Piper sarmentosum. Hasil penelitian tersebut menunjukkan bahwa ekstrak etanol, n-heksana, etil asetat, dan air dari P. sarmentosum masing-masing memiliki IC50
sebesar 128, 127, 317, dan 348 mg/L.
Inhibitor AChE merupakan pengobatan demensia dengan pendekatan kolinergik. Sementara itu, pendekatan nonkolinergik dapat dilakukan melalui penggunaan antioksidan. Stres oksidatif yang disebabkan oleh spesies oksigen reaktif telah diketahui sebagai penyebab oksidasi biomolekul sehingga terjadi kerusakan sel. Hal tersebut dapat menyebabkan proses neurodegeneratif termasuk defisiensi kognitif sebagai penyebab penuaan otak, AD, dan penyakit Parkinson (Orhan et al. 2007). Oleh karena itu, penelitian mengenai pengobatan AD dengan inhibitor AChE sering kali disertai dengan pengujian aktivitas antioksidan.
100000–200000 metabolit sekunder (Asha et al. 2012). Berdasarkan hal tersebut, bakau memiliki potensi yang sangat besar untuk dimanfaatkan dalam fitofarmaka. Batang Rizhophora apiculata menghasilkan asam pirolignin yang memiliki sifat antioksidan yang tinggi (Loo et al. 2007). Rahim et al. (2008) menyatakan bahwa kulit kayu R. apiculata menghasilkan tanin yang dapat digunakan sebagai sumber antioksidan alami. Sementara itu, daun Rizhophora mucronata berpotensi sebagai antibakteri (Joel dan Bhimba 2010). Namun, pada kenyataannya potensi bakau untuk digunakan dalam pengobatan masih perlu dieksplorasi. Oleh karena itu, diperlukan penelitian mengenai potensi bakau untuk pengobatan demensia melalui mekanisme inhibisi AChE dan melalui mekanisme pencegahan stres oksidatif (antioksidan). Berdasarkan latar belakang di atas, penelitian ini bertujuan menguji potensi ekstrak daun dan buah dari 3 spesies bakau, yaitu R. apiculata, R. mucronata, dan R. stylosa sebagai inhibitor asetilkolinesterase dan antioksidan.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah seperangkat alat kaca, penangas ultrasonik, penguap putar, pelat kromatografi lapis tipis (KLT) analitik, microplate reader, 96-well plate, lampu ultraviolet (UV), dan neraca analitik. Bahan-bahan yang digunakan adalah daun dan buah 3 spesies bakau (R. apiculata, R. mucronata, R. stylosa), n-heksana, etil asetat, metanol, diklorometana, kloroform, n-butanol, aseton, dietil eter, asam asetat, etanol, pereaksi uji fitokimia, bufer asam 2-[4-(2-hidroksietil)piperazin-1-il]etanasulfonat (HEPES), asetilkolinesterase, 5-ditiobis-2-nitrobenzoat (DTNB), asetiltiokolina (ATCh), fisostigmina (Sigma Aldrich), 2,2-difenil-1-pikrilhidrazil(DPPH), dan asam askorbat.
Penelitian dilaksanakan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor; Herbarium Bogoriense, LIPI, Cibinong; serta Pusat Studi Biofarmaka, LPPM IPB pada bulan Maret hingga Agustus 2013.
Metode
Metode penelitian yang dilakukan meliputi beberapa tahap (Lampiran 1), yaitu persiapan sampel, penentuan kadar air dan abu, dan ekstraksi sampel menggunakan sonikasi. Ekstrak yang dihasilkan kemudian diuji inhibisi AChE dan beberapa ekstrak dengan hasil inhibisi AChE terbaik diuji aktivitas antioksidannya. Ekstrak dengan aktivitas inhibisi AChE dan antioksidan terbaik difraksionasi dengan kromatografi kolom untuk mendapatkan beberapa fraksi yang lebih murni.
Pengumpulan dan Pengeringan Sampel
3
dipotong hinga berukuran lebih kecil, kemudian dikeringkan dengan oven pada
suhu 40−50 oC selama 4−5 hari. Sampel kering digiling dan diayak dengan ukuran
40 mesh.
Penentuan Kadar Air dan Abu
Penentuan kadar air dan abu dilakukan secara gravimetri sesuai dengan metode AOAC (2007).
Ekstraksi Sampel
Ekstraksi yang digunakan dalam penelitian ini dilakukan dengan bantuan sonikasi menggunakan 3 pelarut dari nonpolar hingga polar. Pelarut yang digunakan adalah n-heksana, etil asetat, serta metanol. Penambahan pelarut dalam ekstraksi dilakukan dengan peningkatan kepolaran. Setiap simplisia ditimbang sebanyak 15 g, lalu masing-masing ditambahkan 75 mL n-heksana, kemudian ditempatkan di dalam penangas ultrasonik selama 30 menit dengan frekuensi 38 kHz. Maserat dipisahkan kemudian residu diekstraksi kembali dengan jenis dan jumlah pelarut yang sama. Maserasi dilakukan 3 kali ulangan. Semua maserat dikumpulkan dan dipekatkan dengan penguap putar. Bobot ekstrak pekat yang diperoleh ditimbang. Residu kemudian diekstraksi berturut-turut dengan etil asetat dan metanol berdasarkan metode yang sama dengan n-heksana. Rendemen setiap ekstrak dihitung dengan membandingkan bobot ekstrak yang diperoleh dengan bobot sampel awal dengan kadar air sebagai faktor koreksi.
Uji Fitokimia (Harborne 1987)
Uji Flavonoid dan Saponin. Sebanyak 1 g simplisia ditambahkan 10 mL air, dipanaskan, kemudian disaring. Filtrat ditambahkan serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat-kuat. Uji positif flavonoid ditandai dengan munculnya warna merah, kuning, atau jingga pada lapisan amil alkohol. Sebagian filtrat dikocok selama 10 menit dalam keadaan tertutup. Jika terbentuk buih yang stabil, berarti ekstrak mengandung saponin.
Uji Alkaloid. Sebanyak 1 g simplisia ditambah dengan 10 mL CHCl3 dan 3
tetes NH3 pekat. Larutan disaring, filtratnya ditambahkan 10 tetes H2SO4 2 M dan
dikocok. Lapisan asam dipisahkan dan masing-masing ditambahkan dengan pereaksi Mayer (positif jika terbentuk endapan putih), pereaksi Wagner (positif jika terbentuk endapan cokelat), dan pereaksi Dragendorf (positif jika terbentuk endapan merah jingga).
Uji Tanin. Sebanyak 10 mL simplisia dipanaskan selama 10 menit. Selanjutnya campuran tersebut disaring dan filtratnya ditambahkan dengan FeCl3
1%. Jika terbentuk warna biru tua atau hijau, berarti ekstrak mengandung tanin.
Uji Steroid dan Terpenoid. Sebanyak 1 g simplisia diekstraksi dengan 10 mL etanol panas, disaring, dan diuapkan hingga kering. Residu yang dihasilkan dilarutkan dalam eter, lalu ditambahkan 3 tetes anhidrida asetat dan H2SO4. Jika
terbentuk warna biru atau hijau, berarti ekstrak positif mengandung steroid. Jika terbentuk warna ungu, berarti ekstrak positif mengandung terpenoid.
Uji Inhibisi AChE
4
dimasukkan ke dalam sumur (96 well plates) berisi 112 µL bufer HEPES pH 8. Pengenceran bertingkat sebanyak 6 kali dilakukan terhadap larutan tersebut. Disiapkan blangko berupa 112 µL bufer HEPES pH 8 tanpa penambahan ekstrak. Seluruh sumur berisi sampel dan blangko ditambahkan 40 µL AChE 0.36 U/mL lalu diinkubasi pada suhu 4 oC selama 30 menit. Selanjutnya ke dalam setiap sumur ditambahkan 20 µL DTNB 0.5 mM lalu 20 µL ATCh 0.6 mM dan diinkubasi pada suhu 37 oC selama 20 menit. Setelah inkubasi selesai, sebanyak 20 µL fisostigmina 1 mM ditambahkan ke dalam setiap sumur. Fisostigmina 1028 mg/L digunakan sebagai kontrol positif dan diberi perlakuan sama seperti sampel. Absorbans larutan pada masing-masing sumur diukur dengan menggunakan microplate reader pada panjang gelombang 412 nm.
Uji Aktivitas Antioksidan (Salazar-Aranda et al. 2011)
Sampel dilarutkan di dalam etanol hingga diperoleh konsentrasi 1.56 100
mg/L. Sebanyak 100 L DPPH 125 M ditambahkan ke dalam masing-masing sumur (96-wellplate). Setelah diinkubasi 30 menit, diukur absorbansnya pada panjang gelombang 517 nm. Asam askorbat digunakan sebagai kontrol positif dan etanol sebagai kontrol negatif. Absorbans sampel dan kontrol positif dengan berbagai konsentrasi diukur tiga kali ulangan (triplo). Aktivitas inhibitor dihitung dengan persamaan:
Keterangan:
A sampel = absorbans DPPH yang ditambah bahan uji
A kontrol = absorbans DPPH yang ditambah asam askorbat sebagai kontrol A blanko = absorbans DPPH dalam etanol.
Penentuan Eluen Terbaik (Houghton dan Raman 1998)
Penentuan eluen terbaik dilakukan dengan metode KLT menggunakan ekstrak yang memiliki aktivitas antioksidan dan inhibisi AChE terbaik. Sepuluh jenis pelarut yang memiliki kepolaran berbeda, yaitu n-heksana, diklorometana, kloroform, n-butanol, etil asetat, aseton, dietil eter, asam asetat, etanol, dan metanol digunakan sebagai fase gerak tunggal. Ekstrak dengan aktivitas terbaik ditotolkan pada pelat KLT silika gel. Pelat KLT tersebut kemudian dimasukkan ke dalam bejana kromatografi yang telah dijenuhkan dengan fase gerak tunggal. Elusi dihentikan ketika fase gerak mendekati batas 1 cm dari tepi atas pelat KLT. Pelat diangkat, dikeringkan lalu dideteksi dengan lampu UV 254 nm dan 366 nm. Eluen terbaik adalah eluen yang menghasilkan keterpisahan spot yang paling baik. Bila belum dihasilkan keterpisahan yang baik, maka dicampurkan beberapa pelarut dengan nisbah tertentu.
Fraksionasi dengan Kromatografi Kolom
5
bawah lampu UV pada panjang gelombang 254 dan 366 nm. Noda yang memiliki Rf yang sama digabungkan sebagai 1 fraksi.
HASIL DAN PEMBAHASAN
Kadar Air dan Abu
Ketiga spesies bakau yang digunakan dalam penelitian ini telah dideterminasi di Herbarium Bogoriense, Lembaga Ilmu Pengetahuan Indonesia (LIPI) untuk memastikan spesies bakau yang digunakan. Hasil identifikasi disajikan pada Lampiran 2. Hasil identifikasi menunjukkan bahwa spesies yang digunakan adalah Rhizophora apiculata Blume, Rhizophora mucronata Lam, dan Rhizophora stylosa Griff. Bagian sampel yang digunakan adalah daun dan buah (Gambar 1). Preparasi sampel dilakukan untuk keefektifan ekstraksi. Sampel yang telah dihaluskan luas permukaannya akan lebih meningkat. Hal ini memudahkan proses perpindahan komponen ke dalam pelarut.
Gambar 1 Tanaman bakau: (a) daun R. apiculata, (b) daun R. mucronata, (c) daun R. stylosa, (d) buah R. apiculata, (e) buah R. stylosa, (f) buah R. mucronata
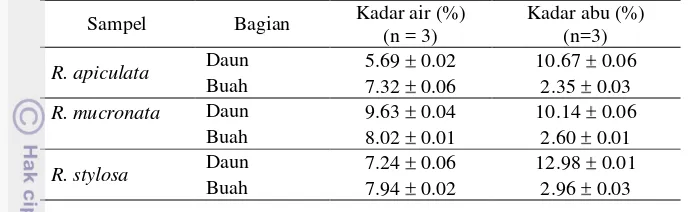
Kadar air dan abu simplisia daun dan buah ditampilkan pada Tabel 1. Kadar air semua simplisia berada di bawah 10%. Kadar air di bawah 10% ini sesuai dengan syarat bahan baku obat tradisional menurut Kemenkes RI (1994).
a b c
d
e
6
Penentuan kadar air ini juga digunakan untuk mengoreksi rendemen ekstrak dan kadar abu. Dengan demikian, rendemen dan kadar abu yang dihasilkan ditentukan berdasarkan bobot kering. Perhitungan kadar air diberikan pada Lampiran 3.
Tabel 1 Hasil penentuan kadar air dan kadar abu
Sampel Bagian Kadar air (%)
Penentuan kadar abu melalui proses pengarangan kemudian pengabuan pada suhu 600 °C yang bertujuan menghilangkan kandungan bahan organik dalam sampel. Oleh karena itulah, kadar abu dapat menggambarkan kandungan mineral dalam suatu bahan. Tabel 1 menunjukkan bahwa kadar abu pada buah dan daun cukup berbeda. Berdasarkan kadar abu, kandungan mineral pada daun lebih tinggi dibandingkan dengan pada buah.
Rohaeti et al. (2010) melaporkan bahwa kadar air dan abu daun R. mucronata dari Pantai Kapuk, Jakarta Utara adalah 11.19% dan 13.27%. Sementara itu, kadar air dan abu pada batangnya adalah 10.16% dan 17.44%. Dengan demikian, kadar abu sampel yang digunakan pada penelitian ini lebih rendah dibandingkan dengan penelitian sebelumnya. Perbedaan kadar abu dengan hasil penelitian sebelumnya dapat disebabkan oleh tanaman yang digunakan memiliki umur yang berbeda. Perhitungan kadar abu terdapat pada Lampiran 4.
Ekstraksi
Ekstraksi dilakukan dengan bantuan sonikasi. Metode ini dipilih karena memiliki kelebihan, yaitu waktu yang dibutuhkan untuk ekstraksi lebih singkat. Sebagai perbandingan, maserasi sederhana tanpa bantuan gelombang ultrasonik membutuhkan waktu 1 3 hari. Sementara itu, ekstraksi pada penelitian ini hanya membutuhkan waktu 30 menit. Proses ekstraksi yang lebih cepat ini disebabkan oleh proses sonikasi yang mengandalkan energi gelombang dan menyebabkan proses kavitasi. Kavitasi merupakan proses pembentukan gelembung-gelembung kecil akibat adanya gelombang ultrasonik untuk membantu difusi pelarut ke dalam dinding sel tanaman (Ashley et al. 2001).
7
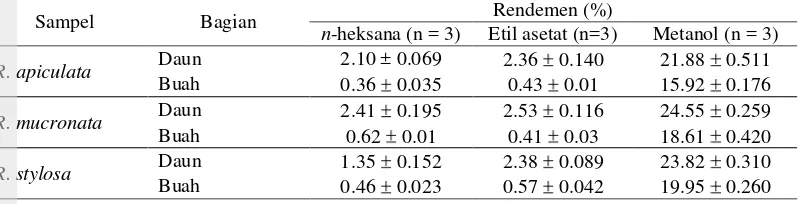
Tabel 2 Rendemen ekstrak daun dan buah bakau
Sampel Bagian Rendemen (%)
Rendemen ekstrak metanol paling tinggi dibandingkan dengan ekstrak etil asetat maupun n-heksana. Demikian pula rendemen ekstrak daun bakau lebih besar daripada buah. Pengaruh pelarut dan bagian tanaman pada rendemen diuji dengan rancangan acak kelompok (RAK) (Lampiran 8). Hasil pengujian statistik pada taraf nyata 5% menunjukkan bahwa jenis pelarut memberikan pengaruh terhadap rendemen ekstrak, demikian pula dengan jenis sampel. Metanol menghasilkan rendemen paling tinggi karena memiliki tetapan dielektrik yang relatif tinggi sehingga mampu mengekstraksi komponen yang tidak terekstrak oleh n-heksana dan etil asetat. Rendemen ekstrak n-heksana yang kecil menunjukkan bahwa komponen nonpolar dalam daun dan buah bakau jumlahnya sedikit.
Fitokimia Simplisia
Uji fitokimia dilakukan pada simplisia, tidak pada ekstrak, karena beberapa ekstrak, terutama ekstrak n-heksana rendemennya sangat kecil. Hasil uji fitokimia pada simplisia dapat digunakan untuk menduga kandungan metabolit sekunder pada sampel secara kualitatif. Berdasarkan dugaan tersebut, dapat diperkirakan senyawa yang berperan dalam bioaktivitas.
Hasil uji fitokimia (Tabel 3) menunjukkan bahwa semua sampel mengandung saponin yang cukup tinggi dan tidak mengandung steroid. Sementara itu, alkaloid hanya ditemukan pada daun dan buah R. mucronata serta daun R. stylosa. Kandungan metabolit sekunder lainnya yang cukup tinggi adalah flavonoid dan tanin. Menurut Asha et al. (2012), kandungan flavonoid pada bakau berpotensi sebagai antioksidan. Pernyataan serupa dilaporkan oleh Rahim et al. (2008) untuk kandungan tanin dalam bakau yang berpotensi sebagai antioksidan.
Tabel 3 Kandungan metabolit sekunder ekstrak sampel
Metabolit sekunder
R. apiculata R. mucronata R. stylosa
Daun Buah Daun Buah Daun Buah
8
Aktivitas Inhibisi AChE dan Antioksidan
Uji aktivitas inhibisi AChE dilakukan berdasarkan metode Ellman et al. (1961) dengan modifikasi Darusman et al. (2013). Metode ini berdasarkan pada reaksi hidrolisis substrat ATCh oleh AChE. Dengan demikian, IC50 menunjukkan
konsentrasi yang dapat menghambat reaksi hidrolisis ATCh menjadi asetat dan tiokolina sebesar 50%. Nilai IC50 yang semakin kecil menunjukkan aktivitas
inhibisi oleh ekstrak yang semakin baik.
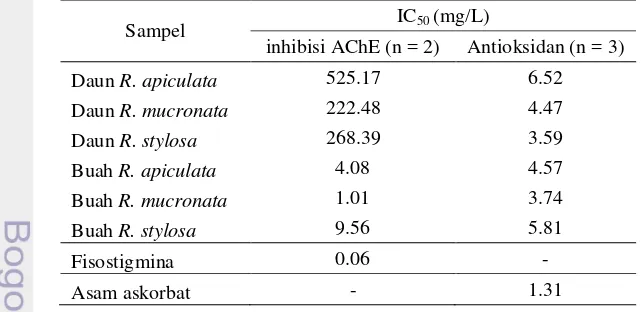
Hasil uji inhibisi AChE (Lampiran 9) menunjukkan bahwa ekstrak metanol dari buah R. mucronata memiliki aktivitas inhibisi terbaik dengan IC50 sebesar
1.01 mg/L. Sementara itu, nilai IC50 kontrol positif fisostigmina dengan IC50
sebesar 0.06 mg/L. Pemilihan fisostigmina sebagai kontrol positif karena fisostigmina merupakan purwarupa inhibitor AChE yang dapat diperoleh dari tanaman (Kitphati et al. 2012).
Ekstrak n-heksana dan etil asetat tidak menghasilkan nilai R2 yang baik. Hasil tersebut diduga disebabkan oleh sifat ekstrak yang tidak homogen saat dilarutkan dalam bufer HEPES pH 8, sehingga mengganggu pengukuran absorbans menggunakan microplate reader.
Enam ekstrak metanol yang memiliki aktivitas inhibisi AChE cukup baik kemudian diuji aktivitas antioksidannya. Aktivitas antioksidan terbaik ditunjukkan oleh ekstrak metanol daun R. stylosa dengan IC50 sebesar 3.59 mg/L. Sementara
itu, nilai IC50 kontrol positif asam askorbat adalah 1.31 mg/L. Pada Tabel 4,
tampak bahwa profil hasil uji inhibisi AChE relatif sama dengan hasil uji antioksidan, kecuali pada ekstrak metanol daun R. stylosa. Dengan demikian, dapat dikatakan bahwa komponen senyawa yang memiliki aktivitas sebagai antioksidan juga memiliki aktivitas sebagai inhibitor AChE.
Tabel 4 Perbandingan hasil uji inhibisi AChE dan antioksidan
Sampel IC50 (mg/L)
9
Meski demikian, diperlukan pengujian lebih lanjut untuk membuktikan hubungan antara kandungan mineral daun bakau dengan peningkatan aktivitas AChE.
Darusman et al. (2013) melaporkan potensi ekstrak 3 tanaman dari genus Syzygium sebagai inhibitor AChE dengam IC50 bervariasi antara 40 dan 62 mg/L
dengan IC50 untuk kontrol positifnya adalah 0.01 mg/L. Nilai IC50 ini 4000 kali
dari kontrol positifnya. Sementara itu, ekstrak metanol buah R. mucronata pada penelitian ini memiliki nilai IC50 17 kali dari kontrol positifnya. Okello et al. 2004
melaporkan aktivitas ekstrak air Camellia sinensis dalam menginhibisi AChE dengan IC50 30 mg/L untuk teh hijau dan 60 mg/L untuk teh hitam. Sementara itu,
Sirgudsson dan Gudbjarnason (2007) menemukan bahwa ekstrak etanol dari biji
Angelica archangelica dan Geranium sylvaticum masing-masing memiliki IC50
sebesar 2200 dan 3560 mg/L dalam menginhibisi AChE. Berdasarkan hasil ini,
ekstrak buah R. mucronata yang memiliki aktivitas inhibisi AChE terbaik, dipilih untuk pemisahan lebih lanjut.
Eluen Terbaik
Penentuan eluen terbaik dilakukan dengan memilih eluen tunggal terlebih dahulu, dari beberapa pelarut organik dengan kepolaran berbeda. Seperti ditunjukkan pada Gambar 2, noda yang dielusi dengan berbagai eluen tunggal tidak mengalami pemisahan.
Gambar 2 Profil KLT ekstrak metanol R. mucronata dengan eluen tunggal: (a) n -heksana, (b) diklorometana, (c) kloroform, (d) n-butanol, (e) etil asetat, (f) aseton, (g) dietil eter, (h) asam asetat, (i) etanol, dan (j) metanol
Abdullah (2011) menggunakan ekstrak metanol R. apiculata sebagai inhibitor tirosinase dan antioksidan. Eluen terbaik yang digunakan untuk pemisahan komponen ekstrak adalah n-heksana-etil asetat-metanol (1:3:6). Sementara itu, Ningsih et al. (2006) menggunakan ekstrak R. mucronata sebagai antibakteri dengan eluen terbaiknya adalah kloroform-metanol (1:9). Berdasarkan hal tersebut, digunakan kombinasi 2 eluen, yaitu kloroform dan metanol-etil asetat dan hasilnya ditampilkan pada Gambar 3.
10
Gambar 3 Profil KLT ekstrak metanol R. mucronata dengan komposisi eluen: (a) kloroform (9:1), (b) etil asetat (9:1), (c) metanol-kloroform (7:3), (d) metanol-etil asetat (7:3)
Pola pemisahan pada Gambar 3 dihasilkan dari pengamatan di bawah sinar
UV pada = 366 nm. Tampak bahwa komposisi eluen yang sama menghasilkan pola pemisahan yang hampir sama. Hasil kombinasi 2 eluen masih belum menghasilkan pemisahan yang cukup baik. Untuk itu, dilakukan penggabungan 3 eluen dengan hasil pemisahan disajikan pada Gambar 4.
Gambar 4 Profil KLT ekstrak metanol R. mucronata dengan komposisi eluen: (a) metanol-etil kloroform (6:2:2) dan (b) metanol-etil asetat-kloroform (6:3:1)
Pemisahan yang lebih baik tampak pada komposisi metanol-etil kloroform (6:2:2), bila dibandingkan dengan komposisi metanol-etil asetat-kloroform (6:3:1), maka tampak bahwa peningkatan jumlah asetat-kloroform menghasilkan pemisahan yang lebih baik. Oleh karena itu, diujikan kombinasi lain dengan penambahan jumlah kloroform dan pengurangan etil asetat, yaitu metanol-etil asetat-kloroform (6:1:3). Hasilnya disajikan pada Gambar 5.
(a) (b) (c) (d)
11
Gambar 5 Profil KLT ekstrak metanol R. mucronata dengan komposisi eluen: (a) metanol-etil asetat-n-heksana (6:3:1) (Abdullah 2011), (b) metanol-etil asetat-kloroform (6:1:3)
Komposisi metanol-etil asetat-kloroform (6:1:3) dengan peningkatan jumlah kloroform dari hasil percobaan sebelumnya menghasilkan pemisahan yang lebih baik dibandingkan komposisi eluen terbaik berdasarkan Abdullah (2011). Pada dasar KLT tampak masih terdapat noda yang tertahan dan tidak terpisah. Oleh karena itu, diujikan kombinasi eluen dengan penambahan jumlah metanol, yaitu metanol-etil asetat-kloroform, yaitu 7:0.5:2.5, 7:1.5:1.5, dan 7:2.5:0.5. Namun komposisi eluen tersebut tidak menghasilkan pemisahan yang lebih baik dibandingkan metanol-etil asetat-kloroform (6:1:3). Dengan demikian, eluen terbaik yang dipilih berdasarkan percobaan adalah metanol-etil asetat-kloroform (6:1:3).
Fraksionasi dengan Kromatografi Kolom
Fraksionasi dengan kromatografi kolom dilakukan dengan silika gel sebagai fasa diam dan elusi secara step gradient menggunakan kloroform, etil asetat, dan metanol. Kolom silika gel dikemas menggunakan pelarut kloroform. Setelah kolom sudah padat, sampel ekstrak metanol R. mucronata diaplikasikan ke dalam kolom. Saat sampel diaplikasikan kemudian dielusi dengan kloroform, terjadi penggumpalan sampel pada permukaan kolom. Penggumpalan ini tidak hilang saat kolom dielusi dengan etil asetat, metanol, hingga air.
Eluat yang keluar dari kolom ditampung setiap 10 mL. Berdasarkan penampungan eluat ini, dihasilkan sebanyak 400 eluat yang disimpan dalam wadah berbeda. Pengujian KLT dilakukan terhadap eluat yang ditampung. Hasil pengujian KLT terhadap 20 mL eluat pertama dan 80 mL eluat selanjutnya menghasilkan pola pemisahan yang ditampilkan pada Gambar 6. Noda tersebut
dihasilkan berdasarkan pengamatan di bawah lampu UV dengan = 366 nm.
Hasil KLT pada eluat selanjutnya hingga eluat ke-400 tidak menghasilkan noda yang berpendar pada 366 nm.
Gambar 6 Hasil KLT: (a) 20 mL eluat pertama dan (b) 80 mL eluat selanjutnya
Penggumpalan yang terjadi pada kolom diduga disebabkan oleh tingginya kandungan karbohidrat. Menurut Buyapraphatsara et al. (2002), buah R. mucronata segar mengandung 22.3% karbohidrat. Diduga keberadaan gugus hidroksil dari karbohidrat menyebabkan karbohidrat yang terkandung dalam buah R. mucronata larut dalam metanol dan tidak larut dalam kloroform sehingga terjadi penggumpalan. Dugaan ini didukung oleh hasil analisis Proksimat (Lampiran 10) yang menunjukkan bahwa kadar karbohidrat simplisia buah R. mucronata adalah 84.83% dan kadar karbohidrat ekstrak metanol R. mucronata adalah 54.35%.
SIMPULAN DAN SARAN
Ekstrak metanol buah R. mucronata merupakan ekstrak yang memiliki aktivitas inhibisi AChE terbaik dengan IC50 sebesar 1.01 mg/L dengan aktivitas
antioksidan yang cukup baik dengan IC50 sebesar 3.74 mg/L. Meski demikian,
nilai keduanya masih lebih besar dibandingkan kontrol positif. Pemisahan komponen aktif menghasilkan 100 mL eluat pertama yang menghasilkan noda yang berpendar pada 366 nm. Meski demikian, pemisahan komponen ekstrak teraktif belum dapat dilakukan karena terjadi penggumpalan sampel saat diaplikasikan ke dalam kolom dan dielusi dengan klorofom-etil asetat-metanol secara step gradient. Penggumpalan diduga terjadi akibat kandungan karbohidrat yang tinggi dalam ekstrak sebesar 54.35%.
Pengujian toksisitas ekstrak teraktif dan pengujian aktivitas ekstrak etanol atau air perlu dilakukan sebagai usaha untuk pengaplikasiannya sebagai bahan baku obat. Diperlukan analisis lebih lanjut terhadap reaksi yang menyebabkan penggumpalan ekstrak sehingga pemisahan komponen ekstrak dapat dilakukan.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC International. Revisi ke-2. Volume ke-1. Maryland: AOAC International.
13
Abdullah. 2011. Potensi bakau Rhizophora apiculata sebagai inhibitor tirosinase dan antioksidan [tesis]. Bogor (ID): Institut Pertanian Bogor.
Asha KK, Mathew S, Lakshmanan. 2012. Flavonoid and phenolic compound in two mangrove species and their antioxidant property. Indian J of Geo-Marine Sci. 41:259-264.
Ashley K, Andrews RN, Cavazos L, Demange M. 2001. Ultrasonic extraction as a sample preparation technique for elemental analysis by atomic spectrometry. J Anal At Spectrom. 16:1147-1153.
Bunyapraphatsara N, Srisukh V, Jutiviboonsuk A, Sornlek P, Thongbainoi W, Chuakul W, Fong HHS, Pezzuto JM, Kosmeder J. 2002. Vegetables from the mangrove areas. Thai J Phytopharmaca. 9:1-112.
Das SK, Pal S, Ghosal MK. 2012. Dementia: Indian scenario. Neurology India. 60: 618-625.
Darusman LK, Wahyuni WT, Alwi F. 2013. Acetylcholinesterase inhibition and antioxidant activity of Syzygium cumini, S. aromaticum, and S. polyanthum from Indonesia. J Biol Sci. 13:412-416.
Ellman GL, Courtney KD, Andres V, Featherstone RM. 1961. A new rapid colorimetric determination of acetylcholinesterase activity. Biochemica Pharmacol. 7:88-95.
Harborne JB. 1987. Metode Fitokimia: Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Soediro I, penerjemah. Bandung: Penerbit ITB. Terjemahan dari: Phytochemical methods.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural Extract. London (GB): Chapman & Hall.
Jung M, Park M. 2007. Acetylcholinesterase inhibition by flavonoids from Agrimonia Pilosa. Molecules. 12:2130-2139.
Joel EL, Bhimba V. 2010. Isolation and characterization of secondary metabolites from the mangrove plant Rhizophora mucronata. Asian Pacific J Trop Med. 1:602-604.
[Kemenkes RI] Kementrian Kesehatan Republik Indonesia. 1994. Persyaratan Obat Tradisional. Jakarta (ID): Kemenkes RI.
Khan M, Elhussein SAA, Khan MM, Khan N. 2012. Anti-acetylcholinesterase activity of Piper sarmentosum by a continous immobilized-enzyme assay. APCBEE Procedia. 2:199-204.doi: 10.1016/j.apcbee.2012.06.035.
Kitphati W, Wattanakamolkul K, Lomarat P, Phanthong P, Anantachoke N, Nukoolkarn V, Thirapanmethee K, Bunyapraphatsara N. 2012. Anticholinesterase of essential oil and their constituents from Thai medicinal plants purified and selular enzymes. JAASP. 1:58-67.
Loo AY, Jain K, Darah I. 2008. Antioxidant activity of compounds isolated from the pyroligneous acid, Rhizophora apiculata.Food Chem. 107:1151-1160. Ningsih DR, Warsinah, Suwandri. 2006. Fraksionasi ekstrak metanol kulit batang
Rhizophora mucronata dan uji daya hambatnya terhadap bakteri Escherichia coli. Molekul. 1:30-35.
Okello EJ, Savelev SU, Perry EK. 2004. In vitro anti β-secretase and dual anti-cholinesterase activities of Camellia sinensis L. (tea) relevant to treatment of dementia. Phytotherapy Reasearch. 18:624-627.doi: 10. 1002/ptr.1519. Orhan I, Kartal M, Naz Q, Ejaz A, Yilmaz G, Kan Y, Konuklugil B, Sener B,
14
selected Turkish Salvia species. Food Chem. 103:1247-1254.
Purnobasuki H. 2004. Potensi mangrove sebagai tanaman obat. J Biota IX2. 2:125-126.
Rahim AA, Rocca E, Steinmetz J, Kassim MJ, Ibrahim MS, Osman H. 2008. Antioxidant activities of mangrove Rhizophora apiculata bark extracts. Food Chem. 107:200-207.
Rohaeti E, Batubara I, Lieke A, Darusman LK. 2010. Potensi ekstrak Rhizhophora sp. sebagai inhibitor tirosinase. Di dalam: [nama editor tidak diketahui], editor. Prosiding Seminar Nasional Sains III; 2010 Nov 13; Bogor, Indonesia. Bogor (ID): Pusat Studi Biofarmaka. hlm 196-201.
Salazar-Aranda R, Perez-Lopez LA, Lopez-Arroyo J, Alanıs-Garza BA, de Torres NW. 2009. Antimicrobial and antioxidant activities of plants from Northeast of Mexico. Evidence-Based Complementary and Alternative Medicine. 10:1-6.
Sigurdsson S, Gudbjarnason S. 2007. Inhibition of acetylcholinesterase by extracts and constituents from Angelica archangelica and Geranium sylvaticum. Z. Naturforsch. 62:689-693.
Wollen KA. 2010. Alzheimer's disease: the pros and cons of pharmaceutical, nutritional, botanical, and stimulatory therapies, with a discussion of treatment strategies from the perspective. Alternative Med Rev. 15:223-244. Zatta P, Ibn-Lkhayat-Idrissi, Zambenedetti, Kilyen M, Kiss T. 2002. In vivo and
15
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Sampel segar
Simplisia
Ekstrak n-heksana Ekstrak etil asetat
Ekstrak teraktif Penentuan
eluen terbaik Eluen terbaik
Fraksionasi dengan kromatografi kolom
Eluat 1 Eluat 2 . . .
Dikeringkan dan dihaluskan
Ekstraksi bertingkat dengan
(1) n-heksana, (2) etil asetat, (3) metanol
Uji antioksidan dan inhibisi AChE Ekstrak metanol
16
17
Lampiran 3 Penentuan kadar air simplisia bakau
Spesies
a = bobot simplisia sebelum dikeringkan b = bobot simplisia setelah dikeringkan
Rerata ( ) = = = 5.69%
18
Lampiran 4 Penentuan kadar abu simplisia bakau
Spesies bakau Bagian Ulangan
19
Lampiran 5 Rendemen ekstrak n-heksana
20
Lampiran 6 Rendemen ekstrak etil asetat
Spesies bakau Bagian Ulangan
21
Lampiran 7 Rendemen ekstrak metanol
Spesies bakau Bagian Ulangan
22
Lampiran 8 Pengolahan data hasil ekstraksi menggunakan Rancangan Acak Kelompok (RAK)
Jenis sampel Jenis pelarut Total blok
(Y.j) n-heksana etil asetat metanol
daun R. apiculata 2.10 2.36 21.88 26.34 propagul R. apiculata, (5) propagul R. mucronata, (6) propagul R. stylosa = pengamatan pada jenis pelarut ke-i dan jenis sampel ke-j
µ = rataan umum
= pengaruh jenis pelarut ke-i = pengaruh jenis sampel ke-j
= pengaruh acak pada jenis pelarut ke-I dan jenis sampel ke-j
Hipotesis
Pengaruh jenis pelarut : = = = 0
(jenis pelarut berbeda dapat menghasilkan rendemen yang sama) : ∃ ≠ 0 (paling sedikit terdapat satu jenis pelarut yang memberikan
pengaruh berbeda terhadap rendemen) Pengaruh jenis sampel
: = = = = = 0
(jenis sampel dapat menghasilkan rendemen yang sama)
: ∃ ≠ 0 (paling sedikit terdapat satu jenis sampel yang memberikan pengaruh berbeda terhadap rendemen)
Tabel Sidik Ragam (ANOVA)
23
Lanjutan lampiran 8
db Perlakuan = (t – 1) = (3 – 1) = 2 db Blok = (r – 1) = (6 – 1) = 5
db Galat = (t – 1) (r – 1) = (3 – 1) (6 – 1) = 10 db Total = (t x r) – 1 = (3 x 6) – 1 = 17
Faktor Koreksi (FK) = = = = = 1099.96
JK Total =
= (2.102 + 2.362+ … + 1λ.λ52) – 1099.96 = 2677.69 – 1099.96
= 1577.73
JK Perlakuan =
= - 1099.96
= - 1099.96 = 2614.37 -1099.96 = 1514.41
JK Blok =
= - 1099.96
= - 1099.96 = 1142.52 -1099.96 = 42.56
JK Galat = JK Total – JK Perlakuan – JK Blok = 1577.73 – 1514.41 – 42.56
= 20.76
KT Perlakuan = = 757.21
KT Blok = 8.51
KT Galat = = 1.22
F-hitung Perlakuan = = 620.66
F-hitung Blok = = = 6.97
Kesimpulan
Pengaruh Jenis Pelarut:
F-hitung F-tabel tolak H0 (Cukup bukti untuk menyatakan bahwa jenis
pelarut berpengaruh terhadap rendemen pada taraf nyata = 0.05) Pengaruh Jenis Sampel:
F-hitung F-tabel tolak H0 (Cukup bukti untuk menyatakan bahwa jenis
24
Lampiran 9 Hasil Uji Inhibisi AChE dan Antioksidan
Pelarut Sampel
Uji inhibisi AChE Uji Antioksidan
Persamaan
Regresi R
2 IC50
(mg/L) Persamaan Regresi R
2 IC50
(kontrol positif antioksidan) y = 24.02ln(x) + 43.46 0.930 1.31
Keterangan:
Regresi linear: x= konsentrasi dan y = % inhibisi
Contoh perhitungan IC50 uji inhibisi AChE:
25
Lampiran 10 Hasil analisis Proksimat
Penentuan kadar karbohidrat menggunakan metode carbohydrate by difference:
Kadar karbohidrat simplisia R. mucronata
= 100% - (kadar air + kadar abu + kadar lemak + kadar protein) = 100% - (9.36% + 0.43% + 1.32% + 4.06%)
= 100% - 15.17% = 84.83%
Kadar karbohidrat ekstrak metanol R. mucronata
= 100% - (kadar air + kadar abu + kadar lemak + kadar protein) = 100% - (43.54% + 0.72% + 0.19% + 1.20%)
RIWAYAT HIDUP
Penulis lahir di Bogor, 26 November 1990. Penulis merupakan anak pertama dari pasangan Basuki Husen dan Esin. Pada tahun 2009, penulis lulus dari SMAN 4 Bogor dan melanjutkan studi di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Selama masa kuliah, penulis tergabung sebagai anggota Koperasi Mahasiswa IPB (Kopma) IPB (2010) dan bendahara departemen Peningkatan Kualitas dan Keprofesian Mahasiswa (PK2M) Ikatan Mahasiswa Kimia (Imasika) IPB (2011). Selain itu, penulis pernah menjadi asisten praktikum, antara lain Asisten Kimia Analitik Layanan untuk Mayor Biologi (2013) dan Asisten Kimia Dasar B (2013).