1. PENDAHULUAN
1.1 Latar Belakang
Fauna Echinodermata di dunia terdapat sebanyak kurang lebih 6000 jenis dan diperkirakan 950 jenis diantaranya adalah bulu babi, yang terbagi atas 15 ordo, 46 famili dan 121 genera (Suwignyo et al. 2005). Di Indonesia, terdapat kurang lebih 84 jenis bulu babi yang berasal dari 31 famili dan 48 genera (Clark dan Rowe, 1971). Pada umumnya setiap jenis bulu babi memiliki sebaran habitat yang spesifik. Bulu babi tersebar mulai dari daerah intertidal yang dangkal hingga ke laut dalam (Jeng, 1998). Bulu babi pada umumnya menghuni ekosistem
terumbu karang dan padang lamun serta menyukai substrat yang agak keras terutama substrat di padang lamun yang merupakan campuran dari pasir dan pecahan karang (Aziz, 1994).
Echinodermatamerupakan salah satu biota yang berasosiasi kuat dengan ekosistem padang lamun dan berperan dalam siklus rantai makanan di ekosistem tersebut. Tingginya tutupan vegetasi lamun di perairan memungkinkan kehadiran berbagai biota yang berasosiasi dengan ekosistem padang lamun termasuk bulu babi untuk mencari makan, tempat hidup, memijah dan tempat berlindung untuk menghindari predator (Supono dan Arbi, 2010).
(Aziz, 1994). Di Indonesia beberapa jenis bulu babi yang dijumpai di padang lamun antara lain adalah Diadema, Tripneustes, Toxopneustes, Echinotrix, Echinometra, Temmopleurus, Mespilia dan Salmacis (Sumitro et al., 1992 dan Aziz, 1994).
Pulau Sapudi terletak di antara gugusan pulau-pulau kecil di sebelah timur Pulau Madura. Secara administratif, pulau ini termasuk wilayah Kabupaten Sumenep, Madura, Jawa Timur. Pulau ini kaya akan biota laut salah satunya dari jenis Echinodermataseperti bulu babi, bintang laut, teripang dan lain-lain. Bulu babi telah dimanfaatkan oleh sebagian penduduk di Pulau Sapudi. Gonad bulu babi Tripneustes gratilla dijadikan makanan ringan oleh sebagian besar penduduk pesisir Pulau Sapudi. Penelitian tentang bulu babi ini belum pernah dilakukan di lokasi tersebut. Sehubungan dengan masih kurangnya informasi mengenai sebaran komunitas bulu babi di Pulau Madura khususnya di Pulau Sapudi, maka penelitian di bidang tersebut perlu dilakukan. Penelitian mengenai struktur dan Sebaran komunitas bulu babi dilakukan di habitat lamun Pulau Sapudi, Kabupaten Sumenep, Madura.
1.2 Tujuan
Tujuan penelitian ini adalah :
1. Mengetahui struktur dan sebaran komunitas bulu babi di habitat lamun Pulau Sapudi, Kabupaten Sumenep, Madura.
2. TINJAUAN PUSTAKA
2.1 Bulu babi
2.1.1 Bentuk dan Morfologi Bulu babi
Bulu babi merupakan fauna dari filum Echinodermata yang paling melimpah dan tersebar di seluruh perairan Indonesia. Menurut Radjab (2001) secara morfologi, bulu babi terbagi menjadi dua kelompok yaitu bulu babi regularia (Gambar 1) atau bulu babi beraturan (regular sea urchin) dan bulu babi iregularia atau bulu babi tidak beraturan (irregular sea urchin).
Gambar 1. Bentuk umum bulu babi regularia (Dobo, 2009).
merupakan salah satu jenis dari bulu babi yang memiliki nilai konsumsi penting di Indonesia (Aziz, 1993).
Suwignyo et al. (2005) menyebutkan bahwa tubuh bulu babi berbentuk bulat atau pipih bundar, tidak bertangan, mempunyai duri-duri panjang yang dapat digerakkan. Semua organnya umumnya terdapat di dalam tempurung, yang terdiri dari 10 keping pelat ganda, biasanya bersambung dengan erat, yaitu pelat
ambulakral selain itu terdapat pelat ambulakral yang berlubang-lubang tempat keluarnya kaki tabung. Pada permukaan tempurung terdapat tonjolan-tonjolan pendek yang membulat, tempat menempelnya duri. Kebanyakan bulu babi mempunyai dua duri, duri panjang atau utama dan duri pendek atau sekunder. Selanjutnya, mulut bulu babi terletak di daerah oral, dilengkapi dengan lima gigi tajam dan kuat untuk mengunyah yang dikenal sebagai aristotle’s lantern. Anus, lubang genital dam madreporit terletak di sisi aboral.
Salah satu diantara keping genital yang berukuran paling besar merupakan tempat bermuaranya sistem pembuluh air (waste vascular system). Sistem ini menjadi ciri khas filum Echinodermata, berfungsi dalam pergerakan, makan, respirasi, dan ekskresi. Pada sistem peristomial terdapat pada selaput kulit tempat menempelnya organ “lentera aristotle”, yakni semacam rahang yang berfungsi sebagai alat pemotong dan penghancur makanan. Organ ini juga mampu memotong cangkang teritip, moluska ataupun jenis bulu babi lainnya (Azis, 1987).
2.1.2 Klasifikasi Bulu babi
Klasifikasi bulu babi menurut Heinke dan Schultz (2006) adalah sebagai berikut :
Filum : Echinodermata Subfilum : Echinozoa Kelas : Echinoidea Ordo : Cidaroida
Famili : Cidaridae, Psychocidaridae, Histocidaridae Ordo : Echinothuroida
Famili : Echinothuridae Ordo : Diadematoida
Famili : Diadematidae, Micropygidae Ordo : Phymosomatoida
Famili : Glyptocidariidae, Stomopneustidae Ordo : Arbacioida
Famili : Arbaciidae Ordo : Temnopleuroida
Famili : Temnopleuridae Ordo : Echinoida
Famili : Echinidae, Parechinidae, Echinometridae, Strongylocentrotidae, Toxopneustidae
Ordo : Clypeasteroida
Ordo : Spatangoida
Famili : Spatangidae, Mycrasteridae, Brissidae, Loveniidae, Schizasteridae, Pericosmidae, Asterostomatidae
Ordo : Holectypoida
Famili : Echinoneidae Ordo : Cassiduloida
Famili : Cassidulidae, Apatopygidae, Echinolampadidae Ordo : Holasteroida
Famili : Stereoneustidae, Urechinidae, Pourtalesiidae
2.2 Reproduksi dan Siklus Hidup Bulu babi
Siklus hidup dari bulu babi diawali dengan terjadinya pembuahan yang terjadi diluar tubuh. Induk jantan membuahi telur-telur dari induk betina. Telur bulu babi dibungkus dengan semacam gelatinous yang biasa disebut dengan jelly coat (Guidice, 1986). Setelah itu terbentuklah embrio, dimana embrio ini akan membelah dengan frekuensi yang sangat tinggi. Setelah mencapai tahap embrio terus masuk fase morula dan embrio muda disebut blastula. Selama 10 jam setelah terbuahi sejak fase blastula, maka embrio tersebut mulai aktif berenang. Setelah itu muncullah anakan bulu babi (Gambar 2), bulu babi sudah dapat dikatakan telah menjadi anakan bila sudah terdapat tentakel-tentakel, duri-duri dan pediselaria (Czihak, 1971).
Gambar 2. Anakan muda bulu babi setelah mengalami proses metamorfosis (Czizak, 1971).
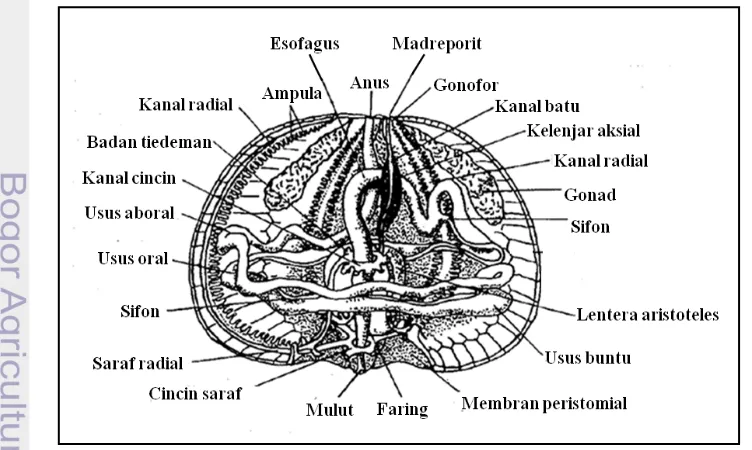
Namun bulu babi dikatakan dewasa betul apabila telah mencapai ukuran cangkang 60 mm. Selain itu bulu babi dewasa memiliki organ lengkap secara morfologi (Gambar 3). Bulu babi dewasa telah memiliki kulit (cangkang) yang keras, jari-jari dan duri-duri (spine) yang sudah dapat berfungsi dengan sempurna, misalnya jari-jari yang sudah dapat memegang pada substrat
2.3 Sebaran Bulu babi
Indonesia memiliki lautan yang lebih luas dari daratannya, oleh karena itu organisme yang ada pun sangatlah beragam. Bulu babi adalah salah satu jenis organisme dari laut yang banyak ditemukan diseluruh pantai di Indonesia. Bulu babi dapat ditemukan mulai dari daerah pasang surut sampai perairan yang dalam. Penyebaran lokal bulu babi sangat tergantung kepada perkembangan faktor substrat dan makanan.
Bulu babi oleh masyarakat yang tinggal di daerah pantai kawasan Timur Indonesia lebih dikenal dengan nama duri babi yang merupakan salah satu dari sekian jenis makrobenthos dari kelas echinoidea yang dapat mencapai ukuran diameter 163 mm dan mencapi berat 200 gr. Bulu babi dari kelas echinoidea, yang hidup di dunia diperkirakan sebanyak 800 jenis dan terbagi dalam 2 anak kelas yaitu Perischoechinoidea yang terdiri dari 1 bangsa dan 2 suku, sedangkan anak kelas Euchhinoidea terdiri dari 14 bangsa dan 44 suku (Aziz, 1987). Bulu babi ini ditemukan antara lain di laut Hindia, Australia, Philipina dan Afrika (Clark dan Rowe, 1971).
Kebanyakan bulu babi beraturan hidup pada substrat yang keras, yakni batu-batuan atau terumbu karang dan hanya sebagian kecil yang menghuni substrat pasir dan Lumpur, karena pada kondisi demikian kaki tabung sulit untuk mendapatkan tempat melekat. Golongan tersebut khusus hidup pada teluk yang tenang dan perairan yang lebih dalam, sehingga kecil kemungkinan dipengaruhi ombak.
Perikanan mengenai bulu babi telah dikenal semenjak 1000 tahun
perikanan bulu babi terutama berkembang di Perancis dan Italia. gonad bulu babi diolah menjadi masakan dengan bumbu khusus. Selain dari Eropa Barat bagian selatan, kebiasaan makan gonad bulu babi juga telah membudaya di Jepang dan Korea. Di Jepang gonad bulu babi dikenal dengan sebutan uni, dan merupakan komponen utama dalam jenis masakan yang disebut sushi.
2.4 Habitat Bulu babi
Bulu babi banyak ditemukan di daerah padang lamun dan terumbu karang. Mereka ditemukan di daerah yang berpasir atau pasir berlumpur biasa juga didapatkan di atas pecahan karang. Mereka menyukai perairan yang jernih dan tenang (Aziz, 1994). Lamun adalah tumbuhan berbunga (angiospermae) yang tumbuh dan berkembang dengan baik di lingkungan laut dangkal, dan membentuk kelompok-kelompok sampai padang lamun yang sangat luas.
Padang lamun dapat berbentuk vegetasi tunggal yang terdiri dari satu jenis lamun atau vegetasi campuran yang terdiri dari 2 sampai 12 jenis lamun yang tumbuh bersama-sama pada satu substrat (Kirkman, 1990). Sedangkan menurut Azkab (2006) lamun (seagrass) adalah tumbuhan air berbunga
(Anthophyta) yang hidup dan tumbuh terbenam di lingkungan laut, berpembuluh, berimpang (rhizoma), berakar, dan berkembang biak secara generative maupun vegetatif. Rimpangnya merupakan batang yang beruas-ruas yang tumbuh terbenam dan menjalar dalam substrat pasir, lumpur dan pecahan karang.
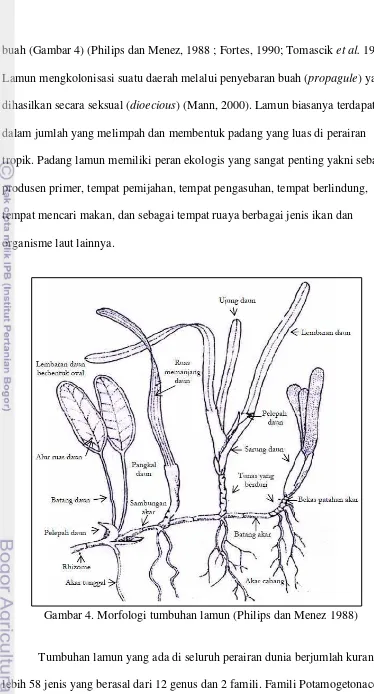
Jenis-jenis lamun umumnya memiliki morfologi luar yang tampak hampir serupa yakni memiliki daun panjang, tipis dan mirip pita yang mempunyai saluran air, serta bentuk pertumbuhannya monopodial. Bagian tubuh lamun dapat
buah (Gambar 4) (Philips dan Menez, 1988 ; Fortes, 1990; Tomascik et al. 1997). Lamun mengkolonisasi suatu daerah melalui penyebaran buah (propagule) yang dihasilkan secara seksual (dioecious) (Mann, 2000). Lamun biasanya terdapat dalam jumlah yang melimpah dan membentuk padang yang luas di perairan tropik. Padang lamun memiliki peran ekologis yang sangat penting yakni sebagai produsen primer, tempat pemijahan, tempat pengasuhan, tempat berlindung, tempat mencari makan, dan sebagai tempat ruaya berbagai jenis ikan dan organisme laut lainnya.
Gambar 4. Morfologi tumbuhan lamun (Philips dan Menez 1988)
terdiri dari 9 genus sedangkan famili Hydrocharitaceae terdiri dari 3 genus. Hingga kini, tercatat kurang lebih 12 jenis lamun dijumpai di perairan Indonesia yang termasuk dalam 7 genus dan 2 famili. Famili Hydrocharitaceae terdiri dari Enhalus acoroides, Thalassia hemprichii, Halophila ovalis, dan H. minor sedangkan famili Potamogetonaceae terdiri dari Syringodium isoetifolium, Cymodocea rotundata, C. serrulata, Halodule pinifolia, H. uninervis, dan Thalassodendron ciliatum (Azkab, 2006).
Klasifikasi tumbuhan lamun yang terdapat di Indonesia menurut Philip dan Menez (1988) adalah sebagai berikut :
Divisi : Anthophyta
Subkelas : Monocotyledoneae Ordo : Helobiae
Famili : Hydrocharitaceae Genus : Enhalus Genus : Thalassia Genus : Halophila Famili : Patamogetonaceae
Genus : Cymodoceae Genus : Halodule Genus : Syringodium Genus : Thalassodendron
fotosintesis lamun memerlukan suhu optimum 25 oC-35 oC dan pada saat cahaya penuh. Spesies lamun memiliki toleransi salinitas yang lebar yakni 10 ‰-40 ‰. Nilai optimum toleransi lamun terhadap salinitas adalah 35 ‰ (Dahuri et al. 1996). Kisaran pH yang optimal untuk laut adalah 7,5-8,5 (Nybakken, 1992). Kisaran pH yang baik untuk lamun adalah pada saat pH air laut normal karena pada saat tersebut ion karbonat yang dibutuhkan lamun untuk fotosintesis oleh lamun dalam keadaan melimpah.
2.5 Parameter Fisika – Kimiawi Perairan
Suhu merupakan parameter fisik yang sangat mempengaruhi pola kehidupan organisme perairan, seperti distribusi, komposisi, kelimpahan dan mortalitas. Suhu juga akan menyebabkan kenaikan metabolisme organisme perairan, sehingga kebutuhan oksigen terlarut menjadi meningkat (Nybakken, 1988). Effendi (2003), menjelaskan bahwa peningkatan suhu perairan akan meningkatkan kecepatan metabolisme tubuh organisme yang hidup didalamnya, sehingga konsumsi oksigen menjadi lebih tinggi. Peningkatan suhu perairan sebesar 10o
Salinitas dapat mempengaruhi penyebaran organisme benthos baik secara horizontal, maupun vertikal. Secara tidak langsung mengakibatkan adanya
perubahan komposisi organisme dalam suatu ekosistem (Odum, 1993).
Gastropoda yang hidupnya berpindah-pindah seperti halnya bulu babi mempunyai kemampuan untuk bergerak guna menghindari salinitas yang terlalu rendah, namun bivalvia yang bersifat sessile akan mengalami kematian jika pengaruh air tawar berlangsung lama (Effendi, 2003). Menurut Hutabarat dan Evans (1985)
kisaran salinitas yang masih mampu mendukung kehidupan organisme perairan, khususnya fauna makrobenthos adalah 15 - 35‰.
Kecerahan perairan dipengaruhi langsung oleh partikel yang tersuspensi didalamnya, semakin kurang partikel yang tersuspensi maka kecerahan air akan semakin tinggi. Selanjutnya dijelaskan bahwa penetrasi cahaya semakin rendah, karena meningkatnya kedalaman, sehingga cahaya yang dibutuhkan untuk proses fotosintesis oleh tumbuhan air berkurang. Oleh karena itu, secara tidak langsung kedalaman akan mempengaruhi pertumbuhan fauna benthos yang hidup
didalamnya. Disamping itu kedalaman suatu perairan akan membatasi kelarutan oksigen yang dibutuhkan untuk respirasi (Nybakken, 1988).
pH merupakan faktor pembatas bagi organisme yang hidup di suatu perairan. Perairan dengan pH yang terlalu tinggi atau rendah akan mempengaruhi ketahanan hidup organisme yang hidup didalamnya (Odum, 1993). Effendi (2003) menambahkan bahwa sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai kisaran pH sekitar 7 – 8,5.
Kedalaman diukur dengan menggunakan pipa berskala, pengukuran kedalaman ini dimaksudkan untuk mengetahui kedalaman yang optimal bagi habitat organisme yang diamati. Disamping itu kedalaman suatu perairan akan membatasi kelarutan oksigen yang dibutuhkan untuk respirasi (Nybakken, 1988).
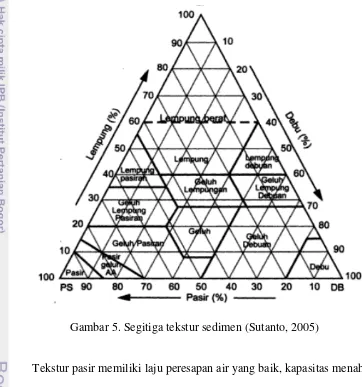
2.6 Jenis Substrat
atau tekstur tanah merupakan komponen penting bagi kehidupan organisme. Substrat di dasar perairan akan menentukan kelimpahan dan komposisi jenis dari hewan bentos (Odum, 1994). Tekstur substrat dikelompokkan dalam segitiga tekstur sedimen, pengelompokan tersebut berdasarkan presentase pasir, liat dan debu (Gambar 5).
Gambar 5. Segitiga tekstur sedimen (Sutanto, 2005)
melekat, maka akan mudah dibentuk seperti sosis dan akan retak atau patah jika dibengkokkan (Sutanto, 2005).
2.7 Bahan Organik dalam Sedimen
Sedimen merupakan padatan yang dapat langsung mengendap jika air didiamkan dan tidak terganggu selama beberapa waktu. Padatan yang mengendap tersebut terdiri dari partikel-partikel padatan yang mempunyai ukuran relative besar dan berat sehingga dapat mengendap dengan sendirinya. Debu dan liat merupakan padatan yang dapat mengendap dengan sendirinya terutama jika airnya tidak terguncang (Fardiaz, 1992). Bahan organik berasal dari hewan atau
tumbuhan yang membusuk lalu tenggelam ke dasar dan bercampur dengan substrat. Bahan organik di dalam ekosistem perairan dapat berasal dari dalam perairan itu sendiri (autochtonous) maupun berasal dari luar (allochtonous). Bahan organik yang berasal dari luar didapat dari adanya proses alami yang terbawa oleh air tanah dan air permukaan tanah serta berasal dari aktivitas
manusia yang langsung memasukkan bahan organik ke dalam suatu perairan. Laju dan pertambahan kandungan bahan organik memiliki pengaruh yang besar
3. METODE PENELITIAN
3.1 Lokasi dan Waktu Penelitian
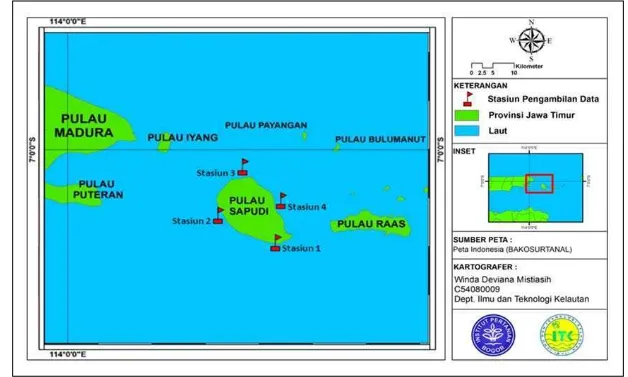
Penelitian ini berlokasi di habitat lamun Pulau Sapudi, Kabupaten
Sumenep, Madura (Gambar 6). Kabupaten Sumenep berada di ujung timur Pulau Madura, pada posisi 113o 32’ 54” – 116o 16’ 48” BT dan 4o 55’ – 7o 24’ LS. Pulau Sapudi merupakan salah satu pulau terbesar di Madura yang mempunyai
keanekaragaman hayati tinggi. Pulau Sapudi terletak pada 114,25o – 114,45o BT dan 7,05o – 7,20o
Lokasi pengambilan data di Pulau Sapudi dibagi menjadi empat stasiun pengamatan (Lampiran 1). Stasiun 1 berada di sebelah selatan tepatnya di Desa Banassem. Lokasi stasiun 1 berdekatan dengan rumah-rumah penduduk dan tempat penambatan perahu-perahu nelayan. Stasiun 2 berada di sebelah barat tepatnya di Desa Soka Rammi. Kondisi stasiun 2 hampir mirip dengan stasiun 1 yaitu berdekatan dengan rumah penduduk dan tempat penambatan perahu-perahu nelayan. Stasiun 3 berada di sebelah utara tepatnya di Desa Sonok sedangkan Stasiun 4 berada di sebelah timur tepatnya di Desa Prambanan. Kedua stasiun ini memiliki kemiripan yaitu jauh dari pemukiman penduduk.
LS, yang terdiri dari dua kecamatan yakni Kecamatan
3.2 Prosedur Kegiatan Penelitian
Prosedur kegiatan yang akan dilakukan selama penelitian di lapang disajikan pada Tabel 1. Kegiatan yang akan dilakukan terdiri dari observasi, wawancara dengan masyarakat setempat, pengumpulan data laporan, dan studi literatur.
Tabel 1. Prosedur kegiatan penelitian
KEGIATAN KETERANGAN
Observasi Kegiatan yang diawali dengan
dilakukannya tinjauan langsung terhadap kondisi lingkungan di lokasi penelitian
Wawancara Dilakukan untuk memperoleh dan
menunjang data yang terkait dengan kegiatan penelitian, dilakukan kepada masyarakat atau pihak-pihak yang memiliki informasi mengenai bulu babi. Pengumpulan Data Dilakukan secara langsung
selama kegiatan penelitian berlangsung. Data yang diambil berupa data primer dan data sekunder
Studi Literatur Dilakukan untuk menambah
3.3 Alat dan Bahan
Alat dan bahan yang digunakan dalam penelitian disajikan pada Tabel 2.
Tabel 2. Alat dan bahan yang digunakan dalam penelitian
NAMA ALAT UNIT/UKURAN/SATUAN KETERANGAN
Pipa berskala 1 Mengukur kedalaman
Tali rafia 50 m
Plastik sampel 60 Menyimpan Sampel
Roll meter 50 m Line Transect
Sabak 2
Kamera underwater 1 Olympus Miju 60
Kamera digital biasa 1 ES 10
Garmin GPS Map 78s 1 Plot Lokasi
Refraktometer Extech RF 10 1 Mengukur Salinitas
Termometer ruangan (Analog) 1 Mengukur Suhu
pH meter pHep +/- 0,1 akurasi 1 Mengukur pH Perairan
Tissu Secukupnya
ADS 1 Pasang
Papan Jalan 1
Alat tulis & Buku tulis 1 Mencatat
Alat penghitung 1 Mencatat
Laptop 1
Peta dasar Indonesia
ArcGIS Membuat Peta Lokasi
Transek kuadrat 1 x 1 meter
Kertas label Secukupnya Label
3.4 Metode Kerja
3.4.1 Penentuan Stasiun Penelitian
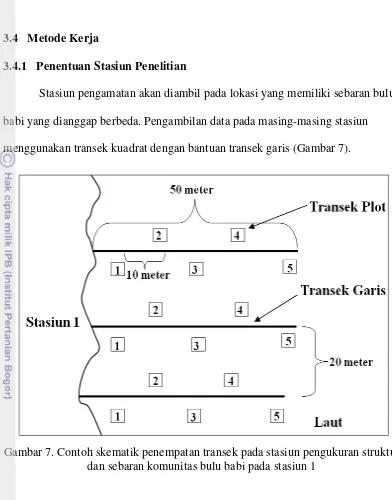
Stasiun pengamatan akan diambil pada lokasi yang memiliki sebaran bulu babi yang dianggap berbeda. Pengambilan data pada masing-masing stasiun menggunakan transek kuadrat dengan bantuan transek garis (Gambar 7).
Gambar 7. Contoh skematik penempatan transek pada stasiun pengukuran struktur dan sebaran komunitas bulu babi pada stasiun 1
Pada setiap stasiun terdiri dari 3 transek garis sepanjang 50 meter yang dibentangkan tegak lurus kearah pantai. Pada setiap transek garis yang
3.4.2 Pengambilan Contoh Bulu babi
Pengambilan contoh bulu babi dilakukan pada sebuah transek plot berukuran 1m x 1m (Gambar 8). Transek plot tersebut diletakkan pada jarak 10 meter dari transek plot yang lain dalam sebuah transek garis.
Gambar 8. Transek plot pengambilan contoh bulu babi
Pengambilan contoh bulu babi dilakukan pada masing-masing transek plot pada tiap stasiun pengamatan, dengan mencatat keberadaan bulu babi dilihat dari jenis dan kepadatannya. Identifikasi bulu babi langsung dilakukan di lapang dengan berpedoman pada buku identifikasi Coral Reef Press (Colin dan Arneson, 1995).
3.4.3 Pengambilan Contoh Lamun
Identifikasi lamun langsung dilakukan di lapang dengan berpedoman pada buku identifikasi Seagrass-Watch (McKenzie et al., 2001).
Gambar 9. Transek plot pengambilan contoh lamun
3.4.4 Pengukuran Parameter Fisika – Kimiawi Perairan
Pengukuran dilakukan untuk mengetahui kondisi air yang bagus untuk habitat bulu babi. Pengukuran kualitas air dilakukan pada setiap stasiun
pengamatan yaitu sebanyak 60 kali pengambilan data. Disetiap stasiun diambil sebanyak 15 kali ulangan. Variabel kualitas air yang diukur serta alat yang digunakan untuk pengukuran dapat dilihat pada Tabel 3.
Tabel 3. Pengukuran parameter fisika – kimiawi perairan
Variabel Satuan Alat / Metode
Suhu oC Termometer
Salinitas ‰ Refraktometer
Kecerahan cm Secchi Disk
pH − pH Meter
3.4.5 Pengukuran Parameter Fisika – Kimiawi Substrat Dasar
Pengambilan contoh substrat bertujuan untuk mengetahui kandungan di dalam substrat tersebut. Pengambilan contoh substrat ini dilakukan pada masing-masing stasiun pengamatan. Analisis substrat dilakukan di Laboratorium
Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas Pertanian IPB. Hasil substrat dari keempat stasiun pengamatan di analisis untuk melihat kandungannya. Kandungan yang dianalisis berupa fraksi substrat (pasir, debu, dan liat), pH substrat, kandungan C-organik dalam substrat, fosfat, dan Nitrat seperti terlihat pada Tabel 4.
Tabel 4. Pengukuran parameter fisika – kimiawi substrat dasar
Variabel Satuan Alat / Metode
Fraksi Substrat % Labu ukur, Metode Pipet
C-organik % Buret, Titrasi
Fosfat ppm Spektrofotometer, Bray I dan Hcl 25 %
pH Substrat − pH Meter, Ekstrak H2
Nitrat
O dan KCl ppm Metode Kjeldahl
3.4.6 Pola Sebaran Bulu babi
Pola sebaran bulu babi dilihat dari setiap stasiun dimana transek garis dipasang. Dari transek garis berukuran 1m x 1m didata jumlah bulu babi dan jenis apa saja yang ada. Hal tersebut dibandingkan dengan hasil dari perolehan jumlah dan jenis bulu babi di transek plot berbeda pada keempat stasiun tersebut.
Pola sebaran bulu babi tersebut juga dilihat untuk semua stasiun
pengamatan, untuk mengetahui bagaimana bulu babi tersebut menyebar di lautan dan untuk melihat stasiun berapa yang sebaran bulu babinya banyak, sedang dan sedikit.
3.5 Analisis Data
3.5.1 Komunitas Bulu babi
Komunitas bulu babi yang diukur adalah kepadatan bulu babi untuk mengetahui jumlah bulu babi dalam tiap plot pengamatan. Indeks yang diukur adalah indeks keanekaragaman, indeks keseragaman, dan indeks dominansi.
3.5.1.1 Kepadatan Bulu babi
Kepadatan merupakan jumlah jenis individu yang dibagi dengan luas total pengambilan contoh (English et al., 1994) dengan persamaan berikut :
……….. (1)
Keterangan :
: Kepadatan individu jenis ke-i (individu / m2 : Jumlah individu jenis ke-i yang diperoleh
)
A : Luas total area pengambilan contoh
3.5.1.2 Indeks keanekaragaman
……..…….…… (2)
Keterangan :
H’ : Indeks keanekaragaman Shannon-Wienner Pi
: Jumlah individu jenis ke-i : /N
N : Jumlah total individu seluruh jenis S : Jumlah jenis
Dengan kriteria :
H’ < 1 = Keanekaragaman jenis rendah 1 < H’ < 3 = Keanekaragaman jenis sedang H’ > 3 = Keanekaragaman jenis tinggi
3.5.1.3 Indeks Keseragaman
Nilai indeks keseragaman digunakan untuk menggambarkan komposisi individu tiap spesies yang terdapat dalam suatu komunitas, yang dihitung dengan menggunakan petunjuk Krebs (1989), sebagai berikut :
……… (3)
Keterangan :
E : Indeks keseragaman
H’ : Indeks keanekaragaman Shannon-Wienner Hmax : log
Dengan kriteria :
0,00 < E ≤ 0,50 = Komunitas tertekan 0,50 < E≤ 0,75 = Komunitas labil 0,75 < E ≤ 1,00 = Komunitas stabil
3.5.1.4 Indeks Dominansi
Nilai indeks dominansi digunakan untuk menggambarkan ada tidaknya dominasi suatu jenis dalam suatu komunitas, yang dihitung dengan menggunakan indeks dominansi Simpson (Magurran, 1988), sebagai berikut :
…………...………. (4)
Keterangan :
C : Indeks dominansi Simpson : /N
: Jumlah individu jenis ke-i
N : Jumlah total individu seluruh jenis s : Jumlah jenis
Dengan kriteria :
3.5.2 Komunitas Lamun
Komunitas lamun yang diukur dalam penelitian ini adalah kerapatan jenis lamun untuk mengetahui seberapa banyak jumlah lamun yang terdapat di tiap plot pengamatan. Selain itu juga mengukur persen penutupan lamun di tiap plot
pengamatan.
3.5.2.1 Kerapatan Jenis Lamun
Kerapatan jenis lamun adalah jumlah total individu atau tegakan lamun dalam suatu unit area yang dihitung berdasarkan petunjuk English et al. (1994) sebagai berikut :
……… (5)
Keterangan :
: Kerapatan jenis ke-i (ind/m2
: Jumlah total individu jenis ke-i (ind) )
A : Luas area total pengambilan contoh (m2)
3.5.2.2 Persentase Penutupan Lamun
Persentase penutupan lamun menyatakan luasan area yang tertutupi oleh lamun. Persentase penutupan lamun dihitung dengan menggunakan rumus berikut English et al. (1994) :
Keterangan :
C : Penutupan jenis Mi
: Frekuensi penutupan lamun
: Nilai tengah kelas penutupan lamun
: Jumlah frekuensi penutupan lamun
Nilai tengah kelas untuk menghitung persen penutupan dapat dilihat pada Tabel 5.
Tabel 5. Kelas penutupan yang digunakan untuk mencatat kelimpahan lamun Kelas Nilai Penutupan Lamun % Penutupan Nilai Tengah (Mi)
5 1/2 sampai semua 50-100 75
3.5.3 Pola Sebaran Jenis Bulu babi
Penentuan pola sebaran jenis dari suatu organisme pada habitatnya dapat ditentukan dengan menggunakan Indeks Sebaran Morisita (Khouw, 2009). Rumus untuk menghitung Indeks Sebaran Morisita sebagai berikut :
………..………. (7)
Keterangan : Id
n
: Indeks Sebaran Morisita
: Jumlah individu di setiap kuadran = x : Jumlah kuadran pengambilan contoh
1 + x2
: Jumlah individu di setiap kuadran di kuadratkan = x + ….
Hasil perhitungan Indeks Sebaran Morisita dibandingkan dengan kriteria sebagai berikut :
Id
I
< 1 : Pola sebaran individu jenis bersifat seragam
d
I
= 1 : Pola sebaran individu jenis bersifat acak
d> 1 : Pola sebaran individu jenis bersifat mengelompok
3.5.4 Hubungan Antara Bulu babi dengan Karakteristik Habitat
Adanya interaksi suatu organisme dengan karakteristik habitat tertentu dapat dipakai sebagai indikasi hadir tidaknya organisme tersebut pada suatu tempat dengan kepadatan yang tertentu pula. Evaluasi keterkaitan antara komunitas lamun dan bulu babi di lokasi penelitian dilakukan dengan menggunakan Analisis Faktorial Koresponden (Correspondence Analysis) (Bengen, 2000), yang didasarkan pada matriks data i baris (jenis bulu babi) dan j kolom (jenis lamun) dimana jenis ke-i bulu babi untuk lamun jenis ke-j terdapat pada baris ke-i dan kolom ke-j. Matriks datanya merupakan tabel kontigensi jenis bulu babi vs jenis lamun.
17
4. HASIL DAN PEMBAHASAN
4.1 Karakteristik Fisika – Kimiawi Perairan
Berdasarkan hasil pengamatan parameter fisik dan kimia di keempat lokasi pengambilan data (Lampiran 2), didapatkan hasil seperti tercantum pada Tabel 6.
Tabel 6. Karakteristik fisika – kimiawi perairan di lokasi pengamatan (rata-rata dan simpangan baku)
Suhu pada keempat stasiun pengamatan memperlihatkan nilai kisaran rata-rata sebesar 28,93 ± 0,80 oC sampai dengan 30,67 ± 0,49 oC (Tabel 6). Stasiun 1 memiliki nilai rata-rata suhu terendah sebesar 28,93 ± 0,80 oC. Stasiun 2 memiliki nilai rata-rata suhu tertinggi sebesar 30,67 ± 0,49 oC. Organisme perairan
memiliki kisaran suhu tertentu yang disukai bagi pertumbuhan dan kelangsungan hidupnya. Dari hasil suhu yang diperoleh di keempat stasiun tersebut masih berada pada kisaran normal yang mendukung kehidupan organisme perairan sebesar 30 – 35 o
Menurut Nybakken (1988) suhu merupakan parameter fisik yang sangat mempengaruhi pola kehidupan organisme perairan, seperti distribusi, komposisi, kelimpahan dan mortalitas. Suhu juga akan menyebabkan kenaikan metabolisme organisme perairan, sehingga kebutuhan oksigen terlarut menjadi meningkat. Effendi (2003) menjelaskan bahwa peningkatan suhu perairan akan meningkatkan
kecepatan metabolisme tubuh organisme yang hidup didalamnya, sehingga konsumsi oksigen menjadi lebih tinggi. Peningkatan suhu perairan sebesar 10 o
Salinitas pada keempat stasiun pengamatan memperlihatkan kisaran nilai rata sebesar 29 ± 0 ‰ sampai dengan 31,07 ± 1,62 ‰ (Tabel 6). Nilai rata-rata salinitas tertinggi terdapat pada stasiun 1 sebesar 31,07 ± 1,62 ‰. Stasiun 3 memiliki rata-rata salinitas terendah yang sama ditiap plot pengambilan data yaitu sebesar 29 ± 0 ‰. Stasiun 2 memiliki nilai rata-rata salinitas sebesar 29,27 ± 0,46 ‰. Stasiun 4 memiliki rata-rata nila salinitas sama ditiap plot pengambilan data sebesar 30 ± 0 ‰.
C, menyebabkan terjadinya peningkatan konsumsi oksigen oleh organisme akuatik sebanyak dua sampai tiga kali lipat (Effendi, 2003).
Salinitas dapat mempengaruhi penyebaran organisme benthos baik secara horizontal, maupun vertikal. Secara tidak langsung mengakibatkan adanya perubahan komposisi organisme dalam suatu ekosistem (Odum, 1993).
Gastropoda yang hidupnya berpindah-pindah seperti halnya bulu babi mempunyai kemampuan untuk bergerak guna menghindari salinitas yang terlalu rendah sehingga dapat bertahan dari kematian (Effendi, 2003). Menurut Hutabarat dan Evans (1985) kisaran salinitas yang masih mampu mendukung kehidupan
organisme perairan, khususnya fauna makrobenthos termasuk bulu babi adalah 15 ‰-35 ‰. Oleh karena itu kisaran salinitas yang terdapat pada ke empat stasiun pada penelitian ini masih tergolong normal.
Nilai pH pada lokasi pengamatan memiliki kisaran nilai rata-rata sebesar 8,6 ± 0 sampai dengan 8,73 ± 0,09 (Tabel 6). Nilai pH pada tiga stasiun
stasiun 3, dan stasiun 4. Stasiun 1 memiliki nilai kisaran pH tertinggi sebesar 8,73 ± 0,09. Kisaran nilai rata-rata pH pada ke empat stasiun tersebut memiliki nilai yang tinggi untuk biota perairan.
Sebagian besar biota akuatik sensitif terhadap perubahan pH dan menyukai kisaran pH sekitar 7 – 8,5 (Effendi, 2003). pH merupakan faktor pembatas bagi organisme yang hidup di suatu perairan, perairan dengan pH yang terlalu tinggi atau rendah akan mempengaruhi ketahanan hidup organisme yang hidup didalamnya (Odum, 1993).
Tingkat kecerahan perairan pada semua stasiun pengamatan adalah 100 % pada semua kedalaman (Tabel 6). Nilai rata-rata kedalaman pada semua stasiun pengamatan berkisar 14 ± 5,07 cm sampai dengan 31,53 ± 9,45 cm, hal ini berarti penetrasi cahaya dapat mencapai dasar perairan. Kondisi ini memungkinkan terjadinya fotosintesis yang baik untuk lamun sehingga akan mendukung kehidupan bulu babi sebagai salah satu avertebrata yang memakan daun lamun secara langsung (McRoy dan Helfferich, 1980).
4.2 Karakteristik Fisika – Kimiawi Substrat Dasar
Karakteristik fisika dan kimiawi substrat dasar di setiap stasiun pengamatan disajikan pada Tabel 7.
Tabel 7. Karakteristik fisika – kimiawi substrat di lokasi pengamatan
Nama
Fraksi substrat yang dihasilkan ada 3 yaitu pasir, debu, dan liat. Fraksi pasir mendominasi ke empat stasiun pengamatan, diikuti oleh fraksi liat dan yang terkecil adalah nilai dari fraksi debu (Tabel 7). Fraksi pasir stasiun 4 memiliki nilai fraksi tertinggi sebesar 95,99 %, dan fraksi pasir terkecil terdapat pada stasiun 1 sebesar 92,29 %. Untuk stasiun 2 fraksi pasir sebesar 93,77 % dan stasiun 3 sebesar 95,99 %. Fraksi liat memiliki nilai semakin kecil dari stasiun 1 ke stasiun 4. Stasiun 1 memiliki nilai sebesar 5,40 %, stasiun 2 sebesar 4,12 %, stasiun 3 sebesar 3,36 %, dan stasiun 4 sebesar 2,87. Sedangkan untuk fraksi debu stasiun 1 memiliki nilai sebesar 2,31 %, stasiun 2 sebesar 2,11 %, stasiun 3
sebesar 1,70 %, dan stasiun 4 sebesar 1,14 %.
Hasil pengukuran nitrat pada setiap stasiun pengamatan (Tabel 7) nilai nitrat tertinggi terdapat pada stasiun 3 sebesar 620 ppm, dan terendah pada stasiun 1 sebesar 310 ppm. Untuk stasiun 2 dan stasiun 4 nilai kandungan nitratnya sama sebesar 616,9 ppm. Nilai fosfat tertinggi terdapat pada stasiun 3 sebesar 35,10 ppm, dan terendah pada stasiun 4 sebesar 30,10 ppm. Nilai nitrat pada substrat di lokasi penelitian tinggi, hal tersebut dikarenakan substratnya kaya akan bahan organik yang menstimulir pertumbuhan alga dan tumbuhan air secara pesat. Semakin tinggi kandungan bahan organik dalam substrat maka nilai nitratnya akan semakin tinggi. Sampai saat ini belum ada standar baku yang pasti mengenai nitrat di substrat.
Nitrat merupakan bentuk utama nitrogen di perairan alami dan merupakan nutrien utama bagi pertumbuhan tanaman dan alga (Effendi, 2003). Fosfat
merupakan bentuk fosfor yang dapat dimanfaatkan oleh tumbuhan dan juga merupakan unsur yang esensial bagi tumbuhan tingkat tinggi dan alga, sehingga unsur ini menjadi faktor pembatas bagi tumbuhan dan alga akuatik serta sangat mempengaruhi tingkat produktivitas perairan (Effendi, 2003). Oleh karena itu nitrat dan fosfat dibutuhkan oleh organisme perairan termasuk lamun dan bulu babi untuk kelangsungan hidupnya.
yang menggunakan KCl tertinggi terdapat pada stasiun 3 dan stasiun 4 dengan nilai sama sebesar 6,90 dan terkecil terdapat pada stasiun 1 dan stasiun 2 dengan nilai yang sama juga sebesar 6,80.
C organik di perairan berasal dari tumbuhan atau biota akuatik, baik yang hidup atau mati dan menjadi detritus. Mikroba memanfaatkan bahan organik sebagai sumber makanan dari suatu rangkaian reaksi biokimia yang kompleks. Pada reaksi katabolisme, makrobenthos merombak bahan organik dan dipecah untuk menghasilkan energi berupa makanan yang digunakan untuk
mempertahankan kelangsungan hidup dan pertumbuhannya (Effendi, 2003). Nilai pH substrat yang semakin tinggi akan menaikkan nilai alkalinitas (basa) dan semakin rendah kadar karbondioksida bebas, sedangkan larutan yang bersifat asam (pH rendah) bersifat korosif (Effendi, 2003). Oleh karena itu C organik dan pH dalam substrat perairan diperlukan oleh organisme akuatik untuk
kelangsungan hidupnya.
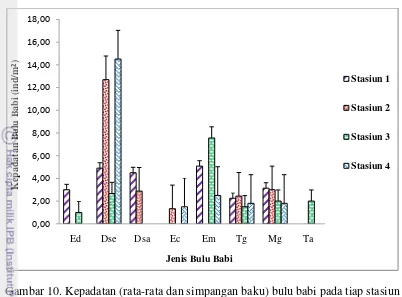
4.3. Kepadatan Bulu babi
Bulu babi yang dijumpai di Pulau Sapudi terdiri dari 8 jenis, yaitu Echinothrix diadema, Diadema setosum, Diadema savignyi, dan Echinothrix calamaris dari famili Diadematidae, Mespilia globulus dan Temnopleurus alexandri dari famili Temnopleuridae, Tripneustes gratilla dari famili
Gambar 10. Kepadatan (rata-rata dan simpangan baku) bulu babi pada tiap stasiun pengamatan, Ed=Echinothrix diadema, Dse=Diadema setosum,
Dsa=Diadema savignyi, Ec=Echinothrix calamaris,
Em=Echinometra mathaei, Tg=Tripneustes gratilla, Mg=Mespilia globulus, dan Ta=Temnopleurus alexandri
Kepadatan rata-rata jenis bulu babi Echinothrix diadema di Pulau Sapudi berkisar antara 1,00 ± 0,00 ind/m2 sampai dengan 3,00 ± 2,00 ind/m2, kepadatan tertinggi berada pada stasiun 1 (Lampiran 5). Kepadatan jenis bulu babi Diadema setosum di Pulau Sapudi berkisar antara 2,67 ± 2,08 ind/m2 sampai dengan 14,51 ± 10,83 ind/m2, kepadatan tertinggi berada pada stasiun 4. Kepadatan jenis bulu babi Diadema savignyi di Pulau Sapudi berkisar antara 2,88 ± 1,13 ind/m2 sampai dengan 4,50 ± 2,07 ind/m2, kepadatan tertinggi berada pada stasiun 1. Kepadatan jenis bulu babi Echinothrix calamaris di Pulau Sapudi berkisar antara 1,50 ± 0,71 ind/m2 sampai dengan 1,33 ± 0,58 ind/m2, kepadatan tertinggi berada pada stasiun 2. Kepadatan jenis bulu babi Echinometra mathaei di Pulau Sapudi berkisar antara 2,50 ± 0,71 ind/m2 sampai dengan 7,56 ± 7,14 ind/m2, kepadatan tertinggi berada pada stasiun 3. Kepadatan jenis bulu babi Tripneustes gratilla di Pulau Sapudi berkisar antara 1,50 ± 0,58 ind/m2 sampai dengan 2,44 ± 1,24 ind/m2, kepadatan tertinggi berada pada stasiun 2. Kepadatan jenis bulu babi Mespilia globulus di Pulau Sapudi berkisar antara 1,80 ± 0,45 ind/m2 sampai dengan 3,14 ± 1,57 ind/m2, kepadatan tertinggi berada pada stasiun 1. Kepadatan jenis bulu babi Temnopleurus alexandri di Pulau Sapudi sebesar 2,00 ± 0,82 ind/m2
(Setiawan, 2010).
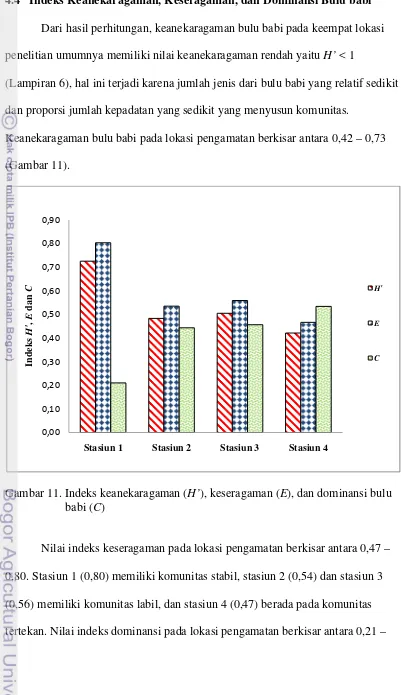
4.4 Indeks Keanekaragaman, Keseragaman, dan Dominansi Bulu babi Dari hasil perhitungan, keanekaragaman bulu babi pada keempat lokasi penelitian umumnya memiliki nilai keanekaragaman rendah yaitu H’ < 1
(Lampiran 6), hal ini terjadi karena jumlah jenis dari bulu babi yang relatif sedikit dan proporsi jumlah kepadatan yang sedikit yang menyusun komunitas.
Keanekaragaman bulu babi pada lokasi pengamatan berkisar antara 0,42 – 0,73 (Gambar 11).
Gambar 11. Indeks keanekaragaman (H’), keseragaman (E), dan dominansi bulu babi (C)
Nilai indeks keseragaman pada lokasi pengamatan berkisar antara 0,47 – 0,80. Stasiun 1 (0,80) memiliki komunitas stabil, stasiun 2 (0,54) dan stasiun 3 (0,56) memiliki komunitas labil, dan stasiun 4 (0,47) berada pada komunitas tertekan. Nilai indeks dominansi pada lokasi pengamatan berkisar antara 0,21 –
0,00
Stasiun 1 Stasiun 2 Stasiun 3 Stasiun 4
0,53. Stasiun 1 (0,21), stasiun 2 (0,44), dan stasiun 3 (0,46) memiliki dominansi rendah dengan kriteria 0,00 < C ≤ 0,50, sedangkan untuk stasiun 4 (0,53) memiliki dominansi sedang dengan kriteria 0,50 < C ≤ 0,75 (Magurran, 1988). Hal ini menandakan bahwa komunitas bulu babi di Pulau Sapudi berada dalam kondisi yang relatif stabil dengan dominansi yang rendah (Dobo, 2009).
4.5 Vegetasi Lamun
Komunitas lamun biasanya terdapat dalam area yang luas dan rapat.Vegetasi lamun di Pulau Sapudi termasuk vegetasi campuran (mixed seagrass beds), hal ini terlihat adanya asosiasi antara dua atau tiga jenis lamun pada beberapa transek kuadrat pengambilan data. Padang lamun di perairan Indonesia umumnya termasuk padang lamun vegetasi campuran (Nienhuis et al. 1989).
Lamun yang ditemukan di Pulau Sapudi terdiri dari 5 jenis (Lampiran 7) yaitu Thalassia hemprichii, Enhalus acoroides, Halophila ovalis (Famili
Gambar 12. Kerapatan (rata-rata dan simpangan baku) jenis lamun pada tiap stasiun pengamatan, Th=Thalassia hemprichii, Ea=Enhalus
acoroides, Si=Syringodium isoetifolium, Cr=Cymodocea rotundata, Ho=Halophila ovalis.
Kerapatan rata-rata lamun tertinggi pada stasiun 2 ditemukan pada jenis Enhalus acoroides sebesar 89,50 ± 60,10 ind/m2. Kerapatan rata-rata lamun tertinggi pada stasiun 3 ditemukan pada jenis Thalassia hemprichii sebesar 99,85 ± 50,84 ind/m2dan terendah pada jenis Enhalus acoroides sebesar 24,13 ± 11,98 ind/m2. Kerapatan rata-rata lamun tertinggi pada stasiun 4 ditemukan pada jenis Syringodium isoetifolium sebesar 132,67 ± 71,51 ind/m2 dan terendah pada jenis Enhalus acoroides sebesar 35,93 ± 22,49 ind/m2
Kerapatan rata-rata jenis lamun Thalassia hemprichii di Pulau Sapudi berkisar antara 87,14 ± 20,82 ind/m
.
2
sampai dengan 142,82 ± 96,95 ind/m2, kerapatan tertinggi berada pada stasiun 1 (Lampiran 8). Kerapatan rata-rata jenis lamun Enhalus acoroides di Pulau Sapudi berkisar antara 24,13 ± 11,98 ind/m2 sampai dengan 89,50 ± 60,10 ind/m2, kerapatan tertinggi berada pada stasiun 2. Kerapatan rata-rata jenis lamun Syringodium isoetifolium di Pulau Sapudi berkisar
antara 67,00 ± 1,41 ind/m2 sampai dengan 132,67 ± 71,51 ind/m2, kerapatan tertinggi berada pada stasiun 4. Kerapatan rata-rata jenis lamun Cymodocea rotundata di Pulau Sapudi berkisar antara 56,50 ± 0,71 ind/m2 sampai dengan 86,50 ± 14,85 ind/m2, kerapatan tertinggi berada pada stasiun 3. Kerapatan rata-rata jenis lamun Halophila ovalis di Pulau Sapudi berkisar antara 48,00 ± 16,97 ind/m2 sampai dengan 53,00 ± 8,49 ind/m2
Kerapatan rata-rata lamun terendah ditemukan di stasiun 2, hal ini diduga karena sedikitnya jenis lamun yang terukur pada plot pengambilan data di stasiun tersebut. Pada stasiun 2 ditemukan satu jenis lamun saja yaitu jenis lamun
Enhalus acoroides dengan kerapatan rata-rata sebesar 89,50 ± 60,10 ind/m , kerapatan tertinggi berada pada stasiun 3.
2
Persentase penutupan lamun di Pulau Sapudi berkisar antara 26,19 % sampai dengan 32,17 %. Persentase penutupan lamun tertinggi di setiap stasiun pengamatan ditemukan pada stasiun 1, sedangkan persentase penutupan lamun terendah ditemukan pada stasiun 2 (Gambar 13).
Gambar 13. Persentase penutupan lamun di Pulau Sapudi, Th=Thalassia hemprichii, Ea=Enhalus acoroides, Si=Syringodium isoetifolium, Cr=Cymodocea rotundata, Ho=Halophila ovalis.
Persentase penutupan lamun pada stasiun 1 sebesar 32,17 % (Lampiran 9), dan jenis lamun yang mendominasi adalah jenis lamun Thalassia hemprichii dan Cymodocea rotundata. Persentase penutupan lamun pada stasiun 2 sebesar 26,19 %, dan jenis lamun yang mendominasi adalah jenis lamun Enhalus acoroides. Persentase penutupan lamun pada stasiun 3 sebesar 29,29 %, dan jenis lamun yang mendominasi adalah jenis lamun Halophila ovalis dan Cymodocea
rotundata. Persentase penutupan lamun pada stasiun 4 sebesar 30,25 %, dan jenis lamun yang mendominasi adalah jenis lamun Cymodocea rotundata dan
Syringodium isoetifolium. Rata-rata kerapatan dan persentase penutupan lamun terendah ditemukan pada stasiun 2, hal ini dimungkinkan lamun kurang tumbuh subur pada lokasi tersebut.
Stasiun 1 Stasiun 2 Stasiun 3 Stasiun 4
Kerapatan lamun di Pulau Sapudi umumnya didominasi oleh jenis lamun Thalassia hemprichii,Enhalus acoroides dan Cymodocea rotundata, sedangkan persentase penutupan lamun didominasi oleh jenis lamun Thalassia hemprichii, Cymodocea rotundata dan Syringodium isoetifolium (Gambar 12 & 13).
Kerapatan dan persentase penutupan Thalassia hemprichii, bernilai tinggi berkaitan dengan kemampuan adaptasinya terhadap tipe substrat yang ada di Pulau Sapudi. Menurut Hartog (1970) Thalassia hemprichii mampu hidup dalam semua jenis substrat, bervariasi dari pecahan karang hingga substrat lunak.
Enhalus acoroides juga merupakan jenis lamun yang mampu beradaptasi terhadap semua jenis substrat di Pulau Sapudi, namun lamun jenis ini memiliki kerapatan dan penutupan yang lebih rendah dari pada Thalassia hemprichii, hal tersebut dimungkinkan karena kondisi perairan Pulau Sapudi yang relatif dangkal pada saat surut, akibatnya jenis ini hanya tersebar pada padang lamun yang pada saat surut masih terendam air.
Secara umum jenis lamun Syringodium isoetifolium memiliki nilai kerapatan yang lebih rendah dibanding Thalassia hemprichii dan Enhalus
ditemukan dengan persen penutupan yang tinggi bersama Thalassia hemprichii, Enhalus acoroides, Cymodocea rotundata, dan Halophila ovalis.
Menurut Tomascik et al. ( 1997) jenis lamun Cymodocea rotundata mampu hidup pada daerah dangkal yang tertutup karang dan mempunyai toleransi yang tinggi pada daerah tidak terendam air (Tomascik et al., 1997). Oleh karena itu lamun jenis ini memiliki kerapatan dan penutupan yang cukup tinggi. Jenis lamun Halophila ovalis memiliki kerapatan yang rendah dan hanya ditemukan pada stasiun 3 dan 4, namun lamun jenis ini memiliki nilai persen penutupan yang cukup tinggi dibandingkan dengan jenis lamun Thalassia hemprichii dan Enhalus acoroides. Jenis lamun ini ditemukan secara bersama-sama dengan Thalassia hemprichii, Enhalus acoroides, Cymodocea rotundata, dan Syringodium
isoetifolium. Menurut Nienhuis et al (1989) jenis lamun Halophila ovalis sering terlihat sebagai jenis pembuka yang mendiami substrat pasir.
4.6 Pola Sebaran Jenis Bulu babi
Kondisi lingkungan perairan pada saat pengamatan sangat mempengaruhi pola sebaran jenis di suatu perairan. Penentuan sebaran jenis dengan
Tabel 8. Pola sebaran bulu babi di Pulau Sapudi Madura
Jenis Echinoidea N ∑x ∑x2 Id Pola Sebaran
Echinothrix diadema 60 20 76 8,84 Mengelompok Diadema setosum 60 249 5109 4,72 Mengelompok Diadema savignyi 60 50 218 4,11 Mengelompok Echinothrix calamaris 60 7 11 5,71 Mengelompok Echinometra mathaei 60 134 1362 4,13 Mengelompok Tripneustes gratilla 60 55 145 1,82 Mengelompok Mespilia globulus 60 67 215 2,01 Mengelompok Temnopleurus alexandri 60 8 18 10,71 Mengelompok
Pola sebaran jenis ini sama di semua stasiun pengamatan dengan nilai Id berkisar antara 1,82 – 10,71. Menurut Aziz (1994) bulu babi di padang lamun dapat hidup soliter atau hidup mengelompok tergantung pada jenis dan habitatnya.
Menurut Aziz (1987) bulu babi baik yang menyendiri ataupun mengelompok, hidup bebas mencari makan secara aktif, berpindah dari satu rumpun ke rumpun alga lainnya. Aktifitas makan ini terutama dilakukan pada malam hari. Kebiasaan bulu babi jenis tertentu untuk hidup mengelompok seperti pada marga Diadema dan Strongylocentrotus ternyata mempunyai pengaruh negatif terhadap komunitas algae dan lamun (Aziz, 1987).
4.7 Hubungan Antara Bulu babi dengan Lamun di Pulau Sapudi
Grafik Analisis Faktorial Koresponden antara bulu babi dan lamun terlihat pada Gambar 14.
Sumbu 1: 0,07442 (59,59% of Inertia)
-0,8
Gambar 14. Grafik Analisis Faktorial Koresponden antara bulu babi dan lamun pada sumbu 1 dan 2, Ed=Echinothrix diadema, Dse=Diadema
Hasil Analisis Faktorial Koresponden (Correspondence analysis) sebaran 8 jenis bulu babi pada 5 jenis lamun di lokasi penelitian (Gambar 14),
dari analisis faktorial koresponden sebesar 87,45 % dari hasil penjumlahan ragam. Sumbu 1 (F1) memiliki akar ciri dan ragam berturut-turut sebesar 0,07 (59,59 %), sedangkan sumbu 2 (F2) memiliki akar ciri dan ragam berturut-turut sebesar 0,03 (27,86 %). Karena sumbu 1 memiliki nilai ragam dan akar ciri yang lebih besar, maka informasi difokuskan pada sumbu 1 tersebut (Lampiran 11).
Dari Gambar 14 terlihat bahwa bulu babi jenis Mespilia globulus (cos2 0,77) dan Echinothrix calamaris (cos2 0,80) memiliki hubungan atau asosiasi dengan lamun jenis Enhalus acoroides (cos2 0,64) dan Syringodium isoetifolium (cos2 0,71). Bulu babi dan lamun tersebut berasosiasi pada kuadran 1 (+,+). Pada kuadran 2 (−,+) terlihat bahwa bulu babi jenis Echinothrix diadema (cos2 0,50), Diadema setosum (cos2 0,88), dan Diadema savignyi (cos2 0,87) memiliki hubungan atau asosiasi dengan lamun jenis Thalassia hemprichii (cos2
Nilai cos
0,94). 2
yang mendekati nilai 1 terlihat lebih memiliki hubungan keterkaitan, dan yang jauh dari nilai 1 tidak memiliki keterkaitan seperti terlihat pada nilai cos2 dari Temnopleurus alexandri sebesar 0,23. Keterkaitan antara ketiga jenis bulu babi tersebut terhadap lamun Thalassia hemprichii yang
5. KESIMPULAN DAN SARAN
5.1 Kesimpulan
Bulu babi yang ditemukan di Pulau Sapudi, Madura terdiri dari 8 jenis yaitu Echinothrix diadema, Diadema setosum, Diadema savignyi, Echinothrix calamaris, Echinometra mathaei, Tripneustes gratilla, Mespilia globulus, dan Temnopleurus alexandri. Kepadatan bulu babi pada tiap stasiun pengamatan didominasi oleh jenis bulu babi Diadema setosum dan Echinometra mathaei.
Pola sebaran jenis bulu babi di Pulau Sapudi Madura memiliki pola sebaran mengelompok (Id> 1). Sebaran bulu babi jenis Mespilia globulus dan
Echinothrix calamaris berasosiasi dengan lamun jenis Enhalus acoroides dan Syringodium isoetifolium. Bulu babi jenis Echinothrix diadema, Diadema setosum, dan Diadema savignyi berasosiasi dengan lamun jenis Thalassia hemprichii.
5.2 Saran
KABUPATEN SUMENEP, MADURA
WINDA DEVIANA MISTIASIH
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Dengan ini saya menyatakan bahwa skripsi berjudul Struktur dan Sebaran Komunitas Bulu Babi (Echinoidea) di Habitat Lamun Pulau Sapudi, Kabupaten Sumenep, Madura adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan
dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2013
WINDA DEVIANA MISTIASIH. Structure and Distribution of Sea Urchin (Echinoidea) Communities in Seagrass Beds of Sapudi Island,
Sumenep, Madura. Supervised by DIETRIECH G. BENGEN and HAWIS H. MADDUPPA.
Sea urchins dispersed from intertidal zone to subtidal zone. Sea urchins are generally inhabit coral reefs, seagrass beds and also prefer almost hard substrate of seagrass beds consisting of sand and rubble. This research objectives is to study the structure and distribution of sea urchins communities in seagrass beds of Sapudi island and it’s relationship with characteristic of habitat.
Observation of research location is conducted from June, 28th until 29th
Sea urchins species were found in this research are Echinotrix calamaris, Diadema setosum, Diadema savignyi, Echinotrix diadema, Echinometra mathaei, Tripneustes gratilla, Mespilia globulus, and Temnopleurus alexandri. Sea urchins density on each stations dominated by Diadema setosum and Echinometra
mathaei. Seagrass species were found in this research are Thalassia hemprichii, Enhalus acoroides, Halophila ovalis, Syringodium isoetifolium, and Cymodoceae rotundata. Seagrasses density on each stations dominated by Thalassia
hemprichii,Enhalus acoroides and Cymodocea rotundata, while percent cover of seagrass dominated by Thalassia hemprichii, Cymodocea rotundata, and
Syringodium isoetifolium.
2012. Primary data was collected at research location from June 30th until July 3th 2012, in four stations. Station 1 is located in south of the island (Banasem village), station 2 in west (Soka Rammi village), station 3 in north (Sonok village), and station 4 in east (Prambanan village). There are 3 line transects on each station. Each line trancents along 50 meters were laid perpendicular towards the beach. The distance between line transect are 20 meters. Furthermore, there are 5 plot transects sized 1m x 1 m on each line transect, with a distance of 10 meters between 3 line transects. Collected data are sea urchins density, seagrass density, percent cover of seagrass, water quality parameters, and substrate samples.
The distribution pattern of sea urchins in Sapudi island, Madura is categorized as clumped distribution (Id>1). Correspondent analysis shows the relationship between the distribution
of sea urchins and seagrass is centered on Factorial axis 1 (F1) an factorial axis 2 (F2). The data shows that the distribution of Mespilia globulus and Echinotrix calamaris is associated with Enhalus acoroides and Syringodium isoetifolium, while the species of Diadema setosum, Diadema savignyi, and Echinotrix diadema is associated with Thalassia
(Echinoidea) di Habitat Lamun Pulau Sapudi, Kabupaten Sumenep, Madura. Dibimbing oleh DIETRIECH GEOFFREY BENGEN dan HAWIS H. MADDUPPA.
Bulu babi tersebar mulai dari daerah intertidal yang dangkal hingga ke laut dalam. Bulu babi pada umumnya menghuni ekosistem terumbu karang dan
padang lamun serta menyukai substrat yang agak keras terutama substrat di padang lamun yang terdiri dari pasir dan pecahan karang. Penelitian ini bertujuan untuk mengetahui struktur dan sebaran komunitas bulu babi di habitat lamun Pulau Sapudi, Kabupaten Sumenep, Madura serta untuk mengetahui hubungan bulu babi dengan karakteristik habitatnya.
Penelitian ini dilaksanakan pada bulan Juni yang dimulai dengan
pengamatan lokasi pada tanggal 28 – 29 Juni 2012. Pengambilan data primer di lokasi penelitian pada tanggal 30 Juni – 3 Juli 2012. Lokasi pengambilan data di Pulau Sapudi dibagi menjadi 4 stasiun. Stasiun 1 di sebelah selatan (Desa Banassem), Stasiun 2 di sebelah barat (Desa Soka Rammi), Stasiun 3 di sebelah utara (Desa Sonok), dan Stasiun 4 di sebelah timur (Desa Prambanan). Pada tiap stasiun terdiri dari 3 transek garis sepanjang 50 meter yang dibentangkan tegak lurus kearah pantai. Pada setiap transek garis yang dibentangkan terdapat 5 transek plot berukuran 1m x 1m dengan jarak 10 meter antara transek plot satu dengan yang lainnya, jarak antara ketiga transek garis sejauh 20 meter. Data yang diambil adalah kepadatan bulu babi, kerapatan lamun, persen penutupan lamun, parameter kualitas air, dan sampel substrat.
Bulu babi yang ditemukan dalam penelitian ini terdiri dari 8 jenis yaitu Echinothrix diadema, Diadema setosum, Diadema savignyi, Echinothrix calamaris, Echinometra mathaei, Tripneustes gratilla, Mespilia globulus, dan Temnopleurus alexandri. Kepadatan bulu babi pada tiap stasiun pengamatan didominasi oleh jenis bulu babi Diadema setosum dan Echinometra mathaei. Lamun yang ditemukan dalam penelitian ini terdiri dari 5 jenis yaitu Thalassia hemprichii, Enhalus acoroides, Halophila ovalis, Syringodium isoetifolium, dan
Cymodocea rotundata. Kerapatan lamun pada tiap stasiun pengamatan umumnya
didominasi oleh jenis lamun Thalassia hemprichii,Enhalus acoroides dan Cymodocea rotundata, sedangkan persentase penutupan lamun didominasi oleh jenis lamun Thalassia hemprichii, Cymodocea rotundata dan Syringodium isoetifolium.
Pola sebaran jenis bulu babi di Pulau Sapudi Madura memiliki pola sebaran mengelompok (Id > 1). Hasil Analisis Faktorial Koresponden
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
WINDA DEVIANA MISTIASIH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada
Departemen Ilmu dan Teknologi Kelautan Fakultas Perikanan dan Ilmu Kelautan
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
Nama : Winda Deviana Mistiasih
NIM : C54080009
Departemen : Ilmu dan Teknologi Kelautan
Disetujui oleh
Pembimbing Utama Pembimbing Anggota
Prof.Dr.Ir. Dietriech G. Bengen, DEA Dr. Hawis H. Madduppa, S.Pi, MSi
NIP. 19590105 198312 1 001 NIP. 19790326 200701 1 001
Mengetahui
Ketua Departemen Ilmu dan Teknologi Kelautan
NIP. 19580909 198303 1 003 Prof.Dr.Ir. Setyo Budi Susilo, M.Sc
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan
hidayah yang telah diberikan, sehingga penelitian yang dituangkan dalam skripsi
yang berjudul Struktur dan Sebaran Komunitas Bulu Babi (Echinoidea) di Habitat
Lamun Pulau Sapudi, Kabupaten Sumenep, Madura ini dapat terselesaikan
dengan baik. Skripsi ini merupakan tugas akhir sebagai satu syarat untuk
memperoleh gelar kesarjanaan, yaitu Sarjana Ilmu dan Teknologi Kelautan.
Penulis mengucapkan terimakasih kepada Bapak Prof.Dr.Ir. Dietriech G.
Bengen, DEA selaku pembimbing utama dan kepada Bapak Dr. Hawis H.
Madduppa, S.Pi, M.Si selaku pembimbing anggota yang telah memberikan
bimbingan, arahan, saran dan idenya sehingga penelitian ini terselesaikan dengan
baik. Ucapan terimakasih penulis ucapkan kepada Bapak Beginer Subhan, S.Pi,
M.Si selaku dosen penguji sidang, Bapak Dr. Henry M. Manik, S.Pi., M.T selaku
dosen pembimbing akademik, dan Bapak Prof.Dr.Ir.Setyo Budi Susilo, M.Sc
selaku ketua departemen ITK. Ucapan terimakasih juga penulis ucapkan kepada
kedua orangtua tercinta, keluarga besar, teman-teman ITK (angkatan 45)
khususnya Hikmah Cut Ramadhana, Verlin Ayu Ibrani, Jihan Jemika Agustina,
Conny Ayuningtiyas, Ririn Prameswari, Nurlaela Herlinawati, Bahrun Rohadi,
Ahmad Ridho dan Hary Aditia Putra atas persahabatan dan dukungannya selama
ini. Tidak lupa pula penulis ucapkan terimakasih kepada Dondy Arafat, S.Pi,
M.Si, Bunga Anggraeny, S.Ik, Yunita Fatmah Sujati, S.Ik, Dino Wicaksono atas
dukungannya selama ini dan kepada Rizal Adi Cahyo yang senantiasa
memberikan kasih sayang, pengertian, semangat dan motivasi kepada penulis.
Penulis memohon maaf apabila terdapat kesalahan penulisan maupun
kekurangan dalam skripsi ini. Oleh karena itu penulis mengharapkan ktitik dan
saran demi kesempurnaan skripsi ini. Penulis berharap semoga skripsi ini dapat
bermanfaat baik bagi penulis sendiri maupun bagi pihak lain yang membacanya.
Bogor, Januari 2013
ii
4.3 Kepadatan Bulu babi ... 35 4.4 Indeks Keanekaragaman, Keseragaman, dan Dominansi Bulu babi 38 4.5 Vegetasi Lamun ... 39 4.6 Pola Sebaran Jenis Bulu babi ... 44 4.7 Hubungan Antara Bulu babi dengan Lamun di Pulau Sapudi ... 46
5. KESIMPULAN DAN SARAN ... 48 5.1 Kesimpulan ... 48 5.2 Saran ... 48
DAFTAR PUSTAKA ... 49
iii
Halaman
1. Prosedur kegiatan penelitian ... 18
2. Alat dan bahan yang digunakan dalam penelitian ... 19
3. Pengukuran parameter fisika – kimiawi perairan ... 22
4. Pengukuran parameter fisika – kimiawi substrat dasar ... 23
5. Kelas penutupan yang digunakan untuk mencatat kelimpahan lamun . 28
6. Karakteristik fisika – kimiawi perairan di lokasi pengamatan
(rata-rata dan simpangan baku) ... 30
7. Karakteristik fisika – kimiawi substrat di lokasi pengamatan ... 33
iv
1. Bentuk umum bulu babi regularia ... 3
2. Anakan muda bulu babi setelah mengalami proses metamorfosis ... 7
3. Struktur internal bulu babi dewasa ... 7
4. Morfologi tumbuhan lamun ... 10
5. Segitiga tekstur sedimen ... 14
6. Peta lokasi penelitian bulu babi di habitat lamun Pulau Sapudi ... 17
7. Contoh skematik penempatan transek pada stasiun pengukuran struktur
dan sebaran komunitas bulu babi pada stasiun 1 ... 20
8. Transek plot pengambilan contoh bulu babi ... 21
9. Transek plot pengambilan contoh lamun ... 22
10. Kepadatan (rata-rata dan simpangan baku) bulu babi pada tiap stasiun
pengamatan ... 36
11. Indeks keanekaragaman, keseragaman, dan dominansi bulu babi ... 38
12. Kerapatan (rata-rata dan simpangan baku) jenis lamun pada tiap stasiun
pengamatan ... 40
13. Persentase penutupan lamun di Pulau Sapudi ... 42
14. Grafik Analisis Faktorial Koresponden antara bulu babi dan lamun
v
Halaman
1. Lokasi pengambilan data... 53
2. Data parameter fisika dan kimiawi perairan di lokasi penelitian ... 54
3. Dokumentasi hasil penelitian jenis-jenis bulu babi di habitat lamun
Pulau Sapudi ... 56
4. Kepadatan bulu babi pada masing-masing transek kuadrat di lokasi
penelitian ... 58
5. Kepadatan (rata-rata dan simpangan baku) bulu babi di Pulau Sapudi 62
6. Hasil perhitungan Indeks Keanekaragaman (H’), Keseragaman (E),
dan Dominansi (C) di lokasi pengamatan ... 63 7. Dokumentasi hasil penelitian jenis-jenis lamun di Pulau Sapudi ... 67
8. Kerapatan (rata-rata dan simpangan baku) lamun di Pulau Sapudi ... 68
9. Persentase penutupan lamun di Pulau Sapudi ... 69
10. Hasil perhitungan Indeks Morisita ... 70
11. Hasil Analisis Faktorial Koresponden (CA) bulu babi terhadap
komunitas lamun ... 71
1. PENDAHULUAN
1.1 Latar Belakang
Fauna Echinodermata di dunia terdapat sebanyak kurang lebih 6000 jenis dan diperkirakan 950 jenis diantaranya adalah bulu babi, yang terbagi atas 15 ordo, 46 famili dan 121 genera (Suwignyo et al. 2005). Di Indonesia, terdapat kurang lebih 84 jenis bulu babi yang berasal dari 31 famili dan 48 genera (Clark dan Rowe, 1971). Pada umumnya setiap jenis bulu babi memiliki sebaran habitat yang spesifik. Bulu babi tersebar mulai dari daerah intertidal yang dangkal hingga ke laut dalam (Jeng, 1998). Bulu babi pada umumnya menghuni ekosistem
terumbu karang dan padang lamun serta menyukai substrat yang agak keras terutama substrat di padang lamun yang merupakan campuran dari pasir dan pecahan karang (Aziz, 1994).
Echinodermatamerupakan salah satu biota yang berasosiasi kuat dengan ekosistem padang lamun dan berperan dalam siklus rantai makanan di ekosistem tersebut. Tingginya tutupan vegetasi lamun di perairan memungkinkan kehadiran berbagai biota yang berasosiasi dengan ekosistem padang lamun termasuk bulu babi untuk mencari makan, tempat hidup, memijah dan tempat berlindung untuk menghindari predator (Supono dan Arbi, 2010).
(Aziz, 1994). Di Indonesia beberapa jenis bulu babi yang dijumpai di padang lamun antara lain adalah Diadema, Tripneustes, Toxopneustes, Echinotrix, Echinometra, Temmopleurus, Mespilia dan Salmacis (Sumitro et al., 1992 dan Aziz, 1994).
Pulau Sapudi terletak di antara gugusan pulau-pulau kecil di sebelah timur Pulau Madura. Secara administratif, pulau ini termasuk wilayah Kabupaten Sumenep, Madura, Jawa Timur. Pulau ini kaya akan biota laut salah satunya dari jenis Echinodermataseperti bulu babi, bintang laut, teripang dan lain-lain. Bulu babi telah dimanfaatkan oleh sebagian penduduk di Pulau Sapudi. Gonad bulu babi Tripneustes gratilla dijadikan makanan ringan oleh sebagian besar penduduk pesisir Pulau Sapudi. Penelitian tentang bulu babi ini belum pernah dilakukan di lokasi tersebut. Sehubungan dengan masih kurangnya informasi mengenai sebaran komunitas bulu babi di Pulau Madura khususnya di Pulau Sapudi, maka penelitian di bidang tersebut perlu dilakukan. Penelitian mengenai struktur dan Sebaran komunitas bulu babi dilakukan di habitat lamun Pulau Sapudi, Kabupaten Sumenep, Madura.
1.2 Tujuan
Tujuan penelitian ini adalah :
1. Mengetahui struktur dan sebaran komunitas bulu babi di habitat lamun Pulau Sapudi, Kabupaten Sumenep, Madura.
2. TINJAUAN PUSTAKA
2.1 Bulu babi
2.1.1 Bentuk dan Morfologi Bulu babi
Bulu babi merupakan fauna dari filum Echinodermata yang paling melimpah dan tersebar di seluruh perairan Indonesia. Menurut Radjab (2001) secara morfologi, bulu babi terbagi menjadi dua kelompok yaitu bulu babi regularia (Gambar 1) atau bulu babi beraturan (regular sea urchin) dan bulu babi iregularia atau bulu babi tidak beraturan (irregular sea urchin).
Gambar 1. Bentuk umum bulu babi regularia (Dobo, 2009).
merupakan salah satu jenis dari bulu babi yang memiliki nilai konsumsi penting di Indonesia (Aziz, 1993).
Suwignyo et al. (2005) menyebutkan bahwa tubuh bulu babi berbentuk bulat atau pipih bundar, tidak bertangan, mempunyai duri-duri panjang yang dapat digerakkan. Semua organnya umumnya terdapat di dalam tempurung, yang terdiri dari 10 keping pelat ganda, biasanya bersambung dengan erat, yaitu pelat
ambulakral selain itu terdapat pelat ambulakral yang berlubang-lubang tempat keluarnya kaki tabung. Pada permukaan tempurung terdapat tonjolan-tonjolan pendek yang membulat, tempat menempelnya duri. Kebanyakan bulu babi mempunyai dua duri, duri panjang atau utama dan duri pendek atau sekunder. Selanjutnya, mulut bulu babi terletak di daerah oral, dilengkapi dengan lima gigi tajam dan kuat untuk mengunyah yang dikenal sebagai aristotle’s lantern. Anus, lubang genital dam madreporit terletak di sisi aboral.
Salah satu diantara keping genital yang berukuran paling besar merupakan tempat bermuaranya sistem pembuluh air (waste vascular system). Sistem ini menjadi ciri khas filum Echinodermata, berfungsi dalam pergerakan, makan, respirasi, dan ekskresi. Pada sistem peristomial terdapat pada selaput kulit tempat menempelnya organ “lentera aristotle”, yakni semacam rahang yang berfungsi sebagai alat pemotong dan penghancur makanan. Organ ini juga mampu memotong cangkang teritip, moluska ataupun jenis bulu babi lainnya (Azis, 1987).
2.1.2 Klasifikasi Bulu babi
Klasifikasi bulu babi menurut Heinke dan Schultz (2006) adalah sebagai berikut :
Filum : Echinodermata Subfilum : Echinozoa Kelas : Echinoidea Ordo : Cidaroida
Famili : Cidaridae, Psychocidaridae, Histocidaridae Ordo : Echinothuroida
Famili : Echinothuridae Ordo : Diadematoida
Famili : Diadematidae, Micropygidae Ordo : Phymosomatoida
Famili : Glyptocidariidae, Stomopneustidae Ordo : Arbacioida
Famili : Arbaciidae Ordo : Temnopleuroida
Famili : Temnopleuridae Ordo : Echinoida
Famili : Echinidae, Parechinidae, Echinometridae, Strongylocentrotidae, Toxopneustidae
Ordo : Clypeasteroida
Ordo : Spatangoida
Famili : Spatangidae, Mycrasteridae, Brissidae, Loveniidae, Schizasteridae, Pericosmidae, Asterostomatidae
Ordo : Holectypoida
Famili : Echinoneidae Ordo : Cassiduloida
Famili : Cassidulidae, Apatopygidae, Echinolampadidae Ordo : Holasteroida
Famili : Stereoneustidae, Urechinidae, Pourtalesiidae
2.2 Reproduksi dan Siklus Hidup Bulu babi
Siklus hidup dari bulu babi diawali dengan terjadinya pembuahan yang terjadi diluar tubuh. Induk jantan membuahi telur-telur dari induk betina. Telur bulu babi dibungkus dengan semacam gelatinous yang biasa disebut dengan jelly coat (Guidice, 1986). Setelah itu terbentuklah embrio, dimana embrio ini akan membelah dengan frekuensi yang sangat tinggi. Setelah mencapai tahap embrio terus masuk fase morula dan embrio muda disebut blastula. Selama 10 jam setelah terbuahi sejak fase blastula, maka embrio tersebut mulai aktif berenang. Setelah itu muncullah anakan bulu babi (Gambar 2), bulu babi sudah dapat dikatakan telah menjadi anakan bila sudah terdapat tentakel-tentakel, duri-duri dan pediselaria (Czihak, 1971).
Gambar 2. Anakan muda bulu babi setelah mengalami proses metamorfosis (Czizak, 1971).
Namun bulu babi dikatakan dewasa betul apabila telah mencapai ukuran cangkang 60 mm. Selain itu bulu babi dewasa memiliki organ lengkap secara morfologi (Gambar 3). Bulu babi dewasa telah memiliki kulit (cangkang) yang keras, jari-jari dan duri-duri (spine) yang sudah dapat berfungsi dengan sempurna, misalnya jari-jari yang sudah dapat memegang pada substrat