MOLEKULER KELAPA KOPYOR
SUKENDAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Supervised by SUDARSONO, WITJAKSONO, and NURUL KHUMAIDA Kopyor coconut is a mutant that cannot be propagated by conventional technique. Morphologically kopyor coconut cannot be differentiated from normal coconut. The aims of these studies were to improve efficiency of coconut zygotic embryo culture and to develop a protocol for clonal propagation through somatic embryogenesis. Moreover, the study was to design a molecular marker to differentiate kopyor coconut from normal one. A series of experiments such as: additions of organic addenda, subculture period, increasing of plantlet rooting by IBA on the zygotic embryo culture technique and embryo splitting technique were carried out to increase the production of plantlets and seedling of kopyor coconut. To develop a protocol of somatic embryogenesis, some experiments were conducted such as: factors that affected callus induction (2,4-D concentration, mode of excision embryo, explant age, and organic addenda), effect of gelled gum concentration, BAP and 2,4-D on the formation of somatic embryos, and effect of ABA on the development of somatic embryos. Designing molecular marker was done to analyze genes related to kopyor trait such as -D galactosidase, sucrose synthase (SUS), abscicic acid insensitive (ABI), and stearoyl acyl carrier protein desaturase (SACPD). Some of those markers were used to analyze the genetic diversity of kopyor fruited and normal coconut. For plantlet production, efficiency of coconut zygotic embryo culture increased to 80% by addition liquid coconut endosperm 150 ml/l in the germination phase, excising the embryo explants into two pieces, subculturing of plantlet every 2-3 months, addition of IBA 1-2 mg/l to induce root of plantlet. For clonal propagation, a protocol of coconut somatic embryogenesis has been established and consisted of callus initiation, callus proliferation, somatic embryo and plantlet formation. Growth regulator 2,4-D at concentration of 50-125 uM induced coconut embryogenic callus. Amino acid was the best organic addendum to increase callus formation, while BAP 10 mg/l+2,4-D 2-5 mg/l was the best concentration on the somatic embryo and plantlet formation. A specific molecular marker for -D galactosidase was designed to analyze kopyor, kopyor fruited and normal coconut. Based on some specific markers of CnSUS1A, CnSUS1B, CnABI3, CnSACPD, and EgFAD3, kopyor fruited coconut from East Java could be separated from Central Java. Some progenies of hybrid kopyor fruited coconuts in the Central Java are suggested to be originated from tall and dwarf kopyor fruited coconut of the Central Java.
Dibimbing oleh SUDARSONO, WITJAKSONO, dan NURUL KHUMAIDA.
Kelapa kopyor bernilai komersial tinggi, tersedia terbatas dengan harga mahal. Endosperma mempunyai nilai gizi yang lebih sehat dari pada endosperma kelapa normal. Keterbatasan dalam penyediaan disebabkan oleh alasan genetik (mutan) yang terjadi pada bagian endosperma, sehingga endosperma tidak fungsional dan embrio tidak dapat berkecambah secara alami.
Satu-satunya cara memperbanyak kelapa kopyor adalah dengan teknik in vitro melalui metode kultur embrio yang telah dikembangkan selama 35 tahun. Walaupun demikian, teknik-teknik yang ada belum mampu menghasilkan bibit secara efisien. Oleh sebab itu perlu modifikasi teknik kultur in vitro untuk meningkatkan efisiensinya. Ada dua pendekatan yang dilakukan, yaitu; (1) memperbaiki kultur embrio sigotik pada tahap perkecambahan, pertumbuhan planlet, dan tahap sebelum aklimatisasi, serta mengembangkan teknik pembelahan eksplan embrio, (2) mengembangkan teknik pembiakan klonal dengan embriogenesis somatik melalui tahap kalus.
Perbaikan kultur embrio sigotik dilakukan dengan menambahkan berbagai macam bahan aditif (air kelapa 150 ml/l, air santan 150 ml/l, thio-urea 50 mg/l, dan thio-urea 100 mg/l) di media Eeuwens pada fase perkecambahan. Pada fase pertumbuhan planlet, menambahkan air kelapa konsentrasi 100, 150, 200 ml/l dan mengatur periode subkultur, yaitu 1, 2, 3, dan 4 bulan. Pada fase sebelum aklimatisasi, memberi perlakuan IBA 1, 2, 3 mg/l ke dalam media kultur untuk meningkatkan perakaran planlet. Teknik pembelahan eksplan embrio dilakukan dengan cara membelah embrio sigotik dan kecambah pada titik tumbuh di daerah meristem apikal menjadi dua belahan. Ke dalam media kultur ditambahkan BAP konsentrasi 2.5-7.5 mg/l untuk menginduksi proliferasi tunas samping.
Pengembangan teknik embriogenesis somatik dilakukan dengan melalui beberapa tahap, yaitu: inisiasi kalus, proliferasi kalus, pembentukan dan pematangan embrio somatik, dan perkembangan/pembentukan planlet. Kalus embriogenik diinduksi dengan 2,4-D pada konsentrasi 50, 75, 100 dan 125 uM dan model pembelahan embrio secara longitudinal & horizontal. Untuk meningkatkan pembentukan kalus ke dalam media ditambahkan bahan aditif seperti asam amino, casein hydrolisate, dan air kelapa. Pada tahap pembentukan embrio somatik, ZPT BAP 10 mg/l yang dikombinasikan dengan 2,4-D 2.5 dan 5.0 mg/l digunakan menginduksi pembentukan embrio somatik, sedangkan untuk perkembangan embrio somatik digunakan perlakuan konsentrasi phytagel dan ZPT ABA 25 dan 50 uM. Analisis morfologi dan histologi juga dilakukan untuk mengamati perkembangan kalus, embrio somatik dan kecambah asal embrio somatik.
Pengamatan yang telah dilakukan menunjukkan 58% belahan embrio dapat tumbuh menjadi planlet, tunas, atau akar saja. Perlakuan BAP 5.0-7.5 mg/l pada eksplan belah kecambah meningkatkan perolehan planlet sampai 100%. Konsentrasi BAP yang paling baik untuk menghasilkan planlet lebih banyak adalah 5 mg/l. ZPT BAP juga berpengaruh pada pertumbuhan tunas planlet meskipun tidak berpengaruh pada pertumbuhan akar.
Protokol teknik embriogenesis somatik telah berhasil dikembangkan untuk pertama kalinya pada kelapa kopyor dalam penelitian ini. Pembentukan kalus embriogenik kelapa kopyor memerlukan zat pengatur tumbuh 2,4- D dengan konsentrasi antara 50-125 uM. Bahan aditif asam amino dapat meningkatkan produksi kalus embriogenik. Struktur embrio somatik mulai terbentuk ketika kultur dipindah dari media yang mengandung 2,4-D tinggi ke media dengan 2.4-D lebih rendah dan dikombinasikan dengan BAP. BAP 10 mg/l+2,4-D 5 mg/l menghasilkan embrio somatik lebih banyak daripada BAP 10 mg/l+2,4-D 2.5 mg/l. Sebaliknya, BAP 10 mg/l+2,4-D 2.5 mg/l lebih baik dalam meningkatkan jumlah planlet. Penambahan ABA dan phytagel tidak banyak berpengaruh pada perkembangan embrio somatik. Analisis morfologi memperlihatkan bahwa embrio somatik kelapa kopyor mirip dengan embrio sigotiknya. Planlet asal embrio sigotik mempunyai batang ramping tegar dengan daun lurus. Planlet asal embrio sigotik mempunyai satu akar primer dan akar-akar lateral yang keluar dari akar primer. Sementara itu, planlet asal embrio somatik mempunyai daun sedikit tidak beraturan dan akar primer lebih dari satu dan tidak bisa dibedakan antara akar primer dan akar lateral. Perkembangan embrio somatik juga menghasilkan bentuk-bentuk yang abnormal seperti bentuk akar tanpa tunas, kecambah dengan banyak tunas, atau kecambah dengan tunas dan akar berasal dari embrio yang berbeda.
Morfologi bibit kelapa kopyor yang dihasilkan dari kultur in vitro, dan bibit kelapa berbuah kopyor yang dihasilkan oleh petani, serta bibit kelapa normal tidak bisa dibedakan. Untuk membedakan ketiga jenis bibit ini sedini mungkin hanya bisa dilakukan dengan penanda (marker) molekuler. Fenomena kopyor pada tanaman kelapa ada kaitannya dengan gen -D Galaktosidase yang ditemukan tidak aktif pada endosperma kelapa kopyor. Untuk itu dalam penelitian ini dikembangkan penanda molekuler gen -D Galaktosidase yang dirancang dari runutan nukleotida DNA kelapa berbuah kopyor.
Komposisi senyawa endosperma buah kelapa kopyor ditemukan berbeda dengan endosperma buah kelapa normal. Endosperma kelapa kopyor mengandung sukrosa dan karbohidrat lebih tinggi daripada kelapa normal. Sebaliknya, kandungan lemak lebih rendah. Asam lemak pada endosperma kelapa kopyor lebih banyak terdiri dari asam oleat (C18:1) dan asam linoleat (C18:2). Berdasarkan perbedaan tersebut dirancang sejumlah primer spesifik untuk gen Sucrose synthase (SUS), Stearoyl acyl carrier protein desaturase (SACPD), dan Absicid acid insensitive (ABI). Enam (6) pasang primer telah berhasil dirancang, yaitu 4 pasang primer spesifik untuk gen SUS (CnSUS1A, CnSUS1B, CnSUS2A, CnSUS2B), sepasang primer gen SACPD (CnSACPD), dan dua pasang gen ABI (CnABI3A dan CnABI3B).
Enam primer spesifik tersebut di atas ditambah dengan primer spesifik gen FAD (EgFAD), gen LTP (EgLTP), gen FATB (EgFATB), dan gen ARF1 (EgARF1) digunakan untuk menganalisis keragaman genetik menggunakan metode SSCP (Single Strand Conformation Polymorphism) pada populasi kelapa berbuah kopyor di P. Jawa. Hasil analisis menunjukkan bahwa populasi kelapa berbuah kopyor asal Jawa Timur membentuk subgroup tersendiri yang terpisah dari subgroup populasi asal Jawa Tengah. Meskipun demikian belum bisa dibedakan antara populasi kelapa berbuah kopyor dengan populasi kelapa normal. Kelapa berbuah kopyor jenis dalam, genjah dan hibrida juga belum bisa dipisahkan secara tegas dengan primer-primer tersebut.
SUKENDAH
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Agronomi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NIM : A. 361050161
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Sudarsono, M.Sc. Ketua
Dr. Ir. Witjaksono, M.Sc. Dr. Ir. Nurul Khumaida, M.S. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Agronomi
Dr. Ir. Munif Ghulamahdi, M.S. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
Penguji pada Ujian Tertutup: Dr. Ir. Agus Purwito, M.S.
Dr. Ir. Darda Effendi, M.Si.
Penguji pada Ujian Terbuka: Prof. Dr. Ir. Sudirman Yahya, M.Sc.
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi yang berjudul: Pembiakan In Vitro dan Analisis Molekuler Kelapa Kopyor adalah karya sendiri dan belum pernah penulis ajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutip dari karya yang diterbitkan maupun tidak diterbitkan oleh penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, 18 Agustus 2009
© Hak cipta milik IPB, tahun 2009
Hak cipta dilindungi
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tujuan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
Puji syukur penulis panjatkan kehadirat Allah SWT yang dengan segala rahmatNya penulis dapat menyelesaikan penelitian dengan judul: PEMBIAKAN IN VITRO DAN ANALISIS MOLEKULER KELAPA KOPYOR. Penelitian ini memuat beberapa topik seperti: (1) Perbaikan Teknik Kultur Embrio Sigotik Kelapa Kopyor, (2) Regenerasi Kelapa Kopyor dengan Metode Pembelahan Eksplan Embrio Sigotik, (3) Regenerasi Kelapa Kopyor Melalui Embriogenesis Somatik, (4) Pengembangan Penanda Molekuler Gen -D Galaktosidase, (5) Isolasi dan Analisis Fragmen DNA Gen-Gen yang Diduga Berhubungan dengan Sifat Kopyor, (6) Keragaman Genetik Kelapa Berbuah Kopyor di P. Jawa. Sebagian penelitian ini dibiayai oleh UPN ”Veteran” Jatim dan Direktorat Jenderal Pendidikan Tinggi Departemen Pendidikan Nasional melalui proyek Hibah Bersaing, Program Sandwich, dan Program Hibah Doktor.
Sebagian disertasi telah dipublikasikan ke jurnal Bulletin Agronomi (36)(1):16-23 (2008) dengan judul: Perbaikan Teknik Kultur Embrio Kelapa Kopyor (Cocos nucifera L.) Asal Sumenep Jawa Timur Melalui Penambahan Bahan Aditif dan Pengujian Periode Subkultur. Sebagian disertasi juga telah didaftarkan untuk memperoleh hak paten pada Direktorat Jenderal Hak Kekayaan Intelektual, Departemen Hukum dan Hak Asasi Manusia R.I. dengan judul invensi (1): Metode Pembiakan Klonal Kelapa Kopyor Melalui Embriogenesis Somatik dengan No. Registrasi: P00200800263 (15 Mei 2008), dan (2): Deteksi Dini Kelapa Kopyor Menggunakan Penanda Molekuler Spesifik Gen -D Galaktosidase dengan No. Registrasi: P00200900431 (12 Agustus 2009).
Pada kesempatan ini penulis menyampaikan rasa terima kasih dan penghargaan pada berbagai pihak yang telah membantu dengan caranya masing-masing dalam studi, penelitian maupun penyempurnaan tulisan disertasi:
(1) Kepada keluarga: suami dan anak-anak yang saya cintai, rasa hormat dan terima kasih yang tidak pernah habis kepada keluarga besar W. Sanoesi (mas Mustadi dan mbak Erna, mas Ayup Soepeno (almarhum) dan mbak Emmy, adik Pri dan Wahyu, mas Yanto sekeluarga) dan keluarga besar Stephan (mas Wayan dan mbak Poppy, mas George Eddy sekeluarga, mas Theodore sekeluarga, dik Iswanyudi dan Lely, dik Didik dan Tetty).
(2) Kepada komisi pembimbing, Prof. Dr. Ir. Sudarsono, MSc. yang telah banyak memberikan pengetahuan dalam bidang molekuler, ketajaman dalam menganalisis, mengelola penelitian dengan baik, dan saran-saran dalam tulisan disertasi. Dr. Ir. Witjaksono, MSc. yang ahli di bidang kultur jaringan telah banyak memberikan arahan dan ketajaman dalam detail-detail penelitian in vitro, serta saran-saran dalam tulisan disertasi. Dr. Ir. Nurul Khumaida, MS. yang selalu memotivasi dan memberi masukan pada tulisan disertasi. (3) Kepada Rektor, Ketua LPPM, dan Dekan Fak. Pertanian UPN ”Veteran”
Jatim yang selalu membantu dalam kelancaran studi dan penelitian sampai terbentuknya kerja sama antara UPN ”Veteran” Jatim dengan IPB dalam bentuk MOU untuk pengelolaan penelitian kelapa kopyor.
Aktratanakul Direktur CAB, Kasetsart University, Thailand yang telah memberikan kesempatan untuk penelitian dan menggunakan segala fasilitas laboratorium di CAB. Teman-teman di CAB: Poom Preedakoon, Songkran Thongthawee, Meow, Uug, dan Eik yang selalu siap membantu dalam penelitian dan yang telah memperkenalkan kebudayaan dan kehidupan orang Thailand.
(6) Kepada Direktur Kantor HKI-IPB dan staf: bu Ade, pak Romli, mas Andre dan mas Hendri yang telah membantu dalam proses dan pendaftaran paten kelapa kopyor ke Direktorat Jenderal Hak Kekayaan Intelektual, Departemen Hukum dan Hak Asasi Manusia R.I.
(7) Kepada sahabat dan teman Lab. Biologi Molekuler: Nenny, Bu Renny, Bu Surti, Bu Loly, Pak Syamsudin, Pak Darmawan, Pak Zhulhermana, Susilowati, mbak Narti, dan mas Agus. Terima kasih atas kebersamaan, kerja sama dan semangat yang diberikan selama penelitian.
(8) Kepada sahabat-sahabat kost: Lisnawita kebersamaan kita selama masa-masa sulit selalu memberiku semangat untuk menyelesaikan studi ini, Niken, Ria, Nenni, Annisa, Bu Hesti yang selalu memberi motivasi meskipun sudah berada di institusi masing-masing.
(9) Kepada sahabat-sahabat kuliah: Sigit, Awang, Nanas, Rai, Edi, Joko, bersama kalian kuliah di IPB terasa sangat menyenangkan seberat apapun tugas dan materi yang diberikan oleh dosen.
(10)Kepada sahabat-sahabat kantor: Jonny, Ziah, Ida, Hadi, Guntoro, Bu Widi, Bu Pongky, Bu Guniarti dan Pak Agus yang selalu menyampaikan berita-berita penting dari UPN dan membantu dalam penyiapan bahan tanam dari Jawa Timur.
(11)Kepada Bapak Ir. Hartoyo yang membantu menelusuri kelapa kopyor di Jember dan dalam pengambilan sampel, serta perhatian yang besar atas pengembangan bibit kelapa kopyor di Jawa Timur.
(12)Akhirnya kepada sahabat, teman dan pihak-pihak yang tidak bisa penulis sebutkan satu per satu, terima kasih atas bantuan yang diberikan selama penulis studi S3 dan penulis berharap semoga tulisan ini bermanfaat bagi pihak yang berkepentingan.
Bogor, 18 Agustus 2009
Penulis dilahirkan di Surabaya pada 31 Oktober 1963. Penulis putri keempat dari pasangan Bapak W. SANOESI dan Ibu NASIKAH. Penulis mempunyai satu saudara laki-laki (Nadiyanto) dan tiga saudara perempuan (Emmy, Herna, dan Wahyuningsih). Penulis menikah dengan Willy Richard Stephan pada tahun 1991 sampai sekarang dan dikaruniai satu anak laki-laki, Atthur K. Willyanda dan satu anak perempuan, Arrum Y. Willyanda.
Penulis menyelesaikan 6 tahun sekolah dasar di SDN Margorejo II di Surabaya dan melanjutkan ke sekolah menengah pertama di SMPN VI pada kota yang sama. Pada tahun 1983 lulus dari sekolah menengah atas di SMAN V Surabaya dan melalui Proyek Perintis II diterima di Institut Pertanian Bogor dan lulus pada tahun 1987. Setelah lulus sarjana, penulis bergabung dengan Universitas Pembangunan Nasional ”Veteran” Jawa Timur pada tahun 1988. Pada tahun 1999 penulis menerima beasiswa dari IPGRI (International Plant Genetic Resources Institute) di bawah pengelolaan SEARCA untuk studi program master di bidang Plant Genetic Resources and Management di Departemen Hortikultura UPLB (University of the Philippines Los Banos) Filipina. Penulis mengambil topik: Coconut In Vitro Conservation sebagai master thesis dibawah bimbingan Dr. Maria Lourdes O. Cedo. Sambil menyelesaikan studi masternya, penulis diberi kesempatan menjadi presiden pertama PSSN (the Philippine Society for the Study of Nature) Inc. Los Baños Chapter periode 2000-2001 dan menjadi anggota sampai sekarang. Organisasi ini banyak memberikan pelajaran, inspirasi dan tantangan dalam membangun hubungan sosial antar warganegara dari berbagai bangsa dan dari berbagai disiplin ilmu. Tahun 2001 penulis diundang untuk bergabung dengan the Gamma Sigma Delta Honor Society of Agriculture (GSD-HAS) Philippine.
xii
Halaman
DAFTAR TABEL………. xv
DAFTAR GAMBAR....……… DAFTAR LAMPIRAN………. xviii xxii I. PENDAHULUAN Latar Belakang……….. 1
Tujuan Penelitian……… 5
Manfaat Penelitian………. 5
II TINJAUAN PUSTAKA Kelapa Kopyor……… 7
Kultur Embrio Sigotik Kelapa……… 9
Kultur Embrio Somatik... 12
Perkembangan Kultur Embrio Somatik pada Tanaman Kelapa... 14
Penanda Molekular... 20
Penggunaan Penanda Molekuler pada Tanaman Kelapa………… 21
Gen-gen Penting pada Endosperma dan Perkecambahan Kelapa.. 22
III. PERBAIKAN TEKNIK KULTUR EMBRIO SIGOTIK KELAPA KOPYOR Abstrak... 24
Abstract... 25
Pendahuluan... 26
Tujuan Penelitian... 28
Metode penelitian... 28
Hasil Penelitian ... 32
Pembahasan... 41
Kesimpulan... 43
IV. REGENERASI KELAPA KOPYOR DENGAN METODE PEMBELAHAN EKSPLAN EMBRIO SIGOTIK PADA DAERAH MERISTEM APIKAL Abstrak... 45
Abstract... 46
Pendahuluan... 47
Tujuan Penelitian... 48
Metode penelitian... 48
Hasil Penelitian ... 50
Pembahasan... 55
xiii
VI. PENGEMBANGAN PENANDA MOLEKULER SPESIFIK UNTUK GEN -D GALAKTOSIDASE KELAPA KOPYOR Abstrak... 81
xiv
DAFTAR PUSTAKA……… 155
xv
Halaman
2.1 Kandungan komposisi senyawa kimia air kelapa dan endosperma kelapa kopyor dengan kelapa normal yang
dihitung berdasarkan persentase bahan kering………... 9
2.2 Protokol komposisi media kultur embrio kelapa yang
dikembangkan oleh berbagai negara... 11
2.3 Mikropropagasi secara klonal pada tanaman kelapa melalui
proses embriogenesis somatik………... 15
3.1 Persentase daya kecambah dan waktu yang dibutuhkan embrio
kelapa kopyor untuk berkecambah... 34
3.2 Persentase embrio kelapa kopyor yang mengalami browning, stagnasi, dan embrio tidak viabel pada fase perkecambahan di
berbagai media tanpa bahan aditif dan dengan bahan aditif …. 34
3.3 Pertumbuhan planlet kelapa kopyor setelah umur 5 bulan pada berbagai periode subkultur dan pada media Eeuwens yang
mengandung berbagai konsentrasi air kelapa... 35
3.4 Persentase planlet kelapa kopyor yang diperoleh pada berbagai periode subkultur dan pada media Eeuwens yang mengandung berbagai konsentrasi air kelapa setelah 8 bulan
dalam proses pengkulturan... 36
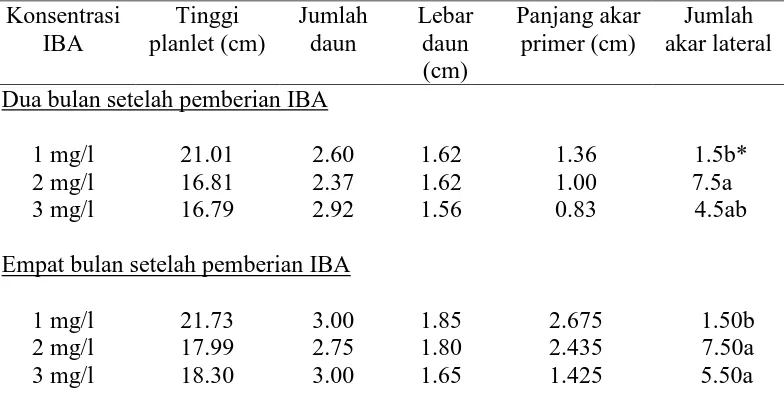
3.5 Persentase planlet kelapa kopyor yang berhasil diinduksi akarnya pada media padat Eeuwens dengan penambahan ZPT
IBA... 38
3.6 Pertumbuhan tunas dan akar planlet kelapa kopyor asal kultur embrio sigotik pada media Eeuwens dengan penambahan
berbagai konsentrasi IBA setelah 2 dan 4 bulan perlakuan... 38
4.1 Persentase eksplan belahan embrio yang tumbuh menjadi tunas dan akar (planlet lengkap) atau tunas atau akar saja pada
berbagai konsentrasi BAP... 51
4.2 Pertumbuhan tunas dan akar planlet kelapa kopyor dari eksplan belah embrio pada media Eeuwens yang mengandung
xvi
BAP... 54
4.4 Pertumbuhan tunas dan akar planlet kelapa kopyor dari eksplan belahan kecambah pada media Eeuwens yang
mengandung berbagai konsentrasi BAP... 54
5.1 Pengaruh model pembelahan longitudinal pada induksi dan pertumbuhan kalus kelapa kopyor di media Eeuwens dengan
penambahan berbagai konsentrasi 2,4-D... 67
5.2 Pengaruh model pembelahan embrio secara horizontal pada pembentukan kalus dan embrio somatik kelapa kopyor di
media Eeuwens padat dengan berbagai konsentrasi 2,4-D…… 69
5.3 Persentase pembentukan kalus, diameter dan berat kalus kelapa kopyor pada eksplan embrio muda (10 bulan) dan tua
(12 bulan) dengan penambahan berbagai konsentrasi 2,4-D…. 70
5.4 Pengaruh penambahan bahan aditif pada induksi dan
pertumbuhan kalus kelapa kopyor di media Eeuwens padat... 71
5.5 Persentase embrio somatik kelapa kopyor yang berkembang menjadi planlet, tunas, atau akar pada media yang
mengandung 2,4-D dan BAP………. 72
5.6 Persentase embrio somatik kelapa kopyor yang berkembang menjadi planlet, tunas, atau akar pada media dengan berbagai
konsentrasi phytagel………. 73
5.7 Persentase embrio somatik kelapa kopyor yang berkembang menjadi planlet, tunas, atau akar pada media dengan berbagai
konsentrasi ABA ... 74
6.1 Hasil rancangan pasangan primer degenerate yang dikembangkan berdasarkan runutan DNA gen -D
Galaktosidase normal yang ada di DNA data base ... 89
6.2 Hasil amplifikasi PCR dengan cetakan DNA kelapa berbuah kopyor dan primer degenerate yang dirancang berdasarkan
gen -D Galaktosidase normal yang ada di DNA data base... 91
7.1 Pasangan primer dan suhu penempelan yang digunakan untuk amplifikasi PCR gen SUS, SACPD, dan ABI dengan cetakan DNA kelapa berbuah kopyor jenis dalam dan perkiraan
xvii
amplifikasi pasangan primer SUS1, SUS2, SACPD, dan
ABI3... 114
8.1 Deskripsi sampel tanaman yang digunakan untuk analisis keragaman genetik populasi pohon kelapa berbuah kopyor di
Jawa Tengah dan Jawa Timur……… 130
8.2 Pasangan primer spesifik dan suhu penempelan yang digunakan untuk amplifikasi PCR berbagai gen yang berhubungan dengan sifat kopyor pada genom populasi kelapa berbuah kopyor di Jawa Tengah dan Jawa Timur serta panjang
fragmen yang dihasilkan……… 133
8.3 Pola pita SSCP alel polimorfik dan keragaman gen antara populasi kelapa berbuah kopyor dengan kelapa berbuah normal untuk masing-masing lokus gen SUS, SACPD, ABI3,
dan FAD……….. 137
8.4 Kemungkinan asal tetua kelapa berbuah kopyor hibrida di
xviii
Halaman
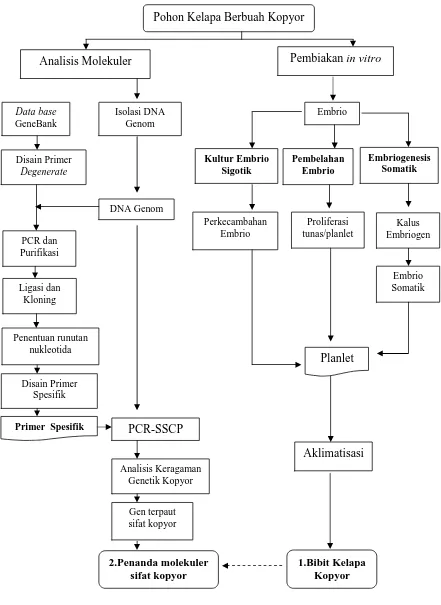
1.1 Bagan alur kerangka penelitian teknik pembiakan in vitro
dan analisis molekuler pada tanaman kelapa kopyor... 6
2.1 Fenotipe endosperma buah kelapa normal dan kelapa
kopyor... 7
3.1 Endosperma kelapa kopyor yang berisi embrio setelah diambil dari buah kelapa kopyor (a) dan embrio kelapa kopyor yang telah dikeluarkan dari endosperma dan dimasukkan dalam
erlenmeyer untuk proses sterilisasi (b)……….. 29
3.2 Berbagai respon embrio kelapa kopyor pada media
perkecambahan………... 33
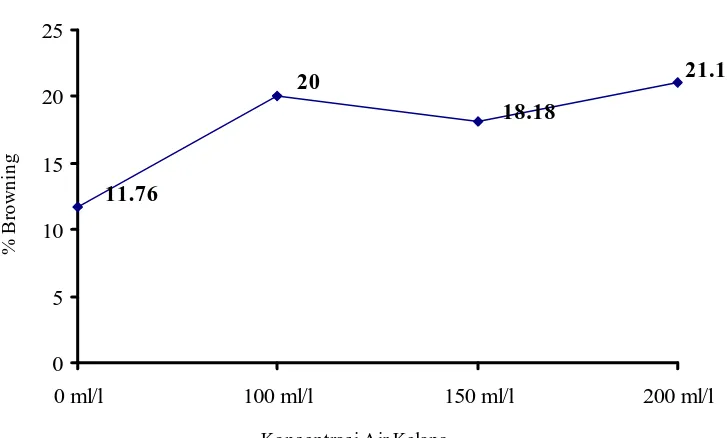
3.3 Persentase planlet kelapa kopyor yang mengalami browning pada fase pertumbuhan di berbagai media tanpa air kelapa dan dengan air kelapa konsentrasi 100 ml/l, 150 ml/l, dan 200
ml/l………. 37
3.4 Proses pertumbuhan planlet kelapa kopyor asal kultur embrio
sebelum dan sesudah aklimatisasi... 40
4.1 Proses regenerasi kelapa kopyor dari embrio sigotik yang dibelah sampai menjadi planlet sempurna pada media yang
mengandung BAP………. 52
4.2 Respon eksplan belahan kecambah kelapa kopyor yang
ditanam pada media Eeuwens dengan penambahan BAP……. 54
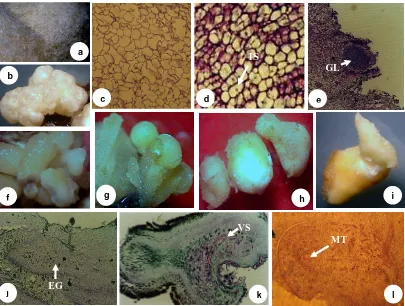
5.1 Berbagai struktur kalus dan embrio somatik kelapa kopyor...
65
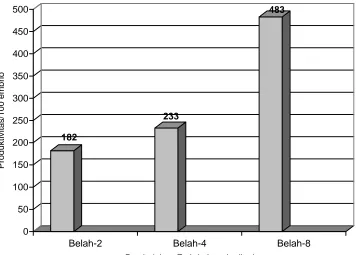
5.2 Produktivitas per 100 embrio yang dibelah secara longitudinal menjadi 2, 4, dan 8 dalam pembentukan kalus embriogenik
kelapa kopyor... 67
5.3 Morfologi eksplan embrio sigotik yang diiduksi menjadi kalus dan planlet kelapa kopyor pada setiap tahap embriogenesis
somatik... 75
5.4 Morfologi kalus non-embriogenik (a) dan bentuk abnormalitas
xix
6.1 Diagram struktur parsial gen -D Galaktosidase normal dari tanaman Vitis vinifera (No.AM423271) dan posisi primer
degenerate yang dirancang... 89
6.2 Representasi hasil amplifikasi PCR dengan menggunakan DNA genom tiga jenis kelapa berbuah kopyor dengan pasangan primer degenerate GAL22 -F2 dan GAL22-R2 atau
pasangan primer GAL11-F1 dan GAL33-R3... 91
6.3 Identifikasi plasmid rekombinan yang membawa potongan DNA hasil PCR dengan cetakan DNA kelapa berbuah kopyor dan pasangan primer degenerate GAL22-F2 dan GAL22-R2 (a), GAL11-F1 dan GAL33-R3 (b), dan GAL22-F2 dan
GAL33-R3 (c)... 93
6.4 Potongan DNA 6 plasmid rekombinan kelapa berbuah kopyor di dalam diagram struktur parsial gen -D Galaktosidase dari tanaman Vitis vinifera (No.AM423271) dan posisi primer
degenerate yang dirancang... 95
6.5 Analisis 6 runutan nukleotida dari potongan gen -D Galaktosidase kelapa berbuah kopyor di program GeneDoc versi 2.6.002. Pensejajaran dimulai dari sekuen potongan gen -D Galaktosidase yang diamplifikasi primer forward2 GAL
22 dan reverse3 GAL33... 96
6.6 Pensejajaran runutan -D Galaktosidase pada ekson 10 dan ekson 12 antar plasmid rekombinan kelapa berbuah kopyor untuk analisis primer spesifik (forward dan reverse)
berdasarkan ClustalW dan program GeneDoc... 98
7.1 Hasil amplifikasi PCR genom kelapa berbuah kopyor dalam dari Kecamatan Tayu dan Margoyoso dengan 3 macam pasangan primer yang digunakan dalam penelitian
ini... 112
7.2 Posisi masing-masing pasangan primer (F & R) dan fragmen DNA kelapa berbuah kopyor di dalam diagram struktur parsial gen Sucrose synthase (SUS), Stearoyl Acyl Carrier Protein Desaturase (SACPD), dan Absicic Acid Insensitive
xx
Oncidium AF530567, Tulipa gesneriana X96938, Triticum aestivum AJ000153, Sacharrum officinarum AF263384, Oryza sativa Z15028, Hordeum vulgare X69931, Zea mays
L22296, dan Bambusa oldhamii AF412037………. 117
7.4 Pensejajaran runutan asam amino yang diturunkan dari fragmen DNA gen SACPD dan ABI kelapa berbuah kopyor hasil amplifikasi pasangan primer SACPD dan ABI3 dengan tanaman monokotil dan dikotil lainnya dan variasi asam
amino yang ditimbulkan antar runutan nukleotida... 118 7.5 Dendrogram runutan asam amino Sucrose synthase (SUS)
kelapa berbuah kopyor CnSus1A+B dan CnSus2A+B dengan spesies Tulipa gesneriana X96938, Triticum aestivum AJ000153, Saccharum officinarum AF263384, Oryza sativa Z15028, Hordeum vulgare X69931, Zea mays L22296, Bambusa oldhamii AF412037, Oncidium AF530567, Vigna radiata D10266, Glycine max AF030231, Hordeum vulgare X69931, Citrus lanatus AB018561, Vicus faba M97551, Pisum sativum AJ012080, Medicago truncale AJ131943, Gossypium hirsutum U73587, Citrus unshiu, Lycopersicon esculentum L19762, dan Daucus carota X75332, yang
runutan asam aminonya tersedia di data base... 119 7.6 Dendrogram asam amino gen SACPD dan ABI dengan
tanaman monokotil dan dikotil yang runutan asam aminonya tersedia di data base………...
120 8.1 Representasi hasil amplifikasi PCR yang menggunakan DNA
genom kelapa berbuah kopyor jenis kelapa dalam dengan primer spesifik yang digunakan dalam penelitian ini dan
ukuran fragmen DNA yang dievaluasi pada agarose gel 1%... 135 8.2 Keragaman pola pita SSCP (Single Strand Conformation
Polimorphism) pada sebagian aksesi kelapa berbuah kopyor di
gel poliakrilamid 11.5 %... 135 8.3 Fenogram populasi kelapa berbuah kopyor (dalam, genjah,
dan hibrida) dan normal (dalam dan genjah) asal Dukuh Seti, Tayu, Margoyoso, dan Jember berdasarkan Jaccard’s similarity coefficients menggunakan SIMQUAL (Similarity
for Qualitative Data) melalui NJ-WNJ-Hierarchical………… 138
8.4 Fenogram populasi kelapa berbuah kopyor (dalam, genjah, dan hibrida) asal Dukuh Seti, Margoyosos, Tayu (Jawa Tengah), dan Jember (Jawa Timur) yang dikontruksi berdasarkan Jaccard’s similarity coefficients menggunakan SIMQUAL (Similarity for Qualitative Data) melalui
xxi
(Similarity for Qualitative Data) melalui
NJ-WNJ-Hierarchical……… 141
9.1 Diagram skema pembiakan kelapa kopyor melalui kultur in vitro yang dikembangkan dari eksplan embrio sigotik buah
xxii
Halaman
1 Komposisi media Eeuwens yang digunakan sebagai media dasar
pada pembiakan in vitro kelapa kopyor………... 168
2 Nama dan kode asam amino serta urutan kodon yang digunakan untuk menterjemahkan runutan nukleotida DNA kelapa berbuah
kopyor……….. 169
3 Kode untuk nukleotida degenerate yang digunakan untuk merancang primer degenerate pada gen-gen yang berkaitan
dengan sifat kopyor pada tanaman kelapa………... 170
4 Registrasi dan No. Pendaftaran Hak Paten Kelapa Kopyor dengan Invensi: Metode Pembiakan Klonal Kelapa Kopyor Melalui
Embriogenesis Somatik... 171
5 Registrasi dan No. Pendaftaran Hak Paten Kelapa Kopyor dengan Invensi: Deteksi Dini Kelapa Kopyor Menggunakan Penanda
xxiii
alel : salah satu bentuk alternatif dari gen yang dapat muncul sebagai lokus tunggal
akar dari embrio : akar yang berkembang dari embrio somatik atau embrio somatik yang tumbuh menjadi akar
data biner : data pola pita yang distandarisasi menjadi suatu nilai yaitu satu (1) bila ada pita atu nol (0) bila tidak ada pita sehingga data bisa dianalis secara statistik
BLAST : program yang terkenal untuk membandingkan sebuah runutan nukleotida DNA (sequence) dengan semua runutan nukleotida DNA yang ada di data base
ClustalW : program yang terkenal untuk mensejajarkan banyak runutan nukleotida DNA (sequence alignments)
dendrogram : nama lain dari pohon filogenetik yaitu pohon yang menggambarkan sejarah kekerabatan dari sekelompok runutan nukleotida DNA yang mempunyai nenek moyang yang sama
endosperma : jaringan nutrisi pada biji (albumen)
ekson : coding region, bagian gen yang ditranslasikan atau yang mengkode protein (dibaca dan ditranslasi menjadi protein)
eksplan : jaringan yang diambil dari tempat asalnya dan ditransfer ke media buatan untuk pertumbuhan atau pemeliharaan
embrio sigotik : embrio hasil fertilisasi antara gamet jantan dengan betina
embrio somatik : embrio yang berkembang dari sel somatik atau bukan berasal dari hasil fertilisasi
embriogenesis : proses pembentukan embrio dari sigot
filogenetik : rekonstruksi dari sejarah evolusi dari kerabat gen berdasarkan perbandingan gen
gap : representasi dari insersi atau delesi di dalam pensejajaran runutan nukleotida DNA
xxiv
makanan (sebutan di beberapa daerah: kentos, abung)
homolog : dua gen homolog jika mereka berbagi nenek moyang yang sama
intron : bagian dari open reading frame (ORF) sebuah gen yang tidak ditranslasikan
kalus
embriogenik
: kalus yang mempunyai kemampuan untuk membentuk embrio
kecambah normal : kecambah yang mempunyai bagian tunas dan akar
kecambah abnormal
: bentuk-bentuk penyimpangan dari embrio menjadi tanaman (kecambah dengan tunas majemuk, kecambah dengan tunas dan akar dari embrio yang berbeda)
kelapa berbuah kopyor
: pohon kelapa yang menghasilkan buah kelapa kopyor dan normal dalam satu tandanya
kelapa kopyor : pohon kelapa yang menghasilkan buah kelapa kopyor 100% (total semua buah yang dihasilkan adalah kopyor)
kelapa berbuah normal
: pohon kelapa yang menghasilkan buah kelapa normal 100%
konversi tanaman : perkembangan embrio somatik ke bentuk planlet (tunas dan akar) atau tunas saja
penanda molekuler
: lokasi fisik pada kromosom yang teridentifikasi dan pewarisannya dapat dimonitor
perkecambahan : munculnya tunas dan akar dari benih/biji setelah melewati masa dormansi
planlet : tanaman yang dipelihara dalam botol kultur atau secara in vitro
planlet tunas : planlet yang hanya dilengkapi dengan tunas daun tanpa adanya akar (akar dapat diinduksi kemudian)
planlet lengkap : planlet yang mempunyai daun dan akar
xxv
polimorfik : bentuk lain atau bentuk yang berbeda dari gen dan runutan nukleotida lainnya
primer degenerate
: sebuah primer yang di sejumlah posisi nukelotidanya mempunyai kemungkinan basa nitrogen lebih dari satu
runutan nukleotida
xxvi
ABI : Abscisic Acid Insensitive ANOVA : Analisis Varian
ARF1 : Auxin Response Factor1
BAP : 6-Benzyl amino purine
BLAST : Basic Local Alignment Search Tool
bp : base pair
CAB : Central for Agricultural Biotechnology
cds : coding segment
EBI : European Bioinformatics Institute dNTP : 2’-deoxy any base 5’-triphosphate
DNA : Deoxyribonucleic acid
DN : Dalam Normal
DK : Dalam Kopyor
2,4-D : 2,4-dichiorophenoxyacetic acid DMRT : Duncan Multiple Range Test FAD : ER-linoleate desaturase FATB : Palmitoyl-ACP thioesterase
GK : Genjah Kopyor
IBA : Indolyl-3-butyric acid LTP : Lipid transfer protein
NCBI : National Center for Biotechnology Information NJ-WNJ : Neighbor Joining-Weighted Neighbor Joining
NTSYS : Numerical Taxonomy and Multivariate Analysis System PCA : Philippine Coconut Authority
SACPD : Stearoyl acyl carrier protein desaturase SIMQUAL : Similarity for Qualitative Data
SSCP : Single Strand Conformation Polymorphism
PENDAHULUAN
Latar Belakang
Kelapa kopyor adalah kelapa mutan yang mempunyai endosperma bergumpal-gumpal yang lepas dari tempurungnya. Endosperma yang tidak normal tersebut justru sangat disukai oleh konsumen. Di lain pihak buah kelapa kopyor tidak selalu tersedia di pasar. Akibatnya, buah kelapa kopyor dijual dengan harga yang lebih mahal dibandingkan dengan buah kelapa biasa. Buah kelapa kopyor menjadi salah satu komoditi pertanian dengan nilai komersial tinggi.
Abnormalitas endosperma buah kelapa kopyor menyebabkan embrio dalam buah kelapa kopyor gagal berkecambah. Endospermanya tidak dapat dimanfaatkan oleh embrio sebagai sumber energi dalam proses perkecambahan. Buah kelapa kopyor sebagai biji jika ditanam akan segera membusuk sehingga embrio tidak dapat tumbuh. Selama ini buah kelapa kopyor diperoleh dari pohon kelapa normal yang menghasilkan buah kelapa normal dan buah kelapa kopyor dalam satu tandannya. Pohon kelapa berbuah kopyor ini menghasilkan buah kopyor hanya 1-2 (1-2%) buah per pohon. Pohon kelapa jenis ini ditumbuhkan dari benih kelapa yang fenotipenya normal, tetapi membawa gen untuk sifat kopyor pada salah satu alel dalam lokus yang mengatur sifat kopyor. Di samping itu, meskipun pohon kelapa tersebar luas di seluruh Indonesia namun pohon kelapa berbuah kopyor hanya bisa ditemukan pada daerah-daerah tertentu seperti di daerah Pati, Sumenep, Jember dan Banyuwangi. Tegakan pohon kelapa berbuah kopyor masih terbatas jumlahnya dan ada di kebun-kebun rakyat yang berskala kecil. Kedua hal tersebut secara simultan menyebabkan buah kelapa kopyor tersedia dalam jumlah terbatas dan mahal.
menjadi tergantikan dengan tegakan kelapa biasa pada proses peremajaan perkebunan kelapa rakyat (proses replanting). Tegakan kelapa berbuah kopyor yang saat ini dikonservasi secara in situ oleh sejumlah petani di berbagai sentra produksi kelapa telah berumur ratusan tahun karena biasanya sebagai tanaman warisan yang diturunkan dari satu generasi ke generasi berikutnya.
Oleh sebab itu perlu dilakukan upaya mengembangkan budidaya pohon kelapa yang dapat menghasilkan buah kopyor dalam persentase tinggi untuk meningkatkan kuantitas dan kualitasnya sehingga layak menjadi komoditi ekspor sekaligus menjadi buah unggulan lokal. Hal ini terbukti sangat sulit dilakukan dengan menggunakan pendekatan konvensional.
Seiring dengan perkembangan ilmu bioteknologi, embrio sigotik kelapa kopyor dapat dikecambahkan dengan menanamnya dalam media agar secara aseptik yang disebut dengan teknik kultur embrio (embryo rescue). Melalui teknik ini diperoleh bibit kelapa kopyor yang pada saat berproduksi dapat menghasilkan buah kelapa kopyor 100% per pohon. Penggunaan teknologi kultur embrio untuk memperbanyak bibit kelapa kopyor telah dirintis oleh de Guzman pada tahun 1971 (de Guzman 1971; Del Rosario & de Guzman 1976) dan bahkan telah dikomersialkan (Tahardi 1997; Del Rosario 1997). Meskipun demikian efisiensi teknik kultur embrio sigotik dalam menghasilkan planlet dan bibit kelapa kopyor masih rendah, yaitu kurang dari 30% (Mashud 1999).
Sedikitnya persentase bibit kelapa kopyor yang diperoleh bersumber dari dua hal, yaitu pertama kehilangan materi tanaman selama proses pengkulturan baik pada fase perkecambahan maupun fase pendewasaan planlet yang disebabkan oleh embrio tidak viabel, kontaminasi, browning, dan stagnasi. Ke dua, kehilangan materi tanaman pada saat periode aklimatisasi planlet dari kondisi in vitro ke kondisi in vivo (Engelmann 1998). Perbaikan-perbaikan proses kultur embrio untuk kelapa kopyor masih perlu dilakukan untuk meningkatkan perkecambahan embrio dan mempertahankan planlet yang dihasilkan.
aklimatisasi, misalnya: kondisi planlet sebelum aklimatisasi, media aklimatisasi dan lingkungan aklimatisasi (suhu, kelembaban dan cahaya). Oleh sebab itu masih perlu dikaji faktor-faktor yang mempengaruhi keberhasilan aklimatisasi baik faktor-faktor sebelum dan pada saat proses aklimatisasi. Dalam penelitian ini dilakukan perbaikan perakaran planlet sebelum diaklimatisasi untuk meningkatkan daya tahan planlet pada kondisi luar.
Pembiakan kelapa kopyor dengan metode kultur embrio sigotik hanya menghasilkan sedikit bibit karena satu embrio maksimal hanya menghasilkan satu tanaman. Perolehan bibit kelapa kopyor asal kultur embrio sigotik yang tidak banyak mengakibatkan harga bibit kelapa kopyor sangat mahal yang sulit terjangkau oleh keuangan petani. Oleh sebab itu dibutuhkan alternatif metode kultur jaringan selain kultur embrio untuk meningkatkan jumlah planlet dan bibit kelapa kopyor. Metode yang dapat digunakan untuk mencapai tujuan tersebut adalah teknologi pembelahan meristem apikal dan embriogenesis somatik.
Metode embriogenesis somatik banyak digunakan untuk menghasilkan bibit tanaman secara masal dan dapat digunakan untuk kepentingan manipulasi genetik pada program pemuliaan tanaman. Pada kelapa kopyor sejauh ini belum banyak publikasi yang melaporkan keberhasilan perakitan bibit kelapa kopyor melalui proses embriogenesis somatik. Walaupun demikian teknologi embrio somatik telah digunakan secara intensif oleh beberapa peneliti untuk tanaman kelapa normal yang tidak berbuah kopyor (Blake 1990; Verdeil et al. 1992; Hornung 1995; Chan et al. 1998; Samosir et al. 1998; Hocher et al. 1998). Sementara itu perbanyakan kelapa kopyor melalui teknik pembelahan embrio pada daerah meristem tunas dan akar apikal belum ada publikasi ilmiahnya.
Hasil observasi menunjukkan bahwa secara morfologi tidak ada perbedaan antara bibit atau pohon kelapa kopyor, kelapa berbuah kopyor dengan kelapa normal. Perbedaan ketiga macam kelapa tersebut hanya terletak pada bagian endosperma dan baru terlihat setelah memasuki fase generatif. Satu-satunya cara untuk membedakan ketiga macam kelapa ini sedini mungkin adalah pada level DNA dengan menggunakan analisis molekuler.
diketahui meningkat sejalan dengan proses pematangan dan perkecambahan buah kelapa (Mujer et al. 1984). Pada dua spesies buah kopi yaitu Coffea arabica dan Coffea canephora var. Robusta, aktivitas enzim -D Galaktosidase meningkat secara gradual selama pembentukan endosperma dan mencapai puncaknya 30 minggu setelah pembungaan, yang mana diiringi oleh mengerasnya endosperma (Marraccini et al. 2005). Pada kelapa kopyor aktivitas enzim -D Galaktosidase sangat rendah, bahkan tak terdeteksi (Mujer et al. 1984).
Penelitian tentang analisis molekular gen -D Galaktosidase pada kelapa atau kelapa kopyor belum pernah dilaporkan. Penelitian yang ada adalah tentang pemanfaatan penanda molekular untuk menganalisis keragaman genetik kelapa kopyor dengan menggunakan marker molekuler RAPD yang dihasilkan oleh random primer OPC09, OPH03, OPH05, dan OPH09 (Toruan & Ginting 1998) dan marker molekuler SSRs dari pasangan primer CNZ 21, CNZ 51, CNZ 09, CNZ 18, dan CnCr4 (Maskromo 2005). Namun demikian, marker molekuler yang ada belum dapat dijadikan sebagai marker untuk secara spesifik mendeteksi bibit kelapa kopyor atau menandai gen penentu sifat kopyor pada kelapa. Hal ini diduga karena marker-marker yang ada tidak terpaut (tidak ada dalam kromosom yang sama) dengan gen mutan penyebab sifat kopyor pada kelapa. Primer spesifik yang digunakan untuk menghasilkan marker SSR pada kelapa oleh Rivera et al. (1999) belum dapat digunakan untuk membedakan pohon kelapa berbuah kopyor dengan kelapa berbuah normal. Untuk itu perlu dikembangkan penanda molekuler spesifik untuk gen -D Galaktosidase yang dapat digunakan untuk mengidentifikasi keberadaan gen mutan yang menyebabkan sifat kopyor pada endosperma kelapa.
Tujuan Penelitian
Penelitian ini bertujuan: (1) memperbaiki teknologi kultur embrio sigotik kelapa kopyor untuk meningkatkan perkecambahan embrio dan meningkatkan jumlah planlet serta mempelajari teknik aklimatisasi bibit kelapa kopyor, (2) mengkaji teknologi pembiakan in vitro dengan teknik pembelahan embrio pada daerah meristem tunas dan akar embrio kelapa kopyor, (3) mengkaji teknologi embrio somatik untuk pembiakan klonal kelapa kopyor, (4) mengembangkan penanda molekuler gen -D Galaktosidase pada kelapa berbuah kopyor, (5) menganalisis fragmen DNA sejumlah gen yang diduga berkaitan erat dengan sifat kopyor, dan (6) menganalisis keragaman genetik populasi kelapa berbuah kopyor di Pulau Jawa. Kerangka pendekatan penelitian untuk mencapai tujuan penelitian tersebut disajikan pada Gambar 1.1.
Manfaat Penelitian
Gambar 1.1 Bagan alur kerangka penelitian teknik pembiakan in vitro dan analisis molekuler pada tanaman kelapa kopyor.
TINJAUAN PUSTAKA
Kelapa Kopyor
Kelapa kopyor (Cocos nucifera L.) (2n=2x=32) sama dengan tanaman kelapa lainnya merupakan anggota dari famili monokotiledon Aracaceae (Palmaceae). Cocos nucifera adalah satu-satunya spesies dalam genus Cocos subfamili Cocoideae (Harris 1990). Buah kelapa kopyor adalah buah kelapa yang endospermanya tidak normal (remah) (Gambar 2.1). Buah dengan karakteristik tersebut dihasilkan dari pohon kelapa tertentu yang sebagian besarnya buahnya normal dan sebagian kecil tidak normal (kopyor) (Wahyuni 2000). Biasanya pohon jenis ini hanya mempunyai buah kelapa kopyor dengan frekuensi antara 1-2 buah kopyor per tandan.
Abnormalitas endosperma kelapa kopyor bersifat genetik dan ditimbulkan oleh beberapa faktor resesif (Zuniga dalam Tahardi & Warga-Dalem 1982). Sifat kopyor dibawa oleh pasangan gen resesif, yaitu 50% dari induk betina dan 50%
Gambar 2.1 Fenotipe endosperma buah kelapa normal dan kelapa kopyor. a. Buah kelapa normal dengan endosperma padat dan masif, b. Buah kelapa kopyor dengan endosperma bergumpal-gumpal dan mengelupas dari tempurung.
dari induk jantan. Buah kopyor akan terbentuk jika terjadi persilangan antara polen dan stigma yang masing-masing memiliki sifat kopyor (Tahardi 1997). Sifat kopyor secara genetik dikendalikan oleh genotipe endosperma (betina) dan genotipe polen (jantan). Bila satu pohon kelapa kopyor bunga betinanya konsisten diserbuki oleh polen dari pohon kelapa kopyor, maka dapat dipastikan pohon tersebut akan menghasilkan 100% buah kopyor.
Morfologi pohon kelapa kopyor dan kelapa berbuah kopyor tidak bisa dibedakan dari kelapa normal. Hasil observasi menunjukkan tidak ada penanda morfologi yang bisa digunakan untuk membedakan ketiga jenis pohon kelapa tersebut (Maskromo 2005). Kepastian tanaman berbuah kopyor diketahui setelah buahnya dipanen. Salah satu cara sederhana untuk mengetahui buah kelapa kopyor adalah dengan mengguncang buah tersebut. Pada saat diguncang buah kopyor akan berbunyi gemericik, yang menandakan endosperma telah hancur dan telah terlepas dari tempurung sehingga bercampur dengan air kelapa.
Fenotipe endosperma abnormal pada kelapa kopyor terkait dengan tidak aktifnya gen penyandi enzim -D Galaktosidase. Pada kelapa normal, aktivitas enzim -D Galaktosidase diketahui meningkat sejalan dengan proses pematangan dan perkecambahan buah kelapa. Pada kebanyakan tanaman, misalnya pada tanaman kopi proses mengerasnya endosperma dikontrol secara langsung oleh aktivitas gen -Gal, melalui pelepasan residu galactosyl dari rantai mannan (Marraccini et al. 2005).
Pada kelapa kopyor, aktivitas enzim -D Galaktosidase sangat rendah dan bahkan tak terdeteksi menyebabkan endospermanya menjadi abnormal (remah). Mutasi genetik yang terjadi pada kelapa kopyor dan terekspresi secara khusus pada endosperma dalam bentuk berkurangnya aktivitas enzim -D Galaktosidase atau tidak aktif sama sekali menjadi penyebab fenotipe endosperma buah kelapa yang tidak normal tersebut (Mujer et al. 1984).
Tabel 2.1 Kandungan komposisi senyawa kimia air kelapa dan endosperma kelapa kopyor dengan kelapa normal yang dihitung berdasarkan persentase bahan kering
Jenis kelapa
Protein Lemak Karbo-hidrat
Sukrosa Glukosa Fruk- tosa
Vit.C -tocopherol
AKN* 9.36 2.67 79.5 9.24 26.7 25.7 7.08 ND** AKK 10.4 4.79 72.8 60.8 6.29 5.24 2.42 0.01 EKN 7.10 62.64 29.1 4.77 0.24 0.46 5.27 0.94 EKK 4.93 30.71 62.3 10.70 2.42 2.08 12.3 2.34
*Sampel buah diambil pada umur 12 bulan setelah penyerbukan, AKN=Air kelapa normal, AKK=air kelapa kopyor, EKN=Endosperma kelapa normal, EKN=endosperma kelapa kopyor ** ND = tidak terdeteksi
Sumber: Santoso et al. (1996)
melaporkan bahwa bahan dasar utama dinding sel pada kelapa “Makapuno” (sebutan kelapa kopyor di Filipina) adalah pektin sedangkan pada kelapa normal adalah hemisellulosa. Kandungan vitamin C dan -tocopherol pada endosperma kelapa kopyor jauh lebih tinggi daripada kelapa normal. Begitu juga kandungan sukrosa, galaktosa dan fruktosa lebih tinggi pada endosperma kelapa kopyor. Menurut Santoso et al. (1996) kombinasi antara kandungan gula yang tinggi, asam sitrat dan asam malat menimbulkan rasa lezat pada endosperma kelapa kopyor. Sementara itu kandungan senyawa protein seperti lisina sangat rendah dibandingkan kelapa normal. Protein pada endosperma kelapa kopyor didominasi oleh asam glutamina, arginina dan asam aspartat.
Kultur Embrio Sigotik Kelapa
Metode kultur embrio telah dikembangkan secara intensif oleh COGENT (International Coconut Genetic Resources Network) sejak tahun 1997 untuk pertukaran plasma nutfah dan konservasi ex situ kelapa (Engelmann 1998). Metode ini juga digunakan oleh UPLB (University of Philippines at Los Banos) untuk mengembangkan kelapa “Makapuno” (kopyor). Hasilnya saat ini terdapat beberapa macam protokol media kultur untuk tanaman kelapa yang dikembangkan oleh PCA (Philippine Coconut Authority), CPCRI (Central Plantation Crops Research Institute) India, ORSTOM/CIRAD Perancis, dan UPLB (Tabel 2.2). Berdasarkan hasil penelitian yang dilakukan terhadap keempat macam protokol tersebut menunjukkan bahwa meskipun protokol yang terbaikpun seperti UPLB persentase embrio yang berhasil mencapai tahap aklimatisasi di screen house masih di bawah 50%. Selanjutnya plantlet-planlet yang berhasil mencapai tahap aklimatisasi dan berhasil bertahan hidup dibawah 30% (Mashud 1999). International Coconut Embryo Culture Workshop, 2000, di Mexico meyimpulkan perlunya upgrading teknik kultur embrio untuk tanaman kelapa dan meningkatkan efisiensinya.
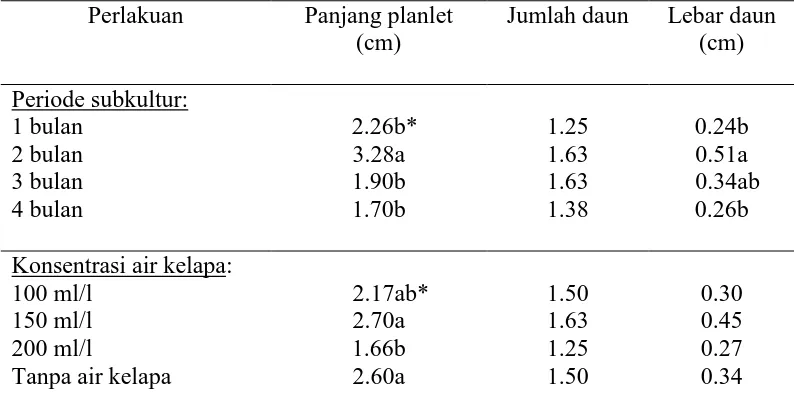
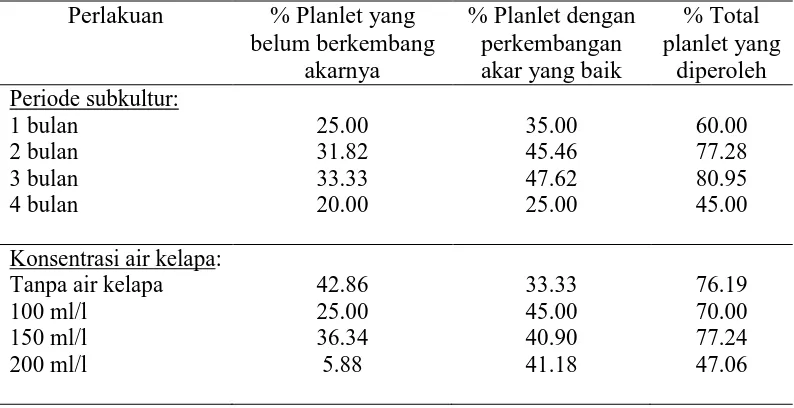
Keragaman respon yang tinggi embrio kelapa kopyor ketika dikulturkan menyebabkan kesenjangan waktu yang lama untuk proses aklimatisasi antara embrio satu dengan embrio lainnya untuk periode inokulasi yang sama. Hal ini karena pertumbuhan planlet satu dengan lainnya tidak seragam. Ada planlet kelapa kopyor yang tumbuh sangat cepat sehingga hanya dibutuhkan waktu 5-6 bulan untuk diaklimatisasi (Sukendah 2003). Di lain pihak ada planlet yang membutuhkan waktu hampir satu tahun baru bisa diaklimatisasi. Vigor (ketegaran) planlet kelapa kopyor juga sangat beragam. Hal ini berkaitan dengan perkembangan tunas dan sisten perakaran yang kurang baik. Untuk planlet-planlet yang kondisinya tidak siap untuk proses aklimatisasi perlu dilakukan peningkatan vigor planlet, salah satunya dengan cara memperbaiki sistem perakarannya.
perakaran adalah dengan menambahkan ZPT NAA 20 mg/l. Untuk meningkatkan pertumbuhan tunas dan akar planlet kelapa, Magdalita et al. (2004) menambahkan GA3 20 uM. GA3 pada konsentrasi ini berpengaruh pada panjang tunas, jumlah akar, dan berat segar dan berat kering planlet, namun tidak mempengaruhi panjang akar.
Tabel 2.2 Protokol komposisi media kultur embrio kelapa yang dikembangkan oleh berbagai negara
*Media perkecambahan , **Media perakaran, Y3= media dasar Eeuwens, MS= media dasar Murashage & Skoog
Kultur Embrio Somatik
Embriogenesis somatik adalah serangkaian proses pada struktur bipolar (mirip embrio sigotik) yang berkembang dari sel non-sigotik tanpa ada hubungan vaskular dengan jaringan sel induknya (Arnold et al. 2002). Sel-sel yang ditumbuhkan secara in vitro ini membentuk embrio somatik. Embrio somatik dapat berkembang dari satu sel dalam suatu eksplan (embriogenesis somatik langsung), atau didahului oleh proses proliferasi sel kalus (embriogenesis somatik tidak langsung) (Witjaksono 2003).
Pada embriogenesis somatik tidak langsung, ekplan seperti daun, bunga, tunas, hipokotil, atau bagian organ lainnya dikulturkan di dalam media yang mengandung auksin (2,4-D) untuk memperoleh kultur embriogenik. Dengan adanya auksin, sel yang sedang mengalami pembelahan dengan cepat distimulasi untuk membelah dengan tidak equal. Hal ini menghasilkan dua bentuk sel, yaitu sel yang besar dengan banyak vakuola, dan sel kecil yang sitoplasmik yang kompeten untuk embriogenesis (Litz & Gray 1995). Embriogenesis somatik tidak langsung terjadi pada sel-sel induced embriogenic determined cell (IEDC) yaitu sel-sel yang mengalami dediferensiasi, pembelahan sel dan transformasi menjadi sel embriogenik. Embriogenesis somatik langsung dapat terjadi pada tanaman tahunan seperti mangga yang dikulturkan dari nuselus (Litz 1984) dan apukat (Witjaksono & Litz 1999).
Embriogenesis somatik langsung, embrio somatik dapat ditumbuhkan dari eksplan (embrio sigotik muda, nuselus, hipokotil) tanpa melalui fase kalus. Embrio somatik dapat diinisiasi dari sel embrionik yang sudah ada di dalam eksplan, yaitu pada sel-sel preembriogenic determined cell (PEDC). Sel-sel PEDC tersebut membutuhkan zat pengatur tumbuh untuk pembentukan embrio somatik. Induksi embriogenesis somatik langsung pada tanaman tahunan terjadi pada nucelus mangga poliembrioni (Litz et al. 1995) dan kotiledon pear tipe liar (de March et al. 1993).
Touchet et al. 1991; Esraghi et al. 2005; Riyadi et al. 2005). Walupun demikian, auksin juga mempunyai kemampuan untuk menghambat pertumbuhan embrio (Litz & Gray 1992). Karena sifat inilah auksin tidak ditambahkan ke dalam media pada proses perkembangan lebih lanjut dari embrio. Auksin dapat mengacaukan polarisasi pembelahan sel yang dibutuhkan dalam pertumbuhan proembrio menjadi embrio somatik (Kawahara & Komamine 1995). Pada kurma proliferasi suspensi kalus dipelihara tanpa auksin (2,4-D), namun ditambahkan glutamina untuk meningkatkan proliferasi embrio somatik (Zouine & Hadrami 2007). Pada mangga proliferasi proembrioni dan apukat dipengaruhi oleh genotipe tanaman (Witjaksono & Litz 1999). Pada wortel tipe liar, proliferasi dipengaruhi oleh pH media. pH rendah sangat ideal untuk terjadinya proliferasi dilain pihak pH tinggi dibutuhkan untuk perkembangan embrio somatik (Smith & Krikorian 1990).
Tahap perkembangan embrio somatik hampir sama dengan jalur yang ditempuh oleh biji/embrio sigotik pada proses perkecambahan, yaitu: tahap globular, hati, torpedo dan kotiledon untuk spesies dikotil (Arnold et al. 2002). Pada spesies tanaman monokotil tahap yang ditempuh adalah globular, skutelar, dan koleoptil (Gray 2005). Perkembangan embrio somatik diinisiasi setelah embrio ditransfer ke media tanpa atau dengan auksin rendah. Walaupun demikian hormon seperti ABA mengontrol pendewasaan embrio somatik sebelum dikonversi menjadi tanaman utuh. Nickel & Yeung (1993) berpendapat bahwa ABA mungkin menginduksi diferensiasi jaringan tunas meristem dan mencegah perkecambahan dini.
Perkembangan Kultur Embrio Somatik pada Tanaman Kelapa
Sejauh ini propagasi klonal melalui embriogenesis somatik pada kelapa kopyor belum banyak dilaporkan. Sifat pertumbuhan kelapa (normal atau kopyor) yang monopodial (tidak bercabang) dan tak ada sucker, rimpang atau anakan yang tumbuh menyebabkan kelapa secara genetik sulit diperbanyak secara vegetatif. Walaupun demikian dengan berpedoman pada teori totipotensi bahwa setiap sel tanaman mempunyai otonomi dan kemampuan untuk berkembang menjadi tanaman utuh, beberapa peneliti mencoba memperbanyak kelapa secara vegetatif dari sel somatiknya (2n). Perbanyakan klonal melalui embriogenesis somatik pada kelapa dimulai pada era 80-an oleh Blake dengan koleganya. Penelitian embriogenesis somatik pada kelapa mulai intensif dikerjakan setelah CIRAD bekerja sama dengan IRD pada tahun 1991 untuk mengembangkan metode propagasi klonal kelapa dari eksplan seperti infloresens muda (Verdeil et al. 1994; Magnaval et al. 1997), dan plumula (Hornung 1995).
Kloning in vitro tanaman kelapa melalui embriogenesis somatik menjajikan prospek yang baik di masa mendatang. Studi untuk mendapatkan embrio somatik telah dilaksanakan menggunakan berbagai jenis eksplan, termasuk daun muda, akar, embrio muda dan infloresens dengan berbagai tingkat keberhasilan (Oropeza et al. 2003.). Pada awal tahun 1990-an kalus dapat diperoleh dari berbagai sumber eksplan tersebut, tetapi embrio somatik dan regenerannya hanya dapat diperoleh dari daun muda (Buffard-Morel et al. 1992; Karunaratne et al. 1991) dan infloresens (Branton & Blake 1986; Verdeil et al. 1994). Studi pendahuluan yang dilakukan oleh Hornung (1995) dan Chan et al. (1998) menunjukkan bahwa pembentukan embrio somatik dan regenerannya lebih tinggi diperoleh dari eksplan plumula daripada jenis eksplan lainnya.
Tabel 2.3 Mikropropagasi secara klonal pada tanaman kelapa melalui proses embriogenesis somatik
No. Eksplan Media Kultur Respon/Hasil Autor
Lanjutan Tabel 2.3
No. Eksplan Media Kultur Respon/Hasil Autor
Lanjutan Tabel 2.3
No. Eksplan Media Kultur Respon/Hasil Autor
Lanjutan Tabel 2.3
No. Eksplan Media Kultur Respon/Hasil Autor
9. Embrio
Embriogenesis somatik adalah proses regenerasi yang melalui beberapa tahap. Pada tanaman kelapa sedikitnya ada empat tahap, yaitu:
Inisiasi kalus embriogenik. Ada dua faktor yang sangat berpengaruh
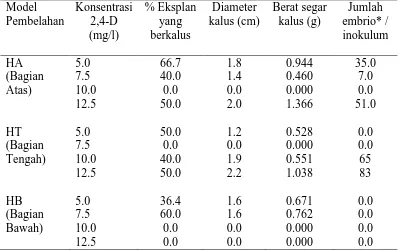
terbatas. Tiga macam eksplan yang biasa digunakan untuk induksi kalus, yaitu: infloresens muda, embrio sigotik, dan plumula (Cueto et al. 1994; Buffard-Morel et al. 1995; Samosir et al. 1998; Chan et al. 1998). Faktor ke dua adalah auksin mutlak dibutuhkan untuk induksi kalus embriogenik tanaman kelapa. Umumnya dari golongan auksin sintetik yang kuat seperti 2,4-D. Konsentrasi 2,4-D sebanyak 250 uM dibutuhkan untuk menginduksi kalus dari eksplan meristem bunga yang muda (infloresens muda) (Verdeil et al. 2001). Eksplan plumula membutuhkan 2,4-D 100 uM untuk membentuk kalus (Chan et al. 1998), sedangkan eksplan embrio sigotik konsentrasi yang dibutuhkan sebesar 125 uM (Samosir et al. 1998).
Proliferasi kalus embriogenik. Untuk multiplikasi kalus embriogenik,
kalus disubkultur 3- 4 kali pada media yang mengandung 2,4-D dengan konsentrasi sama seperti pada saat inisiasi kalus (Cueto et al. 1994), atau kalus dipelihara dengan mengurangi konsentrasi 2,4-D pada setiap subkultur yang dilakukan 4 minggu sekali (Buffard-Morel et al. 1995).
Induksi dan pematangan embrio somatik. Sejumlah peneliti berpendapat
bahwa faktor yang menentukan untuk menginduksi embriogenesis somatik kelapa adalah mengurangi level konsentrasi 2,4-D pada saat yang tepat (Buffard-Morel et al. 1995), karena ada kalanya proembrio sudah terbentuk pada waktu kalus dipelihara pada media dengan 2,4-D tinggi dan pematangan embrio dicapai saat level 2,4-D dikurangi secara gradual pada media yang ditambah BAP (Verdeil et al. 1994). Pengurangan 2,4-D yang terlalu cepat mengakibatkan proses pematangan embrio yang tidak sempurna dan menimbulkan bentuk-bentuk yang menyimpang. Untuk meningkatkan produksi embrio somatik, Adkins et al. (1998) menambahkan poliamina (putrescine 7.5 mM dan spermine 1 uM). Sementara Fernando & Gamage (2000) menambahkan ABA 2.5-5.0 uM untuk meningkatkan jumlah embrio somatik dan planlet lengkap. Samosir et al. (1998) menemukan bahwa cahaya menghambat produksi embrio somatik kelapa dan sedikit berpengaruh pada pematangan embrio, namun dibutuhkan pada saat regenerasi planlet dari embrio somatik.
Konversi tanaman. Konversi embrio kelapa menjadi tunas atau planlet
peneliti melakukan konversi embrio menjadi planlet pada media mengandung 2,4-D sangat rendah yang dikombinasikan dengan BAP (50 uM) di bawah kondisi yang bercahaya (Chan et al. 1998).
Penanda Molekuler
Penanda molekuler belakangan ini telah digunakan secara luas untuk menganalisis variasi sekuen DNA di dalam dan antar spesies tanaman. Penanda molekuler diidentifikasi sebagai fragmen DNA yang pendek yang berada pada posisi tertentu di dalam kromosom dan dapat mendeteksi perbedaan sekuen pada posisi fragmen tersebut antara berbagai spesies atau galur tanaman. Penanda molekuler didasarkan pada keragaman yang terjadi pada sekuen DNA hasil dari mutasi titik, delesi atau insersi, atau adanya variasi pada jumlah copy dari fragmen DNA berulang. Keragaman genetik di dalam atau antar spesies atau organisme dideteksi sebagai polimorfisme (Patwary 2004).
Pada saat ini telah dikembangkan sistem pendeteksi marker untuk mengidentifikasi penanda yang terkait dengan sifat tertentu, baik melalui genome wide marker maupun dengan gene specific marker. Genome wide marker dikembangkan menggunakan teknik seperti RAPD, AFLP, RFLP, SSR. Random Amplified Polymorphic DNA (RAPD) banyak digunakan karena kesederhanaan, mudah dan cepat dalam penerapannya (Tingey et al. 1992). Marker AFLP (Amplified Fragment Length Polymorphism) juga tidak sulit untuk dilakukan dan bisa mendeteksi ratusan lokus dalam genom tanaman untuk satu kali analisis. Walaupun demikian belakangan ini banyak digunakan penanda molekuler SSR (Simple Sequence Repeats) atau microsatellite untuk studi keragaman genetik, filogeni, pemetaan genom, dan evolusi. SSR dapat menghasilkan lebih banyak pita polimorfik dan membutuhkan pengetahuan tentang informasi sekuen DNA tentang keberadaan Simple Sequence Repeats dalam genom tanaman (Godwin et al. 1997).
dengan menggunakan informasi tentang runutan DNA (DNA sequence) dari gen target. Penanda molekuler spesifik biasanya dikembangkan dengan mendisain primer spesifik untuk gen target dan menggunakan SNP (Single Nucleotide Polymorphism) atau SSCP (Single Strand Conformation Polymorphism) untuk mengetahui polimorfisme sekuen DNA. SSCP banyak digunakan untuk menganalisis keragaman alel (Magome et al. 1999) dan mutasi yang diakibatkan oleh delesi atau insersi (Chuayjaeng & Volkaert 2006). Polimorfisme diakibatkan oleh perbedaan mobilitas DNA utas tunggal pada gel poliakrilamid yang mana sangat tergantung pada struktur sekunder yang dibentuk oleh urutan basa nukleotidanya (Glavac & Dean 1993).
Penggunaan Penanda Molekuler pada Tanaman Kelapa
Penggunaan berbagai penanda molekuler pada tanaman kelapa selama ini lebih banyak ditujukan untuk mempelajari keragaman genetik, karakterisasi atau studi evolusi. Studi keragaman genetik populasi kelapa dan karakterisasi plasma nutfah kelapa dari berbagai lokasi negara telah dilakukan dengan menggunakan RAPD (Ashburner et al. 1997; Roslim et al. 2003; Katsuyuki et al. 2003; Upadhyay et al. 2004; Parthasarathy et al. 2005), RFLP (Lebrun et al. 1998), AFLP (Perera et al. 1998), dan SSR (Rivera et al. 1999; Noel et al. 2007). Penggunaan penanda molekuler untuk menelusuri nenek moyang kelapa diulas secara detail oleh Harris et al. (2004). Shalini et al. (2007) mengidentifikasi penanda molekuler SSR dan RAPD yang berasosiasi dengan resistensi tanaman kelapa terhadap kutu (Aceria guerreronis). Sementara itu Warokka et al. (2006) menggunakan teknik nested PCR dengan kombinasi primer P1/P7 dan R16F2n/R16R2 untuk mendeteksi phytoplasma yang menyebabkan penyakit layu Kalimantan pada tanaman kelapa.
Penanda molekuler RAPD yang dihasilkan oleh primer acak OPH03, OPH05, OPH09, dan OPC09 (Toruan & Ginting 1998) dan penanda molekuler SSRs yang dihasilkan oleh pasangan primer CNZ 21, CNZ 51, CNZ 09, CNZ 18, dan CnCr4 (Maskromo 2005) belum dapat dijadikan sebagai marker untuk secara spesifik mendeteksi bibit kelapa kopyor atau bibit kelapa berbuah kopyor.
Seperti yang telah dikemukakan sebelumnya bahwa karakteristik abnormal endosperma kelapa kopyor diduga dikendalikan oleh mutan resesif yang secara alami muncul di antara kelapa normal (Samonthe 1989). Penanda morfologi tidak dapat digunakan untuk membedakan pohon kelapa kopyor dan kelapa berbuah kopyor dengan kelapa berbuah normal (Maskromo 2005). Sampai saat ini, belum ada penanda yang secara akurat dapat mendeteksi bibit atau pohon kelapa kopyor dan kelapa berbuah kopyor dengan kelapa normal atau penanda molekuler yang terpaut dengan gen penentu sifat kopyor pada kelapa.
Gen-gen Penting pada Endosperma dan Perkecambahan Kelapa
Endosperma pada tanaman kelapa sebagian besar terdiri dari galaktomanan. Galaktomanan menduduki 50-61% polisakarida endosperma (Balasubramaniam 1976; Redgwell 2003). Galaktomanan merupakan senyawa penyimpan polisakarida dinding sel pada endosperma berbagai spesies tanaman seperti Cyamopsis tetragonoloba (Overbeeke 1989), Coffea arabica L. (Redgwell 2003), dan Trigonella foemungraecum L. (Reid & Bewley 1979). Galaktomanan akan didegradasi pada saat proses perkecambahan. Salah satu enzim penting dalam degradasi galaktomanan adalah -D Galaktosidase (Mathew & Balasubramaniam 1987). Aktivitas enzim -D Galaktosidase meningkat seiring dengan perkembangan endosperma dan mencapai puncaknya pada saat buah kelapa umur 11-12 bulan (Mujer et al 1984), di mana pada saat tersebut proses perkecambahan embrio dimulai.
oleh pemberian ABA, penghambatan ini berpengaruh pada penyerapan air oleh embrio (Potomati & Buckeridge 2002).
Aktivitas -D Galaktosidase tidak terdeteksi pada endosperma kelapa kopyor (Mujer et al. 1984). Ketidakaktifan enzim -D Galaktosidase diikuti oleh menumpuknya galaktomanan dalam endosperma kelapa kopyor. Sementara pada kelapa normal galaktomanan pada fase lanjut menurun dengan drastis. Pada buah kelapa kopyor tidak terjadi mobilisasi galaktomanan yang berperan sebagai sumber energi untuk perkecambahan embrio. Hal ini mengakibatkan embrio pada buah kelapa kopyor gagal berkecambah.
Analisis biokimia menunjukkan bahwa komposisi senyawa kimia seperti karbohidrat, protein, dan lemak pada endosperma kelapa kopyor dan kelapa normal sangat berbeda. Endosperma kelapa kopyor mengandung lebih tinggi karbohidrat (62.3%) daripada lemak (30.71%), berbanding terbalik dengan endosperma kelapa normal. Kandungan sukrosa pada endosperma dan air kelapa kopyor jauh lebih tinggi daripada kelapa normal (2-10 kali). Kandungan asam oleat (C18:1) dan asam linoleat (C18:2) ditemukan lebih tinggi pada endosperma kelapa kopyor (Santoso et al. 1996).