ABSTRAK
IDENTIFIKASI PARASIT PADA IKAN BADUT (Amphiprion percula) DI BALAI BESAR PENGEMBANGAN
BUDIDAYA LAUT (BBPBL) LAMPUNG
Oleh
RINA HESTI UTAMI
Penelitian ini bertujuan untuk mengidentifikasi parasit yang menginfeksi pada ikan badut (A. percula) serta korelasinya dengan lokasi budidaya. Penelitian ini dilakukan pada bulan Februari sampai dengan April 2013 di Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung. Penelitian ini menggunakan metode eksploratif dengan mengisolasi parasit yang menginfeksi ikan badut (3-5 cm) yang dibudidayakan di tiga lokasi budidaya yaitu indoor, semi outdoor dan outdoor. Parasit yang disolasi diidentifikasi kemudian dibandingkan satu lokasi budidaya dengan lokasi lainnya menggunakan indeks Sorensen. Hasil penelitian ditemukan lima jenis ektoparasit yang menginfeksi ikan badut yaitu Trichodinidae, Microcotyle sp., Plectanocotylidae, Trichodina sp. dan Secernentea. Jenis parasit yang ditemukan pada lokasi semi outdoor dan indoor adalah sama, dengan nilai indeks Sorensen sebesar 100%. Sedangkan pada lokasi semi outdoor dan outdoor, serta outdoor dan indoor memiliki kesamaan parasit yang rendah dengan nilai indeks Sorensen sebesar 57%. Prevalensi parasit tertinggi terdapat pada lokasi outdoor yaitu parasit Trichodina sp., (19,44%) dan intensitas parasit tertinggi yaitu Trichodinidae (85,67 ind/ekor) pada lokasi indoor.
ABSTRACT
IDENTIFICATION OF PARASITES ON CLOWNFISH (Amphiprion percula) IN MAIN CENTER OF MARINE CULTURE
DEVELOPMENT(BBPBL) OF LAMPUNG
By
RINA HESTI UTAMI
The goals of the research were to identify parasites and the correlation between culture location and the types of parasites that infect Clownfish (A. percula). This research was conducted on February through April 2013 at Main Center of Marine Culture Development of Lampung. This research used to explorative method with to infect parasites which infected clownfishes (3-5 cm) which were cultured in three locations were indoor, semi outdoor, and outdoor. Parasites were identified and compared culture location with each other with Sorensen indices. Based on the Clownfishes were infected by five kinds of ectoparasites namely Trichodinidae, Microcotyle sp., Plectanocotylidae, Trichodina sp. and Secernentea. Types of parasites that found in semi outdoor and indoor location was similar with the value of Sorenson indices was 100%. While on semi outdoor and outdoor location, as well as outdoor and indoor low parasites the similarity was low with the value of Sorenson indices was 57%. The highest prevalence of parasites from the location of outdoor was Trichodina sp., (19,44%) and highest intensity was Trichodinidae (85,67 ind/fish) from the outdoor location.
I. PENDAHULUAN
1.1Latar Belakang
Ikan hias baik ikan hias air tawar maupun air laut makin banyak diminati oleh masyarakat sehingga, permintaan ikan hias semakin meningkat baik di pasar lokal hingga pasar internasional. Data Pusat Statistik dan Informasi Sekretariat Jenderal Kementerian Kelautan dan Perikanan, volume ekspor ikan hias air laut pada tahun 2007-2011 mengalami peningkatan sebesar 0,26% (KKP 2012). Diantara jenis-jenis ikan hias air laut yang diperdagangkan salah satunya adalah ikan Badut (Amphiprion percula). Beberapa alasan ikan badut (Amphiprion percula) banyak diminati adalah keindahan warna tubuhnya yaitu oranye cerah dengan kombinasi tiga garis putih di bagian kepala, badan dan pangkal ekor, sebaran warna hitam pekat dan pola garis putih di bagian perut lebih tajam, gerakannya lincah, dan memiliki postur tubuh mungil (Allen, 1991).
sering terjadi pada beberapa waktu terakhir. Penyebab kematian pada ikan badut tersebut hingga saat ini belum diketahui. Kematian pada ikan badut diduga disebabkan adanya penyakit infeksi.
Parasit merupakan salah satu penyakit infeksi yang menyebabkan kematian pada budidaya ikan-ikan laut. Hasil pemantauan penyakit oleh Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Lampung, dari tahun 2008 - 2012 menunjukkan beberapa jenis parasit yang sering menginfeksi ikan laut antara lain Hallotrema sp., Octolasmysmullery sp., Benedenia sp., Marphysa sp., dan Diplectanum sp.
Identifikasi parasit merupakan salah satu upaya dalam mengetahui penyebab kematian pada ikan badut. Hal ini perlu dilakukan karena berkaitan dengan metode penanggulangan penyakit yang harus dilakukan untuk meminimalisasi terjadinya kematian pada ikan badut.
1.2Tujuan
Tujuan penelitian ini untuk mengidentifikasi parasit dan mengetahui korelasi lokasi budidaya terhadap jenis parasit yang menginfeksi ikan badut (Amphiprion percula) yang dibudidayakan di Balai Besar Pengembangan Budidaya Laut
(BBPBL) Lampung.
1.3Manfaat
Manfaat dari penelitian ini adalah :
2. Memberikan informasi kepada pembudidaya agar dapat mengatasi serangan parasit pada ikan badut (Amphiprion percula) sesuai jenis parasit yang menyerang, sehingga dapat meminimalisasi kematian pada ikan badut (Amphiprion percula).
1.4Kerangka Pemikiran
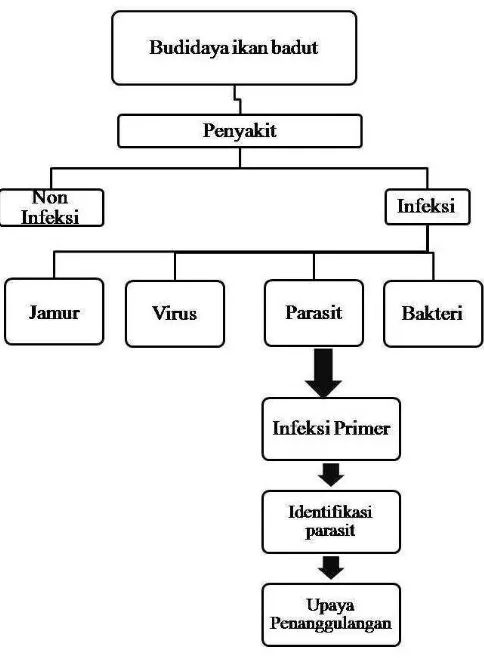
Budidaya ikan badut (Amphiprion percula) yang dilakukan oleh Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung, sering terjadi kematian. Penyebab kematian pada ikan badut tersebut hingga saat ini belum diketahui.
Kematian pada ikan dapat disebabkan oleh penyakit non infeksi dan infeksi. Penyakit non infeksi antara lain disebabkan oleh pakan, genetis dan perubahan lingkungan (Kinne 1980 dalam Irianto, 2005). Sedangkan penyakit infeksi disebabkan oleh virus, parasit, jamur, dan bakteri (Irianto, 2005). Kematian pada ikan badut diduga disebabkan penyakit infeksi karena penyakit infeksi memiliki karakter khusus yaitu kemampuannya untuk menularkan penyakit (transmisi) dari satu ikan ke ikan lain secara langsung (Stasiun Karantina Ikan Kelas I Panjang Lampung, 2009). Wabah penyakit infeksi bersifat musiman, terutama pada daerah tropis. Wabah penyakit infeksi dapat bersifat akut dengan tingkat mortalitas tinggi dalam jangka waktu singkat, sub-akut maupun kronis dengan mortalitas berlangsung beberapa minggu sejak munculnya wabah (Plump, 2001 dalam Irianto, 2005).
ikan dapat menyebabkan insang tertutup, kulit mengalami peradangan dan rusak, hingga menimbulkan borok (ulcer). Kondisi demikian memudahkan infeksi sekunder bakteri dan virus yang dapat menimbulkan kematian pada ikan (Irianto, 2005). Oleh karena itu, perlu dilakukan identifikasi parasit untuk mengetahui penyebab kematian pada ikan badut. Hal ini dilakukan karena berkaitan dengan metode penanggulangan penyakit yang dilakukan untuk meminimalisasi kematian pada ikan badut.
II. TINJAUAN PUSTAKA
2.1Ikan Badut (Amphiprion percula) 2.1.1 Klasifikasi dan Morfologi
Klasifikasi ikan badut (Amphiprion percula) menurut Michael (2008), adalah sebagai berikut:
Kingdom : Animalia Filum : Chordata Subfilum : Vertebrata Superkelas : Osteichthyes Kelas : Actynopterygii Subkelas : Neopterygii Ordo : Perciformes Subordo : Labroidei Famili : Pomacentridae Genus : Amphiprion
Spesies : Amphiprion percula
warna hitam pekat dan pola garis putih di bagian perut lebih tajam. Selain itu,ikan badut memiliki jari-jari keras sebanyak 10 buah dan jari-jari lunak pada sirip punggungnya sebanyak 17 buah, dengan panjang jari-jari sirip yang berbeda (Allen, 1991). Gambar morfologi ikan badut (Amphiprion percula) dapat dilihat pada Gambar 2.
Gambar 2. Morfologi ikan badut (Amphiprion percula) (Sumber : Lieske, 2001)
2.1.2 Distribusi dan Habitat
Ikan badut (Amphiprion percula) berasal dari Papua Nugini dan Kepulauan Solomon. Ikan badut hidup di laut dengan kedalaman 1-12 meter pada derah terumbu karang di pesisir dan di teluk. Beberapa faktor yang mempengaruhi distribusi dan arah distribusi dari ikan badut adalah jumlah larva, ketersediaan anemon laut, faktor-faktor hidrografi dan adanya daratan penghalang (Michael, 2008).
dalam Yasir, 2010). Simbiosis ini berupa, ikan badut mendapat proteksi dan
memakan material non-metabolik yang dikeluarkan oleh anemon. Disisi lain, anemon dibersihkan dan dilindungi dari predator oleh ikan simbionnya (Randall and Fautin, 2002 dalam Yasir, 2010). Menurut Michael (2008), anemon yang biasa bersimbiosis dengan ikan badut antara lain, Heteractis magnifica, dan Stichodactyla gigantean. Ikan badut (Amphiprion percula) biasanya tinggal
menetap di salah jenis anemon saja dan tidak suka berpindah-pindah ke anemon lain.
Parameter kualitas air yang perlu diperhatikan dalam budidaya ikan badut menurut Anonim (2009), yaitu suhu (28 -32 0C), salinitas (30-32 ppt), kesadahan (80-120 mg/l), pH (7-8), DO (>5 mg/l), amoniak (<0,5 mg/l), phospat (<0,1 mg/l), NO2 (<0,1 mg/l), dan NO3 (<0,5 mg/l).
2.1.3 Pakan dan Kebiasaan Makan
Ikan badut (Amphiprion percula) di alam mendapatkan makanan dari sekitar anemon. Ikan badut merupakan ikan omnivora yang mengkonsumsi zooplankton, invertebrata kecil (crustacean) dan parasit yang melekat pada tubuh anemon serta alga bentik. Ikan badut biasanya menghabiskan sebagian besar hidupnya untuk mencari makan, bermain, dan berpasangan dalam wilayah tempat hidupnya (Michael, 2008).
sama. Salah satu contohnya yaitu Amphiprion chrysopterus menghabiskan kurang lebih 90% waktunya untuk makan dan berenang di antara tentakel (Allen,1991).
2.2Parasit
Parasit didefinisikan sebagai organisme yang hidup pada organisme lain (inang) dan mendapat keuntungan dari inang yang ditempatinya hidup, sedangkan inang menderita kerugian. Parasit memiliki habitat tertentu dalam tubuh inang. Parasit pada ikan berdasarkan tempat hidupnya dibedakan menjadai tiga yaitu ektoparasit, mesoparasit dan endoparasit (Anshory, 2008).
Ektoparasit adalah parasit yang menyerang tubuh ikan bagian luar seperti kulit, sirip dan insang. Beberapa golongan parasit yang bersifat ektoparasit antara lain adalah ciliata, flagellata, monogenea, copepod, isopod, dan lintah. Sedangkan endoparasit adalah parasit yang menyerang organ-organ dalam tubuh ikan seperti pada usus, ginjal, hati, otak, dan otot daging. Golongan parasit yang masuk kelompok endoparasit antara lain adalah digenea, cestoda, nematoda, acantocephala, coccidia, microsporidia, dan amoeba. Mesoparasit adalah parasit menginfeksi ikan dimana sebagian dari tubuh parasit menembus sampai organ dalam tubuh inang sedangkan bagian tubuh lainnya berada diluar tubuh inang. Contoh mesoparasit adalah parasit Lernaeocera sp. yang hidup pada rongga insang ikan gadid dan dapat menembus jantung ikan untuk mengisap darah (Anshory, 2008).
2.3Parasit yang Berpotensi Menyerang Ikan Badut
menyerang ikan badut yaitu ektoparasit dari golongan protozoa (penyakit protozoik). Penyakit protozoik yang bisanya menyerang ikan badut disebabkan Brooklynella hostiles, Cryptocaryon irritans dan Amyloodinium ocellatum
(Anonim, 2009).
2.3.1 Cryptocaryon irritans
Cryptocaryon irritans merupakan ciliata (hewan yang memiliki bulu getar). Cryptocaryon irritans memiliki ukuran tubuh 25-60 μm pada fase theront.
sedangkan pada fase trophont, berukuran diameter 60-450 μm. Gejala ikan terserang Cryptocaryon irritans yaitu ikan sering menggosok-gosokan tubuhnya pada benda yang ada disekitarnya, terbentuk cysta berwarna putih pada permukaan tubuh, dan meningkatnya produksi mukus berlebihan pada ikan (Kuncoro, 2004). Menurut Anshary (2008), efek secara umum akibat infeksi Cryptocaryon irritans pada ikan yaitu gangguan osmoregulasi, kehilangan nafsu
makan, dan sel epithel insang dan kulit ikan yang terinfeksi menjadi hyperplastik dan mengalami kerusakan serius. Siklus hidup Cryptocaryon irritans terdiri dari empat stadia yaitu theront, trophont, tomont dan cyst (Gambar 3).
Theront merupakan fasedewasa dari Cryptocaryon irritans. Pada fase ini theront
berenang di air menggunakan ciliata. Jika theront dapat menemukan inangnya dalam waktu 24 jam maka, theront menembus jaringan epidermis dan insang. Pada fase ini, theront akan berubah menjadi fase trophont. Parasit pada fase trophont akan mencapai tingkat kematangannya stelah 4-7 hari, kemudian parasit
ini akan berenang bebas di air (fase tomont). Tomont yang berenang di air akan mencari substrat untuk menempel. Pada substrat inilah tomont akan berubah menjadi cyst. Di dalam cyst akan terjadi perbanyakan sel setelah 7-10 hari, sehingga theront akan lepas dalam jumlah banyak dan kembali menginfeksi ikan (Kuncoro, 2004).
2.3.2 Amyloodinium ocellatum
Amyloodinium ocellatum adalah parasit dari golongan Dinoflagelata dari famili Dinophyceae yang juga merupakan makroalga. Amyloodinium ocellatum memiliki
ukuran tubuh 0,002-0,1 mm, sedangkan pada fase tropon dewasa dapat mencapai ukuran diameter 120 µm. Parasit Amyloodinium ocellatum menyebabkan penyakit yang disebut Amyloodiniasis atau penyakit velvet. Parasit ini melekat pada jaringan inang pada bagian kulit dan insang dengan menggunakan stalk atau peduncle yang pendek dan pada bagian ujungnya terdapat rhizoid dan stomopode
mirip tentakel yang dapat bergerak (Anshary, 2008).
beludru yang menutupi tubuhnya. Pada tingkat akut Amyloodinium ocellatum akan masuk kedalam insang, sehingga menyerang sistem pernafasan. Setelah menyerang sistem pernafasan, maka Amyloodinium ocellatum dapat menyebabkan kematian ikan. Anshary (2008), juga menyebutkan bahwa Amyloodinium ocellatum dapat menyebabkan kematian pada ikan dalam waktu setengah hari.
Perubahan histopathology yang tampak pada insang terinfeksi adalah terjadinya disintegrasi pada insang, hyperlasia epitel insang yang berat dan sel mukus berkurang atau tidak ada sama sekali. Efek pada inang kemungkinan diperparah oleh adanya toksin yang dikeluarkan oleh Amyloodinium ocellatum.
Siklus hidup Amyloodinium ocellatum berlangsung selama 7-10 hari. Pada perkembangan awal, larva akan menempel pada kulit dan insang ikan. Bentuk larva ini sulit dilihat dengan mata telanjang. Setelah beberapa hari menempel, larva ini akan menjadi dewasa yang disebut trophont dan akan menghasilkan kista hingga 256 ekor. Kista inilah yang akan berubah menjadi tomit yang dapat berenang bebas untuk mencari inang atau ikan baru. Tomit ini akan berubah menjadi fase trophont jika mendapatkan inang baru. Tomit mampu bertahan selama 1-2 hari di luar tubuh ikan sebelum mendapatkan inang baru. Jika tidak dapat menemukan inang baru maka tomit akan mati (Kuncoro, 2004).
2.3.3 Brooklynella hostilles
Brooklynella hostiles adalah protozoa dari Phylum Ciliophora yang biasanya
yang terserang Brooklynella hostillis yaitu ditandai dengan adanya bercak lendir putih pada tubuh, produksi lendir berlebih, bernapas dengan cepat, lesu, tidak nafsu makan ikan, dan warna tubuh ikan abnormal. Pada tingkat akut ikan yang terserang Brooklynella hostillis akan menyerang dan merusak bagian epitel sel pada insang dan kulit. Kerusakan epitel pada insang ini akan mengakibatkan laju respirasi meningkat dan ikan sulit bernafas. Selain itu, ikan juga mengeluarkan lendir dalam jumlah banyak karena kerusakan epitel kulit. Lendir ini akan menyelimuti seluruh bagian tubuh ikan. Anshary (2008), menngemukan bahwa Brooklynella hostillis dapat menyebabkan terjadinya infeksi sekunder oleh
bakteri.
Brooklynella hostillis memiliki siklus dua bagian hidup yang meliputi tahap
berenang bebas dan menempel pada inang. Pada tahap berenang bebas Brooklynella hostillis akan mencari inang, setelah itu menempel pada inang dan
mendapatkan makanan pada inang. Pada tubuh inang inilah Brooklynella hostillis berkembang biak dengan pembelahan biner yang diikuti dengan konjugasi. Hal inilah yang menyebabkan perkembangbiakan Brooklynella hostillis lebih cepat dibandingkan Cryptocaryon irritans dan Amyloodinium ocellatum. Sehingga kematian ikan akibat Brooklynella hostillis dapat terjadi dalam hitungan hari saja.
2.4Kondisi Lingkungan Penyebab Timbulnya Parasit
ketahanan tubuh. Hal inilah yang dapat memicu timbulnya serangan penyakit infeksi. Adapun kondisi lingkungan penyebab timbulnya parasit pada ikan baik secara langsung dan tidak langsung yaitu bahan organik, suhu, nutrien, salinitas, amoniak, nitrit, dan nitrat.
2.4.1 Bahan Organik
Irianto (2005) mengemukakan bahwa, pengaruh bahan organik di perairan terhadap ikan adalah penurunan resistensi tubuh ikan. Penurunan resistensi tubuh ikan dipicu disebabkan partikel-partikel dari bahan organik mengganggu insang atau merusak insang ikan, yang akan mengakibatkan ikan memproduksi mukus berlebih. Bahan organik juga berdampak pada peningkatan jumlah alga di perairan. Melimpahnya jumlah alga dapat menurunkan kadar oksigen di perairan. Rouse (1979), menyatakan bahwa ikan rentan terserang parasit jika kandungan oksigen diperairan < 4 mg/l tiap harinya. Oksigen diperlukan ikan untuk katabolisme energi bagi metabolisme, aktivitas dan survivalitas ikan. Dengan demikian minimnya kadar oksigen dapat menurunkan daya survivalitas ikan. Penurunan survivalitas ikan dapat disebabkan tingkat stres yang tinggi pada ikan yang berakibat ikan mudah terserang penyakit.
2.4.2 Suhu
kandungan oksigen yang lebih tinggi dibandingkan pada suhu tinggi, ikan juga dapat mengalami stres pernafasan sehingga ikan lebih rentan terserang penyakit infeksi parasit (Tang dan Neson, 1998).
2.4.3 Nutrien
Nutrien pada tubuh ikan berperan sebagai sumber energi pada tubuh ikan yang digunakan untuk metabolisme, respirasi hingga pembentuk sistem imun tubuh ikan. Nutrien buruk menyebabkan penurunan sistem imun tubuh, sehingga mudah terserang penyakit infeksi (Irianto, 2005).
2.4.4 Salinitas
Salinitas adalah salah satu penyebab penyakit non infeksi pada ikan. Pada kondisi salinitas tinggi >20 ppt ikan rentan terkena penyakit. Hal ini disebabkan karena kadar garam tinggi menyebabkan gas-gas kurang terlarut, sehingga terjadi penurunan kadar oksigen dalam air. Pada air tawar dengan salinitas 0 ppt pada suhu 300 C memiliki kelarutan oksigen sebesar 7,6 mg/liter, sedangkan pada air laut dengan salinitas 30 ppt kelarutan oksigen sebesar 6,1 mg/liter. Pada kondisi seperti inilah ikan rentan terkena penyakit infeksi (Irianto, 2005)
2.4.5 Amoniak, Nitrit dan Nitrat
darah banyak mengikat methemoglobin yang mengakibatkan darah berwarna kecoklatan (brown blood disease). Sedangkan kandungan nitrat yang tinggi dapat berakibat gangguan pertumbuhan dan kesehatan pada ikan (Irianto, 2005).
2.5Pemantauan Penyakit Parasit di Lampung
Pemantauan penyakit ikan bertujuan untuk mengidentifikasi dan menginventarisasi penyebaran hama penyakit ikan. Pemantauan penyakit parasit di Provisi Lampung dilakukan oleh Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Lampung. Hasil dari pemantauan penyakit parasit di Lampung dalam kurun waktu empat empat tahun terakhir menunjukkan beberapa jenis parasit yang menyerang ikan-ikan air laut antara lain Hallotrema sp., Octolasmysmullery sp., Benedenia sp., Marphysa sp., dan Diplectanum sp.
Hingga tahun 2012, belum diketahui jenis parasit yang menyerang ikan badut (Amphiprion percula). Namun untuk jenis bakteri dan jamur yang menyerang ikan badut (Amphiprion ocellaris). sudah diketahui jenisnya yaitu bakteri Pseudomonas putida. Sedangkan jamur yang menginfeksi pada ikan badut adalah Laptolegnia sp. Jenis bakteri dan jamur ini diketahui dari hasil pemantauan
III. METODE PENELITIAN
3.1Waktu dan Tempat
Penelitian ini dilakukan pada bulan Februari sampai dengan April 2013, di Balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung.
3.2 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan dalam penelitian ini yaitu alat ukur kualitas air (pH meter, DO meter, termometer dan refraktometer), penggaris, timbangan digital, seser, kantong plastik, nampan plastik, 1 set alat bedah, mikroskop, tabung Erlenmeyer, beker glass, spektrofotometer, gelas ukur, kertas saring , gelas objek,
gelas penutup, pipet tetes, kamera, kertas label, peralatan aerasi, tisu, filter air, akuarium (81 cm x 44 cm x 54 cm), bak fiber persegi empat (150 cm x 71 cm x 48 cm), dan bak fiber lingkaran (150 cm x 100 cm).
3.2.2 Bahan
3.3 Metode Penelitian
Metode yang digunakan pada penelitian ini adalah metode eksploratif, yaitu sebuah metode penelitian yang bertujuan untuk mengekplorasi fenomena yang menjadi sasaran penelitian (Kuntjojo, 2009). Penelitian ini dilakukan dengan mengambil sampel ikan badut pada lokasi budidaya indoor, semi outdoor dan outdoor di BBPBL Lampung. Pada lokasi budidaya indoor, semi outdoor air
yang masuk ke unit budidaya di filter sebanyak dua kali, sedangkan pada lokasi budidaya outdoor air hanya difilter satu kali. Pada lokasi indoor densitas ikan sebanyak 2452 individu/m3, semi outdoor densitas ikan sebanyak 1403 individu /m3 dan outdoor densitas ikan sebanyak 74 individu/m3.
3.4 Pengambilan Data
Data yang diambil dibagi menjadi dua yaitu:
1. Data primer berasal dari data hasil pengamatan parasit pada ikan-ikan sampel, yang dilengkapi dengan data pendukung berupa data deskripsi lingkungan seperti kondisi cuaca dan parameter kualitas air (pH, DO, suhu, salinitas, NH3, dan NO2).
2. Data sekunder diperoleh dari data penyakit ikan yang berasal dari literatur, instansi pemerintah dan swasta.
3.5 Pelaksanaan 3.5.1 Persiapan
1. Persiapan alat dan bahan yang meliputi : alat ukur kualitas air (pH meter, DO meter, termometer dan refraktometer), penggaris, timbangan digital, seser, kantong plastik, nampan plastik, 1 set alat bedah, mikroskop, tabung Erlenmeyer, beker glass, spektrofotometer, gelas ukur, kertas saring , gelas
objek, gelas penutup, pipet tetes, kamera, kertas label, peralatan aerasi, tisu, filter air, akuarium (80 cm x 45 cm x 50 cm), bak fiber persegi empat (150 cm x 70 cm x 45 cm), bak fiber lingkaran (150 cm x 100 cm), air laut buatan, akuades, NaCl fisiologis, ethyl alkohol 70%, minyak cengkeh, oksidator, phenol, natrium nitroprusid, larutan pewarna, pakan ikan, dan 108 ekor ikan badut (Amphiprion percula) berukuran 3-5 cm.
2. Persiapan bak pemeliharaan outdoor : yaitu menggunakan bak fiber lingkaran (150 cm x 100 cm). Bak fiber dibersihkan dengan dicuci hingga bersih, kemudian dikeringkan. Bak ini digunakan sebagai tempat pemeliharaan ikan badut pada lokasi budidaya outdoor sehingga, memudahkan pengambilan sampel ikan badut.
3. Persiapan sampel ikan : ikan pada lokasi indoor dan outdoor berasal dari lokasi semi outdoor. Sampel ikan badut yang diambil dari lokasi indoor sebanyak 36 individu dari dipelihara total ikan yang sebanyak 331 individu. Sedangkan pada lokasi semi outdoor sampel ikan badut yang diambil sebanyak 36 individu dari 497 individu dan outdoor sebanyak 36 individu dari 65 individu dari total ikan yang dipelihara.
3.5.2 Lokasi Pengambilan Sampel
1. Indoor yaitu lokasi budidaya yang berada di ruangan, dengan dinding beton dan beratap berupa asbes. Pada lokasi indoor, ikan badut dipelihara pada akuarium-akuarium dan bak-bak fiber. Ikan badut yang digunakan sebagai sampel diambil pada lokasi indoor berasal dari satu buah bak fiber berkaki empat pada lokasi semi outdoor (Halaman 55).
2. Semi outdoor yaitu lokasi budidaya yang berada di luar ruangan tanpa dinding namun, masih beratap berupa asbes. Pada lokasi semi outdoor, ikan badut dipelihara pada bak-bak fiber. Ikan badut yang digunakan sebagai sampel diambil pada lokasi semi outdoor berasal dari satu buah bak fiber persegi empat (Halaman 55).
3. Outdoor yaitu lokasi budidaya yang berada di luar ruangan. Pada lokasi outdoor, ikan badut dipelihara pada bak bak fiber lingkaran (150 cm x 100
cm). Ikan badut yang digunakan sebagai sampel diambil pada lokasi outdoor berasal dari satu buah bak fiber berkaki empat pada lokasi semi outdoor (Halaman 55).
3.5.3 Pengambilan Sampel
Pengambilan sampel ikan badut yang dilakukan dengan cara :
1. Ikan badut diambil secara acak dari tiga lokasi budidaya yang sudah ditentukan (indoor, semi outdoor, dan outdoor).
2. Jumlah masing-masing sampel ikan yang diambil sebanyak 6 ekor/minggu/lokasi.
3.5.4 Pemeriksaan Parasit
Sebelum dilakukan pemeriksaan parasit, ikan dipingsankan dahulu dengan minyak cengkeh, kemudian bobot dan panjang ikan di ukur. Setelah itu, dilakukan deteksi tanda-tanda serangan dan mengidentifikasi penyebabnya berdasarkan tanda-tanda ikan yang terserang penyakit.
Pemeriksaan parasit pada ikan badut meliputi organ luar dan organ dalam, yaitu : 1. Organ luar meliputi : insang, operkulum, kulit dan sirip (Kabata, 1985). 2. Organ dalam meliputi : sistem pencernaan, hati, pankreas, dan jantung,
(Kabata, 1985).
Sedangkan metode yang dilakukan dalam pemeriksaan sampel parasit pada ikan yaitu :
3.5.4.1Pemeriksaan Organ Luar
Pemeriksaan organ luar dengan metode kerokan kulit dan metode mount insang. a. Metode kerokan kulit dengan cara :
a) Kulit dari bagian kepala sampai ekor dikerok dengan menggunakan scalpel bersih sehingga diperoleh campuran mucus,sel epidermis dan
parasit-parasit pada kulit. Kerokan kulit dilakukan dari sisi lateral dari tubuh, sirip belakang dan pangkal sirip.
b) Material hasil kerokan kulit diusapkan di atas gelas objek.
c) NaCl diteteskan di atas usapan dengan pipet tetes hingga merata dan ditutup dengan gelas penutup. Usapan tidak boleh tebal untuk memudahkan mengidentifikasi parasit, dan preparat harus bebas gelembung udara.
b. Metode mount insang dengan cara :
a. Sebagian insang diambil dari ikan dengan menggunakan pinset dan gunting hindari kerusakan filament untuk pemeriksaan sebanyak mungkin.
b. Kartilago filamen dipotong menggunakan scalpel. c. Potongan insang di tempatkan di atas gelas objek.
d. NaCl diteteskan pada preparat hingga merata, dan tutup dengan kaca penutup.
e. Preparat diperiksa di bawah mikroskop untuk memeriksa adanya parasit pada lamella (Santoso, 2008).
3.5.4.2Pemeriksaan Organ Dalam
Sebelum dilakukan pemeriksaan organ dalam, tubuh ikan dibedah terlebih dahulu. Kemudian seluruh organ yang ada dikeluarkan lalu disimpan dalam sebuah cawan petri yang berisi larutan fisiologis NaCl. Selanjutnya organ (sistem pencernaan, hati,
pankreas, ginjal, dan jantung) yang akan diperiksa dipisahkan dan ditempatkan dalam cawan petri yang berbeda. Pemeriksaan dilakukan dengan cara memeriksa isi
dan permukaan bagian dalam organ dan diamati dibawah mikroskop (Akbar, 2011).
3.5.5 Identifikasi Parasit
Hasil pemeriksaan parasit pada ikan badut akan akan diidentifikasi jenis parasitnya dengan mengacu pada buku parasit ikan Kabata (1985), Lom dan Dykova (1992), Hendrix (1994), dan Wiliams and Jones (1993).
3.6 Pengamatan Parameter Kualitas Air
dilakukan pengukuran dua kali/minggu pada pagi hari di masing-masing tempat pemeliharaan ikan badut (indoor, semi outdoor, dan outdoor). Sedangkan untuk NH3, dan NO2 dilakukan pengamatan seminggu sekali.
3.7 Analisis Data
Data hasil penelitian akan disajikan dalam bentuk gambar dan tabel, dan dianalisis secara deskriptif (Steel and Torrie, 1993). Berdasarkan hasil identifikasi parasit pada ikan badut (Amphiprion percula), akan dihitung :
3.7.1 Prevalensi
Prevalensi adalah jumlah hewan yang terinfeksi oleh penyakit pada waktu tertentu, dibandingkan dengan total hewan sampel pada waktu tersebut (Cameron, 2002). Perhitungan angka prevalensi parasit menurut Cameron (2002), sebagai berikut :
Prevalensi menunjukkan besarnya persentasi ikan yang terinfeksi parasit. Kategori always atau selalu menggambarkan bahwa parasit selalu menginfeksi ikan dan
tingkat infeksi parasit yang ditimbulkan sangat parah (99-100%). Kategori almost always atau hampir selalu menggambarkan bahwa parasit hampir selalu
menginfeksi ikan dan tingkat infeksi parasit yang ditimbulkan parah (98-99%). Kategori usually atau biasanya menggambarkan bahwa parasit biasanya menginfeksi ikan (70-89%). Kategori frequently atau sering kali menggambarkan bahwa parasit tersebut sering kali menginfeksi ikan (50-69%). Kategori commonly atau biasa menggambarkan bahwa parasit tersebut biasa menginfeksi ikan (30-49%). Kategori often atau sering menggambarkan bahwa parasit tersebut sering menginfeksi ikan (10-29%). Kategori occasionally atau kadang-kadang menggambarkan bahwa parasit kadang-kadang menginfeksi ikan. Kategori rarely atau jarang menggambarkan bahwa parasit tersebut jarang menginfeksi ikan (0,1-<1%). Kategori very rarely atau sangat jarang menggambarkan bahwa parasit tersebut sangat jarang menginfeksi ikan (0,01-<0,1%). Kategori almost never atau tidak pernah menggambarkan bahwa parasit tersebut tidak pernah menginfeksi ikan.
Frequency of Infection
Always = 100-99%
Almost always = 98-90%
Usually = 89-70%
Frequently = 69-50%
Commonly = 49-30%
Often = 29-10%
3.7.2 Intensitas
Intensitas adalah jumlah parasit yang menyerang ikan pada waktu tertentu dibandingkan dengan jumlah total ikan yang terinfeksi (Cameron, 2002). Intensitas parasit dihitung menurut Cameron (2002), dengan menggunakan rumus:
3.7.3 Indeks Sorensen
Indeks Sorensen pada penelitian ini digunakan dilakukan untuk mengetahui kesamaan parasit antar lokasi budidaya (indoor, semi outdoor, dan outdoor). Adapaun rumus Indeks Sorensen munurutOdum (1993) yaitu:
Keterangan :
S = Indeks Sorensen
a = Jumlah spesies ada di A dan B
III. SIMPULAN DAN SARAN
5.1Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat disimpulkan bahwa :
1. Jenis parasit yang menginfeksi ikan badut (Amphiprion percula) antara lain Trichomonadidae, Microcotyle sp., Plectanocotylidae, Trichodina sp. dan Secernentea.
2. Infeksi parasit dapat dijumpai pada ikan badut di semua lokasi budidaya baik indoor, semi outdoor, dan outdoor.
5.2Saran
Dari hasil penelitian dapat disarankan yaitu :
1. Perlu dilakukan identifikasi parasit dengan metode yang lain untuk memastikan jenis parasitnya.
DAFTAR PUSTAKA
Akbar, J. 2011. Identifikasi Parasit Pada Ikan Betok (Anabas testudieus). Bioscientiae. 8 (2): 36-45.
Akmirza. A. 2013. Monogeneans of Fish Near Gökçeada, Turkey. Turkish Journal of Zoology. 10.3906/zoo-1205-4.
Allen G.R. 1991. Damselfishes of the World. Melle (Mergus). 271 pp.
Anonim. 2009. Juknis Budidaya Laut No.16 : Budidaya Clownfish (Amphiprion). Departemen Kelautan dan Perikanan. Direktorat Jenderal Perikanan Budidaya. Balai Besar Pengembangan Budidaya Laut Lampung. 100pp.
Anshary, H. 2008. Modul Pembelajaran Berbasis Student Center Learning (SCL) Mata Kuliah Parasitologi Ikan. Lembaga Kajian dan Pengembangan Pendidikan (LKPP) Makasar. 126 pp.
Badan Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan. 2011. Kompilasi Hasil Pemantauan Daerah Sebar Hama Penyakit Ikan (HPI) dan Hama Penyakit Ikan Karantina (HPIK) Sumatera II. Kementrian Kelautan dan Perikanan. 61 pp.
Baker, D.G. 2007. Flynn’s Parasites of Laboratory Animals. 2nd Edition. Blackweel Publishing. USA. 844 pp. University of Malaysia. CABl Publishing. 365 pp.
Burrows, R.E. 1964. Effect of Accumulated Exretory Products on Hatchery Reared Salmonids. Research Report of U.S. Fisheris and Wildlife Services No. 66 : 12 – 23.
Cameron, A. 2002. Survey Toolbox for Aquatic Animal Disease, A Pratical Manual and Software Package. ACIA Monograph No 94. 377 pp.
Davis, H. S. 1947. Studies of The Protozoan Parasites of Fresh Water Fishes. Fishery Bulletin 41 from From Fishery Bulletin of the Fish, and Wildlife Service 51. United States Goverment Printing Office. Washington. 61 pp.
Diba, D.F. 2009. Prevalensi dan Intensitas Infestasi Endoparasit Berdasarkan Hasil Analisis Feses Kura-kura Air Tawar (Coura amboinensis) di Perairan Sulawesi Selatan. Tesis. Sekolah Pascasarjana. Institut Pertanian Bogor. Bogor. 47 pp.
Effendi, H. 2000. Telaah Kualitas Air Bagi Pengelolaan Sumberdaya dan Lingkungan Perairan. Jurusan Manajemen Sumberdaya Perairan. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor.
Fautin, D.G. and G.R. Allen. 1992. Field Guide to Anemonefishes and Their Host Sea Anemones. Australia, Western Australian Museum.
Fidyandini H.P, S. Subekti., dan Kismiyati. 2012. Identifikasi dan Prevalensi Ektoparasit pada Ikan Bandeng (Chanos hhanos) yang Dipelihara di Karamba Jaring Apung UPBL Situbondo dan di Tambak Desa Bangunrejo Kecamatan Jabon Sidoarjo. Journal of Marine and Coastal Science. 1(2): 91 – 112.
Gong, J. and W. Song. (2006). Description of a New Marine Cyrtophorid Ciliate, Brooklynella sinensis n. sp. from the China Sea with a New Definition of the Genus Brooklynella (Protozoa, Ciliophora, Cyrtophorida). Zootaxa 1113: 41–49.
Hendrix S.S. 1994. Marine Flora and Fauna of the Eastern United States Platyhelminthes: Monogenea. NOAA Technical Report NMFS 121. 112 pp.
Trichodina sp. pada Ikan Manvis (Pterophyllum scalare). Prosiding Seminar Nasional XI PERSADA.
Irianto, A. 2005. Patologi Ikan Teleostei. Gadjah Mada University Press. Jogyakarta.
Kabata, Z. 1985. Parasites and Diseases of Fish Cultured in the Tropics. Taylor and Francis, London and Philadelphia. 303 pp.
Kim, K.H., and J.B. Cho. 2000. Treatment of Microcotyle sebastis (Monogenea: Polyopisthocotylea) infestation with praziquantel in an experimental cage simulating commercial rockfish Sebastes schlegeli culture conditions. Diseases of Aquatic Organisms. 40: 229-231.
[KKP] Kementerian Kelautan dan Perikanan. 2012. Statistik Ekspor Hasil Perikanan 2011. Buku I. Pusat Data, Statistik dan Informasi Sekretariat Jenderal Kementerian Kelautan dan Perikanan. 509 pp.
Kuncoro, EB. 2004. Akuarium Air Laut. Kansius. Yogyakarta.
Kuntjojo. 2009. Metodologi penelitian. Universitas Nusantara PGRI Kediri . 60 pp.
Lafferty, K.D. 2011. Fish Parasites and Food Webs. Bulletin of Marine Science. 89(1):123–134.
Lia, R.P., Zizzo, N., Tinelli, A., Lionetti, A., Cantacessi, C. and D. Otranto. 2007. Mass mortality in wild greater amberjack (Seriola dumerili) infected by Zeuxapta seriolae (Monogenea: Heteraxinidae) in the Ionian Sea. Bull. Eur. Assoc. Fish. 27(3): 108–111.
Lieske, E. and R. Myers. 2001. Reef fishes of the world. Periplus Editions. Singapore. 400 pp.
Lom, J. and I. Dykova. 1992. Protozoan Parasites of Fishes. Developments in Aquaculture and Fisheries Science, Vol. 26. Elsevier, Amsterdam, 315 pp.
Michael, S.W. 2008. Damselfishes and anemone fish. Reef Fishes Series Book 4. TFH Publication. Neptune City.
Montero, F.E., S. Crespo, F. Padros, F. De la Gandara, A. Garci, and J.A. Raga. 2004. Effects of the gill parasite Zeuxapta seriolae (Monogenea: Heteraxinidae) on the amberjack Seriola dumerili Risso (Teleostei: Crangidae). Aquaculture. 232(1–4): 153–163.
Moraes, F.R. and M.L. Martins. 2004. Condições predisponentes e principais enfermidades de teleósteos em piscicultura intensiva. In: Cyrino, J.E.P.; Urbinati, E.C.; Fracalossi, D.M.; Castagnolli, N. (Ed.). Tópicos Especiaisem Piscicultura de Água Doce Tropical Intensiva. São Paulo: Edit. Tecart..343-386 pp.
Mulia, D.S. 2006. Tingkat Infeksi Ektoparasit Protozoa pada Benih Ikan Nila (Oreochromis niloticus) di Balai Benih Ikan (BBI) Pandak dan Sidabowa, Kabupaten Banyumas. Jurnal Sains Akuatik 10 (1). 11 pp.
Odum, E.P. 1993. Dasar-Dasar Ekologi. Penerjemahan: Samingan, T dan B. Srigandono. Gajahmada University Press. Yogyakarta. 697 pp.
Ogut, H. and Palm, H.W. 2005.Seasonal Dynamics of Trichodina sp. on Whiting (Merlangius Merlangus) in Relation to Organic Pollution on The Eastern Black Coast of Turkey. Parasitol. Res., Berlin, 96: 149-153.
Piazza R.S., M.L Martin., L. Uiraldelli, and M.M. Yamashita. 2006. Parasitic Diseases of Freshwater Ornamental Fishes Commercialized in Florianópolis, Santa Catarina, Brazil. B. Inst. Pesca, São Paulo, 32(1): 51 – 57.
Randall, J. E and D.G. Fautin. 2002. Fishes Other Than Anemonefishes That Associate With Sea Anemones.Coral Reefs, 21:188–190 pp.
Rouse, R.D. 1979. Water Quality Management In Pond Fish Culture. Research and Development Series No. 22. Auburn University. Alabama. 32 pp.
Sachlan, M. 1972. Penyakit Ikan. Direktorat Jendral Perikanan. Departemen Pertanian. Bogor. 61 pp.
Santoso, L. 2008. Identifikasi Parasit Pada Ikan Kerapu Macan (Epinephelus fuscoguttatus) dalam Karamba Jaring Apung (KJA) di Teluk Lampung. Jurnal Penelitian Perikanan. 11 (2) : 7 pp.
Smith, S. and M. Schwarz. 2009. Commercial Fish & Shellfish Technology Fact Sheet Dealing with Trichodina and Trichodina-like species. College of Agriculture and Life Sciences. Virginia Polytechnic Institute and State University. 3 pp.
Stasiun Karantina Ikan Kelas II Panjang Lampung. 2008. Laporan Pemantauan Daerah Sebar Hama Penyakit Ikan (HPI) dan Hama Penyakit Ikan Karantina (HPIK) Provinsi Lampung. Stasiun Karantina Ikan Kelas 1 Panjang Lampung. 24 pp.
Stasiun Karantina Ikan Kelas I Panjang Lampung. 2009. Laporan Pemantauan Daerah Sebar Hama Penyakit Ikan (HPI) dan Hama Penyakit Ikan Karantina (HPIK) Provinsi Lampung. Stasiun Karantina Ikan Kelas 1 Panjang Lampung. 33 pp.
Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Lampung. 2012. Laporan Pemantauan Daerah Sebar Hama Penyakit Ikan (HPI) dan Hama Penyakit Ikan Karantina (HPIK) Provinsi Lampung. Stasiun Karantina Ikan, Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Lampung. 52 pp.
Steel R.G.D. and J.H.Torrie. 1993. Prinsip Prosedur Statistika. Terjemahan Oleh Bambang Sumantri. Gramedia Jakarta. 747 pp.
Thoney, D.A. 1986. Post-larval growth of Microcotyle sebastis (Platyhelminthes: Monogenea), a gill parasite of black rockfish. Trans Am Microsc Soc. 105:170-181.
Williams, E. H., Jr. and L. Bunkley-Williams. 1996. Parasites of offshore big game fishes of Puerto Rico and the western Atlantic. Puerto Rico Department of Natural and Environmental Resources, San Juan, PR, and the University of Puerto Rico, Mayaguez, PR, 382 pp.
Williams, H. and A. Jones. 1994. Parasitic Worms of Fish. Taylor and Francis Ltd, London. 593 pp.
Wiyatno F.H., S. Subekti, dan R. Kusdarwati. 2012. Identifikasi dan Prevalensi Ektoparasit pada Ikan Kerapu Tikus (Cromileptes altivelis) di Karamba Jaring Apung Unit Pengelola Budidaya Laut Situbondo. Jurnal Ilmiah Perikanan dan Kelautan. 4 ( 1): 6 pp.
Yasir, I., Syafiuddin, dan Sumarjito. 2010. Identifikasi Jenis Ikan Anemon (Amphiprioninae) dan Anemon Simbionnya di Kepulauan Spermonde, Sulawesi Selatan. Jurnal Ilmu dan Teknologi Kelautan Tropis. 2(2): 10-16.