LAMPIRAN A
BAHAN DAN PERALATAN
A.1.1. Bahan yang Digunakan Pada Pembuatan Slurry
LiFePO4 Super P
DMAC PVDF Aseton
Alumunium Foil Separator A.2.1 Peralatan Pada Pembuatan Slurry
Hot Plate
Termometer Pinset & Spatula Timbangan Digital
A.2.2 Peralatan Pada Pembuatan Lembaran dan Assembly baterai
Sendok Beaker Glass
Doctor Blade Pisau Ukur
Oven untuk pengeringan Mesin Calendering
Glove Box
Oven tempat penyimpan lembaran Glove Box
LAMPIRAN B
PEMBUATAN BATERAI LITHIUM COIN
Pembuatan slurry Slurry
Lembaran dipotong coin Baterai Coin didalam Holder
LAMPIRAN C HASIL UJI MORFOLOGI
C.1 Hasil Uji Mikroskop Optik
C.1.1 Hasil uji mikroskop optik variasi waktu pencampuran
tmix = 3 jam tmix = 5 jam tmix = 7 jam
C.1.2 Hasil uji mikroskop optik variasi suhu pencampuran
C.1.3 Hasil uji mikroskop optik variasi suhu pengeringan
Tdry = 80˚C Tdry = 100˚C Tdry = 120˚C
C.2 HASIL UJI SEM
C.2.1 Hasil morfologi lembar katoda LiFePO4 dengan SEM pada sampel
variasi waktu pencampuran 3 jam
Perbesaran 5.000 kali
Hasil mapping mixing pada sampel
C.3 Hasil SEM cross-section
Tmix=29˚C Tmix= 50˚C
Super P
LiFePO
4Tmix= 50˚C
LAMPIRAN D
D.1 Perhitungan Komposisi bahan LiFePO4
LiFePO
: Super P : PVDF = 85 : 10 : 5 4
Super P = 10
85 � 5 ����= 0,588 ���� = 5 gram
PVDF = 5
85 � 5 ����= 0,294 ����
D.2 Tabel massa LiFePO4 pada lembaran coin
Sampel Massa Laminate
D.2.2Tabel massaLiFePO4 pada lembaran coin untuk variasi suhu pencampuran
Sampel Massa Laminate (g)
D.2.3Tabel massa LiFePO4 pada lembaran coin untuk variasi suhu pengeringan
Sampel Massa Laminate (g)
D.3 Mencari Luas coin Jari – jari coin = 0,7 cm Luas coin = πr2
= 22
D.4 Mencari massa LFP (gram)
D.5 Menghitung Spesifik Kapasitas Discharge
D.5.1 Menghitung Spesifik Kapasitas Discharge untuk variasi waktu pencampuran
D.5.2 Menghitung Spesifik Kapasitas Discharge untuk variasi suhu pencampuran
Spesifik Kapasitas =��������� ����� ��� Untuk sampel S1
Spesifik Kapasitas =0,0107
0,0042
= 2,53
��ℎ
/
g
DAFTAR PUSTAKA
Anies.dkk. 2011. Studi Awal Sintesis Material Katoda Lithium Besi Fosfat (LiFePO4
Armand, M., Tarascon, J.M. 2008.Building Better Batteries.Nature.451: 652-657.
) dengan Metode Solvotermal pada Konsentrasi Tinggi. Tangerang : Puspiptek serpong.
Buchmann, Isidor. 2001. Batteries in a Portable World. Cadex Electronics Inc. Guan Wang, Yan Cheng, Manming Yan, Zhiyu Jiang. 2006. Li0.99FeTi0.01PO4
H. Li, Y.-M. Chen, X.-T.Ma, J.-L.Shi, B.-K.Zhu, L.-P.Zhu, 2011. Gel Polymer Electrolytes Based on Active PVDF Separator for Lithium Ion Battery. I: Preparation and Property of PVDF (Polydimethyl Siloxane) Blending Membrane, J. Membr. Sci 379 : 397–402.
/C Composite as Cathode Material for Lithium Ion Battery.
Kartawidjaja. M, Abdurrochman. A, Rumeksa. E. 2008. Prosiding Seminar Nasional Sains dan Teknologi-II 2008. Lampung: Universitas Lampung: 105-115.
Kahn, Bruce E., 2002, Hand Out Scanning Electron Microscope.
Kim, J.K., Choi, J.W., Chauhan, G.S., Ahn, J.H., Hwang, G,Ch., Choi,J.B., Ahn, H.J., 2008. Enhancement of Electrochemichal Performance of Lithium Ion Phospate by Controlled Sol-Gel Synthesis.Electrochemichal Acta. 55: 8258-8264.
Kittel, C., 1996. Introduction to Solid State Physics Seventh Edition.John Willey & Sons. United States Of America.
Klug, H. P. & Alexander, L. E. 1974. X-ray Diffraction Procedures: for Polycrystalline and Amorphous Materials. 2nd edn, Wiley, New York.
Manjunatha, H; Suresh, G.S; Venkatesha, T.V,. 2011. Electrode Materials for Aqueous Rechargable Lithium Batteries.Journal of Solid State Electrochem.15, 431-445.
Myounggu, Park., Zang, X., Chung, M., Less, G.B., Sastry, A.M. 2010. A Review Of Conduction Phenomena in Li-Ion Batteries. Journal of Power Source Vol 195 hal 7904 – 7929.
Padhi, K., K.S. Nanjundaswamy, and J.B. Goodenough. 1997. Phospoolivine as Positive Electrode Material for Rechargeable Lithium Batteries. J. Electrochem. Soc 144:1189-1194.
Prihandoko, Bambang. 2007. Pemanfaatan Soda Lime Silica dalam Pembuatan Komposit Elektrolit Baterai Lithium.Disertasi.Fakultas Teknik Universitas Indonesia.
Priyono, Slamet. 2014. Sintesis Serbuk LI4TI5O12
Smallman, R.E. dan Bishop, R.J., 2000.Metalurgi Fisik Modern dan Rekayasa Material.Erlangga. Jakarta.
yang Didoping Atom Al dan Na untuk Anoda Baterai Ion Lithium. Tesis.Depok : UI.
Subhan, A. 2011.Fabrikasi dan Karakterisasi Li4Ti5O12
Subhan, A. Dkk. 2014.Pengujian Serbuk Komersial LiFePO4 Sebagai Bahan Aktif KatodaBaterai Lithium Untuk Mobil Listrik Nasional. Tanggerang Selatan : LIPI.
untuk Bahan Anoda Baterai Lithium Keramik.Tesis.Depok :Universitas Indonesia.
S. Jouanneau, A. Le Gal La Salle, A. Verbaere., D. Guyomard M. Deschamps., S. Lascaud., 2002, Journal of New Materials for Electrochemical Systems, New Mg and Ca exchanged derivatives of Li1.1V3O8: Synthesis, characterization andlithium insertion behavior, Laboratoire de Chimie des Solides, J. New. Mat. Electrochem. Systems,p. 5, 191-196.
Thompson, Mitchell L. 2002. On the Material Properties and Constitutive Equations of Piezoelectric Poly Vinylidene Fluoride (PVDF).Doctor of Philosophy Thesis, Drexel University.
Tsutomu Ohzuku, et al., 1995. Factor Affecting The Capacity Retention Of Lithium-Ion Cells. J Power Sources, 54: 99-102.
Waluyo, Hendro dan Noerochiem, Lukman.2014. Pengaruh Temperatur Hydrothermal terhadap Performa Elektrokimia LiFePO4
Xu, Bo, et. al. 2012 Rencent Progress in Cathode Materials Research for Advanced Lithium Ion Batteries, Journal of Materials Science and Engineering R, 73, 51-65.
sebagai Katoda Baterai Ion Lithium Type Aqueous Elektrolit. Jurnal Teknik POMITS. Vol. 3, No. 2 : 2337-3539.
Yoshio, M. 2009. Lithium-Ion Batteries.Springer Science Bussines Media : Japan.
Zhang, Y., Huo, Q., Du, P., Wang, L., Zhang, A., Song, Y., Lv, Y., Li, G., 2012. Advances in New Cathode Material LiFePO4 for Lithium Ion Batteries.Synthetic Metals. Vol. 162 1315 – 1326.
11.00 WIB.
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Tempat penelitian dilakukan di Laboratorium Baterai Pusat Penelitian Fisika (P2F) Serpong Tanggerang Selatan. Penelitian dimulai pada 5 Februari 2015 sampai 5 Mei 2015. Penelitian dilakukan dari penyiapan bahan sampai pembuatan baterai dan pengujian baterai.
3.2 Peralatan dan Bahan Penelitian 3.2.1 Peralatan Penelitian
Adapun peralatan yang digunakan dalam penelitian ini antara lain : 1. Beaker glass
Fungsi : sebagai tempat pencampuran bahan menjadi slurry. 2. Cawan
Fungsi : sebagai tempat bahan. 3. Spatula
Fungsi : sebagai alat untuk mengambil dan memasukkan bahan. 4. Pipet Tetes
Fungsi : untuk menuangkan DMAC kedalam beaker glass. 5. Alumunium foil
Fungsi : untuk menutupi cawan agar serbuk LiFePO4
6. Termometer
tidak terkontaminasi dan menutupi beaker glass pada saat pembuatan slurry serta sebagai lapisan pada laminate.
Fungsi : untuk mengukur suhu ruangan. 7. Timbangan digital
Fungsi : untuk memanaskan dan mencampuran bahan sampai homogen. 9. Docter Blade
Fungsi : untuk membuat lembaran katoda. 10.Pisau ukur
Fungsi : untuk mengukur ketebalan slurry dengan lembaran. 11.Sendok Doctor Blade
Fungsi : untuk menaruh slurry pada lembaran. 12.Oven Coating
Fungsi : untuk mengeringkan slurry pada lembaran. 13.Oven
Fungsi : sebagai tempat penyimpanan lembaran. 14.Mesin calendering
Fungsi : sebagai alat press lembaran agar permukaan material aktif lebih padat.
15.Baki
Fungsi : sebagai wadah untuk lembaran katoda didalam oven. 16.Pinset
Fungsi : untuk menggambil magnetic stirrer pada slurry. 17.Pisau/Gunting
Fungsi : alat untuk memotong lembaran aluminium foil. 18.Penggaris
Fungsi : untuk mengukur lembaran aluminium foil. 19.Glove Box
Fungsi : tempat untuk assemblling baterai.
3.2.2 Peralatan Karakterisasi
Adapun peralatan karakterisasi yang digunakan dalam penelitian ini yaitu : 1. XRD
Fungsi : untuk mengkarakterisasi struktur serbuk LiFePO 2. Mikroskop Optik
Fungsi : untuk mengkarakterisasi morfologi dari lembaran katoda LiFePO
3. SEM - EDS 4.
Fungsi : untuk mengkarakterisasi morfologi dari lembaran katoda LiFePO
4. CD (Charge/ Discharge) 4.
Fungsi : untuk menganalisiskapasitasdischarge pada baterai ion lithium.
3.2.3 Bahan
Adapun bahan- bahan yang digunakan dalam penelitian ini antara lain : 1. Serbuk LiFePO4
Fungsi : sebagai material aktif pembuatan katoda baterai lithium. (Lithium ferro phospat)
2. Lithium Metal
Fungsi : sebagai anoda. 3. LiPF
Fungsi : sebagai elektrolit. 6
4. Serbuk PVDF (Poly vinylidene fluoride)
Fungsi : sebagai perekat (Binder) pada proses pembuatan slurry dengan komposisi tertentu.
5. DMAC (N-N Dimethyl Acetamid )
Fungsi : sebagai pelarut pada proses pembuatan slurry. 6. Serbuk Super P
Fungsi : sebagai zat aditif. 7. Separator
3.3 Diagram Alir
3.3.1 Diagram Alir untuk variasi waktu pencampuran
XRD
LiFePO4 Super P PVDF
Ditimbang dan dimasukan kedalam beaker glass lalu di vacum di oven selama 1 hari
Dicampurkan LiFePO4, Super P dan PVDF dengan DMAC 20 mL pada kecepatan 200 rpm dan divariasikan waktu pencampurannya 3 jam, 5 jam dan 7 jam dengan suhu 29˚C
Slurry Katoda LiFePo4
Coating dengan ketebalan 150 μm
Dikeringkan dengan suhu 120˚C selama 3 jam Laminate Katoda LiFePo4
Calendering
Dipotong dengan bentuk coin cell
Assembling Coin Cell
Uji: Mikroskop Optik
SEM
3.3.2 Diagram Alir untuk variasi suhu pencampuran
XRD
LiFePO4 Super P PVDF
Ditimbang dan dimasukan kedalam beaker glass lalu di vacum di oven selama 1 hari
Dicampurkan LiFePO4, Super P dan PVDF dengan DMAC 20 mL pada kecepatan 200 rpm dan divariasikan suhu pencampuran 29˚C, 50˚C dan 60˚C selama 5 jam
Slurry Katoda LiFePo4
Coating dengan ketebalan 150 μm
Dikeringkan dengan suhu 120˚C selama 3 jam Laminate Katoda LiFePo4
Calendering
Dipotong dengan bentuk coin cell
Assembling Coin Cell
Uji: Mikroskop Optik
SEM
3.3.3 Diagram Alir untuk variasi suhu pengeringan
XRD
LiFePO4 Super P PVDF
Ditimbang dan dimasukan kedalam beaker glass lalu di vacum di oven selama 1 hari
Dicampurkan LiFePO4, Super P dan PVDF dengan DMAC 20 mL pada kecepatan 200 rpm dengan suhu pencampuran 60˚C selama 5 jam
Slurry Katoda LiFePo4
Coating dengan ketebalan 150 μm
Dikeringkan dengan variasi suhu 80˚C, 100˚C dan 120˚C selama 3 jam Laminate Katoda LiFePo4
Calendering
Dipotong dengan bentuk coin cell
Assembling Coin Cell
Uji: Mikroskop Optik
SEM
3.4 Prosedur Penelitian
Pada penelitian dalam pembuatan baterai coin ini yang divariasikan adalah waktudan suhu pencampuran pada saat pembuatan slurry dan suhu pengeringan pada lembaran katoda LiFePO4. Penelitian ini dilakukan dalam beberapa tahapan yaitu: persiapan, pembuatan slurry, penyetakan lembaran, calendering, pemotongan lembaran, pembuatan baterai dan pengujian baterai.
3.4.1 Persiapan
Bahan yang dipakai pada penelitian ini adalah LiFePO4, Super P dan PVDF yang merupakan bahan teknis. Serbuk LiFePO4 merupakan bahan utama untuk pembuatan baterai. Super P merupakan zat aditif yang berfungsi untuk menaikkan konduktivitas dari katoda LiFePO4. Serbuk PVDF yaitu sebagai matriks yang memperkuat katoda baterai ion lithium sekaligus menjadi lem perekat pada LiFePO4
1. Ditimbang bahan tersebut dengan timbangan digital dengan komposisi sebagai berikut : LiFePO
dengan zat aditif. Untuk mencampurkan ketiga bahan tersebut diperlukan pelarut, pelarut yang digunakan adalah DMAC.
4
2. Diberikan label sampelpada beaker glass dan lembar alumunium foil (30 cm x 15 cm). Ini berfungsiuntuk memudahkan penyebutan sampel dan mencegah kekeliruan dalam penyebutan sampel yang memiliki variasi waktu dan suhu pencampuranserta suhu pengeringan. Pemberian nama sampel dapat dilihat pada tabel 3.1 dibawah ini.
= 5 g, Super P = 0,58 g, PVDF = 0,29 g dan pelarut DMAC = 20 mL.
Tabel 3.1 Nama sampel pada lembaran alumunium foil untuk variasi waktu pencampuran
Sampel Tmix, tmix, Tdry, tdry
Tabel 3.1 Nama sampel pada lembaran alumunium foil untuk variasi suhu pencampuran
Tabel 3.1 Nama sampel pada lembaran alumunium foil untuk variasi suhu pengeringan
3. Bahan yang sudah ditimbang dan diletakkan didalam beaker glass dimasukkan kedalan oven selama 1 hari. Ini berfungsi untuk menghilangkan kadar air pada bahan.
3.4.2 Pembuatan Slurry
1. Diletakkan beaker glass diatas hot plate dan diatur kecepatan stirrer-nya 200 rpm. Pada pembuatan slurry ini yang akan divariasikan adalah suhu dan waktu pencampuran. Dimana waktu pencampuran yang akan divariasikan adalah 3 jam, 5 jam dan 7 jam dengan suhu 29˚C (suhu ruan gan) dan suhu pencampuran yang divariasikan adalah 29˚C, 50˚C dan 60˚C selama 3 jam. Sedangkan pada variasi suhu pengeringan, slurry dibuat dengan suhu pencampuran 60˚C selama 5 jam.
2. Dicampurkan PVDF dan DMAC didalam beaker glass dengan menggunakan magnetic stirrer diatas hot plate sampai larutan menjadi bening (± 30 menit).
Sampel Tmix, tmix, Tdry, tdry
2 29˚C, 5 jam, 120˚C, 3 jam 4 50˚C, 5 jam, 120˚C, 3 jam 5 60˚C, 5 jam, 120˚C, 3 jam
Sampel Tmix, tmix, Tdry, tdry
3. Dimasukan Super P sedikit demi sedikit dan teraduk selama ± 15 menit 4. DimasukkanLiFePO4 kedalam larutan sedikit demi sedikit juga. Super P
dan LiFePO4
5. Ditutup beaker glass dengan alumunium foil dan dibiarkan campuran tersebut teraduk.
dimasukan sedikit demi sedikit berfungsi agar campuran tersebut homogen.
3.4.3 Peyetakan lembaran/Sheet Casting 1. Dibersihkan Doctor blade dengan aseton.
2. Diukur ketebalan coating 150 μm dengan menggunakan pisau blade.
3. Diletakkan alumunium foil(30 cm x 15 cm) diatas docter blade kemudian alumunium tersebut di vacum dan dibersihkan dengan aseton.
4. Dituangkan slurry diatas alumunium foil sedikit demi sedikit dengan menggunakan sendok
5. Dijalankandocter blade dengan kecepatan rendah sampai aluminium foil terlapisi sempurna dengan slurry.
6. Dikeringkan lembaran katoda LiFePO4 didalam oven katoda. Pada variasi waktu dan suhu pencampuran pembuatan slurry, lembaran dikeringkan pada suhu pengeringan 1200C selama 3 jam sedangkan pada variasi suhu pengeringan, lembaran dikeringkan dengan suhu pengeringan 800C, 1000C dan 1200
7. Setelah lembaran kering (selama 3 jam) maka lembaran tersebut disimpan kedalam oven dengan suhu 40
C selama 3 jam
0
C. Penyimpananan lembaran katoda di oven bertujuan untuk menjaga agar bahan tidak terkontaminasi dengan kelembaban udara (bahan air) karena dapat menyebabkan bahan rusak.
3.4.4 Proses Calenderingdanpemotongan lembaran (Cutting)
calenderingdipotong kecil bentuk coin. Kemudian diuji mikroskop optik dan SEM untuk melihat morfologi dari lembaran katoda LiFePO4 lalu lembaran katoda dalam bentuk coin di assembling didalam glove box.
3.4.5 Assembling Coin Cell
BAB 4
HASIL DAN PEMBAHASAN
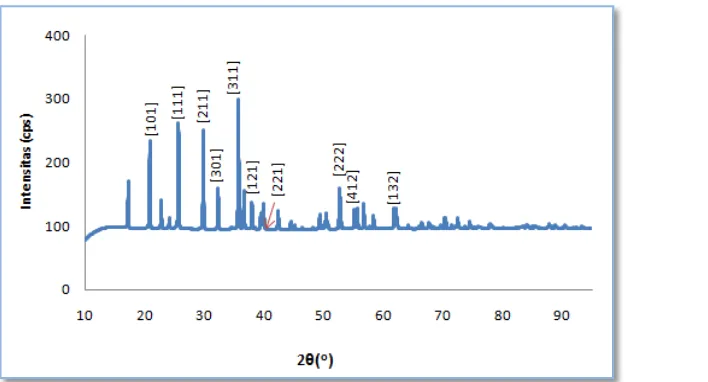
4.1 Analisa hasil XRD
Analisa XRD bertujuan untuk mengetahui struktur kristal pada serbuk LiFePO4. Analisa XRD yang ideal berdasarkan ICDD adalah memiliki nilai Chi2 ≤ 1,3 dan Rwp ≤ 10%. Chi2 merupakan nilai perbandingan antara intensitas observasi dan intensitas referensi sedangkan Rwp (Residu Weight Persent) adalah selisih dari puncak – puncak hasil XRD.Pada penelitian ini hasil analisa XRD pada serbuk LiFePO4 didapatkan nilai Chi2 = 1,0362 dan Rwp = 10,18 %. Hal ini menunjukkan bahwa serbuk LiFePO4
Gambar 4.1 menunjukkan hasil XRD struktur kristal yang terbentuk pada serbuk LiFePO
memenuhi standart analisis XRD yang ideal berdasarkan ICDD.
4 adalah orthorombik dimana ciri – ciri kristal orthorombik (a ≠ b ≠ c ; α= β= γ= 90˚) dengan parameter kisi pada serbuk LiFePO4 yaitu a = 10.329Å, b = 6,0067Å dan c = 4,6916Å serta memiliki sudut yang sama yaitu α = β = γ = 90˚. Dari grafik dapat dilihat dua indeks miler yang sejenis yaitu [111] dan [222]. Ini menunjukkan bahwa struktur kristal LiFePO4 yang terbentuk sudah teratur dan tidak ada karakteristik puncak dari pengotor yang terdeteksi pada hasil tersebut.
4.2 Analisa Hasil Pengujian Mikroskop Optik
Untuk melihat morfologi pada laminate katoda LiFePO4 dilakukan uji mikroskop optik pada sampel. Gambar 4.2 menunjukan hasil mikroskop optik pada 9 sampel dengan variasi waktu dan suhu pencampuran serta suhu pengeringan dengan perbesaran 40 kali.
(a) (b) (c)
(d) (e) (f)
(g) (h) (i)
Gambar 4.2Hasil mikroskop optik lembaran katoda LiFePO4 pada(a)tmix=3 jam, (b)tmix=5jam, (c)tmix=7jam (d)Tmix=29˚C,(e)Tmix=50˚C,(f)Tmix=60˚C, (g)Tdry=80˚C, (h)Tdry=100˚C dan(i)Tdry=120˚C.
lembar katoda LiFePO4. Dari semua sampel (9 sampel) terdapat butiran – butiran kecil berwarna putih dan hitam yang tersebar secara tidak merata pada laminate sampel. Dari hasil mikroskop optik pada setiap sampel tidak terlihat perbedaan struktuk mikro yang cukup signifikan karena semua sampel hampir terlihat sama. Hal ini dikarenakan perbesaran pada mikroskop optik yang digunakan yaitu 40 kali perbesaran. Sehingga dengan pengujian mikroskop optik tidak cukup untuk melihat kehomogenan pencampuran partikel pada lembaran katoda LiFePO4.Untuk hasil yang lebih baik dilakukan uji Scanning Electron Microscope (SEM).
4.3 Analisa Hasil SEM
Scanning Electron Microscope (SEM) digunakan untuk menganalisa morfologi lembaran katoda LiFePO4. Lembaran katoda LiFePO4 yang telah diuji mikroskop optik dilakukan uji SEM kembali, ini dikarenakan hasil mikroskop optik yang didapatkan tidak cukup jelas untuk melihat morfologi dari lebaran tersebut. Pada pengujian SEM ini, sampel yang di uji adalah sampel dengan waktu pencampuran 3 jam (sampel 1) untuk mewakili semua sampel. Ini dikarenakan pada hasil pengujian mikroskop optik, semua sampel memiliki struktur mikro yang hampir sama. Dan pada pengujian SEM cross-section, dilakukan pengujian dengan sampel variasi suhu pencampuran yaitu 29˚C, 50˚C dan 60˚C untuk melihat kerekatan laminate pada alumunium foil.
4.3.1 Hasil analisa morfologi lembar katoda LiFePO4
Pada Gambar 4.3 dapat dilihat hasil SEM morfologi lembaran katoda LiFePO dengan SEM
sampel, dimana beberapa partikel bergabung menjadi satu sehingga kelihatan seperti partikel yang besar. Hal inidikarenakan material LiFePO4, Super P dan PVDF pada lembaran LiFePO4 tidak tercampur homogen pada saat pembuatan slurry. Ketidak homogenannya pada saat pembuatan slurry terjadi karena pada sampel ini, waktu pencampuran yang digunakan adalah waktu pencampuran selama 3 jam (sampel 1) dengan suhu 290C (suhu ruangan), DMAC yang berfungsi sebagai pelarut tidak cukup panas untuk mencampur LiFePO4, Super P dan PVDF sehingga PVDF yang berfungsi sebagai perekat tidak terlarut dan mengakibatkan PVDF tidak mengikat LiFePO4
Dari hasil SEM mapping mixing (pencampuran) yang ditunjukkan pada Gambar 4.3 (d) dapat dilihat, warna biru tua menunjukkan unsur Fe yang mewakili LiFePO
dan Super P. Aglomerasi yang terjadi dapat menurunkan konduktifitas elektronik dari interkalasi/de-interkalasi ion lithium sehingga dapat mempengaruhi kapasitas baterai.
4, warna merah merupakan zat adiktif yaitu Super P dan warna hijau merupakan binder yaitu PVDF. Fe yang mewakili LiFePO4 terlihat hampir rata pada seluruh permukaan sedangkan zat aditif yaitu Super P yang memiliki fungsi untuk meningkatkan konduktifitas terlihat masih banyak terjadinya aglomerasi pada permukaan tersebut. Dan PVDF yang merupakan pengikat terlihat tersebar tidak merata pada permukaan. Karena PVDF tersebar tidak merata, maka PVDF tidak dapat mengikat unsur lain yaitu LiFePO4 dan Super P. Inilah yang menyebabkan laminate mudah terlepas dari alumunium foil.
(b)
(c)
(d)
Gambar 4.3 Morfologi sampel dengan perbesaran (a) 1000 kali (b) 5000 kali(c) 10000 kali (d) Hasil mapping mixing pada sampel.
PVDF
Super P
4.3.2 Hasil analisa SEM cross-section
Untuk melihat kerekatan laminate pada alumunium foil maka diuji SEM cross-section. Pada Gambar 4.4 dapat dilihat kerekatan laminate pada alumunium foil. Pada sampel dengan suhu pencampuran 29˚C (sampel 2) laminate pada alumunium foiltidak merekat dan terdapat celah begitu juga pada sampel dengan suhu pencampuran 60˚C (sampel 5), laminate pada alumunium foil tidak merekat sempurna dan masih ada celah kecil. Sementara pada suhu pencampuran 50˚C (sampel 4) laminate merekat sempurna pada alumunium foil.
Tidak merekat laminate pada alumunium foil sangat dipengaruhi oleh suhu pencampuran pada saat pembuatan slurry. Pada sampel dengan suhu pencampuran 29˚C (sampel 2) DMAC tidak dipanaskan sehingga PVDF tidak meleleh dan tidak larut dalam DMAC yang mengakibatkan PVDF tidak memiliki sifat plasticizer (sebagai perekat) sedangkan celah kecil/tidak merekat sempurna laminate pada alumunium foil pada sampel suhu pencampuran 60˚C (sampel 5) disebabkan karena terlalu panasnya suhu pencampuranpada saat pembuatan slurry yang menyebabkan DMAC lebih cepat menguap dan slurry kekurangan DMAC sehingga LiFePO4
Pada sampel dengan suhu pencampuran 50˚C (sampel 4) tidak ada lagi celah dan laminate merekat sempurna pada alumunium foil. Suhu yang paling baik diantara ketiga suhu tersebut agar laminate dan aluminium foil merekat sempurna adalah pada sampel saat suhu pencampuran 50˚C (sampel 4).
, Super P dan PVDF tidak terlarut sempurna.
(b)
(c)
4.4 Hasil Pengujian Charge/Discharge
Untuk mengetahui kapasitas discharge pada baterai LiFePO4 maka dilakukan pengujian charge/discharge. Kapasitas yang dihasilkan dari pengujian ini dinyatakan dalam satuan mAh. Dari kapasitas yang didapatkan, maka akan dibagi dengan massa material aktif tersebut. Ini dinyatakan dalam mAh/gr yang disebut spesifik kapasitas atau kapasitas energi. Pada pengujian ini baterai diberi arus 30 μA dan tegangan sebesar 2,5V – 3,5V dan data yang diambil adalah cycle ke-3. Dimana satu kali cycleadalah sama dengan satu proses charge (terjadinya reaksi oksidasi,dimana katoda melepaskan ion lithium dan elektron ke anoda) dan satu kali discharge (terjadinya reaksi reduksi,dimana ion lithium dan elektron masuk ke katoda). Dari sini yang akan di analisa adalah tegangan dan kapasitas discharge yang dialami oleh katoda LiFePO4, sehingga terbentuknya kurva tegangan (V) vs kapasitas (mAh/g).
4.4.1 Analisa charge/discharge dengan variasi waktu pencampuran
Variasi waktu pencampuran pada saat pembuatan slurry yang ditunjukan pada Tabel 4.1, dari ketiga sampel nilai kapasitas discharge pada sampel dengan waktu pencampuran selama 3 jam (sampel 1) yaitu 2,53 mAh/g yang merupakan kapasitas paling kecil pada variasi waktu pencampuran. Sementara pada sampel dengan waktu pencampuran 5 jam (sampel 2) didapatkan kapasitas discharge sebesar 3,23 mAh/g dan pada sampel dengan waktu pencampuran selama 7 jam (sampel 3) didapatkan kapasitas sebesar 3,74 mAh/g.
Tabel 4.1 Kapasitas discharge untuk variasi waktu pencampuran Waktu Pencampuran Kapasitas
(mAh/g)
3 jam 2,53
5 jam 3,23
Pada saat waktu pencampuran 3 jam (sampel 1) larutan yang dihasilkan tidak lebih homogen daripada waktu pencampuran 5 jam (sampel 2) dan 7 jam (sampel 3). Ketidak homogenannya larutan disebabkan oleh waktu dan suhu pencampuran slurry pada variasi waktu pencampuran ini. Pada waktu pencampuran selama 3 jam (sampel 1) dengan suhu yang digunakan adalah suhu 290C (sampel 2), DMAC yang berfungsi sebagai pelarut tidak terlalu panas untuk mecampur LiFePO4, Super P dan PVDF sehingga PVDF yang berfungsi sebagai perekat tidak terlarut dan mengakibatkan PVDF tidak mengikat LiFePO4 dan Super P. Sementara pada waktu pencampuran selama 5 jam (sampel 2) dan 7 jam (sampel 3), lembaran yang dihasilkan lebih homogen daripada waktu pencampuran 3 jam (sampel 1). Hal ini dikarenakan, meskipun suhu pencampuran rendah (290
Waktu pencampuran saat pembuatan slurry mempengaruhi kehomogenan slurry, dimana semakin lama waktu pencampuransaat pembuatan slurry maka semakin homogen slurry yang dihasilkan dan kualitas lembaran katoda yang didapatkan semakin baik sehingga kapasitas semakin tinggi. Grafik kapasitas discharge untuk variasi waktu pencampuran ditunjukkan pada Gambar 4.5.
C) (sampel 2) tetapi waktu pencampuran lebih lama sehingga larutan yang dihasilkan lebih terlarut. Ketidak homogennanya slurry akan mengakibatkan terjadi aglomerasi pada permukaan laminate tersebut yang menyebabkan menurunnya konduktivitas ion sehingga nilai kapasitas yang didapatkan rendah.
4.4.2Analisa charge/discharge dengan variasi suhu pencampuran
Kapasitas discharge yang optimal pada variasi suhu pencampuran terdapat pada sampel dengan suhu pencampuran50˚C (sampel 4) yaitu 5,81 mAh/g sedan gkan pada sampel dengan suhu pencampuran 29˚C (sampel 2) didapatkan kapasitas discharge terendah yaitu 3,23mAh/g dan pada sampel dengan suhu pencampuran 60˚C (sampel 5) didapatkan nilai kapasitas discharge sebesar 4,06 mAh/g, Ini ditunjukkan pada Tabel 4.2.
Tabel 4.2 Kapasitas discharge untuk variasi suhu pencampuran Suhu Pencampuran Kapasitas
(mAh/g)
29˚C 3,23
50˚C 5,81
60˚C 4,06
laminate tersebut akan mudah rontok dan mengakibatkan nilai kapasitas yang didapatkan rendah ditunjukan dengan grafik pada Gambar 4.6 yang merupakan grafik spesifik kapasitas pada variasi suhu pencampuran.
Gambar 4.6Grafik tegangan vs kapasitas discharge (a) Tmix (b)T
= 29˚C, mix=50˚C, (c) Tmix = 60˚C
4.4.3Analisa charge/discharge dengan variasi suhu pengeringan
Tabel 4.3 Kapasitas discharge untuk variasi suhu pengeringan Suhu Pengeringan Kapasitas
(mAh/g)
80˚C 5,70
100˚C 4,31
120˚C 4,06
Dari Tabel 4.3 dapat dilihat kapasitas discharge tertinggi terdapat pada sampel dengan suhu pengeringan 80˚C (sampel 6) yaitu 5,70 mAh/g sementara pada sampel dengan suhu pengeringan 100˚C (sampel 7) kapasitas turun menjadi
4,31 mAh/g dan pada sampel dengan suhu pengeringan 120˚C (sampel 5) kapasitas semakin turun yaitu 4,06 mAh/g.
Gambar 4.10Grafik tegangan vs kapasitas discharge (a) Tdry= 80˚C,(b) Tdry= 100˚C dan(c) Tdry = 120˚C.
Pada variasi suhu pengeringan dengan suhu pengeringan 800C (sampel 6) lembaran yang didapatkan lebih bagus daripada suhu pengeringan 1000C (sampel 7) dan 1200C (sampel 5). Dapat dilihat pada Gambar 4.7. Ini karena pada suhu pengeringan 1000C (sampel 7) dan 1200C (sampel 5), laminate pada lembaran terlalu kering yang menyebabkan ikatan antar permukaan partikel dan binder tidak bagus sehingga lembaran katoda yang dihasilkan akan mudah terlepas dari alumunium foil dan kapasitas yang dihasilkan pun akan rendah. Tujuan dari pengeringan lembaran katoda LiFePO4 yaitu selain agar laminate pada lembaran katoda LiFePO4 kering sempurna, tujuan lainnya adalah untuk menghilangkan DMAC yang masih terperangkap didalam laminate pada lembaran katoda tersebut. DMAC hanya berfungsi sebagai pelarut saja pada saat pembuatan slurry dan pada saat dijadikan lembaran, DMAC harus dihilangkan dengan cara mengeringkan laminate. Pada variasi suhu pengeringan, slurry dibuat dengan suhu 600C (sampel 5) selama 5 jam. Hal ini juga sudah sangat berpengaruh pada slurry yang dipanaskan dengan suhu 600C (sampel 5) selama 5 jam sehingga slurry kekurangan
BAB 5
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Setelah melakukan penelitian dan pengujian serta menganalisis hasil dari pengujian tersebut, maka dapat disimpulkan :
1. Dari hasil SEM, lembaran yang memiliki kerekatan yang paling baik adalah sampel dengan suhu pencampuran 50˚C (sampel 4) dan memiliki kapasitas discharge tertinggi yaitu 5,81 mAh/g.
2. Pada variasi waktu pencampuran, sampel yang memiliki kapasitas paling tinggi adalah sampel dengan waktu pencampuran 7 jam (sampel 3) yaitu 3,74 mAh/g. Semakin lama waktu pencampuran maka slurry yang dihasilkan semakin homogen sehingga kapasitas yang didapat semakin tinggi. Sementara pada variasi suhu pencampuran, kapasitas dischargetertinggi terdapat pada sampel dengan suhu pecampuran 50˚C (sampel 4)yaitu 5,81 mAh/g.
3. Pada variasi suhu pengeringan kapasitas tertinggi terdapat pada sampel dengan suhu pengeringan 80˚C (sampel 6) yaitu 5,70 mAh/g.
5.2 SARAN
1. Untuk penelitian selanjutnya sebaiknya tidak menggunakan suhu ruangan pada saat pembuatan slurry.
2. Untuk penelitian selanjutnya sebaiknya untuk suhu pengeringan lembaran diatas 80˚C, waktu pengeringan harus lebih kecil dari 3 jam.
BAB 2
TINJAUAN PUSTAKA
2.1Baterai
2.1.1 Sejarah Baterai
Pada awal abad ke-19 Alessandro Volta menciptakan baterai pertama yang dikenal dengan Tumpukan Volta (Voltaic Pile).Baterai ini terdiri dari tumpukan cakram seng dan tembaga berselang seling dengan kain basah yang telah dicelupkan air garam sebagai pembatasnya.Baterai ini telah mampu menghasilkan arus yang kontinue dan stabil. Pada tabel 2.1 akan ditunjukan perkembangan baterai.
Tabel 2.1 Sejarah perkembangan baterai (Buchman, 2001)
Tahun Penemu Penemuan
1600 Gilbert (Inggris) Peletakkan dasar-dasar elektrokimia 1789 Galvani (Italia) Penemuan listrik dari hewan
1800 Volta (Italia) Penemuan sel voltaic
1802 Cruickshank (Inggris) Baterai pertama dengan yang mampu di produksi massal
1820 Ampere (Perancis) Listrik oleh magnet 1833 Faraday (Inggris) Hukum Faraday
1859 Plante (Inggris) Penemuan baterai timbal/asam 1868 Leclance (Inggris) Penemuan sel Leclance
1888 Gasner (Amerika Serikat) Penyempurnaan sel kering 1899 Jungner (Swedia) Penemuan baterai Ni-Cd 1901 Edison (Amerika Serikat) Penemuan baterai Ni-Fe 1932 Shlecht & Ackerman
(Jerman)
Penemuan pelat kutub yang dipadatkan
1947 Neuman (Perancis) Berhasil mengemas baterai Ni-Cd 1960-an UnionCarbide(Amerika
Serikat)
1970-an Union Carbide (Amerika Serikat)
Pengembangan baterai timbal/asam dengan pengaturan kutup
1990 Union Carbide (Amerika Serikat)
Komersialisasi baterai Ni-MH
1992 Kordesch (Kanada) Komersialisasi baterai alkalin yang dapat dipakai ulang
1999 Kordesch (Kanada) Komersialisasi baterai Li-ion polimer
2.1.2 Pengertian Baterai
Baterai didefenisikan sebagai suatu sel elektrokimia yang dapat mengubah langsung energi kimia menjadi energi listrik (Triwibowo, 2011).Pengertian baterai secara umum mencakup beberapa sel baterai yang digabungkan. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, seperator, wadah dan terminal/ current collector (Subhan, 2011).
Kinerja baterai melibatkan transfer elektron melalui suatu media yang bersifat konduktif dari elektroda negatif (anoda) ke elektroda positif (katoda) sehingga menghasilkan arus listrik dan beda potensial. Bahan dan luas permukaan elektroda mampu mempengaruhi jumlah beda potensial yang dihasilkan. Setiap bahan elektroda memiliki tingkat potensial elektroda yang berbeda-beda. Jika luas permukaan elektroda diperbesar maka akan semakin banyak elektron yang dapat dioksidasi dibandingkan dengan elektroda dengan luas permukaan yang kecil (Kartawidjaja et al., 2008).
2.1.3 Jenis – Jenis Baterai
Mengacu pada sumber energi listrik yang terbentuk dari hasil proses elektrokimia, maka baterai/ sel dikelompokkan sebagai berikut (Triwibowo, 2011):
1. Baterai/ sel primer (baterai dengan penggunaan sekali saja)
kecepatan discharge yang rendah dan tidak memerlukan perawatan. Contoh baterai ini dapat dilihat di Gambar 2.1.a
2. Baterai/ sel sekunder (dapat diisi ulang/rechargeable)
Pengisian dilakukan dengan memasukkan arus listrik pada kutub yang berlawanan. Baterai jenis ini disebut juga sebagai baterai penyimpan/ storage battrey atau accumulator. Baterai sekunder diaplikasikan dalam dua katagori, yaitu:
a. Sebagai alat penyimpan energi/ Energy-storage Device. Umumnya baterai jenis ini tersambung dengan jaringan listrik permanen dan jaringan listrik primer saat digunakan. Contoh penggunaanya adalah dalam otomotif, pesawat terbang, Uninterupptible Power Source (UPS) dan sebagai pendukung load leveling pada Stationary Energy Sttorge Systems.
b. Sebagai sumber energi listrik pada portabel divais, pengganti baterai primer dan pada semua divais yang menggunakan baterai primer, seperti telephone genggam, kamera, notebook dll. Contoh baterai sekunder dapat dilihat pada Gambar 2.1.b
(a) (b)
2.2 Baterai Ion Lithium
2.2.1 Pengertian Baterai Ion Lithium
Baterai ion lithium adalah salah satu dari tipe baterai rechargeable (dapat diisi ulang). Baterai ini memiliki kelebihan dibandingkan baterai sekunder jenis lain, yaitu memiliki stabilitas penyimpanan energi yang sangat baik (daya tahan sampai 10 tahun atau lebih), energi densitasnya tinggi, tidak ada memori efek dan berat yang relatif lebih ringan dibandingkan dengan baterai jenis lain. Sehingga dengan berat yang sama energi yang dihasilkan baterai lithium dua kali lipat dari baterai jenis lain (Lawrence, 1992).
Baterai lithium pada umumnya memiliki empat komponenutama yaitu(Linden,2002):
1. Elektroda negatif (anoda) yaitu elektroda yang melepaskan elektron ke rangkaian luar serta mengalami proses oksidasi pada proses elektrokimia.
2. Elektroda positif (katoda) yaitu elektroda yang menerima elektron dari rangkaian luar serta mengalami proses reduksi pada proses elektrokimia.
3. Penghantar ion (elektrolit) yaitu media transfer ion yang bergerak dari anoda ke katoda dalam sel baterai saat penggunaan.
4. Separator yaitu suatu material berpori yang terletak di antara anoda dan katoda berfungsi untuk mencegah agar tidak terjadi hubungan singkat dan kontak antara katoda dan anoda.
2.2.2 Prinsip Kerja Baterai Ion Lithium
Dalam kondisi discharge dan charge baterai lithium bekerja menurut fenomena interkalasi, dimana ion lithium melakukan migrasi dari katoda lewat elektrolit ke anoda atau sebaliknya tanpa terjadi perubahan struktur kristal dari bahan katoda dan anoda (Singhal et al, 2009). Interkalasi merupakan proses pelepasan ion lithium dari tempatnya di struktur kristal suatu bahan elektroda dan pemasukan ion lithium pada tempat di struktur kirstal bahan elektroda yang lain (Prihandoko, 2007).
anoda karena kekurangan elektron untuk berpindah menuju katoda melalui elektrolit. Pada proses pengisian (charging) terjadi perubahan energi listrik menjadi energi kimia elektron dari katoda mengalir menuju anoda sedangkan ion lithium dalam sistem berpindah dari katoda menuju anoda melalui elektrolit. Separator yang terletak di antara anoda dan katoda berfungsi untuk mencegah agar tidak terjadi hubungan singkat dan kontak antara katoda dan anoda.
Electrolyte
Charge
Discharge
Separator
Li2C6 LiFePO4
Gambar 2.1 Proses charge dan discharge pada baterai Lithium
2.2.3Jenis – Jenis Baterai Ion Lithium
Untuk beberapa alasan, baterai sekunder didesain dalam beberapa bentuk. Desain baterai sekunder dibagi menjadi (Buchman, 2001):
1. Baterai Slinder
Jenis baterai ini paling bayak ditemui. Desain berbentuk slinder mudah dalam pembuatannya, disamping itu memiliki stabilitas mekanik yang baik. Saat charging, baterai akan menghasilkan gas yang memberikan tekanan dalam slinder, untuk itu baterai slinder dilengkapi pula dengan ventilasi. Ventilasi diperlukan untuk mengalirkan gas bila terjadi tekanan yang berlebih. Kerugian dari desain ini adalah bentuknya yang tidak ringkas saat beberapa slinder
Elektroda negatif
Elektroda positif
digabungkan, yaitu akan terbentuk ruangan kosong diantaranya. Kapasitas listrik yang dikandung baterai ini berkisar antara 1800-2000mAh.Ilustrasi baterai slinder dapat dilihat pada Gambar 2.3.a.
2. Baterai kancing
Baterai yang sering disebut baterai koin ini memiliki ukuran terkecil dibandingkan baterai lain. Disebabkan ukurannya, jenis ini tidak memiliki masalah dengan ruang yang tersedia. Karena bentuknya yang miniatur, baterai ini tidak dilengkapi dengan ventilasi (lihat Gambar 2.3.b). Sementara proses charging yang cepat akan membuat baterai menggelembung. Untuk menghindari keadaan ini, baterai kancing hanya dapat di charge dengan kecepatan yang rendah. Pengisisan baterai jenis ini dapat memakan waktu 10-16 jam.
3. Baterai prismatik
Baterai ini memaksimalkan penggunaan ruang yang ada dalam suatu perangkat elektrik. Oleh karenanya baterai jenis ini tidak memiliki ukuran yang standart (disesuaikan dengan ruang yang ada). Kapasitas listrik baterai ini umumnya dibawah baterai slinder, yaitu 400 - 2000mAh. Stabilitas mekanik baterai ini juga tidak sebaik dengan baterai slinder, untuk itu diperlukan material yang lebih kuat untuk kemasaan baterai. Ilustrasi baterai prismatik tertera pada Gambar 2.3.c.
4. Baterai kantung
(a) (b)
(c) (d)
Gambar 2.3 Jenis-jenis desain baterai sekunder a) baterai slinder b) baterai kancing (coin) c) Baterai prismatik d) Baterai Kantung (Buchman, 2001).
2.3 Material Katoda
Tabel 2.2Perbandingan jenis material yang digunakan untuk katoda (Xu.Bo et al,
Keunggulan Konduktivitas tinggi, mudah
Kelemahan Mahal dan beracun
Karakteristik yang harus dipenuhi suatu material yang digunakan sebagai katoda antara lain (Ohzuku.T, 1995) :
1. Material tersebut terdiri dari ion yang mudah melakukan reaksi reduksi dan oksidasi.
2. Memiliki konduktifitas yang tinggi seperti logam. 3. Memiliki kerapatan dan kapasitas energi yang tinggi.
4. Memiliki kestabilan yang tinggi (tidak mudah berubah strukturnya atau terdegradasi baik saat pemakaian maupun pengisian ulang),
5. murah dan ramah lingkungan.
Material katoda tidak hanya harus bersifat konduktif ionik, namun juga harus bersifat konduktif elektronik. Saat proses charging ion lithium akan dilepaskan dari katoda ke anoda melalui elektrolit, dengan begitu katoda harus bersifat konduktif ionik. Bersamaan dengan itu elektron akan dilepaskan melewati rangkaian luar menuju anoda, ini berarti katoda juga harus bersifat konduktif elektronik (Triwibowo, 2011).
Pada penelitian ini katoda yang digunakan adalah LiFePO4. Lithium ferro phosphate (LFP) merupakan material pembentuk katoda yang sering digunakan.LiFePO4
LiFePO
memiliki struktur olivin, kelompok ruang ortorombik Pnma dan memiliki parameter kisi a ≠ b ≠ c ; α = β = γ = 90˚.
4 tidak beracun, berstruktur stabil sehingga aman untuk bahan katoda baterai lithium.LiFePO4 memiliki kapasitas teoritik yang cukup tinggi yaitu 170 mAh/g, murah, tidak memiliki efek memori, dan ramah lingkungan (Anies, 2011).
Tabel 2.3 Karakteristik LiFePO4 Karakteristik LiFePO4
Spesifik energi
Ketahanan waktu >10 tahun Daya tahan siklus 2.000 Tegangan sel 3.5 V Spesifik Kapasitas 170 mAh/g
2.4 Material Anoda
2.5 Elektrolit
Elektrolit adalah bagian yang berfungsi sebagai penghantar ion lithium dari anoda ke katoda atau sebaliknya. Elektrolit merupakan bagian penting dalam sel elektrokimia baik dalam pengoperasianya maupun dalam sistem kelengkapannya. Selain itu elektrolit harus dapat menghantarkan ion untuk menjalankan sel elektrokimia (Jouannea, 2002).
Elektolit terbagi 2 yaitu elektrolit padat dan elektrolit cair. Elektrolit padat menunjukkan kestabilan pada suhu tinggi dan memiliki resistansi listrik yang baik. Namun elektrolit padat memiliki beberapa kelemahan diantaranya aliran arus rendah, kemampuannya menurun pada temperatur rendah dan sangat rentan terhadap hubungan singkat yang dapat menyebabkan hilangnya energi. Sedangkan elektrolit cair dapat menembus celah – celah atau pori – pori dari bahan elektroda, baik anoda maupun katoda. Karena elektrolit berupa larutan, maka elektrolit sangat mudah mencapai permukaan serbuk elektroda.Untuk penerapan elektrolit padat persyaratan yang harus dipenuhi adalah adanya pertemuan permukaan serbuk elektroda dengan elektrolit.Oleh karena itu komponen elektroda dibuat dengan komposisi yang mengandung bahan elektrolit atau garam lithium, sehingga reaksi redoks dapat berlangsung tepat di permukaan serbuk elektroda.(Prihandoko, 2008).
2.6 Separator
Separator adalah suatu material berpori yang terletak di antara anoda dan katoda berfungsi untuk mencegah agar tidak terjadi hubungan singkat dan kontak antara katoda dan anoda. Separator dapat berupa elektrolit yang berbentuk gel, atau plastik film microporous (nano pori), atau material inert berpori yang diisi dengan elektrolit cair. Sifat listrik separator ini mampu dilewati oleh ion tetapi juga mampu memblokir elektron, jadi bersifat konduktif ionik sekaligus tidak konduktif elektron.(Subhan, 2011).
seluruh permukaan. Struktur pori dan penyerapan elektrolit berpengaruh terhadap konduktivitas ion. Separator dengan porositas yang tinggi dapat menyerap lebih banyak elektrolit liquid. Sehingga besarnya penyerapan elektrolit pembawa muatan ion sangat dibutuhkan (H. Li, 2011). Beberapa material yang dapat digunakan sebagai separator antara lain polyolefins(PE dan PP), PVdF(Polyvinylidene fluodire), PTFE, PVC, dan poly ethylene oxide(Manjunatha, 2011).
2.7 Komponen Tambahan Penyusun Katoda Baterai 2.7.1. Super P
Super P adalah campuran superplasticizing yang dapat mengurangi jumlah air yang dibutuhkan tanpa mempengaruhi konsistensi campuran.Super P berfungsi untuk meningkatkan daya tahan dan kekuatan, menghilangkan unit retak dan membuat permukaan halus pada campuran.(Safety Data Sheet)
2.7.2. Polyvinylidene Fluoride (PVDF)
PVDF (poly vinylidene fluoride) merupakan binder (pengikat) antara elektroda dan material lain. Tanpa PVDF material akan berantakan. Dalam keluarga floropolimer, PVDF memiliki proses leleh yang lebih mudah karena titik lelehnya yang relatif rendah. Selain itu, ia juga memiliki densitas yang relatif rendah dibandingkanfloropolimerlainnya.Wilayah amorf di PVDF adalah matrik yang baik untuk molekul polar, dan ion lithium dapat melewati lapisan tipis PVDF. (Tsunemi,K et al,1983)
2.7.3. N-N Dimethyl Acetamide (DMAC)
DMAC adalah pelarut industri yang kuat dan serbaguna yang memiliki kelarutan terhadap bahan organik dan anorganik yang tinggi, titik didih tinggi, titik beku yang rendah, dan stabilitas yang baik. Selain itu DMAC tidak reaktif dalam reaksi kimia. DMAC larut dalam air, eter, ester, keton dan senyawa aromatik. DMAC umumnya larut dalam senyawa alifatik tidak jenuh dan kestabilannya bagus.
2.8 Pencampuran (Mixing)
Pencampuran (mixing) yaitu suatu proses pencampuran bahan sehingga dapat bergabung menjadi suatu homogen. Ada dua macam pencampuran yaitu pencampuran basah (wet mixing) dan pencampuran kering (dry mixing). Pencampuran basah (wet mixing) yaitu proses pencampuaran dimana serbuk matrik dan filler dicampur terlebih dahulu dengan pelarut. Sedangkan pencampuran kering (dry mixing) yaitu proses pencampuran yang dilakukan tanpa menggunakan pelarut. Faktor penentu kehomogenandistribusi partikel, antara lain kecepatan pencampuran, lamanya waktu pencampuran dan ukuran partikel.
2.9 Karakterisasi dan Pengujian
Pengujian karakteristik serbuk LiFePO4dilakukan dn yaituengan alat uji X-Ray Difraction(XRD) dan lembaran katoda LiFePO4 dengan mikroskop optik dan Scanning Electron Microscopy(SEM) untuk melihat struktur morfologi lembaran katoda LiFePO4serta pengujian kapasitas discharge baterai dengan charge/discharge.
2.9.1 Uji X-Ray Difraction(XRD)
-800nm) (Smallman, 2000). Panjang gelombang sinar-X ini merupakan dasar digunakannya teknik difraksi sinar-X (X-Ray Difraction) untuk mengetahui struktur mikroskopis suatu bahan. Teknik X-Ray Diffraction (XRD) berperan penting dalam proses analisis padatan kristalin. XRD adalah metode karakterisasi yang digunakan untuk mengetahui ciri utama kristal, seperti parameter kisi dan tipe struktur. Selain itu, juga dimanfaatkan untuk mengetahui rincian lain seperti susunan berbagai jenis atom dalam kristal, kehadiran cacat, orientasi, dan cacat kristal (Smallman, 2000).
Sinar-X dihasilkan dari penembakan target (logam anoda) oleh elektron berenergi tinggi yang berasal dari hasil pemanasan filamen dari tabung sinar-X (Rontgen). Tabung sinar-X tersebut terdiri atas empat komponen utama, yakni filamen (katoda) yang berperan sebagai sumber elektron, ruang vakum sebagai pembebas hambatan, target sebagai anoda dan sumber tegangan listrik.
Peralatan X-Ray Diffractometer (XRD) dapat digunakan untuk identifikasi mineralogi material, termasuk batuan piroklastika secara cepat dan akurat.Data semikuantitatif hasil uji XRD adalah jenis dan jumlah mineral pembentuk Kristal yang dijumpai di dalam suatu percontohan batuan (Klug, 1974).
Pada penelitian ini pengujian XRD dilakukan untuk melihat struktur kristal pada serbuk LiFePO4yang dipakai pada percobaan. Dan menganalisis nilai chi2 (nilai perbandingan antara intensitas observasi dan intensitas referensi) dan wrp (Residu Weight Persent) yang ideal berdasarkan standart ICDD.
2.9.2 Uji Mikroskop Optik
Pengujian mikrroskop optik bertujuan untuk melihat morfologi dari lembaran katoda LiFePO4.
Lensa objektif adalah sebuah kaca pembesar bertenaga sangat tinggi dengan panjang fokus yang sangat pendek. Lensa ini diletakkan sangat dekat dengan spesimen yang akan diteliti sehingga cahaya dari spesimen jatuh ke fokus
sekitar 160 mm di dalam tabung mikroskop sehingga menciptakan perbesaran sebuah gambar dari subjek. Gambar yang dihasilkan terbalik dan dapat dilihat dengan menghapus lensa okuler dan menempatkan secarik kertas kalkir di ujung tabung.
Di kebanyakan mikroskop, lensa okuler merupakan lensa majemuk, dengan satu lensa komponen di dekat bagian depan dan satu di dekat bagian belakang tabung lensa okuler. Dalam beberapa desain, gambar virtual menuju ke sebuah fokus antara dua lensa okuler. Lensa pertama membawa gambar nyata dan lensa kedua memungkinkan matauntuk fokus pada gambar virtual.Untuk pengujian mikroskop optik ini diperlukan permukaan spesimen yang rata dan halus (Kahn, 2002).
2.9.3 Uji Scanning Electron Microscope (SEM)
Mikroskop adalah alat optik yang dapat digunakan untuk mengamati benda ukuran kecil (mikro). Secara garis besar mikroskop elektron dapat dibagi menjadi dua bagian yaitu Tranmision Electron Microscope (TEM) dan Scanning Electron Microscope (SEM).Scanning Electron Microscope (SEM) adalah sebuah mikroskop elektron yang didesain untuk mengamati permukaan objek solid secara langsung. SEM memiliki perbesaran 10 – 3.000.000 kali, depth of field 4 – 0.4 mm dan resolusi sebesar 1 – 10 nm. Kombinasi dari perbesaran yang tinggi, depth of field yang besar, resolusi yang baik, kemampuan untuk mengetahui komposisi dan informasi kristalografi membuat SEM banyak digunakan untuk keperluan penelitian dan industri (Prasetyo, 2011).
SEM memiliki tiga komponen pokok yaitu kolom elektron, ruang sampel, sistem pompa vakum, kontrol elektron dan sistem lensa magnetik.Di dalam kolom elektron terdapat penembak elektron yang terdiri dari katoda dan anoda.Elektron yang terlepas dari katoda bergerak ke arah anoda yang dalam perjalananya berkas elektron ini dipengaruhi oleh lensa magnetik hingga didapatkan berkas elektron yang terfokus ke arah sampel. Saat elektron menumbuk sampel, akan terjadi beberapa fenomena yaitu terbentuknya dua jenis hamburan/ scattering, sinar X dan foton.
Pada SEM digunakan berkas elektron yang dibangkitkan dari filamen, lalu diarahkan pada sampel.Untuk elektron yang energinya dibawah 50kV berinteraksi langsung dengan elektron pada atom sampel dipermukaan.Akibatnya elektron – elektron yang ada di kulit terluar atom permukaan sampel terlempar keluar dan oleh detektor dikumpulkan dan dihasilkan gambar topografi permukaan sampel.
2.9.4 Uji Charge/Discharge
Kapasitas baterai adalah ukuran muatan yang disimpan suatu baterai, yang ditentukan oleh masa aktif material didalamnya.Kapasitas menggambarkan sejumlah energi maksimum yang dapat dikeluarkan dari sebuah baterai dengan kondisi tertentu.Tetapi kemampuan penyimpanan baterai dapat berbeda dari kapasitas nominalnya, diantaranya karena kapasitas baterai bergantung pada umur dan keadaan baterai, parameter charge/discharge, dan temperatur.
Kapasitas baterai juga tergantung pada jenis aktif material yang digunakan dan kecepatan reaksi elektrokimia saat beterai digunakan atau diisi.Luasnya kontak permukaan material aktif juga akan memperbesar kapasitas baterai. Kontak permukaan yang luas dapat dicapai dengan menggunakan material aktif berukuran nano dan berpori. Kecepatan reaksi elektrokimia tergantung pada:
1. Suhu ruang/ lingkungan dimana sistem baterai itu bekerja. 2. Konsentrasi metal ion pada larutan elektrolit.
Dalam baterai ion lithium material katoda memegang peranan penting dalam pencapaian kapasitas baterai. Material ini yang nantinya harus dapat melepaskan lithium ion bergerak menuju anoda saat charging. Makin besar jumlah lithium ion yang dapat dipindahkan ke anoda, maka makin besar pula arus listrik yang dihasilkan saat discharging nantinya.
Besar kapasitas baterai secara teoritik tergantung dari jumlah material aktif terkandung. Sebagai contoh, menghitung kapasitas material katoda LiFePO4
Berat atom Li = 7, Fe = 56 , P = 31 dan O = 16 seberat 1 gram adalah sebagai berikut :
1 gram LiFePO4
Dari bilangan Avogardo diketahui 1 mol material mengandung 96.500 Coloumb.
setara dengan mol �� �� =
1
158 = 0,0063mol
Maka 1 gram LiFePO4
Kapasitas baterai sering dinyatakan dalam Ampare hours (Ah), ditentukan sebagai waktu dalam jam yang dibutuhkan baterai untuk secara kontinu mengalirkan arus atau nilai discharge pada tegangan nominal baterai. Satuan Ampere hours (Ah) sering digunakan ketika tegangan baterai bervariasi selama siklus chargedan discharge. Nilai charge dalam ampere adalah sejumlah muatan yang diberikan pada baterai persatuan waktu. Sedangkan discharge dalam ampere adalah sejumlah muatan yang digunakan kerangkaian luar (beban).
memiliki spesifik kapasitas sebesar = 0,0063 x 1 x 96.500/3600 = 0,169 Ah/g = 169 mAh/g.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Energi tidak akan lepas dari kehidupan manusia. Penyimpanan energi telah dan akan terus menjadi salah satu yang paling penting dalam teknologi karena konsumsi energi terus meningkat. Salah satu alasan meningkatrnya konsumsi energi adalah karena meningkatnya penggunaan perangkat elektronik portabel.Konsumsi energi yang semakin meningkat menyebabkan sumber energi semakin menipis.Oleh karena itu perlu adanya sumber energi alternatif. Salah satu upaya sumber energi alternatif adalah dengan caramengembangkan baterai.
Baterai sebagai penyimpanan energi merupakan pendukung utama dalam aplikasi energi baru dan terbarukan yang saat ini sedang dikembangkan di Indonesia.Diantara banyak jenis baterai isi ulang, baterai ion lithium dinilai sebagai pilihan solusi terbaik untuk sumber energi alternatif karena baterai ion lithium memiliki kapasitas yang tinggi (150 – 275 mAh/g), ramah lingkungan dan memiliki lifecycle panjang (500-1000 siklus) (Armand, 2008), tidak ada memory effect sehingga kapasitas baterai relatif konstan/tetap, kapasitas listrik dan tegangannya besar, sehingga memiliki kebebasan yang lebih luas untuk pemilihan material yang lebih ramah lingkungan sebagai material pembentuknya (Linden, 2002).
Pada komponen katoda material aktif, material katoda yang pertama digunakan pada baterai ion lithium adalah LiCoO2. Kemudian muncul material-material katoda lain seperti LiNiO2, LiMnO4, LiNi1/3Co1/3Mn1/3O2, dan LiFePO4. LiFePO4 baru-baru ini secara ekstensif dipelajari sebagai material katoda untuk baterai ion lithium karena kapasitas teoritis tinggi (170 mAh/g), stabil,murah karena bahan dasarnya (besi) melimpah di alam, tidak memiliki memory effect dan ramah lingkungan. (Padhi dkk, 1997).Namun material ini memiliki kekurangan yaitu konduktivitas elektronik dan koefisien difusi ion lithiumnya yang rendah dan juga memiliki konduktivitas listrik yang rendah (10-9Scm-1
Material katoda harus memiliki kapasitas spesifik yang tinggi dan harus bersifat ionik konduktif dan elektronik konduktif. Hal ini berkaitan dengan peristiwa menerima dan melepas elektron pada proses elektrokimia, sehingga diperlukan material katoda dengan konduktivitas listrik yang tinggi. Konduktivitas listrik yang tinggi merupakan salah satu indikator bahwa material yang digunakan memenuhi persyaratan sebagai bahan baterai (Triwibowo, 2011).
) (Anies, 2011).
Untuk menghasilkan baterai dengan kapasitas tinggi, salah satu kriteria yang harus dimiliki lembaran katoda yaitu laminate merekat sempurna pada lembaran (tidak mudah rontok). Hal ini sangat berkaitan dengan suhu dan waktu pencampuran pada pembuatan slurry katoda LiFePO4
Penelitian ini membuat baterai coincell dengan bahan LiFePO
serta suhu pengeringan pada lembaran katoda yang dihasilkan. Dimana suhu dan waktu pencampuran yang baik akan menghasilkan slurry yang memiliki kehomogenitas tinggi sehingga lembaran yang dihasilkan akan optimal. Dan dengan suhu pengeringan yang baik maka lembaran akan merekat sempurna dan tidak mudah terlepas dari alumunium foil nya sehingga kapasitas yang akan dihasilkan tinggi.
1.2Rumusan Masalah
Untuk menghasilkan baterai coin cell yang memiliki kapasitas discharge tinggi, maka perumusan masalah pada penelitian ini adalah :
1. Bagaimana morfologi dari lembaran katoda LiFePO4
2. Bagaimana pengaruh variasi waktu dan suhu pencampuran saat pembuatanslurry pada lembaran katoda LiFePO
yang dihasilkan terhadap kapasitas discharge baterai ion lithium ?
4
3. Bagaimana pengaruh variasi suhu pengeringan pada lembaran katoda LiFePO
terhadap kapasitas discharge baterai ion lithium ?
4 terhadapkapasitas discharge baterai ion lithium ?
1.3Batasan Masalah
Batasan masalah dalam penelitian ini adalah :
1. Pembuatan material katoda merupakan campuran dari LiFePO4 sebagai material aktif, Super P sebagai zat aditif, PVDF sebagai matriks dan DMAC sebagai pelarut. Perbandingan komposisi antara LiFePO4
2. Membuat slurry dengan variasi waktu pencampuran 3 jam, 5 jam dan 7 jam pada suhu ruangan (29˚C) dan variasi suhu pencampuran 29˚C, 50˚C dan 60˚C dengan waktu pencampuran selama 5 jam dan dikeringkan dengan suhu 120˚C selama 3 jam.
: Super P : PVDF yaitu 85 : 10 : 5 dengan DMAC 20 mL pada saat pembuatan slurry.
3. Membuat lembaran katoda LiFePO4
4. Membuat baterai coin cell dengan bahan katoda LiFePO
dengan variasi suhu pengeringan 80˚C, 100˚C dan 120˚C selama 3 jam.
4
5. Pengujian karakteristik serbuk LiFePO
dan lithium metal sebagai anoda serta LiPF6 sebagai elektrolit.
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut: 1. Untuk menghasilkan lembaran katoda LiFePO4
2. Untuk mengetahui pengaruh variasi suhu dan waktupencampuran pada pembuatanslurry katoda LiFePO
yang akan dimanfaatkan sebagai bahan dalam pembuatan baterai ion lithium.
4terhadap kapasitas discharge baterai ion lithium
3. Untuk mengetahui pengaruh variasi suhu pengeringan pada lembaran katoda LiFePO
.
4 terhadap kapasitas discharge baterai ion lithium.
1.5 Manfaat Penelitian.
Penelitian ini diharapkan dapat memberikan kontribusi yang positif terhadap: 1. Memberikan informasi ilmiah mengenai cara pembuatan lembaran katoda
dengan material aktif LiFePO4
2. Menghasilkan lembaran katoda LiFePO
, zat aditif adalah Super P dan PVDF sebagai matriks.
1.6Sistematika Penulisan
Laporan tugas akhir ini disusun dengan sistematika sebagai berikut: Bab 1 Pendahuluan
Bab ini berisi tentang latar belakang penelitian, perumusan masalah, tujuan penelitian, manfaat penelitian, batasan masalah dan sistematika penulisan. Bab 2 TinjauanPustaka
Bab ini membahas tentang landasan teori yang menjadi acuan untuk proses pengembilan data, analisa data serta pembahasan.
Bab 3 MetodologiPenelitian
Bab ini membahas tentang rancangan penelitian, tempat dan waktu penelitian, peralatan dan bahan penelitian, prosedur penelitian serta diagram alir penelitian.
Bab 4 Hasil dan PembahasanPenelitian
Bab ini membahas tentang data hasil penelitian dan analisa data yang diperoleh dari penelitian.
Bab 5 Kesimpulan dan Saran
Bab ini menyajikan kesimpulan dari seluruh kegiatan dan hasil penelitian dan berisi saran-saran yang diperlukan untuk pengembangan dan penelitian lebih lanjut.
Daftar Pustaka
PENGARUH VARIASI WAKTU DAN SUHU PENCAMPURAN SERTA SUHU PENGERINGAN PADA LEMBAR KATODA LiFePO
TERHADAP KAPASITAS BATERAI ION LITHIUM
4
ABSTRAK
Telah dilakukan penelitian pembuatan baterai coin dengan variasi suhu dan waku pencampuran pada slurry katoda LiFePO4 serta variasi suhu pengeringan lembar katoda LiFePO4. Material katoda merupakan campuran dari LiFePO4 : Super P : PVDF dengan komposisi 85 : 10 : 5 dan DMAC 20 mL. Waktu dan suhu pencampuran divariasikan yaitu 3, 5 dan 7 jam pada suhu 29˚C dan 29, 50 dan 60˚C selama 3 jam dan variasi suhu pengeringan 80, 100 dan 120˚C selama 5 jam.
Lembaran katoda dibuat dengan menggunakan doctor blade. Pengujian karakteristik serbuk LiFePO4 dengan XRD, mikroskop optik dan SEM-EDX untuk melihat morfologi lembaran katoda LiFePO4 dan pengujian kapasitas discharge dengan charge/discharge. Hasil analisis menunjukkan bahwa variasi waktu pencampuran yang memiliki kapasitas tertinggi adalah sampel 7 jam yaitu 3,74 mAh/g. Sementara pada variasi suhu pencampuran, kapasitas tertinggi terdapat pada sampel 50˚C yaitu 5,81 mAh/g. Pada variasi suhu pengeringan kapasitas tertinggi terdapat pada sampel 80˚C yaitu 5,70 mAh/g.
THE EFFECT OF TIME VARIATION, MIXING TEMPERATURE AND DRYING TEMPERATURE ON LiFePO4
LITHIUM ION BATTERIES CAPACITY
CATHODE SHEETS OF
ABSTRAC
A research on the fabrication of coin battery with the variation of mixing time and temperature at slurry cathode LiFePO4 and variation of drying temperature at cathode sheets. The material of cathode was using a powder of LiFePO4 : Super P : PVDF with composition 85 : 10 : 5 and 20 mL of DMAC. The mixing time was varied at 3, 5, 7 hour at 29˚C and the mixing temperature was varied at 29, 50, 60˚C for 3 hour and the drying temperature was varied of 80, 100, 120˚C for 5 hour. The sheets of cathode are made by using doctor blade process. The powder of LiFePO4 was analyzed by XRD. Morphology of the LiFePO4 cathode sheets was analyzed by Microscope Optic and SEM. Discharge capacity was analyzed by charge/discharge. The result of this research showed that the variation of mixing time has the highest capacity at 7 hour-sampel is 3,75 mAh/g. Meanwhile, the variation of mixing temperature has the highest capacity at 50˚C sampel is 5,81 mAh/g. The variation of drying temperature has the highest capacity at 80˚C sampel is 5,70 mAh/g.
PENGARUH VARIASI WAKTU DAN SUHU PENCAMPURAN
SERTA SUHUPENGERINGAN PADA LEMBAR KATODA
LiFePO
4LITHIUM
TERHADAP KAPASITASBATERAI ION
SKRIPSI
SHELLY MAHARANI
110801011
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUANALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH VARIASI WAKTU DAN SUHU PENCAMPURAN
SERTA SUHUPENGERINGAN PADA LEMBAR KATODA
LiFePO
4LITHIUM
TERHADAPKAPASITAS BATERAI ION
SKRIPSI
Diajukan untuk melengkapi tugas akhir dan memenuhi syarat mencapai
gelar Sarjana Sains
SHELLY MAHARANI
110801011
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
MEDAN
PERNYATAAN
PENGARUH VARIASI WAKTU DAN SUHU PENCAMPURAN SERTA SUHU PENGERINGAN PADA LEMBAR KATODA
LiFePO4
LITHIUM
TERHADAP KAPASITAS BATERAI ION
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri.Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2015
PENGHARGAAN
Karena sesungguhnya sesudah kesulitan itu ada kemudahan. Sesungguhnya sesudah kesulitan itu ada kemudahan (Q.S Ash-Sharh : 5-6).
Bismillahirahmanirrohim
Alhamdulillah, puji syukur penulis panjatkan kepada Allah SWT atas rahmat, karunia dan segala kemudahan yang telah diberikan sehingga penulis dapat menyelesaikan penyusunan skripsi ini dengan judul “Pengaruh Variasi Waktu dan Suhu Pencampuran serta Suhu Pengeringan pada Lembar Katoda LiFePO4
Penulis menyadari skripsi ini terselesaikan tidak terlepas dari dukungan, bantuan, bimbingandan saran-saran yang berharga dari semua pihak. Oleh karena itu penulis ingin mengucapkan terimakasih kepada:
terhadap Kapasitas Baterai Ion Lithium.”
1. Kedua orangtua, Papa Syahril, Mama Henita dan Adik (Devi Zahara) serta seluruh Keluarga, terima kasih atas kasih sayang, doa dan semua dukungan yang telah kalian berikan kepada penulis.
2. Dr. Marhaposan Situmorangselaku Ketua Departemen Fisika Universitas Sumatera Utara, Drs. Syahrul Humaidi, M.Sc. selaku Sekertaris Departemen Fisika Universitas Sumatera Utara, dan seluruh staf pengajar beserta pegawai administrasi di Departemen Fisika yang telah memberikan fasilitas kepada penulis selama perkuliahan.
3. Dr. Kerista Sebayang, MS. selaku dosen pembimbing I danIr.Joko Triwibowo, M.Sc., M.T. selaku dosen pembimbing II yang telah memberikan kritik, saran, dan arahan kepada penulis dalam menyelesaikan skripsi ini.
5. Ibu Dr. Diana Alemin Barus, M.Sc selaku penguji I, Bapak Drs. Aditia Warman, M.Si selaku penguji II dan Bapak Dr. Kurnia Sembiring, MS selaku penguji III yang telah memberikan kritik dan saran.
6. Sahabat-sahabat seperjuangan Rani, Tika, Meme, Ucik, Yuni dan kelompok Baterai yang selama ini bersama-sama berbagi suka duka dan selalu memberikan dukungan kepada penulis serta seluruh mahasiswa Fisika angkatan 2011.
7. Sahabat tercinta Arde, Vhe, Aisyah, Dyan, Endang, Fauzi terima kasih dukungannya semoga kalian segera menyusul.
8. Semua pihak yang membantu penulis yang tidak dapat disebutkan satu persatu. Terima kasih, semoga Allah SWT membalas semua kebaikan kalian.
Saran dan kritik yang membangun senantiasa penulis harapkan dan semoga skripsi ini dapat memberi manfaat kepada penulis dan pembaca serta perkembangan ilmu pengetahuan.
Medan, Agustus 2015 Penulis,
PENGARUH VARIASI WAKTU DAN SUHU PENCAMPURAN SERTA SUHU PENGERINGAN PADA LEMBAR KATODA LiFePO
TERHADAP KAPASITAS BATERAI ION LITHIUM
4
ABSTRAK
Telah dilakukan penelitian pembuatan baterai coin dengan variasi suhu dan waku pencampuran pada slurry katoda LiFePO4 serta variasi suhu pengeringan lembar katoda LiFePO4. Material katoda merupakan campuran dari LiFePO4 : Super P : PVDF dengan komposisi 85 : 10 : 5 dan DMAC 20 mL. Waktu dan suhu pencampuran divariasikan yaitu 3, 5 dan 7 jam pada suhu 29˚C dan 29, 50 dan 60˚C selama 3 jam dan variasi suhu pengeringan 80, 100 dan 120˚C selama 5 jam.
Lembaran katoda dibuat dengan menggunakan doctor blade. Pengujian karakteristik serbuk LiFePO4 dengan XRD, mikroskop optik dan SEM-EDX untuk melihat morfologi lembaran katoda LiFePO4 dan pengujian kapasitas discharge dengan charge/discharge. Hasil analisis menunjukkan bahwa variasi waktu pencampuran yang memiliki kapasitas tertinggi adalah sampel 7 jam yaitu 3,74 mAh/g. Sementara pada variasi suhu pencampuran, kapasitas tertinggi terdapat pada sampel 50˚C yaitu 5,81 mAh/g. Pada variasi suhu pengeringan kapasitas tertinggi terdapat pada sampel 80˚C yaitu 5,70 mAh/g.
THE EFFECT OF TIME VARIATION, MIXING TEMPERATURE AND DRYING TEMPERATURE ON LiFePO4
LITHIUM ION BATTERIES CAPACITY
CATHODE SHEETS OF
ABSTRAC
A research on the fabrication of coin battery with the variation of mixing time and temperature at slurry cathode LiFePO4 and variation of drying temperature at cathode sheets. The material of cathode was using a powder of LiFePO4 : Super P : PVDF with composition 85 : 10 : 5 and 20 mL of DMAC. The mixing time was varied at 3, 5, 7 hour at 29˚C and the mixing temperature was varied at 29, 50, 60˚C for 3 hour and the drying temperature was varied of 80, 100, 120˚C for 5 hour. The sheets of cathode are made by using doctor blade process. The powder of LiFePO4 was analyzed by XRD. Morphology of the LiFePO4 cathode sheets was analyzed by Microscope Optic and SEM. Discharge capacity was analyzed by charge/discharge. The result of this research showed that the variation of mixing time has the highest capacity at 7 hour-sampel is 3,75 mAh/g. Meanwhile, the variation of mixing temperature has the highest capacity at 50˚C sampel is 5,81 mAh/g. The variation of drying temperature has the highest capacity at 80˚C sampel is 5,70 mAh/g.