LAMPIRAN A
ALAT-ALAT PERCOBAAN
A.1 Alat Persiapan Bahan
Timbangan Digital Cawan Petri Beaker Glass
Spatula Pipet Tetes Oven Penyimpanan Bahan
A.2 Alat Proses Pembuatan Slurry Katoda dan Anoda
Magnetic Stirrer Magnetic Bar Alat Tambahan
A.3 Alat Proses Coating Slurry
Mesin Coating Pisau Referensi
A.4 Alat Proses Pengeringan dan Calendring Lembaran Elektroda
Pengeringan dengan MSK AFA E 300 Alat Calendring
A.5 Alat Proses Pemotongan (Cutting)
Kaca Perlengkapan Pemotongan A.6 Alat Penyimpanan Lembaran
A.7 Alat Proses Assembling Baterai
Proses Welding Proses Stacking Pencetak Pouch
MSK 800 MSK 112 A MSK 120 Proses Sealing Proses Isi Elektrolit
MSK 140 Glove Box Multimeter
A.8 Alat Karakterisasi
LAMPIRAN B
BAHAN-BAHAN PERCOBAAN
B.1. Bahan Pembuatan Slurry Katoda dan Anoda
LiFePO4 MCMB
Super P PvDf
B.2. Current Collector
Alumunium (Al) Foil Tembaga (Cu) Foil
B.3. Seperator dan Bahan Kantung Baterai (Pouch)
Seperator Alumunium Laminate Film (Pouch)
B.4. Terminal Tab
LAMPIRAN C
LEMBARAN KATODA LiFePO4 DAN ANODA MCMB
C.1. Lembaran Katoda LiFePO4
C.1.1 Ketebalan 100 µm
C.1.2 Ketebalan 150 µm
C.2. Lembaran Anoda MCMB
C.2.1 Lembaran Anoda Komposisi 85 : 10 : 5 Ketebalan 150 µm
C.2.2 Lembaran Anoda Komposisi 80 : 13 : 7 Ketebalan 150 µm
LAMPIRAN D
PERHITUNGAN DATA PENGUJIAN
D1. Data Hasil Kapasitas Charge-Discharge pada arus charge 15 mA
D.1.1 Hasil kapasitas charge-discharge baterai dengan komposisi anoda MCMB (85 : 10 : 5) ketebalan 150 µm.
Kode
Baterai
Material Katoda LiFePO4
(85 : 10 :5)
D.1.2 Hasil kapasitas charge-discharge baterai dengan komposisi anoda MCMB (80 : 13 : 7) ketebalan 150 µm.
Kode
Baterai
Material Katoda LiFePO4
(85 : 10 :5)
D.1.3 Hasil kapasitas charge-discharge baterai dengan komposisi anoda MCMB (85 : 10 : 5) ketebalan 100 µm.
Kode
Baterai
Material Katoda LiFePO4
1. Perhitungan Massa Bahan Pembuatan Slurry Elektroda
a. Massa Bahan Slurry Katoda LiFePO4
• Perbandingan Komposisi Filler : Zat Aditif : Matriks = 85 : 10 : 5
85 % Filler (LiFePO4) = 15 gram
• Perbandingan Komposisi Filler : Zat Aditif : Matriks = 85 : 10 : 5
85 % Filler (MCMB) = 15 gram
• Perbandingan Komposisi Filler : Zat Aditif : Matriks = 80 : 13 : 7
80 % Filler (MCMB) = 15 gram
2. Perhitungan Specific Discharge Capacity Baterai ion lithium
Specific Discharge Capacity = ��������� ����ℎ����
����� �������� ����� = mAh/gr
a. Dengan Komposisi Anoda MCMB = 85 : 10 : 5 Ketebalan 150 µm
• Baterai LD 2 (Ketebalan 150 µm)
Specific Discharge Capacity = 82,4 ��ℎ
1,47�� = 56,05 mAh/gr
• Baterai LD 3 (Ketebalan 300 µm)
Specific Discharge Capacity = 173,2 ��ℎ
2,47 �� = 70,12 mAh/gr
b. Dengan Komposisi Anoda MCMB = 80 : 13 : 7 Ketebalan 150 µm
• Baterai LD 4 (Ketebalan 100 µm)
Specific Discharge Capacity = 98,2 ��ℎ
1.41�� = 69,65 mAh/gr
• Baterai LD 5 (Ketebalan 150 µm)
Specific Discharge Capacity = 122,2 ��ℎ
1,66�� = 73,61 mAh/gr
• Baterai LD 6 (Ketebalan 300 µm)
Specific Discharge Capacity = 220,4 ��ℎ
2,69 �� = 81, 93 mAh/gr
c. Dengan Komposisi Anoda MCMB = 85 : 10 : 5 Ketebalan 100 µm
• Baterai LD 7 (Ketebalan 100 µm)
Specific Discharge Capacity = 106 ��ℎ
1,34 �� = 79,10 mAh/gr
• Baterai LD 8 (Ketebalan 150 µm)
Specific Discharge Capacity = 136,2 ��ℎ
1,65 �� = 82,54 mAh/gr
• Baterai LD 9 (Ketebalan 300 µm)
Specific Discharge Capacity = 211,2 ��ℎ
2.40 �� = 88 mAh/gr
3. Perhitungan Efisiensi Baterai ion lithium
Efisiensi Baterai = ��������� ����ℎ����
DAFTAR PUSTAKA
Abdillah, Nur Himawan. 2008. Pembuatan Komposit Pelat Bipolar dengan Matriks Polipropilena (PP) dengan Penguat Karbon dan Aditif Polivinylidene Fluoride (PVDf). [Skripsi]. Depok : Universitas Indonesia.
BASF Corporation. 2014. Safe Data Sheet N, N- Dimethylacetamide.
Buchmann, I. 2001. Batteries in a Portable World. Cadex Electronics Inc.
Courtel, Fabrice M et al. 2011. Water Soluble Binders for MCMB Carbon Anodes for Lithium Ion Batteries. Journal of Power Source. 196 : 2128 – 2134.
Gritzner, G., Kreysa, G. 1993. Nomenclature Symbols and Definitions in Electrochemical Engineering. Journal Pure & Appl Chem. 65 : 1009-20
Hudaya, Chairul, Ph.D. 2011. Peranan Riset Baterai Sekunder dalam Mendukung Penyediaan Energi Bersih Di Indonesia 2025. Proceeding Olimpiade Karya Tulis Inovatif (OKTI).
Hossain, S. 1995. Handbook of Batteries. 2nd. New York : McGraw-Hill Inc.
Kawamoto, Hiroshi. 2010. Trends of R & D on Materials for High-power and Large-capacity Lithium ion Batteries for Vehicles Applications. Journal Science & Technology Trends. 36
Kim, K.J., J.H. Kim, M.S. Park, H.K. Kwon, H. Kim and Y.J. Kim et al. 2012. Enhancement of Electrochemical and Thermal Properties of Polyethylene Separators Coated with Polyvinylidene Fluoride Hexafluoropropylene Copolymer for Li-Ion Batteries. Journal Power Source. 198 : 298–302.
Leite, E.R. 2007. Nanostructurd Materials for Electrochemical Energy Production and Storage. Japan : Springer
Linden, David. 2002. Handbook of Batteries. New York : McGraw-Hill Inc.
Marom, R., S.F. Amalraj, N. Leifer, D. Jacob and D. Aurbach. 2001. A Review of Advanced and Practical Lithium Battery Materials. Journal of Materials Chemistry. 21 : 9938–9954.
Minami, T. 2005. Solid State Ionics For Batteries. Japan : University Gakuen-cho Sakai.
Binders for Anatase TiO2 Anodes. [Doctoral Thesis]. Camerino : University of Camerino.
Munshi, M.Z.A. 1995. Handbook of Solid State Batteries & Capacitors. hal : 427- 444 & 469-478.
MTI Corporation. 2010. MCMB (Mesocarbon Microbeads) Graphite Powder. Material Safety Data Sheet.
Oswal, Mehul, Paul Jason and Runhua Zhao. 2010. A Comparative Study Of Lithium Ion Batteries. California : University of Southern California.
Padhi, A.K., Nan Jundaswamy, K.S. and Goodenough, G.B. 2002. Phospo Olivine as Positive-electrode Materials for Rechargeable Lithium Batteries. Journal electrochemical Soc. 144 :1188 - 1194.
Patterson, Mary L, Ph.D. 2009. Anode Materials for Lithium Ion Batteries. Enerdel : Indiana University Battery Workshop.
Prihandoko, Bambang. 2008. Pemamfaatan Soda Lime Silica dalam Pembuatan Komposit Elektrolit Baterai Lithium. [Thesis]. Depok : Universitas Indonesia, Program Pascasarjana.
Priyono, Slamet. 2014. Sintesis Serbuk Li4Ti5O12 yang Didoping Atom Al dan Na untuk Anoda Baterai Ion Lithium. [Thesis]. Depok : Universitas Indonesia.
Recharge. 2013. Safety of Lithium Ion Batteries. Belgium : The European Association for Advanced Rechargeable Batteries.
Rizki, Muhammad. 2014. Upaya Peningkatan Konduktifitas Listrik Katoda LiFePO4 dengan Pelepasan Karbon Tepung Tapioka. [PKL]. Jakarta : Universitas Islam Negeri Syarif Hidayatullah.
Shen, Chin Wei et al. 2014. Low Temperature Process Modified MCMB for Litihium Ion Batteries. Journal Solid State Ionics. 268 : 282 : 287.
Shin, Ho Chul, Won II Cho and Ho Jang. 2006. Electrochemical Properties of Carbon Coated LiFePO4 Chatode Using Graphite, Carbon Black, and Acetylene Black. Journal Electrochimica Acta. 52 : 1472-1476.
Sloop, Steven E, J.K. Pugh, S. Wang, J.B. Kerr and K. Kinoshita. Reactivity of Li-ion Battery Electrolytes. Journal Electrochem Solid State 4 A 42.
Subhan, Achmad. 2011. Fabrikasi dan Karakterisasi Li4Ti5O12 untuk Bahan Anoda Baterai Lithium Keramik. [Thesis]. Depok : Universitas Indonesia.
Triwibowo, Joko. 2011. Rekayasa Bahan LixTiMnyFez(PO4) sebagai Katoda Solid Polimer Battery (SPB) Lithium. [Thesis]. Depok : Universitas Indonesia.
Warren, E. 1969. X-Ray Diffraction. Messach$ssetfs : Addittion-wesley pub.
Wu, Borong, Yonghuan Ren and Ning Li. 2011. LiFePO4 Cathode Material, Electrical Vehicles The Benefits and Barriers. Beijing : School of Chemical Engineering and Environment, Institute of Technology.
Yang, Hui, Guorong V. Zhuang and Philip N. Ross, Jr.Thermal Stability of LiPF6 Salt and Li-ion Battery Electrolytes Containing LiPF6. Berkeley : University of California, Environmental Energy Technologies Division and Material Science Division.
Yao,Yueping. 2003. Carbon Based Anode Materials Lithium Ion Batteries. [Thesis]. University of Wollongong: Institute for Superconducting & Electronic Materials, Faculty of Engineering.
Yoshio, Masaki, Ralph, J. Brodd and Akiya Kozawa. 2009. Lithium Ion Batteries Science and Technologies. Japan : Springer.
Zakaria, 2003. Analisis Kandungan Mineral Magnetik pada Batuan Beku dari Daerah Istimewe Yogyakarta dengan Metode X-Ray Diffiaction. [Skripsi]. Kendari : Fakultas Keguruan dan Ilmu Pendidikan Universitas Haluoleo.
Zhao, Rui, Jie Liu and Junjie Gu. 2015. The effects of electrode thickness on the electrochemical and thermal characteristic of lithium ion battery. Applied Energy. 139 : 220-229.
Zheng, Honghe, Jiang Li, Xiangyun Song, Gao Liu and Vincent S. Battaglia. 2012. A Comprehensive Understanding of Electroda Thickness Effects on The Electrochemical Performance of Lithium ion Battery Cathodes. Journal Electrochimica Acta. 71 : 258-265.
Zheng, et al. 2013. Surface and Structural Stabilities of Carbon Additives in High Voltage Lithium Ion Batteries. Journal of Power Source. 227 : 211-217.
.http://www.targray.com/li-ion-battery/cathode-materials/foil.
BAB 3
METODOLOGI PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 3 bulan, dimulai dari bulan 5 Februari 2015 hingga 5 Mei 2015 di Laboratorium Baterai Pusat Penelitian Fisika (P2F) di Lembaga Ilmu Penelitian Indonesia (LIPI) Serpong, Tangerang Selatan. Penelitian dilakukan dari penyiapan bahan baku sampai baterai dan pengujiannya.
3.2 Peralatan dan Bahan 3.2.1 Peralatan Penelitian
Peralatan yang digunakan dalam penelitian terdiri atas dua bagian yaitu alat proses dan alat karakterisasi.
a. Alat Proses
1. Cawan Petri 3 Buah.
Fungsi : untuk tempat meletakkan serbuk bahan slurry. 2. Gelas Ukur 100 ml 2 buah.
Fungsi : untuk tempat mencampurkan bahan baku dan slurry. 3. Gelas Ukur 25 ml 1 buah.
Fungsi : untuk tempat pelarut DMAC. 4. Spatula.
Fungsi : untuk mengambil dan memasukkan serbuk dari bahan baku. 5. Pipet Tetes 1 buah.
Fungsi : untuk mengambil larutan DMAC. 6. Magnetic Stirrer (Hot Plate HS 65) 1 buah
Fungsi : untuk tempat mencampurkan DMAC, PvDf dan Super P. 7. Magnetic Bar 1 buah
9. Pisau Referensi
Fungsi : untuk mengukur ketebalan laminate saat pembuatan lembaran. 10. Oven 2 buah
Fungsi: untuk mengeringkan sampel dan lembaran elektroda dari kandungan air dan zat organik.
11. Timbangan Digital 1 buah
Fungsi : untuk menimbang serbuk, laminate, lembaran Alumunium dan Tembaga.
12. Mesin Calendering 1 buah
Fungsi : untuk menghomogenisasikan lapisan dan menghilangkan tegangan sisa.
13. Lembaran Kaca 1 buah Fungsi : untuk alas memotong. 14. Penggaris 50 cm 1 buah
Fungsi : untuk mengukur lembaran. 15. Multimeter Digital 1 Buah
Fungsi : untuk memastikan baterai tidak dalam keadaan short current. 16. Pisau 1 buah
Fungsi : untuk memotong lembaran. 17. Baki 4 buah
Fungsi : untuk tempat meletakkan lembaran. 18. MSK SFM 7 (Vacum Mixer) 1 buah
Fungsi : untuk mencampurkan serbuk dan larutan agar homogen. 19. MSK AFA III (Automatic Thick Film Coater) 1 buah
Fungsi : untuk proses coating dalam pembuatan lembaran elektroda. 20. MSK AFA E 300 (Automatic Coating Machine) 1 buah
Fungsi : untuk mengeringkan lembaran elektroda. 21. MSK-120 (Pouch cell case) 1 buah
Fungsi : untuk membuat kantung baterai.
22. MSK-800 (Desk-Top Ultrasonic Metal Welder) 1 buah
23. MSK-112A (Semi Automatic Winding Machine) 1 buah Fungsi : untuk menggulung lembaran (stacking).
24. MSK-140 (Compact Heating Sealer) 1 buah Fungsi : untuk merekat kantung baterai (sealing). 25. Alat – Alat Lain.
Perlengkapan lain yang digunakan antara lain : tissue, sarung tangan, masker, kertas label, spidol, plastik sampel dan lain-lain.
b. Alat Karakterisasi
1. X-Ray Diffraction (XRD)
Fungsinya untuk mengetahui struktur kristal dari serbuk LiFePO4 dan MCMB. 2. Scanning Electron Microscope (SEM)
Fungsinya untuk mengetahui ukuran dan bentuk partikel pada serbuk LiFePO4 dan MCMB serta morfologi lembaran katoda LiFePO4.
3. Mikroskop Optik
Fungsinya untuk mengamati morfologi permukaan lembaran elektroda. 4. Uji charge/discharge (BST8-10A30V)
Fungsinya untuk mengetahui kapasitas baterai.
3.2.2 Bahan Baku Penelitian
Dalam penelitian ini bahan-bahan yang digunakan antara lain : 1. Serbuk LiFePO4 bahan teknis produk Lin Yi Gelon, China.
Fungsinya sebagai material aktif pembuatan katoda baterai ion lithium. 2. Serbuk MCMB bahan teknis produk Lin Yi Gelon, China.
Fungsinya sebagai material aktif pembuatan anoda baterai ion lithium. 3. Serbuk Super P (SP) produk Lin Yi Gelon, China.
Fungsinya sebagai zat aditif.
4. Serbuk PvDf bahan teknis produk Kynar Flex, Arkema. Fungsinya sebagai matriks polimer.
Fungsinya untuk membersihkan semua peralatan. 7. Lembaran Alumunium (Al foil)
Fungsinya sebagai current collector pada lembaran katoda . 8. Lembaran Tembaga (Cu foil)
Fungsinya sebagai current collector pada lembaran anoda. 9. 1 M LiPF6 produk Lin Yi Gelon, China.
Fungsinya sebagai elektrolit.
10. Lembaran Seperator Polypropilene dan Polyethilene produk Celgard, China. Fungsinya sebagai pemisah antara anoda dan katoda.
11. Alumunium Laminate Film
3.3 Diagram Alir Penelitian
3.3.1 Pembuatan Lembaran Elektroda
Dicampur PvDf 0,88 gr pada komposisi 85 : 10 : 5 dan 1,31 gr pada komposisi 80 : 13 : 7 dengan 60 ml pelarut DMAC
Dimasukkan serbuk LiFePO4 sebanyak 15 gr
Di sheet casting dengan doctor blade ke Alumunium
foil dengan ketebalan lapisan100 µm,150 µm, dan
300 µm
Dikeringkan pada suhu110 0C Ditimbang bahan LiFePO4 : Super P : PvDf dengan komposisi
85 : 10 : 5, MCMB dengan komposisi 85 : 10 : 5 dan 80 : 13 : 7.
Dicutting dan calendering
Dimasukkan serbuk Super P sebanyak 1,76 gr pada komposisi 85 : 10 : 5 dan 2,44 gr pada komposisi 80 : 13 : 7
Dimixing di vacum mixer selama 180 menit
Lembaran Katoda LiFePO4
Dimasukkan serbuk MCMB sebanyak 15 gr
Slurry Katoda LiFePO4 Slurry Anoda MCMB 85 : 10 :5
Di sheet casting dengan doctor blade ke Cu foil
dengan ketebalan lapisan100 µm, dan 150 µm
Slurry Anoda MCMB 80 : 13 :7
Di sheet casting dengan doctor blade ke Cu foil
dengan ketebalan lapisan150 µm
Di keringkan selama 16 jam pada suhu 800 C di ruang vakum
Analisis Mikrostruktur Lembaran Anoda MCMB
Dimixing di magnetic stirrer dengan kecepatan 200 rpm dan suhu T = 60 0C
Material Aktif (Uji XRD & SEM)
3.3.2 Proses Assembling Baterai ion Lithium
Digulung lembaran (katoda, anoda dan seperator) sehingga jadi lembaran baterai dengan panjang 8,5 cm, lebar 5 cm dan tebal 3 mm.
Dilas dua lembaran katoda dan dua lembaran anoda yang mempunyai komposisi dan ketebalan bahan yang sama menjadi satu lembaran yang
timbal-balik serta dipasang terminal tab pada lembaran.
Direkatkan celah selesai isi elektrolit
Dimasukkan lembaran baterai ke dalam kantung baterai.
Baterai ion lithium
Uji charge/discharge
Lembaran katoda LiFePO4 dan lembaran Anoda MCMB
Direkatkan pinggiran kantung baterai dan sisakan sedikit untuk celah agar bisa diisi elektrolit
Pengujian
Analisa Data
3.4 Prosedur Penelitian
3.4.1 Pemberian Label pada Sampel Katoda dan Anoda
Untuk mencegah kekeliruan dalam penyebutan sampel yang memiliki komposisi bahan dan ketebalan slurry yang berbeda-beda, maka sampel diberi label/ nama seperti yang tertera dalam Tabel 3.1, 3.2, dan 3.3.
Tabel 3.1. Pembuatan Material Katoda LiFePO4 dengan Komposisi 85 : 10 : 5 Komposisi Bahan Tebal slurry (��) Kode Sample Filler : Aditif : Matriks
(85 : 10 : 5)
Filler (LiFePO4) = 15 gram Aditif (SP) = 1,76 gram Matriks (PvDf) = 0,88 gram
Larutan DMAC = 60 ml
100 LFP 85:10:5 (100)
150 LFP 85:10:5 (150)
300 LFP 85:10:5 (300)
Tabel 3.2. Pembuatan Material Anoda MCMB dengan Komposisi 85 : 10 : 5 Komposisi Bahan Tebal slurry��) Kode Sample Filler : Aditif : Matriks
(85 : 10 : 5)
Filler (MCMB) = 15 gram Aditif (SP) = 1,76 gram Matriks (PvDf) = 0,88 gram Larutan DMAC = 60 ml
100 MC 85:10:5 (100)
150 MC 85:10:5 (150)
Tabel 3.3. Pembuatan Material Anoda dengan Komposisi 80 : 13 : 7 Komposisi Bahan Tebal slurry��) Kode Sample Filler : Aditif : Matriks
(80 : 13 : 7)
Filler (MCMB) = 15 gram Aditif (SP) = 2,44 gram Matriks (PvDf) = 1,31 gram
3.4.2 Tahap Pembuatan Lembaran Elektroda 1. Persiapan Bahan Katoda dan Anoda
Tahap persiapan yaitu meliputi penyiapan semua bahan dan alat yang digunakan. Bahan katoda ditimbang dengan perbandingan komposisi LiFePO4, Super P, PvDf 85 : 10 : 5 dan bahan anoda MCMB dengan komposisi 85 : 10 : 5 dan 80 : 13 : 7. Massa semua bahan dapat dilihat pada Tabel 3.1, 3.2, dan 3.3.
Masing–masing bahan ditempatkan kedalam beaker glass yang berbeda, dan diberi label agar tidak tertukar dengan bahan lain. Semua bahan ditutup dengan Alumunium foil dan dimasukkan dalam oven dengan suhu 80 0C selama 24 jam kecuali larutan DMAC.
2. Pembuatan Slurry Katoda dan Anoda
Tahap pembuatan slurry terdiri dari beberapa langkah yaitu :
a. Dicampurkan bahan PvDf dan pelarut DMAC 25 ml kedalam satu beaker glass dan diletakkan magnetic bar didalamnya. Diletakkan beaker glass tersebut diatas magnetic stirrer dan diatur suhunya 60 0C dan kecepatan putarannya 200 rpm selama 30 menit sampai larutan homogen yang ditandai dengan larutan berubah warna menjadi bening.
b. Dimasukkan serbuk Super P sedikit demi sedikit disertai penambahan larutan DMAC 5 ml saat magnetic bar tidak dapat berputar. Proses berlangsung selama 60 menit dengan total penambahan DMAC sebanyak 35 ml.
a) b)
c. Dimasukkan serbuk LiFePO4 kedalam wadah pemutar vacum mixer dan di mixing di vacum mixer selama 180 menit.
a) b)
Gambar 3.2. a) Proses Mixing di Vacum Mixer, b) Slurry Katoda LiFePO4 Proses pembuatan slurry untuk anoda MCMB sama dengan langkah proses pembuatan slurry katoda seperti tahap-tahap diatas.
3. Penyetakan lembaran/ sheet casting
Setelah pengadukan campuran matriks, aditif, dan filler maka campuran siap dijadikan lembaran katoda. Docter blade dibersihkan dengan Aceton, lalu kecepatanya diatur dengan range 5-7 dan presisi celah docter blade diatur dengan ketebalan 100 ��.
Gambar 3.3. Proses Sheet Casting Katoda LiFePO4 dengan Doctor Blade
coating selesai, lembaran katoda diangkat dengan kertas paper dan dikeringkan pada suhu 110 0C di MSK AFA E300 sampai benar-benar kering. Dengan langkah yang sama untuk ketebalan laminate katoda LiFePO4 150 μm dan 300 μm.
Gambar 3.4. Proses Pengeringan Lembaran Katoda dengan MSK-AFA E 300
Proses pembuatan lembaran/sheet casting anoda MCMB sama dengan cara pembuatan lembaran katoda LiFePO4 hanya saja slurry di coating di lembaran tembaga (Cu foil).
Gambar 3.5. Proses Sheet Casting Anoda MCMB dengan Doctor Blade
Lembaran anoda dan katoda disimpan didalam oven saat belum dikerjakan agar menjaga bahan tidak terkontaminasi dengan kelembaban udara (uap air), karena dapat menyebabkan bahan rusak.
4. Proses Pemotongan (Cutting) dan Calendring
Lembaran katoda dipotong dengan ukuran laminate 8,1 cm x 27,5 cm dan sedangkan lembaran anoda dipotong dengan ukuran 8 cm x 30 cm.
Lembaran katoda dan anoda di calendring dan ketebalannya diukur setelah calendring.
Gambar 3.7. Proses Calendring Lembaran Elektroda dengan Mesin Calendring
Selesai di calendring, dua lembaran katoda dengan komposisi dan ketebalan yang sama dilas menjadi satu lembaran timbal balik dan dipasang alumunium tab pada lembaran tersebut. Begitu juga dengan lembaran anoda namun terminalnya dengan nickel tab. Lembaran elektroda tersebut kemudian dikeringkan didalam oven dengan suhu 80 0C dalam ruang vakum selama 16 jam.
3.4.3 Tahap Proses Assembling Baterai ion Lithium
Lembaran katoda yang telah dibuat bolak-balik bersama lembaran anoda dan seperator digulung dengan menggunakan alat yang bernama MSK-112A sehingga di dapat lembaran baterai. Lembaran baterai yang dibuat dengan panjang 8,5 cm, lebar 5 cm dan ketebalan 3 mm.
Gambar 3.8. Proses Penggulungan Lembaran Elektroda dengan Seperator
Gambar 3.9. Proses Pemasukan Lembaran Baterai dalam Kantung Baterai
Pinggiran kantung baterai direkatkan dan sisakan sedikit untuk celah agar bisa diisi elektrolit dengan menggunakan alat yang bernama MSK-140.
Gambar 3.10. Proses Perekatan Pinggiran Kantung Baterai dengan Alat MSK 140
Baterai diisi elektrolit sebanyak 5 ml didalam Glove box dan direkatkan celah untuk mengisi elektrolit tersebut.
Gambar 3.11. Proses Pengisian Elektrolit dalam Glove Box
Didiamkan baterai selama minimal 16 jam didalam ruangan agar elektrolit meresap sempurna kedalam elektroda dan seperator sebelum dilakukan pengujian.
BAB 4
HASIL DAN PEMBAHASAN
4.1 Analisa Hasil XRD terhadap Material Aktif Elektroda
Karakterisasi serbuk material aktif dilakukan dengan pengujian XRD dengan sumber radiasi CuKα (λ = 1,54056 Å) yang dioperasikan pada tegangan 40 kV
dan arus 30 mA. Analisis XRD dilakukan menggunakan metode Rietveld dengan software Rigaku PDXL dengan standard kalayakan analisis XRD yang ideal yaitu
nilai chi2 = 1 ± 0.3 dan nilai Rwp ≤ 10 %.
4.1.1 Material Aktif Katoda LiFePO4
Hasil pola difraksi sinar–X material aktif katoda LiFePO4 dapat dilihat pada Grafik 4.1. dibawah ini.
Dari hasil XRD yang ditunjukkan pada Grafik 4.1. terlihat bahwa fasa yang terbentuk adalah fasa tunggal LiFePO4. Hal ini ditunjukkan dengan ditemukannya tiga nilai dobs yaitu 2,5167 Å, 3,4765 Å dan 2,9973 Å sesuai dengan standard ICDD (International Center for Diffraction Data) untuk LiFePO4 dengan PDF 4 nomor 04-014-1691.
Hasil XRD menunjukkan sistem kristal yang terbentuk adalah orthorombik dengan struktur kristal Simple Cubic (SC) dengan Space group Pnma. Hal ini ditunjukkan dengan nilai parameter kisi yaitu a = 10.329 Å, b = 6.0067 Å, dan c = 4.6916 Å (a ≠b ≠ c ) dan memiliki sudut α = β = γ = 90o.
Hasil analisis Rietvield untuk serbuk LiFePO4 menunjukkan nilai Residu weight percent (Rwp) sebesar 10.18 % dan chi2 sebesar 1.0362. Nilai tersebut telah memenuhi standard analisis XRD sehingga dapat dikatakan bahwa hasil XRD sudah baik dan memenuhi standard kelayakan diatas.
Nilai fisis berupa parameter kisi, densitas, serta identitas struktur kristal dari serbuk LiFePO4 hasil analisis XRD terhadap database yang ada pada software PDXL dapat terlihat pada tabel 4.1.
Tabel 4.1. Parameter Kisi Serbuk LiFePO4 Hasil Pembacaan Software PDXL
Senyawa Sistem Kristal Space Group
LiFePO4 Orthorombik Pnma
4.1.2 Material Aktif Anoda MCMB
Hasil pola difraksi sinar–X material aktif anoda MCMB dapat dilihat pada Grafik 4.2. dibawah ini.
Grafik 4.2. Pola Difraksi Sinar– X pada Serbuk MCMB
Dari hasil XRD yang ditunjukkan pada Grafik 4.2. terlihat bahwa fasa yang terbentuk adalah fasa tunggal Graphite 2H. Hal ini ditunjukkan dengan ditemukannya tiga nilai dobs yaitu 3,3670 Å, 2,0283 Å dan 1,6806 Å sesuai dengan standard ICDD (International Center for Diffraction Data) untuk Graphite 2H dengan PDF 4 nomor 00-041-1487 yaitu dref = 3,3756 Å, 2,0390 Å dan 1,6811 Å.
Hasil XRD menunjukkan sistem kristal yang terbentuk adalah heksagonal dengan struktur kristal Simple Cubic (SC) dengan Space group P63/mmc. Hal ini ditunjukkan dengan nilai parameter kisi yaitu a = 2,4597 Å, b = 2,4597 Å, dan c = 6,735 Å (a = b ≠c) dan memiliki sudut α = β = 90o dan γ =1200.
belum memenuhi kelayakan karena kemungkinan masih terdapat pengotor (impurities) dalam bentuk amorf sehingga tidak terdeteksi oleh XRD.
Nilai fisis berupa parameter kisi, densitas, serta identitas struktur kristal dari serbuk MCMB hasil analisis XRD terhadap database yang ada pada software PDXL dapat terlihat pada tabel 4.2.
Tabel 4.2. Parameter Kisi Serbuk MCMB Hasil Pembacaan Software PDXL
Senyawa Sistem Kristal Space Group
Paramaeter Kisi (Å) Vol
(Å)
Density
(g/cm³)
a b c
Graphite 2H Heksagonal P63/mmc
2.4597
2.4597 6.735 35.29 2.255
* Sudut α = β = 900, γ = 1200
4.2 Analisa Morfologi Serbuk Material Aktif Elektroda dengan SEM
4.2.1 Material Aktif Katoda LiFePO4
Morfologi permukaan butiran serbuk LiFePO4 dapat dilihat pada Gambar 4.1. dibawah ini.
a) b)
Berdasarkan Gambar 4.1. terlihat bahwa aglomerasi partikel LiFePO4 memiliki ukuran yang sangat kecil sehingga memerlukan perbesaran yang cukup
tinggi untuk melihat morfologinya dengan jelas. Pada perbesaran 5000
x
mulaitampak aglomerasi partikel LiFePO4 namun belum cukup jelas terlihat bentuk dan ukuran partikelnya. Pada perbesaran tersebut tampak bahwa aglomerasi butir yang satu dengan yang lainnya tidak dapat dibedakan batas antar butirnya. Aglomerasi
partikel LiFePO4 tampak jelas pada perbesaran 10.000
x
yang bentuk butirnya bervariasi (polyhedral) seperti lonjong, bulat, dan tidak beraturan. Namun, aglomerasi partikel LiFePO4 dominan berbentuk lonjong (oval) serta memiliki ukuran partikel yang tidak seragam dengan ukuran rata-rata partikel (D50) sebesar 2,99 µm dan terdapat juga yang berukuran sebesar 0,36 µm dan 11,66 µm. Ukuran dan bentuk aglomerasi partikel yang tidak seragam tersebut akan memberikan pengaruh pada performa baterai.4.2.2 Material Aktif Anoda MCMB
Morfologi permukaan butiran serbuk MCMB dapat dilihat pada Gambar 4.2. dibawah ini.
a) b)
Morfologi permukaan butiran serbuk anoda MCMB dengan SEM pada
perbesaran 1000
x
dan 2000x
dapat dilihat pada Gambar 4.2. Tampak aglomerasipartikel MCMB rata-rata mempunyai bentuk bulat dan terdiri dari partikel grafit yang berukuran tidak seragam. Namun, masih terdapat juga partikel yang berbentuk tidak beraturan. Keberadaan aglomerasi partikel yang berbentuk tidak beraturan ini akan memberikan pengaruh pada densitas muatan yang lebih besar. Ukuran aglomerasi partikel bulat pada serbuk MCMB dari gambar SEM pada
perbesaran 2000
x
dapat diukur dengan bantuan software Image J. Perkiraanukuran partikel MCMB dari hasil ukur software Image J, rata-rata partikel bulat MCMB memiliki ukuran 141 µm dengan ukuran partikel bulat terkecil yaitu 37 µm sedangkan partikel bulat yang terbesar memiliki ukuran 312 µm.
4.3 Analisa Morfologi Lembaran Elektroda dengan Mikroskop Optik
Untuk melihat struktur mikro dan kehomogenan pada lembaran elektroda maka
menggunakan alat Mikroskop Optik dengan perbesaran 40
x
.4.3.1 Lembaran Katoda LiFePO4
Hasil pengamatan struktur mikro dan kehomogenan morfologi lembaran
katoda LiFePO4 dengan Mikroskop Optik perbesaran 40
x
dapat dilihat pada Gambar 4.3.c) d)
Gambar 4.3. Hasil Mikroskop Optik pada Lembaran Katoda LiFePO4 a) Serbuk LiFePO4, b) Ketebalan Laminate 100 µm,
c) Ketebalan Laminate 150 µm dan d) Ketebalan Laminate 300 µm
Dari Gambar 4.3. Hasil Mikroskop Optik menunjukkan bahwa lembaran katoda yang terdiri atas campuran antara material aktif katoda (LiFePO4), zat aditif (Super P) dan matriks (PvDf) sulit untuk melihat distribusi dari masing-masing bahan tersebut. Struktur mikro dari LiFePO4 hampir merata disetiap permukaan sedangkan Super P tertutupi oleh material aktif LiFePO4. Hal ini karena komposisi material LiFePO4 yang lebih dominan dengan perbandingan komposisi LiFePO4 : Super P : PvDf (85 : 10 : 5). Pada perbesaran 40
x
pada mikroskop optik tampak butiran cukup merata dan halus (homogen) pada permukaan laminate katoda.Pada ketebalan laminate yang berbeda (100 µm, 150 µm dan 300 µm) pada lembaran katoda, tidak terlihat perbedaan yang jelas karena lembaran memiliki komposisi yang sama sehingga struktur mikro dari LiFePO4 terlihat jelas dari masing–masing ketebalan. Pada pengamatan mikroskop optik, gambar tampak tidak terfokus karena ketebalan yang tidak merata pada permukaan laminate katoda. Ketebalan yang tidak merata pada permukaan laminate tersebut karena
4.3.2 Lembaran Anoda MCMB
Hasil pengamatan struktur mikro dan kehomogenan pada lembaran anoda
MCMB menggunakan alat Mikroskop Optik dengan perbesaran 40
x
dapat dilihatpada Gambar 4.4.
a) b)
c) d)
Gambar 4.4. Hasil Mikroskop Optik pada Lembaran anoda MCMB a) Serbuk MCMB, b) Komposisi 80 : 13 : 7 Ketebalan 150 µm, b) Komposisi 85 : 10: 5 Ketebalan c) 100 µm dan d) 150 µm
Dari Gambar 4.4. Hasil Mikroskop Optik menunjukkan bahwa semakin besar komposisi dan ketebalan pada lembaran anoda MCMB maka semakin
80 : 13 : 7 dengan ketebalan 150 µm terlihat partikel grafitnya tampak sedikit dibandingkan komposisi bahan aktif MCMB pada komposisi 85 : 10 : 5 dengan ketebalan 100 µm dan 150 µm.
Pada lembaran anoda sulit untuk membedakan struktur mikro dari masing-masing bahan penyusunnya. Struktur mikro dari partikel MCMB tersebar hampir merata sedangkan Super P tertutupi oleh material aktif MCMB. Struktur mikro dari serbuk MCMB terlihat jelas pada setiap perbedaan komposisi dan ketebalan karena komposisi material aktif MCMB yang dominan dibandingkan zat aditif (Super P) dan matriks polimer (PvDf) serta ukuran partikel MCMB yang besar
sehingga pada perbesaran 40
x
tampak jelas distribusi partikel grafit padalembaran.
4.4 Analisa Morfologi Lembaran Katoda LiFePO4 dengan SEM
Analisa morfologi permukaan pada lembaran katoda LiFePO4 pada komposisi 85 : 10 : 5 dengan SEM pada perbesaran 1000
x
dan 5000x
dengan tegangan 20kV. Morfologi permukaan dapat dilihat pada Gambar 4.5. dibawah ini.
a) b)
Gambar 4.5. Hasil Morfologi Lembaran Katoda LiFePO4 dengan SEM Perbesaran a) 1000
x
dan b) 5000x
Morfologi permukaan lembaran katoda LiFePO4 dengan SEM pada perbesaran 1000
x
tampak bahwa lembaran adalah homogen. Hal ini terlihat daripartikel LiFePO4 dan Super P yang tersebar hampir merata pada seluruh permukaan dan terikat dengan baik oleh partikel PvDf. Pada perbesaran ini belum cukup untuk melihat struktur morfologi dari masing-masing partikel penyusun katodanya karena ukuran partikelnya sangat kecil.
Hal ini dapat dilihat berdasarkan hasil mapping dari SEM yang ditunjukkan pada Gambar 4.6.
a) b) c)
Fe F
C
d) e)
Gambar 4.6. a) Unsur Fe, b) Unsur F, c) Unsur C, d) Maping Mix SEM dan e) SEM
Berdasarkan hasil mapping mix SEM tampak bahwa partikel LiFePO4 tersebar merata pada seluruh permukaan karena unsur ini yang memiliki komposisi dominan dibandingkan dengan zat aditif dan matriksnya. PvDf juga tersebar merata dan mengikat baik antara partikel LiFePO4 dan sumber karbon Super P.
Partikel LiFePO4 yang terselimuti oleh karbon tersebar tidak merata. Ada partikel LiFePO4 yang tertutupi tebal oleh karbon seluruhnya ditandai dengan warna abu-abu tua, ada yang hanya tertutupi tipis oleh karbon ditandai dengan warna abu-abu muda dan ada yang tertutupi karbon hanya sebagian saja.
Adanya partikel LiFePO4 yang tertutupi tebal oleh sumber karbon aditif dapat menurunkan performa baterai karena menyebabkan ion lithium susah keluar maupun masuk kedalam struktur host LiFePO4. Hal ini karena karbon aditif bersifat elektron konduktif bukan ion konduktif. Melekatnya karbon pada partikel LiFePO4 dapat dikarenakan komposisi zat aditif yang digunakan mungkin terlalu banyak. Walaupun sumber karbon berfungsi untuk meningkatkan konduktifitas listrik namun jika komposisinya terlalu banyak dapat menyebabkan berkurangnya kapasitas sel dan densitas energi.
4.5 Analisa Hasil Pengujian Charge – Discharge
4.5.1 Dengan Anoda MCMB 85 : 10 : 5 Ketebalan 150 µm
Hasil pengujian charge-discharge pada masing-masing ketebalan katoda LiFePO4 pada komposisi 85 : 10 : 5 dengan anoda MCMB komposisi 85 : 10 : 5 dengan ketebalan 150 µm.
1. Baterai LD 1 (Ketebalan 100 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 1 dapat dilihat pada Grafik 4.3. dibawah ini. Baterai LD 1 di charge dengan arus tetap 7,9 mA pada range tegangan 2,5 – 3,5 Volt.
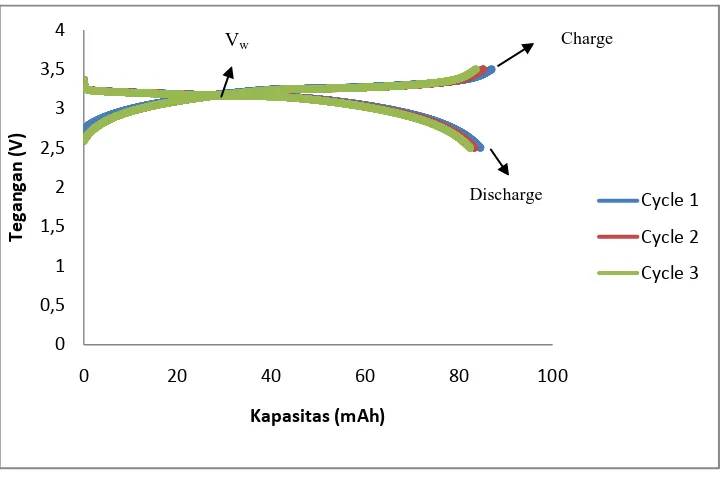
Grafik 4.3. Kapasitas pada Baterai LD 1 pada Cycle ke 1, 2 dan 3
Berdasarkan Grafik 4.3. tegangan kerja (Vw) baterai LD 1 mencapai 3,3 V. Kapasitas terus mengalami penurunan dengan besarnya kapasitas discharge yang hilang dari cycle pertama sampai cycle ketiga yaitu 2,46 %.
Besarnya kapasitas charge-discharge pada baterai LD 1 dapat dilihat pada tabel 4.3. dibawah ini.
Tabel 4.3. Kapasitas Baterai LD 1 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Hasil pengujian kapasitas charge-discharge pada baterai LD 2 dapat dilihat pada Grafik 4.4. dibawah ini. Pada baterai LD 2 di charge dengan arus tetap 9,1 mA pada range tegangan 2,5 – 3,5 Volt.
Grafik 4.4. Kapasitas pada Baterai LD 2 pada Cycle ke 1, 2 dan 3
Berdasarkan Grafik 4.4. maka besar kapasitas charge-discharge pada baterai LD 2 dapat dilihat pada tabel 4.4.
Tabel 4.4. Kapasitas Baterai LD 2 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 87 84,6
Cycle 2 85,2 83,3
Cycle 3 83,6 82,4
Tegangan kerja (Vw) baterai LD 2 mencapai 3,3 V. Besarnya kapasitas discharge yang hilang dari cycle pertama sampai cycle ketiga yaitu 2,6 %.
3. Baterai LD 3 (Ketebalan 300 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 3 dapat dilihat pada Grafik 4.5. dibawah ini. Baterai LD 3 di charge dengan arus tetap 16,5 mA dengan range tegangan 2,5 – 3,5 Volt.
Grafik 4.5. Kapasitas pada Baterai LD 3 pada Cycle ke 1, 2 dan 3 Charge
Discharge
Berdasarkan Grafik 4.5. maka besar kapasitas charge-discharge pada baterai LD 3 dapat dilihat pada tabel 4.5.
Tabel 4.5. Kapasitas Baterai LD 3 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 191,8 176,3
Cycle 2 177 174
Cycle 3 174,5 173,2
Tegangan kerja (Vw) baterai LD 3 mencapai 3,3 V. Besarnya kapasitas discharge yang hilang dari cycle pertama sampai cycle ketiga yaitu 1,76 %.
4. Kapasitas Baterai pada Cycle Ketiga pada Setiap Ketebalan Katoda LiFePO4 Besarnya kapasitas pada masing-masing ketebalan katoda LiFePO4 pada cycle ketiga dapat dilihat pada Grafik 4.6. dibawah ini.
Grafik 4.6. Kapasitas pada Baterai LD 1, LD 2 dan LD 3 pada Cycle Ketiga
Berdasarkan Grafik 4.6. besarnya kapasitas spesifik dan efisiensi baterai dapat ditentukan hasilnya. Kapasitas spesifik dan efisiensi baterai pada cycle ketiga dapat dilihat hasilnya pada tabel 4.6.
Tabel 4.6. Hasil Kapasitas Charge–Discharge Baterai dengan Komposisi Anoda MCMB 85 : 10 : 5 Ketebalan 150 µm
Kode Baterai
Material Katoda LiFePO4
(85 : 10 : 5)
4.5.2 Dengan Anoda MCMB 80 : 13 : 7 Ketebalan 150 µm
Hasil pengujian charge-discharge pada masing-masing ketebalan katoda LiFePO4 pada komposisi 85 : 10 : 5 dengan anoda MCMB komposisi 80 : 13 : 7 pada ketebalan 150 µm.
1. Baterai LD 4 (Ketebalan 100 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 4 dapat dilihat pada Grafik 4.7. dibawah ini. Baterai LD 4 di charge dengan arus tetap 9,8 mA pada range tegangan 2,5 – 3,5 Volt.
Grafik 4.7. Kapasitas pada Baterai LD 4 pada Cycle ke 1, 2 dan 3
Besarnya kapasitas charge-discharge pada baterai LD 4 dapat dilihat pada tabel 4.7. dibawah ini.
Tabel 4.7. Kapasitas Baterai LD 4 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Hasil pengujian kapasitas charge-discharge pada baterai LD 5 dapat dilihat pada Grafik 4.8. dibawah ini. Baterai LD 5 di charge dengan arus tetap 12,8 mA pada range tegangan 2,5 – 3,5 Volt.
Berdasarkan Grafik 4.8. maka besar kapasitas charge-discharge pada baterai LD 5 dapat dilihat pada tabel 4.8.
Tabel 4.8. Kapasitas Baterai LD 5 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 128,6 126
Cycle 2 126 124
Cycle 3 124 122,2
Tegangan kerja (Vw) baterai LD 5 mencapai 3,3 V. Besarnya kapasitas discharge yang hilang dari cycle pertama sampai cycle ketiga yaitu 3,0 %.
3. Baterai LD 6 (Ketebalan 300 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 6 dapat dilihat pada Grafik 4.9. dibawah ini. Baterai LD 6 di charge dengan arus tetap 24,1 mA dengan range tegangan 2,5 – 3,5 Volt.
Berdasarkan Grafik 4.9. maka besar kapasitas charge-discharge pada baterai LD 6 dapat dilihat pada tabel 4.9.
Tabel 4.9. Kapasitas Baterai LD 6 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 227,7 224
Cycle 2 224,7 222
Cycle 3 222,7 220,4
Tegangan kerja (Vw) baterai LD 6 mencapai 3,3 V. Besarnya kapasitas discharge yang hilang pada cycle pertama sampai cycle ketiga yaitu sebesar 1,6 %.
4. Kapasitas Baterai pada Cycle Ketiga pada Setiap Ketebalan Katoda LiFePO4 Besarnya kapasitas pada masing-masing ketebalan katoda LiFePO4 pada cycle ketiga dapat dilihat pada Grafik 4.10. dibawah ini.
Berdasarkan Grafik 4.10. besarnya kapasitas spesifik dan efisiensi baterai dapat ditentukan hasilnya. Kapasitas spesifik dan efisiensi baterai pada cycle ketiga dapat dilihat hasilnya pada tabel 4.10.
Tabel 4.10. Hasil Kapasitas Charge-Discharge Baterai dengan Komposisi Anoda MCMB 80 : 13 : 7 Ketebalan 150 µm
Kode Baterai
Material Katoda LiFePO4
(85 : 10 : 5)
4.5.3 Dengan Anoda MCMB 85 : 10 : 5 Ketebalan 100 µm
Hasil pengujian charge-discharge pada masing-masing ketebalan katoda LiFePO4 pada komposisi 85 : 10 : 5 dengan anoda MCMB komposisi 85 : 10 : 5 dengan ketebalan 100 µm.
1. Baterai LD 7 (Ketebalan 100 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 7 dapat dilihat pada Grafik 4.11. dibawah ini. Baterai LD 7 di charge dengan arus tetap 10 mA pada range tegangan 2,5 – 3,5 Volt.
Grafik 4.11. Kapasitas pada Baterai LD 7 pada Cycle ke 1, 2 dan 3
Besar kapasitas charge-discharge pada baterai LD 7 dapat dilihat pada tabel 4.11. dibawah ini.
Tabel 4.11. Kapasitas Baterai LD 7 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 109 108
Cycle 2 108 106,3
Cycle 3 106,6 106
2. Baterai LD 8 (Ketebalan 150 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 8 dapat dilihat pada Grafik 4.12. dibawah ini. Baterai LD 8 di charge dengan arus 14,6 mA pada range tegangan 2,5 – 3,5 Volt.
Grafik 4.12. Kapasitas pada Baterai LD 8 pada Cycle ke 1, 2 dan 3 Charge
Discharge
Berdasarkan Grafik 4.12. maka besar kapasitas charge-discharge pada baterai LD 8 dapat dilihat pada tabel 4.12.
Tabel 4.12. Kapasitas Baterai LD 8 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 160 141,7
Cycle 2 142 138
Cycle 3 138,7 136,2
Tegangan kerja (Vw) baterai LD 8 mencapai 3,3 V. Besarnya kapasitas discharge yang hilang dari cycle pertama sampai cycle ketiga yaitu sebesar 3,88 %.
3. Baterai LD 9 (Ketebalan 300 µm)
Hasil pengujian kapasitas charge-discharge pada baterai LD 9 dapat dilihat pada Grafik 4.13 dibawah ini. Baterai LD 9 di charge dengan arus 22,3 mA pada range tegangan 2,5 – 3,5 Volt.
Berdasarkan Grafik 4.13. maka besar kapasitas charge-discharge pada baterai LD 9 dapat dilihat pada tabel 4.13.
Tabel 4.13. Kapasitas Baterai LD 9 pada Cycle ke 1, 2 dan 3
Cycle Kapasitas (mAh)
Charge Discharge
Cycle 1 216,2 214,5
Cycle 2 214 212,7
Cycle 3 212,5 211,2
Tegangan kerja (Vw) pada baterai LD 9 mencapai 3,3 V. Besarnya kapasitas discharge yang hilang dari cycle pertama sampai cycle ketiga yaitu sebesar 1,54 %.
4. Kapasitas Baterai pada Cycle Ketiga pada Setiap Ketebalan Katoda LiFePO4 Besarnya kapasitas pada masing-masing ketebalan katoda LiFePO4 pada cycle ketiga dapat dilihat pada Grafik 4.14. dibawah ini.
Grafik 4.14. Kapasitas pada Baterai LD 7, LD 8 dan LD 9 pada Cycle Ketiga
Vw
Berdasarkan Grafik 4.14. besarnya kapasitas spesifik dan efisiensi baterai dapat ditentukan hasilnya. Kapasitas spesifik dan efisiensi baterai pada cycle ketiga dapat dilihat hasilnya pada tabel 4.14.
Tabel 4.14. Hasil Kapasitas Charge–Discharge Baterai dengan Komposisi Anoda MCMB 85 : 10 : 5 ketebalan 100 µm
*Luas laminate lembaran anoda = 480 cm2
Kapasitas pada masing-masing sel baterai semakin menurun ketika dilakukan pengisian cycle berikutnya. Pada cycle pertama menunjukkan nilai tertinggi, sedangkan pada cycle ketiga kapasitas menjadi menurun sekitar 1,5 - 4 %. Penurunan kapasitas yang terjadi mengindikasikan ion Li+ yang berinterkalasi/deinterkalasi mengalami jumlah yang menurun. Hilangnya kapasitas pada setiap cycle nya dapat terjadi akibat deposisi SEI (Solid Electrolyte Interphase) pada struktur mikroanoda (grafit). Pembentukan lapisan SEI ini terjadi karena dekomposisi bahan elektroda grafit dan elektrolit cair (LiPF6). Lithium tidak stabil dalam semua elektrolit sehingga permukaan grafit yang terkena elektrolit secara kinetik dilindungi oleh SEI. Pembentukan SEI secara efektif untuk mengurangi kapasitas irreversible dan kegagalan baterai. Oleh karena itu, SEI sangat berperan penting untuk proses charge-discharge selanjutnya karena mencegah dekomposisi elektrolit selanjutnya.
irreversible yang rendah dibawah 2 % sehingga baterai akan memiliki life time yang panjang. Tegangan setiap sel baterai pun mampu bertahan dari 2,5 - 3,5 V dan tegangan saat proses charging sudah mencapai karakteristik tegangan kerja untuk katoda LiFePO4 sebesar 3,3 V.
Berdasarkan hasil charge-discharge pada semua baterai dapat dilihat pengaruh ketebalan katoda LiFePO4 pada kapasitas baterai ion lithium. Pengaruh ketebalan terhadap besarnya kapasitas pada masing-masing baterai dapat dilihat pada Grafik 4.6, 4.10 dan 4.14. Kapasitas mengalami kenaikan dengan meningkatnya ketebalan laminate pada lembaran katoda LiFePO4. Hal ini karena semakin meningkatnya ketebalan laminate maka semakin besar massa aktif LiFePO4 yang terkandung didalam lembaran tersebut sehingga sumber ion lithium yang akan dihasilkan semakin besar. Hal ini sesuai dengan besar kapasitas baterai secara teori yang dipengaruhi oleh jumlah material aktif katoda yang terkandung. Pada masing-masing baterai memiliki kapasitas yang terbesar pada ketebalan laminate katoda 300 µm dan kapasitas terkecil pada ketebalan laminate 100 µm.
Berdasarkan Tabel 4.6, 4.10 dan 4.14 maka kapasitas spesifik yang tertinggi yaitu pada baterai LD 9 sebesar 88 mAh/gr. Sedangkan kapasitas spesifik yang terendah yaitu pada baterai LD 1 sebesar 52,81 mAh/gr. Berdasarkan hasil penelitian sebelumnya, untuk bahan teknis kapasitas baterai untuk LiFePO4 mencapai 70 mAh/gr. Oleh karena itu, kapasitas yang dihasilkan pada penelitian ini cukup baik. Namun, jika dibandingkan dengan besarnya kapasitas spesifik secara teori masih mencapai setengahnya yaitu untuk katoda LiFePO4 sebesar 170 mAh/gr.
larutnya filler dan zat aditif dalam larutan polimer, sehingga saat proses pelapisan dengan banyaknya filler yang digunakan menyebabkan terjadi pengendapan filler kebagian dasar wadah hingga tidak homogennya slurry saat dituang ke Alumunium foil. Pengendapan filler ini juga terjadi karena terus berkurangnya jumlah pelarut pada slurry yang disebabkan pelarut DMAC yang digunakan akan mengalami penguapan sedikit demi sedikit pada temperatur kamar. Pendistribusian partikel yang tidak merata tersebut terlihat jelas pada hasil pengamatan morfologi lembaran katoda LiFePO4 dengan SEM pada Gambar 4.6.
Untuk variasi komposisi pada anoda MCMB dengan komposisi 85 : 10 : 5 dan 80 : 13 : 7 pada ketebalan laminate yang sama yaitu 150 µm maka kapasitas spesifik yang tertinggi pada masing-masing ketebalan katoda LiFePO4 yaitu dengan anoda komposisi 80 : 13 : 7 (baterai LD 4, LD 5, dan LD 6). Perbandingan kapasitas spesifik pada variasi komposisi anoda dapat dilihat pada Grafik 4.15. dibawah ini.
Grafik 4.15. Kapasitas Spesifik Baterai ion Lithium pada Variasi Komposisi Anoda
Perbedaan kapasitas yang dihasilkan pada variasi komposisi anoda dipengaruhi oleh kualitas dari lembaran anoda. Pada komposisi Anoda MCMB 85 : 10 : 5 tampak pada lembaran mudahnya laminate terlepas dari current
komposisi yang tidak optimal antara filler (MCMB), zat aditif (Super P) dan matriks (PvDf). Massa material aktif MCMB yang besar dengan massa matriks PvDf yang sedikit, maka lembaran akan tidak melekat dengan baik karena massa PvDf yang digunakan tidak cukup untuk mengikat bahan laminate dan bahan laminate dengan current collector. Sedangkan pada anoda MCMB dengan komposisi 80 : 13 : 7 tampak laminatenya melekat dengan baik ditandai dengan tidak mudahnya rontok laminate pada lembaran. Hal ini karena komposisi PvDf yang digunakan cukup optimal untuk mengikat bahan laminate dan bahan laminate dengan current collector.
Pada perbandingan komposisi yang sama antara katoda dan anoda (85 : 10 : 5) memiliki perbedaan pada kualitas lembarannya. Kualitas lembaran katoda LiFePO4 melekat dengan baik pada komposisi tersebut tetapi pada lembaran anoda mudahnya laminate terlepas dari current collector. Hal ini terjadi karena perbedaan ukuran partikel antara LiFePO4 dan serbuk MCMB yang terlihat dari hasil SEM pada Gambar 4.1 dan 4.2. Serbuk LiFePO4 memiliki ukuran rata-rata partikel yang kecil 2,99 µm sehingga larutan PvDf dapat mengikat dengan baik antara partikel LiFePO4 dan zat aditif Super P. Sedangkan pada serbuk MCMB memiliki ukuran partikel yang besar dengan ukuran rata-rata 141 µm. Pada jumlah massa PvDf dan volume pelarut yang sama, maka larutan PvDf tidak cukup untuk mengikat antara serbuk MCMB dan zat aditif Super P sehingga pada komposisi tersebut laminate pada lembaran anoda mudah mengalami kerontokan.
Perbandingan kapasitas spesifik pada variasi ketebalan anoda dapat dilihat pada Grafik 4.16. dibawah ini.
Grafik 4.16. Kapasitas Spesifik Baterai ion Lithium pada Variasi Ketebalan
Anoda
Perbedaan hasil kapasitas pada variasi ketebalan anoda juga dipengaruhi oleh kualitas dari lembaran. Kualitas lembaran pada komposisi anoda MCMB 85 : 10 : 5 dengan ketebalan laminate 100 µm lebih baik dibandingkan dengan ketebalan laminate 150 µm. Pada jumlah larutan PvDf yang sama, maka larutan PvDf akan lebih mengikat pada ketebalan laminate 100 µm dibandingkan dengan ketebalan laminate 150 µm karena semakin meningkatnya ketebalan maka semakin banyak partikel MCMB yang memiliki ukuran besar pada lembaran tersebut. Hal ini sesuai dengan pengamatan morfologi lembaran anoda dengan
mikroskop optik perbesaran 40
x
.Pada variasi komposisi dan ketebalan laminate pada lembaran anoda, maka kapasitas spesifik dan efisiensi yang tertinggi pada masing-masing ketebalan laminate LiFePO4 yaitu dengan komposisi anoda 85 : 10 : 5 ketebalan 100 µm. Hal ini karena lembaran anoda tersebut memiliki massa aktif MCMB yang terkecil dibandingkan massa aktif MCMB pada lembaran anoda dengan
Tampak jelas bahwa, semakin kecil massa aktif MCMB pada lembaran anoda maka semakin baik kualitas lembarannya sehingga akan menghasilkan kapasitas dan efisiensi yang lebih baik.
BAB 5
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Berdasarkan penelitian dan hasil pengamatan maka dapat disimpulkan bahwa 1. Pengaruh ketebalan pada lembaran katoda LiFePO4 pada kapasitas baterai ion
lithium yaitu dengan meningkatnya ketebalan pada lembaran katoda LiFePO4 maka semakin besar kapasitas yang dihasilkan. Kapasitas yang terbesar yaitu pada baterai yang memiliki ketebalan laminate katoda 300 µm dan kapasitas yang terkecil pada baterai yang memiliki ketebalan laminate katoda 100 µm. 2. Pengaruh variasi komposisi pada lembaran anoda MCMB pada kapasitas
baterai ion lithium yaitu baterai dengan komposisi anoda MCMB 80 : 13 : 7 memiliki kapasitas yang lebih tinggi. Kapasitas spesifik pada ketebalan laminate katoda 100 µm, 150 µm dan 300 µm masing-masing sebesar 69,65 mAh/gr, 73,61 mAh/gr dan 81,93 mAh/gr.
3. Pengaruh ketebalan pada lembaran anoda MCMB pada kapasitas baterai ion lithium yaitu baterai dengan ketebalan laminate anoda 100 µm memiliki kapasitas yang lebih tinggi. Kapasitas spesifik yang diperoleh pada ketebalan laminate katoda 100 µm, 150 µm dan 300 µm masing-masing sebesar 79,10 mAh/gr, 82,54 mAh/gr dan 88 mAh/gr. Pada variasi komposisi dan ketebalan pada lembaran anoda MCMB, maka MCMB dengan komposisi 85 : 10 : 5 dan ketebalan 100 µm merupakan anoda terbaik karena menghasilkan kapasitas yang terbesar dan efisiensi diatas 99 %.
5.2 SARAN
1. Sebaiknya perlu dilakukan penelitian untuk selanjutnya, pengaruh kapasitas baterai pada anoda MCMB dengan massa material aktif MCMB pada lembaran dibawah satu gram.
BAB 2
TINJAUAN PUSTAKA
2.1 Sejarah Perkembangan Baterai
Baterai adalah alat yang dapat mengubah energi kimia menjadi energi listrik melalui proses elektrokimia yaitu proses terjadinya reaksi oksidasi dan reduksi. Listrik yang dihasilkan oleh sebuah baterai muncul akibat adanya perbedaan potensial energi listrik kedua buah elektrodanya. Perbedaan potensial ini dikenal dengan potensial sel atau gaya gerak listrik (ggl).
Alessandro Volta merupakan orang yang pertama kali menciptakan baterai pada awal abad ke-19 yang dikenal dengan Tumpukan Volta (Voltaic Pile). Baterai ini terdiri dari tumpukan cakram seng dan tembaga berselang seling dengan kain basah yang telah dicelup air garam sebagai pembatasnya. Baterai ini telah mampu menghasilkan arus yang kontinu dan stabil.
Baterai mempunyai sejarah yang panjang dan terus mengalami perkembangan. Berikut sejarah perkembangan baterai yang dapat dilihat pada Tabel 2.1.
Tabel 2.1. Sejarah Perkembangan Baterai
Tahun Penemu Penemuan
1600 Gilbert (Inggris) Peletakkan dasar-dasar elektrokimia
1789 Galvani (Italia) Penemuan listrik dari hewan
1800 Volta (Italia) Penemuan Sel Voltaik
1802 Cruickshank (Inggris) Baterai pertama yang mampu diproduksi massal
1820 Ampere (Perancis) Listrik oleh magnet
1833 Faraday (Inggris) Hukum Faraday
1868 Leclanche (Inggris) Penemuan sel Leclanche
1888 Gassner (AS) Penyempurnaan sel kering
1899 Jungner (Swedia) Penemuan baterai Ni-Cd
1901 Edison (AS) Penemuan baterai Ni-besi
1932 Schlect dan Ackerman (Jerman)
Penemuan pelat kutub yang dipadatkan
1947 Neumann (Perancis) Berhasil mengemas baterai Ni-Cd
1960-an Union Carbide (AS) Pengembangan baterai alkaline primer
1970-an Union Carbide (AS) Pengembangan baterai timbal/asam dengan pengaturan katup
1990 Union Carbide (AS) Komersialisasi baterai Ni-MH
1992 Kordesch (Kanada) Komersialisasi baterai alkaline yang dapat dipakai ulang
1999 Kordesch (Kanada) Komersialisasi baterai Li-ion polimer
Sumber : Buchmann (2001)
2.1.1 Komponen Utama Baterai
Komponen utama pada baterai yaitu terdiri atas :
a. Elektroda negatif (anoda) yaitu elektroda yang melepaskan elektron ke rangkaian luar dan mengalami proses oksidasi pada proses elektrokimia.
b. Elektroda positif (katoda) yaitu elektroda yang menerima elektron ke rangkaian luar dan mengalami proses reduksi pada proses elektrokimia.
c. Elektrolit adalah media transfer ion yang bergerak dari anoda ke katoda dalam sel baterai saat penggunaan (Linden, 2002).
d. Separator.
2.1.2 Jenis – Jenis Baterai
Berdasarkan kemampuannya untuk dikosongkan (discharged) dan diisi ulang (recharged) baterai terbagi menjadi dua jenis yaitu sebagai berikut :
1. Baterai Primer
Baterai primer adalah baterai yang tidak dapat diisi ulang. Setelah kapasitas baterai habis (fully discharged), baterai tidak dapat dipakai kembali. Beberapa contoh baterai jenis ini adalah baterai Seng-Karbon (Baterai Kering), baterai Alkalin dan baterai Merkuri.
2. Baterai Sekunder
Baterai sekunder adalah baterai yang dapat diisi ulang. Kemampuan diisi ulang baterai sekunder bervariasi antara 100-500 kali (satu siklus adalah satu kali pengisian dan pengosongan). Beberapa contoh baterai sekunder adalah baterai Ni-Cd, baterai Ni-MH dan baterai ion lithium (Buchmann, 2001).
2.1.3 Istilah-Istilah Umum dalam Baterai
Beberapa istilah-istilah umum dalam baterai yaitu antara lain : 1. Kapasitas baterai
Kapasitas baterai merupakan kemampuan baterai untuk menyimpan dan memberikan arus listrik pada waktu tertentu yang dinyatakan dalam satuan Ampere-hour (Ah). Proses reaksi sel yang terjadi secara spontan, terkait dengan perubahan energi bebas dan jumlah total muatan yang bisa ke rangkaian luar Q, disebut "kapasitas sel", oleh hukum Faraday dirumuskan dengan:
Q = ∫ �0� �� = zF*N (2.1)
Besar kapasitas baterai secara teoritik tergantung dari jumlah material aktif terkandung terlihat pada rumus 2.1. Sebagai contoh, besar kapasitas material katoda LiCoO2 sebesar 1 gram adalah sebagai berikut :
Berat atom Li = 7, Co = 59 dan O2 = 16. 1 gram LiCoO2 setara dengan 0,010204 mol Jumlah muatan = 1
Dari bilangan Avogadro diketahui 1 mol material mengandung 96.500 Couloumb.
Maka 1 gram LiCoO2 memiliki kapasitas listrik sebesar = 0,010204 × 1 × 96.500 /3600 = 273,5 mAh (Triwibowo, 2011).
2. Kapasitas spesifik
Kapasitas spesifik adalah total muatan yang dihasilkan pada saat discharge dari sel dalam satu siklus dibagi dengan total massa (∑ �) dari sel.
Q = ��∗�
∑ � (2.2)
3. Efisiensi baterai
Efisiensi baterai merupakan perbandingan antara kapasitas discharge dan kapasitas charge yang dirumuskan sebagai berikut :
Efisiensi baterai = ����ℎ���� ke n
�ℎ���� ke n x 100 % (2.3)
dimana discharge ke n adalah kapasitas discharge pada siklus ke n dan charge ke n adalah kapasitas charge pada siklus ke n.
4. Kerugian kapasitas irreversible
Kerugian kapasitas irreversible berhubungan dengan banyaknya kapasitas yang hilang setiap siklus.
Kerugian kapasitas irreversible = �ℎ���� ke n−����ℎ���� ke n
2.2 Baterai ion Lithium
Baterai ion lithium adalah baterai yang digerakkan oleh ion lithium. Baterai ion lithium pertama kali dikomersialisasikan pada tahun 1990 oleh Sony Corp untuk ponsel Kyocera. Sejak diperkenalkan, pasar ion lithium telah berkembang menjadi sekitar $ 4 miliar pada tahun 2005 (Yoshio et al. 2009).
Baterai ion lithium memiliki banyak keunggulan dibandingkan dengan baterai sekunder lainnya yaitu ringan, densitas energinya tinggi, tidak memiliki memory effect, dapat diisi ulang (rechargeable), tahan lama, tegangannya tinggi (4V), ramah lingkungan dan penurunan charge baterai ion lithium rendah sekitar 5% per bulan. Namun, baterai ion lithium masih memiliki kekurangan diantaranya sangat sensitif terhadap suhu tinggi dan biayanya lebih tinggi dibandingkan dengan baterai yang sudah ada (Oswal et al. 2010).
Baterai ion lithium juga memiliki sifat utama yaitu nilai spesifik energi secara grafimetrik maupun volumik jauh lebih unggul dibandingkan dengan baterai sekunder lain (Kawamoto, 2010). Hal ini dapat dilihat perbandingannya pada Gambar 2.1.
Penjelasan pada Gambar 2.1. dapat dilihat perbandingan antara baterai ion lithium dengan baterai sekunder lainnya pada Tabel 2.2. dibawah ini.
Tabel 2.2. Perbandingan Baterai ion Lithium dengan Baterai Sekunder Lainnya Katoda Ion Li Pb – Acid Ni – Cd Ni – MH Waktu hidup (cycle) 500-1000 200-500 500 500
Tegangan kerja (V) 3,6 1,0 1,2 1,2
Energi Spesifik (Wh/Kg) 100 30 60 70
Energi Spesifik (Wh/L) 240 100 155 190
Sumber : Wu et al (2011)
Dalam kondisi charge dan discharge baterai ion lithium bekerja menurut fenomena interkalasi, yaitu proses pelepasan ion lithium dari tempatnya di struktur kristal suatu bahan elektroda dan pemasukan ion lithium pada tempat di struktur kristal bahan elektroda yang lain (Munshi, 1995). Sehingga bahan elektroda harus mempunyai tempat bagi perpindahan ion lithium yang sering disebut host. Bahan elektroda mempunyai struktur host dengan variasi interkalasi yang berbeda-beda. Pada umumnya, bahan memiliki tiga model interkalasi berdasarkan struktur dari hostnya, yaitu interkalasi satu dimensi, dua dimensi dan tiga dimensi seperti pada Gambar 2.2. (Prihandoko, 2008).
Proses interkalasi pada baterai ion lithium saat charge dan discharge dapat dilihat pada Gambar 2.3. dibawah ini.
Gambar 2.3. Proses Interkalasi pada Baterai ion Lithium saat Charge dan Discharge (Leite, 2009)
Selama proses charge baterai, terjadi pergerakan ion lithium dari elektroda positif (katoda) melalui seperator dan elektrolit ke elektroda negatif (anoda). Baterai menyimpan energi selama proses ini (densitas energi). Selama discharge, ion lithium bergerak dari elektroda negatif (anoda) ke elektroda positif (katoda) melalui seperator dan elektrolit, menghasilkan densitas daya pada baterai. Dalam proses interkalasi elektron mengalir dalam arah yang berlawanan dengan ion di sekitar sirkuit luar (Oswal et al. 2010).
Reaksi kimia yang terjadi dalam baterai ion lithium bersifat reversible, sehingga material penyusun sel dipilih dari material yang memiliki struktur kristal dengan kemampuan ’insertion compound’ yaitu material yang mampu menerima dan melepaskan ion lithium tanpa mengalami perubahan besar atau kerusakan dalam struktur kristalnya (Linden, 2002). Reaksi yang terjadi merupakan reaksi reduksi dan oksidasi (redoks) pada katoda dan anoda.
molekul atau atom. Reaksi oksidasi dan reduksi yang terjadi pada katoda LiFePO4 dan anoda LiC6 saat charge dan discharge pada baterai ion lithium yaitu :
Pada katoda : LiFePO4 + xLi+ + xe- xFePO4 + Li1-xFePO4 (2.5) (Wu et al. 2011).
Pada anoda : C6 + x Li+ + x e- LixC6 (2.6)
Reaksi pada sel baterai : LiFePO4 + C6 Li1-xFePO4 + LixC6 (2.7) (Zhao et al. 2015).
Suatu material elektrokimia dapat berfungsi baik sebagai elektroda anoda maupun katoda bergantung pada pemilihan material yang akan menentukan karakteristik perbedaan nilai tegangan kerja (working voltage) dari kedua material tersebut. Potensial tegangan yang terbentuk antara kedua elektroda bergantung dari reduksi dan oksidasi pada bahan elektroda yang dipilih (Subhan, 2011). Tegangan kerja dari beberapa material elektroda dapat dilihat pada Gambar 2.4.
Pada Gambar 2.4. tampak bahwa material yang dapat berfungsi sebagai katoda dan anoda dilihat pada tegangan kerjanya. Material yang berperan sebagai katoda harus memiliki tegangan kerja yang lebih tinggi dibandingkan dengan tegangan kerja pada material anoda. Misalnya, grafit berfungsi sebagai anoda ketika dipasangkan dengan LixMnO2 karena tegangan kerja grafit sebesar 0,5 V sedangkan LixMnO2 tegangan kerjanya sebesar 3 V. Namun grafit dapat berfungsi sebagai katoda saat dipasangkan dengan elektroda Li metal sebagai anodanya
karena tegangan kerja Li metal masih dibawah tegangan kerja grafit sebesar 0 Volt (Subhan, 2011).
2.3 Material Elektroda untuk Baterai ion Lithium
Material elektroda pada baterai ion lithium terdiri atas material aktif katoda dan material aktif anoda. Material aktif katoda yang sering digunakan yaitu LiFePO4 dan material aktif anoda yaitu Mesocarbon Microbead (MCMB).
2.3.1 Material Katoda
Struktur, sifat fisik dan sifat elektrokimia material katoda menentukan kinerja pada baterai ion lithium. Untuk setiap berat material katoda, jumlah ion lithium yang dilepaskan material katoda saat charging dan jumlah ion lithium yang kembali dalam waktu tertentu ke material katoda saat discharging menggambarkan densitas energi dan densitas daya sel baterai. Semakin banyak ion lithium dipindahkan dari katoda ke anoda maka semakin besar pula densitas energi sel baterai. Semakin banyak ion lithium yang kembali ke katoda dari anoda maka semakin besar densitas dayanya. Oleh karena itu, material katoda harus bersifat ion dan elektron konduktif (Triwibowo, 2011).
Ada beberapa karakteristik yang harus dimiliki oleh material katoda yaitu antara lain :
1. Struktur host nya harus memiliki kemampuan interkalasi yang besar (kapasitas energinya tinggi) dan memiliki koefisien difusi kimia lithium yang
2. Perubahan struktur host selama interkalasi dan deinterkalasi harus sekecil mungkin (siklus hidupnya panjang).
3. Material harus memiliki sifat kimia yang stabil, tidak beracun dan murah. 4. Proses pengerjaannya mudah (Yao, 2003).
Material katoda yang sering digunakan pada baterai ion lithium yaitu LiCoO2, LiFePO4, LiMn2O4 dan material lainnya. Ketiga material tersebut memiliki bentuk struktur host yang berbeda yang dapat dilihat pada Gambar 2.5.
a) b) c) Gambar 2.5. (a) Struktur Layered pada Material Katoda LiCoO2, (b) Struktur Spinel pada LiMn2O4 dan
(c) Struktur Olivine pada LiFePO4 (Buchmann, 2001)
Pada struktur host bentuk layered, ion lithium beinterkalasi dalam tiga arah, pada struktur host bentuk spinel interkalasi ion lithium dalam dua arah, sedangkan pada struktur host bentuk olivine interkalasi ion lithium dalam satu arah (Buchmann, 2001). Karakteristik elektrokimia dari masing-masing material tersebut dapat dilihat perbandingannya pada Tabel 2.3.
Tabel 2.3. Karakteristik Elektrokimia dari Beberapa Material Katoda
Katoda LiFePO4 LiMnO4 LiCoO2
Densitas (g/cm3) 3,6 4,31 5,10
Potensial (V) 3,5 4,05 3,90
Kapasitas Spesifik (mAh/g) 169 148 274
Lithium Ferrophosphate (LiFePO4)
LiFePO4 merupakan salah satu material katoda yang memiliki struktur olivine, termasuk kedalam sistem kristal ortorombik Pnma. Konstanta kisi a, b dan c adalah masing-masing 1,033, 0,601 dan 0,4693 μm. Ikatan kovalen kuat pada PO membuat LiFePO4 stabil bahkan pada suhu diatas 200 °C. Struktur kristal LiFePO4 dapat dilihat pada Gambar 2.6.
a) b)
Gambar 2.6. (a) Struktur Kristal LiFePO4 (Padhi et al. 2002) dan b) Struktur Kristal LiFePO4 saat Charge-Discharge (Rizki, 2014)
Penggunaan LiFePO4 sebagai material aktif katoda pertama kali dilakukan oleh John Goodenough’s di Universitas Texas pada tahun 1996. Alasan pemilihan LiFePO4 sebagai material aktif katoda karena memiliki banyak keunggulan dibandingkan material katoda lain diantaranya seperti biaya pembuatan lebih murah karena bahan pembentuknya mudah didapatkan di alam, tidak beracun, kapasitas sedang (170 mAh/g), keelektronegatifannya tinggi, sangat reaktif, densitas energi yang tinggi, dan ramah lingkungan. Namun, material ini masih memiliki kelemahan yaitu konduktifitas listrik yang rendah berorde 10-9 S/cm dan difusi ion lithium yang lambat (Padhi et al. 2002).