LAMPIRAN BAHAN
PVDF Super P
LAMPIRAN ALAT
Neraca digital Beaker Glass
Cawan Penjepit dan Spatula
Oven Hot Plate dan Magnetic Stirrer
Doctor Blade Oven Vakum
Kaca Preparat Holder
LAMPIRAN SAMPEL
Slurry (Lumpur) Lembaran Katoda LiMn2O4
LAMPIRAN ALAT KARAKTERISASI
XRD Optical Microscop (OM)
Lampiran Perhitungan Massa LMO
Komposisi 85:10:5
Massa Al foil ukuran 4x4 cm = 0,07 gr Massa Al foil ukuran coin cell = 0,0063 gr Jari-jari dari coin cell = 0,725 cm
Luas coin cell = 1,65 cm
Kode Sampel
2
Massa setelah dipress (4x4 cm) (gr) Massa coin cell (gr)
85T1 0,15 0,0114
85T2 0,17 0,0178
85T3 0,18 0,0194
Kode Sampel ukuran 4x4 cm LMO dalam laminate (gr/cm2) LMO elektroda coin cell w(gr)
85T1 0,0068 Massa Al foil ukuran coin cell = 0,0063 gr Jari-jari dari coin cell = 0,725 cm
Luas coin cell = 1,65 cm
Kode Sampel
2
Massa setelah dipress (4x4 cm) (gr) Massa coin cell (gr)
85T1 0,10 0,0105
85T2 0,13 0,0122
Kode Sampel ukuran 4x4 cm LMO dalam laminate (gr/cm2) LMO elektroda coin cell w(gr)
85T1 0,027
16 = 0,0016875
0,00378
85T2 0,054
16 = 0,003375
0,00531
85T3
0,108
16 = 0,00675
LAMPIRAN GRAFIK KAPASITAS DISCHARGE BATERAI
Analysis Results
General Information
Analysis date 2015/04/23 18:24:45
Sample name LMO Measurement date 2015/04/23 15:16:46
File name LMO.ras Operator Ibrahim Purawiardi
Comment
Measurement conditions
X-Ray 40 kV , 30 mA Scan speed / Duration time 3.0000 deg/min
Goniometer SmartLab(In-plane) Step width 0.0100 deg
Attachment RxRy Scan axis Theta/2-Theta
Filter Cu_K-beta Scan range 10.0000 - 90.0000 deg
CBO selection slit BB Incident slit 1/2deg
Diffrected beam mono. None Length limiting slit 10.0mm
Detector SC-70 Receiving slit #1 1/2deg
Qualitative analysis results
Phase name Formula Figure of merit Phase reg. detail DB card number
Graphite-2H, syn C 0.310 ICDD (PDF-4+ 2013 RDB) 00-056-0160
Lithium Manganese Oxide Li Mn2 O4 1.393 ICDD (PDF-4+ 2013 RDB) 04-016-2988
Phase name Formula Space group Phase reg. detail DB card number
Graphite-2H, syn C 194 : P63/mmc ICDD (PDF-4+ 2013 00-056-0160
Peak list
No. 2-theta(deg) d(ang.) Height(counts) FWHM(deg) Int. I(counts deg) Int. W(deg) Asym. factor
1 18.9259 4.68523 6.060307 0.225891 6.398392 1.055787 1.58624
2 23.908(4) 3.7189(6) 114(11) 0.185(15) 30.6(12) 0.27(4) 3.0(9)
3 26.5121(18) 3.3593(2) 12383(111) 0.1834(13) 2974(9) 0.240(3) 2.10(10)
4 27.535(10) 3.2368(11) 113(11) 0.12(2) 23.9(12) 0.21(3) 2.2(12)
5 36.4832 2.46082 11.943339 0.225891 4.530867 0.379363 1.58624
6 42.36(3) 2.1322(12) 59(8) 0.17(3) 12.6(11) 0.22(5) 0.9(6)
7 44.53(3) 2.0331(11) 90(9) 0.52(4) 84.9(18) 0.94(12) 1.3(4)
8 50.73(12) 1.798(4) 5(2) 0.63(17) 4.8(12) 0.9(6) 1.7(13)
9 54.633(5) 1.67854(15) 395(20) 0.226(7) 127.5(13) 0.323(19) 2.2(3)
10 59.67(2) 1.5483(5) 15(4) 0.74(7) 13.7(12) 0.9(3) 0.3(3)
11 77.471(10) 1.23105(13) 84(9) 0.156(8) 17.4(6) 0.21(3) 0.8(2)
12 83.537(16) 1.15639(18) 39(6) 0.38(3) 23.4(9) 0.60(12) 0.42(7)
Structure parameters
Data set name Phase Name Element x y z Occupancy Temperature fact
LMO Graphite-2H, syn C 0.000000 0.000000 0.250000 1.000 0.000
LMO Graphite-2H, syn C 0.333333 0.666667 0.250000 1.000 0.000
LMO Lithium Manganese Li 0.125000 0.125000 0.125000 1.000 0.500
LMO Lithium Manganese Mn 0.500000 0.500000 0.500000 1.000 0.500
LMO Lithium Manganese O 0.244000 0.244000 0.244000 1.000 0.500
Data set name Rwp Rp Re S Chi^2 Maximum shift/e.s.
Lattice constants
Angular correction
Analysis results
Data set name a(A) b(A) c(A) alpha(deg) beta(deg) gamma(deg)
LMO 2.4613(10) 2.4613(10) 6.7173(5) 90.000000 90.000000 120.000000
LMO 8.223(6) 8.223(6) 8.223(6) 90.000000 90.000000 90.000000
Phase name a(A) b(A) c(A) alpha(deg) beta(deg) gamma(deg) V(A^3)
Graphite-2H, syn 2.4613(10) 2.4613(10) 6.7173(5) 90.000000 90.000000 120.000000 35.24(2) Lithium Manganese 8.223(6) 8.223(6) 8.223(6) 90.000000 90.000000 90.000000 556.1(7)
Crystal structure analysis results
Phase name Indexing
Formula Figure of merit Phase reg. detail DB card number
Graphite-2H, syn C 0.310 ICDD (PDF-4+ 2013 RDB) 00-056-0160
Lithium Manganese Oxide Li Mn2 O4 1.393 ICDD (PDF-4+ 2013 RDB) 04-016-2988
Quantitative analysis results
Phase name Content(%)
- Graphite-2H, syn 92.1(16)
- Lithium Manganese Oxide 7.9(5)
Phase name
Lattice information
a(A) b(A) c(A) alpha(deg) beta(deg) gamma(deg) V(A^3)
Graphite-2H, syn 2.4613(10) 2.4613(10) 6.7173(5) 90.000000 90.000000 120.000000 35.24(2) Lithium Manganese 8.223(6) 8.223(6) 8.223(6) 90.000000 90.000000 90.000000 556.1(7)
Phase name Space group Z Z' Calc. density(g/cm^3)
Graphite-2H, syn 194 : P63/mmc 4 0.167 2.262
Lithium Manganese Oxide 227 : Fd-3m,choice-2 8 0.042 4.484
Structure determination
Measurement range: 10.0000-90.0000deg Refinement range: 10.0000-90.0000deg (1.09 A), Rwp = 13.30% S = 1.3873 Refinement
Phase name Atomic coords # of indep. reflns
Graphite-2H, syn Fractional coords 11
DAFTAR PUSTAKA
Abdillah, Nur Himawan. 2008. Pembuatan Komposit Pelat Bipolar dengan Matriks Polipropilena (PP) dengan Penguat Karbon dan Aditif Polivynilidene Fluoride (PVDF). [Skripsi]. Jakarta: Universitas Indonesia.
Bouwmann, P.J. 2002. Lithium Intercalation in Preferentially Oriented Submicron LiCoO2 Films. University of Twente. Nederlands.
Buchman, I. 2001. Batteries in a Portable World. Cadex Electronics Inc.
Ceder, G, Chiang, Y. M., Sadoway, D. R., Aydinol, M. K., Jang, Y. I. and Huang, B. 1998. Identification of Cathode Materials for Lithium Batteries Guided by First-principles Calculation, Nature. 392.
Chang, Horng-Yie, et all. 1998. Effects of Rapid on the Conductivity of Multiple Doped Ceria-Based Electrolyte. Journal of Power Sources. 196: 1704-1711. Chew, S.Y., et all. 2008. Thin Nanostructured LiMn2O4 Film by Flame Spray Deposition an In Situ Annealing Method. Journal of Power Sources. 189: 449-453.
Chew, S.Y., et all. 2008. “Thin Nanostuctured LiMn2O4 Film by Flame Spray Deposition an In Situ Annealing Method”. Journal of Power Sources. Vol. 189. hal. 449 – 453.
Eriksson, T. 2001. LiMn2O4 as a Li-Ion Battery Cathode From Bulk to Electrolyte Interface. [Disertasi]. Uppsala Universityty Sweden. Swedan: Chemistry Uppsala University, Uppsala.
Hamid, N.A, et all. 2012. High-Capacity Cathodes for Lithium-Ion Batteries from Nanostructured LiFePO4 Synthesized by Highly-Flexible and Scalable Flame Spray Pyrolysii. Journal of Power Sources. 216: 76-83.
Herstedt, M. 2003. Towards Safer Lithium-Ion Batteries. Departement of Materials.
http://files.tested.com/upload/0/5/16904-lithium-ion-separator.gif, diakses tanggal 20 April 2015.
http://www.chem-is-try.org/artikel_kimia_material/bergaul-denganbateraibagian-2/, diakses tanggal 20 April 2015.
Kiehne, H.A. 1989. Baterry Technology Handbook. Federal Republic of Jerman. 395- 405.
Koseva, N. V., et all. 2000. Synthesis of LixMn2O4, Cathoda Material for LithiumBatteries. Journal of Mechanochemical. Institute of Solid State
Chemistry. Russia. 107-114.
Linden, David. Handbook of Batteries. Mc Graw-Hill. 2002.
LiPF6Electrolyte. MSDS No. 94804 [online]. MTI Corporation. California USA. Maulidanir, Rohman. 2012. Studi Karakteristik Kelistrikan Komposit Carbon Nanotube-Polivynilidene Fluoride (CNT-PVDF). [Skripsi]. Yogyakarta:
Universitas Diponegoro.
Masaki, Yoshio. 2009. Lithium – Ion Batteries. Jepang : Springer.
N-N-Dimethylacetamide. MSDS No. 96035 [online]. ACROS ORGANICS. Canada.TDG.
Najmuddin, Ade. 2005. Studi Karakteristik Sel Baterai Lithium dengan Doping Boron (y=0;0,1;0,15;0,2). [Skripsi]. Jakarta: Universitas Negeri Jakarta.
Prihandoko, Bambang. 2007. Pemanfaatan Soda Lime Silica dalam Pembuatan Komposit Elektrolit Baterai Lithium. [Disetasi]. Jakarta: Universitas Indonesia.
Prihandoko, Bambang. 2010. Pembuatan Nanomaterial Sebagai Bahan Komponen Baterai Lithium. Laporan Akhir Program Intensif Peneliti dan Perekayasa LIPI 2010.
Priyono, Slamet. 2013. Sintesis Serbuk LiTi5O12 yang Didoping Atom Al dan Na untuk Anoda Baterai Ion Lithium. [Tesis]. Jakarta: Universitas Indonesia.
Ritchie, A.G. 2001. Recent Development And Future Prospects For Lithium Rechargeable Batteries. Journal of power Sources. 96: 1 – 4.
Tipler, Paul A. 2001b. Fisika Untuk Sains dan Teknik. Jilid 2. Edisi Ketiga. Erlangga. Jakarta.
Triwibowo, Joko. 2011. Rekayasa Bahan LixTiMnyFez(PO4) Sebagai Katoda Solid Polymer Battery (SPB) Lithium. [Tesis]. Jakarta: Universitas Indonesia.
BAB 3
METODOLOGI PERCOBAAN
3.1 Tempat dan Waktu Penelitian
Tempat penelitian ini dilakukan di Pusat Penelitan Pengembangan Fisika (P2F) Lembaga Ilmu Pengetahuan Indonesia (LIPI) PUSPITEK, Serpong. Waktu penelitian dimulai dari tanggal 5 Februari 2015 sampai dengan 5 Mei 2015.
3.2 Peralatan dan Bahan Penelitian 3.2.1 Peralatan Penelitian
1. Beaker glass
Berfungsi sebagai tempat untuk menimbang sampel dan mencampur bahan. 2. Spatula
Berfungsi untuk mengambil bahan dan mengaduk lumpur (slurry). 3. Timbangan Digital
Berfungsi untuk menimbang bahan yang digunakan dan massa lembaran katoda. 4. Doctor Blade
Berfungsi sebagai alat untuk pelapisan. 5. Penggaris
Berfungsi untuk mengukur luas lembaran katoda LiMn2O 6. Cawan
4.
Berfungsi sebagai tempat untuk meletakkan sampel di oven. 7. Magnetic stirrer
Berfungsi menghomogenkan campuran bahan dengan pengadukan. 8. Hot Plate
9. Pipet Tetes
Berfungsi untuk mengambil DMAC 10. Penjepit
Berfungsi untuk mengambil sampel. 11. Pisau
Berfungsi untuk memotong lembaran lembaran LiMn2O4 12. Oven
dan Al foil.
Berfungsi untuk mengeringkan lembaran laminate LiMn2O4
13. Baki
dan menjaga suhu sampel agar tetap konstan.
Berfungsi sebagai tempat meletakkan lembaran katoda LiMn2O4. 14. Jangka Sorong
dalam oven.
Berfungsi untuk mengkur ketebalan lembaran katoda LiMn2O4. 15. Lembar Kaca
.
Berfungsi untuk tempat memotong Al foil dan lembaran katoda LiMn2O4. 16. Mesin Press Hidrolik
.
Berfungsi untuk menekan lembaran katoda agar laminate LiMn2O4
17. Holder
lebih merekat pada Al foil.
Berfungsi untuk assembling baterai. 18. Kaca Preparat
Berfungsi untuk meletakkan sampel saat di miksroskop optik. 19. Glove Box
Berfungsi untuk aktivasi baterai coin cell.
3.2.2 Alat Karakterisasi
1. Optical Microscope
Berfungsi untuk mengamati miksrotruktur lembaran katoda LiMn2O 2. XRD (X-Ray Difractometer)
4.
3. SEM (Scanning Electron Microscope)-EDX
Berfungsi untuk mengamati mikrostruktur dan komposisi lembaran katoda LiMn2O 4. Alat uji charge discharge
4.
Berfungsi untuk mengetahui kapasitas charge discharge baterai yang dihasilkan.
3.2.3 Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah: 1. LiMn2O4,produk LinYi
Berfungsi sebagai bahan material aktif katoda. , Gelon, China
2. Super P, produk LinYi
Berfungsi sebagai bahan aditif konduktif. , Gelon, China
3. PVDF, produk LinYi
Berfungsi sebagai bahan pengikat. , Gelon, China
4. DMAC, produk LinYi Berfungsi sebagai pelarut.
, Gelon, China
5. Metalik Lithium, produk LinYi Berfungsi sebagai anoda.
3.3 Diagram Alir Penelitian
Ditimbang Bahan Baku Serbuk (LMO+Super P+PVDF) dan pelarut DMAC sebanyak 60 ml dengan variasi komposisi 85:10:5,
Dimixing di hot plate dengan suhu 60oC dan kecepatan 200 rpm selama 3 jam
Dicoating diatas Al foil dengan menggunakan doctor blade dengan kecepatan 0,6 mm/s Dikeringkan dengan suhu 110 oC selama ± 5 menit
Dimasukkan di oven vakum dengan suhu 40oC selama 24 jam
Dipotong lembaran katoda ukuran 4x4 cm
Dipress dengan beban 300 kg/cm2 Diassembling baterai di glove box
Diuji karakterisasi Kapasitas Discharge
Data
Hasil dan Pembahasan Kesimpulan
Selesai
Diukur ketebalan doctor blade dengan ketebalan (100, 150, 300) µm untuk masing-masing komposisi
Lumpur (slurry)
Lembaran katoda LiMn2O4
XRD
3.4 Prosedur Pembuatan Sampel 3.4.1 Bahan Baku
Penelitian ini dilakukan dengan menggunakan bahan baku teknis yang terdiri dari serbuk Lithium Mangan Oksida (LiMn2O4
3.4.2 Penentuan Komposisi Bahan
) sebagai bahan material aktifnya, Super P sebagai bahan aditif konduktifnya, PVDF sebagai binder (pengikat). Sebelum digunakan, bahan-bahan tersebut di oven terlebih dahulu selama 24 jam untuk menghilangkan kelembabannya. Pelarut yang digunakan adalah DMAC sebanyak 60 ml.
Bahan-bahan kimia yang digunakan dalam eksperimen ini adalah LiMn2O4
• Untuk massa LiMn
(Lithium Mangan Oksida), Super P, PVDF (Polyvynilidene Flouride).
2O4
Perbandingan komposisi 85 : 10 : 5 (LiMn = 5 gram
Perbandingan komposisi 90 : 7 : 3 (LiMn = 5 gram
Komposisi Ketebalan Nama Sampel
3.4.4 Proses Pencampuran
Tahapan yang dilakukan setelah penentuan komposisi dan penimbangan bahan di timbangan analitik adalah proses pencampuran. Di dalam proses mixing jumlah DMAC yang digunakan sebagai pelarut sebanyak 60 ml. Proses pencampuran dilakukan dengan mencampur PVDF dan DMAC dari beaker glass kemudian diletakkan pada hot plate dengan temperatur 60oC dan kecepatan 200 rpm. Kemudian tunggu hingga beberapa menit hingga tercampur merata, ditandai dengan berubahnya warna menjadi bening. Kemudian masukkan Super P sedikit demi sedikit. Jika proses
mixing terhenti maka tambahkan sedikit DMAC, tunggu beberapa menit hingga
tercampur merata. Setelah merata maka tambahkan LiMn2O4 sedikit demi sedikit. Lalu dimixing selama 3 jam untuk menghasilkan lumpur (slurry).
Gambar 3.1 Proses Mixing
3.4.5 Proses Pelapisan
Lumpur (slurry) yang sudah jadi, dicoating dengan menggunakan doctor blade. Diukur ketebalan doctor blade dengan ketebalan setiap masing-masing komposisi yaitu 100 μm, 150 μm, 300 μm. Al foil yang sudah dipotong dengan ukuran 35 x 15 cm divakumkan dan dibersihkan dengan aseton. Diletakkan doctor blade diatas Al
foil. Kemudian dilakukan pelapisan dengan menuangkan lumpur (slurry) secukupnya
pada doctor blade dengan kecepatan 0,6 mm/s.
3.4.6 Prosese Pengeringan
Kemudian diletakkan sampel di oven vakum dengan temperatur 40oC selama 24 jam untuk menjaga suhu sampel agar tetap konstan dan agar tidak terkontaminasi.
3.4.7 Proses Press
Lembaran katoda dipotong dengan ukuran 4 x 4 cm. Kemudian di press menggunakan mesin press hidrolik dengan beban 300 kg/cm2 selama 2 menit sehingga akan terlihat laminate semakin merekat pada aluminium foil.
3.4.8 Proses Pencetakan
Setelah di press maka dibentuk lembaran katoda dengan menggunakan cetakan yang berbentuk coin diatas lembaran kaca. Kemudian dihitung massa lembaran katoda coin
cell dengan menggunkan timbangan digital dan dihitung ketebalannya dengan
menggunakan jangka sorong.
3.4.9 Proses Aktivasi Baterai
BAB 4
HASIL DAN PEMBAHASAN
4.1 Analisa Struktur Kristal Serbuk LiMn2O4 Bahan serbuk LiMn
dengan XRD
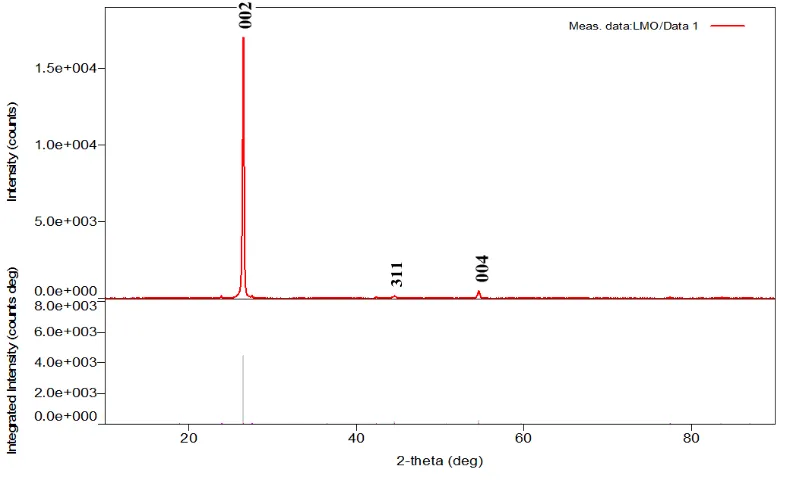
2O4 yang digunakan dalam penelitian adalah bahan teknis. Pengujian dilakukan dengan sinar X menggunakan range sudut 10o-90o dan panjang gelombang Cu-Kα (1,54056Å) untuk meninjau jenis fasa dan komposisi yang terdapat pada serbuk LiMn2O4.Dioperasikan pada tegangan 40 kV dan arus 30 mA. Melalui analisis sesuai dengan ICDD (PDF-4+2013 04-016-2988, berikut adalah bentuk grafik hasil XRD dari serbuk LiMn2O4
311
:
Gambar 4.1 Grafik dari hasil XRD serbuk LiMn2O4 Data untuk tiga puncak tertinggi dan indeks miller dari serbuk LiMn
Tabel 4.1 Data puncak tertinggi serbuk LiMn2O
2 36,4832 2,46082 311 Lithium Manganese Oxide
3 54,633 1,67854 004 Graphite, 2H
Dari hasil XRD yang dilakukan pada serbuk LiMn2O4 maka diketahui bahwa terbentuk 2 fasa yaitu Grapithe-2H, syn dan lithium manganese Oxide. Fasa
Grapithe-2H, syn, mempunyai parameter kisi a=2,4613 Ǻ, b=2,4613 Ǻ, c=6,7173 Ǻ
(a=b≠c) dan α=90o, β=90o, γ=120o (α=β≠γ) sehingga membentuk sistem kristal
heksagonal. Fasa Grapithe-2H, syn memiliki volume 35,24 Ǻ3 , densitas sebesar 2,262 g/cm3 dan space group P63/mmc. Sedangkan untuk fasa Lithium Manganese Oxide mempunyai parameter kisi a=8,223 Ǻ, b=8,233 Ǻ, c=8,233 Ǻ (a=b=c) dan
α=90o, β=90o, γ=90o (α=β=γ) dan membentuk sistem kristal
cubic. Fasa lithium manganese oxide mempunyai volume sebesar 556,1 Ǻ3 , densitas 4,484 g/cm3 dan
space group FD-3m. Dari hasil XRD dari serbuk LiMn2O4 diperoleh chi2 sebesar 1,92 dan Rwp sebesar 13,3. Berdasarkan ICDD besar chi2
Tabel 4.2 Hasil Analisis Struktur Kristal (Paramter kisi) Serbuk LiMn2O4
seharusnya ≤ 1,3 dan Rwp
≤ 10. Bahan yang digunakan dalam penelitian ini tidak murni LiMn2O4 karena
terbentuk fasa lain yaitu graphite.
No. Nama Fasa a (Ǻ) b (Ǻ) c(Ǻ) Vol
4.2 Analisa Morfologi dengan SEM (Scanning Electron Microscope )-EDX
dengan perbesaran 100, 1000, 2500 kali perbesaran. Pada pengujian mikrostruktur dari LiMn2O4 ini ditembakkan Secondary Electron yang berfungsi untuk melihat morfologi suatu material serta mengetahui komposisi unsur kimia lembaran katoda LiMn2O4. Pada pengujian mikrostruktur ini, sampel yang di SEM adalah lembaran katoda LiMn2O4 dengan komposisi 85:10:5 (LiMn2O4 : Super P : PVDF).
a. b.
c.
Gambar 4.2 Hasil Mapping a) Unsur C, b) Unsur F, c) Mix Unsur
Dapat dilihat pada gambar 4.2 diatas bahwa unsur C (karbon) ditandai dengan warna merah dan F yang berwarna hijau tosca. Hasil gambar mapping dari mix unsur terlihat 2 unsur yaitu C dan F. Dan terlihat unsur yang paling dominan adalah unsur C yang
berwarna merah dan unsur C tersebar merata dipermukaan. Adapun hasil point Id atau spektrum untuk mengetahui kandungan unsur pada lembaran katoda LiMn2O4 tersebut adalah:
Gambar 4.3 Hasil compare spectrum lembaran katoda LiMn2O4 Dengan persentase dari hasil 4 spektrum diperoleh hasil sebagai berikut: Tabel 4.3 Persentase Unsur Laminate LiMn2O4 komposisi 85:10:5 (150µm)
Unsur Spektrum1(%) Spektrum2(%) Spektrum3(%) Spektrum4(%) Rata-rata
C 90,78 94,65 92,49 92,75 92,6675
O 7,27 4,96 6,93 2,76 5,48
F 1,71 0,32 0,58 4,19 1,7
Al 0,05 - - 0,10 0,075
P 0,12 - - 0,20 0,16
Cu 0,07 - - - 0,07
Ca - 0,07 - - 0,07
Gambar 4.4 Hasil SEM lembaran katoda LiMn2O4 perbesaran 100 x
Gambar 4.6 Hasil SEM lembaran katoda LiMn2O4 2500 x
Dari Gambar 4.4 dapat kita ketahui bahwa hasil analisis permukaan lembaran katoda LiMn2O4 dengan komposisi 85:10:5 (LMO : Super P : PVDF), terlihat bentuk butirannya yang tidak beraturan dan terlihat bahwa unsur yang paling dominan adalah C (karbon). Hal ini diperkuat dengan hasil mapping. Dari gambar 4.4 terlihat partikel yang berbentuk gumpalan. Partikel yang berbentuk gumpalan merupakan partikel yang mengalami aglomerasi LiMn2O dan graphite. Dan terlihat dari hasil SEM dengan perbesaran 100 x, 1500 x, dan 2500 x terdapat pori pada lembaran katoda LiMn2O4.
4.3 Analisa Mikrostruktur dengan Optical Microscope (OM)
Analisis mikrostruktur dilakukan dengan menggunakan Optical Microscope (OM) dengan perbesaran 40 x. Pengamatan OM dilakukan pada serbuk LMO, super P, dan pada sembilan sampel dengan dua variasi komposisi yaitu 85:10:5, 90:7:3 dan ketebalan setiap masing-masing komposisi (100, 150, 300) µm.
85T1 85T2 85T3
90T1 90T2 90T3
Gambar 4.7 Hasil Uji Optical Microscope lembaran katoda LiMn2O4 untuk komposisi 85:10:5, sampel 85T1 (100µm), 85T2(150µm), 85T3(300µm); komposisi
90:7:3, sampel 90T1(100µm), 90T2(150µm), 90T3(300µm).
dengan graphite lebih banyak dibandingkan sampel 85T2 dan 85T3. Sedangkan pada komposisi 90:7:3 pada ketebalan 150 µm partikel yang mengalami aglomerasi lebih sedikit dibandingkan pada ketebalan 100 µm dan 300 µm. Dan dari perbandingan komposisi dapat terlihat pada komposisi 90:7:3 partikel yang teraglomerasi lebih banyak dan ukurannya lebih besar dibandingkan pada komposisi 85:10:5.
4.4 Analisa Kapasitas Discharge Baterai Coin Cell
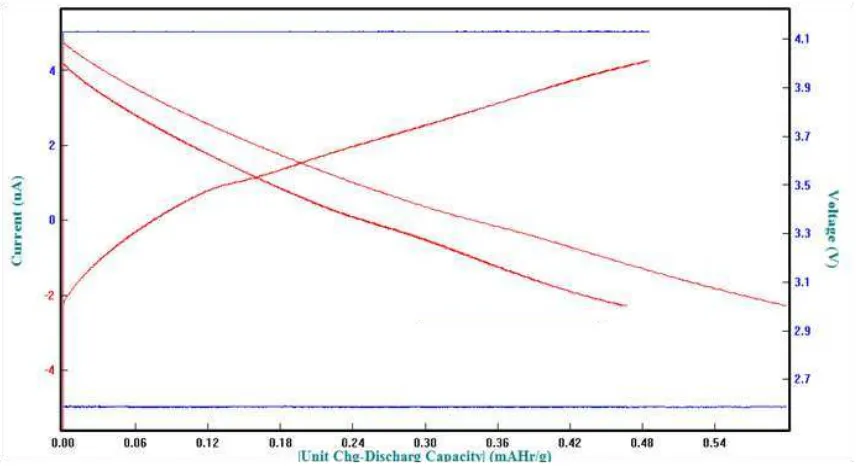
Dalam pengujian uji charge discharge baterai coin cell menggunakan arus 0,005 mA dan tegangan yang digunakan adalah 3 - 4 Volt. Berikut ini adalah grafik kapasitas baterai coin cell yang diperoleh:
Gambar 4.9 Grafik charge discharge komposisi 85:10:5 ketebalan 150µm
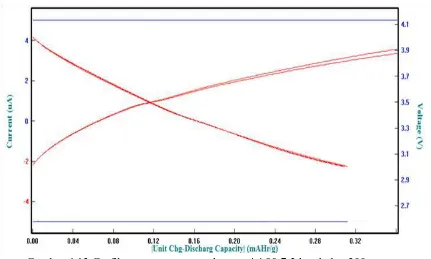
Gambar 4.11 Grafik charge discharge komposisi 90:7:3 ketebalan 100µm
90 T1-30µ_2003 90 T1-30µ_2003
Gambar 4.13 Grafik charge discharge komposisi 90:7:3 ketebalan 300µm Dari grafik charge discharge pada komposisi 85:10:5 dan komposisi 90:7:3 diatas, diperoleh hasil kapasitas baterai coin cell:
Tabel 4.4 Kapasitas Discharge Baterai Coin Cell
Komposisi Nama Sampel Capacity (mAh)
x 10
sebesar 0,47mA/gr, dan ketebalan 300 µm sebesar 0,37 mA/gr. Semakin tebal lembaran katoda LiMn2O4 maka kapasitas discharge yang dihasilkan semakin menurun. Sedangkan pada komposisi 90:7:3, pada ketebalan 100 µm kapasitas
discharge-nya sebesar 0,91 mA/gr, ketebalan 150 µm sebesar 0,93 mA/gr, dan pada
ketebalan 300 µm sebesar 0,31 mA/gr. Pada komposisi 90:7:3 kapasitas discharge-nya masih meningkat pada ketebalan 150 µm tetapi ketika ketebalan lembaran katoda LiMn2O4 dinaikkan lagi pada ketebalan 300 µm, kapasitasnya discharge-nya tidak meningkat tetapi menjadi menurun. Dari data dapat dilihat bahwa kapasitas discharge yang didapatkan belum maksimal karena kapasitas discharge terbesarnya hanya sebesar 1,31 mAh/gr yaitu pada komposisi 85:10:5 untuk ketebalan 100 µm.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari seluruh kegiatan penelitian yang dilakukan maka diperoleh kesimpulan yaitu: 1. Mikrostruktur dari lembaran katoda LiMn2O4 yang didapatkan adalah pada komposi 85:10:5, semakin besar ketebalan yang digunakan maka partikel yang mengalami aglomerasi oleh LiMn2O4 dan graphite semakin banyak dan tersebar merata sedangkan pada komposisi 90:7:3 pada ketebalan 150 µm, partikel yang mengalami aglomerasi lebih sedikit dibandingkan pada ketebalan 100 µm dan 300 µm.
2. Kapasitas discharge baterai yang didapatkan yaitu pada komposisi 85:10:5 untuk ketebalan 100 µm, 150 µm, 300 µm yaitu 1,31 mAh/gr, 0,47 mAh/gr, dan 0,37 mAh/gr. Dapat dilihat bahwa semakin tebal lembaran katoda LiMn2O4 maka kapasitas discharge baterainya semakin menurun sedangkan pada komposisi 90:7:3, kapasitas discharge baterai yang diperoleh pada ketebalan 100 µm, 150 µm, 300 µm yaitu 0,91 mAh/gr, 0,93 mAh/gr, 0,31 mAh/gr. Pada komposisi ini kapasitas
discharge baterai meningkat pada ketebalan 150 µm dan jika ditambahkan lagi
ketebalannya maka kapasitasnya menjadi menurun.
5.2 Saran
1. Sebaiknya diuji viskositas lumpur (slurry) agar diketahui kekentalannya sudah bagus atau belum.
2. Sebaiknya perlu diperhatikan lagi komposisi yang digunakan, waktu mixing, temperatur mixing, dan kecepatan mixing-nya agar lumpur (slurry) yang dihasilkan homogen.
BAB 2
TINJAUAN PUSTAKA
2.1 Baterai
Baterai didefenisikan sebagai suatu alat yang dapat mengubah langsung energi kimia menjadi energi listrik melalui proses elektrokimia. Pengertian baterai yang saat ini umum digunakan sesungguhnya mencakup satu atau beberapa sel baterai yang digabungkan secara seri atau paralel sesuai dengan tegangan dan kapasitas listrik yang diinginkan. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, separator, wadah terminal / current collector (Triwibowo, 2011). Listrik yang dihasilkan oleh sebuah baterai muncul akibat adanya perbedaan potensial energi listrik kedua buah elektrodanya. Perbedaan potensial ini dikenal dengan potensial sel atau gaya gerak listrik (ggl).
Komponen terpenting dari sel baterai yaitu:
1. Anoda / Elektroda negatif yaitu elektroda yang melepaskan elektron ke rangkaian luar serta mengalami proses oksidasi pada proses elektrokimia berlangsung.
2. Katoda / Elektroda positif yaitu elektroda yang menerima elektron dari rangkaian luar serta mengalami proses reduksi pada proses elektrokimia berlangsung.
4. Separator adalah material berpori yang diletakkan diantara anoda dan katoda, yang dapat mencegah terjadinya gesekan antara kedua elektroda tersebut yang dapat menyebabkan arus pendek
Cathode Lead
Gambar 2.1 Struktur sebuah sel baterai (http://files.tested.com/upload/0/5/16904-lithium-ion-separator.gif, diakses tanggal 20 April 2015).
2.2 Sejarah Baterai
Tabel 2.1 Sejarah perkembangan baterai (Bouwmann, 2002).
Tahun Penemu Penemuan
1600 Gilbert (Inggris) Peletakkan dasar-dasar elektrokimia 1789 Galvani (Italia) Peenemuan listrik dari hewan 1800 Volta (Italia) Penemuan sel voltaik
1802 Cruickhsank (Inggris) Baterai pertama dengan yang mampu diproduksi missal
1820 Ampere (Peransic) Listrik oleh magnet 1833 Faraday (Inggris) Hukum Faraday
1859 Plante (Inggris) Penemuan baterai timbale/asam 1868 Leclanche (Inggris) Penemuan sel Lechlanche 1888 Gassner (AS) Penyempurnaan sel kering 1899 Jungner (Swedia) Penemuan baterai Ni-Cd) 1901 Edison (AS) Penemuan baterai nikel-besi 1932 Shlecht & Ackerman
(Jerman)
Penemuan pelat kutub yang dipadatkan
1947 Neumann (Perancis) Berhasil mengemas baterai Ni-Cd 1960-an Union Carbide (AS) Pengembangan baterai alakalin primer
1970-an Union Carbide (AS) Pengembangan baterai timbale/asam dengan pengaturan katup
1990 Union Carbide (AS) Komersialisasi baterai Ni-MH
1992 Kordesch (Kanada) Komersialisai baterai alakalin yang dapat dipakai ulang
1999 Kordesch (Kanada) Komersialisai baterai Li-ion primer
2.3 Jenis-Jenis Baterai 2.3.1 Baterai Primer
baterai jenis ini adalah baterai seng karbon (baterai kering), baterai alkalin dan baterai merkuri.
Reaksi : xLi + AzBy LixAzBy Discharge
Baterai primer sering disebut dengan baterai kering dan keuntungan yang diperoleh dari penggunaan baterai ini adalah bentuknya yang sederhana, mudah untuk digunakan, densitas energi listriknya besar, tidak memerlukan perawatan, dapat dibuat dalam berbagai bentuk dan ukuran sesuai aplikasinya, memiliki ketahanan yang relatif baik dan memiliki harga yang terjangkau oleh konsumen. Baterai jenis ini banyak digunakan pada kalkulator, jam, remote tv, dan lainnya.
2.3.2 Baterai Sekunder
Baterai sekunder merupakan baterai yang bersifat rechargeable atau dapat dilakukan pengisian energi kembali apabila energi melemah. Kemampuan diisi ulang baterai sekunder bervariasi antara 100-500 kali (satu siklus adalah satu kali pengisian dan pengosongan).
Charge
Reaksi : xLi + AzBy LixAzBy
Discharge
Beberapa contoh baterai sekunder adalah baterai timbal-asam (aki), baterai litium-ion, baterai Ni-Cd, baterai Ni-MH. Baterai sekunder ini banyak digunakan pada peralatan elektronik seperti handphone, laptop, handycam, power bank, dan lain-lain.
2.4 Bentuk-Bentuk Baterai Sekunder
1. Baterai kantung. Jenis baterai ini adalah yang paling fleksibel dalam segi bentuk dan ukuran. Disamping itu, juga paling ringan karena tidak menggunakan pelat besi sebagai kemasan. Material aktif yang digunakan umumnya dalam bentuk lembaran polimer, dengan demikian dapat mengurangi produksi gas saat operasional. Proses
charging dan discharging harus dilakukan dengan seksama agar tidak menghasilkan
tekanan dari luar, benda tajam dan pemuntiran. Oleh karenanya, penggabungan jenis baterai ini tidak dapat dilakukan dengan menumpuknya, tapi meletakkannya berdampingan. Walaupun baterai ini banyak diaplikasikan, namun belum ada data-data kehandalan baterai ini. Standarisai mengenai baterai ini juga belum ada (Triwibowo, 2011).
Gambar 2.2 Baterai kantung yang simple, fleksibel dan ringan. Kapasitas listriknya dibawah baterai konvensional lain, disamping biaya produksinya terbilang mahal.
2. Baterai silinder. Jenis baterai ini paling banyak ditemui. Desain berbentuk silinder mudah dalam pembuatannya, disamping itu memiliki stabilitas mekanik yang baik. Saat charging, baterai akan menghasilkan gas yang memberikan tekanan dalam silinder, untuk itu baterai silinder dilengkapi pula dengan ventilasi. Kerugian dari desain ini adalah bentuknya yang tidak ringkas saat beberapa silinder digabungkan, yaitu akan terbentuk ruangan kosong diantaranya. Kapasitas listrik yang dikandung baterai ini berkisar antara 1800-2000mAh (Triwibowo, 2011).
3. Baterai Kancing. Baterai yang sering disebut baterai koin memiliki ukuran terkecil dibanding baterai lain. Disebabkan ukurannya, jenis ini tidak memiliki masalah dengan ruang yang tersedia. Karena bentuknya yang miniatur, baterai ini tidak dilengkapi dengan ventilasi. Sementara proses charging yang cepat akan membuat baterai menggelembuing. Untuk menghindari keadaan ini, baterai kancing hanya dapat di charge dengan kecepatan yang rendah. Pengsisin baterai jenis ini dapat memakan waktu 10-16 jam (Triwibowo, 2011).
Gambar 2.4 Baterai sekunder berbentuk kancing tidak dilengkapi ventilasi. Kecepatan pengisian/charging sangat rendah untuk mencegah terjadinya swelling dan tekanan.
4. Baterai Perismatik. Baterai ini memaksimalkan penggunaan ruang yang ada dalam suatu perangkat elektrik. Oleh karenanya baterai jenis ini tidak memiliki ukuran yang standard. Ukuiran senantiasa disesuaikan dengan ruang yang ada. Kapasitas listrik baterai ini umumnya dibawah baterai silinder, yaitu 400-2000mAh.
(Triwibowo, 2011).
Gambar 2.5 Penampang baterai prismatik yang lebih fleksibel dalam segi ukuran. Densitas energi lebih rendah dan biaya pembuatannya lebih mahal dari baterai
2.5 Baterai Lithium
Baterai lithium secara teori adalah baterai yang digerakkan oleh ion lithium. Dalam kondisi charge dan discharge baterai lithium bekerja menurut fenomena interkalasi, dimana ion lithium melakukan migrasi dari katoda lewat elektrolit ke anoda. Baterai ion lithium umumnya dijumpai pada barang-barang elektronik. Baterai ini merupakan jenis baterai isi ulang yang paling popular untuk peralatan elektronik portabel, karena memiliki salah satu kepadatan energi terbaik, tanpa efek memori, dan mengalami kehilangan isi yang lambat saat tidak digunakan. Selain digunakan pada peralatan elektronik konsumen, baterai lithium juga sering digunakan pada kendaraan listrik. Prinsip kerja baterai lithium yang dapat diisi ulang dapat dilihat pada gambar 2.6.
a. b.
Gambar 2.6 Prinsip kerja baterai litium yang dapat diisi ulang a) Proses Charging; b) Proses Discharging (Priyono, 2013).
Dalam proses migrasi yang berjalan secara difusi, reaksi kimia terjadi secara
reversible dari kondisi charging atau pengisisan dan discharging atau pemakaian.
dari anoda ke katoda melalui elektrolit, elektron mengalir dari anoda ke katoda dan arus mengalir dari katoda ke anoda. Reaksi kimia dari proses charging dan
discharging dapat dituliskan sebagai berikut:
Reaksi kimia pada proses charging:
Elektroda positif (+) : LiMnyOz nLi+1 + Lix-nMnyOz + ne Elektroda negatif (-) : nLi
-1 +1
+ C + ne-1 Lin Reaksi Keseluruhan : LiMn
C
yOz + C Lix-nMnyOz + LinC
Elektroda positif (+) : nLi Reaksi kimia pada proses discharging:
+1
+ Lix-nMnyOz + ne-1 LiMnyO Elektroda negatif (-) : Li
z nC nLi+1 + C + ne
Reaksi Keseluruhan : Li
-1
x-nMnyOz + LinC LiMnyOz + C
2.6 Proses Interkalasi
Sel baterai litium mempunyai tiga komponen penting yaitu katoda, anoda, dan elektrolit. Baterai litium bekerja menurut fenomena interkalasi, dimana litium ion yang bergerak sebagai penghantar dapat melakukan migrasi (perpindahan) dari katoda melewati elektrolit ke anoda tanpa terjadi perubahan struktur kristal dari bahan katoda ke anoda.
Interkalasi merupakan proses pelepasan ion lithium dari tempatnya di struktur kristal suatu bahan elektroda dan pemasukan ion lithium pada tempatnya di struktur kirstal bahan elektroda yang lain. Proses terjadinya interkalasi dapat digambarkan dalam Gambar 2.7.
Gambar 2.7 Proses interkalasi dalam beberapa fase
perpindahan ion lithium yang sering disebut host. Oleh karena itu bahan elektroda harus mempunyai struktur host. Pada umumnya bahan mempunyai tiga kategori/ model dalam melakukan interkalasi yang bergantung pada bentuk host strukturnya, yaitu interkalasi dalam satu dimensi, dua dimensi dan tiga dimensi, seperti tergambar di Gambar 2.8. Lithium mangan oksida mempunyai host interkalasi dalam tiga dimensi (Prihandoko, 2008).
Gambar 2.8 Tiga model host dari bahan katoda dan anoda
2.7 Material Katoda
Material katoda harus memenuhi karakter sebagai bahan yang mempunyai
host agar proses interkalasi bias berlangsung dengan baik. Ada banyak bahan katoda
yang sudah diteliti. Baterai lithium rechargeable di pasaran menggunakan bahan katoda anatara lain dari jenis lithium nikel oksida, lithium kobalt oksida, dan lithium mangan oksida.
Adapun perbandingan antara bahan penyusun sebuah katoda baterai dilihat dari asspek ekologi dan ekonomi dapat dilihat dibawah ini.
Katoda: - Mn2O4 - NiO
(spinel) Murah, tidak beracun, rapat energi tinggi 2
- CoO
(layered) Mahal, beracun, rapat energi rendah 2
- Rutile (layered) Murah, tidak beracun, rapat energi rendah (layered) Mahal, beracun, rapat energi rendah
- Anatase (layered) Murah, tidak beracun, rapat energi rendah - V2O5
Bahan mangan oksida (Mn (layered) Beracun
lingkungan, serta rapat energi yang tinggi. Selain itu lithium mangan oksida mempunyai host dalam tiga dimensi, sehingga arah kristal yang bersinggungan antar butir tidak banyak mempengaruhi (Najmuddin, 2005).
2.8 Metalik Lithium
Metalik Lithium merupakan bahan anoda yang ideal untuk baterai isi ulang karena memiliki kemurnian tinggi. Metalik lithium memiliki kapasitas teoritis yang tinggi yaitu sebesar 3860 mAhg-1 yang sepuluh kali lebih besar dibandingkan dengan kapasitas teoritis anoda grafit sebesar 372 mAh g- 1 yang digunakan dalam baterai Li-ion. Metalik lithium sangat reaktif terhadap air dan udara.
Gambar 2.9 Bentuk dari Metalik Lithium Tabel 2.2 Sifat fisis dari metalik lithium.
Penampilan Logam lunak padat putih-keperakan
Rumus molekul Li
Berat molekul 6,941
Nomor atom 3
Titik cair 180,5oC
Titik didih 1317 oC
Suhu nyala 179 oC
Densitas (g/cc) m%20Metal%20Safety%20version%202.pdf, diakses tanggal 20 April 2015).
2.9 Elektrolit LiPF
Salah satu jenis elektrolit adalah elektrolit cair. Sesuai dengan namanya elektrolit ini berbentuk cairan, dan pada umumnya mengandung Lithium
Hexafluorophosphate (LiPF6) 1.0~1.2 M (mol/L). Untuk melarutkan LiPF
6
6 diperlukan zat pelarut organik yang umumnya terdiri atas campuran senyawa karbonat. Syarat-syarat zat pelarut organik ini agar bisa dipakai pada baterai litium ion adalah memiliki konduktivitas tinggi, dan viskositas yang rendah sehingga ion litium bisa berpindah dengan mudah, dapat digunakan pada suhu -30~80 C, tidak mudah terbakar, dan tidak berbahaya. LiPF6 banyak digunakan pada baterai ion Lithium. Hexafluorophosphate Lithium (LiPF6) memiliki kombinasi sifat yang seimbang seperti konduktivitas ionik yang tinggi, disosiasi yang baik, dan mobilitas ion yang baik. Namun kelemahan utama dari LiPF6
Tabel 2.3 Sifat Fisik dan Kimia.
adalah sifatnya yang sangat peka terhadap lembab, ketika bereaksi dengan air akan membentuk asam fluorida yang memiliki efek merugikan pada kinerja sel baterai.
Penampilan cairan tidak berwarna
Bau bau amina sedikit
Titik didih 90-248oC
Titik leleh <20oC
Densitas (air): 1.16-1.45g / cm3 Tekanan uap (mmHg): 8mmHg (20oC)
Kelarutan larut dalam alkohol, keton, ester, air.
2.10 Separator
Separator adalah material berpori yang diletakkan diantara anoda dan katoda, yang dapat mencegah terjadinya gesekan antara kedua elektroda tersebut yang dapat menyebabkan arus pendek. Selain itu separator harus dapat dilewati oleh ion lithium dengan baik. Tidak hanya sebagai pembatas antar elektroda, separator memiliki peranan penting dalam proses penghasilan listrik, pengisian ulang, dan tentunya keamanan pada baterai litium ion sendiri.
Separator harus stabil pada kerja baterai untuk jangka waktu yang panjang dan tidak menghasilkan kotoran yang dapat mengganggu fungsi baterai. Separator yang ideal mempunyai resistansi ion yang rendah dapat diperoleh dengan nilai porositas yang tinggi. Sejauh ini separator yang digunakan pada baterai ion lithium terdiri dari membran polimer yang membentuk lapisan microporous. Meskipun separator umumnya telah menunjukkan kinerja yang memuaskan tetapi masih terdapat kekurangan karena separator mudah terbakar cairan elektrolit organik.
Tabel 2.4 Jenis separator (pemisah) yang digunakan dalam berbagai jenis baterai lithium sekunder.
Jenis separator yang biasa digunakan dalam berbagai jenis baterai lithium sekunder dapat dilihat pada Tabel 2.4 berikut;
Sistem Baterai Jenis Separator Komposisi
Ion Lithium (Elektrolit cair)
Mikroporous Polyolefin (PE, PP,
PP/PE/PP) Ion lithium gel polimer Mikroporous
Mikroporous
PVDF
Polyolefins (PE, PP, PP/
PE/PP) dilapisi oleh PVDF atau gel lainnya. Lithium polimer Elektrolit polimer Polyethylene dan garam
lithium
Polyolefin sangat umum digunakan sebagai bahan separator, khususnya pada
laptop dan hp, karena tipis dan memiliki kestabilan elektrokimia yang baik.
Polyolefin sendiri terdiri atas perpaduan antara polypropylene (sbg penyangga utama, backbone) dan polyethylene sebagai pelapis pada lubang/pori-pori. Polyethylene
memiliki sifat meleleh pada suhu diatas 120-130 o
Sisi negatifnya karena sifat diatas, polyolefin sulit digunakan pada baterai litium ion untuk mobil. Karena ukuran baterai mobil yang besar, memungkinkan terjadinya perubahan suhu yang tinggi secara drastis. Untuk mengatasi masalah tersebut, dilakukan pelapisan Al
C. Apabila panas yang dihasilkan didalam baterai melewati ambang batas, polyethylene akan melelah dan menutup lubang pada separator, mengakibatkan proses perpindahan lithium ion berhenti. Sehingga separator memiliki fungsi utama dalam hal keamanan bila terjadi panas berlebihan.
2O3 atau material keramik lainnya, pada permukaan separator. Sehingga walapun pada suhu tinggi, bentuk dari separator dapat terjaga bagian-2/).
2.11 Lithium Mangan Oksida (LiMn2O4
Lithium mangan oksida merupakan bahan katoda yang cukup populer pada baterai lithium. Lithium mangan oksida mempunyai struktur spinel dengan kemampuan interkalasi tiga dimensi. Hal ini menyebabkan bahan katoda ini mampu disisipi ion lithium dalam tiga arah. Baterai lithium merupakan baterai yang berbasis ion dengan ion lithium sebagai motor penggerak (Kiehne, 1998).
)
yang cukup stabil dalam proses interkalasi. Sebagaimana diketahui bahwa LixMn2O4 mempunyai struktur spinel yang tergambar di Gambar 2.10 (Prihandoko, 2007).
Keterangan:
Tabel 2.5 Sifat Bahan Baku LiMn
4 2O4
Bahan Baku
(Wigayati,2007). LiMn2O4
Kandungan Kristal atau serbuk hitam; larut pada hydrochloric acid; tidak larut pada air. Sp. Gr. 5.026; titik cair 535oC.
Resiko Dapat membakar bahan organik; tidak mengandung racun Kegunaan Untuk bahan baterai kering; katalis
2.12 Super P
Super P adalah karbon hitam konduktif yang digunakan sebagai aditif konduktif untuk Zinc-carbon dan lithium baterai primer masing-masing. Super P memiliki kemurnian yang tinggi. Kemurnian tinggi ini dibuktikan dengan abu yang rendah, kelembaban, belerang dan kandungan yang mudah menguap, sedangkan struktur tinggi diungkapkan oleh penyerapan minyak dan konduktivitas listrik. Ini adalah aditif konduktif dengan kinerja yang unggul, kemurnian tinggi dan penyerapan
elektrolit optimal. Pengaruh Super P terhadap kesehatan apabila terkena mata dan kulit dapat menyebabkan iritasi, dan apabila terhirup dapat menyebabkan iritasi saluran pernafasan.
2.13 Polyvynilidene Flouride (PVDF)
Binder adalah bagian penting dari formulasi elektroda pada baterai ion lithium karena binder mempertahankan struktrur fisik elektroda, tanpa binder elektroda akan berantakan. Sangat diharapkan bahwa binder memiliki titik leleh yang tinggi, dan struktur komposit dari material aktif dan binder harus stabil di dalam elektrolit, bahkan di suhu tinggi. Potensi kelemahan dari binder yaitu binder mungkin saja melapisi permukaan material aktif. PVDF ini berwarna putih dan tidak larut dalam air. Polimer ini banyak digunakan dalam aplikasi yang membutuhkan kemurnian, kekuatan, dan ketahanan terhadap bahan pelarut, asam, basa, dan panas yang sangat baik.
PVDF memiliki sifat pizoelektrik, yaitu sifat dari beberapa material dimana material tersebut dapat menimbulkan potensial listrik sebagai respon dari beban mekanis yang diterimanya. PVDF memiliki nilai koefisien pizoelektrik sebesar 6-7 pCN-1, 10 kali lebih besar dibandingkan dengan polimer jenis lain. (Abdillah, 2008). Struktur molekul PVDF memiliki rumus CH2 - CF2.
Gambar 2.11 Struktur Polyvynilidene Flouride (Tareev, 1975). Tabel 2.6 Sifat umum Polyvinylidene Fluoride (Abdillah, 2008).
Sifat Nilai
Modulus Elastisitas 1380-55200 MPa
Elongasi 12 %-600%
Kekuaatan Fleksural 67-95 MPa
Modulus Fleksural 1173-82800 Mpa
Temperatur Transisi Gelas (Tg) -60 − -20oC Temperatur Leleh (Tm) 141-178oC
Shrinkage 0,02-0,035 cm/cm
2.14 N-N Dimetil acetamide (DMAC)
N-N Dimetil acetamide (DMAC) merupakan pelarut industry yang kuat dan
serbaguna yang memiliki kelarutan terhadap bahan organic dan anorganik. DMAC diproduksi secara terbatas karena tidak dimaksudkan untuk digunakan oleh masyarakat umum. DMAC adalah cairan yang tidak berwarna dan dapat larut dengan air. Karakteristik dari DMAC yaitu memiliki berat molekul 87,12, kerapatannya 0,945 mg/cm3, titik didih tinggi yaitu 164 – 166 oC, titik beku yang rendah yaitu -20 o
C, dan stabilitas yang baik.
Gambar 2.12 Struktur molekul N-N dimetil acetamide (DMAC)
Pengaruh DMAC apabila terkena mata dan kulit dapat menyebabkan iritasi, apabila terhirup dapat menyebabkan iritasi saluran pernafasan, dan jika tertelan dapat menyebabkan mual, muntah dan diare sehingga saat menggunakan DMAC haruslah menggunakan masker dan sarung tangan sebagai alat pelindung diri.
Tabel 2.7 Sifat umum N-N-Dimethylacetamide
Sifat Keterangan
Berat molekul 87,12
Titik beku -20 ° C
Kerapatan 0,945 mg/cm
Sumber: (N-N-Dimethylacetamide, MSDS No. 96035 [online], ACROS ORGANICS, Canada.TDG).
2.15 XRD (X-Ray Diffraction)
XRD merupakan alat yang diguanakan untuk mengkarakterisasi struktur kristal, ukuran kristal dari suatu bahan padat. Semua bahan yang mengandung kristal tertentu ketika dianalisa menggunakan XRD akan memunculkan puncak-puncak yang spesifik. Sehingga kelemahan alat ini tidak dapat untuk mengkarakterisasi bahan yang bersifat amorf.
Metode difraksi umumnya digunakan untuk mengidentifikasi senyawaa yang belum diketahui yang terkandung dalam suatu padatan dengan cara membandingkan dengan data difraksi dengan database yang dikeluarkan oleh International Centre for
Diffraction Data berupa PDF (Powder Diffraction File). Pengamatan struktur kristal
dengan XRD dilakukan sebagai tahap awal karakterisasi untuk mengidentifikasi sejauh mana fasa yang terbentuk seperti yang diinginkan dan fasa lainnya yang tidak diharapkan .
gelombang dan frekuensi yang sama dengan sinar datang, yang disebut koheren satu sama lain. Gejala penghamburan atau difraksi ini yang akan direkam Fabrikasi dan karakterisasi sebagai identifikasi yang terkait dengan struktur kristal. Gambar 3.3 menunjukkan prinsip dasar XRD.
Gambar 2.13 Pola difraksi sinar-X yang terhambur oleh kisi dalam bidang kristal Penghamburan sinar ini mengikuti hukum bragg yang memenuhi persamaan berikut :
nλ = 2d sinθ (2.1) Struktur kristal dalam material berfasa tunggal atau lebih akan memiliki pola XRD yang unik. Pola-pola XRD ini tersimpan dalam kumpulan data JCPDS/ICDD yang dapat digunakan sebagai data pencocokan puncak-puncak 2θ dan intensitas dari data XRD sampel yang diuji (Subhan, 2011).
2.16 SEM (Scanning Electron Microscope)–EDS
SEM (Scanning Electron Microscope) adalah sebuah mikroskop elektron yang didesain untuk mengamati permukaan objek solid secara langsung. SEM memiliki perbesaran 10-3.000.000 kali, depth of field 4-0,4 mm dan resolusi sebesar 1-10 nm.
memproduksi suatu citra dengan kedalaman medan yang besar dan penampakan yang hamper tiga dimensi. Dalam penelitian morfologi permukaan SEM terbatas pemakaiannya, tetapi memberikan informasi yang bermanfaat mengenai topologi permukaan dengan resolusi sekitar 100 �̇.
Gambar 2.14 Contoh sebuah alat SEM
Gambar 2.15 Interaksi antara elektron primer dengan permukaan sampel
Hamburan terbagi menjadi dua jenis yaitu hamburan elstis dan non elastis. Hamburan elastik dihasilkan dari tumbukan berkas elektron dengan inti atom sampel tanpa terjadi perubahan energi. Gejala ini disebut juga Back Scattered Electron (BSE). Kebalikannya dengan BSE, hamburannya non elastis ditimbulkan dari berkas elektron yang dipancarkan oleh penembak elektron menumbuk elektron sampel hingga terjadi perpindahan energi dari elektron asal ke elektron sampel yang lebih rendah. Sinyal yang dihasilkan berupa energi dapat digunakan untuk analisis mikro. Sinyal-sinyal ini adalah elektron sekunder, elektron Auger dan sinar-X karakteristik.
Elektron sekunder adalah elektron yang dipancarkan dari sampel akibat interaksi berkas elektron asal/primer dengan elektron pada pita penghantar benda uji. Interaksi ini menghasilkan perpindahan energi yang rendah ke elektron penghantar. Elektron sekunder dengan energi rendah ini dapat dibelokan membentuk sudut dan menimbulkan bayangan topografi atau struktur permukaan. Pada waktu elektron primer memenuhi permukaan sampel, akan menghasilkan elektron sekunder dari suatu area scan dalam bentuk informasi/bayangan.
secara kualitatif maupun kuantitatif. Untuk menentukan komposisi unsur suatu permukaan sampel diperlukan integrasi dengan SEM, alat ini disebut EDX (Energy
Dispersive X-ray Spectroscopy) (Triwobowo, 2011).
2.17 Mikroskop Optik
Cara kerja dari mikroskop optik adalah dari cahaya lampu yang dibiaskan oleh lensa kondenser, setelah melewati lensa kondenser sinar mengenai spesimen dan diteruskan oleh lensa objektif. Lensa objektif ini merupakan bagian yang paling penting dari mikroskop karena dari lensa ini dapat diketahui perbesaran yang dilakukan mikroskop. Sinar yang diteruskan oleh lensa objektif ditangkap oleh lensa okuler dan diteruskan pada mata atau kamera.
Mikroskop optik mempunyai bagian-bagian seperti bagan dibawah ini:
(a) (b)
Gambar 2.16 a) Skema Mikroskop Optik, b) Contoh mikroskop optik
2.18 Charge Discharge Baterai Lithium-Ion
sumber tegangan. Besar beban/arus yang dialirkan pada baterai coin cell sebesar 0,005 mA dan range potensialnya sebesar 3,5-4 V. Gambar 3.1 menunjukkan profil I-V pengisian baterai lithium ion rechargeable.
Gambar 2.17 Profil tegangan yang harus dipenuhi selama mengisi ulang sebuah baterai lithium
Terdiri dari 3 tahapan. Stage 1 baterai diisi dengan sumber arus tetap, stage 2-3 dengan sumber tegangan tetap. Untuk mendapatkan performasi sebuah baterai maka diperlukan pengujian charge/discharge sehingga akan didapatkan besar kapasitas sel baterai. Pada penelitian ini pengujian dilakukan dengan membuat sistem pengujian
charging dan discharging. Gambar 3.7 memperlihatkan desain skematik rangkaian
elektronik pengujian sel baterai. Data selama pengujian sel direkam dengan picologer ADC20 yang memiliki kemampuan merekam hingga 50 ms yang terdiri dari 8
Gambar 2.18 Gambaran skema konfigurasi elektronik pengujian karakterisasi
charge/discharge sel baterai
Pengaturan waktu T1 dilakukan untuk waktu charging, T2 untuk mengatur waktu
discharging dan T untuk mengatur waktu jeda antara charging dan discharging.
Pengaturan T diperlukan untuk mengamati tegangan baterai Vocv. Data pengukuran dapat direkam setiap 50-500 ms. (Subhan, 2011). Perhitungan kapasitas dilakukan dengan program excel sederhana. Data pengamatan yang dihasilkan adalah rekaman waktu (t / ms ), arus (i / mA ), tegangan ( V / volt). Dari setiap data waktu (t), arus (i), dan tegangan (v) dapat dihitung nilai kapasitas sel baterai. Kapasitas merupakan jumlah total dari perkalian arus (i) dan waktu (s), memenuhi . persamaan berikut : �� = ∑ ∆��� �.�� ; dengan, j = detik ke−1,2,3, … , terakhir (2.2) Dan kapasitas total dihitung berdasarkan persamaan:
BAB 1
PENDAHULUAN
1.1Latar Belakang
Baterai kini telah menjadi bagian dari kehidupan sehari-hari, untuk kehidupan modern saat ini baterai sudah menjadi sebuah kebutuhan yang melekat pada setiap aktivitas terutama yang berhubungan dengan piranti elektronika. Pengembangan baterai yang kian hari kian maju menuju arah yang lebih baik, terus dilakukan oleh para ahli. Apalagi saat ini masyarakat dunia tengah berupaya mencari energi alternatif yang berupa non migas. Pemanfaatan baterai yang digunakan sebagai media penyimpan energi alternatif yang terlebih dahulu dikonversikan menjadi energi listrik. Salah satu upaya untuk penyelamatan dari ketergantungan pada minyak bumi.
Baterai didefenisikan sebagai suatu alat yang dapat mengubah langsung energi kima menjadi energi listrik melalui proses elektrokimia. Pengertian baterai yang saat ini umum digunakan sesungguhnya mencakup satu atau beberapa sel baterai yang digabungkan secara seri atau paralel sesuai dengan tegangan dan kapasitas listrik yang diinginkan. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, separator, wadah terminal/current collector (Triwibowo, 2011).
Penggunaan baterai ion-Li dalam produk-produk teknologi saat ini sangat luas seperti laptop, telepon selular, sepeda elektrik dan mobil elektrik. Baterai ion-Li mempunyai densitas energi paling tinggi di antara baterai sekunder yang lain (Ceder, 1998).
Baterai sekunder ialah baterai yang dapat dipakai ulang beberapa kali untuk mengkonversi energi kimia menjadi energi listrik melalui proses elektrokimia. Proses elektrokimia ini berlangsung bolak-balik sehingga baterai ini disebut juga baterai isi ulang atau rechargeable battery (Linden, 2002).
Li-ion. Diantara baterai-baterai sekunder tersebut yang paling menonjol adalah baterai Li-ion. Kelebihan baterai Li-ion memiliki lifecycle panjang (500-1000 siklus), densitas energi tinggi dan kapasitas spesifik lebih tinggi dibandingkan dengan baterai sekunder yang lain. Selain itu, baterai ion lithium sudah banyak digunakan sebagai sumber energi untuk peralatan elektronik portable bahkan pada mobil listrik (Chew, 2008).Baterai ion-Li tidak mengalami memory effect sehingga dapat diisi kapan saja, waktu pengisian singkat (2 – 4 jam) karena arus pengisian baterai tinggi (0,5 – 1 A), laju penurunan efisiensi baterai rendah (5 – 10 % per bulan) serta lebih tahan lama (masa hidup 3 tahun) (Eriksson, 2001). Anoda baterai ion-Li komersial berupa kristal karbon, oksida logam (LiCoC2) sebagai katoda, separator sebagai lapisan pemisah antar elektroda, serta elektrolit berupa larutan garam lithium (LiPF6, LiBF4 atau LiClO4
Secara umum, baterai ion lithium terdiri dari tiga komponen utama yaitu elektrolit, anoda dan katoda. Material material elektrolit yang digunakan antara lain adalah lithium hexafluorophosphat (LiPF
) dalam pelarut organik seperti eter (Herstedt, 2003).
Beberapa material katoda pada baterai ion litium yang telah disintesis yaitu
lithium mangan oxide (LiMn
2O4) (Chew, 2008), lithium cobalt oxide (LiCoO2) (Ritchie, 2001) dan lithium iron phospate (LFP) (Hamid, 2012). Lithium Mangan Oksida (LiMn2O4) banyak digunakan sebagai bahan katoda untuk baterai lithium
rechargeable. Hal ini dianggap berpotensi untuk bahan katoda karena ketersediaanya
yang melimpah, ramah lingkungan dan harga terjangkau, memiliki kapasitas spesifik teori sebesar 110 mAh/g, konduktivitas listrik yakni sekitar 10-5
Dalam pembuatan lembaran katoda, ada beberapa hal yang harus diperhatikan untuk mempengaruhi bagus tidaknya lembaran katoda yang akan dihasilkan yaitu tingkat kehomogenan lumpur (slurry), suhu pemanasan, viskositas lumpur (slurry), kecepatan pencampuran, dan lain-lain. Pada pembuatan lembaran katoda ini digunakan bahan LiMn
S/cm dan memiliki
range tegangan yang besar yaitu 3,5-4,5 Volt.
2O4 ( Lithium Mangan Oxide) sebagai bahan material aktifnya, PVDF (Polyvynilidene Flouride) sebagai bindernya, dan Super P sebagai bahan aditif konduktif sedangkan untuk pelarutnya digunakan DMAC. Kemudian dari lembaran katoda LiMn2O4 tersebut akan dibuat menjadi baterai coin cell dengan menggunakan metalik litium sebagai anodanya. Dalam penelitian ini difokuskan pembuatan lembaran katoda dengan variasi komposisi, serta variasi ketebalan lembaran katoda LiMn2O4 untuk mengetahui mikrostruktur dari lembaran katoda LiMn2O4, dan karakterisasi kapasitas discharge baterai coin cell.
1.2Rumusan Masalah
Berdasarkan latar belakang diatas, maka permasalahan yang akan dibahas dalam penelitian ini adalah:
1. Bagaimana pengaruh variasi komposisi terhadap performa baterai coin cell? 2. Bagaimana pengaruh ketebalan lembaran katoda LiMn2O4 terhadap performa
1.3Batasan Masalah
Untuk mendapatkan suatu hasil penelitian dari permasalahan yang ditentukan maka perlu ada pembatasan masalah penelitian, yaitu sebagai berikut:
1. Bahan yang digunakan dalam pembuatan lembaran katoda adalah serbuk LiMn2O4,
2. Variasi komposisi yang digunakan adalah 85:10:5 dan 90:7:3.
Super P, PVDF dan pelarutnya yaitu DMAC sebanyak 60 ml.
3. Variasi ketebalan lembaran katoda LiMn2O4
4. Anoda yang digunakan dalam pembuatan baterai coin cell adalah metalik lithium.
adalah 100 μm, 150 μm, 300μm.
5. Elektrolit yang digunakan dalam pembuatan baterai coin cell adalah 1M LiPF6
6. Parameter yang dianalisa yaitu kapasitas discharge baterai dan mikrostruktur dari lembaran katoda
.
LiMn2O4.
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Membuat lembaran katoda LiMn2O4
2. Mengetahui mikrostruktur lembaran katoda
dengan variasi komposisi dan ketebalan. LiMn2O4
3. Mengetahui kapasitas discharge baterai coin cell.
dengan variasi komposisi dan ketebalan.
1.5Manfaat Penelitian
Manfaat yang didapat dari penelitian ini adalah dapat mengetahui performa baterai
coin cell dan mikrostrukturnya terhadap variasi komposisi dan ketebalan lembaran
katoda LiMn2O4.
1.6Tempat dan Waktu Penelitian
Taangerang Selatan, Kode Pos 15310, Provinsi Banten, Indonesia. Dimulai tanggal 5 Februari 2015 sampai tanggal 5 Mei 2015.
1.7Sistematika Penulisan
Sistematika penulisan pada masing-masing bab adalah sebagai berikut: BAB 1 PENDAHULUAN
Bab ini mencakup latar belakang penelitian, batasaan masalah yang akan diteliti, rumusan masalah, tujuan penelitian, manfaat penelitian, tempat penelitian, dan sistematika penulisan.
BAB 2 TINJAUAN PUSTAKA
Bab ini membahas tentang landasan teori yang menjadi acuan untuk proses pngambilan data, analisa data, serta pembahasannya.
BAB 3 METODOLOGI PENELITIAN
Bab ini membahas tentang metode penelitian, tempat dan waktu penelitian peralatan dan bahan penelitian, diagram alir penelitian, prosedur penelitian, dan pengujian sampel.
BAB 4 HASIL DAN PEMBAHASAAN
Bab ini membahas tentang data hasil penelitian dan analisa data yang diperoleh dari penelitian.
BAB 5 KESIMPULAN DAN SARAN
Bab ini berisikan tentang kesimpulan yang diperoleh dari penelitian dan memeberikan saran untuk penelitian yang lebih lanjut.
DAFTAR PUSTAKA
ABSTRAK
Telah dibuat lembaran katoda LiMn2O4 dari campuran serbuk LiMn2O4, Super P, PVDF serta pelarutnya DMAC sebanyak 60 ml dengan menggunakan variasi komposisi dan ketebalan dimana variasi komposisi yang digunakan adalah 85:10:5 dan 90:7:3 sedangkan variasi ketebalannya adalah 100 µm, 150 µm, 300 µm. Dari lembaran katoda tersebut dibuat baterai coin cell dengan menggunakan anoda yaitu metalik lithium dan elektrolitnya yaitu 1 M LiPF6. Karakterisasi yang diuji yaitu serbuk LiMn2O4 dengan XRD, morfologi lembaran katoda LiMn2O4 dengan Mikroskop Optik dan SEM-EDX, serta kapasitas discharge baterai coin cell dengan uji charge discharge. Dari hasil pengujian kapasitas discharge baterai yang dihasilkan pada komposisi 85:10:5 semakin menurun dengan bertambahnya ketebalan lembaran katoda LiMn2O4, sedangkan pada komposisi 90:7:3 kapasitas discharge baterai meningkat pada ketebalan 150 µm yaitu sebesar 0,93 mAh/gr, jika ketebalan lembaran katoda ditambahkan menjadi 300 µm maka kapasitas discharge-nya menjadi menurun yaitu sebesar 0,31 mAh/gr.
ABSTRACT
LiMn2O4 cathode sheets have been made from a mixture of LiMn2O4 powder, Super P, PVDF and DMAC solvent of 60 ml by using a variation of the composition and thickness variation wherein the composition used is 85: 10: 5 and 90: 7: 3, while the variation in thickness is 100 μm, 150 μm, 300 µm. The cathode sheets made from coin cell batteries using metallic lithium anode and electrolyte which is 1 M LiPF6. Characterization of powder LiMn2O4 tested by XRD, morphology LiMn2O4 cathode sheets with Optical Microscopy and SEM-EDX, and the coin-cell battery discharge capacity with charge-discharge test. From the results of testing the capacity of the battery discharge generated on the composition of 85: 10: 5 decreases with increasing thickness of the sheet LiMn2O4 cathode, while the composition of 90: 7: 3 discharge
capacity of the battery is increased in thickness of 150 μm is equal to 0.93 mAh / g, if the thickness of cathode sheets are added to 300 μm then its discharge capacity was
decreased in the amount of 0.31 mAh / g.
KAPASITAS BATERAI ION LITHIUM
SKRIPSI
TRI MALA SARI
110801080
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENGARUH KOMPOSISI DAN KETEBALAN KATODA
LiMn
2O
4KAPASITAS BATERAI ION LITHIUM
(LITHIUM MANGAN OKSIDA) PADA
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
TRI MALA SARI 110801080
DEPARTEMEN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
Judul : Pengaruh Komposisi Dan Ketebalan Katoda LiMn2O4
Kategori : Skripsi
(Lithium Mangan Oksida) Pada Kapasitas Baterai Ion Lithium
Nama : Tri Mala Sari
Nomor Induk Mahasiswa : 110801080
Program Studi : Sarjana (S1) Fisika Departemen : Fisika
Fakultas : Matematika Dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
Disetujui di Medan, Agustus 2015
Disetujui Oleh
Departemen Fisika FMIPA USU Pembimbing, Ketua,
PENGARUH KOMPOSISI DAN KETEBALAN KATODA
LiMn
2O
4KAPASITAS BATERAI ION LITHIUM
(LITHIUM MANGAN OKSIDA) PADA
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juli 2015
Syukur alhamdulillah, puji syukur kepada Allah SWT, Tuhan semesta alam yang telah memberikan rahmat dan karunia-nya sehingga penulis dapat menyelesaikan tugas akhir. Salawat beriring salam teruntuk nabi besar Muhammad SAW yang menjadi teladan dalam menjalani kehidupan.
Tugas akhir merupakan salah satu persyaratan untuk memperoleh gelar sarjana pada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan. Untuk memenuhi persyaratan diatas penulis mengerjakan tugas akhir dengan judul : “ PENGARUH KOMPOSISI DAN KETEBALAN
KATODA LiMn2O4
Penulis menyadari bahwa selama proses hingga akhir terselesaikannya penyusunan skripsi ini bayak sekali bimbingan dan bantuan dari berbagai pihak. Dengan segala kerendahan hati, penulis ingin menyampaikan rasa terima kasih dan penghargaan yang sebesar-besarnya kepada :
(LITHIUM MANGAN OKSIDA) PADA KAPASITAS BATERAI ION LITHIUM ”. Yang dilaksanakan di Laboratorium Baterai P2F
Lembaga Ilmu Pengetahuan Indonesia, Serpong, Tangerang Selatan, Banten.
1. Kedua orangtua saya yang tercinta dan tersayang Ayahanda Misri dan Ibunda Rumiati yang tulus menyayangi penulis dan tak henti-hentinya memberikan nasehat, doa, dukungan serta materi maupun moril. Semoga penulis menjadi anak yang bisa membanggakan ayah dan ibu.
2. Bapak Dr. Sutarman M.Sc selaku Dekan Departemen Fisika Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan. 3. Bapak Dr. Marhaposan Situmorang selaku Ketua Departemen Fisika Fakultas
Medan.
5. Bapak Ir. Joko Triwibowo, M.Sc. M.T. dan Bapak Dr. Kerista Sebayang, MS selaku Dosen Pembimbing yang telah bersedia meluangkan waktu untuk membimbing penulis dalam melakukan penelitian dan menyelesaikan skripsi ini.
6. Bapak Dr. Bambang Widyatmoko, M. Eng, selaku Kepala Laboratorium Pusat Penelitian Fisika P2F-LIPI Serpong.
7. Bapak Ibrahim, Bapak Slamet Priyono, Mbak Kristine, Bapak Fadli yang telah memberikan waktu, bimbingan, ilmu kepada penulis dalam menyelesaikan skripsi ini.
8. Mas Edi, Kak Reza, Kak Ali yang telah memberikan waktu dan tenaganya dalam membantu penulis melakukan penelitian di lapangan.
9. Seluruh Staf dosen, Pembantu Dekan, Pegawai Departemen Fisika FMIPA USU
10. Kakak saya tercinta Dwi Misri Yani dan Abang saya Junaidi yang telah memberikan motivasi, doa, dan dukungan yang tak henti-henti kepada penulis.
11. Sahabat-sahabat saya Sry Pratiwi, Sri Handika Pratiwi, Intan Zahar, Henni Setia Ningsih, Elmariska Khairani, Wiria Sasmita yang tak henti-hentinya memberikan semangat, doa, dan dukungan kepada penulis.
12. Seluruh teman – teman seperjuangan angkatan 2011 yang tidak bisa saya sebutkan satu per satu, sukses untuk kedepannya buat kita semua.
Medan, Juli 2015
ABSTRAK
Telah dibuat lembaran katoda LiMn2O4 dari campuran serbuk LiMn2O4, Super P, PVDF serta pelarutnya DMAC sebanyak 60 ml dengan menggunakan variasi komposisi dan ketebalan dimana variasi komposisi yang digunakan adalah 85:10:5 dan 90:7:3 sedangkan variasi ketebalannya adalah 100 µm, 150 µm, 300 µm. Dari lembaran katoda tersebut dibuat baterai coin cell dengan menggunakan anoda yaitu metalik lithium dan elektrolitnya yaitu 1 M LiPF6. Karakterisasi yang diuji yaitu serbuk LiMn2O4 dengan XRD, morfologi lembaran katoda LiMn2O4 dengan Mikroskop Optik dan SEM-EDX, serta kapasitas discharge baterai coin cell dengan uji charge discharge. Dari hasil pengujian kapasitas discharge baterai yang dihasilkan pada komposisi 85:10:5 semakin menurun dengan bertambahnya ketebalan lembaran katoda LiMn2O4, sedangkan pada komposisi 90:7:3 kapasitas discharge baterai meningkat pada ketebalan 150 µm yaitu sebesar 0,93 mAh/gr, jika ketebalan lembaran katoda ditambahkan menjadi 300 µm maka kapasitas discharge-nya menjadi menurun yaitu sebesar 0,31 mAh/gr.