BAB 2 TINJAUAN PUSTAKA
2.1. Baterai
Baterai didefinisikan sebagai perangkat penyimpanan elektrokimia yang menyimpan listrik dalam ikatan kimia. Alat ini mengubah energi kimia yang terkandung dalam bahan aktif langsung menjadi energi listrik dengan cara reaksi elektrokimia. Reaksi ini melibatkan transfer elektron dari satu materi ke materi yang lain melalui sebuah sirkuit listrik. Secara ilmiah, baterai disebut sebagai sel elektrokimia atau sel galvanik yang menyimpan energi listrik dalam bentuk energi kimia dan reaksi elektrokimia yang terjadi disebut galvanis. Proses elektrokimia ini kemudian mengalami reaksi redoks. Konversi energi kimia menjadi energi listrik dilakukan melalui transfer elektron pada sirkuit eksternal (Ho Kar Yee et al., 2014).
Baterai terdiri dari dua jenis yaitu primer dan sekunder. Dalam baterai primer, Reaksi elektroda tidak reversibel oleh karena itu sel tidak dapat diisi ulang, yaitu setelah satu charge, akan dibuang. Pada baterai sekunder, reaksi elektroda bersifat reversibel dan sel-sel dapat diisi ulang. Sebuah baterai terdiri dari tiga komponen utama: katoda, elektrolit dan anoda. Katoda merupakan elektroda tempat reaksi reduksi terjadi (yaitu elektron yang diterima dari rangkaian luar), sedangkan reaksi oksidasi terjadi pada anoda (yaitu elektron yang dilepaskan ke sirkuit luar). Elektrolit adalah isolator elektronik, namun konduktor ionik yang baik fungsi utamanya adalah untuk memberikan transportasi menengah untuk ion melakukan perjalanan dari satu elektroda ke elektroda lainnya. (Eriksson, 2001).
2.2. Baterai Lithium Ion
Sebuah baterai Li-ion biasanya mengacu pada baterai sekunder di mana energi kimia disimpan melalui reaksi redoks yang mempekerjakan interkalasi lithium antara elektroda positif (katoda) dan elektroda negatif (anoda). Ketika charging dan
discharging ion lithium bergerak bolak-balik antara katoda dan anoda. (Paravasthu,
elektroda tidak menyentuh satu sama lain tetapi dihubungkan secara elektrik dengan elektrolit sementara separator mencegah pencampuran antara elektroda tetapi memungkinkan ion Li untuk mengalir.
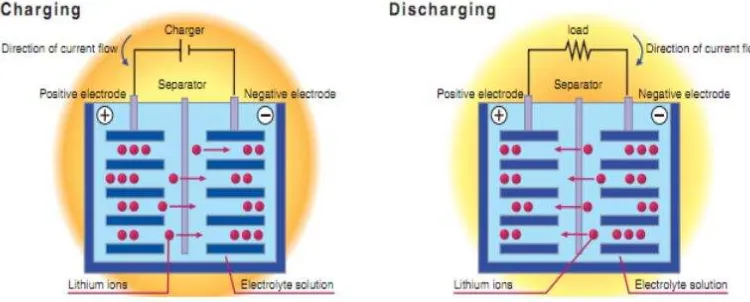
Berbagai baterai telah dikembangkan, seperti lead-acid, Ni-Cd, Ni-metal hidrida dan baterai Lithium ion. Di antara semua sistem baterai, baterai Li-Ion dapat memberikan kepadatan (densitas) energi yang lebih tinggi karena Lithium merupakan baterai yang paling elektropositif (-3,04V v.s. standar hidrogen elektroda) dan logam ringan (M = 6,94 g / mol). Selama proses pengisian dan pengosongan Li ion mentransfer seluruh elektrolit antara anoda dan katoda dengan oksidasi dan reduksi yang terjadi pada dua elektroda seperti ditunjukkan pada Gambar 1.
Gambar 1. Proses Charging dan Discharging pada Baterai Lithium Ion (Sumber: Paravasthu R, 2012)
1) Selama pengisian baterai (charging), lithium ion mengalir dari elektroda positif ke elektroda negatif melalui elektrolit. Elektron cenderung mengalir pada arah di sekitar sirkuit luar
2) Ketika semua ion berhenti mengalir, baterai akan terisi penuh dan siap untuk digunakan.
3) Selama pemakaian baterai (discharging), ion mengalir kembali dari elektroda negatif ke elektroda positif. (Oswal M et al., 2010).
2.3 Bagian-Bagian Baterai Lithium Ion
2.3.1 Elektroda Negatif (Anoda)
Anoda, atau elektroda negatif, umumnya terbuat dari grafit (karbon) dan dilapiskan pada tembaga foil. Anoda menerima Li-ion saat siklus pengisian dan memancarkan ke katoda selama siklus pemakaian. Bahan aktif di anoda terdiri dari grafit, perekat, pelarut, dan karbon konduktif. Ada dua jenis struktur karbon elektroda yaitu: "Kristal grafit alam dan kristal karbon buatan". Anoda terbuat dari grafit yang memungkinkan ion lithium tunggal untuk diinsersi dalam struktur segi enam pada pengisian penuh komposisi LiC6. (Arora Y et al., 2015).
Bahan potensial untuk elektroda negatif harus memenuhi persyaratan sebagai berikut:
1. Dapat bereaksi reversibel dengan lithium.
2. Dapat Mengakomodasi beberapa Li-ion per atom logam untuk memberikan kapasitas tinggi.
3. Penyisipan / ekstraksi harus dioperasikan pada tegangan rendah dengan Li+/ Li (-3,04V) untuk mendapatkan tegangan yang besar.
4. Konduktivitas elektronik dan ionik yang baik.
5. Harga Murah dan ramah lingkungan (Philippe B, 2013).
2.3.2 Elektroda Positif (Katoda)
Elektroda positif dalam baterai lithium-ion didasarkan pada tiga jenis kimia dasar: oksida berlapis (seperti lithium cobalt oksida), spinel (seperti lithium mangan oksida), atau polyanion (seperti lithium iron phosphate). Bahan katoda yang paling umum digunakan dalam sel lithium-ion adalah lithium cobalt oksida. Namun, berbagai bahan lain yang digunakan seperti lithium feroposfat (LiFePO4), spinel
seperti lithium mangan oksida (LiMn2O4), atau oksida logam campuran yang
mencakup cobalt (Co), nikel (Ni), aluminium (Al), dan oksida mangan seperti kobalt nikel aluminat (NCA) (Mikolajczak C et al., 2011). Bahan yang umum digunakan sebagai katoda pada baterai lithium adalah LiCoO2. LiCoO2 merupakan bahan katoda
yang memilki kapasitas spesifik yang paling tinggi. Namun material katoda ini berbahaya untuk digunakan karena mengandung logam berat. LiMn2O4 merupakan
Tabel 1. Sifat Bahan Katoda dalam Baterai Li-ion
Gambar 2. Fenomena Konduktifitas Ionik dan Elektronik pada Material Katoda (Sumber: Park, 2010).
Gambar diatas menggambarkan fenomena konduksi dalam partikel komposit katoda tunggal. Ketika Li-ion berdifusi keluar dari katoda (konduksi ionik) selama siklus charge keadaan valensi ion logam transisi berubah (konduksi elektronik) jadi penting bahwa konduktivitas listrik dan ionik dioptimalkan dalam bahan katoda (Park, 2010).
Untuk dapat digunakan sebagai elektroda positif dalam baterai Li-ion, bahan harus memenuhi beberapa persyaratan sebagai berikut:
1. Bahan harus mudah direduksi / ion teroksidasi, misalnya logam transisi. 2. Bahan harus bereaksi reversibel dengan lithium yaitu tidak ada perubahan
3. Bahan harus harus mampu beroperasi pada tegangan tinggi (sekitar 4 V) untuk memberikan kapasitas penyimpanan energi yang tinggi.
4. Proses insersi / ekstraksi harus cepat untuk mencapai densitas daya (power
density) yang tinggi.
5. Bahan harus memiliki konduktivitas elektronik dan konduktivitas Li-ion yang baik.
6. Bahan harus stabil secara termal dan kimia, murah dan ramah lingkungan. (Philippe B, 2013).
2.3.3 Elektrolit
Elektrolit adalah bagian penting ketiga dari baterai Li-ion. Ini memastikan konduksi dari lithium-ion antara elektroda negatif dan elektroda positif dan bertindak sebagai penghalang fisik antara dua elektroda (ketika digabungkan dengan separator untuk elektrolit cair). Sifat kimia dari elektrolit memiliki dampak yang kuat pada kinerja baterai dan terutama pada antarmuka elektroda / elektrolit (Philippe B, 2015). Fungsi utama dari elektrolit adalah untuk mencegah pertukaran elektron langsung antara elektroda dan memfasilitasi aliran elektron agar teratur dan stabil melalui sirkuit eksternal. Secara bersamaan, elektrolit harus menjadi konduktor ionik (konduktif yang sangat ideal) untuk menjaga transfer internal. Selain itu, elektrolit juga harus memenuhi beberapa syarat lagi untuk memastikan bahwa fungsi baterai yang dihasilkan seperti yang diinginkan. Mungkin yang paling penting, elektrolit harus menunjukkan stabilitas elektrokimia yang tinggi, di seluruh rentang tegangan baterai. Ini berarti bahwa elektrolit harus tetap lembam selama operasi. (Øystein G, 2012).
Elektrolit dalam sel lithium-ion biasanya terdiri dari garam lithium yang dilarutkan dalam campuran pelarut yang juga mengandung sejumlah aditif kecil. Garam lithium umumnya LiPF6 yang memiliki kualitas yang memadai misalnya
stabilitas elektrokimia dan kisaran suhu yang dapat digunakan untuk baterai lithium-ion komersial. (Svens P, 2016).
Elektrolit yang ideal memiliki beberapa persyaratan umum untuk memenuhi :
1. Konduktivitas ionik tinggi (σ Li > 10-4 S/cm) dan konduktivitas elektronik
2. Stabil secara kimiawi terhadap semua komponen sel (separator, kolektor, bahan kemasan sel).
3. Harus membentuk lapisan pasif yang stabil pada permukaan Elektroda. 4. Dapat mentolerir kondisi ekstrim (listrik, mekanik dan penyalahgunaan
termal).
5. Toksisitas rendah dan harga murah (Phlippe B, 2013). 6. Elektrokimia stabil di kisaran tegangan operasi baterai. 7. Viskositas rendah (terkait dengan konduktivitas ionik tinggi).
8. Kemampuan untuk melarutkan garam bahkan pada konsentrasi tinggi (konstanta dielektrik tinggi).
9. Stabil pada rentang temperatur yang tinggi (Gulbrekken,2012).
2.3.4 Separator
Separator adalah membran berpori yang ditempatkan di antara katoda dan anoda. Membran ini memiliki fungsi mencegah kontak fisik antara elektroda dan memungkinkan pergerakan ion lithium lancar dengan hosting sejumlah besar ion-konduktif cairan elektrolit. Kontak antara elektroda, seperti korsleting, dapat menyebabkan perpindahan panas dan dalam kasus terburuk, kebakaran dan ledakan mungkin terjadi sebagai akibat dari meningkatnya suhu di dalam sel lithium-ion. Oleh karena itu, separator diperlukan untuk mempertahankan sifat fisik dan elektrokimia, bahkan pada suhu yang relatif tinggi (Carvalho et al., 2015).
Bahan seperti serat nonwoven (misalnya nylon, katun, poliester, kaca), film polimer (misalnya polietilena (PE), polypropylene (PP), poly (tetrafluoroethylene) (PTFE), polivinil klorida (PVC), dan zat alami (misalnya karet, asbes, kayu) telah digunakan untuk separator mikro dalam baterai yang beroperasi pada suhu kamar dan rendah (<100 ° C) (Arora P et al., 2004). Beberapa pertimbangan penting dan mempengaruhi dalam pemilihan separator adalah sebagai berikut :
1. Daya tahan elektrolit (ionik) minimal. 2. Stabilitas mekanis dan dimensi.
3. Kekuatan fisik yang cukup untuk memudahkan perlakuan.
4. Resistansi kimia terhadap degradasi oleh elektrolit, pengotor, elektroda reaktan dan produk.
5. Efektif dalam mencegah migrasi partikel atau koloid atau larut antara dua elektroda (Arora P, 2004).
2.4 Material Katoda untuk Baterai Lithium Ion
Material katoda yang sering digunakan pada baterai ion lithium yaitu LiCoO2,
LiMn2O4, LiFePO4, LiNiO2. Ketiga material tersebut memiliki bentuk struktur host
yang berbeda yang dapat dilihat pada Gambar 2.3.
Gambar 3. Ilustrasi Skematis pada Struktur Host dari (a) LiCoO2 (Struktur Layered),
(b) LiMn2O4 (Struktur Spinel), dan (c) LiFePO4 (Struktur Olivine)
(Sumber: Julien, 2014).
Pada struktur host layered, ion lithium berinterkalasi dalam dua arah, pada struktur host spinel interkalasi ion lithium dalam tiga arah, sedangkan pada struktur
2.4.1 LiCoO2
LiCoO2 adalah elektroda positif yang paling umum digunakan dalam
baterai Li ion komersial karena memiliki potensial yang tinggi 3,9 V dan waktu hidup yang baik. LiCoO2 memiliki kapasitas teoritis 274 mAh/g tetapi hanya
setengah dari kapasitas ini (~140 mAh/g) yang dapat digunakan dalam sel praktis karena hanya 0,5 Li yang dapat reversibel tanpa kehilangan kapasitas (Philippe B, 2013). LiCoO2 memiliki struktur kristal layered, selama discharge penyisipan ion Li
akan menurunkan tolakan antara lembar CoO2 dan mengarah ke kontraksi volume ~
2% (Kejie Z, 2012). Katoda LiCoO2 bersifat reversibel. Lebih dari 1000 siklus
charge-discharge diperoleh tanpa kehilangan kapasitas spesifik yang cukup besar
(Wang G, 2000).
2.4.2 LiFePO4
Senyawa ini memiliki jenis struktur olivine. LiFePO4 memiliki kapasitas
reversibel ~160 mAh.g-1 dan tegangan operasi. LiFePO4 mengandung unsur
berlimpah, murah dan ramah lingkungan. FePO4 sangat stabil (terhadap
ketidakstabilan elektrolit, termal dan struktural) dan dengan demikian lebih aman daripada oksida TMO (Transition Metal Oxides) yang disajikan sejauh ini. Kapasitas utama tidak berkurang dan kinerja elektrokimia dapat ditingkatkan pada suhu tinggi (sampai 85 °C) selama siklus hidup panjang.
Kelemahan utama dari LiFePO4 adalah konduktivitas listrik rendah yang
membatasi kapasitas reversibel. Secara paralel, pembentukan senyawa kompleks dengan substitusi parsial Fe oleh logam transisi lainnya (Ni, Co, Mn) digunakan untuk meningkatkan tegangan operasi. LiMnPO4, LiCoPO4 dan LiNiPO4 juga
membentuk struktur olivin memiliki masing-masing tegangan operasi dari 4,1V, 4,8V dan 5,1V (Philippe B, 2013).
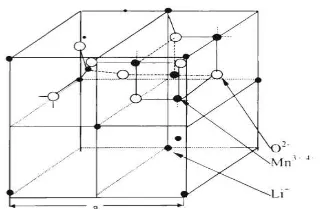
2.4.3 LiMn2O4 (LMO)
LiMn2O4 memilki jenis struktur spinel yang memiliki stabilitas struktural
merupakan baterai yang berbasis ion dengan ion lithium sebagai motor penggerak Spinel LiMn2O4 menunjukkan kurangnya ketahanan dalam siklus hidup dan
hilangnya ireversibel dari kapasitas yang cepat pada temperatur tinggi. (Julien, 2014). Insersi dan ekstraksi pada spinel LiMn2O4 menghasilkan tegangan rata-rata 4
V. Spinel LiMn2O4 memiliki keunggulan dibandingkan Co dan Ni yaitu murah,
ramah lingkungan dan memiliki stabilitas termal yang lebih besar terutama ketika
overcharged, namun kapasitas teoritis LiMn2O4 hanya 148 mAh/g (Wang G, 2000).
Gambar 4. Struktur Spinel Lithium Mangan Oksida (LiMn2O4)
(Sumber: Wang G, 2000)
Valensi dari Mn dalam stoikiometri LiMn2O4, reaksi spinel elektroda LiMn2O4 pada
proses sel lithium :
LiMn2O4 Li+ + Mn2O4 + e- (1)
Reaksi stoikiometri merupakan penentuan perbandingan massa unsur-unsur dalam senyawa dalam pembentukan senyawanya. Reaksi kimia merupakan suatu proses dimana zat-zat baru yaitu hasil reaksi, terbentuk dari beberapa zat aslinya, yang disebut pereaksi. Biasanya, suatu reaksi kimia disertai oleh kejadian-kejadian fisis, seperti perubahan warna, pembentukan endapan, atau timbulnya gas.
n
=
�
(2)
Keterangan :
n = mol
m = massa (gram)
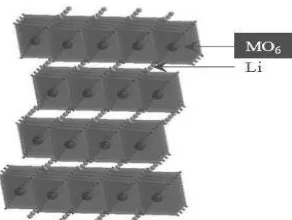
2.4.4 LiNiO2
LiNiO2merupakan material katoda yang memiliki struktur layered. LiNiO2 ini memiliki tingkat toksisitas yang rendah dan lebih murah. Namun, karena ketidakstabilan struktural dari senyawa tersebut sehingga belum dapat dikomersialisasikan sebagai bahan elektroda Li-ion. senyawa stoikiometri sulit didapat karena ion Ni3+ yang tidak stabil. Stabilitas struktural yang buruk saat cycling dengan kandungan litium rendah membuat sistem ini tidak aman. LiNiO2 tidak dapat
digunakan semestinya, namun sebagian substitusi Ni oleh logam transisi lainnya atau logam redoks yang tidak aktif dapat menstabilkan sistem ini (Philippe B, 2013).
Gambar 5. Struktur Oksida Layered LiMO2 (M=Ni, Co)
2.5 KARAKTERISASI DAN PENGUJIAN
Pengkarakterisasian dilakukan pada serbuk material aktif dan baterai. Pada serbuk material aktif dilakukan pengujian X-Ray Diffraction (XRD) dan Fourier
Transform Infra Red (FTIR). Sedangkan pada baterai diuji kemampuan baterai dan
reaksi reduksi-oksidasi yang terjadi dengan pengujian Cyclic Voltammetry (CV) dan
Charge Discharge (CD) untuk melihat kapasitas dari baterai tersebut.
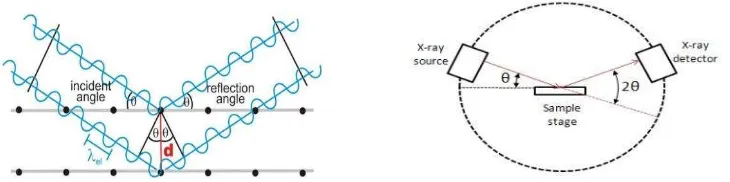
2.5.1X-Ray Difraction (XRD)
pusat hamburan menimbulkan serangkaian gelombang bulat yang merambat di dalam materi.
Gambar 6. (a) Representasi Geometri Menurut Hukum Bragg (b) Instrumentasi Susunan Difraktometer Geometri Bragg-Brentano
(Sumber: Maroni F et al., 2014)
Posisi masing-masing puncak dalam pola difraksi adalah karakteristik dari spesies kimia yang diberikan dan bergantung pada panjang gelombang dari sumber. Instrumental yang beroperasi di θ geometri/2θ ditunjukkan pada Gambar 6. Pola yang dihasilkan analisis difraksi sinar-X (XRD) adalah metode yang efisien untuk menentukan fase yang berbeda dalam sampel. Karena panjang gelombang sinar-X yang digunakan adalah dari urutan yang sama besarnya sebagai jarak antar dan panjang ikatan dalam padatan kristal (~ 1 Å), metode XRD berfungsi dengan baik untuk menentukan struktur bahan kristal. Keuntungan terletak pada kemampuannya untuk memantau perubahan struktural dalam bahan elektroda pada hasil insersi atau deinsersi ion .
Landasan teori difraksi terletak pada Hukum Bragg yang menentukan sudut yang benar diperlukan untuk memiliki difraksi dari serangkaian bidang kristal seperti yang ditunjukkan di bawah ini:
n λ = 2d sinθ (3)
Keterangan :
n = urutan sinar (dalam bilangan bulat) λ = Panjang gelombang radiasi, θ = Sudut radiasi
Struktur kubik material LiMn2O4 parameter kisi (a) dari satu puncak difraksi dapat
ditentukan menurut:
1
=
2+ 2+ 2�2 (4)
d adalah jarak dari bidang kristal dan h, k, l adalah indeks Miller dari refleksi diukur (Eriksson, 2001).
2.5.2 Fourier Transform Infra Red (FTIR)
FTIR Spektroskopi adalah teknik berdasarkan penentuan interaksi antara radiasi IR dan sampel yang dapat berupa padat, cair atau gas. FTIR mengukur frekuensi di mana sampel menyerap dan juga intensitas serapan ini. Frekuensi yang membantu untuk menyusun identifikasi sampel kimia karena fakta bahwa gugus fungsional kimia yang bertanggung jawab untuk penyerapan radiasi pada frekuensi yang berbeda. Konsentrasi komponen dapat ditentukan berdasarkan intensitas penyerapan. Spektrum adalah plot dua dimensi dimana sumbu diwakili oleh intensitas dan frekuensi penyerapan sampel.
Radiasi infra merah dibagi menjadi:
1. Dekat (NIR, ν = 10.000 - 4.000 cm-1); 2. Tengah (MIR, ν = 4.000 - 200 cm-1) 3. Jauh (FIR, ν = 200 - 10 cm-1).
Karena semua senyawa menunjukkan karakteristik absorpsi/emisi di wilayah spektral IR dan berdasarkan ini mereka dapat dianalisis secara kuantitatif dan kualitatif dengan menggunakan spektroskopi FT-IR. Spektrum NIR pada sampel cair rentan terhadap lingkungan (seperti suhu, kelembaban). Spektrometer FT-IR dapat mendeteksi lebih dari seratus senyawa organik volatil (VOC) yang dipancarkan dari sumber-sumber industri dan biogenik. Selain metode FTIR transmisi tradisional (T-FTIR) (misalnya KBr-pelet). Teknik-teknik modern seperti Attenuated Total
Reflection FTIR (ATR-FTIR), dan difusi reflektansi spektroskopi inframerah
2.5.3 Cyclic voltammetry (CV)
Siklik voltametri merupakan teknik yang paling banyak digunakan untuk memperoleh informasi kualitatif tentang reaksi elektrokimia. Identifikasi cepat potensi redoks khas untuk jenis elektroaktif, memberikan informasi yang cukup tentang termodinamika proses redoks, kinetika reaksi transfer elektron heterogen, dan analisis penambahan reaksi elektrokimia atau proses adsorpsi (Brownson, 2013).
Gambar 7. (a) Siklik Potensial Sweep (b) Hasil Siklik Voltamogram (Sumber: Brownson, 2013)
Siklik voltametri dapat digunakan untuk mempelajari kinetika transfer elektron dan sifat transportasi reaksi elektrolisis. Pada jenis reaksi pada potensi yang berbeda dan dengan intensitas yang berbeda, CV memungkinkan beberapa deteksi dalam satu pengukuran (kualitatif) dan perkiraan konsentrasi (kuantitatif) (Alice D, 2011). Hasil siklik voltammetri adalah plot E vs I dimana puncak yang muncul pada potensial tertentu, menunjukkan adanya proses reaksi redoks aktif. Pada Gambar 7. Menujukkan Potensial memanjang dari E1 ke E2 dan ini tingkat yang dicapai adalah voltammetri scan rate (atau gradien garis) biasanya diukur dalam V/s (Brownson, 2013). Saat tegangan mencapai E2 scan dibalik dan memanjang kembali ke E1.
Waktu yang dibutuhkan untuk potensial sweep rentang tegangan scan rate (ν), dihitung dari kemiringan V = f (t) (Lancon, 2011). Plot arus terhadap potensial (tegangan) disebut sebagai 'Siklik Voltamogram' (CV). Siklik Voltamogram digunakan untuk reaksi elektrokimia reversibel menggunakan makroelektoda. Pada gambar diatas Epc dan Epa adalah potensi puncak di katoda dan pada anoda.
2.5.4 Charge-Discharge (CD)
Pengujian sel baterai dilakukan dengan proses charging dan discharging. Untuk mendapatkan performa sebuah baterai maka diperlukan pengujian
charge/discharge sehingga didapatkan kapasitas pada sel baterai. Hal yang
diutamakan dalam menentukan performa sel baterai terletak pada aspek kimia permukaan yang menghasilkan kontak permukaan yang bagus sehingga menjamin proses interkalasi dan deinterkalasi berjalan dengan baik. Kapasitas baterai dimaksudkan sebagai besarnya energi listrik yang dapat dikeluarkan baterai pada waktu tertentu. Kapasitas baterai tergantung pada jenis material aktif yang digunakan dan kecepatan reaksi elektrokimia pada saat baterai di charge atau discharge. Luasnya kontak permukaan antar material aktif juga akan memperbesar kapasitas baterai. (Triwibowo, 2011).
Gambar 8. Kurva Charge-Discharge Baterai Lithium Ion (Sumber: Simpson C, 2011)