BAB 3 METODOLOGI PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan dari tanggal 6 Februari 2017 s.d 28 April 2017 di Pusat Penelitian Fisika-LIPI, Komplek Puspiptek Gd 442 Serpong Tangerang Selatan.
3.2 Bahan dan Peralatan Penelitian 3.2.1 Bahan Penelitian
1. Li2CO3
Fungsi : berfungsi sebagai material aktif (bahan katoda). 2. LiOH.H2O
Fungsi : berfungsi sebagai material aktif (bahan katoda). 3. MnO2
Fungsi : berfungsi sebagai material aktif (bahan katoda). 4. PVDF (Polyvinylidene Fluoride)
Fungsi : sebagai bahan polimer pengikat (Binder).
5. AB (Acetylene Black)
Fungsi : sebagai karbon konduktif. 6. DMAC (N,N-Dimethylacetamide)
Fungsi : sebagai pelarut bahan PVDF. 7. Aseton
Fungsi : untuk membersihkan peralatan penelitian. 8. Al Foil
Fungsi : sebagai current collector dalam lembaran katoda. 9. Separator
Fungsi : untuk mencegah terjadinya kontak/ hubungan singkat antara LiMn2O4 (katoda) dan Metal Lithium (anoda).
10. Metal Lithium
11. LiPF6
Fungsi : sebagai elektrolit dalam pembuatan sel baterai.
3.2.2 Peralatan Penelitian
1. Neraca Digital
Fungsi : untuk mengukur massa dari bahan baku. 2. Beaker Glass
Fungsi : sebagai wadah dalam pembuatan slurry. 3. Spatula
Fungsi : untuk mengambil dan mengaduk bahan. 4. Pipet Tetes
Fungsi : untuk mengambil cairan DMAC. 5. Cawan
Fungsi: sebagai tempat untuk menimbang bahan yang digunakan. 6. Mortar dan pastel
Fungsi : Untuk menumbuk bahan hingga halus. 7. Hot Plate
Fungsi : untuk memanaskan campuran bahan sehingga mampu mempercepat proses homogenisasi.
8. Magnetic Stirer
Fungsi : untuk menghomogenkan campuran bahan dengan pengadukan. 9. Penjepit
Fungsi : untuk menjepit lembaran. 10.Doctor Blade
Fungsi : untuk pelapisan slurry pada Al Foil. 11.Pisau doctor blade
Fungsi : Untuk mengukur ketebalan pengcoatingan. 12.Oven
Fungsi : untuk mengeringkan lembaran LiMn2O4 setelah dicoating. 13.Coin Cell
14.Glove Box
Fungsi : sebagai tempat untuk assembling sel baterai. 15.Multimeter
Fungsi : untuk mengukur tegangan sel baterai pada coin cell. 16.WBCS 3000
Fungsi : untuk uji kapasitas sel baterai
17.XRD (X-Ray Diffraction)
Fungsi : untuk mengetahui fasa dan struktur kristal dari material aktif katoda LiMn2O4
18.FTIR
Fungsi : Untuk mengetahui gugus fungsional yang terbentuk pada lembaran katoda LiMn2O4
3.3 Perhitungan Massa Bahan
Massa bahan untuk sebanyak 5 gram. Sehingga massa bahan utama yang dibutuhkan adalah seperti yang ditunjukkan oleh tabel berikut ini. Perhitungan stokiometri secara lengkap dapat dilihat di lampiran 1.
Tabel 2. Massa bahan baku pembuatan serbuk LiMn2O4
Bahan Baku Massa (gram)
Li2CO3 1,0196
LiOH.H2O 1,1581
MnO2 4,7989
Tabel 3. Perbandingan komposisi bahan pembuatan lembaran LiMn2O4
mpel omposisi (%wt) 4 (gr) (gr)
(gr) C
3.4.1 Proses Pembuatan Serbuk LiMn2O4
3.4.2 Pembuatan lembaran katoda LiMn2O4 Mulai
Li2CO3/LiOH.H2O MnO2
Ditimbang Ditimbang
Dicampur homogen/merata
Digerus
Disintering 800 0C selama 4 jam
Material aktif katoda LiMn2O4
Karakterisasi
FTIR XRD
Analisa Digerus + Diayak
3.5 Prosedur Penelitian
PVDF Material aktif
(LiMn2O4)
DMAC AB
Dicampur homogen/merata
Slurry
Dilakukan coating pada Al foil
Dikeringkan pada suhu 80oC
Assembly sel baterai dengan Coin Cell
Uji CV/CD
Analisa
Kesimpulan
….... Hot Plate T= 700C Rpm = 200 Rpm
Lembaran LiMn2O4
Cutting
3.5.1 Proses Pembuatan Serbuk LiMn2O4
1. Tahap Penimbangan Bahan
Ditimbang semua bahan baku sesuai dengan hasil perhitungan stoikiometri menggunakan neraca digital dengan Li2CO3 = 1,0196 gram, LiOH.H2O = 1,1581 gram dan MnO2 = 4,7989 gram. Bahan yang telah ditimbang tersebut dicampur terlebih dahulu kemudian diaduk dan dilakukan penggerusan.
2. Tahap Sintering
Setelah itu, dilakukan sintering dengan suhu awal 400 oC selama 2 jam kemudian suhu dinaikkan menjadi 800 0C selama 4 jam.
3.5.2 Pembuatan Lembaran Katoda LiMn2O4
1. Tahap Penimbangan Bahan
Bahan material aktif LiMn2O4, PVDF, Acetylene Black ditimbang dengan menggunakan Neraca Digital, sedangkan untuk DMAC diukur dengan beaker glass. Massa bahan LiMn2O4 dibutuhkan sebanyak 1 gram. Massa PVDF dibutuhkan sebanyak 0,1176 gram, massa acetylene black sebanyak 0,0588 gram dan pelarut DMAC sebanyak 4 ml untuk sampel A dan 3 ml untuk sampel B.
2. Tahap Slurry
Pelarut DMAC dimasukkan kedalam Beaker Glass, kemudian dimasukkan magnetic stirrer didalamnya. Diletakkan beaker glass tersebut diatas Hot Plate. Dilakukan pengaturan Hot Plate dengan 200 rpm, dan suhu 70oC. Kemudian ditunggu selama 15 menit kemudian dimasukkan serbuk PVDF dan ditunggu 30 menit hingga tercampur merata. Setelah itu dimasukkan serbuk Acetylene Black perlahan-lahan dengan menggunakan spatula dan ditunggu selama 30 menit hingga serbuk Acetylene Black tersebut tercampur merata dan warnanya menjadi hitam. Kemudian dimasukkan serbuk LiMn2O4 perlahan-lahan menggunakan spatula ditunggu selama 30 menit hingga tercampur merata dan warna yang dihasilkan hitam. Jika pada saat pencampuran serbuk LiMn2O4 terjadi pengentalan, maka dapat dilakukan penambahan pelarut DMAC.
Setelah bahan selesai dibentuk menjadi slurry, maka bahan tersebut siap dibuat menjadi lembaran katoda. Alat yang digunakan yaitu Doctor Blade. Doctor Blade dibersihkan dengan Aseton, lalu kecepatanya diatur dengan range 6 dan presisi celah Doctor Blade diatur dengan ketebalan 0,15 µm. Al Foil dibersihkan menggunakan etanol. Lembaran Al foil diletakkan diatas mesin coating dan tombol vakum dihidupkan. Diletakkan lembaran diatas Doctor Blade dan slurry dituangkan secukupnya. Dengan menggunakan Doctor Blade, slurry diratakan pada lembaran Al foil. Setelah proses coating selesai, lembaran katoda diangkat dan dikeringkan menggunakan oven pada suhu 80oC sampai kering. Dilakukan langkah yang sama untuk ketebalan lembaran katoda LiMn2O4 menggunakan sampel B.
4. Tahap Cutting
Lembaran katoda yang telah terbentuk tersebut digunting membentuk lingkaran dengan ukuran sisinya 14 mm dan separator dipotong dengan ukuran diameter 18 mm.
5. Tahap Assembly
Pada tahapan ini lembaran katoda LiMn2O4 yang sudah disiapkan dalam bentuk coin cell di assembling didalam glove box dengan anoda yaitu metal lithium, elektrolit yaitu LiPF6, dan separator sebagai pemisah antara katoda dan anoda yang berfungsi untuk mencegah agar tidak terjadinya hubungan singkat antara katoda dan anoda. Assembling didalam glove box bertujuan agar semua bahan tidak terkontaminasi dengan udara luar. Kemudian setelah menjadi baterai coin, dilakukan pengujian CV/CD pada baterai.
6. Karakterisasi
BAB 4 HASIL DAN PEMBAHASAN
4.1 Lembaran Katoda LiMn2O4 Variasi Bahan Baku
Pada Gambar 9 dapat dilihat lembaran katoda LiMn2O4 dengan bahan baku sumber lithium yang berbeda, sampel A (dengan sintesis Li2CO3) dan sampel B (dengan sintesis LiOH.H2O). Maka dari hasil yang di dapatkan lembaran katoda LiMn2O4 pada Sampel A dan Sampel B memiliki daya rekat yang baik dapat dilihat dengan tidak rontoknya material aktif dari Al Foil dan tidak terdapat bintik-bintik pori pada lembaran. Pada Gambar 9 tampak bahwa warna lembaran pada sampel B lebih hitam jika dibandingkan dengan sampel A dikarenakan pelarut DMAC yang digunakan pada sampel B lebih sedikit. Pada lembaran katoda sampel A DMAC yang digunakan sebanyak 4 ml sedangkan pada sampel B DMAC yang digunakan lebih sedikit sekitar 3 ml, sehingga slurry pada sampel B lebih pekat dan lembaran yang dihasilkan lebih hitam.
A B
Gambar 9. Hasil Lembaran Katoda LiMn2O4 pada Sampel A (dengan Sintesis Li2CO3) dan B (dengan Sintesis LiOH.H2O)
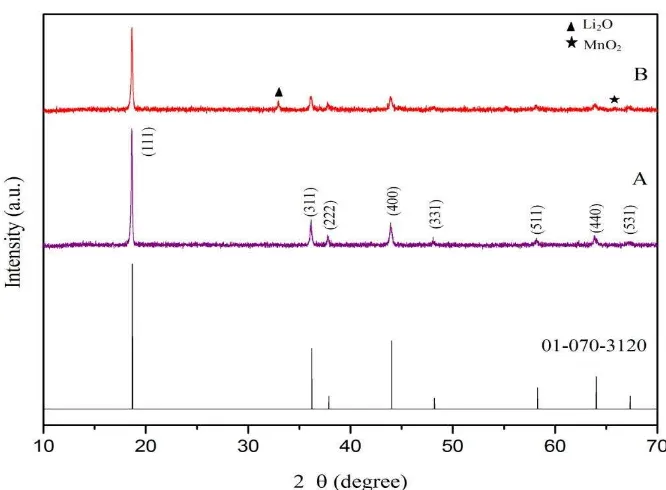
4.2 Analisis Struktur Kristal Serbuk LiMn2O4 Menggunakan XRD
dikumpulkan setiap 4s step with 0,01o dengan range sudut 2θ dari 10o– 70o. Hasil uji semua sampel dicocokkan dengan data ICDD (International Centre Diffraction Database). Identifikasi fasa yang terbentuk dilakukan dengan membandingkan nilai
sudut 2θ hasil pengujian dengan sudut 2θ sampel standar dari data ICDD pada PDF
(Powder Diffraction File) dengan nomor 01-070-3120 yang dapat dilihat pada Gambar 10. Puncak-puncak difraksi yang muncul pada XRD memiliki kesamaan dengan ICCD nomor 01-070-3120 untuk material LiMn2O4. Hasil analisa XRD selengkapnya dapat dilihat pada lampiran.
Pada Gambar 10 memperlihatkan hasil pengolahan XRD material aktif katoda LiMn2O4 dengan variasi bahan baku sumber lithium. Kedua sampel teridentifikasi memiliki struktur Kristal LiMn2O4 dengan puncak tertinggi berada
pada sudut 2θ =18.60o dengan jarak bidang d = 4,76 Å. Data tersebut cocok atau
sesuai dengan data ICDD dengan nomor PDF 01-070-3120. Berdasarkan Gambar 10 dapat dilihat bahwa material aktif katoda LiMn2O4 mempunyai tingkat kristalinitas yang rendah, Hal ini ditunjukkan dengan tingkat intensitas peak yang diperoleh pada masing-masing pola difraksi tidak begitu tajam.
Dari hasil XRD yang ditunjukkan pada Gambar 10 terlihat bahwa Material LiMn2O4 pada sampel A (yang disintesis dengan Li2CO3) telah terbentuk fasa LiMn2O4 tanpa adanya fasa pengotor. Hasil pengamatan XRD material aktif katoda LiMn2O4 pada sampel A menunjukkan bahwa puncak fasa LiMn2O4 terdapat pada sudut 2θ 18,6014o; 36,133o; 37,808o; 43,901o; 48,071o; 58,137o; 63,828o; 67,14o.
Pola difraksi LiMn2O4 pada sampel Bmenunjukkan bahwa fasa LiMn2O4 telah terbentuk namun terdapat fasa pengotor (impurities) yang terdeteksi dalam spektrum XRD. Pada sampel yang B ini ditemukan beberapa puncak difraksi yang bukan merupakan puncak LiMn2O4 yaitu puncak yang berada pada sudut 2θ = 32,93o dengan d = 2,7180 Å merupakan fasa Li2O dan puncak pada sudut 2θ = 65,77o dengan d = 1.4187 merupakan fasa MnO2 (Zhang, 2015). Material katoda LiMn2O4 pada sampel B puncak fasa LiMn2O4 terdapat pada sudut 2θ 18,6047o; 36,077o; 37,720o; 43,858o; 48,17o; 58,12o; 63,82o; 67,16o.
Hasil XRD menunjukkan bahwa sampel A memiliki tingkat kristalinitas yang lebih tinggi jika dibandingkan dengan tingkat kristalinitas LiMn2O4 yang diperoleh pada sampel B. Hal ini dapat ditunjukkan dengan fasa yang terbentuk pada masing-masing sampel dimana fasa yang terbentuk pada sampel A adalah fasa LiMn2O4 murni sedangkan pada sampel B masih ditemukannya fasa selain dari fasa LiMn2O4 yang merupakan impurities (fasa pengotor). Adanya fasa pengotor pada sampel B ini dapat disebabkan karena campuran bahan baku tidak merata dan waktu sintering yang masih singkat. Selain itu juga partikel LiOH.H2O memiliki ukuran partikel yang lebih besar dan tingkat kemurnian yang lebih kecil jika dibandingkan dengan Li2CO3, sehingga tidak bereaksi sempurna dan jika dicampur dengan bahan lain campuran menjadi tidak merata. Sedangkan partikel Li2CO3 memiliki tingkat kemurnian yang lebih besar dan ukuran partikel yang jauh lebih kecil. Hasil XRD pada fasa LiMn2O4 menunjukkan struktur Kristal yang terbentuk adalah kubik dengan Space Group (Fd-3m) dan parameter kisi yaitu 8,244 Å.
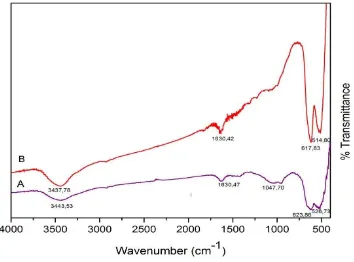
4.3 Pengamatan Gugus Fungsi Menggunakan FTIR
Pusat Penelitian Fisika-LIPI. Proses karakterisasi ini dilakukan untuk mengetahui adanya gugus fungsi yang terdapat dalam sampel yang telah dibuat. Pengujian ini dilakukan dengan metode iTR pada rentang wavenumber dari 400-4000 cm-1. Dari uji spektroskopi FTIR dengan sampel A dan B didapatkan spektrum inframerah seperti yang tampak pada Gambar 11.
Gambar 11. Hasil Analisis Spektrofotometri FTIR pada Sampel A dan B
Pengambilan data wavenumber dilakukan dengan cara membuat sampel dalam bentuk pellet lalu dilakukan proses pencampuran sampel dengan KBr di dalam wadah. Setelah itu, dilanjutkan dengan mengkarakterisasi sampel menggunakan FTIR. Dari uji Spektroskopi FTIR didapatkan spektrum inframerah seperti yang tampak pada Gambar 11.
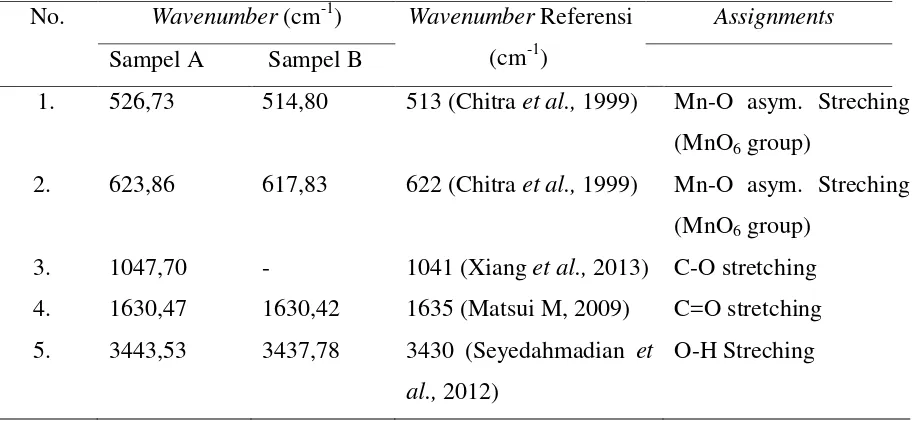
Tabel 4. Akumulasi Data Wavenumber dari Sampel A dan B menggunakan FTIR yang Dicocokkan Berdasarkan literatur
No. Wavenumber (cm-1) Wavenumber Referensi (cm-1)
4.4 Karakterisasi Performa Elektrokimia
Karakterisasi performa elektrokimia dilakukan melalui uji CV (Cyclic Voltammetry) dan uji CD (Charge-Dicharge).
4.4.1 Pengujian CV (Cyclic Voltammetry)
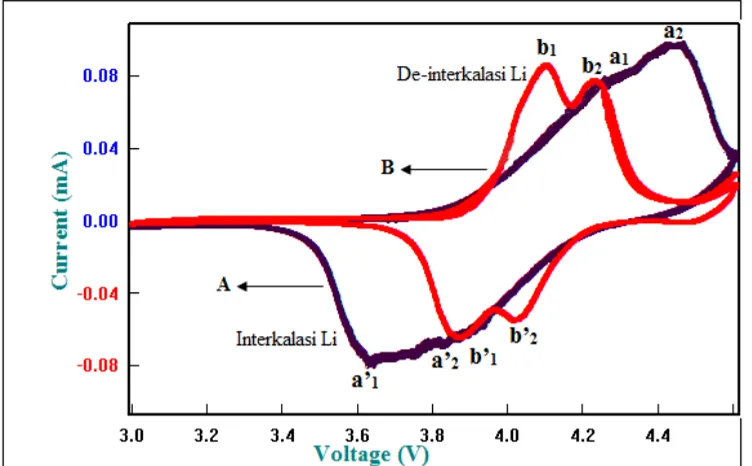
Karakterisasi elektrokomia menggunakan cyclic voltametry menggunakan WBCS 3000, Automatic Battery ver. 3.2 yang dilakukan di pusat Penelitian Fisika-LIPI. Pengujian Cyclyc Voltammetry ini yang bertujuan untuk melihat adanya reaksi oksidasi dan reduksi yang terbentuk pada sampel. Data yang diperoleh berupa grafik voltammogram, yaitu kurva potensial (V) terhadap arus (A). Pengujian ini dilakukan dengan tingkat scan rate 0,01 mV/s dan memiliki rentang potensial 3 V sampai 4,6 V. Gambar 12 menunjukkan kurva voltammogram hasil uji CV material katoda LiMn2O4.
Gambar 12. Grafik Cyclic Voltammetri Katoda LiMn2O4 pada Sampel A dan Sampel B
Puncak-puncak reaksi redoks berkaitan dengan interkalasi dan de-interkalasi ion lithium pada LiMn2O4.
Setiap reaksi redoks memiliki dua puncak oksidasi dan dua puncak reduksi. Reaksi oksidasi ditunjukkan pada puncak yang menghadap keatas sedangkan reaksi reduksi ditunjukkan pada puncak yang menghadap kebawah. Grafik cyclic Voltammetri pada Gambar 12 menunjukkan bahwa sampel B memiliki performa elektrokimia yang lebih baik. Hal ini ditunjukkan dengan adanya dua pasang puncak oksidasi dan reduksi yang lebih tajam dari pada sampel A. Puncak redok yang sempit dan tajam dalam kurva cyclic voltammetri menunjukkan bahwa reaksi elektrokimia pada sampel B berlangsung cepat, sehingga proses interkalasi/deinterkalasi dari Li-ion berlangsung pada tingkat yang lebih cepat. Pada sampel A puncak oksidasi dan reduksi terlihat tidak begitu tajam dan bentuk puncak redok melebar, hal ini mengindikasikan bahwa interkalasi dan deinterkalasi berlangsung lambat. Beberapa parameter yang diperoleh dari Cyclic voltammetry sampel A dan B tercantum dalam Tabel 5.
4.4.2 Pengujian CD (Charge-Discharge)
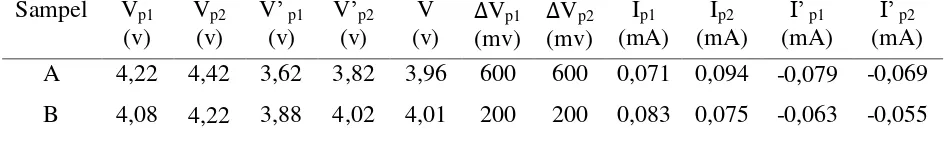
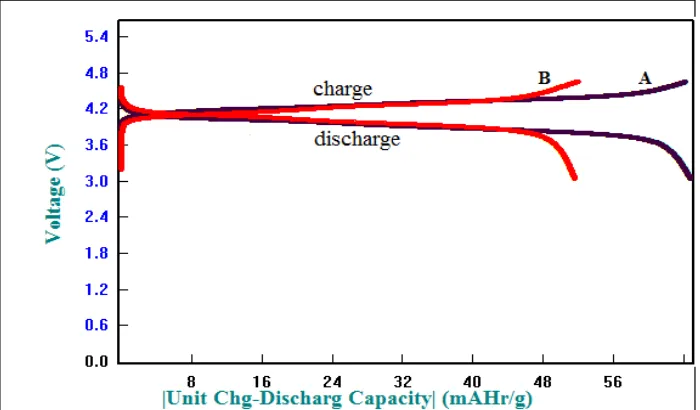
Pengujian charge-discharge dilakukan untuk mengetahui kemampuan sel baterai untuk menyimpan kapasitas energi. Kapasitas energi dinyatakan dalam satuan mAh/gram atau Ah/gram. Pengujian charge-discharge (CD) dilakukan menggunakan alat WBCS 3000. Pengukuran Charge-discharge dilakukan dengan arus konstan sebesar 0,05 mA (0,1 C) dengan rentang potensial 3,3 V- 4,6 V. Dari Pengujian charge/discharge dengan range yang dilakukan pada 1 cycle, satu kali cycle adalah sama dengan satu proses charge (terjadinya reaksi oksidasi,dimana melepaskan ion Li dan elektron ke anoda) dan satu kali discharge (terjadinya reaksi reduksi, dimana ion Li dan elektron masuk ke katoda). Dari pengujian charge-discharge pada lembaran katoda LiMn2O4 didapatkan kurva seperti pada Gambar 13.
Gambar 13. Grafik Charge-Discharge pada sampel A dan sampel B
Tabel 6. Data Analisis charge/discharge pada LiMn2O4
Sampel Kapasitas Spesifik Efisiensi
Coulombic (%) Charge (mAh/g) Discharge (mAh/g)
A (Li2CO3) 65,068 64,78 99,58
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilakukan dapat ditarik kesimpulan sebagai berikut : 1. Telah disintesis serbuk LiMn2O4 dengan Metode Solid State Reaction. Hasil
analisa XRD menunjukkan bahwa katoda LiMn2O4 pada sampel A (dengan sintesis Li2CO3) terbentuk fase LiMn2O4 murni, sedangkan pada hasil analisa XRD untuk katoda LiMn2O4 pada sampel B (dengan sintesis LiOH.H2O) terbentuk fasa LiMn2O4 dan fasa pengotor berupa Li2O dan MnO2. LiMn2O4 yang disintesis dengan Li2CO3 memiliki tingkat kristalinitas yang lebih baik dari pada LiOH.H2O.
2. Pengaruh komposisi bahan baku terhadap karakteristik fisik dari katoda LiMn2O4 yaitu dilihat dari hasil analisa gugus fungsi masing-masing sampel dengan menggunakan FTIR. Hasil FTIR menunjukkan kedua bahan memiliki gugus fungsi yang sama namun sampel A mengalami kemungkinan untuk terdegradasi kembali menjadi Li2CO3 .
3. Dari Data Cyclic Voltammetry menunjukkan bahwa sampel B (dengan sintesis LiOH.H2O) memiliki performa elektrokimia yang lebih baik. Hal ini ditunjukkan dengan adanya pasangan puncak oksidasi dan pasangan puncak reduksi yang diperoleh sampel B lebih tajam dan sempit dari pada sampel A, tetapi sampel A (dengan sintesis Li2CO3) memiliki kapasitas charge-discharge yang lebih tinggi dari pada sampel B dengan kapasitas charge 65,068 mAh/g dan kapasitas discharge 64,78 mAh/g.
5.2Saran
1. Untuk penelitian selanjutnya teknik pembuatan slurry perlu diperhatikan agar campuran bahan lebih homogen dan kualitas yang dihasilkan dapat lebih baik. 2. Untuk mendapatkan fasa LiMn2O4 yang lebih baik, perlu dilakukan penambahan
waktu proses sintering.