BAB 2
TINJAUAN PUSTAKA
2.1 Baterai
Baterai didefenisikan sebagai suatu alat yang dapat mengubah langsung energi kimia menjadi energi listrik melalui proses elektrokimia. Pengertian baterai yang saat ini umum digunakan sesungguhnya mencakup satu atau beberapa sel baterai yang digabungkan secara seri atau paralel sesuai dengan tegangan dan kapasitas listrik yang diinginkan. Sel baterai adalah unit terkecil dari suatu sistem proses elektrokimia yang terdiri dari elektroda, elektrolit, separator, wadah terminal / current collector (Triwibowo, 2011). Listrik yang dihasilkan oleh sebuah baterai muncul akibat adanya perbedaan potensial energi listrik kedua buah elektrodanya. Perbedaan potensial ini dikenal dengan potensial sel atau gaya gerak listrik (ggl).
Komponen terpenting dari sel baterai yaitu:
1. Anoda / Elektroda negatif yaitu elektroda yang melepaskan elektron ke rangkaian luar serta mengalami proses oksidasi pada proses elektrokimia berlangsung.
2. Katoda / Elektroda positif yaitu elektroda yang menerima elektron dari rangkaian luar serta mengalami proses reduksi pada proses elektrokimia berlangsung.
4. Separator adalah material berpori yang diletakkan diantara anoda dan katoda, yang dapat mencegah terjadinya gesekan antara kedua elektroda tersebut yang dapat menyebabkan arus pendek
Gambar 2.1 Struktur sebuah sel baterai (http://files.tested.com/upload/0/5/16904-lithium-ion-separator.gif, diakses tanggal 20 April 2015).
2.2 Sejarah Baterai
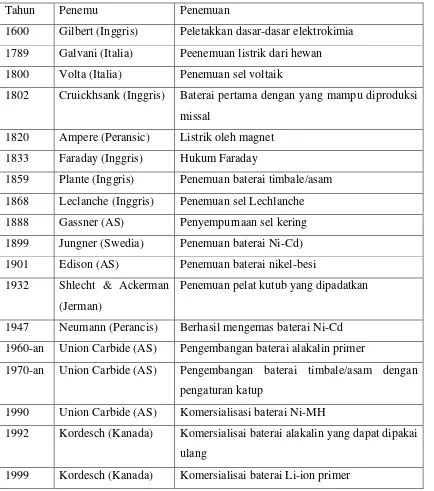
Tabel 2.1 Sejarah perkembangan baterai (Bouwmann, 2002).
Tahun Penemu Penemuan
1600 Gilbert (Inggris) Peletakkan dasar-dasar elektrokimia 1789 Galvani (Italia) Peenemuan listrik dari hewan 1800 Volta (Italia) Penemuan sel voltaik
1802 Cruickhsank (Inggris) Baterai pertama dengan yang mampu diproduksi missal
1820 Ampere (Peransic) Listrik oleh magnet 1833 Faraday (Inggris) Hukum Faraday
1859 Plante (Inggris) Penemuan baterai timbale/asam 1868 Leclanche (Inggris) Penemuan sel Lechlanche 1888 Gassner (AS) Penyempurnaan sel kering 1899 Jungner (Swedia) Penemuan baterai Ni-Cd) 1901 Edison (AS) Penemuan baterai nikel-besi 1932 Shlecht & Ackerman
(Jerman)
Penemuan pelat kutub yang dipadatkan
1947 Neumann (Perancis) Berhasil mengemas baterai Ni-Cd 1960-an Union Carbide (AS) Pengembangan baterai alakalin primer
1970-an Union Carbide (AS) Pengembangan baterai timbale/asam dengan pengaturan katup
1990 Union Carbide (AS) Komersialisasi baterai Ni-MH
1992 Kordesch (Kanada) Komersialisai baterai alakalin yang dapat dipakai ulang
1999 Kordesch (Kanada) Komersialisai baterai Li-ion primer
2.3 Jenis-Jenis Baterai
2.3.1 Baterai Primer
baterai jenis ini adalah baterai seng karbon (baterai kering), baterai alkalin dan baterai merkuri.
Reaksi : xLi + AzBy LixAzBy Discharge
Baterai primer sering disebut dengan baterai kering dan keuntungan yang diperoleh dari penggunaan baterai ini adalah bentuknya yang sederhana, mudah untuk digunakan, densitas energi listriknya besar, tidak memerlukan perawatan, dapat dibuat dalam berbagai bentuk dan ukuran sesuai aplikasinya, memiliki ketahanan yang relatif baik dan memiliki harga yang terjangkau oleh konsumen. Baterai jenis ini banyak digunakan pada kalkulator, jam, remote tv, dan lainnya.
2.3.2 Baterai Sekunder
Baterai sekunder merupakan baterai yang bersifat rechargeable atau dapat dilakukan pengisian energi kembali apabila energi melemah. Kemampuan diisi ulang baterai sekunder bervariasi antara 100-500 kali (satu siklus adalah satu kali pengisian dan pengosongan).
Charge
Reaksi : xLi + AzBy LixAzBy Discharge
Beberapa contoh baterai sekunder adalah baterai timbal-asam (aki), baterai litium-ion, baterai Ni-Cd, baterai Ni-MH. Baterai sekunder ini banyak digunakan pada peralatan elektronik seperti handphone, laptop, handycam, power bank, dan lain-lain.
2.4 Bentuk-Bentuk Baterai Sekunder
tekanan dari luar, benda tajam dan pemuntiran. Oleh karenanya, penggabungan jenis baterai ini tidak dapat dilakukan dengan menumpuknya, tapi meletakkannya berdampingan. Walaupun baterai ini banyak diaplikasikan, namun belum ada data-data kehandalan baterai ini. Standarisai mengenai baterai ini juga belum ada (Triwibowo, 2011).
Gambar 2.2 Baterai kantung yang simple, fleksibel dan ringan. Kapasitas listriknya dibawah baterai konvensional lain, disamping biaya produksinya terbilang mahal.
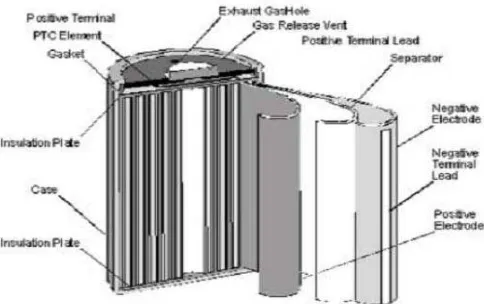
2. Baterai silinder. Jenis baterai ini paling banyak ditemui. Desain berbentuk silinder mudah dalam pembuatannya, disamping itu memiliki stabilitas mekanik yang baik. Saat charging, baterai akan menghasilkan gas yang memberikan tekanan dalam silinder, untuk itu baterai silinder dilengkapi pula dengan ventilasi. Kerugian dari desain ini adalah bentuknya yang tidak ringkas saat beberapa silinder digabungkan, yaitu akan terbentuk ruangan kosong diantaranya. Kapasitas listrik yang dikandung baterai ini berkisar antara 1800-2000mAh (Triwibowo, 2011).
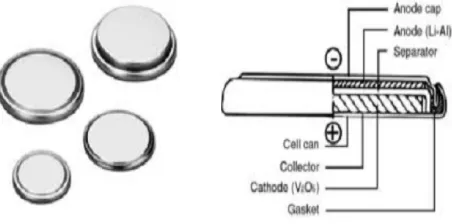
3. Baterai Kancing. Baterai yang sering disebut baterai koin memiliki ukuran terkecil dibanding baterai lain. Disebabkan ukurannya, jenis ini tidak memiliki masalah dengan ruang yang tersedia. Karena bentuknya yang miniatur, baterai ini tidak dilengkapi dengan ventilasi. Sementara proses charging yang cepat akan membuat baterai menggelembuing. Untuk menghindari keadaan ini, baterai kancing hanya dapat di charge dengan kecepatan yang rendah. Pengsisin baterai jenis ini dapat memakan waktu 10-16 jam (Triwibowo, 2011).
Gambar 2.4 Baterai sekunder berbentuk kancing tidak dilengkapi ventilasi. Kecepatan pengisian/charging sangat rendah untuk mencegah terjadinya swelling dan tekanan.
4. Baterai Perismatik. Baterai ini memaksimalkan penggunaan ruang yang ada dalam suatu perangkat elektrik. Oleh karenanya baterai jenis ini tidak memiliki ukuran yang standard. Ukuiran senantiasa disesuaikan dengan ruang yang ada. Kapasitas listrik baterai ini umumnya dibawah baterai silinder, yaitu 400-2000mAh.
(Triwibowo, 2011).
Gambar 2.5 Penampang baterai prismatik yang lebih fleksibel dalam segi ukuran. Densitas energi lebih rendah dan biaya pembuatannya lebih mahal dari baterai
2.5 Baterai Lithium
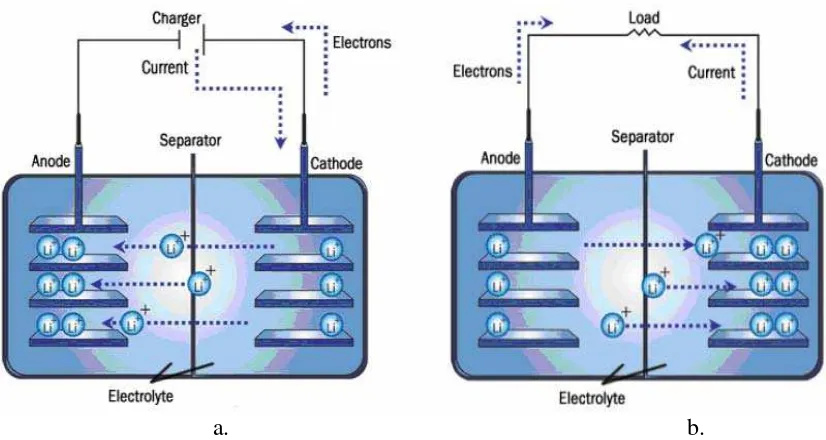
Baterai lithium secara teori adalah baterai yang digerakkan oleh ion lithium. Dalam kondisi charge dan discharge baterai lithium bekerja menurut fenomena interkalasi, dimana ion lithium melakukan migrasi dari katoda lewat elektrolit ke anoda. Baterai ion lithium umumnya dijumpai pada barang-barang elektronik. Baterai ini merupakan jenis baterai isi ulang yang paling popular untuk peralatan elektronik portabel, karena memiliki salah satu kepadatan energi terbaik, tanpa efek memori, dan mengalami kehilangan isi yang lambat saat tidak digunakan. Selain digunakan pada peralatan elektronik konsumen, baterai lithium juga sering digunakan pada kendaraan listrik. Prinsip kerja baterai lithium yang dapat diisi ulang dapat dilihat pada gambar 2.6.
a. b.
Gambar 2.6 Prinsip kerja baterai litium yang dapat diisi ulang a) Proses Charging; b) Proses Discharging (Priyono, 2013).
dari anoda ke katoda melalui elektrolit, elektron mengalir dari anoda ke katoda dan arus mengalir dari katoda ke anoda. Reaksi kimia dari proses charging dan discharging dapat dituliskan sebagai berikut:
Reaksi kimia pada proses charging:
Elektroda positif (+) : LiMnyOz nLi+1 + Lix-nMnyOz + ne
Sel baterai litium mempunyai tiga komponen penting yaitu katoda, anoda, dan elektrolit. Baterai litium bekerja menurut fenomena interkalasi, dimana litium ion yang bergerak sebagai penghantar dapat melakukan migrasi (perpindahan) dari katoda melewati elektrolit ke anoda tanpa terjadi perubahan struktur kristal dari bahan katoda ke anoda.
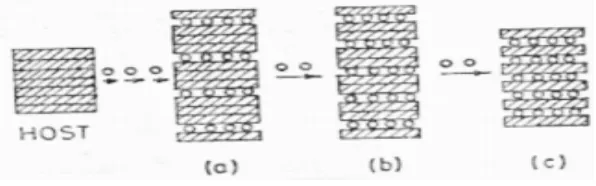
Interkalasi merupakan proses pelepasan ion lithium dari tempatnya di struktur kristal suatu bahan elektroda dan pemasukan ion lithium pada tempatnya di struktur kirstal bahan elektroda yang lain. Proses terjadinya interkalasi dapat digambarkan dalam Gambar 2.7.
Gambar 2.7 Proses interkalasi dalam beberapa fase
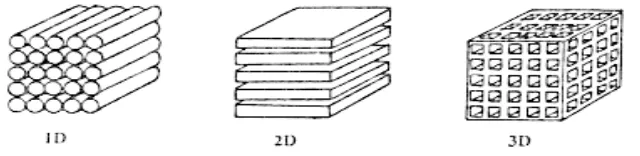
perpindahan ion lithium yang sering disebut host. Oleh karena itu bahan elektroda harus mempunyai struktur host. Pada umumnya bahan mempunyai tiga kategori/ model dalam melakukan interkalasi yang bergantung pada bentuk host strukturnya, yaitu interkalasi dalam satu dimensi, dua dimensi dan tiga dimensi, seperti tergambar di Gambar 2.8. Lithium mangan oksida mempunyai host interkalasi dalam tiga dimensi (Prihandoko, 2008).
Gambar 2.8 Tiga model host dari bahan katoda dan anoda
2.7 Material Katoda
Material katoda harus memenuhi karakter sebagai bahan yang mempunyai host agar proses interkalasi bias berlangsung dengan baik. Ada banyak bahan katoda yang sudah diteliti. Baterai lithium rechargeable di pasaran menggunakan bahan katoda anatara lain dari jenis lithium nikel oksida, lithium kobalt oksida, dan lithium mangan oksida.
Adapun perbandingan antara bahan penyusun sebuah katoda baterai dilihat dari asspek ekologi dan ekonomi dapat dilihat dibawah ini.
Katoda: - Mn2O4 - NiO
(spinel) Murah, tidak beracun, rapat energi tinggi 2
- CoO
(layered) Mahal, beracun, rapat energi rendah 2
- Rutile (layered) Murah, tidak beracun, rapat energi rendah (layered) Mahal, beracun, rapat energi rendah
- Anatase (layered) Murah, tidak beracun, rapat energi rendah - V2O5
Bahan mangan oksida (Mn (layered) Beracun
lingkungan, serta rapat energi yang tinggi. Selain itu lithium mangan oksida mempunyai host dalam tiga dimensi, sehingga arah kristal yang bersinggungan antar butir tidak banyak mempengaruhi (Najmuddin, 2005).
2.8 Metalik Lithium
Metalik Lithium merupakan bahan anoda yang ideal untuk baterai isi ulang karena memiliki kemurnian tinggi. Metalik lithium memiliki kapasitas teoritis yang tinggi yaitu sebesar 3860 mAhg-1 yang sepuluh kali lebih besar dibandingkan dengan kapasitas teoritis anoda grafit sebesar 372 mAh g- 1 yang digunakan dalam baterai Li-ion. Metalik lithium sangat reaktif terhadap air dan udara.
Gambar 2.9 Bentuk dari Metalik Lithium Tabel 2.2 Sifat fisis dari metalik lithium.
Penampilan Logam lunak padat putih-keperakan
Rumus molekul Li
Berat molekul 6,941
Nomor atom 3
Titik cair 180,5oC
Titik didih 1317 oC
Suhu nyala 179 oC
Densitas (g/cc) m%20Metal%20Safety%20version%202.pdf, diakses tanggal 20 April 2015).
2.9 Elektrolit LiPF
Salah satu jenis elektrolit adalah elektrolit cair. Sesuai dengan namanya elektrolit ini berbentuk cairan, dan pada umumnya mengandung Lithium Hexafluorophosphate (LiPF6) 1.0~1.2 M (mol/L). Untuk melarutkan LiPF
6
6 diperlukan zat pelarut organik yang umumnya terdiri atas campuran senyawa karbonat. Syarat-syarat zat pelarut organik ini agar bisa dipakai pada baterai litium ion adalah memiliki konduktivitas tinggi, dan viskositas yang rendah sehingga ion litium bisa berpindah dengan mudah, dapat digunakan pada suhu -30~80 C, tidak mudah terbakar, dan tidak berbahaya. LiPF6 banyak digunakan pada baterai ion Lithium. Hexafluorophosphate Lithium (LiPF6) memiliki kombinasi sifat yang seimbang seperti konduktivitas ionik yang tinggi, disosiasi yang baik, dan mobilitas ion yang baik. Namun kelemahan utama dari LiPF6
Tabel 2.3 Sifat Fisik dan Kimia.
adalah sifatnya yang sangat peka terhadap lembab, ketika bereaksi dengan air akan membentuk asam fluorida yang memiliki efek merugikan pada kinerja sel baterai.
Penampilan cairan tidak berwarna
Bau bau amina sedikit
Titik didih 90-248oC
Titik leleh <20oC
Densitas (air): 1.16-1.45g / cm3 Tekanan uap (mmHg): 8mmHg (20oC)
Kelarutan larut dalam alkohol, keton, ester, air.
2.10 Separator
Separator adalah material berpori yang diletakkan diantara anoda dan katoda, yang dapat mencegah terjadinya gesekan antara kedua elektroda tersebut yang dapat menyebabkan arus pendek. Selain itu separator harus dapat dilewati oleh ion lithium dengan baik. Tidak hanya sebagai pembatas antar elektroda, separator memiliki peranan penting dalam proses penghasilan listrik, pengisian ulang, dan tentunya keamanan pada baterai litium ion sendiri.
Separator harus stabil pada kerja baterai untuk jangka waktu yang panjang dan tidak menghasilkan kotoran yang dapat mengganggu fungsi baterai. Separator yang ideal mempunyai resistansi ion yang rendah dapat diperoleh dengan nilai porositas yang tinggi. Sejauh ini separator yang digunakan pada baterai ion lithium terdiri dari membran polimer yang membentuk lapisan microporous. Meskipun separator umumnya telah menunjukkan kinerja yang memuaskan tetapi masih terdapat kekurangan karena separator mudah terbakar cairan elektrolit organik.
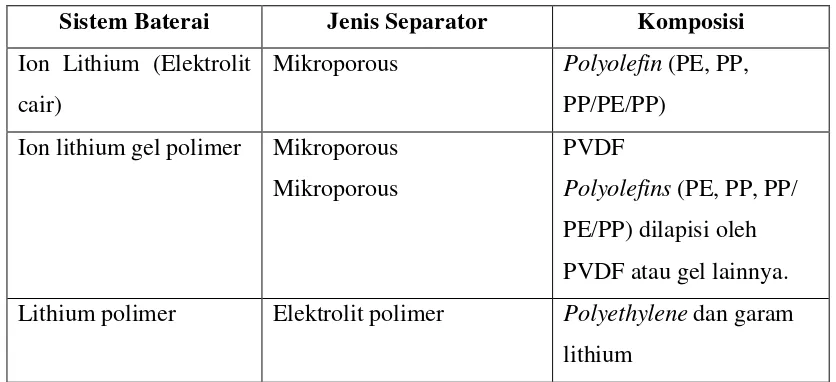
Tabel 2.4 Jenis separator (pemisah) yang digunakan dalam berbagai jenis baterai lithium sekunder.
Jenis separator yang biasa digunakan dalam berbagai jenis baterai lithium sekunder dapat dilihat pada Tabel 2.4 berikut;
Sistem Baterai Jenis Separator Komposisi
Ion Lithium (Elektrolit cair)
Mikroporous Polyolefin (PE, PP, PP/PE/PP)
Ion lithium gel polimer Mikroporous Mikroporous
PVDF
Polyolefins (PE, PP, PP/ PE/PP) dilapisi oleh PVDF atau gel lainnya. Lithium polimer Elektrolit polimer Polyethylene dan garam
lithium
Polyolefin sangat umum digunakan sebagai bahan separator, khususnya pada laptop dan hp, karena tipis dan memiliki kestabilan elektrokimia yang baik. Polyolefin sendiri terdiri atas perpaduan antara polypropylene (sbg penyangga utama, backbone) dan polyethylene sebagai pelapis pada lubang/pori-pori. Polyethylene memiliki sifat meleleh pada suhu diatas 120-130 o
Sisi negatifnya karena sifat diatas, polyolefin sulit digunakan pada baterai litium ion untuk mobil. Karena ukuran baterai mobil yang besar, memungkinkan terjadinya perubahan suhu yang tinggi secara drastis. Untuk mengatasi masalah tersebut, dilakukan pelapisan Al
C. Apabila panas yang dihasilkan didalam baterai melewati ambang batas, polyethylene akan melelah dan menutup lubang pada separator, mengakibatkan proses perpindahan lithium ion berhenti. Sehingga separator memiliki fungsi utama dalam hal keamanan bila terjadi panas berlebihan.
2O3 atau material keramik lainnya, pada permukaan separator. Sehingga walapun pada suhu tinggi, bentuk dari separator dapat terjaga bagian-2/).
2.11 Lithium Mangan Oksida (LiMn2O4
Lithium mangan oksida merupakan bahan katoda yang cukup populer pada baterai lithium. Lithium mangan oksida mempunyai struktur spinel dengan kemampuan interkalasi tiga dimensi. Hal ini menyebabkan bahan katoda ini mampu disisipi ion lithium dalam tiga arah. Baterai lithium merupakan baterai yang berbasis ion dengan ion lithium sebagai motor penggerak (Kiehne, 1998).
)
yang cukup stabil dalam proses interkalasi. Sebagaimana diketahui bahwa LixMn2O4 mempunyai struktur spinel yang tergambar di Gambar 2.10 (Prihandoko, 2007).
Keterangan:
Tabel 2.5 Sifat Bahan Baku LiMn
4
2O4 Bahan Baku
(Wigayati,2007). LiMn2O4
Kandungan Kristal atau serbuk hitam; larut pada hydrochloric acid; tidak larut pada air. Sp. Gr. 5.026; titik cair 535oC.
Resiko Dapat membakar bahan organik; tidak mengandung racun Kegunaan Untuk bahan baterai kering; katalis
2.12 Super P
Super P adalah karbon hitam konduktif yang digunakan sebagai aditif konduktif untuk Zinc-carbon dan lithium baterai primer masing-masing. Super P memiliki kemurnian yang tinggi. Kemurnian tinggi ini dibuktikan dengan abu yang rendah, kelembaban, belerang dan kandungan yang mudah menguap, sedangkan struktur tinggi diungkapkan oleh penyerapan minyak dan konduktivitas listrik. Ini adalah aditif konduktif dengan kinerja yang unggul, kemurnian tinggi dan penyerapan
elektrolit optimal. Pengaruh Super P terhadap kesehatan apabila terkena mata dan kulit dapat menyebabkan iritasi, dan apabila terhirup dapat menyebabkan iritasi saluran pernafasan.
2.13 Polyvynilidene Flouride (PVDF)
Binder adalah bagian penting dari formulasi elektroda pada baterai ion lithium karena binder mempertahankan struktrur fisik elektroda, tanpa binder elektroda akan berantakan. Sangat diharapkan bahwa binder memiliki titik leleh yang tinggi, dan struktur komposit dari material aktif dan binder harus stabil di dalam elektrolit, bahkan di suhu tinggi. Potensi kelemahan dari binder yaitu binder mungkin saja melapisi permukaan material aktif. PVDF ini berwarna putih dan tidak larut dalam air. Polimer ini banyak digunakan dalam aplikasi yang membutuhkan kemurnian, kekuatan, dan ketahanan terhadap bahan pelarut, asam, basa, dan panas yang sangat baik.
PVDF memiliki sifat pizoelektrik, yaitu sifat dari beberapa material dimana material tersebut dapat menimbulkan potensial listrik sebagai respon dari beban mekanis yang diterimanya. PVDF memiliki nilai koefisien pizoelektrik sebesar 6-7 pCN-1, 10 kali lebih besar dibandingkan dengan polimer jenis lain. (Abdillah, 2008). Struktur molekul PVDF memiliki rumus CH2 - CF2.
Gambar 2.11 Struktur Polyvynilidene Flouride (Tareev, 1975). Tabel 2.6 Sifat umum Polyvinylidene Fluoride (Abdillah, 2008).
Sifat Nilai
Modulus Elastisitas 1380-55200 MPa
Elongasi 12 %-600%
Kekuaatan Fleksural 67-95 MPa
Modulus Fleksural 1173-82800 Mpa
Temperatur Transisi Gelas (Tg) -60 − -20oC Temperatur Leleh (Tm) 141-178oC
Shrinkage 0,02-0,035 cm/cm
2.14 N-N Dimetil acetamide (DMAC)
N-N Dimetil acetamide (DMAC) merupakan pelarut industry yang kuat dan serbaguna yang memiliki kelarutan terhadap bahan organic dan anorganik. DMAC diproduksi secara terbatas karena tidak dimaksudkan untuk digunakan oleh masyarakat umum. DMAC adalah cairan yang tidak berwarna dan dapat larut dengan air. Karakteristik dari DMAC yaitu memiliki berat molekul 87,12, kerapatannya 0,945 mg/cm3, titik didih tinggi yaitu 164 – 166 oC, titik beku yang rendah yaitu -20 o
C, dan stabilitas yang baik.
Gambar 2.12 Struktur molekul N-N dimetil acetamide (DMAC)
Pengaruh DMAC apabila terkena mata dan kulit dapat menyebabkan iritasi, apabila terhirup dapat menyebabkan iritasi saluran pernafasan, dan jika tertelan dapat menyebabkan mual, muntah dan diare sehingga saat menggunakan DMAC haruslah menggunakan masker dan sarung tangan sebagai alat pelindung diri.
Tabel 2.7 Sifat umum N-N-Dimethylacetamide
Sifat Keterangan
Berat molekul 87,12
Titik beku -20 ° C
Kerapatan 0,945 mg/cm
Sumber: (N-N-Dimethylacetamide, MSDS No. 96035 [online], ACROS ORGANICS, Canada.TDG).
2.15 XRD (X-Ray Diffraction)
XRD merupakan alat yang diguanakan untuk mengkarakterisasi struktur kristal, ukuran kristal dari suatu bahan padat. Semua bahan yang mengandung kristal tertentu ketika dianalisa menggunakan XRD akan memunculkan puncak-puncak yang spesifik. Sehingga kelemahan alat ini tidak dapat untuk mengkarakterisasi bahan yang bersifat amorf.
Metode difraksi umumnya digunakan untuk mengidentifikasi senyawaa yang belum diketahui yang terkandung dalam suatu padatan dengan cara membandingkan dengan data difraksi dengan database yang dikeluarkan oleh International Centre for Diffraction Data berupa PDF (Powder Diffraction File). Pengamatan struktur kristal dengan XRD dilakukan sebagai tahap awal karakterisasi untuk mengidentifikasi sejauh mana fasa yang terbentuk seperti yang diinginkan dan fasa lainnya yang tidak diharapkan .
gelombang dan frekuensi yang sama dengan sinar datang, yang disebut koheren satu sama lain. Gejala penghamburan atau difraksi ini yang akan direkam Fabrikasi dan karakterisasi sebagai identifikasi yang terkait dengan struktur kristal. Gambar 3.3 menunjukkan prinsip dasar XRD.
Gambar 2.13 Pola difraksi sinar-X yang terhambur oleh kisi dalam bidang kristal Penghamburan sinar ini mengikuti hukum bragg yang memenuhi persamaan berikut : nλ = 2d sinθ (2.1) Struktur kristal dalam material berfasa tunggal atau lebih akan memiliki pola XRD yang unik. Pola-pola XRD ini tersimpan dalam kumpulan data JCPDS/ICDD yang dapat digunakan sebagai data pencocokan puncak-puncak 2θ dan intensitas dari data XRD sampel yang diuji (Subhan, 2011).
2.16 SEM (Scanning Electron Microscope)–EDS
SEM (Scanning Electron Microscope) adalah sebuah mikroskop elektron yang didesain untuk mengamati permukaan objek solid secara langsung. SEM memiliki perbesaran 10-3.000.000 kali, depth of field 4-0,4 mm dan resolusi sebesar 1-10 nm.
memproduksi suatu citra dengan kedalaman medan yang besar dan penampakan yang hamper tiga dimensi. Dalam penelitian morfologi permukaan SEM terbatas pemakaiannya, tetapi memberikan informasi yang bermanfaat mengenai topologi permukaan dengan resolusi sekitar 100 �̇.
Gambar 2.14 Contoh sebuah alat SEM
Gambar 2.15 Interaksi antara elektron primer dengan permukaan sampel
Hamburan terbagi menjadi dua jenis yaitu hamburan elstis dan non elastis. Hamburan elastik dihasilkan dari tumbukan berkas elektron dengan inti atom sampel tanpa terjadi perubahan energi. Gejala ini disebut juga Back Scattered Electron (BSE). Kebalikannya dengan BSE, hamburannya non elastis ditimbulkan dari berkas elektron yang dipancarkan oleh penembak elektron menumbuk elektron sampel hingga terjadi perpindahan energi dari elektron asal ke elektron sampel yang lebih rendah. Sinyal yang dihasilkan berupa energi dapat digunakan untuk analisis mikro. Sinyal-sinyal ini adalah elektron sekunder, elektron Auger dan sinar-X karakteristik.
Elektron sekunder adalah elektron yang dipancarkan dari sampel akibat interaksi berkas elektron asal/primer dengan elektron pada pita penghantar benda uji. Interaksi ini menghasilkan perpindahan energi yang rendah ke elektron penghantar. Elektron sekunder dengan energi rendah ini dapat dibelokan membentuk sudut dan menimbulkan bayangan topografi atau struktur permukaan. Pada waktu elektron primer memenuhi permukaan sampel, akan menghasilkan elektron sekunder dari suatu area scan dalam bentuk informasi/bayangan.
secara kualitatif maupun kuantitatif. Untuk menentukan komposisi unsur suatu permukaan sampel diperlukan integrasi dengan SEM, alat ini disebut EDX (Energy Dispersive X-ray Spectroscopy) (Triwobowo, 2011).
2.17 Mikroskop Optik
Cara kerja dari mikroskop optik adalah dari cahaya lampu yang dibiaskan oleh lensa kondenser, setelah melewati lensa kondenser sinar mengenai spesimen dan diteruskan oleh lensa objektif. Lensa objektif ini merupakan bagian yang paling penting dari mikroskop karena dari lensa ini dapat diketahui perbesaran yang dilakukan mikroskop. Sinar yang diteruskan oleh lensa objektif ditangkap oleh lensa okuler dan diteruskan pada mata atau kamera.
Mikroskop optik mempunyai bagian-bagian seperti bagan dibawah ini:
(a) (b)
Gambar 2.16 a) Skema Mikroskop Optik, b) Contoh mikroskop optik
2.18 Charge Discharge Baterai Lithium-Ion
sumber tegangan. Besar beban/arus yang dialirkan pada baterai coin cell sebesar 0,005 mA dan range potensialnya sebesar 3,5-4 V. Gambar 3.1 menunjukkan profil I-V pengisian baterai lithium ion rechargeable.
Gambar 2.17 Profil tegangan yang harus dipenuhi selama mengisi ulang sebuah baterai lithium
Gambar 2.18 Gambaran skema konfigurasi elektronik pengujian karakterisasi charge/discharge sel baterai
Pengaturan waktu T1 dilakukan untuk waktu charging, T2 untuk mengatur waktu discharging dan T untuk mengatur waktu jeda antara charging dan discharging. Pengaturan T diperlukan untuk mengamati tegangan baterai Vocv. Data pengukuran dapat direkam setiap 50-500 ms. (Subhan, 2011). Perhitungan kapasitas dilakukan dengan program excel sederhana. Data pengamatan yang dihasilkan adalah rekaman waktu (t / ms ), arus (i / mA ), tegangan ( V / volt). Dari setiap data waktu (t), arus (i), dan tegangan (v) dapat dihitung nilai kapasitas sel baterai. Kapasitas merupakan jumlah total dari perkalian arus (i) dan waktu (s), memenuhi . persamaan berikut : �� = ∑ ∆��� �.�� ; dengan, j = detik ke−1,2,3, … , terakhir (2.2) Dan kapasitas total dihitung berdasarkan persamaan: