LAMPIRAN 1
DATA PERCOBAAN
L1.1 DATA RENDEMEN VCO
Dari hasil percobaan diperoleh data rendemen VCO sebagai
berikut:
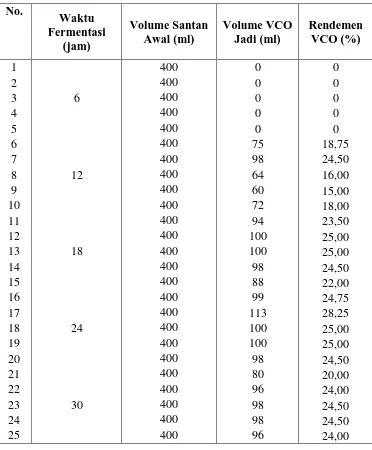
Tabel L1.1. Data Rendemen VCO
No. Run Waktu Fermentasi (jam) Konsentrasi Inkokulum (%) Volume VCO (ml) rendemen VCO (%) 1 6
5 0 0
2 10 0 0
3 15 0 0
4 20 0 0
5 25 0 0
6
12
5 75 18,75
7 10 98 24,50
8 15 64 16,00
9 20 60 15,00
10 25 72 18,00
11
18
5 94 23,50
12 10 100 25,00
13 15 100 25,00
14 20 98 24,50
15 25 88 22,00
16
24
5 99 24,75
17 10 113 28,25
18 15 100 25,00
19 20 100 25,00
20 25 98 24,50
21
30
5 80 20,00
22 10 96 24,00
23 15 98 24,50
24 20 98 24,50
25 25 96 24,00
Pada Tabel L1.1 di atas terlihat besar rendemen virgin coconut oil (VCO) dari 25 run, yang dinyatakan dalam satuan %. Besar rendemen VCO didapat
volume bahan baku yaitu santan kelapa (yang volumenya 400 ml). Metode
perhitungannya dapat dilihat pada Lampiran 3.
L1.2 DATA KARAKTERISTIK VIRGIN COCONUT OIL (VCO)
Dari hasil percobaan diperoleh data karakteristik virgin coconut oil
(VCO) sebagai berikut dimana untuk analisa GC, bilangan peroksida, bilangan iod
dan densitas hanya dilakukan pada rendemen VCO tertinggi yaitu pada perlakuan
penambahan inokulum 10% dan 24 jam waktu fermentasi dan terendah pada
penambahan 20% konsentrasi inokulum dengan waktu fermentasi 12 jam seperti
terlihat pada tabel berikut:
Tabel L1.2 Data Kadar VCO
No. Parameter Perlakuan
10%, 24 jam 20%, 12 jam
1. C6:0 (Asam kaproat) 0,498 0,4416
2. C8:0 (Asam Kaprilat) 6,8894 6,7989
3. C10:0 (Asam kaprat) 5,6473 5,9592
4. C12:0 (Asam laurat) 48,3486 50,0801
5. C14:0 (Asam miristat) 18,9536 18,7669
6. C16:0 (Asam palmitat) 9,2637 8,5946
7. C18:0 (Asam stearat) 3,0187 2,7486
8. C18:1 (Asam oleat) 6,0549 5,4159
9. C18:2 (Asam linoleat) 1,2298 1,1339
10. C20:0 (Asam arachidrat) 0,0657 0,0602
11. C20:1 0,0303 -
12. Iodine value 9,2406 8,8441
13. Free fatty Acid (%) 0,25 0,21
14. Peroxide value, meq/kg oil 0,4 1
15. Densitas 0,9061 0,9239.
Pada Tabel L1.2 di atas terlihat data kandungan virgin coconut oil
(VCO) dari dua perlakuan yang dianalisa. Besarnya nilai (angka) dari beberapa
analisa dari rendemen VCO yang dihasilkan. Metode perhitungan lengkapnya
LAMPIRAN 2
HASIL ANALISA
L2.1 HASIL ANALISA Virgin Coconut Oil (VCO)
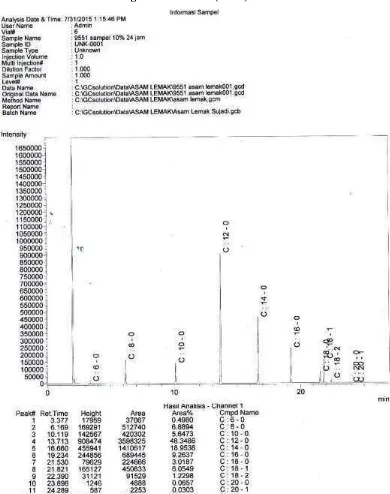
Gambar L2.1 Hasil Analisa Gas Kromatografi pada Perlakuan Penambahan
Pada gambar L2.1 di atas terlihat grafik analisa gas kromatografi dimana
kandungan asam lemak tertinggi pada VCO ialah asam laurat (C:12) yaitu sebesar
48,3486%.
Gambar L2.2 Hasil Analisa Gas Kromatografi pada Perlakuan Penambahan
Inokulum 20% dan Waktu Fermentasi 12 Jam
Pada gambar L2.2 yaitu perlakuan penambahan inokulum 20% dengan
waktu fermentasi 12 jam terlihat kandungan asam lemak tertinggi pada VCO
LAMPIRAN 3
CONTOH PERHITUNGAN
L3.1 PERHITUNGAN BAHAN BAKU Volume santan : 400 ml
Untuk perlakuan run 1 : 5% penambahan inokulum (v/v)
Maka volume inokulum yang ditambahkan: 5
100x 400 ml = 20 ml
Berikut Tabel L3.1 yang menunjukkan volume inokulum yang ditambahkan ke
dalam 400 ml santan, yang diperoleh dari perhitungan.
Tabel L3.1 Volume Inokulum yang Ditambahkan Untuk Semua Run
No. Run konsentrasi inokulum (%)
volume santan (ml)
volume inokulum yang ditambahkan (ml)
1 5 400 20
2 10 400 40
3 15 400 60
4 20 400 80
5 25 400 100
6 5 400 20
7 10 400 40
8 15 400 60
9 20 400 80
10 25 400 100
11 5 400 20
12 10 400 40
13 15 400 60
14 20 400 80
15 25 400 100
16 5 400 20
17 10 400 40
18 15 400 60
19 20 400 80
20 25 400 100
21 5 400 20
22 10 400 40
23 15 400 60
24 20 400 80
L3.2 PERHITUNGAN RENDEMEN VIRGIN COCONUT OIL (VCO)
Perhitungan rendemen dilakukan dengan cara membandingkan antara volume
produk yang dihasilkan dengan volume bahan baku awal, dengan rumus :
Rendemen = volume VCO jadi
volume santan awalx 100%
Misal, untuk Run 6 diperoleh volume VCO (produk jadi) sebesar 75 ml dari
volume awal 400 ml santan kelapa, maka perhitungannya adalah :
Rendemen = 75
400x 100%
Rendemen = 18,75 %
Tabel L3.2 menunjukkan hasil perhitungan rendemen untuk seluruh 25 run :
No. Waktu Fermentasi (jam) Volume Santan Awal (ml) Volume VCO Jadi (ml) Rendemen VCO (%) 1 6
400 0 0
2 400 0 0
3 400 0 0
4 400 0 0
5 400 0 0
6
12
400 75 18,75
7 400 98 24,50
8 400 64 16,00
9 400 60 15,00
10 400 72 18,00
11
18
400 94 23,50
12 400 100 25,00
13 400 100 25,00
14 400 98 24,50
15 400 88 22,00
16
24
400 99 24,75
17 400 113 28,25
18 400 100 25,00
19 400 100 25,00
20 400 98 24,50
21
30
400 80 20,00
22 400 96 24,00
23 400 98 24,50
24 400 98 24,50
L3.3 PERHITUNGAN ANALISA VIRGIN COCONUT OIL (VCO)
Analisa data yang dilakukan antara lain analisa bilangan peroksida,
analisa bilangan iodin, analisa FFA dan analisa densitas dimana pada penelitian
ini analisa hanya dilakukan pada rendemen VCO tertinggi yaitu pada perlakuan
penambahan inokulum 10%, 24 jam waktu fermentasi dan rendemen terendah
yaitu pada perlakuan 20% inokulum dengan waktu fermentasi 12 jam.
L3.3.1 Analisa Kadar Air Untuk perlakuan 10%, 24 jam
Berat Awal = 2 gram
Berat Akhir = 1,995 gram
% kadar air = − ℎ 100%
= 0,25 %
L3.3.2 Analisa Bilangan Peroksida Untuk perlakuan 10%,24 jam:
PV =�.N.1000 w
Dimana:
Vs: volume Na2S2O3
N : normalitas larutan Na2S2O3 W : berat cuplikan
PV: peroxide value
Pada perlakuan ini:
Vs = 0,2 ml
N = 0,01
W = 5 gram
Maka:
PV =(0,2)(0,1)(1000)
L3.3.3 Analisa Bilangan iodin Untuk perlakuan 10%,24 jam:
IV =(N)(A-B) (12,69) w
A: volume blanko
B: volume pentiter
N : normalitas pentiter
W : berat cuplikan
IV: iodine value
Dimana pada perlakuan ini
A= 50 ml
B = 42,7 ml
N = 0,1
W = 1,0025
Maka:
IV =(0,1)(50-42,7) (12,69)
1,0025 = 9,24
L3.3.4 Analisa Densitas ρ=ρair
ρair = 0,9925 mminyak = 5,1
mair = 5,6
Maka:
ρ= 0,99255,1
5,6= 0,9038
L3.3.5 Analisa FFA
Analisa FFA dilakukan pada semua run berikut contoh perhitungan analisa FFA.
Untuk perlakuan 50 rpm, 30 menit:
=� 200
V = volume NaOH dalam peniteran (ml)
N = Normalitas NaOH
M = Bobot contoh (gr)
200 = Bobot molekul asam laurat
=� 200
10
= 5,75 0,1 200
LAMPIRAN 4
DOKUMENTASI PENELITIAN
L4.1 FOTO PEMBUATAN VCO
Gambar L4.1 Foto Pemisahan skim dan krim
Gambar L.4.3 Foto terbentuk 3 lapisan yaitu air, blondo dan VCO
L4.2 FOTO PROSES ANALISA VCO
L4.3 FOTO ANALISA DENSITAS
Gambar L4.5 Foto Analisa Densitas
L4.3 FOTO HASIL VCO
DAFTAR PUSTAKA
[1] Laras Cristianti, A.H. Prakosa, “Pembuatan Minyak Kelapa Murni (virgin coconut oil) Menggunakan Fermentasi Ragi Tempe”, Tugas Akhir, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Sebelas Maret, Surakarta, 2009
[2] Yurnaliza, “Pengaruh Variasi pH dan Konsentrasi Inokulum pada Produksi Minyak Kelapa secara Fermentasi”, Jurnal Biologi Sumatera, Departemen Biologi, Fakultas Matematika Dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, vol.2, No.1, 2007
[3] A. Rasyidi Fachry, Andre Oktarian dan Wahyu Wijanarko, “Pembuatan
Virgin Coconut Oil dengan Metode Sentrifugasi”, Seminar Nasional Teknik Kimia Indonesia, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Sriwijaya, Palembang, 2006
[4] Henni Pujiati, “Sifat Antibakteri Hasil Hidrolisis Minyak Kelapa Murni terhadap
Staphylococcus aureus dan Escherichia coli”, Skripsi, Fakultas Farmasi,
Universitas Sumatera Utara, 2012
[5] Didik Purwanto, “Pengaruh Desain Impeller, Baffle dan Kecepatan Putar pada Proses Isolasi Minyak Kelapa Murni Dengan Metode Pengadukan”, Seminar Nasional Aplikasi Sains dan Teknologi, Jurusan Teknik Kimia, Institut Teknologi Adhi Tama Surabaya (ITATS), 2008
[6] Sasniwiaty Sari Hasibuan, “Pengggunaan Minyak Kelapa Murni (VCO) Sebagai Pelembab dalam Sediaan Krim”, Skripsi. Fakultas Farmasi, Universitas Sumatera Utara, Medan, 2011
[7] Rahayu Endah Nurani, “Pengaruh Waktu Fermentasi Saccharomyces cerevisiae Terhadap Ketengikan dan Ketidakjenuhan pada Virgin Coconut Oil (VCO)”, Skripsi, Fakultas Pendidikan Matematika Dan Ilmu Pengetahuan Alam, Program Studi Pendidikan Biologi, Ikip PGRI, Semarang, 2013
[8] Nuzul Wahyuning Diyah, Purwanto, Y. Susanti dan Y.K. Dewi, “Pembuatan Minyak Kelapa Secara Enzimatis dengan Memanfaatkan Kulit Buah dan Biji Pepaya Serta Analisis Sifat Fisikokimianya”, Penelitian Hayati, Departemen Kimia Farmasi, Fakultas Farmasi, Universitas Airlangga, Surabaya, 2010
[9] Juniarti K., “Pengaruh Variasi Volume danWaktu Kontak Air Jeruk Nipis (Citrus Aurantifolia Swinggle) dengan Krim Santan pada Pembuatan Minyak Kelapa (Cocos nucifira L)”, Skripsi, Program Studi Kimia, Fakultas Sains dan Teknologi, Universitas Islam Negeri Sunan Kalijaga, Yogyakarta, 2010
[11] Sadiah Djajasoepena, O. Suprijana dan M. Resmelia, “Virgin Coconut Oil Production by Fermentation Using Saccharomyces cerevisiae”, Proceedings of the 2nd International Seminar on Chemistry, Department of Chemistry, Faculty of Mathematics and Natural Sciences, Universitas Padjadjaran, Bandung, Indonesia, 2011
[12] Wong Pei Wen, “Production of Virgin Coconut Oil (Vco) Via Combination Of Microwave and Centrifugation Method”, a Thesis Submitted in Fulfillment of The Requirements for The Award of The Degree of Bachelor of Chemical Engineering, Faculty of Chemical & Natural Resources Engineering, University Malaysia Pahang, 2010
[13] A. Tarore, M.R. Kereh dan D. Adipati, “Studi Kandungan Merkuri pada Daging Buah Kelapa di Tempat Pengolahan Bijih Emas, Desa Tatelu Rondor Kecamatan Dimembe Kabupaten Minahasa”, Jurnal, Lembaga Penelitian, Universitas Sam Ratulangi, Manado, vol.2, No.1, 2002
[14] Rommel Doloksaribu, “Pengaruh Konsentrasi Starter Saccharomyces cereviceae dan Waktu Fermentasi terhadap Hasil dan Mutu Minyak Kelapa
Virgin Coconut Oil”,Tesis, Program Magister Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan, 2010
[15] Rina Yurika, “Penentuan Kualitas Minyak yang Diperoleh dari Hasil Ekstraksi Kopra dengan Pelarut N-Heksan”, Karya Ilmiah, Program Studi Diploma III Kimia Analis, Fakultas Matematika Dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan, 2009
[16] Fatma Ananda Garini, “Pengaruh Pengaturan Konsentrasi Lemak Santan Murni (Limbah Sisa Analisis Laboratorium PT. Bumi Sarimas Indonesia) terhadap Karakteristik Nata de coconut Milk”, Jurnal Penelitian, Fakultas Teknologi Pertanian, Universitas Andalas, Padang, 2011
[17] Suhardi, “Penggunaan Plastik Polipropilen untuk Pengemas Geplak dan Pengaruhnya Terhadap Sifat-Sifat Geplak Selama Penyimpanan”, Laporan Penelitian, Fakultas Teknologi Pertanian, Departemen Pendidikan dan Kebudayaan, Universitas Gadjah Mada, 1989
[18] Larose Kumalla M., Sumardi, H.S. dan M.B. Hermanto, “Uji Performansi Pengering Semprot Tipe Buchi B-290 Pada Proses Pembuatan Tepung Santan”, Jurnal Bioproses Komoditas Tropis, Jurusan Keteknikan Pertanian, Fakultas Teknologi Pertanian, Universitas Brawijaya, vol.1, No.1, 2013 [19] Sukasih, “Optimasi Pembuatan Cocogurt (Yogurt Santan Kelapa) dengan
[20] Endang Srihari, F.S. Lingganingrum, R. Hervita dan Helen W.S, “Pengaruh Penambahan Maltodekstrin pada Pembuatan Santan Kelapa Bubuk”, Seminar Rekayasa Kimia dan Proses, Jurusan Teknik Kimia, Fakultas Teknik Universitas Surabaya, 2010
[21] E. Fajrin, “Penggunaan Enzim Bromelin pada Pembuatan Minyak Kelapa (Cocos Nucifera) Secara Enzimatis”, Jurnal, Jurusan Teknologi Pertanian, Fakultas Pertanian, Universitas Hasanuddin, Makassar, 2012
[22] Sri Winarti, Jariyah danY. Purnomo, “Proses Pembuatan VCO secara Enzimatis Menggunakan Papain Kasar”, Jurnal teknologi Pertanian, Jurusan Teknologi Pangan, Fakultas Teknologi Industri, Universitas Pembangunan Nasional, Surabaya, 2012
[23] Rahayu Endah Nurani, “Pengaruh Waktu Fermentasi Saccharomyces cerevisiae terhadap Ketengikan dan Ketidakjenuhan pada Virgin Coconut Oil
(VCO)”, Skripsi, Fakultas Pendidikan Matematika Dan Ilmu Pengetahuan Alam, Program Studi Pendidikan Biologi, Ikip PGRI Semarang, 2013
[24] SNI, “Minyak Kelapa Virgin (VCO)”, Badan Standardisasi Nasional, 2008
[25] Triastuti Rahayu, D. Widianto dan T. Yuwono, “Konstruksi Strain Haploid
Saccharomyces cerevisiae Pembawa Kromosom XII yang Terpotong pada Sisi Kanan Lokus rDNA”, Jurnal, Program Studi Bioteknologi Program Pascasarjana, Universitas Gadjah Mada (UGM), Yogyakarta, 2005
[26] Riza Zainuddin Ahmad, “Pemanfaatan Khamir Saccharomyces cerevisiae
untuk Ternak”, Jurnal, Balai Penelitian Veteriner.PO Box 151 Bogor 16144, vol.15, No.1, 2005
[27] D. Hartanto, “Peningkatan Teknik Pengolahan Buah Kelapa Menjadi Minyak Goreng Bermutu (VCO) Melalui Proses Fermentasi”, Jurnal, Fakultas Peternakan, Universitas Udayana, vol.9, No.2, 2012
[28] Apriwinda, “Studi Fermentasi Nira Batang Sorgum Manis (Sorghum Bicolor (L) Moench) untuk Produksi Etanol”, Skripsi, Fakultas Pertanian, Universitas Hasanuddin, Makassar. 2013
[29] Ratna Juwita, “Studi Produksi Alkohol dari Tetes Tebu (Saccharum officinarum L) Selama Proses Fermentasi”, Skripsi, Jurusan Teknologi Pertanian, Fakultas Pertanian, Universitas Hasanuddin, Makassar, 2012
[30] Tri Supriyanto dan Wahyudi, “Proses Produksi Etanol oleh Saccharomyces cerivisiae dengan Operasi Kontinyu Pada Kondisi Vakum”, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, 2010
[32] B.S.T. Sembodo, A. Noorlyta dan Nur, E.L.M, “Pengaruh Kecepatan Putar Pengaduk Proses pemecahan Emulsi Santan Buah Kelapa Menjadi Virgin Coconut Oil (VCO)”, ISSN, Jurusan Teknik Kimia, Universitas Sebelas Maret, Surakarta, vol.9, No.1, 2010
[33] A.M. Marina, Y.B. Che Man and I. Amin, “Virgin Coconut Oil: Emerging Functional Food Oil”, Food Science and Technologi, Departmen of Food Technologi, Faculty of Food Science and Technology, Universiti Putra Malaysia, 2009
[34] Mansor T.S.T., Che Man Y.B., Shuhaimi M., Abdul Afig M.J and Ku Nurul F.K.M, “ Physicochemical Properties of Virgin Coconut Oil Extracted from Different Processing Methods”, International Food Research Journal, Universiti Putra Malaysia, 2012
[35] Mochamad Hadi Fadlana, “Pengaruh Suhu Penyimpanan dan Cara Ekstraksi
Virgin Coconut Oil (VCO) terhadap Mutu Minyak yang Dihasilkan Selama Penyimpanan”, Skripsi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, 2006
[36] Sapta Raharja dan Maya Dwiyuni, ”Kajian Sifat Fisiko Kimia Ekstrak Minyak Kelapa Murni (Virgin Coconut Oil, VCO) yang Dibuat dengan Metode Pembekuan Krim Santan”, Jurnal Teknologi Industri Pertanian, Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, vol. 18(2), 2012
[37] Nely Fatwatun R., K. Chusna dan B. Pramudono, ”Pembuatan Virgin Coconut oil (VCO): Pemecahan Emulsi dengan Metode Ultrasonik”, Jurnal Teknologi Kimia dan Industri, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Semarang, vol.2, No.4, 2013
[38] Riko Aditiya, H. Rusmarilin dan L.N. Limbong, ”Optimasi Pembuatan Virgin Coconut Oil (VCO) dengan Penambahan Ragi Roti (Saccharomyces cerevisiae) dan Lama Fermentasi dengan VCO Pancingan”, Jurnal Rekayasa Pangan dan Pertanian, Program Studi Ilmu dan Teknologi Pangan Fakultas Pertanian USU Medan, vol.2, No. 2, 2014
[39] Ngatemin, Nurraham dan J.T. Isworo, “Pengaruh Lama Fermentasi pada Produksi Minyak Kelapa Murni (Virgin Coconut Oil) terhadap Sifat Fisik, Kimia, dan Organoleptik, Jurnal Pangan dan Gizi, Universitas Muhammadiyah Semarang, vol.04, No. 08, 2013
[40] I Wayan Arnata, ”Pengembangan Alternatif Teknologi Bioproses Pembuatan Bioetanol dari Ubi Kayu Menggunakan Trichoderma viride, Aspergillus niger dan Saccharomyces cerevisiae”, Tesis, Sekolah Pascasarjana, Institut
[41] L. Kamariah, A. Azmi, A. Rosmawati, M.G. Wai Ching, M.D. Azlina, A. Sivapragasam, C.P. Tan and O.M. Lai, “Physico-chemical and Quality Characteristics of Virgin Coconut Oil”, Journal Trop. Agricultural and Food Science, Malaysian Agricultural Research and Development Institute, vol.36, No. 02, 2008
[42] Firman Budiman, O. Ambari, A.H. Surest, ”Pengaruh Waktu Fermentasi dan Perbandingan Volume Santan dan Sari Nanas pada Pembuatan Virgin Coconut Oil (VCO)”, Jurnal Teknik Kimia, Universitas Sriwijaya, vol.18, No. 2, 2012
[43] Tri Susanto, “Perbandingan Mutu Minyak Kelapa yang Diproses Melalui Pengasaman dan Pemanasan”, Jurnal Hasil Penelitian Industri, Balai Riset dan Standarisasi Industri, Palembang, 2012
[44] Augustyn, G.H., ”Pengaruh Penambahan Ekstrak Buah Pepaya (Carica papaya L.) Terhadap Mutu Minyak Kelapa Murni”, Jurnal budidaya Pertanian, Program Studi Teknologi Hasil Pertanian, Fakultas Pertanian, Universitas Pattimura, vol.8, No. 01, 2012
[45] Asian and Pacific Coconut Community (APCC), “ Standards for Virgin Coconut Oil”, 2012
[46] Intan deasy Ariwianti dan Kristina Ari Cahyani, “Pembuatan Minyak Kelapa dari Santan Secara Enzimatis Menggunakan Enzim Papain dengan Penambahan Ragi
Tempe”, Makalah Penelitian, Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Semarang, 2008
[47] Fabian M. Dayrit, Olivia E.M Buenafe, Edward T. Chainani, Ian Mitchelle S. De Vera, Ian ken D. Dimzon, Estrella G. Gonzales dan Jaclyn E.R. Santos, “Standards for Essential Composition and Quality Factors of Commercial Virgin Coconut Oil and its Differentiation from RBD Coconut Oil and Copra Oil”, Philippine Journal of Science, vol.136, No. 02, 2007
[49] Yuli Witono, Aulanni, Achmad Subagio dan Simon Bambang Widjanarko, “Ekstraksi Virgin Coconut Oil Secara Enzimatis Menggunakan Protease dari Tanaman Biduri (Calotropis gigantea)”, Agritech, Universitas Brawijaya Malang, vol.27, No. 03, 2007
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Proses Industri Kimia, Laboratorium
Mikrobiologi Industri Departemen Teknik Kimia, Fakultas Teknik, Universitas
Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 3 bulan.
3.2 BAHAN DAN PERALATAN 3.2.1 Bahan Penelitian
Pada penelitian ini bahan yang digunakan antara lain:
1. Kelapa parut sebagai bahan baku pembuatan minyak kelapa murni (VCO)
2. Bakteri murni Saccharomyces cerevisiae sebagai sampel mikroba yang digunakan pada proses fermentasi
3. Air (H2O) digunakan untuk perolehan santan kelapa
4. Kalium Hidroksida (KOH) sebagai pentiter pada analisa bilangan asam
5. Asam Klorida (HCl) sebagai pentiter pada analisa bilangan penyabunan
6. Phenolptalein sebagai indikator larutan
7. Asam Asetat dan kloroform sebagai pelarut
8. Natrium Thiosulfat sebagai pentiter pada analisa peroksida
9. Kalium Iodide sebagai pelarut
3.2.2 Peralatan Penelitian
Pada penelitian ini peralatan yang digunakan antara lain:
1. Shaker
Fungsi : Sebagai pengaduk
2. Beaker Glass
Fungsi : Sebagai wadah larutan
3. Gelas Ukur
Fungsi : sebagai alat untuk mengukur volume suatu larutan
4. Neraca Digital
5. Erlenmeyer
Fungsi : sebagai tempat fermentasi berlangsung
6. Kertas saring
Fungsi : Sebagai penyaring minyak kelapa murni
7. Piknometer
Fungsi : Untuk mengukur densitas minyak
8. Kromatografi gas (GC)
Fungsi : Untuk menganalisa asam lemak
3.3 PROSEDUR PENELITIAN 3.3.1 Persiapan Bahan Baku
Buah kelapa yang akan diolah menjadi VCO adalah buah yang
tua, yakni berumur 11-12 bulan, yang ditandai dengan kulit sabut
berwarna coklat. Buah kelapa tua akan menghasilkan rendemen minyak
yang tinggi.
3.3.2. Pembuatan Santan
Berikut proses penbuatan santan kelapa:
1. Menyiapkan dan memilih daging kelapa yang sudah tua.
2. Memarut daging kelapa.
3. Menambahkan air kedalam parutan kelapa dengan perbandingan 1:1,5
(b/v) lalu mengambil santannya.
4. Menyaring semua santan yang dihasilkan.
5. Mengendapkan santan yang telah disaring selama 30 menit, sehingga
terbentuk dua lapisan yaitu: lapisan bawah berupa air (skim) dan lapisan
atas berupa krim (kanil).
8. Memisahkan krim dan air dengan menggunakan corong
pemisah.
3.3.3. Pembuatan Starter
1. Skim yang diperoleh dari pembuatan santan dijadikan sebagai medium
2. Skim dimasukkan ke dalam botol sebanyak 1 liter
3. Menambahkan glukosa sebanyak 10 gram ke dalam skim
4. Larutan skim disterilkan pada suhu 1210C selama 15 menit 5. Mendinginkan skim yang sudah steril hingga suhu kamar
6. Sebanyak 2 (dua) ose khamir Saccharomyces cerevisiae diinokulasikan
ke dalam medium skim
7. Diaduk selama 24 jam dengan menggunakan shaker
8. Dimasukkan ke dalam kulkas
3.3.4. Pembuatan Minyak Kelapa Murni (VCO)
1. Menampung krim/kanil yang terbentuk ke dalam toples transparan.
2. Menambahkan larutan inokulum dengan konsentrasi 5, 10, 15, 20 dan
25 % (v/v)
3. Mendiamkan campuran tersebut selama 6, 12, 18, 24 dan 30 jam hingga
terbentuk 3 lapisan. Lapisan paling atas merupakan minyak kelapa
murni, lapisan tengah adalah blondo (ampas kanil) dan lapisan paling
bawah adalah air.
4. Memisahkan minyak kelapa murni tersebut dari air dan blondo dengan
melakukan penyaringan pada minyak.
5. Dilakukan perhitungan rendemen
Rendemen =Volume minyak VCO/Volume kanil x 100
3.4 Karakterisasi Minyak Kelapa Murni (VCO) 3.4.1 Analisa Bilangan Asam Lemak Bebas (FFA)
1. Menimbang 30 gram contoh minyak atau lemak dan memasukkan kedalam
erlenmeyer 250 ml.
2. Menambahkan 50 ml etanol 95%.
3. Tambahkan 3 tetes tetes indikator PP.
4. Titrasi dengan larutan standar NaOH 0,1 N hingga warna merah muda
(tidak berubah selama 15 detik).
5. Lakukan penetapan duplo.
= � 200 10 V = volume NaOH dalam peniteran (ml)
N = Normalitas NaOH
M = Bobot contoh (gr)
200 = Bobot molekul asam laurat
3.4.2 Analisa Kadar Air
1. Menimbang sampel sebanyak 5 gram
2. Mencatat berat sampel (berat awal)
3. Dipanaskan dalam oven pada suhu 105 0C selama satu jam 4. Didinginkan dalam desikator selama ½ jam
5. Menimbang botol yang berisi sampel tersebut
6. Diulangi pemanasan dan penimbangan sampai diperoleh berat yang tetap
6. Mencatat berat sampel (berat akhir)
3.4.3 Analisa Bilangan Peroksida
1. Menimbang minyak seberat 5 gram, kemudian dimasukkan ke dalam
Erlenmeyer 250 ml.
2. Ditambahkan 10 ml kloroform dan dilarutkan contoh dengan cara
menggoyangkan erlenmeyer dengan kuat.
3. Ditambahkan 15 ml asam asetat glasial dan 1 ml larutan kalium iodida
jenuh.
4. Ditutup erlenmeyer dan dikocok kira-kira 5 menit ditempat gelap pada
suhu 15oC – 25 oC.
5. Tambahkan 75 ml air suling dan kocok dengan kuat
6. Dititrasi dengan larutan standar natrium thiosulfat 0,02 N dengan larutan
kanji sebagai indikator
7. Dilakukan penetapan blanko
8. Dilakukan penetapan duplo
9. Hitung bilangan peroksida dalam contoh
(�1−�0)
Vo = Volume dari natrium thiosulfat untuk titrasi blanko (ml)
V1 = Volume dari larutan natrium thiosulfat untuk titrasi contoh (ml)
N = Normalitas larutan standar natrium thiosulfat yang digunakan
M = berat contoh
3.4.4 Bilangan Iodin
1. menimbang dengan teliti sejumlah contoh berdasarkan bilangan iod dari
contoh kemudian dimasukkan ke dalam erlenmeyer bertutup asah.
2. Ditambahkan 15 ml pelarut (sikloheksan:asam asetat, 1:1) dengan
menggunakan gelas ukur untuk melarutkan lemak.
3. Ditambahkan 25 ml larutan wijs dengan menggunakan pipet gondok
kemudian erlenmeyer ditutup
4. Simpan selama 1-2 jam dalam ruangan gelap selama 1 jam.
5. Ditambahkan 10 ml larutan KI 20% dan 100 ml air suling. Erlenmeyer
ditutup segera, kocok dan titrasi dengan larutan natrium tiosulfat 0,1 N dan
larutan kanji sebagai indikator.
6. Dilakukan penetapan duplo.
7. Dilakukan peetapan blanko.
8. Dihitung bilangan iod dalam sampel.
3.4.5 Analisa Berat Jenis
1. Menimbang picnometer kosong
2. Mengisi picnimeter dengan aquadest sampai meluap dan tidak terbentuk
gelembung udara kemudian menutupnya.
3. Menimbang piknometer dan isinya.
4. Mengukur suhu aquadest.
5. Melakukan hal yang sama pada contoh minyak.
3.4.6 Analisa Asam Lemak
3.5 FLOWCHART PENELITIAN
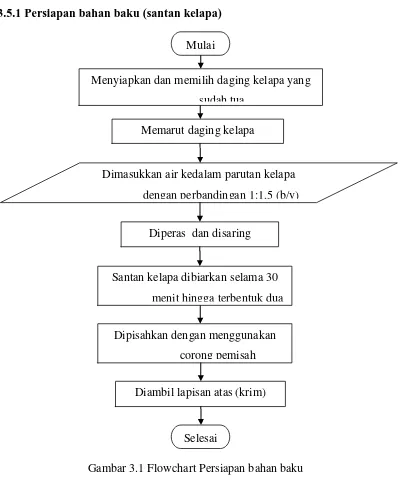
3.5.1 Persiapan bahan baku (santan kelapa)
Gambar 3.1 Flowchart Persiapan bahan baku Menyiapkan dan memilih daging kelapa yang
sudah tua.
Memarut daging kelapa
Selesai Mulai
Diperas dan disaring
Dimasukkan air kedalam parutan kelapa
dengan perbandingan 1:1,5 (b/v)
Santan kelapa dibiarkan selama 30
menit hingga terbentuk dua
Dipisahkan dengan menggunakan
corong pemisah
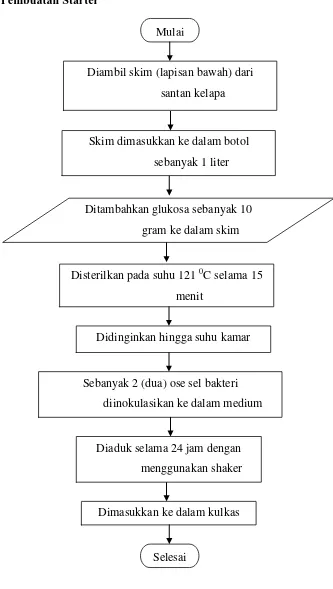
3.5.2 Pembuatan Starter
Gambar 3.2 Flowchart Pembuatan Starter Mulai
Diambil skim (lapisan bawah) dari
santan kelapa
Disterilkan pada suhu 121 0C selama 15 menit
Sebanyak 2 (dua) ose sel bakteri
diinokulasikan ke dalam medium
Selesai
Diaduk selama 24 jam dengan
menggunakan shaker Skim dimasukkan ke dalam botol
sebanyak 1 liter
Ditambahkan glukosa sebanyak 10
gram ke dalam skim
Didinginkan hingga suhu kamar
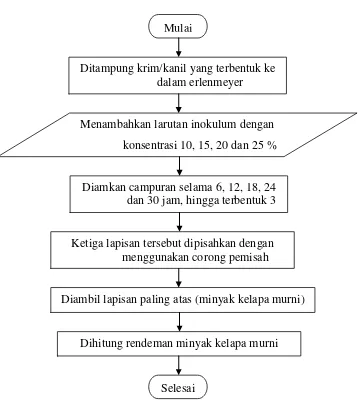
3.5.3 Pembuatan Minyak Kelapa Murni (VCO)
Gambar 3.3 Flowchart Pembuatan Minyak Kelapa Murni (VCO) Diambil lapisan paling atas (minyak kelapa murni)
Dihitung rendeman minyak kelapa murni
Selesai Mulai
Menambahkan larutan inokulum dengan
konsentrasi 10, 15, 20 dan 25 %
Diamkan campuran selama 6, 12, 18, 24 dan 30 jam, hingga terbentuk 3
lapisan
Ketiga lapisan tersebut dipisahkan dengan menggunakan corong pemisah Ditampung krim/kanil yang terbentuk ke
3.5.4 Flowchart Karakterisasi Minyak Kalapa Murni (VCO) 3.5.4.1 Analisa Bilangan Asam Lemak Bebas (FFA)
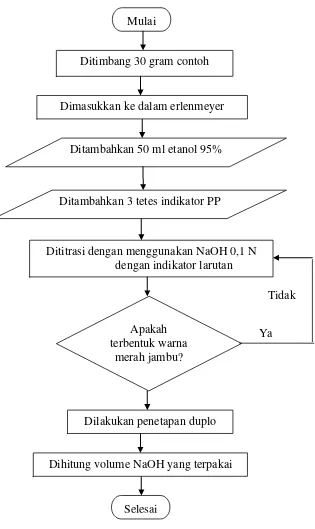
Gambar 3.4 Flowchart Analisa Bilangan Asam Mulai
Ditimbang 30 gram contoh
Dititrasi dengan menggunakan NaOH 0,1 N dengan indikator larutan
phenolphtalein
Apakah terbentuk warna
merah jambu?
Ya Tidak
Selesai
Dimasukkan ke dalam erlenmeyer
Dilakukan penetapan duplo Ditambahkan 50 ml etanol 95%
Ditambahkan 3 tetes indikator PP
3.5.4.2Analisa Kadar Air
Gambar 3.5 Flowchart Analisa Bilangan Iodin Mulai
Ditimbang sampel sebanyak 5 gram
Mencatat berat sampel (berat awal)
Memanaskan sampel dalam oven pada
suhu 105 0C
Menimbang botol yang berisi sampel tersebut
Selesai
Mencatat berat sampel (berat akhir) Diulangi pemanasan dan penimbangan sampai
3.5.4.3Analisa Bilangan iod
Gambar 3.5 Flowchart Analisa Bilangan Iodin Mulai
Ditimbang sejumlah contoh dalam penelitian
ini sebanyak 1,0025 gram
Sampel dimasukkan ke dalam erlenmeyer dan
ditutup
Simpan selama 1 jam dalam ruangan gelap
Dititrasi dengan menggunakan larutan natrium
tiosulfat 0,1 N dan larutan kanji sebagai
Selesai
Ditambahkan 25 ml larutan wijs
dengan menggunakan
pipet gondok lalu ditutup
Dilakukan penetapan blanko Ditambahkan 10 ml larutan KI
20% dan 100 ml air
suling, ditutup lalu
Dilakukan penetapan duplo
3.5.4.4Analisa Bilangan Peroksida
Gambar 3.6 Flowchart Analisa Bilangan Peroksida Mulai
Ditimbang contoh sebanyak 0,3 gram -5 gram
Sampel dimasukkan ke dalam erlenmeyer
Dititrasi dengan larutan natrium thiosulfat
0,02 N dengan larutan kanji sebagai
Selesai
Ditambahkan 15 ml asam asetat glasial
dan 1 ml larutan kalium iodida jenuh
Ditambahkan aquadest sebanyak 75 ml
Hitung bilangan peroksida pada contoh Ditutup erlenmeyer dan dikocok kira-kira 5
menit pada suhu 15 oC-25 oC
3.5.4.5 Analisa Berat Jenis
Gambar 3.7 Flowchart Analisa Berat Jenis Mulai
Ditimbang piknometer kosong
Mengisi piknometer dengan aquadest sampai meluap
Selesai
Menimbang piknometer dan isinya
Mengukur suhu aquadest
Dihitung berat jenis air
BAB IV
HASIL DAN PEMBAHASAN
Analisa yang dilakukan dalam penelitian ini adalah analisa kualitatif dan
kuantitatif. Analisa kualitatif meliputi beberapa karakteristik seperti penampilan,
warna dan bau yang mengidentifikasikan sifat-sifat dari VCO.
4.1 ANALISA KUALITATIF
Berikut ini merupakan data hasil analisa kualitatif VCO yang diperoleh dari
[image:33.595.155.471.318.399.2]penelitian ini:
Tabel 4.1. Hasil Analisa Kualitatif VCO
No Karakteristik Pengamatan
1 Penampilan cairan
2 Warna rnih (tidak berwarna)
3 Bau Wangi kelapa segar
Tabel 4.1 memperlihatkan hasil yang diperoleh yaitu penampilan berupa
cairan jernih dengan bau cenderung kelapa segar seperti yang dapat dilihat pada
Gambar L4.6 yang terdapat di Lampiran 4.
Menurut hasil penelitian yang dilakukan oleh Fadlana [35], menyatakan
bahwa VCO yang diperoleh dengan proses peragian (fermentasi) berupa jernih kristal (tidak berwarna). Menurut Raharja [36], aroma yang dimiliki VCO yang
diperoleh adalah aroma kelapa.
Hasil penelitian analisa kualitatif yang diperoleh pada penelitian ini juga
sejalan dengan hasil penelitian yang dilakukan Fatwatun [37] yaitu VCO yang
jernih (tidak berwarna) dan memiliki aroma kelapa segar.
4.2 ANALISA KUANTITATIF
4.2.1 Pengaruh Waktu Fermentasi Terhadap Rendemen Virgin Coconut Oil (VCO)
Pengaruh waktu fermentasi terhadap rendemen VCO pada masing-masing
Semakin lama fermentasi maka rendemen yang dihasilkan semakin
tinggi. Hal ini dikarenakan pada proses fermentasi lanjut akan terbentuk air dan
asam asetat dimana asam asetat memiliki kemampuan untuk memutus ikatan
lemak-protein, akibatnya semakin banyak lemak yang terlepas dari protein [38].
Hal yang sama juga diperoleh Ngatemin [39] bahwa semakin lama fermentasi,
kecepatan reaksi hidrolisis protein semakin meningkat sehingga minyak yang
dapat dibebaskan dari selubung protein juga semakin banyak sehingga rendemen
semakin tinggi.
Pada Gambar 4.1 dapat dilihat bahwa rendemen VCO yang dihasilkan
untuk berbagai macam konsentrasi inokulum cenderung meningkat dengan
[image:34.595.116.495.317.519.2]peningkatan waktu fermentasi.
Gambar 4.1 Pengaruh Waktu Fermentasi dan Konsentrasi Inokulum Sebesar (a) 5% (b) 10% (c) 15% (d) 20% dan (e) 25% Terhadap Rendemen Virgin
Coconut Oil (VCO)
Hasil penelitian yang diperoleh memperlihatkan bahwa waktu ekstraksi
selama 6 jam belum menghasilkan VCO, sementara 12 jam fermentasi
menghasilkan rendemen VCO (15-24,75%), 18 jam (22,25-25%), 24 jam
(24,5-28,25%) dan 30 jam memberikan rendemen VCO (24,75-27,5%). Dari data
tersebut dapat dilihat bahwa semakin lama waktu fermentasi yang dilakukan maka
rendemen VCO cenderung semakin menigkat. Rendemen tertinggi diperoleh saat
fermentasi dilakukan selama 24 jam. 0 3 6 9 12 15 18 21 24 27 30
6 12 18 24 30
Namun pada penelitian ini terjadi penurunan perolehan rendemen
minyak pada waktu 30 jam. Menurut Juwita [29], semakin lama fermentasi maka
asam yang dihasilkan akan lebih banyak. Proses terjadinya penurunan pH dapat
terjadi dari awal fermentasi diakibatkan terbentuknya asam-asam selama proses
fermentasi berlangsung. Asam-asam yang terbentuk seperti asam asetat, asam
piruvat, dan asam laktat yang dapat menurunkan pH. Arnata [40] juga
menyebutkan bahwa khamir saccharomyces cerevisiae bersifat fakultatif anaerobik, yaitu tumbuh baik pada suhu 30oC dan pH 4,0-4,5. Sehingga penurunan
rendemen VCO diduga karena kehidupan khamir saccharomyces cerevisiae yang sudah mulai terganggu sehingga tidak mampu lagi untuk memproduksi minyak.
Pengamatan oleh Winarti [22] menyatakan bahwa dalam reaksi
hidrolisis, minyak atau lemak akan berubah menjadi asam-asam lemak bebas dan
gliserol. Ditambahkan lagi oleh Ngatemin [39] dalam penelitiannya yaitu semakin
lama waktu fermentasi maka semakin tinggi asam lemak bebasnya yang
terkandung dalam VCO. Hal ini disebabkan karena kandungan air dalam VCO
meningkat dan adanya enzim lipase yang berperan dalam pembentukan asam
lemak bebas. Dimana proses penting terbentuknya asam lemak bebas yaitu proses
hidrolisis yang akan melepaskan asam lemak rantai pendek yang dapat
menyebabkan timbulnya bau. Dengan adanya air, lemak akan terhidrolisis
membentuk gliserol dan asam lemak bebas.
Oleh karena itulah diduga penurunan rendemen VCO pada waktu 30 jam
terjadi karena pada saat reaksi hidrolisis santan tidak terkonversi menjadi minyak
lagi melainkan hasil samping yang lain seperti gliserol dan asam-asam lemak
bebas yang lainnya.
Hasil penelitian ini sejalan dengan hasil yang dilaporkan oleh Satheesh
dan Prasad [10] yang melakukan pengamatan optimasi parameter fermentasi pada
4.2.2 Pengaruh Konsentrasi Inokulum Terhadap Rendemen Virgin Coconut
Oil (VCO)
Pengaruh konsentrasi inokulum terhadap rendemen VCO pada
[image:36.595.113.514.165.388.2]masing-masing perlakuan dapat dilihat pada Gambar 4.2.
Gambar 4.2 Pengaruh Konsentrasi Inokulum dan Waktu Fermentasi Selama (a) 6
jam (b) 12 jam (c) 18 jam (d) 24 jam (e) 30 jam Terhadap Rendemen
VCO
Pada Gambar 4.2 dapat dilihat bahwa penambahan konsentrasi inokulum
tidak terlalu berpengaruh terhadap rendemen VCO. Menurut Ngatemin [39]
semakin tinggi konsentrasi inokulum yang digunakan maka rendemen yang
diperoleh juga akan semakin naik (besar). Hal ini dikarenakan enzim yang berasal
dari Saccharomyces cerevisiae adalah enzim proteolitik yang dapat menghidrolisis ikatan peptida.
Namun pada penelitian ini berbeda dengan yang dilaporkan oleh
Ngatemin [39]. Dimana penambahan inokulum tidak begitu berpengaruh terhadap
rendemen VCO. Hal ini diduga bahwa penambahan Saccharomyces cerevisiae
sudah tidak seimbang dengan sumber makanan yang tersedia dalam santan kelapa
yang akan difermentasi sehingga khamir mulai kekurangan makanan sehingga
yang terjadi adalah khamir saling memakan satu sama lain. 0 3 6 9 12 15 18 21 24 27 30
5% 10% 15% 20% 25%
Re n d em en VC O (% )
Konsentrasi Inokulum (%)
6 jam
12 jam
18 jam
24 jam
Hasil yang diperoleh memperlihatkan bahwa rendemen VCO pada
penambahan konsentrasi inokulum 10% mencapai rendemen VCO hingga 28,25
dimana penambahan konsentrasi 10% ini memberikan hasil yang lebih besar jika
dibandingkan dengan 5% (24,75%), 15% (24,75%), 20% (25,25%) dan 25%
(25,75%).
4.2.3 Analisa Karakteristik Virgin Coconut Oil (VCO)
Pada penelitian ini, dilakukan beberapa analisa untuk mengetahui
karakteristik VCO yakni analisa gas kromatografi, analisa asam lemak bebas
(FFA), analisa bilangan peroksida (ketengikan), analisa bilangan iodin dan analisa
densitas minyak.
Pengaruh Waktu Fermentasi Terhadap Asam Lemak Bebas (FFA) VCO
Pengaruh waktu fermentasi terhadap FFA pada masing-masing perlakuan
dapat dilihat pada Gambar 4.3.
Pada Gambar 4.3 dapat dilihat bahwa FFA VCO untuk berbagai macam
waktu fermentasi dan konsentrasi inokulum cenderung meningkat seiring
[image:37.595.129.499.475.669.2]peningkatan waktu fermentasi.
Gambar 4.3 Pengaruh Waktu Fementasi, dan Konsentrasi Inokulum Sebesar (a)
5% (b) 10% (c) 15% (d) 20% dan (e) 25% Terhadap FFA VCO 0
0.1 0.2 0.3 0.4 0.5
6 12 18 24 30
K
ad
ar
F
F
A
(%
)
Waktu (jam)
5%
10%
15%
20%
Free fatty acid (FFA) merupakan karakteristik yang penting untuk kualitas VCO dalam penjualan atau pemasaran. FFA merupakan sebuah petunjuk
perhatian selama produksi VCO [41].
Semakin lama waktu fermentasi maka semakin tinggi asam lemak bebas
yang terkandung dalam VCO. Hal ini disebabkan karena kandungan dalam VCO.
Hal ini disebabkan karena kandungan air dalam VCO meningkat dan adanya
enzim lipase yang berperan dalam pembentukan asam lemak bebas. Proses
penting terbentuknya asam lemak bebas yaitu proses hidrolisis yang akan
melepaskan asam lemak rantai pendek yang dapat menyebabkan timbulnya bau.
Dengan adanya air, lemak akan terhidrolisis membentuk gliserol dan asam lemak
bebas Ngatemin [39]. Dari grafik pada penelitian ini dapat dilihat bahwa
karakterisitk FFA VCO cenderung semakin meningkat seiring dengan
bertambahnya waktu fermentasi.
Hasil yang diperoleh memperlihatkan bahwa waktu fermentasi selama 12
jam memiliki FFA (0,24-0,33%), 18 jam (0,24-0,36%), 24 jam (0,25-0,28%) dan
30 jam (0,26-0,38%). Dari data yang diperoleh dapat diambil kesimpulan bahwa
semakin lama waktu fermentasi, maka karakterisitk FFAnya semakin besar. Hasil
penelitian ini sejalan dengan hasil yang dilaporkan oleh Aditiya [38] yang
melakukan penelitian optimasi pembuatan VCO dengan penambahan ragi roti
(saccharomyces cerevisiae) dan lama fermentasi dengan VCO pancingan.
Pengaruh Konsentrasi Inokulum Terhadap Asam Lemak Bebas (FFA) VCO
Pengaruh konsentrasi inokulum terhadap FFA pada masing-masing perlakuan
dapat dilihat pada Gambar 4.4.
Pada Gambar 4.4 dapat dilihat bahwa FFA VCO untuk berbagai macam
konsentrasi inokulum dan lama fermentasi cenderung meningkat seiring
Gambar 4.4 Pengaruh Konsentrasi Inokulum dan Waktu fermentasi selama (a) 12 jam (b) 18 jam (c) 24 jam dan (d) 30 jam Terhadap FFA VCO
Semakin banyak penambahan ragi roti (Saccharomycescerevisiae) maka asam lemak bebas semakin tinggi. Hal ini dikarenakan semakin banyak ragi maka
semakin tinggi karakterisitk air VCO. Adanya air, minyak dapat terhidrolisis
menjadi gliserol dan asam lemak [38].
Dari Gambar 4.4, peningkatan FFA VCO yang didapat juga dapat
dilihat dari meningkatnya konsentrasi Inokulum yang digunakan untuk
mengekstrak VCO.
Dari percobaan yang dilakukan pada penelitian ini, karakterisitk
FFA VCO pada penambahan konsentrasi inokulum 10% (mencapai FFA tertinggi
0,3%) lebih rendah jika dibandingkan dengan penambahan 5% (karakterisitk FFA
paling tinggi 0,36), 15% (FFA tertinggi 0,33), 20% (FFA tertinggi 0,32) dan 25%
(FFA tertinggi 0,38%). Hasil penelitian ini sama seperti hasil yang dilaporkan
oleh Aditiya [38] dimana karakterisitk FFA VCO meningkat dengan semakin
tingginya penambahan konsentrasi inokulum.
Menurut [36] kadar FFA maksimal yang terkandung dalam VCO yaitu
0,2 % sedangkan menurut [25] kadar FFA maksimal yang terkandung dalam VCO
yaitu 0,5 %. Dari hasil penelitian terlihat bahwa kadar FFA masih sesuai standart
menurut [25]. 0 0.1 0.2 0.3 0.4 0.5
5% 10% 15% 20% 25%
F
F
A
VC
O (%
)
Konsentrasi Inokulum (%)
6
12
18
24
Kadar Air VCO
Kadar air merupakan parameter yang mempengaruhi tingkat ketahanan
minyak terhadap kerusakan. Pada penelitian ini kadar air hanya diuji pada
perolehan rendemen VCO tertinggi dan terendah. Kadar air yang diperoleh pada
rendemen VCO tertinggi yaitu sebesar 0,25 % dan pada rendemen VCO terendah
diperoleh kadar air sebesar 0,239 %.
Menurut standar philipina kadar air yang diperbolehkan pada VCO
maksimal 0,1%. Pada penelitian ini kadar air yang diperoleh melebihi standar
yang diperbolehkan yang berarti bahwa VCO masih belum sesuai dengan standar
yang ada .
Kadar air yang tinggi bisa dikarenakan bercampurnya air pada saat
pembuatan dan tidak bisa dipisahkan dengan metode pemisahan biasa [51].
Peroxide Value (Angka Peroksida) VCO
Angka peroksida sangat penting untuk menentukan derajat kerusakan
minyak. Asam lemak tak jenuh dapat mengikat oksigen pada ikatan rangkapnya
sehingga membentuk peroksida. Semakin kecil angka peroksida maka kualitas
minyak semakin baik [42].
Nilai peroksida memberikan indikasi keadaan oksidasi utama dari minyak.
Salah satu produk pertama yang dibentuk oleh oksidasi minyak adalah
hidroperoksida. Metode yang paling umum untuk menentukan oksidasi adalah
dengan pengukuran peroxide value (PV). Tes ini didasarkan pada kemampuan untuk membebaskan iodin dari kalium iodida. Meskipun metode ini sangat
empiris, itu adalah panduan yang baik untuk kualitas VCO. Sebuah minyak yang
baru disaring atau dibersihkan harus memiliki PV nol [41].
Bilangan peroksida didefinisikan sebagai miliequivalen (mEq) peroksida
per kg sampel, yang ditentukan dengan titrasi redoks (iodimetri), dengan asumsi
bahwa senyawa yang bereaksi di bawah kondisi uji adalah peroksida atau produk
sejenis dari oksidasi lipid. Apabila nilai bilangan peroksida yang terlalu besar
maka ada proses oksidasi lebih lanjut pada produk minyak kelapa yang berakibat
Menurut Augustyn [44] penyebab terjadinya kenaikan angka peroksida
yaitu banyaknya air yang terkandung dalam santan dan molekul-molekul minyak
atau yang mengandung radikal asam lemak tidak jenuh sehingga mengalami
oksidasi dan menjadi tengik.
Menurut standar APCC (Asian and Pacific Coconut Community) [25] untuk
virgin coconut oil, bilangan peroksida VCO yang diperbolehkan adalah maksimal 3 meq/kg.
Pada penelitian ini bilangan peroksida hanya diuji pada perolehan rendemen
VCO tertinggi dan terendah. Dimana perolehan VCO tertinggi diperoleh pada
penambahan konsentarsi inokulum 10% dengan lama fermentasi 24 jam yaitu
sebanyak 113 ml (rendemen 28,25%) dan terendah diperoleh pada penambahan
inokulum 20% dengan lama fermentasi 12 jam yaitu sebanyak 60 ml VC0
(rendemen 15%).
Bilangan peroksida yang diperoleh pada rendemen VCO tertinggi yaitu
sebesar 0,4 meq/kg dan pada rendemen VCO terendah diperoleh bilangan
peroksida sebesar 1 meq/kg.
Menurut standar APCC (Asian and Pacific Coconut Community) untuk
virgin coconut oil, bilangan peroksida VCO yang diperbolehkan adalah maksimal
3 meq/kg.
Jika dilihat dari SNI dan standar APCC di atas maka bilangan peroksida
yang diperoleh pada penelitian ini masih sesuai dengan standar yang
diperbolehkan.
Iodine Value (Angka Iodin) VCO
Angka iod menjelaskan ketidakjenuhan asam lemak penyusun minyak dan
lemak. Asam lemak tidak jenuh mampu mengikat iod dan membentuk senyawaan
yang jenuh. Banyaknya iod yang diikat menunjukkan banyaknya ikatan rangkap.
Angka iod dinyatakan sebagai banyaknya gram iod yang diikat oleh 100 gram
minyak atau lemak [42].
Sama halnya dengan analisa bilangan peroksida, bilang iod juga hanya diuji
pada perolehan rendemen VCO tertinggi dan terendah. Dimana perolehan VCO
fermentasi 24 jam yaitu sebanyak 113 ml (rendemen 28,25%) dan terendah
diperoleh pada penambahan inokulum 20% dengan lama fermentasi 12 jam yaitu
sebanyak 60 ml VC0 (rendemen 15%).
Untuk rendemen VCO tertinggi, bilangan iod yang diperoleh sebesar 9,2406
dan pada rendemen VCO terendah memiliki bilangan iod sebesar 8,8441.
Menurut SNI, standar bilangan iodin yang diperbeolehkan adalah 5-20
dengan bobot sampel minyak ≥ 1,00 gram.
Pada standar APCC bilangan iod VCO yang diperbolehkan adalah sebesar
4,1-11.
Jika dilihat dari standar yang ada yaitu SNI dan standar APCC, besarnya
bilangan iodin yang diperoleh pada penelitian ini masih sesuai dengan standar
VCO yang sudah ditentukan.
Densitas (Berat Jenis) VCO
Massa jenis merupakan salah satu parameter yang digunakan untuk
menentukan kualitas suatu minyak, semakin tinggi nilai massa jenis maka kualitas
minyak tersebut rendah, hal ini dikarenakan kenaikan massa jenis dipengaruhi
asam lemak bebas [38].
Menurut Asian and Pacific Coconut Community (APCC) [45] untuk virgin
coconut oil, menyebutkan bahwa relative densitiy dari VCO yang diperbolehkan
adalah 0,915-0,920.
Pada penelitian ini analisa densitas hanya dilakukan pada perolehan
rendemen VCO tertinggi dan terendah. Untuk rendemen VCO tertinggi diperoleh
densitas VCO sebesar 0,9061 dan densitas untuk rendemen VCO terendah sebesar
0,9239.
Jika dilihat dari standar yang ada maka densitas VCO yang diperoleh pada
penelitian ini masih tidak sesuai dengan standar yang diperbolehkan. Hal ini
dikarenakan oleh karakterisitk air minyak serta zat-zat yang lolos pada saat
penyaringan minyak seperti kotoran, protein, garam mineral yang dapat
Analisa Gas Kromatografi VCO
Berikut ini adalah grafik dari hasil analisa asam-asam lemak dengan
[image:43.595.117.512.134.652.2]menggunakan alat gas kromatografi.
Gambar 4.5 Hasil Analisa Gas Kromatografi VCO pada Perlakuan Penambahan
Gambar 4.6 Hasil Analisa Gas Kromatografi VCO pada Perlakuan Penambahan
Inokulum 20% dan Waktu Fermentasi 12 Jam
Pada analisa ini kandungan asam-asam lemak yang terdapat pada VCO
masih sesuai dengan standar yang ada. Dalam hal ini kandungan asam lemak
tertinggi yang terdapat pada VCO adalah asam laurat. Dimana pada penelitian ini
analisa GC dilakukan pada rendemen tertinggi dan terendah. Dimana pada
terendah sebesar 50,08%. Menurut SNI kandungan asam laurat yang
diperbolehkan adalah 45,1-53,2%.
4.3 PERBANDINGAN PEROLEHAN VIRGIN COCONUT OIL (VCO) Tabel 4.2 menunjukkan perbandingan perolehan rendemen dan
karakteristik dari VCO yang diperoleh pada penelitian ini dengan Standar
Nasional Indonesia (SNI), Standar Asian and Pacific Coconut Community
(APCC) dan Philiphine National Standar (PNS).
Tabel 4.2 Perbandingan Rendemen dan Karakteristik VCO dari Penelitian indengan
Standar Asian and Pacific Coconut Community (APCC), Philiphine National Standar (PNS) dan Standar Nasional Indonesia (SNI)
Parameter Standar APCC
Philiphine Nasional Standar SNI Penelitian ini 10%, 24 jam 20%, 12 jam C6:0 (Asam kaproat) (%) 0,4-0,6 ND-0,7 ND-0,7 0,498 0,4416 C8:0 (Asam Kaprilat)
(%) 5,0-10,0 4,6-10 4,6-10,0 6,8894 6,7989
C10:0 (Asam kaprat) (%) 4,5-8,0 5,0-8,0 5,0-8,0 5,6473 5,9592 C12:0 (Asam laurat) (%) 43,0-53,0 45,1-53,2 45,1-53,2 48,3486 50,0801 C14:0 (Asam miristat)
(%) 16,0-21,0 16,8-21 16,8-21 18,9536 18,7669
C16:0 (Asam palmitat)
(%) 7,5-10 7,5-10,2 7,5-10,2 9,2637 8,5946
C18:0 (Asam stearat)
(%) 2,0-4,0 2,0-4,0 2,0-4,0 3,0187 2,7486
C18:1 (Asam oleat) (%) 5,0-10,0 5,0-10,0 5,0-10,0 6,0549 5,4159 C18:2 (Asam linoleat)
(%) 1,0-2,5 1,0-2,5 1,0-2,5 1,2298 1,1339
C20:0 (Asam arachidrat)
(%) <0,5 - - 0,0657 0,0602
C20:1 (%) - ND - 0,0303 -
Iodine value 4,1-11,00 - 4,1-11 9,2406 8,8441
Free fatty Acid (%) ≤0,5 0,2 maks 0,2 0,25 0,21
Peroxide value, meq/kg
oil max 3 3 maks 2,0 0,4 1
Densitas 0,915-0,920 - 0,9061 0,9239.
Pada penelitian ini terlihat bahwa kandungan VCO seperti asam-asam lemak
[image:45.595.85.544.329.699.2]ditentukan pada beberapa standar yang dirujuk sebagai teori pembanding
penelitian ini.
Tabel berikut memperlihatkan perbandingan hasil penelitian ini dengan penelitian
[image:46.595.109.515.163.752.2]yang sudah dilakukan oleh peneliti terlebih dahulu.
Tabel 4.3. Perbandingan Hasil Penelitian ini dengan Penelitian Sebelumnya No. Nama peneliti Metode Hasil penelitian
1. Fachry [3] Sentrifugasi Rendemen tertinggi 91 ml dari 200 ml
santan, kandungan asam laurat meurun
hingga dibawah standar yang ada seiring
bertambahnya kecepatan sentrifugasi,
warna: jernih
2. Witono [48] Enzimatis Warna: kehijauan, FFAnya tinggi
mencapai 0,6% (tidak sesuai dengan
standar) dan rendemen tertinggi 38,43%.
3. Ahmad [49] Pemanasan Warna: jernih, rendemen tertinggi 20%,
FFA sesuai standar yaitu 0,17%.
4. Asy’ari [50] Isolasi
pemancinag
n
Warna: jernih, FFAnya rendah yaitu
0,002, kandungan asam laurat 39,69%
(dibawah standar).
5. Raharja [36] Pembekuan Rendemen tertinggi: 23%, warna: jernih,
bilangan peroksida tinggi 0,6939 (tidak
sesuai dengan standar).
6. Penelitian ini Fermentasi Rendemen tertinggi 28,25%, warna:
jernih, bilangan peroksida untuk
rendemen tertinggi 0,4 meq/kg dan
rendemen terendah 1 meq/kg (sesuai
standar), bilangan iodin untuk rendemen
tertinggi 9,2406 dan rendemen terendah
8,8441 (sesuai standar), asam laurat
untuk rendemen tertinggi 48,3486 dan
rendemen terendah 50,0801 (sesuai
Dari perbandingan beberapa penelitian diatas dapat dilihat bahwa
penggunaan metode fermentasi masih lebih efektif jika dibandingkan dengan
metode-metode lain pada pembuatan VCO. Hal itu terlihat pada hasil yang
diperoleh pada setiap penelitian tersebut dimana masih ada parameter mutu VCO
yang belum sesuai dengan standar sementara pada metode fermentasi pada
penelitian ini parameter VCO yang diuji masih sesuai dengan standar yang ada.
Disamping biaya ekonomi yang lebih murah, proses pengerjaan metode ini juga
labih mudah untuk dilakukan dibanding metode sentrigugasi, pemanasan, isolasi
pemancingan, dan metode pembekuan. Jika dibandingkan dengan metode
enzimatis, metode ini juga efektif dari segi biaya dan juga dari tahap
pengerjaannya, hanya saja pada metode enzimatis ini VCO yang dihasilkan itu
sering terisolasi warna enzim yang digunakan sehingga warna VCO yang didapat
terkadang tidak jernih, dan juga angka FFAnya yang tinggi yang memicu
kerusakan VCO semakin cepat. Oleh karena itulah, melalui penelitian ini penulis
menyimpulkan bahwa pemilihan metode fermentasi ini lebih efektif pada
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang dapat diambil dari penelitian yang telah
dilakukan adalah :
1. Pengaruh penambahan inokulum
- Rendemen VCO yang diperoleh cenderung semakin meningkat seiring
dengan bertambahnya konsentrasi inokulum
- Rendemen VCO tertinggi yang diperoleh yaitu 28,25% pada penambahan
konsentrasi inokulum 10%. Sedangkan rendemen terendah yang diperoleh
sebesar 15% pada penambahan konsentrasi inokulum 20%.
- Kadar free fatty acid (FFA) semakin meningkat seiring bertambahnya konsentrasi inokulum.
2. Pengaruh lama fermentasi
- Virgin coconut oil belum terbentuk pada saat 6 jam fermentasi untuk semua variasi penambahan konsentrasi inokulum.
- Rendemen VCO yang diperoleh cenderung semakin meningkat seiring
dengan bertambahnya waktu fermentasi.
- Rendemen VCO tertinggi yang diperoleh yaitu 28,25% pada waktu
fermentasi 24 jam. Sedangkan rendemen terendah yang diperoleh sebesar
15% pada waktu fermentasi 12 jam.
- Kadar free fatty acid (FFA) semakin meningkat seiring bertambahnya waktu fermentasi.
3. Karakteristik virgin coconut oil (VCO)
- Analisa kualitatif virgin coconut oil (VCO) yang difermentasi dari santan kelapa menunjukkan beberapa karakteristik yaitu penampilan berupa
cairan jernih dengan bau yang khas kelapa segar.
- Bilangan peroksida untuk rendemen tertinggi yaitu 0,4 meq/kg dan
rendemen terendah memiliki bilangan peroksida 1 meq/kg, bilangan iodin
dan 8,8441, densitas untuk rendemen VCO tertinggi 0,9061 dan untuk
rendemen terendah o,9239.
- Kadar air pada rendemen tertinggi 0,25% dan rendemen terendah 0,239%
- Kandungan asam-asam lemak pada analisa gas kromatografi sesuai dengan
standar yang ada.
5.2 SARAN
Adapun saran yang dapat diberikan adalah :
1. Penelitian selanjutnya disarankan agar mengutamakan kebersihan selama
mulai persiapan bahan baku hingga proses pengerjaan penelitian selesai
karena sangat mempengaruhi jumlah dan kualitas minyak yang diperoleh.
2. Penelitian selanjutnya disarankan agar langsung melakukan penyaringan
minyak sesaat memisahkan air dari blondo dan minyak selesesai karena
jika penyaringan dilakukan lebih lama akan menyebabkan minyak
semakin mudah tengik.
3. Penelitian selanjutnya disarankan agar langsung melakukan analisa
terhadap virgin coconut oil sesaat setelah selesai melakukan penyaringan minyak, karena lama penyimpanan minyak sangat berpengaruh terhadap
BAB II
TINJAUAN PUSTAKA
2.1 Buah Kelapa
Kelapa atau Cocos nucifera termasuk tumbuhan berkeping satu suku palem-paleman. Tinggi tanaman ini dapat mencapai 20 samapi 25
meter, dan bisa hidup 80 hingga 100 tahun [13].
Kelapa (Cocos nucifera L) merupakan salah satu hasil pertanian Indonesia yang cukup potensial. Hampir semua bagian dari tanaman
tersebut dapat dimanfaatkan. Banyak kegunaan yang dapat diperoleh
dari kelapa dan salah satu cara untuk memanfaatkan buah kelapa adalah
mengolahnya menjadi minyak makan atau minyak goreng. Produk
kelapa yang paling berharga adalah minyak kelapa, yang dapat diperoleh
dari daging buah kelapa segar atau dari kopra [1].
Tanaman kelapa (Cocos nucifera L) merupakan tanaman yang sangat berguna dalam perekonomian di Indonesia. Karena semua bagian
dari pohon kelapa dapat dimanfaatkan untuk memenuhi kebutuhan
manusia. Salah satu bagian kelapa yang mempunyai banyak manfaat
adalah daging buah [14].
Salah satu bagian kelapa yang mempunyai banyak manfaat
adalah daging buah kelapa. Berikut tabel 2.1 yang memperlihatkan
[image:50.595.172.455.570.693.2]komposisi buah kelapa:
Tabel 2.1. Komposisi Buah Kelapa [14]
No Komponen Jumlah berat (%)
1. Sabut 25-32
2. Tempurung 12-13,1
3. Daging buah 28-34,9
4. Air buah 19,2-25
Buah Kelapa berbentuk bulat panjang dengan ukuran lebih
mesokarp), tempurung (endokarp), daging buah (endosperm) dan air buah.Tebal sabut kelapa lebih kurang 5 cm dan tebal daging buah 1 cm
atau lebih. Bunga betina tanaman kelapa akan dibuahai 18 – 25 hari
[image:51.595.239.469.190.344.2]setelah bunga berkembang dan buah akan menjadi masak (ripe) setelah 12 bulan [15].
Gambar 2.1 Bagian-bagian kelapa [1]
Keterangan:
1. Epicarp (lulit Luar)
2. Mesocarp (sabut)
3. Endocarp (tempurung)
4. Testa (kulit daging buah)
5. Endosperm (daging buah)
6. Lembaga
Berikut ini adalah taksonomi tanaman kelapa [15] :
Kingdom : Plantae
Phylum/divison : Spermatopyta
Klas : Monocotyledoneae
Ordo : Arales (Spadiciflorae)
Famili : Arecaceae (Palmae)
Sub famili : Cocoideae (Cocoinae)
Genus : Cocos
Spesies : Cocos nucifera (Linneaus)
Varietas :Genjah Kuning Nias, Jangkung Bali dan
sebagainya
2.2 Daging Kelapa
Daging buah kelapa digunakan untuk kebutuhan rumah tangga
sehari-hari, sebagai bahan pembuat kopra untuk minyak kelapa dan
[image:52.595.161.487.207.415.2]bungkil kopra sebagai bahan pakan ternak dalam bentuk pelet [16].
Gambar 2.2 Daging Kelapa [17]
Putih lembaga atau daging kelapa merupakan jaringan yang
berisi cadangan makanan untuk lembaga sebelum dapat memperoleh
makanan sendiri [13]. Putih lembaga ini mengandung [13] :
Air : 52 %
Minyak : 34 %
Zat putih telur : 3 %
Zat gula : 1,5 %
Zat abu : 1 %
Daging buah kelapa merupakan sumber protein dan lemak yang
baik. Komposisi daging buah kelapa dipengaruhi oleh umur buah [18].
Tabel 2.2 memperlihatkan komposisi kimia daging buah kelapa pada
Tabel 2.2. Komposisi Kimia Daging Buah Kelapa pada Berbagai Tingkat Kematangan
Analisis
(dalam 100 gr) Buah Muda
Buah
Setengah Tua Buah Tua
Kalori 68,0 kalori 180,0 kalori 359,0 kalori
Protein 1,0 g 4,0 g 3,4 g
Lemak 0,9 g 13,09 34,7 g
Karbohidrat 14,0 g 10,0 g 14,0 g
Kalsium 17,0 mg 8,0 mg 21,0 mg
Fosfor 30,0 mg 35,0 mg 21,0 mg
Besi 1,0 mg 1,3 mg 2,0 mg
Thiamin 0,0 mg 0,5 mg 0,1 mg
Asam askorbat 4,0 mg 4,0 mg 2,0 mg
Air 83,3 g 70,09 g 46,9 g
Bagian yang dapat
dimakan 53,0 g 53,0 g 53,0 g
2.3 Santan Kelapa
Pada dasarnya, santan adalah emulsi antara minyak, protein, dan
air. Emulsi dapat diartikan sebagai campuran dari dua cairan atau lebih
yang saling tidak melarutkan, di mana cairan yang satu terdispersi dalam
bentuk globula-globula atau butir-butir kecil dalam cairan lainnya.
Kestabilan emulsi cair dapat rusak akibat pemanasan, pendinginan,
proses sentrifugasi [5].
Santan merupakan emulsi minyak dalam air alami berwarna
putih susu yang diekstrak dari daging buah kelapa tua baik dengan atau
tanpa penambahan air. Bila santan didiamkan, secara perlahan akan
terjadi pemisahan. Bagian yang kaya dengan minyak disebut sebagai
krim, dan bagian yang miskin dengan minyak disebut dengan skim.
Krim lebih ringan dibanding skim [19].
Santan mengandung air yang tinggi serta lemak dan protein
pada umumnya adalah untuk bahan campuran masak dan pembuatan kue
[20].
Santan kelapa biasanya bertahan kurang dari sepuluh jam dalam
suhu ruang 25-300C dan bisa bertahan lebih dari dua puluh empat jam dalam lemari es. Santan juga mudah rusak jika dipanaskan pada suhu
yang relatif tinggi. Santan kelapa mengandung tiga nutrisi utama, yaitu
lemak sebesar 88,3%, protein sebesar 6,1% dan karbohidrat sebesar
5,6% [21].
Santan kelapa diperoleh dari ekstrak kelapa dengan
menggunakan pelarut air. Banyaknya air santan yang diperoleh sangat
tergantung pada banyaknya air yang ditambahkan pada saat pembuatan
santan. Berdasarkan hasil penelitian diketahui bahwa pemerasan parutan
kelapa tanpa air diperoleh emulsi minyak dalam air yang mengandung
minyak sekitar 41- 44%, air sekitar 46%, zat padat bebas lemak sekitar
10%, dan protein sekitar 4,8%. Bahan tersebut dinamakan sebagai krim kelapa atau “cocos cream” [22].
2.4 Minyak Kelapa Murni
VCO merupakan minyak kelapa murni yang terbuat dari daging kelapa segar yang diolah dalam suhu rendah atau tanpa melalui pemanasan. Kandungan yang penting dalam minyak tetap dapat dipertahankan, dan minyak mempunyai warna lebih jernih [23]. Minyak kelapa murni mengandung asam laurat yang tinggi (45-55%) , disamping itu juga
mengandung asam lainnya. Asam laurat adalah lemak jenuh dengan rantai sedang
atau disebut trigliserida rantai sedang (medium chain triglycerida) atauMCT [24]. Minyak kelapa mengandung 84 % trigliserida yang ketiga asam lemaknya
jenuh, 12 % trigliserida dengan dua asam lemak jenuh dan satu asam lemak tidak
jenuh dan 4 % trigliserida yang mempunyai satu asam lemak jenuh dan dua asam
lemak tidak jenuh. Minyak kelapa dikenal sebagai minyak laurat karena sebagian
besar asam lemak penyusunnya adalah asam laurat. Minyak kelapa mengandung
lebih kurang 90 % asam lemak jenuh yang terdiri dari asam laurat, miristat dan
Berikut Tabel 2.3 mengenai standar mutu VCO menurut Standar Nasional
[image:55.595.113.515.131.329.2]Indonesia:
Tabel 2.3. Standar Mutu VCO menurut SNI [25]
Karakteristik Kandungan
Kadar air Maksimal 0,2
Bilangan Peroksida (mg Oksigen/kg) Maksimal 2,0
Bilangan iod (mg KOH/g contoh) 4,1-11,0
Bilangan Asam (mg KOH/g contoh) Maksimal 10
Kadar Asam Lemak Bebas Maksimal 0,2( % asam
laurat)
warna Tidak berwarna hingga
kuning pucat
2.5 Saccharomyces cerevisiae
Saccharomyces cerevisiae merupakan khamir yang banyak digunakan dalam industri fermentasi dan sebagai jasad model dalam
penelitian-penelitian biologi molekular [26].
Saccharomyces cerevisiae merupakan khamir sejati tergolong eukariot yang secara morfologi hanya membentuk blastospora berbentuk
bulat lonjong, silindris, oval atau bulat telur yang dipengaruhi oleh
strainnya seperti terlihat pada Gambar 2.3. Khamir ini dapat berkembang
biak dengan membelah diri melalui "budding cell". Reproduksinya dapat dipengaruhi oleh keadaan lingkungan serta jumlah nutrisi yang tersedia
bagi pertumbuhan sel. Penampilan makroskopik mempunyai koloni
berbentuk bulat, warna kuning muda, permukaan berkilau, licin, tekstur
Gambar 2.3 Mikroba Saccharomyces cerevisiae [27]
Berikut adalah taksonomi Saccharomyces [27]: Super Kingdom : Eukaryota
Phylum : Fungi
Subphylum : Ascomycota
Class : Saccharomycetes
Order : Saccharomycetales
Family : Saccharomycetaceae
Genus : Saccharomyces
Species : Saccharomyces cerevisiae
Khamir dapat berkembang biak dalam gula sederhana seperti
glukosa, maupun gula kompleks disakarida yaitu sukrosa. Selain itu
untuk menunjang kebutuhan hidup diperlukan oksigen, karbohidrat, dan
nitrogen . Pada uji fermentasi gulagula mempunyai reaksi positif pada
gula dekstrosa, galaktosa, sukrosa, maltosa, raffinosa, trehalosa, dan
negatif pada gula laktosa [27].
2.6 Fermentasi
Fermentasi merupakan suatu proses terjadinya perubahan
agen-agen biologis terutama enzim sebagai biokatalis. Karena bahan ini
hasil proses mikrobial maka disebut produk fermentasi [28].
Fermentasi adalah suatu proses dimana komponen-komponen
kimiawi dihasilkan sebagai akibat adanya pertumbuhan maupun
metabolisme mikroba. Fermentasi dapat meningkatkan nilai gizi bahan
yang berkualitas rendah serta berfungsi dalam pengawetan bahan dan
merupakan suatu cara untuk menghilangkan zat antinutrisi atau racun
yang terkandung dalam suatu bahan makanan [29].
Makanan yang mengalami fermentasi biasanya mempunyai nilai
gizi yang tinggi daripada bahan asalnya. Tidak hanya disebabkan karena
mikroba bersifat katabolik atau memecah komponen yang komplek
menjadi zat-zat yang lebih sederhana sehingga lebih mudah dicerna,
tetapi mikroba juga dapat mensintesa beberapa vitamin yang kompleks.
Melalui fermentasi juga dapat terjadi pemecahan oleh enzim-enzim
tertentu terhadap bahan-bahan yang tidak dapat dicerna oleh manusia
[14].
Ada tiga karakteristik penting yang harus dimiliki oleh
mikroorganisme bila akan digunakan dalam fermentasi, yaitu :
1. Mikrobiologi harus mampu tumbuh dengan cepat dalam suatu substrat dan
lingkungan yang cocok dan mudah untuk dibudidayakan dalam jumlah
besar.
2. Organisme harus memiliki kemampuan untuk mengatur ketahanan
fisiologis dalam kondisi seperti di atas, dan menghasilkan enzim-enzim
essensial dengan mudah dan dalam jumlah besar agar
perubahan-perubahan kimia yang dikehendaki dapat terjadi.
3. Kondisi lingkungan yang diperlukan bagi pertumbuhan dan produksi
maksimum secara komparatif harus sederhana [14].
Untuk memperoleh hasil yang optimum, persyaratan untuk pertumbuhan ragi
harus diperhatikan, yaitu :
1. pH dan kadar karbohidratnya dari substrat
2. Temperatur selama fermentasi
Fermentasi dapat terjadi karena adanya aktifitas mikroba
penyebab fermentasi pada subsrat organik yang sesuai. Faktor-faktor
yang mempengaruhi fermentasi antara lain :
a