PEMERIKSAAN KANDUNGAN MINERAL KALSIUM,
KALIUM DAN NATRIUM PADA
APEL HIJAU (Pyrus malus, L.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
WINDA SRI UTAMI HSB
NIM 091501011
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PEMERIKSAAN KANDUNGAN MINERAL KALSIUM,
KALIUM DAN NATRIUM PADA
APEL HIJAU (Pyrus malus, L.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
SKRIPSI
Diajukan untuk melengkapi salah satu syarat memperoleh
gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
WINDA SRI UTAMI HSB
NIM 091501011
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
PEMERIKSAAN KANDUNGAN
MINERALKALSIUM,KALIUM DAN NATRIUM PADA
APEL HIJAU (Pyrus malus, L.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
OLEH:
WINDA SRI UTAMI HSB
NIM 091501011
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal : 14 Juni 2013
Pembimbing I, Panitia Penguji,
Dra. Masfria, M.S., Apt. Drs. Fathur Rahman Harun, M.Si., Apt. NIP 195707231986012001 NIP 195201041980031002
Dra. Masfria, M.S., Apt. Pembimbing II, NIP 195707231986012001
Drs. Chairul Azhar Dalimunthe., M.Sc., Apt. Dra.Sudarmi, M.Si.,Apt. NIP 194907061980021001 NIP195409101983032001
Dra Siti Nurbaya, M.Si., Apt. NIP 195008261974122001
Medan, Juli 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
KATA PENGANTAR
Bismillahirrahmanirrahiim,
Puji syukur penulis ucapkan kepada Allah SWT atas segala limpahan rahmat dan karunianya, sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini, serta shalawat beriring salam untuk Rasulullah Muhammad SAW sebagai suri tauladan dalam kehidupan. Skripsi ini disusun untuk melengkapi salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul Pemeriksaan Kandungan Mineral Kalsium, Kalium dan Natrium pada Apel Hijau ( Pyrus
malus, L.) secara Spektrofotometri Serapan Atom.
Penulis juga mengucapkan terima kasih dan penghargaan yang tiada terhingga kepada Ayahanda Syafruddin Hsb dan Ibunda Asrina Nst, yang telah memberikan cinta dan kasih sayang yang tidak ternilai dengan apapun, pengorbanan baik materi maupun motivasi beserta doa yang tulus yang tidak pernah berhenti. Abangku tercinta Andi Surahman Tagor Hsb dan adikku tercinta Windi Layla Sari Hsb, Wanda Rahmadhani Hsb serta seluruh keluarga yang selalu mendoakan dan memberikan semangat. Sahabat-sahabat terbaikku Farmasi 2009 serta semua pihak yang tidak dapat disebutkan satu persatu yang telah banyak membantu hingga selesainya penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa dalam penulisan skripsi ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati, penulis menerima kritik dan saran demi kesempurnaan skripsi ini. Akhirnya, penulis berharap semoga skripsi ini dapat memberi manfaat bagi kita semua.
Medan, 14 Juni2013 Penulis,
PEMERIKSAAN KANDUNGAN MINERALKALSIUM, KALIUM DAN NATRIUM PADA APEL HIJAU ( Pyrus malus, L.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Apel hijau merupakan salah satu buah yang sanga tpopuler dan banyak dikonsumsi oleh masyarakat dalam bentuk minuman dengan cara dibuat jus. Disamping itu, masyarakat juga mengkonsumsi apel hijau dengan cara dimakan langsung baik dikupas maupun tanpa kupas. Apel Hijau mengandung berbagai mineral penting yang dibutuhkan oleh tubuh, yaitu kalium, kalsium, fosfor, natrium, magnesium danzatbesi. Umumnya kandungan kalium dan kalsium pada buah- buahan dan sayuran banyak terdapat pada kulit buah ataupun kulit biji. Kandungan natrium pada apel hijau banyak terdapat pada daging buah.Tujuan dari penelitian ini adalah untuk mengetahui perbedaan kadar mineral kalsium, kalium dan natrium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas. Apel yang digunakan adalah apel Granny Smith yang berasal dari Australia.
Penetapan kadar ketiga mineral dilakukan dengan menggunakan alat spektrofotometer serapan atom menggunakan nyala udara-asetilen pada panjang gelombang 422,7 nm untuk kalsium, kalium pada 766,5 nm dan natrium pada 589,0 nm.
Hasil penelitian menunjukkan kadar kalsium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas adalah 1,6269 ± 0,1085mg/100 g dan 2,2302 ± 0,3178 mg/100 g. Kadar kalium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas adalah281,6260±19,7426 mg/100g dan337,8728 ±38,2576 mg/100g. Kadar natrium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas adalah 6,0849 ± 0,4488 mg/100 g dan 5,7784 ± 0,6030 mg/100 g. Dari ketiga mineral, kalium mempunyai kadar yang lebih tinggi dari kalsium dan natrium baik yang dikupas maupun tanpa dikupas. Secara statistik, uji beda rata-rata kandungan kalsium, kalium dan natrium antara apel hijau yang kulitnya dikupas dan tanpa dikupas dengan menggunakan distribusi t, menyimpulkan bahwa kandungan kalsium, kalium dalam apel hijau tanpa dikupas lebih tinggi secara signifikan dari apel hijau kupas. Kandungan natrium dengan kulit dikupas dan tanpa dikupas tidak terdapat perbedaan yang signifikan dengan menggunakan uji F.
IDENTIFICATION OF CALCIUM, POTASSIUMAND NATRIUM IN GREEN APPLE ( Pyrus malus, L.) BY ATOMIC ABSORPTION
SPECTROPHOTOMETRY
ABSTRACT
Green apple is one of the most popular’s fruitthat often consumed by the citizien form in drinks by blend it or made in juice form. Besides that, the people also consume green apple by eating with peeled or without peeled. Green apple contains many important minerals for our body, such as potassium, calsium, phosphorus, sodium, magnesium and iron. Generally, potassium and calcium contentsin fruits and vegetables at high amount in fruit peel or seed coat, while sodium content in green apple at high amount in the fruit flesh. The purpose of this research was to know the different level of calcium, potassium and sodium in peeled or without peeled green apple. Apple used is Granny Smith apple from Australia.
The identification of these mineral was done by using atomic absorption spectrophotometry acetylene-air flame with the wavelength at 422.7 nm for calcium, at 766.5 nm for potassium and sodium at 589.0 nm.
The result showed that the levels of calcium in peeled green apple and whitout peeled were 1,6269 ± 0,1085 mg/100 g and 2,2302 ± 0,3178 mg/100 g. The levels of potassium in peeled green apple and whitout peeled were 281,6260 ± 19,7426 mg/100 g and 337,8728 ± 38,2576 mg/100 g. The levels of natrium peeled green apple and whitout peeled were 6,0849 ± 0,4488 mg/100 g and 5,7784 ± 0,6030 mg/100 g. From determination showed that at the three minerals, potassium has the higher mineral level in peeled or without peeled green aple than calsium and sodium in peeled green apple and without peeled.Statistically, the average difference test potassium and calsium content between peele dgreen apple and whitout peeled used the t distribution, concluded that the content of potassium, and calsium in green apple without peeled were significantly higher than peeled green apple, sodium were not significantly between peeled green apple and whitout peeled used the f test.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
KATA PENGANTAR ... iv
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Apel Hijau ... 5
2.2 Mineral ... 9
2.2.1 Kalsium ... 10
2.2.2 Kalium ... 11
2.3 Spektrofotometri Serapan Atom ... 12
2.3.1 Gangguan-gangguan pada Spektrofotometri Serapan Atom ... 15
2.4 Validasi Metode Analisis ... 16
BAB III METODE PENELITIAN ... 19
3.1 Tempat dan Waktu Penelitian ... 19
3.2 Bahan-bahan ... 19
3.2.1 Sampel ... 19
3.2.2 Pereaksi ... 19
3.3 Alat-alat ... 19
3.4 Pembuatan Pereaksi ... 20
3.4.1 Larutan HNO3 (1:1) ... 20
3.4.2 Larutan Asam Pikrat 1% b/v ... 20
3.4.3 Larutan H2SO4 1 N ... 20
3.5 Prosedur Penelitian ... 20
3.5.1 Pengambilan Sampel ... 20
3.5.2 Penyiapan Sampel ... 20
3.5.3 Proses Destruksi Kering ... 21
3.5.4 Pembuatan Larutan Sampel ... 21
3.5.5 Pemeriksaan Kualitatif ... 22
3.5.5.1 Kalsium ... 22
3.5.5.1.1 Uji Nyala Ni/Cr ... 22
3.5.5.1.2 Uji Kristal Kalsium dengan Asam Sulfat 1N ... 22
3.5.5.2.1 Uji Nyala Ni/Cr ... 22
3.5.5.2.2 Uji Kristal Kalium dengan Asam Pikrat ... 22
3.5.5.3 Natrium ... 23
3.5.5.3.1 Uji Nyala Ni/Cr ... 23
3.5.5.3.2 Uji Kristal Natrium dengan Asam Pikrat ... 23
3.5.6 Pemeriksaan Kuantitatif ... 23
3.5.6.1 Pembuatan Kurva Kalibrasi Kalsium ... 23
3.5.6.2 Pembuatan Kurva Kalibrasi Kalium ... 24
3.5.6.3 Pembuatan Kurva Kalibrasi Natrium ... 26
3.5.6.4 Penetapan Kadar Kalsium, Kalium, dan Natrium dalam Sampel ... 24
3.5.6.4.1 Penetapan Kadar Kalsium ... 24
3.5.6.4.2 Penetapan Kadar Kalium ... 24
3.5.6.4.3 Penetapan Kadar Natrium ... 26
3.5.7 Analisis Data Secara Statistik ... 27
3.5.7.1 Penolakan Hasil Pengamatan ... 27
3.5.7.2 Pengujian Beda Nilai Rata-rata antar Sampel ... 27
3.5.8 Uji Perolehan Kembali (Recovery) ... 28
3.5.9 Simpangan Baku Relatif ... 29
3.5.10 Penentuan Batas Deteksi dan Kuantitasi ... 30
BAB IV HASIL DAN PEMBAHASAN ... 31
4.1 Analisis Kualitatif ... 31
4.2.1 Kurva Kalibrasi Logam Kalsium, Kalium, dan
Natrium ... 32
4.2.2 Analisis Kadar Kalsium, Kalium, dan Natrium dalam Apel Hijau Kupas dan Tanpa Kupas ... 34
4.2.3 Uji Perolehan Kembali (Recovery) ... 36
4.2.4 Simpangan Baku Relatif ... 37
4.2.5 Batas Deteksi dan Batas Kuantitasi ... 37
BAB V KESIMPULAN DAN SARAN ... 38
5.1 Kesimpulan ... 38
5.2 Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Tabel Halaman
1 Hasil Analisis Kualitatif dalam Sampel Apel hijau yang kulitnya dikupas Dan tanpa dikupas yang Telah Didestruksi... 31 2 Hasil Analisis Kadar Kalsium, Kalium dan Natrium dalam
Sampel ... ... 35 3 Hasil Uji Beda nilai rata-rata kadar kalsium, kaliumdan
natrium antar sampel ... 35 4 Persen Uji Perolehan Kembali (recovery) kadar kalsium,
DAFTAR GAMBAR
Gambar Halaman
DAFTAR LAMPIRAN
Lampiran Halaman
1 Hasil Identifikasi/Determinasi Tumbuhan Apel Hijau ... 41
2 Gambar Apel Hijau (Pyrus malus,L.) ... 42
3 Bagan Alir Proses Destruksi Kering ... 43
4 Bagan Alir Proses Pembuatan Larutan Sampel ... 44
5 Hasil Analisis Kualitatif Kalsium, Kalium dan Natrium ... 45
6 Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 47
7 Data Kalibrasi Kalium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi Dan Koefisien Korelasi (r) ... 48
8 Data Kalibrasi Natrium dengan Spektrofotometer Serapan Atom, Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r) ... 49
9 Hasil Analisis Kadar Kalsium, Kalium dan Natrium Dalam Apel Hijau yang Kulitnya Dikupas ... 50
10 Hasil Analisis Kadar Kalsium, Kalium dan Natrium Dalam Apel Hijau Yang kulitnya tanpa dikupas ... 50
11 Contoh Perhitungan Kadar Kalsium, Kalium dan Natrium dalam Apel Hijau yang Kulitnya Dikupas ... 52
12 Contoh Perhitungan Kadar Kalsium, Kaliumdan Natrium dalam Apel Hijau yang Kulitnya Tanpa Dikupas .. 53
13 Perhitungan Statistik Kadar Kalsium dalam Sampel ... 54
14 Perhitungan Statistik Kadar Kalium dalam Sampel ... 57
15 Perhitungan Statistik Kadar Natrium dalam Sampel ... 60
17 Pengujian Beda Nilai Rata-rata Kadar Kalium pada
Sampel Apel Hijau Kupas dan Tanpa Kupas ... 66 18 Pengujian Beda Nilai Rata-rata Kadar Natrium pada
Sampel Apel Hijau Kupas dan Tanpa Kupas ... 68 19 Hasil Analisis Kadar Kalsium, Kalium dan Natrium
Setelah Penambahan Masing-masing Larutan Baku
pada Apel Hijau Kupas ... 70 20 Contoh Perhitungan Uji Perolehan Kembali Kadar
Kalsium, Kalium dan Natrium dalam Apel Hijau Kupas
... 71 21 Perhitungan Simpangan Baku Relatif (RSD) Kadar
Kalsium, Kalium dan Natrium dalam Apel Hijau Kupas
... 74 22 Perhitungan Batas Deteksi dan Batas Kuantitasi ... 76 23 Gambar Alat Spektrofotometer Serapan Atom dan
PEMERIKSAAN KANDUNGAN MINERALKALSIUM, KALIUM DAN NATRIUM PADA APEL HIJAU ( Pyrus malus, L.) SECARA
SPEKTROFOTOMETRI SERAPAN ATOM
ABSTRAK
Apel hijau merupakan salah satu buah yang sanga tpopuler dan banyak dikonsumsi oleh masyarakat dalam bentuk minuman dengan cara dibuat jus. Disamping itu, masyarakat juga mengkonsumsi apel hijau dengan cara dimakan langsung baik dikupas maupun tanpa kupas. Apel Hijau mengandung berbagai mineral penting yang dibutuhkan oleh tubuh, yaitu kalium, kalsium, fosfor, natrium, magnesium danzatbesi. Umumnya kandungan kalium dan kalsium pada buah- buahan dan sayuran banyak terdapat pada kulit buah ataupun kulit biji. Kandungan natrium pada apel hijau banyak terdapat pada daging buah.Tujuan dari penelitian ini adalah untuk mengetahui perbedaan kadar mineral kalsium, kalium dan natrium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas. Apel yang digunakan adalah apel Granny Smith yang berasal dari Australia.
Penetapan kadar ketiga mineral dilakukan dengan menggunakan alat spektrofotometer serapan atom menggunakan nyala udara-asetilen pada panjang gelombang 422,7 nm untuk kalsium, kalium pada 766,5 nm dan natrium pada 589,0 nm.
Hasil penelitian menunjukkan kadar kalsium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas adalah 1,6269 ± 0,1085mg/100 g dan 2,2302 ± 0,3178 mg/100 g. Kadar kalium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas adalah281,6260±19,7426 mg/100g dan337,8728 ±38,2576 mg/100g. Kadar natrium dalam apel hijau yang kulitnya dikupas dan tanpa dikupas adalah 6,0849 ± 0,4488 mg/100 g dan 5,7784 ± 0,6030 mg/100 g. Dari ketiga mineral, kalium mempunyai kadar yang lebih tinggi dari kalsium dan natrium baik yang dikupas maupun tanpa dikupas. Secara statistik, uji beda rata-rata kandungan kalsium, kalium dan natrium antara apel hijau yang kulitnya dikupas dan tanpa dikupas dengan menggunakan distribusi t, menyimpulkan bahwa kandungan kalsium, kalium dalam apel hijau tanpa dikupas lebih tinggi secara signifikan dari apel hijau kupas. Kandungan natrium dengan kulit dikupas dan tanpa dikupas tidak terdapat perbedaan yang signifikan dengan menggunakan uji F.
IDENTIFICATION OF CALCIUM, POTASSIUMAND NATRIUM IN GREEN APPLE ( Pyrus malus, L.) BY ATOMIC ABSORPTION
SPECTROPHOTOMETRY
ABSTRACT
Green apple is one of the most popular’s fruitthat often consumed by the citizien form in drinks by blend it or made in juice form. Besides that, the people also consume green apple by eating with peeled or without peeled. Green apple contains many important minerals for our body, such as potassium, calsium, phosphorus, sodium, magnesium and iron. Generally, potassium and calcium contentsin fruits and vegetables at high amount in fruit peel or seed coat, while sodium content in green apple at high amount in the fruit flesh. The purpose of this research was to know the different level of calcium, potassium and sodium in peeled or without peeled green apple. Apple used is Granny Smith apple from Australia.
The identification of these mineral was done by using atomic absorption spectrophotometry acetylene-air flame with the wavelength at 422.7 nm for calcium, at 766.5 nm for potassium and sodium at 589.0 nm.
The result showed that the levels of calcium in peeled green apple and whitout peeled were 1,6269 ± 0,1085 mg/100 g and 2,2302 ± 0,3178 mg/100 g. The levels of potassium in peeled green apple and whitout peeled were 281,6260 ± 19,7426 mg/100 g and 337,8728 ± 38,2576 mg/100 g. The levels of natrium peeled green apple and whitout peeled were 6,0849 ± 0,4488 mg/100 g and 5,7784 ± 0,6030 mg/100 g. From determination showed that at the three minerals, potassium has the higher mineral level in peeled or without peeled green aple than calsium and sodium in peeled green apple and without peeled.Statistically, the average difference test potassium and calsium content between peele dgreen apple and whitout peeled used the t distribution, concluded that the content of potassium, and calsium in green apple without peeled were significantly higher than peeled green apple, sodium were not significantly between peeled green apple and whitout peeled used the f test.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Mineral merupakan salah satu unsur yang memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg/hari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg/hari. Mineral makro adalah natrium, klorida, kalium, kalsium, fosfor, magnesium dan sulfur, sedangkan yang termasuk mineral mikro, seperti besi, seng, iodium dan selenium (Almatsier, 2004).
Banyak mineral esensial yang didistribusikan secara luas dalam makanan, dan kebanyakan orang mengkonsumsi makanan mungkin untuk mendapatkan asupan yang memadai. Jumlah yang dibutuhkan per hari bervariasi, mulai dari beberapa gram untuk natrium, kalsium, besi, seng sampai mikrogram per hari (Murray, dkk. 2009).
Kalsium merupakan mineral yang paling banyak terdapat dalam tubuh, yaitu 1,5 – 2 % dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Mineral kalsium dibutuhkan untuk perkembangan tulang. Jumlah yang dianjurkan per hari untuk anak-anak sebesar 500 mg, remaja 600-700 mg dan dewasa sebesar 500-800 mg. Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan gangguan pertumbuhan. Tulang kurang kuat, mudah bengkak dan rapuh (Almatsier, 2004).
Kebutuhan natrium didasarkan pada kebutuhan untuk pertumbuhan, kehilangan natrium melalui keringat dan sekresi lain. Dianjurkan untuk membatasi konsumsi garam dapur hingga 6 gram sehari (ekivalen dengan 2400 mg natrium). Pembatasan ini dilakukan karena peranan potensial natrium dalam menimbulkan tekanan darah tinggi (Almatsier, 2004).
Apel hijau merupakan salah satu buah yang sangat populer dan banyak dikonsumsi
oleh masyarakat dalam bentuk minuman dengan cara dibuat jus. Disamping itu, Masyarakat
juga mengkonsumsi apel hijau dengan cara dimakan langsung baik dikupas maupun tanpa
kupas.Buah ini bermanfaat untuk kesehatan karena mengandung gizi yang cukup tinggi
antara lain: 58 kkal energi; 4 g lemak; 3 g protein; 14,9 g karbohidrat; 900 IU vitamin A; 7
mg tiamin; 3 mg riboflavin; 2 mg niacin; 5 mg vitamin C; 0,04 mg vitamin B1; 0,04 mg
vitamin B2; 6 mg/100 g kalsium; 3 mg/100g zat besi; 10 mg/100 fosfor, dan 130
mg/100gkalium (Anonim, 2009).
Buah dan sayuran yang mengandung kalium baik dikonsumsi penderita darah tinggi, karenakeberadaan kalium sangat penting untuk mengimbangi natrium, kalium bersifat hipotensif, yaitu memiliki efek penurunan tekanan darah. Oleh karena itu, rasio kalium terhadap natrium yang tinggi berperan penting dalam pencegahan hipertensi (Astawan, 2009).Kebutuhan kalium diperkirakan sebesar 2000 mg/hari (Almatsier, 2004).
Umumnya kandungan kalium dan kalsium pada buah- buahan dan sayuran banyak terdapat pada kulit buah ataupun kulit biji (Astawan,2009). Kandungan natrium pada apel hijau banyak terdapat pada daging buah (Anonim, 2009).
serapan atom, gravimetri. Penetapan kadar natrium dapat dilakukan dengan metode spektrofotometri serapan atom dan metode gravimetri (Bassett, dkk., 1994).
Berdasarkan uraian di atas, penulis meneliti kandungan kalium, kalsium dan natrium yang terdapat pada apel hijau yang kulitnya dikupas dan tanpa dikupas.
1.2 Perumusan Masalah
Berdasarkan uraian di atas, maka permasalahan dalam penelitian ini dapat dirumuskan sebagai berikut:
a. Berapakah kadar kalium, kalsium dan natrium pada apel hijau yang kulitnya dikupas dan tanpa dikupas.
b. Apakah ada perbedaan kadar dari ketiga mineral kalium, kalsium dan natrium pada buah apel hijau yang kulitnya dikupas dan tanpa dikupas.
1.3 Hipotesis
Hipotesis dalam penelitian ini adalah:
a. Apel hijau mengandung kalium, kalsium dan natrium dalam jumlah tertentu. b. Terdapat perbedaan kadar kalium, kalsium dan natrium pada apel hijau yang
kulitnya dikupas dan tanpa dikupas.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah:
a. Untuk mengetahui kadar kalsium, kalium dan natrium padaapel hijau yang kulitnya dikupas dan tanpa dikupas.
b. Untuk mengetahui perbedaankadar kalium, kalsium dan natrium pada apel hijau yang dikupas dan tanpa dikupas.
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA
2.1 Apel Hijau
Apel Hijau merupakan buah yang kaya akan serat dan antioksidan yang tinggi. Kulitnya yang berwarna merah atau hijau memiliki kandungan quercetin yang bisa membantu melindungi dari penyakit jantung dan alergi. Kandungan gizi dalam 100 gram; kalsium 6 gram, energi 58 kal, protein 0,3 gram, lemak 0,4 gram, karbohidrat 14,9 gram, fosfor, natrium, magnesium, zat besi, vit. A, vit.B kompleks, vit.C, serat kasar (pektin), asam felonik, kalium, flavonoid dan zat fitokimia. Menurut penelitian apel juga dapat membersihkan dan memutihkan gigi (Anonim, 2009).
Menurut Herbarium Medanense (2012), klasifikasi apel hijau adalah sebagai berikut: Kingdom : Plantae
Divisio : Spermatophyta Class : Dicotyledoneae Ordo : Rosales
Famili : Rosaceae Genus : Pyrus
Spesies : Pyrus malus L
Menurut Sufrida, dkk., (2004), menyebutkan bahwa laki-laki dan perempuan yang makan satu apel setiap harinya beresiko lebih rendah terkena stroke daripada mereka yang jarang mengkonsumsi apel. Mereka menyatakan penalitian yang pernah dilakukan terhadap lebih dari 9000 orang sehat, baik pria maupun wanita yang berumur 15 tahun, menunjukkan pria yang makan lebih dari 54 g apel per hari dan wanita yang makan apel 71 g apel per hari beresiko lebih rendah terkena stroke dibandingkan mereka yang sedikit makan apel.
Ada beberapa jenis apel, diantaranya yaitu : a. Apel Manalagi
Apel ini memiliki rasa yang manis walaupun masih muda dan aromanya harum. Diameter buah ini berkisar antara 5-7 cm dengan berat 75-160 gram per buahnya. Daging buahnya berawarna putih, kadar airnya hanya 84,05%.Bentuk bijinya bulat dengan ujung tumpul dan berwarna cokelat tua (Sufrida, dkk., 2004).
b. Apel Rome Beauty
Apel jenis ini merupakan apel yang paling banyak ditanam petani di daerah Batu Malang yaitu sekitar 70%. Kulitnya tebal berwarna merah pudar, daging buahnya berwarna putih kekuningan. Memiliki kandungan air hingga 86,65%. Diameter buah ini berkisar antara 5 –12 cm denganberat 70 –300 gram per buahnya (Sufrida, dkk., 2004).
c. Apel Gala (Royal Gala)
Apel ini merupakan hasil persilangan antara jenis apel kidds orange red dengan apel golden delicious. Menurut penelitian buah ini berasal dari Selandia Baru, yang ditemukan oleh J. H Kidd pada tahun 1934. Bentuknya bulat berukuran sedang dengan warna semburat kuning dan jingga kemerahan. Tekstur daging buah renyah dan warna putih kekuningan (Sufrida, dkk., 2004).
d. Apel Fuji
e. Apel Anna
Apel ini mempunyai aroma yang kuat dengan rasa agak asam. Kadar air dan kandungan vitamin C-nya cukup tinggi. Apel anna berbentuk lonjong seperti trapesium terbalik. Kulit buahnya halus tetapi tipis dan berwarna merah tua. Kadar airnya sekitar 84,12%(Sufrida, dkk., 2004).
f. Apel Mc. Intosch
Apel ini mempunyai aroma yang kuat dengan rasa yang sangat asam. Apel ini berwarna merah tua dengan ukuran yang sangat bervariasi. Rasa apel ini sangat renyah, lembut dan kandunagn airnya banyak ( Sufrida, dkk., 2004).
g. Apel Mutsu
Apel ini merupakan perpaduan antara apel jenis golden delicious dan indo di Jepang yang dikawinsilangkan pada tahun 1930. Buahnya berwarna hijau dengan garis kuning ditepinya (Sufrida, dkk., 2004).
h. Apel Princess Noble
Apel ini dikenal juga dengan sebutan apel australia, Karen aapel ini didatangkan dari Australia pada tahun 1932. Warna kulitnya hijau kekuningan dengan bintik-bintik putih. Memiliki pori-pori yang halus dan renggang. Tangkai buahnya panjang dan kecil berwarna hijau, kadar airnya 86,35% dan rasanya asam (Sufrida, dkk., 2004).
i. Apel Granny Smith
j. Apel Golden Delicious
Golden delicious merupakan jenis apel yang paling banyak ditanam di dunia. Apel yang berasal dari Amerika ini ditemukan oleh A.H. Mullins pada tahun 1980. Ukuran buah ini termasuk ukuran sedang yaitu antara 67 x64 mm,kulit buah berwarna hijau kekuningan. Buah ini memiliki aroma yang harum,kandungan airnya tinggi dan rasanya manis agak asam (Sufrida, dkk., 2004).
k. Apel Red Delicious
Apel jenis ini merupakan salah satu apel yang paling terkenal di dunia. Di Indonesia, buah ini juga banyak dijumpai dipasar swalayan dan pasar tradisional. Buah ini memiliki warna kulit yang merah tua sesuai dengan namanya. Ukuran buah ini tergolong besar yaitu 70 x 70 mm. Daging buah ini berwarna putih, bertekstur renyah dengan kandungan air yang banyak serta rasanya yang manis (Sufrida, dkk., 2004).
2.2 Mineral
Mineral merupakan salah satu unsur yang memegang peranan penting dalam pemeliharaan fungsi tubuh, baik pada tingkat sel, jaringan, organ, maupun fungsi tubuh secara keseluruhan. Mineral digolongkan ke dalam mineral makro dan mineral mikro. Mineral makro adalah mineral yang dibutuhkan tubuh dalam jumlah lebih dari 100 mg/hari, sedangkan mineral mikro dibutuhkan kurang dari 100 mg/hari. Mineral makro adalah natrium, klorida, kalium, kalsium, fosfor, magnesium dan sulfur, sedangkan yang termasuk mineral mikro, seperti besi, seng, iodium dan selenium (Almatsier, 2004).
lebih dari 100 mg/hari, sedangkan mineral mikro merupakan mineral yang dibutuhkan dengan jumlah kurang dari 100 mg /hari (Almatsier, 2004).
Secara tidak langsung, mineral banyak berperan dalam proses pertumbuhan. Peran mineral dalam tubuh berkaitan satu sama lainnya dan kekurangan atau kelebihan salah satu mineral akan berpengaruh terhadap kerja mineral lainnya (Pudjiadi, 2000).
Umumnya kandungan kalium dan kalsium pada buah- buahan dan sayuran banyak terdapat pada kulit buah ataupun kulit biji (Astawan, 2009). Kandungan natrium pada apel hijau banyak terdapat pada daging buah (Anonim,2009).
2.2.1 Kalsium
Kalsium merupakan mineral yang paling banyak terdapat dalam tubuh, yaitu 1,5 – 2 % dari berat badan orang dewasa atau kurang lebih sebanyak 1 kg. Mineral kalsium dibutuhkan untuk perkembangan tulang. Jumlah yang dianjurkan per hari untuk anak-anak sebesar 500 mg, remaja 600-700 mg dan dewasa sebesar 500-800 mg (Almatsier, 2004).
Kekurangan kalsium pada masa pertumbuhan dapat menyebabkan gangguan pertumbuhan. Tulang kurang kuat, mudah bengkok dan rapuh. Semua orang dewasa, terutama sesudah usia 50 tahun akan mengalami resorpsi kalsium dari tulangnya. Tulang menjadi rapuh dan mudah patah. Ini yang dinamakan osteoporosis (Almatsier, 2004).
2.2.2 Kalium
Buah dan sayuran yang mengandung kalium baik dikonsumsi penderita darah tinggi, karena keberadaan kalium sangat penting untuk mengimbangi natrium. Kalium bersifat hipotensif, yaitu memiliki efek penurunan tekanan darah. Oleh karena itu, rasio kalium terhadap natrium yang tinggi berperan penting dalam pencegahan hipertensi (Astawan, 2009). Kebutuhan kalium diperkirakan sebesar 2000 mg/hari (Almatsier, 2004).
Kalium merupakan bagian essensial semua sel hidup, sehingga banyak terdapat dalam bahan makanan. Kebutuhan minimum akan kalium ditaksir sebanyak 2000 mg sehari. Kalium terdapat dalam semua makanan mentah/segar, terutama buah, sayuran dan kacang – kacangan (Almatsier, 2004).
2.2.3 Natrium
Natrium adalah kation utama dalam cairan ekstraseluler. 35-40% natrium ada di dalam kerangka tubuh. Makanan sehari – hari biasanya cukup mengandung natrium yang dibutuhkan tubuh. Oleh karena itu, tidak ada penetapan kebutuhan natrium sehari. Taksiran kebutuhan natrium sehari untuk orang dewasa adalah sebanyak 500 mg. Kebutuhan natrium didasarkan pada kebutuhan untuk pertumbuhan, kehilangan natrium melalui keringat dan sekresi lain. Dianjurkan untuk membatasi konsumsi garam dapur hingga 6 gram sehari (ekivalen dengan 2400 mg natrium). Pembatasan ini dilakukan karena peranan potensial natrium dalam menimbulkan tekanan darah tinggi (Almatsier, 2004).
2.3 Spektrofptometri Serapan Atom
untuk mengubah logam dalam larutan sampel menjadi atom-atom logam berbentuk gas yang digunakan untuk analisis kuantitatif darilogam dalam sampel (Bender, 1987).
Terdapat berbagai macam metode penetapan kadar kalsium antara lain kompleksometri, spektrofotometri serapan atomdan gravimetri (Khopkar, 1985). Penetapan kadar kalium dapat dilakukan dengan menggunakan metode spektrofotometri serapan atom dan gravimetri. Penetapan kadar natrium dapat dilakukan dengan metode spektrofotometri serapan atom dan metode gravimetri (Bassett, dkk., 1994).
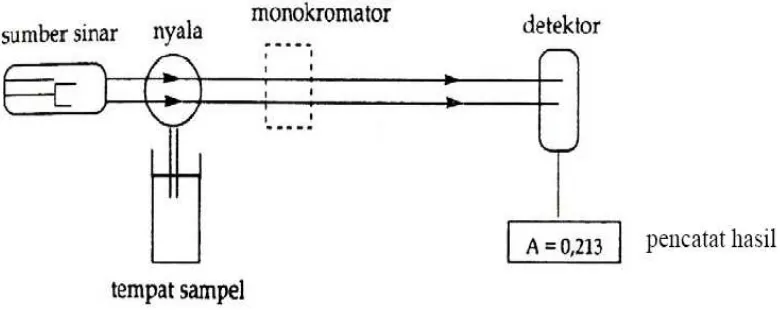
Prinsip dari spektofotometer serapan atom adalah atom atom pada keadaan dasar mampu menyerap cahaya pada panjang gelombang tertentu, yang pada umumnya adalah panjang gelombang radiasi yang akan dipancarkan atom atom itu bila kembali ke keadaan dasar dari keadaan tereksitasi. Jika pada cahaya dengan panjang gelombang tertentu dilewatkan nyala yang mengandung atom atom yang bersangkutan maka sebagian cahaya itu akan diserap dan banyaknya penyerapan akan berbanding lurus dengan banyaknya atom keadaan dasar yang berada dalam nyala.Lampu yang digunakan disebut ‘lampu katode rongga’ dan katode tersebut dilapisi dengan logam yang akan dianalisis. Kerugian teknik ini adalah bahwa lampu harus selalu diganti tiap kali suatu unsur yang berbeda sedang dianalisis dan hanya satu unsur yang dapat dianalisis pada sewaktu-waktu. Instrumen-instrumen modern memiliki sekitar 12 lampu yang tersusun, yang dapat secara otomatis berputar (Watson, 2005).
mineral karena mempunyai kepekaan yang tinggi (batas deteksi kurang dari 1 ppm) dan pelaksanaannya relatif cepat dan sederhana (Gandjar dan Rohman, 2007).
Bagian instrumentasi spektrofotometer serapan atom adalah sebagai berikut: a. Sumber Radiasi
Sumber radiasi yang digunakan adalah lampu katoda berongga (hollow cathode
lamp). Lampu ini terdiri atas tabung kaca tertutup yang mengandung suatu katoda dan
anoda. Katoda berbentuk silinder berongga yang dilapisi dengan mineral tertentu (Gandjar dan Rohman, 2007).
b. Tempat Sampel
Dalam analisis dengan spektrofotometer serapan atom, sampel yang akan dianalisis harus diuraikan menjadi atom-atom netral yang masih dalam keadaan azas. Ada berbagai macam alat yang digunakan untuk mengubah sampel menjadi uap atom-atomnya, yaitu:
1. Dengan nyala (Flame)
Nyala digunakan untuk mengubah sampel yang berupa cairan menjadi bentuk uap atomnya dan untuk proses atomisasi. Suhu yang dapat dicapai oleh nyala tergantung pada gas yang digunakan, misalnya untuk gas asetilen-udara suhunya sebesar 22000C. Sumber nyala asetilen-udara ini merupakan sumber nyala yang paling banyak digunakan. Padasumber nyala tersebut asetilen sebagai bahan pembakar, sedangkan udara sebagai bahan pengoksidasi (Gandjar dan Rohman, 2007). Gasasetilen-udara digunakan untuk logam- logam yang bersifat refractory (sukar diuraikan dalam nyala api) seperti logam kalsium. Sedangkan untuk logam natrium dan kalium tepat menggunakan gas propana-udara (Khopkar, 1985).
Pengatoman dilakukan dalam tungku dari grafit. Sejumlah sampel diambil sedikit (hanya beberapa µL), lalu diletakkan dalam tabung grafit, kemudian tabung tersebut dipanaskan dengan sistem elektris dengan cara melewatkan arus listrik pada grafit. Akibat pemanasan ini, maka zat yang akan dianalisis berubah menjadi atom-atom netral dan pada fraksi atom ini dilewatkan suatu sinar yang berasal dari lampu katoda berongga sehingga terjadilah proses penyerapan energi sinar yang memenuhi kaidah analisis kuantitatif (Gandjar dan Rohman, 2007).
c. Monokromator
Monokromator merupakan alat untuk memisahkan dan memilih spektrum sesuai dengan panjang gelombang yang digunakan dalam analisis dari sekian banyak spektrum yang dihasilkan lampu katoda berongga (Gandjar dan Rohman, 2007).
d. Detektor
Detektor digunakan untuk mengukur intensitas cahaya yang melalui tempat pengatoman (Gandjar dan Rohman, 2007).
e. Amplifier
Amplifier merupakan suatu alat untuk memperkuat signal yang diterima dari
detektor sehingga dapat dibaca alat pencatat hasil (Readout) (Gandjar dan Rohman, 2007).
f. Readout
Readout merupakan suatu alat penunjuk atau dapat juga diartikan sebagai pencatat
Gambar 1. Komponen Spektrofotometer Serapan Atom
2.3.1Gangguan-gangguan pada Spektrofotometri Serapan Atom
Gangguan-gangguan (interference) pada Spektrofotometri Serapan Atom adalah peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel (Gandjar dan Rohman, 2007). Secara luas dapat dikategorikan menjadi dua kelompok, yakni interferensi spektral dan interferensi kimia (Khopkar, 1985).
Menurut Gandjar dan Rohman (2007), gangguan-gangguan yang terjadi pada spektrofotometri serapan atom adalah:
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi banyaknya sampel yang mencapai nyala.
2. Gangguan kimia yang dapat mempengaruhi jumlah atau banyaknya atom yang terjadi di dalam nyala.
3. Gangguan oleh absorbansi yang disebabkan bukan oleh absorbansi atom yang dianalisis, yakni absorbansi oleh molekul-molekul yang tidak terdisosiasi di dalam nyala.
2.4 Validasi Metode Analisis
Validasi metode analisis adalah suatu tindakan penilaian terhadap parameter tertentu berdasarkan percobaan laboratorium untuk membuktikan bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita, 2004).
Beberapa parameter analisis yang harus dipertimbangkan dalam validasi metode analisis adalah sebagai berikut:
a. Kecermatan
Kecermatan adalah ukuran yang menunjukkan derajat kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan (Harmita, 2004). Kecermatan dapat ditentukan dengan dua cara, yaitu:
- Metode simulasi
Metode simulasi (Spiked-placebo recovery) merupakan metode yang dilakukan dengan cara menambahkan sejumlah analit bahan murni ke dalam suatu bahan pembawa sediaan farmasi (plasebo), lalu campuran tersebut dianalisis dan hasilnya dibandingkan dengan kadar analit yang ditambahkan (kadar yang sebenarnya) (Harmita, 2004).
- Metode penambahan baku
b. Keseksamaan (presisi)
Keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen (Harmita, 2004).
Nilai simpangan baku relatif (RSD) untuk analit dengan kadar part per million (ppm) adalah tidak lebih dari 16% dan untuk analit dengan kadar part per billion (ppb) RSDnya adalah tidak lebih dari 32% (Harmita, 2004).
c. Selektivitas (Spesifisitas)
Selektivitas atau spesifisitas suatu metode adalah kemampuannya yang hanya mengukur zat tertentu secara cermat dan seksama dengan adanya komponen lain yang ada di dalam sampel (Harmita, 2004).
d. Linearitas dan rentang
Linearitas adalah kemampuan metode analisis yang memberikan respon baik secara langsung maupun dengan bantuan transformasi matematika, menghasilkan suatu hubungan yang proporsional terhadap konsentrasi analit dalam sampel. Rentang merupakan batas terendah dan batas tertinggi analit yang dapat ditetapkan secara cermat,seksama dan dalam linearitas yang dapat diterima (Harmita, 2004).
e. Batas deteksi (Limit of detection) dan batas kuantitasi (Limit of quantitation)
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini dilakukan diLaboratorium Kimia Farmasi Kualitatif dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara Medan pada bulan Desember 2012-Februari 2013
3.2 Bahan–bahan
3.2.1 Sampel
Sampel yang digunakan dalam penelitian ini adalah apel hijau yang berasal dari Australia diambil dari Supermarket PalangkaRaya Fruits Medan.
3.2.2 Pereaksi
Semua bahan yang digunakan dalam penelitian ini berkualitas pro analisa keluaran E. Merck kecuali disebutkan lain yaitu akuabides (PT. Ikapharmindo Putramas), asam sulfat 96% v/v, asam pikrat 1% b/v, HNO3 65% b/v, larutan baku
kalium 1000 µg/ml, larutan baku kalsium 1000 µg/ml, dan larutan baku natrium 1000 µg/ml.
2.3 Alat–alat
3.4 Pembuatan Pereaksi
3.4.1 Larutan HNO3 (1:1)
Sebanyak 500 ml larutan HNO3 65% b/v diencerkan dengan 500 ml akuabides
(Helrich, 1990).
3.4.2 Larutan H2SO4 1 N
Sebanyak 3 ml larutan H2SO4 96% v/v diencerkan dengan akuades hingga 100
ml (Ditjen POM, 1979).
3.4.3 Asam Pikrat 1% b/v
Sebanyak 1 gram asam pikrat dilarutkan dalam air suling hingga 100 ml (Ditjen POM, 1979).
3.5 Prosedur Penelitian
3.5.1 Pengambilan sampel
Metode pengambilan sampel dilakukan dengan cara sampling purposif yang dikenal juga sebagai sampling pertimbangan. Metode sampling ini ditentukan atas dasar pertimbangan bahwa sampel yang diambil dapat mewakili populasi (Budiarto, 2004).
3.5.2 Penyiapan Sampel
3.5.3 Proses Destruksi Kering
Sampel yang telah dihaluskan ditimbang sebanyak 25 gram dalam krus porselen, diarangkan di atas hot plate, lalu diabukan dalam tanur dengan temperatur awal 100℃ dan perlahan – lahan temperatur dinaikkan hingga suhu 500℃ dengan interval 25℃ setiap 5 menit. Pengabuan dilakukan selama 60 jam (dihitung saat suhu sudah 500℃), lalu setelah suhu tanur ±27℃, krus porselen dikeluarkan dan dibiarkan hingga dingin pada desikator. Abu ditambahkan 5 ml HNO3 (1:1), kemudian diuapkan
pada hot plate sampai kering. Krus porselen dimasukkan kembali ke dalam tanur dengan temperatur awal 100℃ dan perlahan – lahan temperatur dinaikkan hingga suhu 500℃ dengan interval 25℃ setiap 5 menit. Pengabuan dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator (Horwitz, 2000).
3.5.4 Pembuatan Larutan Sampel
Sampel hasil destruksi dilarutkan dalam 5 ml HNO3 (1:1), lalu dipindahkan ke
3.5.5 Pemeriksaan Kualitatif
3.5.5.1 Kalsium
3.5.5.1.1 Uji nyala
Bersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian celupkan sampel lalu dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen. Jika terdapat kalsium akan terbentuk warna merah bata pada nyala tersebut (Vogel,1979).
3.5.5.1.2 Uji Kristal Kalsium dengan Larutan Asam Sulfat 1 N
Larutan sampel hasil destruksi sebanyak 1-2 tetes diteteskan pada object glass kemudian ditetesi dengan larutan asam sulfat 1 N akan terbentuk endapan putih lalu diamati di bawah mikroskop. Jika terdapat kalsium akan terlihat kristal berbentuk jarum (Vogel, 1979).
3.5.5.2 Kalium
3.5.5.2.1 Uji nyala
Bersihkan kawat Ni/Cr dengan HCl pekat lalu dipijar pada api bunsen sampai tidak memberikan warna khusus pada nyala bunsen. Kemudian celupkan sampel lalu dipijar pada api bunsen, amati warna yang terjadi pada nyala bunsen. Jika terdapat kalium akan terbentuk warna ungu pada nyala tersebut (Vogel, 1979).
3.5.5.2.Uji Kristal Kalium dengan Larutan Asam pikrat
3.5.5.3 Natrium
3.5.5.3.1 Uji Nyala
Kawat Ni/Cr dicelupkan ke dalam HCl pekat kemudian dibakar pada nyala bunsen hingga nyalanya bersih. Kawat dicelupkan lagi ke dalam HCl pekat lalu ke dalam sampel dan dibakar. Jika terdapat natrium, akan dihasilkan nyala kuning pada nyala tersebut (Vogel, 1979).
3.5.5.3.2 Uji Kristal Natrium dengan Larutan Asam Pikrat
Larutan zat diteteskan 1-2 tetes pada object glass kemudian ditetesi dengan larutan asam pikrat 1% b/v, dibiarkan ± 5 menit lalu diamati di bawah mikroskop. Jika terdapat natrium, akan terlihat kristal berbentuk jarum halus tersusun di pinggir.
3.5.6 Pemeriksaan Kuantitatif
3.5.6.1 Kalsium
3.5.6.1.1 Pembuatan Kurva Kalibrasi Kalsium
Larutan baku kalsium (1000 µg/ml) sebanyak 1 ml dimasukkan kedalam labu tentukur 50 ml lalu dicukupkan hingga garis tanda dengan akuabides. Dari konsentrasi 20 mcg/ml dipipet masing-masing 1,25 ml; 2,5 ml; 3,75 ml; 5 ml; dan 6,25 ml; dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan hingga garis tanda dengan akuabides sehingga diperoleh larutan dengan konsentrasi 1,0 µg/ml; 2,0 µg/ml; 3,0
µg/ml; 4,0 µg/ml; 5,0 µg/ml; dan diukur absorbansi pada panjang gelombang 422,7 nm dengan tipe nyala udara-asetilen.
3.5.6.1.2 Penetapan Kadar Kalsium dalam Sampel
pada panjang gelombang 422,7 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalsium. Konsentrasi kalsium dalam sampel dihitung berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.6.2 Kalium
3.5.6.2.1 Pembuatan Kurva Kalibrasi Larutan Baku Kalium
Larutan baku kalium (1000 µg/ml) sebanyak 0,5 ml dimasukkan kedalam labu tentukur 50 ml lalu dicukupkan hingga garis tanda dengan akuabides. Dari konsentrasi 10 mcg/ml dipipet masing-masing 1,25 ml; 2,5 ml; 5 ml; 7,5 ml; dan 10 ml; dimasukkan ke dalam labu tentukur 25 ml dan dicukupkan hingga garis tanda dengan akuabides sehingga diperoleh larutan dengan konsentrasi 0,5 µg/ml; 1,0 µg/ml; 2,0 µg/ml; 3,0 µg/ml; 4
µg/ml; dan diukur absorbansi pada panjang gelombang 766,5 nm dengan tipe nyala udara-asetilen.
3.5.6.2.2 Penetapan Kadar Kalium dalam Sampel
Larutan sampel apel hijau yang kulitnya dikupas dengan apel hijau yang kulitnya tanpa kupas hasil destruksi dipipet sebanyak 0,1 ml dimasukkan ke dalam labu tentukur 50ml dan dicukupkan dengan akuabides hingga garis tanda (Faktor pengenceran = 50/0,1 kali). Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 766,5 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku kalium. Konsentrasi kalium dalam sampel dihitung berdasarkan persamaan garis regresi dari kurva kalibrasi.
3.5.6.3 Natrium
3.5.6.3.1 Pembuatan Kurva Kalibrasi Larutan Baku Natrium
dalam labu tentukur 25 ml dan dicukupkan hingga garis tanda dengan akuabides sehingga diperoleh larutan dengan konsentrasi 0,2 µg/ml; 0,4 µg/ml; 0,6 µg/ml; 0,8 µg/ml; 1,0
µg/ml; dan diukur absorbansi pada panjang gelombang 589,0 nm dengan tipe nyala udara-asetilen.
3.5.6.3.2 Penetapan Kadar Natrium dalam Sampel
Larutan sampel apel hijau yang kulitnya dikupas dengan apel hijau tanpa kupas hasil destruksi dipipet sebanyak 1 ml dimasukkan ke dalam labu tentukur 50ml dan dicukupkan dengan akuabides hingga garis tanda (Faktor pengenceran = 50/1,0 kali). Lalu diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada panjang gelombang 589,0 nm dengan nyala udara-asetilen. Nilai absorbansi yang diperoleh harus berada dalam rentang kurva kalibrasi larutan baku natrium. Konsentrasi natrium dalam sampel dihitung berdasarkan persamaan garis regresi dari kurva kalibrasi.
Menurut Gandjar dan Rohman (2007), Kadar logam kalsium, kalium dan natrium dalam sampel dapat dihitung dengan cara sebagai berikut:
(g) Sampel Berat
n pengencera Faktor
x (ml) Volume x
(µg/ml) i
Konsentras (µg/g)
Logam
3.5.7 Analisis Data Secara Statistik
3.5.7.1 Penolakan Hasil Pengamatan
Kadar kalsium, kalium dan natrium yang diperoleh dari hasil pengukuran masing-masing larutan sampel dianalisis secara statistik. Menurut Sudjana (2005), standar
deviasi dapat dihitung dengan menggunakan rumus:
SD =
( )
1 -n
X
-Xi 2
∑
Keterangan : Xi = Kadar sampel
−
X = Kadar rata-rata sampel n = Jumlah perlakuan
Untuk mencari t hitung digunakan rumus:
t hitung =
n SD
X Xi
/ −
Menurut Harris (1982), untuk menghitung kadar mineral di dalam sampel dengan interval kepercayaan 99%, dk = n-1, dapat digunakan rumus:
Kadar Mineral : µ = X ± (t(α/2, dk) x SD / √n )
Keterangan :
−
X = Kadar rata-rata sampel SD = Standar Deviasi
dk = Derajat kebebasan (dk = n-1)
α = Interval kepercayaan n = Jumlah perlakuan
3.5.7.2 Pengujian Beda Nilai Rata-Rata Antar Sampel
Fo = 2
2 2 1
S S
Keterangan : Fo = Beda nilai yang dihitung
S1 = Standar deviasi terbesar
S2= Standar deviasi terkecil
Apabila dari hasilnya diperoleh Fo tidak melewati nilai kritis F maka dilanjutkan uji
dengan distribusi t dengan rumus:
(X1 – X2)
to =
Sp √1/n1 + 1/n2
Keterangan : X1 = kadar rata-rata sampel 1 n 1 = Jumlah perlakuan sampel 1
X2 = kadar rata-rata sampel 2 n 2 = Jumlah perlakuan sampel 2
Sp = Simpangan baku
jika Fo melewati nilai kritis F, dilanjutkan uji dengan distribusi t dengan rumus :
(X1 – X2)
to =
√S12/n1 + S22/n2
Keterangan: X1 = kadar rata-rata sampel 1 S1 = Standar deviasi sampel 1
X2 = kadar rata-rata sampel 2 S2 = Standar deviasi sampel2
n1 = Jumlah perlakuan sampel 1 n2 = Jumlah perlakuan sampel 2
Kedua sampel dinyatakan berbeda apabila to yang diperoleh melewati nilai
kritis t, dan sebaliknya.
3.5.8 Uji Perolehan Kembali (Recovery)
tertentu (Miller, 2005). Larutan baku yang ditambahkan yaitu, 0,3 ml larutan baku kalsium (konsentrasi 1000 µg/ml), 7,5 ml larutan baku kalium (konsentrasi 1000 µg/ml) dan 1 ml larutan baku natrium (konsentrasi1000 µg/ml).
Apel hijau yang kulitnya dikupas yang telah dihaluskan ditimbang sebanyak 25 gram di dalam krus porselen, lalu ditambahkan 0,3 ml larutan baku kalsium (konsentrasi 1000 µg/ml), 7,5 ml larutan baku kalium (konsentrasi 1000 µg/ml) dan 1 ml larutan baku natrium (1000 µg/ml), kemudian dilanjutkan dengan prosedur destruksi kering seperti yang telah dilakukan sebelumnya.
Menurut Harmita (2004), persen perolehan kembali dapat dihitung dengan rumus di bawah ini:
% Perolehan Kembali= CF- CA x 100%
C*A
Keterangan :
CA = Kadar logam dalam sampel sebelum penambahan baku
CF = Kadar logam dalam sampel setelah penambahan baku
C*A = Kadar larutan baku yang ditambahkan
3.5.9 Simpangan Baku Relatif
Menurut Harmita (2004), keseksamaan atau presisi diukur sebagai simpangan baku relatif atau koefisien variasi. Keseksamaan atau presisi merupakan ukuran yang menunjukkan derajat kesesuaian antara hasil uji individual ketika suatu metode dilakukan secara berulang untuk sampel yang homogen. Nilai simpangan baku relatif yang memenuhi persyaratan menunjukkan adanya keseksamaan metode yang dilakukan.
RSD = ×100%
X SD
Keterangan : X− = Kadar rata-rata sampel SD = Standar Deviasi
RSD= Relative Standard Deviation
3.5.10 Penentuan Batas Deteksi (Limit of Detection) dan Batas Kuantitasi (Limit
of Quantitation)
Batas deteksi merupakan jumlah terkecil analit dalam sampel yang dapat dideteksi yang masih memberikan respon signifikan. Sedangkan batas kuantitasi merupakan kuantitas terkecil analit dalam sampel yang masih dapat memenuhi kriteria cermat dan seksama (Harmita, 2004).
Menurut Harmita (2004),batas deteksi dan batas kuantitasi ini dapat dihitung dengan rumus sebagai berikut:
Simpangan Baku (
X
SY ) =
(
)
2
2
− −
∑
n Yi Y
Batas deteksi (LOD) =
slope X SY x
3
Batas kuantitasi (LOQ) =
slope X SY x
BAB IV
HASIL DAN PEMBAHASAN
4.1 Analisis Kualitatif
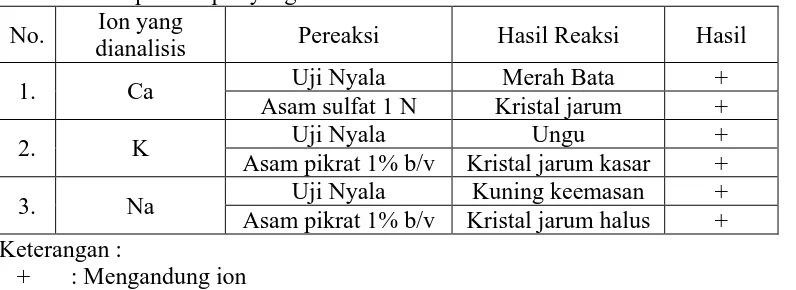
[image:47.595.114.512.289.434.2]Analisis kualitatif dilakukan sebagai analisis pendahuluan untuk mengetahui ada atau tidaknya ion-ion kalsium, kalium dan natrium dalam sampel. Data dapat dilihat pada Tabel 1dan Lampiran 5, halaman 45.
Tabel 1. Hasil Analisis Kualitatif dalam Sampel Apel Hijau yang kulitnya Dikupas dan
Tanpa Dikupas yang Telah Didestruksi No. Ion yang
dianalisis Pereaksi Hasil Reaksi Hasil 1. Ca Uji Nyala Merah Bata +
Asam sulfat 1 N Kristal jarum + 2. K Uji Nyala Ungu + Asam pikrat 1% b/v Kristal jarum kasar + 3. Na Uji Nyala Kuning keemasan + Asam pikrat 1% b/v Kristal jarum halus + Keterangan :
+ : Mengandung ion
Tabel di atas menunjukkan bahwa larutan sampel yang diperiksa mengandung ion kalsium, kalium dan natrium. Sampel positif mengandung ion kalsium karena menghasilkan endapan putih CaSO4 berbentuk kristal jarum dengan penambahan asam
4.2 Analisis Kuantitatif
4.2.1 Kurva kalibrasi Kalsium, Kalium dan Natrium
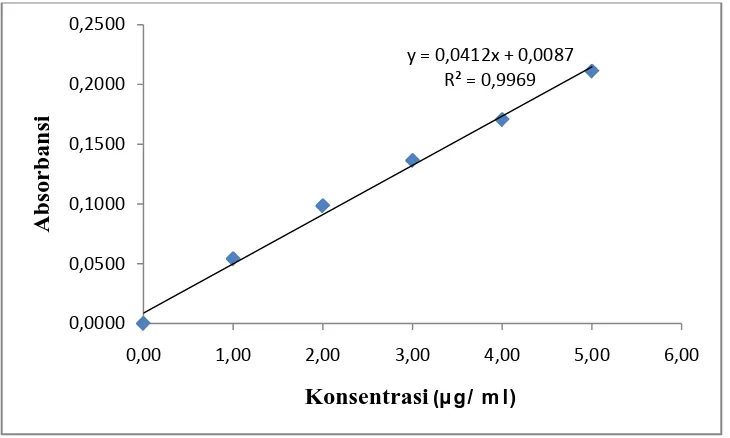
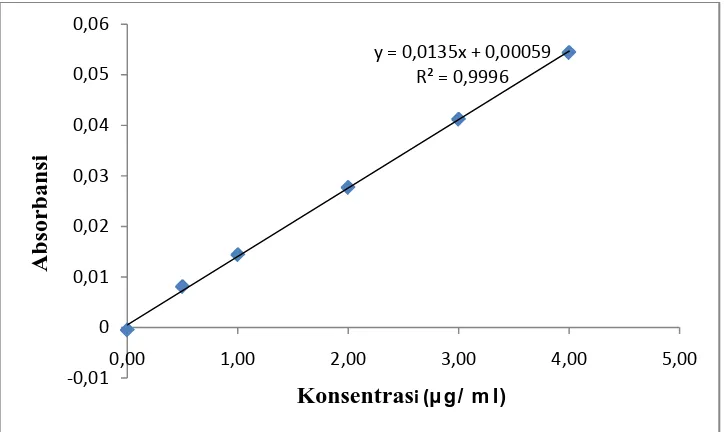
Kurva kalibrasi kalsium, kalium dan natrium diperoleh dengan cara mengukur absorbansi dari larutan baku ketiganya pada panjang gelombang masing-masing. Hasil pengukuran kurva kalibrasi untuk ketiganya diperoleh persamaan garis regresi yaitu Y = 0,0412X + 0,0087 untuk kalsium, Y = 0,0135X + 0,000059 untuk kaliumdan Y = 0,1106X + 0,0025 untuk natrium.
[image:48.595.114.479.332.551.2]Kurva kalibrasi larutan baku kalsium, kalium dan natrium dapat dilihat pada Gambar 1 sampai dengan Gambar 3.
Gambar 1. Kurva Kalibrasi Kalsium
y = 0,0412x + 0,0087 R² = 0,9969
0,0000 0,0500 0,1000 0,1500 0,2000 0,2500
0,00 1,00 2,00 3,00 4,00 5,00 6,00
A
bs
or
ban
si
Gambar 2. Kurva Kalibrasi Kalium
Gambar 3. Kurva Kalibrasi Natrium
Berdasarkan kurva di atas diperoleh hubungan yang linear antara konsentrasi dengan absorbansi, dengan koefisien korelasi (r) kalsium sebesar 0,9969, kalium sebesar 0,9996 dan natrium sebesar 0,9993. Nilai r ≥ 0,97 menunjukkan adanya korelasi linier yang menyatakan adanya hubungan antara X (Konsentrasi) dan Y (Absorbansi) (Miller, 2005). Data hasil pengukuran absorbansi larutan baku kalsium, kalium dan natrium dan
y = 0,0135x + 0,00059 R² = 0,9996
-0,01 0 0,01 0,02 0,03 0,04 0,05 0,06
0,00 1,00 2,00 3,00 4,00 5,00
A
bs
or
ban
si
Konsentrasi (µ g/ m l)
y = 0,1106x + 0,0025 R² = 0,9993
0,0000 0,0200 0,0400 0,0600 0,0800 0,1000 0,1200 0,1400
0,00 0,20 0,40 0,60 0,80 1,00 1,20
A
bs
or
ban
si
perhitungan persamaan garis regresi dapat dilihat padaLampiran 6 sampai dengan Lampiran 8, halaman 47 sampai halaman 49.
4.2.2 Analisis Kadar Kalsium, Kaliumdan Natrium dalam Apel Hijau yang Kulitnya
Dikupas dan Tanpa Dikupas
Penentuan kadar kalsium, kaliumdan natriumdilakukan secara spektrofotometri serapan atom. Konsentrasi mineral kalsium, kalium dan natrium dalam sampel ditentukan berdasarkan persamaan garis regresi kurva kalibrasi larutan baku masing-masing mineral. Agar konsentrasi mineral kalsium, kalium, dan natrium dalam sampel berada pada rentang kurva kalibrasi maka masing-masing sampel diencerkan terlebih dahulu dengan faktor pengenceran yang berbeda-beda. Faktor pengenceran untuk penentuan kadar kalsium pada apel hijau yang kulitnya dikupas dan tanpa dikupas adalah sebesar 5 kali, sedangkan faktor pengenceran untuk penentuan kadar kalium pada apel hijau yang kulitnyadikupasdan tanpa dikupas adalah sebesar 50/0,1 kali.Sebaliknya faktor pengenceran untuk penentuan kadar natrium pada apel hijau yang kulitnya dikupas dan tanpa dikupas adalah sebesar 50/1,0 kali. Data dan contoh perhitungan dapat dilihat pada Lampiran 11 sampai dengan Lampiran 12,halaman 52 sampai halaman 53.
[image:50.595.115.526.665.743.2]Analisis dilanjutkan dengan perhitungan statistik (Perhitungan dapat dilihat pada Lampiran 13 sampai dengan Lampiran 15, halaman 53 sampai halaman 63). Hasil analisis kuantitatif mineral kalsium, kalium dan natrium pada sampel dapat dilihat pada Tabel 2 berikut ini.
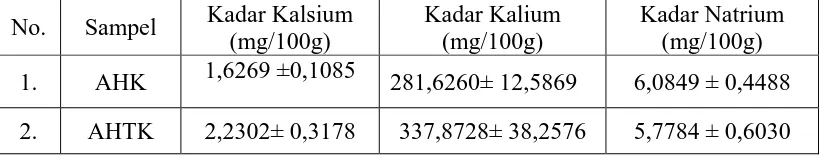
Tabel 2. Hasil Analisis Kadar Kalsium, Kalium dan Natrium dalam Sampel
No. Sampel Kadar Kalsium (mg/100g)
Kadar Kalium (mg/100g)
Keterangan :
AHK : Apel Hijau yang Kulitnya Dikupas AHTK : Apel Hijau yang Kulitnya Tanpa Dikupas
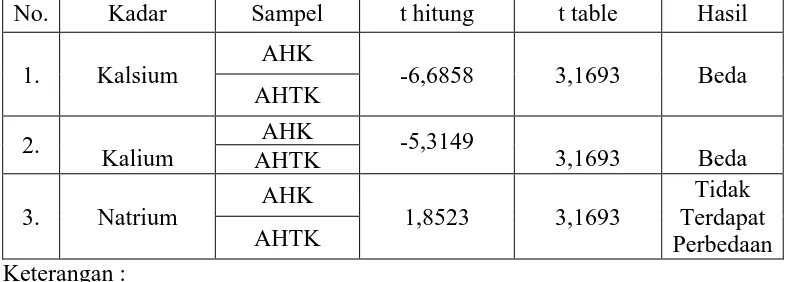
[image:51.595.112.510.293.434.2]Data yang didapat kemudian diuji kembali secara statistik untuk mengetahui beda nilai kadar rata-rata ketiga mineral pada sampel dengan kadar rata-rata mineral antar kedua sampel (Perhitungan dapat dilihat pada Lampiran 16 sampai dengan Lampiran 18,halaman 64 sampai halaman 69). Hasil perhitungan uji statistik dapat dilihat pada Tabel 3 berikut ini.
Tabel 3. Hasil Uji Beda nilai rata-rata kadar kalsium, kalium dan natrium antar sampel
No. Kadar Sampel t hitung t table Hasil 1. Kalsium AHK -6,6858 3,1693 Beda
AHTK 2.
Kalium
AHK -5,3149
3,1693 Beda AHTK
3. Natrium AHK 1,8523 3,1693
Tidak Terdapat Perbedaan AHTK
Keterangan :
AHK : Apel Hijau yang Kulitnya Dikupas AHTK : Apel Hijau yang Kulitnya Tanpa Dikupas
4.2.3 Uji Perolehan Kembali (Recovery)
[image:52.595.113.555.197.336.2]Hasil uji perolehan kembali (recovery) kadar kalsium, kalium dan natrium setelah penambahan masing-masing larutan baku kalsium, kalium dan natrium dalam sampel dapat dilihat pada Tabel 4 berikut ini.
Tabel 4. Persen Uji Perolehan Kembali (recovery) kadar kalsium, kalium dan natrium
NO Mineral yang dianalisis Recovery (%)
Syarat rentang persen recovery (%)
1. Ca 93,76 80-120
2. K 94,16 80-120
3. Na 98,74 80-120
Berdasarkan tabel di atas, dapat dilihat bahwa rata-rata hasil uji perolehan kembali (recovery) berturut-turut untuk kandungan kalsium 93,76%, untuk kandungan kalium 94,16% dan untuk kandungan natrium 98,74%. Persen recovery tersebut menunjukkan kecermatan kerja yang memuaskan pada saat pemeriksaan kadar kalsium, kalium dan natrium dalam sampel. Hasil uji perolehan kembali (recovery) ini memenuhi syarat akurasi yang telah ditetapkan, jika rata-rata hasil perolehan kembali (recovery) berada pada rentang 80-120% (Miller, 2005). Hasil uji perolehan kembali (recovery) kadar kalsium, kaliumdan natrium setelah penambahan masing-masing larutan baku dapat dilihat pada Lampiran 19, halaman 70.
4.2.4 Simpangan Baku Relatif
analit dengan kadar part per million (ppm) adalah tidak lebih dari 16% dan untuk analit dengan kadar part per billion (ppb) RSDnya adalah tidak lebih dari 32%. Dari hasil yang diperoleh menunjukkan bahwa metode yang dilakukan memiliki presisi yang baik.
4.2.5 Batas Deteksi dan Batas Kuantitasi
Berdasarkan data kurva kalibrasi kalsium, kalium dan natrium diperoleh batas deteksi dan batas kuantitasi untuk ketiga mineral tersebut. Dari hasil perhitungan diperoleh untuk pengukuran kalsium, kalium dan natrium masing-masing sebesar 0,3602μg/ml, 0,9650μg/ml dan 0,2078μg/ml, sedangkan batas kuantitasinya sebesar 0,6928μg/ml, 0,0483μg/ml dan 0,1609μg/ml.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
a. Hasil penetapan kadar kalsium, kalium dan natrium secara spektrofotometri serapan atom menunjukkan bahwa kadar kalsium, kalium dan natrium dalam apel hijau yang dikupas dan tanpa dikupasadalah (1,6269 ± 0,1085)mg/100g dan (2,2302 ± 0,3178) mg/100 g; kadar kalium kulitnya yang dikupas dan tanpa dikupas adalah (281,6260 ± 12,5869) mg/100 g dan (337,8728 ± 38,2576) mg/100 g; dan kadar natrium kulitnya yang dikupas dan tanpa dikupas adalah (6,0849 ± 0,4488) mg/100g dan (5,7784 ± 0,6030) mg/100 g.
b. Hasil uji statistik yaitu uji beda rata-rata kadar kalsium dan kalium antara apel hijau yang kulitnya dikupas dan tanpa dikupas terdapat perbedaan signifikan dimana kadar kalsium dan kalium dalamapel hijau yang kulitnya tanpa dikupas lebih tinggi daripada apel hijau yang kulitnya dikupas, sedangkan kadar natrium pada kulit yang kulitnya dikupas dan tanpa dikupas tidak terdapat perbedaan yang signifikan.
5.2 Saran
DAFTAR PUSTAKA
Almatsier, S. (2004). Prinsip Dasar Ilmu Gizi. Jakarta: PT. Gramedia Pustaka Utama. Hal. 235, 241-243, 247, 255.
Anonim. (2009). Kandungan Apel Hijau. Diakses : 08 Oktober
Anonim . (2012). Khasiat Apel Hijau. Diakses : 08 Oktober 2012. http ://www. Kandungan apel hijau/ search.
Astawan, M. (2009). Sehat dengan Hidangan Kacang dan Biji-bijian. Jakarta: Penebar Swadaya. Hal.33-35.
Bassett, J., Denney, R.C., Jeffery, G.H., Mendham, J. (1994). Vogel’sTextbook of
Quantitative Inorganic Analysis Including Elementary Instrumental Analysis.
Penerjemah: Hadiyana Pudjaatmaka dan Setiono, L,. (1994). Buku Ajar Vogel
Kimia Analisis Kuantitatif Anorganik. Edisi IV. Jakarta: Penerbit Buku
Kedokteran EGC. Hal. 372, 512, 973, 463, 516.
Bender, G.T. (1987).Principal of Chemical Instrumentation Philadelphia: W.B.Sounders Company. Hal. 98.
Budiarto, E. (2004). Metodologi Penelitian Kedokteran. Jakarta: Penerbit Buku Kedokteran EGC. Hal. 46.
Ditjen POM. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan RI. Hal. 744.
Gandjar, I.G., dan Rohman, A. (2007). Kimia Farmasi Analisis. Cetakan II. Yogyakarta: PustakaPelajar.Hal. 298, 305-312, 319.
Harmita. (2004). Petunjuk Pelaksanaan Validasi Metode dan Cara Perhitungannya. Review Artikel. Majalah Ilmu Kefarmasian. 1(3):117-119-122, 127-130.
Harris, D. C. (1982). Quantitative Chemical Analysis. New Yor: W. H. Freeman and Company. Hal. 47, 143
Helrich, K. (1990). Official Methods of the Association of Official Analytical Chemist. Edisi kelimabelas. Viginia: AOAC International. Hal. 42.
Herbarium Medanense. (2012). Identifikasi Tumbuhan. Medan: Herbarium Medanense Sumatera Utara
Khopkar, S.M. (1985). Basic Concepts of Analytical Chemistry. Penerjemah: Saptorahardjo. (1990). Konsep Dasar Kimia Analitik. Jakarta: UI-Press.
Hal.189-191, 194-196.
Miller, J.H.McB.(2005). Method Validation in Pharmaceutical Analysis. Weinheim: Wiley-Vch Verlag GmbH & Co. KGaA. Hal. 171.
Murray, Daryl K, Granner, dan Victor, W. R. (2006).Harper’s Illustrated Biochemistry. Penerjemah: Brahm U. (2009). Biokimia Harper. Edisi 27. Jakarta: EGC. Hal. 519-520.
Poedjiadi, A. (1994). Dasar-Dasar Biokimia. Edisi Revisi. Jakarta: Universitas Indonesia (UI-Press). Hal. 419.
Sudjana. (2005). Metode Statistika. Edisi IVI. Bandung: Tarsito. Hal. 93,168, 239.
Sufrida, Y., Irlansyah, Edi J, dan Mofatis W. (2004). Khasiat dan Manfaat Apel. Jakarta: Agromedia. Hal 11, 26-28.
Vogel, A.I. (1979). Textbook of Macro and Semimicro Qualitative Inorganic Analysis. Edisi Kelima. Bagian I. Penerjemah: Setiono dan Hadyana Pudjaatmaka. (1990).
Analisis Anorganik Kualitatif Makro dan Semimikro. Jakarta: PT Kalman Media
Pustaka. Hal. 262-, 263, 301, 307.
Watson, D.G. (2005). Pharmaceutical Analysis: A Textbook for Pharmacy Students and
Pharmaceutical Chemists. Penerjemah: Syarief, W. R. (2010). Analisis Farmasi.
Jakarta: Penerbit Buku Kedokteran EGC. Hal. 18, 169-170.
Lampiran 2. Gambar Apel Hijau (Pyrus malus, L.)
Gambar 1. Apel Hijau yang Kulitnya Tanpa Dikupas (Pyrus malus, L)
[image:58.595.158.521.403.589.2]Lampiran 3. Bagan Alir Proses Destruksi Kering
Apel Hijau
Ditimbang sebanyak 25 gram di atas krus Diarangkan di atas hot plate
Diabukan dalam tanur dengan temperatur awal 100◦C dan perlahan – lahan temperatur dinaikkan hingga suhu 500◦C dengan interval 25◦C setiap 5 menit
Ditambahkan 5 ml HNO3 (1:1)
Diuapkan pada hot plate sampai kering
Hasil
Dilakukan selama 60 jam dan dibiarkan hingga dingin pada desikator
Abu
Dilakukan selama 1 jam dan dibiarkan hingga dingin pada desikator
Dicuci bersih
Dimasukkan kembali ke dalam tanur dengan temperatur awal 100˚C dan perlahan – lahan temperatur dinaikkan hingga suhu 500˚C dengan interval 25˚C setiap 5 menit.
Dikupas dan dibuang kulitnya Dipotong kecil-kecil
Lampiran 4. Bagan Alir Pembuatan Larutan Sampel
Sampel yang telah didestruksi
Dilarutkan dalam 5 ml HNO3 (1:1)
Dipindahkan ke dalam labu tentukur 50 ml Dipindahkan ke dalam labu tentukur 50 ml, dibiladibila
Dibilas krus porselen sebanyak tiga kali dengan 10 ml akuabides. Dicukupkan dengan akuabides hingga garis tanda
Dimasukkan ke dalam botol Larutan sampel
Disaring dengan kertas saring Whatman No.42
Filtrat
Dibuang 5 ml untuk menjenuhkan kertas saring
Dilakukan analisis kualitatif
Dilakukan analisis kuantitatif dengan Spektrofotometer Serapan atom pada λ 422,7 nm untuk kadar kalsium, pada 766,5 nm untuk kadar kalium, dan pada λ 589,0 nm untuk kadar natrium
Lampiran 5. Hasil Analisis Kualitatif Kalsium, Kalium dan Natrium
Gambar 3. Gambar Kristal Kalium pikrat (Perbesaran 10x10)
Gambar 4. Gambar Kristal Natrium pikrat (Perbesaran 10x10)
[image:61.595.213.518.119.310.2] [image:61.595.191.465.387.620.2]Lampiran 6. Data Kalibrasi Kalsium dengan Spektrofotometer Serapan Atom,
Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r). No. Konsentrasi (µg/ml)
(X)
Absorbansi (Y)
1. 0,0000 0,0000
2. 1,0000 0,0541
3. 2,0000 0,0984
4. 3,0000 0,1363
5. 4,0000 0,1705
6. 5,0000 0,2111
No. X Y XY X2 Y2
1. 0,0000 0,0000 0,0000 0,0000 0,0000 2. 1,0000 0,0541 0,0541 1,0000 0,0029 3. 2,0000 0,0984 0,1968 4,0000 0,0097 4. 3,0000 0,1363 0,4089 9,0000 0,0186 5. 4,0000 0,1705 0,6820 16,0000 0,0291 6. 5,0000 0,2111 1,0555 25,0000 0,0446 ∑ 15,0000
X = 2,5000
0,6704
Y= 0,1117
2,3973 55,0000 0,1048
a =
( )
X nX n Y X XY / / 2 2
∑
∑
∑
∑ ∑
− − =(
)
(
15,0000)
/6 0000 , 55 6 / ) 6704 , 0 ( 0000 , 15 3973 , 2 2 − − = 0,0412Y = a X + b b = Y − aX
= 0,1117 – (0,0412)(2,5000) = 0,0087
Maka persamaan garis regresinya adalah: Y = 0,0412X + 0,0087
=
(
)(
)
(
)
Lampiran 7. Data Kalibrasi Kalium dengan Spektrofotometer Serapan Atom,
Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r). No. Konsentrasi (µg/ml)
(X)
Absorbansi (Y)
1. 0,0000 -0,0005
2. 0,5000 0,0081
3. 1,0000 0,0144
4. 2,0000 0,0277
5. 3,0000 0,0412
6. 4,0000 0,0544
No. X Y XY X2 Y2
1. 0,0000 -0,0005 0,0000 0,0000 0,0000 2. 0,5000 0,0081 0,0041 0,2500 0,00007 3. 1,0000 0,0144 0,0144 1,0000 0,0002 4. 2,0000 0,0277 0,0544 4,0000 0,0008 5. 3,0000 0,0412 0,1236 9,0000 0,0017 6. 4,0000 0,0544 0,2176 16,0000 0,0029 ∑ 10,5000
X = 1,7500
0,1453
Y = 0,0242
0,4151 30,2500 0,0057
a =
( )
X nX n Y X XY / / 2 2
∑
∑
∑
∑ ∑
− − =(
)(
)
(
10,5000)
/6 2500 , 30 6 / 1453 , 0 5000 , 10 4151 , 0 2 − − = 0,0135Y = a X + b b = Y − aX
= 0,0242 – (0,0135)(1,7500) = 0,000059
Maka persamaan garis regresinya adalah: Y = 0,0135X + 0,000059
=
(
)(
)
(
)
Lampiran 8. Data Kalibrasi Natrium dengan Spektrofotometer Serapan Atom,
Perhitungan Persamaan Garis Regresi dan Koefisien Korelasi (r)
No. Konsentrasi (µg/ml) (X)
Absorbansi (Y)
1. 0,0000 0,0033
2. 0,2000 0,0254
3. 0,4000 0,0459
4. 0,6000 0,0674
5. 0,8000 0,0893
6. 1,0000 0,1155
No. X Y XY X2 Y2
1. 0,0000 0,0000 0,0000 0,0000 0,0000 2. 0,2000 0,0254 0,0051 0,0400 0,0006 3. 0,4000 0,0459 0,0184 0,1600 0,0021 4. 0,6000 0,0674 0,0404 0,3600 0,0045 5. 0,8000 0,0893 0,0714 0,6400 0,0080 6. 1,0000 0,1155 0,1155 1,0000 0,0133 ∑ 3,0000
X = 0,5000
0,3468
Y = 0,0578
0,2508 2,2000 0,0286
a =
( )
X nX n Y X XY / / 2 2
∑
∑
∑
∑ ∑
− − =(
)
(
3,0000)
/6 2000 , 2 6 / ) 3468 , 0 ( 0000 , 3 2508 , 0 2 − − = 0,1106Y = a X + b b = Y − aX
= 0,0578 – (0,1106)(0,5000) = 0,0025
Maka persamaan garis regresinya adalah: Y = 0,1106X + 0,0025
=
(
)(
)
(
)
Lampiran 9. Hasil Analisis Kadar Kalsium, Kalium dan Natrium dalam Apel Hijau
Kupas (AHK) 1.Hasil Analisis Kadar Kalsium
Sampel Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/ml)
Kadar (mg/100g) 1 25,009 0,0734 1,5703 1,5697 2 25,018 0,0740 1,5849 1,5837 3 25,001 0,0743 1,5922 1,5821 4 25,001 0,0795 1,7184 1,7183 5 25,027 0,0749 1,6067 1,6051 6 25,047 0.0790 1,7063 1,7030 2. Hasil Analisis Kadar Kalium
Sampel Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/ml)
Kadar (mg/100g) 1 25,009 0,0358 2,6474 264,6447 2 25,018 0,0393 2,9067 290,4608 3 25,001 0,0387 2,8622 286,2085 4 25,001 0,0385 2,8474 284,7286 5 25,027 0,0399 2,9511 294,7916 6 25,047 0,0365 2,6993 269,4234 3. Hasil Analisis Kadar Natrium
Sampel Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/ml)
Lampiran 10. Hasil Analisis Kadar Kalsium, Kalium dan Natrium dalam Apel Hijau
Tanpa Kupas (AHTK) 1.Hasil Analisis Kadar Kalsium
Sampel Berat Sampel (g)
Absorbansi (A)
Konsentrasi (µg/ml)
Kadar (mg/100g) 1 25,063 0,1002 2,2208 2,2152 2 25,010 0,1090 2,4344 2,4334 3 25,032 0,0879 1,9223 1