ENKAPSULASI BEBERAPA JENIS Trichoderma sp. PADA BENIH KEDELAI UNTUK MENGENDALIKAN PENYAKIT Sclerotium rolfsii Sacc.
SKRIPSI
OLEH : ELI SAPUTRI
090301009
AGROEKOTEKNOLOGI/HPT
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
ENKAPSULASI BEBERAPA JENIS Trichoderma sp. PADA BENIH KEDELAI UNTUK MENGENDALIKAN PENYAKIT Sclerotium rolfsii Sacc.
SKRIPSI
OLEH : ELI SAPUTRI
090301009
AGROEKOTEKNOLOGI/HPT
Skripsi Sebagai Salah Satu Syarat Untuk Mendapatkan Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan
Komisi Pembimbing
Ketua Pembimbing Anggota Pembimbing
(Dr. Lisnawita, SP, M.Si) (Ir. Mukhtar Iskandar Pinem, M.Agr NIP : 196910051994032001 NIP : 195301291979031001
)
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
ABSTRACT
Eli Saputri. 2014.“The Enkapsulated of Some Trichoderma. sp. on Soybean Seed to Control Sclerotium Rolfsii Sacc.”. Under supervised Lisnawita and Mukhtar Iskandar Pinem. The research was aimed to get species of Trichoderma which mixed alginat and tapioca soybean encapsulated seed to inhibiting S. rolfsii. This research was done in Laboratory of Plant Pathology, Faculty of Agriculture, University of North Sumatera, Medan since February untill April 2014. The method of this research was Randomized Block Design 3 Factor and sixteen treatments : A1B0C0 (Alginate), A2B0C0 (Tapioca), A1B0C1 (Alginate + S. rolfsii), A2BOC1(Tapioca + S. rolfsii), A1B1C0(Alginate + T. harzianum), A2B1C0 (Tapioca + T. harzianum), A1B2C0 (Alginat + T. koningii), A2B2C0(Tapioca + T. koningii), A1B3C0 (Alginate + T. viridae), A2B3C0(Tapioca + T. viridae), A1B1C1 (T. harzianum + Alginate + S. rolfsii), A2B1C1(T. harzianum + Tapioca + S. rolfsii), A1B2C1 (T. koningii + Alginate + S. rolfsii), A2B2C1(T. koningii + Tapioca + S. rolfsii), A1B3C1 (T. viridae + Alginate + S. rolfsii), A2B3C1 (T. viridae + Tapioca + S. rolfsi), respectivity with four replications. The result showed that the Trichoderma sp. isolates which mixed alginat and tapioca have high viability in inhibiting S. rolfsii damping off. All isolate of Trichoderma seed enabled to reduce damping off on soybean seed. The treatments A1B1C1, A2B1C1, A1B2C1 have high viability in inhibiting damping off by 100 % and followed A2B3C1 and A1B3C1 (75%) and A2B2C1 (50%). This result indicated that T. harzianum., T. koningii., and T. viridae might be used as potential biological control agenst againt S. rolfsii. They can reduce 100% damping off on soybean seed.
ABSTRAK
Eli Saputri. 2014. “Enkapsulasi Beberapa Jenis Trichoderma. sp. pada Benih Kedelai untuk Mengendalikan Penyakit Sclerotium Rolfsii Sacc.”. Di bawah bimbingan Lisnawita dan Mukhtar Iskandar Pinem. Penelitian ini bertujuan untuk mendapatkan spesies Trichoderma yang dicampur alginat dan tapioka mengenkapsulasi benih kedelai untuk menghambat serangan S. rolfsii. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan Februari sampai April 2014. Metode yang digunakan adalah Rancangan Acak Kelompok (RAK) 3 Faktor, dengan 16 kombinasi perlakuan yaitu A1B0C0 (Alginat), A2B0C0 (Tapioka), A1B0C1 (Alginat + S. rolfsii), A2BOC1 (Tapioka + S. rolfsii), A1B1C0 (Alginat + T. harzianum), A2B1C0 (Tapioka + T. harzianum), A1B2C0 (Alginat + T. koningii), A2B2C0 (Tapioka + T. koningii), A1B3C0 (Alginat + T. viridae), A2B3C0 (Tapioka + T. viridae), A1B1C1 (T. harzianum + Alginat + S. rolfsii), A2B1C1(T. harzianum + Tapioka + S. rolfsii), A1B2C1 (T. koningii + Alginat + S. rolfsii), A2B2C1 (T. koningii + Tapioka + S. rolfsii), A1B3C1 (T. viridae + Alginat + S. rolfsii), A2B3C1 (T. viridae + Tapioka + S. rolfsi), dengan 4 ulangan. Hasil penelitian menunjukkan bahwa tiga isolat Trichoderma sp. yang dicampur alginat dan tapioka memiliki viabilitas yang tinggi dalam menghambat rebah kecambah S. rolfsii. Semua isolat Trichoderma sp. terenkapsulasi yang diuji mampu mengendalikan penyakit rebah kecambah yang disebabkan oleh S. rolfsii pada tanaman kedelai. Perlakuan A1B1C1, A2B1C1, A1B2C1 memiliki kemampuan rebah kecambah sebesar 100 % diikuti dengan A2B3C1 dan A1B3C1 sebesar 75 % serta A2B2C1 sebesar 50% dengan fenotipik kecambah yang sehat. Ketiga jamur Trichoderma ini berpotensi sebagai agens pengendali hayati.
RIWAYAT HIDUP
Eli Saputri, lahir tanggal 9 Juni 1991 di Desa Subur, Kabupaten Asahan,
Sumatera Utara. Merupakan anak kedua dari dua bersaudara dari pasangan bapak Ponidi
dan ibu Sadiem.
Pendidikan Formal telah ditempuh adalah:
- SD Negeri 013852 di Desa Subur Lulus Tahun 2003
- SMP Negeri 7 di Kisaran Lulus Tahun 2006
- Madrasah Aliyah Negeri di Kisaran Lulus Tahun 2009
- Tahun 2009 Lulus Seleksi Masuk Universitas Sumatera Utara melalui jalur PMP
di Jurusan Agroekoteknologi, Fakultas Pertanian. Tahun 2012 pengambilan
minat Hama Penyakit Tumbuhan.
Pendidikan Informal:
- Tahun 2009-2012 sebagai anggota HIMAGROTEK (Himpunan Mahasiswa
Agroekoteknologi), Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2009-2012 sebagai anggota dan pengurus Nahdatussubhan Budidaya
Pertanian dan Perkebunan, Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2012 melaksanakan Praktek Kerja Lapangan (PKL) di perkebunan kelapa
sawit di PT. PP London Sumatera di Rambong Sialang, Perbaungan.
- Tahun 2012-2013 sebagai anggota dan pengurus KOMUS (Komunikasi
Muslim) Hama dan Penyakit Tumbuhan, Fakultas Pertanian Universitas
Sumatera Utara.
- Tahun 2012-2013 menjadi asisten Laboratorium Bioteknologi Pertanian Sub
- Tahun 2013 menjadi asisten Laboratorium Mikrobiologi Akuatik, Laboratorium
Hama Penyakit Ikan, Laboratorium Pestisida dan Tehnik Aplikasi, Ilmu Hama
Penyakit Tumbuhan Sub Penyakit, Laboratorium Ekologi Organisme
Pengganggu Tanaman, Laboratorium Pengendalian Hayati Sub Penyakit,
Fakultas Pertanian Universitas Sumatera Utara.
- Tahun 2013 melaksanakan penelitian di Laboratorium Penyakit Tumbuhan,
KATA PENGANTAR
Puji dan syukur penulis ucapkan atas kehadirat Tuhan Yang Maha Esa, karena
berkat rahmat dan hidayah-Nya penulis dapat menyelesaikan skripsi ini dengan
sebaik-baiknya.
Adapun judul dari proposal ini adalah “Enkapsulasi Beberapa Jenis Trichoderma sp. pada Benih Kedelai untuk Mengendalikan Penyakit Sclerotium rolfsii” merupakan salah satu syarat untuk mendapatkan gelar sarjana di Program Studi Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada
Dr. Lisnawita, SP, M.Si selaku ketua komisi pembimbing dan
Ir. Mukhtar Iskandar Pinem, M.Agr selaku anggota komisi pembimbing yang telah
memberikan bimbingan dan arahan kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena
itu, penulis mengharapkan saran dan kritik demi kesempurnaan skripsi ini.
Akhir kata, penulis mengucapkan terima kasih dan semoga skripsi ini
bermanfaat bagi kita semua.
Medan, November 2014
DAFTAR ISI
Faktor yang Mempengaruhi Perkembangan Penyakit ... 8
Pengendalian ... 9 Tempat dan Waktu Penelitian ... 16
Bahan dan Alat ... 16
Metode Penelitian ... 16
Pelaksanaan Penelitian ... 19
Inokulasi Patogen Penyebab Penyakit ... 19
Persiapan Bahan Tanaman ... 19
Enkapsulasi Benih Kedelai ... 19
Peubah Amatan ... 20
Tinggi Tanaman ... 20
Kejadian Penyakit ... 20
Bobot Akar Basah ... 21
Bobot Akar Kering ... 21
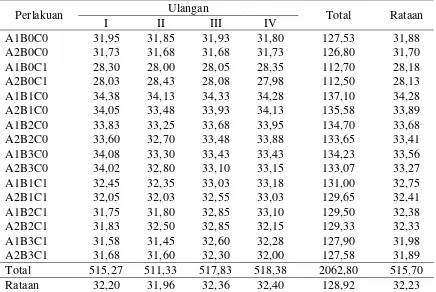
HASIL DAN PEMBAHASAN Tinggi Tanaman ... 22
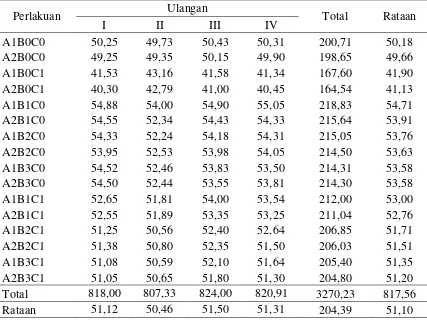
Kejadian Penyakit ... 27
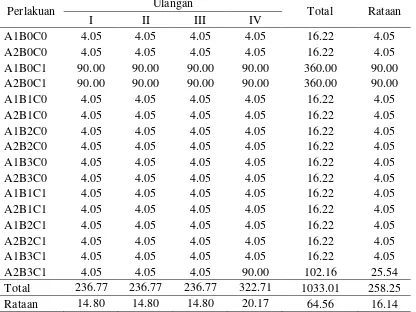
Bobot Akar Basah dan Bobot Akar Kering ... 30
KESIMPULAN DAN SARAN Kesimpulan ... 33
Saran ... 34
DAFTAR PUSTAKA
DAFTAR TABEL
No Judul Halaman
1
Tinggi tanaman kedelai yang diinokulasikan S. rolfsii pada media tanam dengan benih terenkapsulasi Trichoderma sp.
22
2
Kejadian penyakit tanaman kedelai yang diinokulasikan S. rolfsii dengan enkapsulasi Trichoderma sp.
31
3
Bobot akar basah tanaman kedelai yang diinokulasikan S. rolfsii dengan enkapsulasi Trichoderma sp.
DAFTAR GAMBAR
No. Judul Halaman
1 Gejala serangan S. rolfsii di lapangan 7
2 Mikroskopis T. harzianum 13
3 Pertumbuhan tinggi tanaman kedelai 25
DAFTAR LAMPIRAN
No Judul Halaman
1 Bagan penelitian 42
2 Tinggi tanaman kedelai pada pengamatan 1 MST 45
3 Tinggi tanaman kedelai pada pengamatan 2 MST 48
4 Tinggi tanaman kedelai pada pengamatan 3 MST 51
5 Tinggi tanaman kedelai pada pengamatan 4 MST 54
6 Persentase damping off tanaman kedelai 57
7 Bobot akar basah tanaman kedelai 61
8 Bobot akar kering tanaman kedelai 65
9 Foto tinggi tanaman kedelai 4 MST 69
10 Foto bobot akar tanaman kedelai 4 MST 70
11 Mikroskopis fungi Trichoderma sp. 71
12 Trichoderma pada media PDA 72
ABSTRACT
Eli Saputri. 2014.“The Enkapsulated of Some Trichoderma. sp. on Soybean Seed to Control Sclerotium Rolfsii Sacc.”. Under supervised Lisnawita and Mukhtar Iskandar Pinem. The research was aimed to get species of Trichoderma which mixed alginat and tapioca soybean encapsulated seed to inhibiting S. rolfsii. This research was done in Laboratory of Plant Pathology, Faculty of Agriculture, University of North Sumatera, Medan since February untill April 2014. The method of this research was Randomized Block Design 3 Factor and sixteen treatments : A1B0C0 (Alginate), A2B0C0 (Tapioca), A1B0C1 (Alginate + S. rolfsii), A2BOC1(Tapioca + S. rolfsii), A1B1C0(Alginate + T. harzianum), A2B1C0 (Tapioca + T. harzianum), A1B2C0 (Alginat + T. koningii), A2B2C0(Tapioca + T. koningii), A1B3C0 (Alginate + T. viridae), A2B3C0(Tapioca + T. viridae), A1B1C1 (T. harzianum + Alginate + S. rolfsii), A2B1C1(T. harzianum + Tapioca + S. rolfsii), A1B2C1 (T. koningii + Alginate + S. rolfsii), A2B2C1(T. koningii + Tapioca + S. rolfsii), A1B3C1 (T. viridae + Alginate + S. rolfsii), A2B3C1 (T. viridae + Tapioca + S. rolfsi), respectivity with four replications. The result showed that the Trichoderma sp. isolates which mixed alginat and tapioca have high viability in inhibiting S. rolfsii damping off. All isolate of Trichoderma seed enabled to reduce damping off on soybean seed. The treatments A1B1C1, A2B1C1, A1B2C1 have high viability in inhibiting damping off by 100 % and followed A2B3C1 and A1B3C1 (75%) and A2B2C1 (50%). This result indicated that T. harzianum., T. koningii., and T. viridae might be used as potential biological control agenst againt S. rolfsii. They can reduce 100% damping off on soybean seed.
ABSTRAK
Eli Saputri. 2014. “Enkapsulasi Beberapa Jenis Trichoderma. sp. pada Benih Kedelai untuk Mengendalikan Penyakit Sclerotium Rolfsii Sacc.”. Di bawah bimbingan Lisnawita dan Mukhtar Iskandar Pinem. Penelitian ini bertujuan untuk mendapatkan spesies Trichoderma yang dicampur alginat dan tapioka mengenkapsulasi benih kedelai untuk menghambat serangan S. rolfsii. Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan, Fakultas Pertanian Universitas Sumatera Utara, Medan pada bulan Februari sampai April 2014. Metode yang digunakan adalah Rancangan Acak Kelompok (RAK) 3 Faktor, dengan 16 kombinasi perlakuan yaitu A1B0C0 (Alginat), A2B0C0 (Tapioka), A1B0C1 (Alginat + S. rolfsii), A2BOC1 (Tapioka + S. rolfsii), A1B1C0 (Alginat + T. harzianum), A2B1C0 (Tapioka + T. harzianum), A1B2C0 (Alginat + T. koningii), A2B2C0 (Tapioka + T. koningii), A1B3C0 (Alginat + T. viridae), A2B3C0 (Tapioka + T. viridae), A1B1C1 (T. harzianum + Alginat + S. rolfsii), A2B1C1(T. harzianum + Tapioka + S. rolfsii), A1B2C1 (T. koningii + Alginat + S. rolfsii), A2B2C1 (T. koningii + Tapioka + S. rolfsii), A1B3C1 (T. viridae + Alginat + S. rolfsii), A2B3C1 (T. viridae + Tapioka + S. rolfsi), dengan 4 ulangan. Hasil penelitian menunjukkan bahwa tiga isolat Trichoderma sp. yang dicampur alginat dan tapioka memiliki viabilitas yang tinggi dalam menghambat rebah kecambah S. rolfsii. Semua isolat Trichoderma sp. terenkapsulasi yang diuji mampu mengendalikan penyakit rebah kecambah yang disebabkan oleh S. rolfsii pada tanaman kedelai. Perlakuan A1B1C1, A2B1C1, A1B2C1 memiliki kemampuan rebah kecambah sebesar 100 % diikuti dengan A2B3C1 dan A1B3C1 sebesar 75 % serta A2B2C1 sebesar 50% dengan fenotipik kecambah yang sehat. Ketiga jamur Trichoderma ini berpotensi sebagai agens pengendali hayati.
PENDAHULUAN
Latar Belakang
Kedelai merupakan tanaman asli Daratan Cina dan telah dibudidayakan oleh
manusia sejak 2500 SM. Sejalan dengan makin berkembangnya perdagangan
antarnegara yang terjadi pada awal abad ke-19, menyebabkan tanaman kedelai juga ikut
tersebar ke berbagai negara tujuan perdagangan tersebut, yaitu Jepang, Korea,
Indonesia, India, Australia, dan Amerika. Kedelai mulai dikenal di Indonesia sejak abad
ke-16. Awal mula penyebaran dan pembudidayaan kedelai yaitu di Pulau Jawa,
kemudian berkembang ke Bali, Nusa Tenggara, dan pulau-pulau lainnya. Pada
awalnya, kedelai dikenal dengan beberapa nama botani, yaitu Glycine soja dan Soja
max. Namun pada tahun 1948 telah disepakati bahwa nama botani yang dapat diterima
dalam istilah ilmiah, yaitu Glycinemax (L.) Merill. (Irwan, 2006).
Tanaman kedelai sejak awal pertumbuhan hingga panen tidak terlepas dari
gangguan hama, penyakit, dan gulma. Gangguan OPT terutama pada awal pertumbuhan
kedelai mengakibatkan penurunan hasil yang nyata sehingga perlu dikendalikan
(Saleh, 2008).
Salah satu kendala yang mempengaruhi produksi kedelai adalah gangguan
penyakit yang umum menyerang adalah rebah kecambah. Rebah kecambah yang
disebabkan oleh Sclerotium. rolfsii merupakan penyakit penting tanaman kedelai,
terutama pada musim hujan atau pada lahan yang drainasenya buruk. Infeksi S. rolfsii
pada kedelai biasanya mulai terjadi di awal pertumbuhan tanaman dengan gejala busuk
kecambah atau rebah kecambah (Malinda et al. 2012).
Sclerotium rolfsii merupakan jamur tular tanah yang dapat bertahan lama dalam
merupakan struktur yang tahan terhadap kondisi ekstrim. S. rolfsii dilaporkan
mempunyai kisaran tanaman inang yang luas antara lain wijen, bawang merah, bawang
putih, jahe, kedelai dan kacang tanah. Bahkan jamur ini dapat terus berkembang pada
produk pertanian pascapanen sehingga menurun kualitas produk. Selain itu, sklerosium
yang menempel pada biji yang akan dipakai sebagai benih merupakan sumber inokulum
pada musim penanaman berikutnya (Priyatmojo, 2009).
Selama ini pengendalian S. rolfsii adalah dengan cara mekanis, yaitu dengan
mencabut dan membuang tanaman yang sakit. Cara ini dinilai kurang efektif karena
patogen masih mampu bertahan lama di dalam tanah dengan membentuk organ
pembiakan yaitu sklerotia (Tarigan dan Kuswandi, 2010).
Dalam usaha pengendalian penyakit, menggunakan fungisida kimia lebih
populer dari pada biokontrol. Walau sering bertentangan dengan kelestarian lingkungan
karena menimbulkan banyak dampak negatif baik bagi lingkungan hewan maupun
manusia. Belakangan ini kesadaran masyarakat untuk menggunakan fungisida yang
ramah lingkungan mulai meningkat. Salah satu alternatif pengendalian adalah secara
hayati dengan menggunakan jamur yang bersifat antagonistik untuk meningkatkan
ketahanan induksi terhadap penyakit (Sudantha, 2009).
Salah satu cara penggunaan jamur antagonis ialah dengan tehnik enkapsulasi
yaitu merupakan teknik pembungkusan eksplan atau benih dengan suatu pembungkus
khusus yang membuat benih tidak mudah rusak dan memiliki viabilitas yang tinggi
untuk tumbuh.
Berdasarkan hal di atas maka dirasa perlu dilakukan percobaan menggunakan
jamur bersifat antagonistik yang di aplikasikan dengan bahan mudah terurai yang
(damping off) pada tanaman kedelai yang diupayakan dapat mengurangi pengendalian
yang selama ini masih menggunakan pengendalian secara kimiawi yang tidak aman
bagi ekosistem.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan spesies Trichoderma sp. yang
dicampur alginat dan tapioka pada benih kedelai untuk menghambat serangan S.
rolfsii.
Hipotesis Penelitian
Spesies Trichoderma sp. yang dicampur alginat dan tapioka pada benih kedelai
mampu menghambat serangan S. rolfsii..
Kegunaan Penelitian
− Untuk memperoleh spesies Trichoderma sp. yang efektif dan mudah diterapkan
oleh petani untuk mengendalikan penyakit rebah kecambah yang disebabkan
oleh S. rolfsii pada lahan pertanaman kedelai.
− Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Program
Studi Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan.
TINJAUAN PUSTAKA
Botani Tanaman
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Ordo : Rosales
Famili : Papilionaceae
Genus : Glycine
Species : Glycine max (L.) Merill
Sistem perakaran kedelai terdiri dari dua macam, yaitu akar tunggang dan akar
sekunder (serabut) yang tumbuh dari akar tunggang. Pertumbuhan batang kedelai
dibedakan menjadi dua tipe, yaitu tipe determinate dan indeterminate. Tanaman kedelai
mempunyai dua bentuk daun yang dominan dengan daun tunggal dan daun bertangkai
tiga (trifoliate leaves) yang tumbuh selepas masa pertumbuhan. Bunga sampai
pemasakan biji. Polong kedelai pertama kali terbentuk sekitar 7-10 hari setelah
munculnya bunga pertama (Irwan, 2006).
Syarat Tumbuh Iklim
Kedelai dapat tumbuh baik ditempat yang berhawa panas, ditempat-tempat
terbuka dan bercurah hujan 100 – 400 mm3 per bulan. Kedelai kebanyakan ditanam
didaerah yang terletak kurang dari 400 m diatas permukaan laut dan jarang sekali
ditanam didaerah yang terletak kurang dari 600 m diatas permukaan laut (Sumarno dan
Pada suhu yang lebih tinggi dari 30 0C, fotorespirasi cenderung mengurangi hasil
fotosintesis (Sutedjo dan Kartasapoetra,1987). Rata-rata curah hujan tiap tahun yang
cocok bagi kedelai adalah kurang dari 200 mm dengan jumlah bulan kering 3-6 bulan
dan hari hujan berkisar antara 95-122 hari selama setahun (Irwan, 2006).
Tanah
Tanaman kedelai sebenarnya dapat tumbuh di semua jenis tanah, namun
demikian, untuk mencapai tingkat pertumbuhan dan produktivitas yang optimal, kedelai
harus ditanam pada jenis tanah berstruktur lempung berpasir atau liat berpasir. Faktor
lain yang mempengaruhi keberhasilan pertanaman kedelai yaitu kedalaman olah tanah
yang merupakan media pendukung pertumbuhan akar (Irwan, 2006).
Patogen penyebab penyakit Biologi patogen
Menurut Alexopoulos dan Mims (1979), S. rolfsii dapat diklasifikasikan sebagai
berikut :
Kingdom : Mycetaceae
Divisi : Mycopyta
Kelas : Deuteromycetes
Ordo : Mycelia Steril
Famili : Agonomycetaceae
Genus : Sclerotium
Spesies : Sclerotium rolfsii Sacc.
Bentuk teleomorf dari cendawan S. rolfsii adalah Athelia rolfsii, termasuk ke
dalam kelompok cendawan Agonomycetes. Miselium cendawan S. rolfsii berwarna
panjang mencapai 350 μm (Semangun 1993). Hifa mempunyai satu atau lebih hubungan
jaringan yang sama. Sel hifa sekunder, tersier, dan seterusnya berukuran lebih kecil dari
sel primer dan mempunyai lebar 1,6–2 μm. Percabangannya membentuk sudut yang
lebih besar dan tidak mempunyai hubungan jaringan yang sama (Sumartini, 2012).
Untuk pemencaran dan untuk mempertahankan diri jamur membentuk sejumlah
sclerotia. Butir-butiran sclerotia mudah sekali lepas dan tersangkut air
(Semangun, 2004). Menurut Rahayu (2008), sklerotia merupakan pemampatan dari
himpunan miselia jamur, warnanya kecoklatan, berbentuk butiran kecil dengan diameter
1 mm, berkulit keras, dan mampu bertahan lama (dorman) di tanah dan residu tanaman.
Pada lapisan dalam sklerotia terdapat gelembung-gelembung yang merupakan
cadangan makanan. Bagian dalam sklerotia yang tua mengandung gula, asam amino,
asam lemak, dan lemak, sedangkan bagian dindingnya mengandung gula, kitin,
laminarin, asam lemak, dan β 1−3 glukosida. Permukaan sklerotium dapat
mengeluarkan eksudat berupa ikatan ion, protein, karbohidrat, enzim
endopoligalakturonase, dan asam oksalat. Asam oksalat yang dihasilkan S. rolfsii
bersifat racun terhadap tanaman (fitotoksik). S. rolfsii juga mengeluarkan L-prolin yang
merupakan antibiotik terhadap bakteri tertentu. Selama masa awal pertumbuhannya,
pembentukan asam oksalat meningkat (Sumartini, 2012).
Gejala Serangan
Rebah semai yang disebabkan oleh jamur S. rolfsii merupakan penyakit penting
tanaman kedelai, terutama pada musim hujan atau pada lahan yang drainasenya buruk.
Infeksi S. rolfsii pada kedelai biasanya mulai terjadi di awal pertumbuhan tanaman
dengan gejala busuk kecambah atau rebah kecambah. Pada tanaman kedelai berumur
bagian terinfeksi terlihat bercak berwarna coklat pucat dan di bagian tersebut tumbuh
miselia (Gambar 1b) (Rahayu, 2008).
Gambar 1.Gejala serangan S. rolfsii di lapangan (a) pangkal batang terinfeksi di selimuti miselia (b) pangkal batang terinfeksi berwarna kecoklatan (c) pertumbuhan sclerotia muda pada tanah di sekitar perakaran terinfeksi.
Sumber : Foto langsung.
S. rolfsii pertama kali menyerang batang, meskipun mungkin menginfeksi
beberapa bagian tanaman dibawah kondisi lingkungan yang sesuai termasuk akar, buah,
petiole, daun dan bunga. Tanda pertama infeksi, meskipun tidak terdeteksi adalah coklat
gelap pada batang atau di bawah tanah. Gejala pertama yang mungkin adalah proses
penguningan dan kelayuan pada daun, gejala berikutnya terlihat lapisan putih atau
benang miselium pada jaringan yang terinfeksi dalam tanah (Gambar 1a)
(Fichtner, 2006).
Faktor yang Mempengaruhi Perkembangan Penyakit
Sclerotium rolfsii merupakan salah satu jamur patogen yang dapat menyebabkan
beberapa penyakit mematikan pada tanaman seperti busuk batang, layu dan rebah
kecambah. Jamur ini merupakan jamur tular tanah yang dapat bertahan lama dalam
bentuk sklerotia di dalam tanah, pupuk kandang, dan sisa-sisa tanaman sakit. Di
samping itu, jamur tersebut dapat menyebar melalui air irigasi dan benih pada lahan
yang ditanami secara terus menerus dengan tanaman inang dari S. rolfsii tersebut,
sehingga mengakibatkan turunnya produksi tanaman yang akan dipanen
(Magenda et al. 2011).
Perkembangan jamur terjadi lebih cepat pada tanaman yang diperlakukan
dengan sungkup daripada tanpa sungkup, hal ini dikarenakan perbedaan kelembaban.
Pada tanaman yang disungkup, kelembaban mencapai 90%. S. rolfsii dari kacang tanah
semakin infektif pada kelembaban tinggi yang menyebabkan tingginya intensitas dan
luas serangan . Sebaliknya, pada kelembaban yang rendah akan memacu S. rolfsii untuk
membentuk sklerotia (Gambar 1c) (Sukamto dan Dono, 2013).
Sclerotium rolfsii merupakan salah satu jamur patogen yang dapat menyebabkan
beberapa penyakit mematikan pada tanaman seperti busuk batang, layu dan rebah
kecambah. Jamur ini merupakan jamur tular tanah yang dapat bertahan lama dalam
bentuk sklerotia di dalam tanah, pupuk kandang, dan sisa-sisa tanaman sakit. Di
samping itu, jamur tersebut dapat menyebar melalui air irigasi dan benih pada lahan
yang ditanami secara terus menerus dengan tanaman inang dari S. rolfsii tersebut
(Magenda et al. 2011).
Pengendalian Penyakit
Pengendalian S. rolfsii selama ini hanya secara mekanis dengan mencabut dan
membuang tanaman yang sakit. Cara pengendalian tersebut kurang efektif karena
patogen masih mampu bertahan lama di dalam tanah, dengan membentuk organ
pembiakan, yaitu sklerotia. Sklerotia merupakan pemampatan dari himpunan miselia
jamur, warnanya kecoklatan, berbentuk butiran kecil dengan diameter 1 mm, berkulit
keras, dan mampu bertahan lama (dorman) di tanah dan residu tanaman. S. rolfsii dapat
tanaman, dan penggunaan mikroorganisme antagonis dalam upaya pengendalian
penyakit secara hayati (Rahayu, 2008).
Keberhasilan pengendalian hayati sangat dipengaruhi oleh daya antagonis atau
daya hambat yang dimiliki suatu isolat, atau jumlah inokulum yang digunakan, dan cara
aplikasinya (Cook & Baker 1996). Aplikasi P. fluorescens melalui penyelaputan benih
(enkapsulasi), sangat sesuai dan praktis untuk pengendalian patogen tular tanah.
Masalah yang perlu mendapat perhatian dalam penggunaan P. fluorescens selain daya
hambat yang harus tinggi adalah konsentrasi aplikasi yang efektif (Rahayu, 2008).
Enkapsulasi
Enkapsulasi adalah suatu proses pembungkusan suatu bahan atau campuran
beberapa bahan dengan bahan lain. Bahan yang dibungkus atau bahan yang ditangkap
biasanya berupa cairan, walaupun ada juga yang berbentuk partikel padat atau gas yang
disebut sebagai bahan inti atau bahan aktif atau bahan
internal, sedangkan bahan yang berfungsi sebagai pembungkus disebut sebagai dinding
atau bahan pembawa atau membran. Proses enkapsulasi banyak digunakan untuk
mempertahankan flavor, asam, lipida, enzim, mikroorganisme, pemanis buatan, vitamin,
mineral, air, bahan pengembang, warna dan garam (Risch, 1995).
Penggunaan enkapsulasi dalam industri benih sangat efektif karena dapat
memperbaiki penampilan benih, meningkatkan daya simpan, mengurangi risiko tertular
penyakit dari benih di sekitarnya, dan dapat digunakan sebagai pembawa zat aditif,
misalnya antioksidan, anti mikroba, repellent, mikroba antagonis, zat pengatur tumbuh
Alginat
Alginat adalah zat koloidal hidrofilik yang diekstrasi dari ganggang laut
Macrocystis pyrifera dan Ascophyllum nodosum yang bersifat biokompatibel dan
biodegradabel terdiri dari β-D manuronat dan α–L guluronat yang dihubungkan dengan
ikatan (1-4) dengan berbagai perbandingan. Alginat yang tersedia secara komersial
adalah dalam bentuk garamnya yaitu natrium alginat. Keunikan natrium alginat yaitu
perubahannya menjadi hidrogel dengan 95% molekul air di dalamnya, yang merupakan
syarat penting untuk penggunaan dalam menjebak senyawa. Ketika natrium alginat
bertemu dengan kation divalent seperti Ca+2 menghasilkan pembentukan gel dimana
residu G dari alginat yang mengikat ion Ca+2 (Wang et al. 2006).
Teknik enkapsulasi ini dikembangkan oleh Redenbaugh et al. (1985) dengan
cara membungkus embrio somatik dengan natrium alginat, yaitu sejenis gel yang
diperkaya dengan hara, ZPT, mikroorganisme yang bersifat simbiosis misalnya
Rhizobium dan jamur VAM (Vesicular Arbuscular Mycorhyza) atau komponen lain
yang berfungsi dalam perkecambahan. Semakin tinggi konsenterasi alginat yang
digunakan akan mengakibatkan semakin padat kapsul yang terbentuk dan semakin
sempurna membungkus bibit mikro (Warnita dan Suliansyah, 2008).
Tapioka
Tepung tapioka mutlak diperlukan sebagai perekat antar komponen bahan
enkapsulasi dengan benih. Enkapsulasi dapat melindungi benih selama penyimpanan
BiologiTrichodermasp
Menurut Alexopoulos dan Mims (1979), Trichoderma sp. dapat diklasifikasikan sebagai berikut :
Kingdom : Mycetaceae
Divisi : Amastigomycota
Kelas : Denteromycetes
Ordo : Moniliales
Famili : Moniliaceae
Genus : Trichoderma
Spesies : Trichoderma harzianum
Trichoderma koningii
Trichoderma viridae
Pertumbuhan koloni Trichoderma mula-mula berbentuk anyaman miselium
dengan permukaan yang putih mulus berair dan kemudian berambut banyak karena
terjadinya pembentukan hifa-hifa baru. Selanjutnya koloni Trichoderma akan
berubah warna dan kelihatan hijau pekat sedangkan bagian bawahnya tetap tidak
berwarna. Miselium Trichoderma terdiri dari hifa-hifa yang transparan, berdinding
mulus, bersepta dan bercabang banyak. Hifa ini sering membentuk klamidiospor yang
timbul dalam posisi interseluler. Konidiofor akan muncul pada daerah percabangan
pada miselia. Konidia dapat dihasilkan dari ujung phialides (Gambar 2)
(Hasibuan, 2005).
Trichoderma sp. indigenus mampu memanfaatkan nutrisi, ruang dan tempat
tumbuh, serta mampu menghasilkan senyawa antibiosis yang menyebabkan
mikoparasit bagi jamur lain dengan tumbuh mengelilingi miselium patogen dan
menghasilkan enzim dari dinding miselia atau disebut dengan senyawa antibiosis yang
dapat menghambat bahkan membunuh patogen. Trichoderma sp. menghasilkan zat
antibiotik lain seperti trichotoxin yang dapat menyebabkan hifa patogen mengalami lisis
(Supriati et al. 2008).
Trichoderma mempunyai kemampuan menghasilkan kitinase. Enzim kitinase
yang dihasikan oleh Trichoderma sp lebih efektif dibandingkan kitinase yang dihasilkan
oleh organisme lain untuk menghambat berbagai fungi patogen tanaman. Kitinase
berperanan penting dalam pengendalian fungi patogen tanaman secara mikoparasitisme
(Umrah et al. 2009).
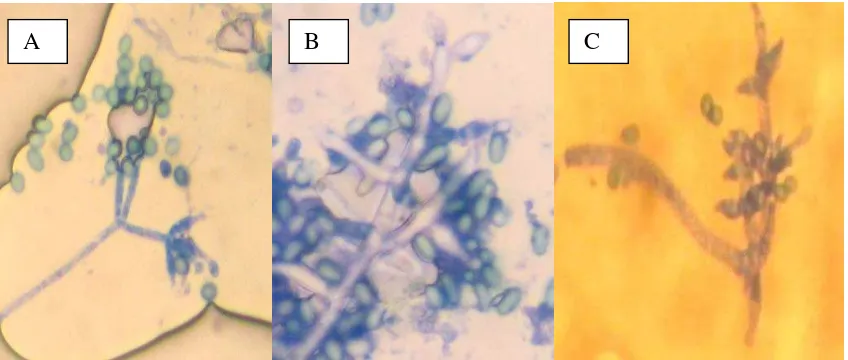
Gambar 2. Mikroskopis fungi (A) T. viridae (B) T. koningii (C) T. harzianum, Sumber : Foto langsung pada perbesaran 40 x 10.
Trichoderma spp. mempunyai konidia yang berdinding halus koloni mula-mula
berwarna hialin, lalu menjadi putih kehijauan, dan selanjutnya hijau tua terutama pada
bagian yang menunjukkan banyak terdapat konidia. Konidiofor dapat bercabang
menyerupai piramida yaitu pada bagian bawah cabang lateral yang berulang-ulang,
sedangkan semakin ke ujung percabangan menjadi bertambah pendek. Phialid tampak C
B
A B
langsing dan panjang terutama pada apeks dari cabang. konidia berbentuk semi bulat hingga
oval pendek (Purwantisari dan Hastuti, 2009).
Koloni jamur T.viridae tumbuh cepat, tiga hari setelah inokulasi menutupi
cawan petri (90,00 mm), berwarna putih, setelah terbentuk konidia berubah menjadi
hijau tua. Phialospore bentuk bulat, warna hijau dan diameter 3 – 5 µ. Phialide
terbentuk 2 – 3 pada ujung percabangan konidiofor, dan pada tiap ujung phialide
terbentuk phialospore (Gambar 2a)(Sudantha, 2009).
Koloni T. harzianum tumbuh cepat , tiga hari setelah inokulasi menutupi cawan
petri (90,00 mm). Setelah terbentuk konidia koloni berubah menjadi putih kehijauan.
Phialide tumbuh pada setiap ujung percabangan dan pada ujungnya
terdapt phialospore bentuk bulat sampai bulat lonjong, warna hijau pucat, berukuran 2,5
– 3,3 x 2,5 – 2,8µ (Gambar 2c) (Sudantha, 2009).
Secara makroskopis koloni jamur T. koningii pada usia 1-2 hari di awal
pertumbuhan berupa miselium putih lembut yang kemudian pada usia 3 hari berubah
menjadi hijau gelap membentuk lingkaran yang beraturan. Pada usia 5 hari koloni
mencapai diameter 8 cm pada media PDA. Pengamatan secara mikroskopis
menunjukkan tipe konidiofor bercabang tidak beraturan. Cabang dengan arah tak
beraturan dan berdinding halus berbintil. Phialide tersusun berpasangan/tunggal dan tak
beraturan. Konidia bulat atau lonjong sempit dengan diameter 1 μm dengan warna hijau
(Gambar 2b) (Wirawan et al., 2014).
T. harzianum menghasilkan beberapa antibiotik, di antaranya antibiotik
peptaibol yang bekerja secara sinergis dengan enzim ß (1,3) glukanase, senyawa 3- (2
hidroksipropil)-4-(2-heksadienil)-2(5H) furanon karbohidrat, air, oksigen, energi dan
alkil piron (6-n-pentil-2H- piran-2-on atau 6PP) yang mampu mengubah penyebaran
biomassa cendawan dengan kisaran luas. Asam amino bebas seperti asam pembentukan
dinding sel hifa. T. harzianum secara in vitro juga dapat menurunkan patogenitas
cendawan patogen (Mukarlina et al. 2010).
Dalam interaksi mikroparasitik Trichoderma sp. menghasilkan enzim-enzim
litik pendegradasi dinding sel jamur inang. Endokitinase merupakan enzim yang
mempunyai aktivitas antifugal yang paling tinggi disbanding enzim-enzim yang lain
(Wibowo et al. 2003). Mekanisme pengendalian Trichoderma sp. yang bersifat spesifik
target, membentuk koloni dengan cepat dan melindungi akar dari serangan jamur
patogen, mempercepat pertumbuhan tanaman dan meningkatkan hasil produksi
tanaman, menjadi keunggulan lain sebagai agen pengendali hayati. Beberapa
keunggulan Trichoderma sp. yang lain adalah mudah dimonitor dan dapat berkembang
biak, sehingga keberadaannya di lingkungan dapat bertahan lama serta aman bagi
lingkungan (Siregar, 2011).
Trichoderma viridae adalah kapang berfilamen yang sangat dikenal sebagai
organisme selulolitik dan menghasilkan enzim-enzim selullolitik, termasuk enzim
selobiohidrolase, endoglukanase dan ß-glukosidase. Kelebihan dari Trichoderma
viridae selain menghasilkan enzim selulolitik yang lengkap, juga menghasilkan enzim
xyloglukanolitik Keberadaan enzim ini akan semakin mempermudah enzim selulolitik
dalam memecah selulosa (Gunam et al. 2011).
Trichoderma koningii merupakan kompetitor yang kuat di daerah rhizosfer pada
perakaran dan merupakan jamur antagonis yang sering digunakan dalam pengendalian
pada patogen dengan cara cendawan antagonis membelit hifa cendawan patogen
(Soenartiningsih et al. 2011).
Semua spesies Trichoderma sp. akan tumbuh baik disekitar perakaran tanaman
yang sehat, sehingga terjadi simbiosis mutualisme antara jamur antagonis tersebut
dengan tanaman yang dilindunginya.. Mekanisme perlindungan tanaman oleh
Trichoderma sp. tidak hanya melibatkan serangan terhadap patogen pengganggu, tetapi
juga melibatkan produksi beberapa metabolit sekunder yang berfungsi meningkatkan
pertumbuhan tanaman dan akar, dan memacu mekanisme pertahanan tanaman itu
sendiri (Agustina et al. 2013).
Trichoderma sp. akan mempertahankan bagian tanah sehingga akan membentuk
struktur yang remah. Akar tanaman akan lebih mudah berkembang sehingga penyerapan
terhadap air dan kandungan unsur hara baik makro dan mikro lebih terpenuhi untuk
BAHAN DAN METODE Waktu dan Tempat Penelitian
Penelitian ini dilakukan di Laboratorium Penyakit Tumbuhan, Program Studi
Agroekoteknologi, Fakultas Pertanian, Universitas Sumatera Utara, Medan. Dengan
ketinggian tempat + 25 meter dpl. Penelitian dimulai pada bulan Februari sampai April
2014.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah bibit kedelai varietas
Grobogan, cup, tanah steril, air steril, alginat, tepung tapioka, alkohol 96 %, aquades,
media PDA, tissue, kapas, aluminium foil, clink warp, amplop, dan label.
Alat yang digunakan adalah handsprayer, alat tulis, object glass, mikroskop,
cawan petri, autoclave, erlenmeyer, selotipe, spidol, beaker glass, pengaduk, timbangan
analitik , cangkul, haemocytometer.
Metode penelitian
Penelitian dilakukan dengan menggunakan metode Rancangan Acak Kelompok
(RAK) 3 faktor dengan 4 ulangan.
Faktor I : Jenis bahan pelekat
A1 : Alginat
A2 : Tapioka
Faktor II : Agens hayati
B0 : tanpa Trichoderma sp. (control)
B1 : T. harzianum
B2 : T. koningii
Faktor III : Patogen
C0 : Tanpa S. rolfsii
C1 : S. rolfsii
Dengan kombinasi perlakuan sebagai berikut :
A1B0C0 A2B0C0 A1B0C1 A2BOC1
A1B1C0 A2B1C0 A1B2C0 A2B2C0
A1B3C0 A2B3C0 A1B1C1 A2B1C1
A1B2C1 A2B2C1 A1B3C1 A2B3C1
Jumlah ulangan diproleh dengan rumus sebagai berikut :
(t -1)(r-1) > 15
(16-1)(r-1) > 15
15r - 15 > 15
15r > 30
r > 2
r = 4
Perlakuan yang digunakan adalah sebagai berikut :
A1B0C0 : Alginat
A2B0C0 : Tapioka
A1B0C1 : Alginat + S. rolfsii
A2BOC1 : Tapioka + S. rolfsii
A1B1C0 : Alginat + T. harzianum
A2B1C0 : Tapioka + T. harzianum
A1B2C0 : Alginat + T. koningii
A1B3C0 : Alginat + T. viridae
A2B3C0 : Kontrol T. viridae + Tepung Tapioka
A1B1C1 : T. harzianum + Alginat + S. rolfsii
A2B1C1 : T. harzianum + Tepung Tapioka + S. rolfsii
A1B2C1 : T. koningii + Alginat + S. rolfsii
A2B2C1 : T. koningii + Tepung Tapioka + S. rolfsii
A1B3C1 : T. viridae + Alginat + S. rolfsii
A2B3C1 : T. viridae + Tepung Tapioka + S. rolfsi
Model linear yang digunakan adalah sebagai berikut :
Yijkl = µ + Ki + αj+ βk + ᵧl + (αβ)jk + (αᵧ)jl + (βᵧ)kl + (αβᵧ)jkl + ∑ijkl ;
Dimana :
Yijk = nilai pengamatan dari kelompok ke-I yang memperoleh taraf ke-j dari
faktor A, taraf ke-k dari faktor B da taraf ke-l dari faktor C.
μ = efek nilai tengah populasi
Ki = pangaruh aditif dari kelompok ke-i
αj = pangaruh aditif dari taraf ke-j faktor A
βk = pangaruh aditif dari taraf ke-k faktor B
ᵧl = pangaruh aditif dari taraf ke-l faktor C
(αβ)jk = pengaruh interak taraf ke-j faktor A dan taraf ke-k faktor B
(αᵧ)jl = pengaruh interak taraf ke-j faktor A dan taraf ke-l faktor C
(βᵧ)kl = pengaruh interak taraf ke-k faktor A dan taraf ke-l faktor C
(αβᵧ)jkl = pengaruh interak taraf ke-j faktor A, taraf ke-k faktor B dan taraf ke-l
faktor C
Pelaksanaan Penelitian
Isolasi patogen penyebab penyakit
Sumber inokulum diperoleh dari tanaman kedelai yang terserang penyakit rebah
kecambah S. rolfsii. Bagian yang terinfeksi seperti pangkal batang dibersihkan dengan
air steril lalu dipotong-potong selebar 1 cm. Setelah itu disterilkan dengan klorox 1%
selama + 1 menit dan dibilas 2 kali dengan air steril. Selanjutnya potongan tersebut
ditanam dalam media PDA (Potato Dextrose Agar) dan diinkubasi pada suhu kamar
selama 1 minggu. Setelah miselium S. rolfsii tumbuh, diisolasi kembali untuk
mendapatkan biakan murni.
Persiapan Bahan Tanaman
Sebanyak 64 cup diisi dengan tanah yang telah disterilkan, kemudian diletakkan
dengan jarak 50 cm antar perlakuan dan 100 cm antar ulangan. Setiap polibeg, ditanam
dengan 1 benih. Pemeliharaan tanaman yang dilakukan yaitu penyiraman tanaman pada
pagi hari.
Enkapsulasi Benih kedelai
Enkapsulasi tapioka, 5 g benih kedelai direndam ke dalam 10 ml suspensi
T. harzianum, T. koningii, T. viridae dengan kerapatan spora 106 kemudian dicampur
dengan 3 ml gliserol, 25 g tapioka dan 50 g tepung talk. Semua bahan dicampur
kemudian ditambahkan akuades steril sampai volumenya menjadi 100 ml lalu
dikeringanginkan (Nurwidada, 2010).
Enkapsulasi alginat, 5 g benih kedelai direndam ke dalam 10 ml suspensi
T. harzianum, T. koningii, T. viridae dengan kerapatan spora 106 kemudian
ditambahkan gliserol 3 ml, dan alginat 3%, semua bahan dicampur dan ditambahkan
Inokulasi Patogen pada Tanaman
Benih yang ditanam pada media yang tidak diinokulasi S. rolfsii digunakan
sebagai kontrol negatif sedangkan benih yang ditanam pada media yang diinokulasi S.
rolfsii digunakan sebagai control positif. Peubah yang diamati adalah tanaman yang
terserang rebah recambah selama masa persemaian 30 hari.
Peubah Amatan Tinggi Tanaman
Pengamatan tinggi tanaman dimulai dari umur 1 MST hingga 4 MST.
Pengamatan dilakukan dengan mengukur dari batang di atas permukaan tanah hingga
titik tumbuh tertinggi tanaman. Pengamatan dilakukan dengan interval 1 minggu sekali.
Kejadian Penyakit
Persentase rebah kecambah dihitung dari jumlah kecambah yang rebah dibagi
jumlah seluruh kecambah yang tumbuh.
Persentase damping off = Jumlah kecambah rebah Seluruh kecambah
x 100%
(Yuspita & Rustam,2003).
Bobot Basah Akar
Akar dicuci bersih dengan air mengalir kemudian akar ditiriskan, setelah akar
kering kemudian akar ditimbang dengan menggunakan timbangan analitik.
Bobot Kering Akar
Masing-masing akar diberi label, kemudian dimasukkan kedalam amplop dan
diberi label masing-masing perlakuan. Setelah itu akar dikering ovenkan dengan suhu
HASIL DAN PEMBAHASAN 1. Tinggi Tanaman
Analisis sidik ragam menunjukkan bahwa T. harzianum, T. koningii, T. viridae
berpengaruh nyata dalam meningkatkan pertumbuhan tanaman kedelai. Selengkapnya
dapat dilihat pada Tabel 1 dan Lampiran 2-5.
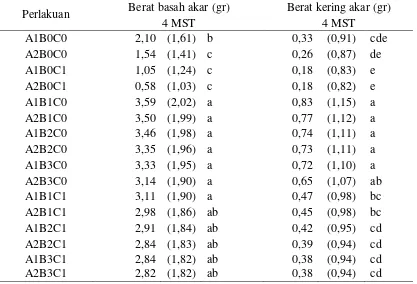
Tabel 1. Tinggi tanaman kedelai yang diinokulasikan S. rolfsii pada media tanam dengan benih terenkapsulasi Trichoderma sp.
Perlakuan Tinggi tanaman (cm)
1 MST 2 MST 3 MST 4 MST
Keterangan : angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%
MST : minggu setelah tanam
Tabel 1 menunjukkan bahwa pertumbuhan tinggi tanaman kedelai meningkat
pada perlakuan dengan pemberian Trichoderma sp. dibanding dari keadaan normal yaitu
dengan benih tanpa Trichoderma sp. dan S. rolfsii. Hal ini menunjukkan pemberian
Trichoderma yang disertakan dengan bahan enkapsulasi dapat meningkatkan
pertumbuhan tanaman. Peningkatan pertumbuhan tanaman dari minggu pertama hingga
dibanding tanaman yang tidak diberi Trichoderma. Pertumbuhan tanaman yang paling
terendah terdapat pada perlakuan yang diberi Sclerotium tetapi tidak diberi Trichoderma
(A1B0C1 dan A2B0C0) walaupun kedua benih dienkapsulasi dengan alginat dan
tapioka.
Lebih baiknya pertumbuhan tanaman yang diberi Trichoderma menunjukkan
bahwa T. harzianum, T. koningii, T. viridae mampu meningkatkan pertumbuhan
tanamana hal ini disebabkan karena agens antagonis seperti T. harzianum, T. koningii,
T. viridae memiliki mekanisme yang bersifat PGPF (Plant Growth Promoting Fungi)
yaitu dapat meningkatkan pertumbuhan tanaman, meningkatkan daya serap mineral
aktif, dan nutrisi lainnya dari dalam tanah. Menurut Cornejo et al. (2009), serapan hara
yang tinggi mempengaruhi pertumbuhan tanaman karena nutrisi tanaman terpenuhi,
sehingga produksi tanaman juga semakin tinggi). Peningkatan pertumbuhan tanaman
yang dipicu dengan adanya pemberian agens antagonis T. harzianum, T. koningii,
T. viridae juga disebabkan karena agens antagonis tersebut mampu merangsang
tanaman untuk memroduksi hormon asam giberelin (GA3), asam indolasetat (IAA), dan
benzylaminopurin (BAP) dalam jumlah yang lebih besar, sehingga pertumbuhan
tanaman lebih optimum, subur, sehat, kokoh, dan pada akhirnya berpengaruh pada
ketahanan tanaman. Hormon giberelin dan auksin berperan dalam pemanjangan akar
dan batang, merangsang pembungaan dan pertumbuhan buah serta meningkatkan
pertumbuhan tanaman. Lestari et al. (2007) menyatakan bahwa IAA yang dihasilkan
oleh mikroba endofit berpengaruh pada perkembangan akar dan dapat memperbaiki
produktivitas tanaman melalui stimulasi hormon.
Keragaman pertumbuhan tanaman yang terbentuk membukt ikan bahwa agens
tanaman, misalnya sebagai dekomposer bahan organik dan selulosa serta mampu
mempercepat pertumbuhan tanaman dan meningkatkan produksi. Siregar (2011)
menyatakan bahwa mekanisme pengendalian Trichoderma sp. bersifat spesifik target,
membentuk koloni dengan cepat dan melindungi akar dari serangan jamur patogen,
mempercepat pertumbuhan tanaman dan meningkatkan hasil produksi tanaman, menjadi
keunggulan lain sebagai agens pengendali hayati. Mukarlina et al. (2010) mengatakan
bahwa Trichoderma sp. juga berperan sebagai biodekomposer karena mampu
memanfaatkan bahan organik di alam terutama selulosa sebagai sumber karbon dan
energi untuk kebutuhan hidupnya.
Gambar 5. Pertumbuhan tinggi tanaman kedelai (a) tanaman terenkapsulas T. harzianum dengan pemberian S. rolfsii (b) tanaman terenkapsulasi T.
koningii dengan pemberian S. rolfsii (c) tanaman terenkapsulasi T. viridae dengan pemberian S. rolfsii.
Penggunaan metode enkapsulasi dalam industri benih seperti alginat dan
tapioka sangat efektif karena dapat meningkatkan daya simpan, mengurangi risiko
tertular penyakit dari benih di sekitarnya, dan dapat digunakan sebagai pembawa zat
aditif, misalnya antioksidan, anti mikroba, repellent, mikroba antagonis, zat pengatur
tumbuh dan lain-lain. Pada gambar 5a, menunjukkan bahwa benih kedelai yang di
enkapsulasi dan di tambah dengan agens hayati memiliki tingkat pertumbuhan yang
lebih baik di banding dengan benih yang di enkapsulasi tanpa bahan tambahan lain. Hal
c
ini sesuai dengan literatur dari Warnita dan Irfan (2008) yang menyatakan bahwa
alginat merupakan sejenis gel yang dapat diperkaya dengan hara, ZPT, mikroorganisme
yang bersifat simbiosis misalnya Rhizobium dan jamur VAM (Vesicular Arbuscular
Mycorhyza) atau komponen lain yang berfungsi dalam perkecambahan. Selain itu,
Priadi (2011) juga mengatakan bahwa tepung tapioka mutlak diperlukan sebagai
perekat antar komponen bahan enkapsulasi dengan benih. Enkapsulasi dapat melindungi
benih selama penyimpanan selama 1 tahun serta mempunyai viabilitas yang tinggi.
Trichoderma sp. bekerja secara spesifik serta sebagai decomposer yang sangat
menguntungkan bagi pertumbuhan tanaman. Pada gambar 5 menunjukkan bahwa T.
harzianum memiliki pengaruh yang sama dengan T. koningii dan T. viridae dalam
pengendalian penyakit dan peningkatan pertumbuhan tanaman. Hal ini disebabkan
karena semua Trichoderma merupakan biodekomposer dalam tanah yang hasilnya di
manfaatkan oleh tumbuhan sebagai penyedia unsur hara. Selain itu T. harzianum juga
mengeluarkan enzim kitinase yang akan menghancurkan dinding sel patogen hingga
akhirnya patogen akan mati sehingga tanah dan dan perakaran tanaman akan terbebas
dari infeksi patogen. Hal ini sesuai dengan literature dari Chamzurni et al. (2011) yang
menyatakan bahwa mekanisme T. harzianum terjadi bersamaan dengan penusukan hifa,
jamur mikoparasit ini mengeluarkan enzim seperti enzim kitinase dan β-1-3 glukanase
yang akan menghancurkan dinding sel cendawan patogen. Akibatnya, hifa cendawan
patogen akan rusak, protoplasmanya keluar dan cendawan akan mati. Secara bersamaan
pula terjadi mekanisme antibiosis, keluarnya senyawa anti cendawan golongan
peptaibol dan senyawa furanon oleh T. harzianum yang dapat menghambat
pertumbuhan spora dan hifa cendawan patogen. Gunam et al. (2011) juga
juga menghasilkan enzim xyloglukanolitik Keberadaan enzim ini akan semakin
mempermudah enzim selulolitik dalam memecah selulosa.
Gambar 6. Pertumbuhan tinggi tanaman kedelai normal dan terserang penyakit (a) tanaman terenkapsulasi tapioka tanpa Trichoderma dan tanpa S. rolfsii (b) tanaman terenkapsulasi dengan inokulasi S. rolfsii.
Sclerotium rolfsii. menyerang tanaman pada awal perkecambahan hingga masa
pertumbuhan vegetatif. Pada musim dingin penyakit ini sangat mudah menyebar. Pada
Gambar 6a dan 6b menunjukkan bahwa tanaman tanpa inokulum S. rolfsii tumbuh
subur dan baik di banding dengan tanaman yang di tanaman pada tanah yang terinfeksi
S.rolfsi. Serangan S.rolfsii menimbulkan gejala pada daun menguning dan layu, serta
pangkal batang yang berwarna kecoklatan. Pertumbuhan tanaman yang terserang
penyakit ini berjalan dengan lambat disebabkan karena penyakit juga menginfeksi akar,
hingga akhirnya jaringan perakaran menjadi rusak sehingga tanaman mendapatkan
unsur hara yang sedikit di bandingkan dengan perakaran tanaman normal. Hal ini
sesuai dengan literatur Fichtner (2006) menyatakan bahwa S. rolfsii menyerang
beberapa bagian tanaman di bawah kondisi lingkungan yang sesuai termasuk akar,
buah, petiole, daun dan bunga. Tanda pertama infeksi, meskipun tidak terdeteksi adalah
coklat gelap pada batang atau di bawah tanah (Gambar 1b). Gejala pertama yang
mungkin adalah proses penguningan dan kelayuan pada daun.
2. Kejadian Penyakit
Berdasarkan analisis sidik ragam diketahui bahwa pemberian agens hayati
T. harzianum., T. koningii., dan T. viridae perpengaruh nyata terhadap persentase rebah
kecambah S. rolfsii. pada tanaman kedelai. Selengkapnya dapat di lihat dari Tabel 2
dan Lampiran 6.
Tabel 2 menunjukkan bahwa adanya perbedaan yang nyata pada uji jarak
duncan di seluruh perlakuan. Benih kedelai yang telah terenkapsulasi ke 3
Trichoderma sp. memiliki ketahanan yang sangat besar dalam menghambat infeksi S.
rolfsii untuk masuk dan merusak jaringan tanaman, hingga akhirnya penih tanaman
yang terenkapsulasi T. harzianum., T. koningii., T. viridae memiliki penurunan kejadian
penyakit sebesar 50% hingga 0%. Sedangkan benih yang ditumbuhkan pada tanah
yang mengandung S. rolfsii sangat rentan terserang penyakit rebah kecambah.
Persentase kejadian penyakit tertinggi yaitu pada perlakuan enkapsulasi benih dengan
alginat dan S. rolfsii A1B0C1 dan perlakuan enkapsulasi benih dengan tapioka dan S.
rolfsii A2B0C1 yaitu sebesar 100%.
Trichoderma sp. menghasilkan enzim kitinase yang mampu menghancurkan
sel-sel hifa jamur patogen. Akibatnya pertumbuhan spora dan hifa patogen terhambat,
sehingga patogenitas untuk menginfeksi jaringan tanaman menjadi menurun. Wibowo
et al. (2003) menyatakan bahwa dalam interaksi mikroparasitik Trichoderma sp.
menghasilkan enzim-enzim litik pendegradasi dinding sel jamur inang. Endokitinase
merupakan enzim yang mempunyai aktivitas antifugal yang paling tinggi disbanding
enzim-enzim yang lain .Umroh et al. (2009) juga menambahkan bahwa T. harzianum
kitinase yang dihasikan oleh T. harzianum lebih efektif dibandingkan kitinase yang
dihasilkan oleh organisme lain untuk menghambat berbagai fungi patogen tanaman.
Tabel 2. Persentase kejadian penyakit tanaman kedelai yang diinokulasikan S. rolfsii dengan enkapsulasi Trichoderma sp.
Perlakuan Persentase damping off
Keterangan : angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%.
Sclerotium rolfsii merupakan penyakit yang terbawa oleh tanah (soil born), pada
perlakuan A1B0C0 dan A2B0C0 kejadian penyakit yang disebabkan S. rolfsii sebesar
0% disebabkan karena media tumbuh tanaman tidak terinfeksi oleh S. rolfsii, selain itu
perekat benih mampu melindungi benih dari gangguan alam seperti, kelembaban rendah
atau tinggi maupun serangan penyakit pada saat benih belum berkecambah. Warnita dan
Suliansyah (2008), semakin tinggi konsenterasi alginat yang digunakan akan
mengakibatkan semakin padat kapsul yang terbentuk dan semakin sempurna
3. Pengaruh Trichoderma Sp dan S. rolfsii terhadap bobot akar basah dan bobot akar kering tanaman kedelai
Berdasarkan analisis sidik ragam diketahui bahwa pemberian agens hayati T.
harzianum., T. koningii., dan T. viridae perpengaruh nyata terhadap bobot akar tanaman
kedelai. Selengkapnya dapat di lihat dari Tabel 3 dan Lampiran 7.
Tabel 3. Bobot akar basah tanaman kedelai yang diinokulasikan S. rolfsii dengan enkapsulsi Trichoderma sp.
Perlakuan Berat basah akar (gr) Berat kering akar (gr)
4 MST 4 MST
Keterangan : angka yang diikuti notasi huruf yang sama pada kolom yang sama menyatakan tidak berbeda nyata pada uji jarak duncan taraf 5%, angka yang di dalam kurung merupakan data transformasi dengan menggunakan
√x+0,5.
Tabel 3 menunjukan bahwa bobot akar basah A1B1C0 berbeda nyata dengan
perlakuan A1B0C0 maupun perlakuan A1B0C2. Hal ini menunjukan bahwa
mikroorganisme yang berperan sebagai agens pengendalian hayati mampu bersimbiosis
dengan tanah dan perakaran tanaman. Tanah menjadi remah sehingga pertumbuhan
miselium Trichoderma sp. akan mempertahankan bagian tanah sehingga akan
membentuk struktur yang remah. Dengan keadaan tersebut akar tanaman akan lebih
mudah berkembang dan penyerapan terhadap air dan kandungan unsur hara baik makro
dan mikro lebih terpenuhi untuk pertumbuhan. Menurut Agustina et al. (2013)
Trichoderma sp. tidak hanya melibatkan serangan terhadap patogen pengganggu, tetapi
juga melibatkan produksi beberapa metabolit sekunder yang berfungsi meningkatkan
pertumbuhan tanaman dan akar, dan memacu mekanisme pertahanan tanaman itu
sendiri.
Pengaruh agens hayati terhadap bobot basah akar menunjukkan nilai yang tidak
berbeda nyata dengan interaksi antara agens hayati dengan patogen. Nilai tengah
persentase bobot basah akar pada tanaman dengan pemberian agens hayati seperti T.
harzianum, T. koningii, T. viridae cenderung lebih tinggi, dibandingkan perlakuan
agens dengan inokulasi pathogen pada media. Namun sangat berbeda nyata dengan
perlakuan benih yang diinfeksikan dengan S.rolfsii sebesar. Hal ini dikarenakan benih
yang di enkapsulasi dengan alginat dan agens hayati sebagai bahan tambahan lebih
cepat berkecambah dibanding benih tanpa agens hayati. Menurut Rasyid (2005), salah
satu sifat terpenting dalam pemanfaatan alginat adalah kemampuannya untuk
membentuk gel yang bereaksi dengan ion-ion kalsium. Wang et al. (2006),
menambahkan bahwa keunikan natrium alginat yaitu perubahannya menjadi hidrogel
dengan 95% molekul air di dalamnya, yang merupakan syarat penting untuk penggunaan
dalam menjebak senyawa. Ketika natrium alginat bertemu dengan kation divalent seperti
Ca=2
. Hal ini juga menyebabkan benih kedelai yang dienkapsulasi dengan bahan pelekat alginat lebih cepat tumbuh dibanding tapioka yang hanya tersusun atas polisakarida
Berdasarkan Tabel 3 bobot akar basah tidak berbeda nyata dengan bobot akar
kering. Bobot basah akar dan bobot kering akar yang tinggi menunjukkan
perkembangan perakaran yang baik, karena penyerapan unsur hara yang tinggi dapat
dilihat dari tingginya nilai bobot basah dan bobot kering akar serta pertumbuhan
tanaman. Menurut Saputra (2010), volume akar yang tinggi menunjukkan kemampuan
akar dalam menyimpan air dan unsur hara yang diperlukan untuk pertumbuhan tanaman
semakin baik. Peningkatan bobot kering akar dipengaruhi oleh pertumbuhan vegetatif
tanaman itu sendiri, seperti tinggi tanaman dan jumlah daun. Akar yang dilindungi
dengan agens hayati memperlihatkan pertumbuhan tanaman yang lebih baik bila
dibandingkan dengan tanaman yang tidak terinfeksi agens hayati, sehingga proses
fotosintesis yang berlangsung juga akan optimal. Menurut Prasasti et al. (2013),
Semakin tinggi serapan air dan unsur hara pada tanaman menyebabkan proses
metabolisme semakin baik, sehingga pada akhirnya dapat meningkatkan pertumbuhan
dan hasil tanaman. Banyaknya serapan air dan unsur hara akan menjamin lebih baiknya
proses metabolisme tanaman seperti proses transportasi dan alokasi fotosintat.
Peningkatan metabolisme tanaman ini akan diiringi pula dengan peningkatan
KESIMPULAN Kesimpulan
1. T. harzianum., T. koningii., T. viridae sangat efektif untuk mengendalikan penyakit
rebah kecambah S. rolfsii. pada tanaman kedelai dan dapat meningkatkan
pertumbuhan tanaman.
2. Kejadian penyakit S. rolfsii yang dikendalikan dengan T. harzianum., T. koningii., T
viridae masing-masing sebesar 0%, 25% dan 50%.
3. Bobot akar basah tertinggi terdapat pada perlakuan benih terenkapsulasi alginat dan
T. harzianum (A1B1C0) yaitu sebesar 3,59 gr dan terendah terdapat pada perlakuan
benih terenkapsulasi tapioka dan S. rolfsii (A2B0C1) yaitu sebesar 0,58gr.
4. Bobot akar kering tertinggi terdapat pada perlakuan benih terenkapsulasialginat dan
T. harzianum (A1B1C0) yaitu sebesar 0,83 gr dan terendah terdapat pada perlakuan
benih terenkapsulasi dengan tapioka dan S. rolfsii (A2B0C1) yaitu sebesar 0,18 gr.
Saran
Disarankan enkapsulasi menggunakan alginat sebab benih yang dienkapsulasi
dengan Trichoderma sp. dan alginat memiliki pertumbuhan yang lebih baik dibanding
DAFTAR PUSTAKA
Abadi L. 2003. Ilmu Penyakit Tumbuhan II. Edisi Pertama. Bayumedia Publishing dan Fakultas Pertanian Universitas Brawijaya Malang Jawa Timur – Indonesia. 137 hal.
Agustina I., M I Pinem & F Zahara. 2013. Uji Efektivitas Jamur Antagonis Trichoderma Sp. dan Ggliocladium sp. untuk Mengendalikan Penyakit Lanas (Phytophthora nicotianae) pada Tanaman Tembakau Deli (Nicotiana Tabaccum L.). Fakultas Pertanian Universitas Sumatera Utara. Jurnal Online Agroekoteknologi. (1) 4 : 1140-1141.
Aslamiyah S. 2003. Optimalisasi dan Keefektifan Agen Biokontrol Trichoderma harzianum dalam Mengendalikan Penyakit Busuk Pangkal Batang Kelapa Sawit Secara In-Vitro. (Skripsi). Jurusan Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Syiah Kuala. Darussalam, Banda Aceh.
Alexopoulos C J & C W Mims. 1979. Introductory Mycologi. Jhon Wiley and Sons. New York.
Badan Pusat Statistik. 2013. Produksi Padi Jagung dan Kedelai (Angka Sementara Tahun 2012). Berita Resmi Statistik.
Bahari R., A Arief & Sukriadi. 2012. Daya Hambat Ekstrak Na-Alginat dari Alga Coklat Jenis Sargassum sp. Terhadap Proses Pematangan Buah Mangga dan Buah Jeruk. Universitas Hasanuddin. Jurnal Indonesia Chimica Acta. 5(2): 28.
Chamzurni T., R Sriwati & R D Selian. 2011. Efektivitas Dosis dan Waktu Aplikasi Trichoderma virens terhadap Serangan Sclerotium rolfsii pada Kedelai. Jurnal Floratek. Fakultas Pertanian. Unsyiah Banda Aceh. 6: 62 – 73.
Chet I., Y Henis & Kislev. 1969. Ultrastructure of sclerotia and hyphae of Sclerotium rolfsii Sacc. Gen. Microbiol. 57: 143–147.
Cook R J. & K F Baker. 1996. The Nature and Practice of Biological Control of Plant Pathogens. APS Press. The American Phytophatological Society. St Paul. Minnesot. USA.
Cornejo, C. H. A., L. Marcias-Rodrigues, C. Cortes-Penagos, and J. Lopez-Bucio. 2009. Trichoderma virens, a Plant Benefecial Fungus, Enhances Boimass Production and Promotes Lateral Root Growth Through an Auxin-Dependent Mechanism in Arabidopsis. Plant Physiol; 149 (3): 1579 - 1592.
Fatahuddin & J Bumbungan. 2011. Efektivitas Cendawan Entomopatogen (Fusarium sp.) terhadap Aphis glycines dan Empoasca terminalis pada Tanaman Kedelai. Universitas Hasanuddin Makassar. Sulawesi Selatan.
Fichtner, E. J. 2006. Sclerotium rolfsii. Kudzu of the Fungal World.
Gunam IPW., W R Aryanta & IBN S. Darma. 2011. Produksi Selulase Kasar dari Kapang Trichoderma viridae dengan Perlakuan Konsentrasi Substrat Ampas Tebu dan Lama Fermentasi. Fakultas Teknologi Pertanian, Universitas Udayana. Jurnal Biologi 15 (2) : 29 – 33
Hasibuan M. 2005.Uji Antagonis Trichoderma spp Terhadap Penyakit Layu (Fusarium oxysporum f.sp. capsici) pada Tanaman Cabai (Capsicum annum L.) di Lapangan. Skripsi. Universitas Sumatera Utara.
Hartal., Misnawaty & I Budi. 2010. Efektivitas Trichoderma sp. dan Gliocladium sp. dalam Pengendalian Layu Fusarium pada Tanaman Krisan. Fakultas Pertanian Universitas Bengkulu. Jurnal Ilmu-Ilmu Pertanian Indonesia. 12 (1) : 11.
Ilyas S. 2003. Teknologi Pelapisan Benih. Makalah Seminar Benih Pellet. Fakultas Pertanian. IPB. Bogor. Hlm 16.
Irwan A W. 2006. Budidaya Tanaman Kedelai (Glycine max (L.) Merill). Padjadjaran Univercity Press. Jatinangor.
Kinerley, C.M. & P. Mukherjee. 2010. Trichoderma virens.
Lestari P., D N Susilowati & E I Riyanti. 2007. Pengaruh Hormon Asam Indol Asetat yang Dihasilkan oleh Azospirillum sp. Terhadap Perkembangan Akar Padi. Jurnal Agro Biogen. 3(2): 66 – 71.
Magenda S., Kandao F & Umboh S. 2011. Karakteristik Isolat Jamur Sclerotium rolfsii dari Tanaman Kacang Tanah (Arachis hypogaea Linn). J Bioslogos. 1: 17-23.
Malinda L., D Suryanto. & K Nurtjahja. 2012. Penghambatan Serangan Sclerotium rolfsii Penyebab Rebah Kecambah pada Kedelai dengan Bakteri Kitinolitik. Fakultas Mipa. Universitas Sumatera Utara. Medan.
Mardhia Y. 2010. Aktivitas Antibakteri Edible Film dari Pati Tapioka Yang di Inkorporasi dengan Minyak Atsiri Daun Attarasa [Litsea Cubeba(Lour.) Pers.]. Skripsi. USU. Medan.
Nurwidada W. 2010. Karakteristik Mikrobiologis Granul Kultur Starter dengan Sinbiotik Terenkapsulasi untuk Menghasilkan Yogurt dan Dadih Sinbiotik. Pascasarjana. IPB .Bogor
Padget B., R Schneider & C A Hollier. 2011. Soybean Disease Management. Louisiana Agriculture.
Prasasti O H., K I Purwani & S Nurhatika. 2013. Uji Hayati Mikoriza Glomus
fasciculatum Terhadap Patogen Sclerotium rolfsii pada Tanaman Kacang Tanah (Arachis hypogaea L. var. Domba). Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember (ITS).
Priadi. 2011. Pengaruh Jenis & Kadar Bahan Enkapsulasierhadap Viabilitas Benih Mangium (Acacia Mangium Willd). Pusat Penelitian Bioteknologi-LIPI. Seminar Nasional HUT Kebun Raya Cibodas Ke-159.
Priyatmojo A. 2009. Peranan Jamur Tanah dalam Ilmu Penyakit Tumbuhan. Pidato Pengukuhan Jabatan Guru Besar dalam Ilmu Penyakit Tumbuhan pada Fakultas Pertanian Universitas Gadjah Mada. Universitas Gadjah Mada. Yogyakarta.
Purwantisari S & R B Hastuti. 2009. Isolasi dan Identifikasi Jamur Indigenous Rhizosfer Tanaman Kentang dari Lahan Pertanian Kentang Organik di Desa Pakis, Magelang. Jurnal BIOMA. 11 (2) : 45-53
Rahayu M. 2008. Efikasi Isolat Pseudomonas fluorescens terhadap Penyakit Rebah Semai pada Kedelai. Balai Penelitian Tanaman Kacang-Kacangan dan Umbi-Umbian. Malang. Penelitian Pertanian Tanaman Pangan. 27(3): 182.
Rasyid A. 2005. Beberapa Catatan Tentang Alginat. Oseana 30(1): 9-14
Redenbaugh K., D Slade P., R Viss & M E Kossler. 1985. In Colloquim on Progres and Prospects in Forest and Crop Biotechnology. F. Valentin (Ed.). Spinger-Verlag Berlin.
Risch, S. J. 1995. Encapsulation: Overview of Uses and Techniques. Abstrak. AS Symposium Series, Volume 590. American Chemical Society.
Rukmana R & Yuniarsih Y. 2001. Kedelai: Budidaya dan Pasca Panen. Kanisius. Jakarta.
Saleh N. 1998. Peningkatan Mutu Benih Kedelai Asal Sistem Jabalsim dari Aspek Kesehatan Benih. Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian. Malang.
Saputra V. 2010. Teknik Pembibitan Jarak Pagar (Jatropha curcas L.) dengan Metode Penyemaian. Skripsi. Fakultas Pertanian. Institut Pertanian Bogor. Bogor.
Sastrosupadi A. 2000. Rancangan Percobaan Praktis Bidang Pertanian. Kanisius. Jakarta.
Semangun H. 1993. Penyakit-penyakit Tanaman Pangan di Indonesia. Gadjah Mada University Press. Yogyakarta.
_____ 2004. Pengantar Ilmu Penyakit Tumbuhan. Gajah Mada University Press. Yogyakatra.
Siregar W N. 2011. Uji Efektifitas Jamur Antagonis Trichoderma Sp. dan Gliocladium sp. Untuk Mengendalikan Penyakit Rebah Semai (Phytium spp.) pada Tanaman Tembakau Deli (Nicotiana tabaccum L.) di Pembibitan.Skripsi. Fakultas Pertanian. Universitas Sumatera Utara. Medan.
Soenartiningsih M S., Pabbage & N. Djaenuddin. 2011. Penggunaan Inokulum Antagonis (Trichoderma dan Gliocladium) dalam Menekan Penyakit Busuk Pelepah pada Jagung. Balai Penelitian Tanaman Serealia. Seminar Nasional Serealia.
Sudantha I M. 2009. Karakterisasi Jamur Saprofit dan Potensinya untuk Pengendalian Jamur Fusarium oxysporum F. Sp. Vanillae pada Tanaman Vanili. Fakultas Pertanian. Universitas Mataram.Jurnal Agroteksos. 20 (1): 10-11.
______2010. Pengaruh Aplikasi Jamur Trichoderma spp. dan Serasah dalam Meningkatkan Ketahanan Terinduksi Tanaman Vanili Terhadap Penyakit Busuk Batang Fusarium. Fakultas Pertanian. Universitas Mataram. Jurnal Agroteksos. 20 (1): 10-11.
Sukamto & Dono W. 2013. Identifikasi dan Karakterisasi Sclerotium rolfsii Sacc. Penyebab Penyakit Busuk Batang Nilam (Pogostemon cablin Benth). Balai Penelitian Tanaman Rempah & Obat. Bogor. Bul Littro.24 (1): 37.
Sumarno & Harnoto. 1983. Kedelai dan Cara Bercocok Tanamnya. Pusat Penelitian dan Pengembangan Tanaman Pangan. Buletin Teknik. 6:53.
Sumartini. 2012. Penyakit Tular Tanah (Sclerotium rolfsii dan Rhizoctonia solani) Pada Tanaman Kacang kacangan dan Umbi-Umbian serta Cara Pengendaliannya. Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbianMalang. Jurnal Litbang Pertanian 31(1): 27-28.
Sutedjo M M & Kartasapoetra AG.1987. Pupuk dan Cara Pemupukan. Rineka Cipta. Jakarta.
Tarigan R & Kuswandi. 2010. Efektivitas Asal Isolat Bakteri Endofit dan Kerapatan Pengenceran dalam Mengendalikan Penyakit Busuk Batang (Sclerotium rolfsii Sacc) pada Tanaman Kedelai. Kebun Percobaan Tanaman Buah Berastagi dan Balai Penelitian Tanaman Buah Tropika Solok.
Umrah., T Anggraeni., R R Esyanti., I Nyoman P & Aryantha. 2009. Antagonisitas dan Efektivitas Trichoderma sp dalam Menekan Perkembangan Phytophthora palmivora pada Buah Kakao. Jurnal Agrol&.16 (1) : 9 – 16.
Wahyu E R., K I Purwani & S. Nurhatika. 2013. Pengaruh Glomus fasciculatum pada Pertumbuhan Vegetatif Kedelai yang Terinfeksi Sclerotium rolfsii. Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember (ITS). Jurnal Sains Dan Seni Pomits. 2 (2): 67.
Wang W., X Liu., Y Xie., H Zhang., W Yu., Y Xiong., W Xie & X Ma. 2006. Microencapsulation using natural polysaccharides for drug delivery and cell implantation. 16 3252 – 3267
Warnita & Suliansyah I. 2008. Pertumbuhan dan Ketahanan Bibit Mikro Kentang (Solanum tuberosum L.) Enkapsulasi Pada Beberapa Konsentrasi Alginat. Jurnal.Fakultas Pertanian. Unand. Padang. 1(3): 138-140.