TANAMAN KEDELAI (Glycine max (L.) Merill)
SKRIPSI
Oleh : SURYA HERNANDA
050302013 HPT
DEPARTEMEN HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PADA TANAMAN KEDELAI (Glycine max (L.) Merill)
SKRIPSI
Oleh : SURYA HERNANDA
050302013 HPT
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana Di Departemen Ilmu Hama dan Penyakit Tumbuhan Fakultas Pertanian
Universitas Sumatera Utara.Medan.
Disetujui Oleh :
(Ir. Mukhtar Iskandar Pinem, M.Agr)
2010
(Ir.Kasmal Arifin, MSi) Ketua Pembimbing Anggota Pembimbing
DEPARTEMEN ILMU HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
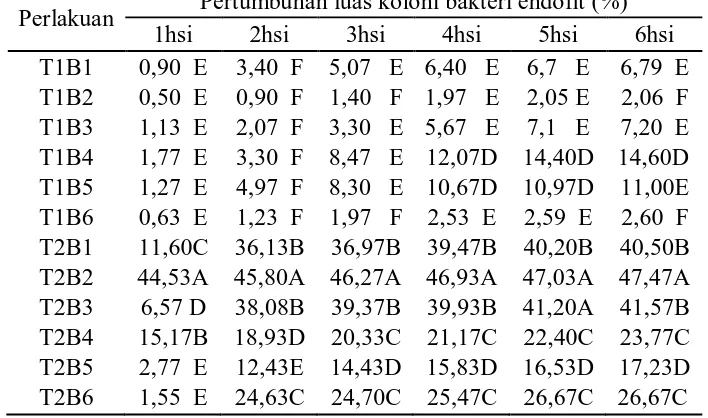
Surya Hernanda, An experiment of Antagonist Endophytic Bacteria And How Some Of Inoculation Sclerotium Rolffsi Sacc Stem Rot Disease Cause On Soybean Crop (Glycine Max (L.) Merrill). Under the guidance of Mr. Ir. Mukhtar Iskandar Pinem, M.Agr as chairman and Mr. Ir. Kasmal Arifin, Msi as members. The research aimed to test the power of the antagonism some endophytic bacteria against Sclerotium rolfsii Sacc causes stem rot disease on soybean (Glycine max (L.) Merrill.), As well as to determine the effect of inoculation against the way of the inhibition of endophytic bacteria. This research was conducted at Plant Pathology Laboratory of Plant Pests and Diseases Department, Agriculture Faculty, University of North Sumatra, Medan starts in January 2010 and completed in July 2010. Research using Completely Randomized Design (CRD) in factorial which consist of two factors. Factor 1: Technical Testing antagonist (T) with three levels, ie: T1: Dual culture methode (bacterial colonies + colonies of fungi), T2: Dual culture methode (filter paper drops of bacterial suspension + colonies of fungi), T3: The method of mixing the fungus on media. Factor 2 namely Endophytic Bacteria (B) with six levels: B1: Endophytic Bacteria A, B2: Endophytic Bacteria B, B3: Endophytic Bacteria C, B4: Endophytic Bacteria D, B5: Endophytic Bacteria E, B6: Corynebacterium. The result is five isolates of endophytic bacteria, each bacterium has its distinct antagonism against fungi S. rolffsi. Results showed the percentage of the highest growth inhibiting zone is in T2B3 treatment that is equal to 90%, T2B1 treatment of 82. 00%, the T2B2 treatment amounted to 75.00%, T2B6 treatment amounted to 71.80%, T2B4 treatment amounted to 47.40%, T2B5 treatment for 21:33%, T1B1 treatment is 8.10%, amounting to 7.83% T1B3 treatment, T1B4 treatment for 7:00%, T1B5 treatment amounted to 5.67% , T1B6 treatment of 5:33% and the lowest in T1B2 treatment that is equal to 3.00 %. Size endophytic bacteria colony growth was highest in T2B2 treatment that is equal to 47.47%, T2B3 treatment followed by 41.57%, amounting to 40.50% T2B1 treatment, T2B6 treatment for 26.67%, T2B4 treatment for 23.77%, amounting to 14.60% T1B4 treatment , T1B5 treatment of 11:00%, T1B3 treatment of 7:20%, amounting to 6.79% T1B1 treatment and the lowest in T1B2 treatment that is equal to 2:06%.
Surya Hernanda, Uji Antagonisme Beberapa Bakteri Endofit Dan Cara Inokulasi Terhadap Sclerotium Rolffsi Sacc Penyebab Penyakit Busuk Batang Pada Tanaman Kedelai (Glycine Max (L.) Merill). Dibawah bimbingan Bapak Ir. Mukhtar Iskandar Pinem, M.Agr selaku ketua dan Bapak Ir. Kasmal Arifin, Msi selaku anggota. Penelitian bertujuan untuk menguji daya antagonisme beberapa bakteri endofit terhadap Sclerotium rolfsii Sacc penyebab penyakit busuk batang pada tanaman kedelai (Glycine max (L) Merrill.), serta untuk mengetahui pengaruh cara inokulasi terhadap daya hambat dari bakteri endofit. Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara, Medan mulai dari bulan Januari 2010 dan selesai bulan Juli 2010. Penelitian menggunakan Rancangan Acak Lengkap (RAL) faktorial yang terdiri dari 2 faktor. Faktor 1 : Teknik Pengujian antagonis (T) dengan 3 taraf yaitu : T1 : Metode dua biakan (koloni bakteri + koloni jamur), T2 : Metode dua biakan (kertas saring yang ditetesi suspensi bakteri + koloni jamur), T3 : Metode pencampuran jamur pada media. Faktor 2 yaitu Bakteri Endofit (B) dengan 6 taraf yaitu B1 : Bakteri Endofit A, B2 : Bakteri Endofit B, B3 : Bakteri Endofit C, B4 : Bakteri Endofit D, B5 : Bakteri Endofit E, B6 : Corynebacterium. Dari hasil penelitian didapat 5 isolat bakteri endofit yang masing-masing bakteri tersebut memiliki daya antagonisme yang berbeda terhadap jamur S. rolffsi. Hasil penelitian menunjukkan persentase zona penghambat pertumbuhan yang tertinggi adalah pada perlakuan T2B3 yaitu sebesar 90 %, perlakuan T2B1 sebesar 82. 00 %, perlakuan T2B2 sebesar 75.00 %, perlakuan T2B6 sebesar 71.80 %, perlakuan T2B4 sebesar 47.40 %, perlakuan T2B5 sebesar 21.33 %, perlakuan T1B1 sebesar 8.10 %, perlakuan T1B3 sebesar 7.83 %, perlakuan T1B4 sebesar 7.00 %, perlakuan T1B5 sebesar 5.67 %, perlakuan T1B6 sebesar 5.33 % dan yang terendah pada perlakuan T1B2 yaitu sebesar 3.00 %. Luas pertumbuhan koloni bakteri endofit yang tertinggi adalah pada perlakuan T2B2 yaitu sebesar 47,47 %, diikuti perlakuan T2B3 sebesar 41.57 %, perlakuan T2B1 sebesar 40.50 %, perlakuan T2B6 sebesar 26.67 %, perlakuan T2B4 sebesar 23,77 %, perlakuan T1B4 sebesar 14.60 %, perlakuan T1B5 sebesar 11.00 %, perlakuan T1B3 sebesar 7.20 %, perlakuan T1B1 sebesar 6.79 % dan yang terendah pada perlakuan T1B2 yaitu sebesar 2.06 %.
Puji dan syukur penulis panjatkan kehadirat Allah SWT, atas rahmat dan
hidayah - Nya penulis dapat menyelesaikan skripsi ini. Adapun judul dari
skripsi ini adalah “Uji Antagonisme Beberapa Bakteri Endofit dan Cara
Inokulasi Terhadap Sclerotium rolfsii Sacc. Penyebab Penyakit Busuk Batang Pada Tanaman Kedelai (Glycine max (L.) Merill)”. yang merupakan salah satu syarat untuk memperoleh gelar sarjana di Fakultas Pertanian,
Universitas Sumatera Utara, Medan.
Pada kesempatan ini, penulis mengucapkan banyak terima kasih kepada
Komisi Pembimbing Bapak Ir. Mukhtar Iskandar Pinem, M.Agr., selaku ketua,
dan Bapak Ir. Kasmal Arifin, Msi., selaku anggota yang telah banyak memberikan
bimbingan dan arahan kepada penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa dalam penulisan skripsi ini masih banyak
terdapat kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang
bersifat membangun demi kesempurnaan skripsi ini. Akhir kata penulis
mengucapkan banyak terima kasih.
Medan, Agustus 201
Halaman
Pembuatan Media PDA ... 11
Pembuatan Media NA ... 12
Pembuatan Media King’ B ... 12
Isolasi Bakteri Endofit ... 12
Isolasi Jamur S. rolffsi ... 13
Identifikasi Jamur ... 13
Identifikasi Morfologi Koloni Bakteri Endofit ... 14
Identifikasi Morfologi Sel Bakteri Endofit ... 14
Uji Motilitas Bakteri Endofit ... 17
Uji Pendar Flour ... 17
Morfologi Koloni Bakteri Endofit ... 20 Morfologi Koloni Bakter ... 24
Morfologi Sel Bakteri... 24
Motilitas Bakteri Endofit ... 25
Bakteri Endofit Pendar Flour ... 25
Pengaruh Inokulasi Bakteri Endofit (B) Terhadap Pertumbuhan
Pengaruh Teknik Pengujian (T) Terhadap Pertumbuhan (%) Koloni Bakteri Endofit ... 33
Pengaruh Interaksi Teknik Pengujian (T) dan Jamur S. Rolffsi Terhadap Pertumbuhan (%) Koloni Bakteri Endofit...34
Persentase Zona Penghambat Pertumbuhan...36
Hasil Pengujian Daya Antagonisme Bakteri Endofit Terhadap Jamur Srolffsi Dengan Teknik Pencampuran Jamur Kedalam Medi....38
KESIMPULAN DAN SARAN Kesimpulan ... 40
Saran ... 41
No. Judul Halaman
1. Morfologi koloni bakteri endofit ...24 2. Morfologi sel bakteri endofit...24 3. Hasil Uji Motilitas bakteri endofit ...25 4. Beda uji rataan pengaruh inokulasi bakteri endofit terhadap pertumbuhan (%)
miselium jamur S. Rolffsi pada pengamatan 1 – 6 hsi...26 5. Beda uji rataan pengaruh teknik pengujian (T) terhadap pertumbuhan (%)
miselium jamur S. rolffsi pada pengamatan 1 – 6 hsi...27 6. Beda uji rataan interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap
pertumbuhan (%) miselium jamur S. rolffsi pada pengamatan 1 – 6 hsi...29 7. Beda uji rataan pengaruh inokulasi jamur S. Rolffsi terhadap pertumbuhan (%)
koloni bakteri endofit pada pengamatan 1 – 6 hsi...31 8. Beda uji rataan pengaruh teknik pengujian (T) terhadap pertumbuhan (%)
bakteri endofit pada pengamatan 1 – 6 hsi...33 9. Beda uji rataan interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap
pertumbuhan (%) miselium jamur S. rolffsi pada pengamatan 1 – 6 hsi...34 10. Beda uji rataan interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap
zona penghambat pertumbuhan (%)...36 11. Hasil Pengujian Dengan Teknik Pencampuran Jamur ke dalam Media
No. Judul Halaman
15. Histogram pengaruh inokulasi bakteri endofit terhadap pertumbuhan (%) miselium jamur S. Rolffsi pada pengamatan 1 – 6 hsi...27
16. Histogram pengaruh inokulasi bakteri endofit terhadap pertumbuhan (%) miselium jamur S. Rolffsi pada pengamatan 1 – 6 hsi...28
17. Histogram pengaruh interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap pertumbuhan (%) miselium jamur S. Rolffsi Pada pengamatan 1-6 hsi...30
20. Histogram pengaruh teknik pengujian (T) terhadap pertumbuhan (%) koloni bakteri endofit...35
No. Judul Halaman 1. Bagan Penelitian...44 2. Photo Penelitian...45 3. Pengenalan Bagian Planimeter...49 4. Data Pengamatan Pertumbuhan Luas Miselium Jamur S. Rolffsi 1-6 hsi..50 5. Data Pengamatan Pertumbuhan Luas Koloni Bakteri 1-6 hsi...69 6. Data Zona Penghambat Pertumbuhan...87
Surya Hernanda, An experiment of Antagonist Endophytic Bacteria And How Some Of Inoculation Sclerotium Rolffsi Sacc Stem Rot Disease Cause On Soybean Crop (Glycine Max (L.) Merrill). Under the guidance of Mr. Ir. Mukhtar Iskandar Pinem, M.Agr as chairman and Mr. Ir. Kasmal Arifin, Msi as members. The research aimed to test the power of the antagonism some endophytic bacteria against Sclerotium rolfsii Sacc causes stem rot disease on soybean (Glycine max (L.) Merrill.), As well as to determine the effect of inoculation against the way of the inhibition of endophytic bacteria. This research was conducted at Plant Pathology Laboratory of Plant Pests and Diseases Department, Agriculture Faculty, University of North Sumatra, Medan starts in January 2010 and completed in July 2010. Research using Completely Randomized Design (CRD) in factorial which consist of two factors. Factor 1: Technical Testing antagonist (T) with three levels, ie: T1: Dual culture methode (bacterial colonies + colonies of fungi), T2: Dual culture methode (filter paper drops of bacterial suspension + colonies of fungi), T3: The method of mixing the fungus on media. Factor 2 namely Endophytic Bacteria (B) with six levels: B1: Endophytic Bacteria A, B2: Endophytic Bacteria B, B3: Endophytic Bacteria C, B4: Endophytic Bacteria D, B5: Endophytic Bacteria E, B6: Corynebacterium. The result is five isolates of endophytic bacteria, each bacterium has its distinct antagonism against fungi S. rolffsi. Results showed the percentage of the highest growth inhibiting zone is in T2B3 treatment that is equal to 90%, T2B1 treatment of 82. 00%, the T2B2 treatment amounted to 75.00%, T2B6 treatment amounted to 71.80%, T2B4 treatment amounted to 47.40%, T2B5 treatment for 21:33%, T1B1 treatment is 8.10%, amounting to 7.83% T1B3 treatment, T1B4 treatment for 7:00%, T1B5 treatment amounted to 5.67% , T1B6 treatment of 5:33% and the lowest in T1B2 treatment that is equal to 3.00 %. Size endophytic bacteria colony growth was highest in T2B2 treatment that is equal to 47.47%, T2B3 treatment followed by 41.57%, amounting to 40.50% T2B1 treatment, T2B6 treatment for 26.67%, T2B4 treatment for 23.77%, amounting to 14.60% T1B4 treatment , T1B5 treatment of 11:00%, T1B3 treatment of 7:20%, amounting to 6.79% T1B1 treatment and the lowest in T1B2 treatment that is equal to 2:06%.
Surya Hernanda, Uji Antagonisme Beberapa Bakteri Endofit Dan Cara Inokulasi Terhadap Sclerotium Rolffsi Sacc Penyebab Penyakit Busuk Batang Pada Tanaman Kedelai (Glycine Max (L.) Merill). Dibawah bimbingan Bapak Ir. Mukhtar Iskandar Pinem, M.Agr selaku ketua dan Bapak Ir. Kasmal Arifin, Msi selaku anggota. Penelitian bertujuan untuk menguji daya antagonisme beberapa bakteri endofit terhadap Sclerotium rolfsii Sacc penyebab penyakit busuk batang pada tanaman kedelai (Glycine max (L) Merrill.), serta untuk mengetahui pengaruh cara inokulasi terhadap daya hambat dari bakteri endofit. Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan Departemen Hama dan Penyakit Tumbuhan Fakultas Pertanian Universitas Sumatera Utara, Medan mulai dari bulan Januari 2010 dan selesai bulan Juli 2010. Penelitian menggunakan Rancangan Acak Lengkap (RAL) faktorial yang terdiri dari 2 faktor. Faktor 1 : Teknik Pengujian antagonis (T) dengan 3 taraf yaitu : T1 : Metode dua biakan (koloni bakteri + koloni jamur), T2 : Metode dua biakan (kertas saring yang ditetesi suspensi bakteri + koloni jamur), T3 : Metode pencampuran jamur pada media. Faktor 2 yaitu Bakteri Endofit (B) dengan 6 taraf yaitu B1 : Bakteri Endofit A, B2 : Bakteri Endofit B, B3 : Bakteri Endofit C, B4 : Bakteri Endofit D, B5 : Bakteri Endofit E, B6 : Corynebacterium. Dari hasil penelitian didapat 5 isolat bakteri endofit yang masing-masing bakteri tersebut memiliki daya antagonisme yang berbeda terhadap jamur S. rolffsi. Hasil penelitian menunjukkan persentase zona penghambat pertumbuhan yang tertinggi adalah pada perlakuan T2B3 yaitu sebesar 90 %, perlakuan T2B1 sebesar 82. 00 %, perlakuan T2B2 sebesar 75.00 %, perlakuan T2B6 sebesar 71.80 %, perlakuan T2B4 sebesar 47.40 %, perlakuan T2B5 sebesar 21.33 %, perlakuan T1B1 sebesar 8.10 %, perlakuan T1B3 sebesar 7.83 %, perlakuan T1B4 sebesar 7.00 %, perlakuan T1B5 sebesar 5.67 %, perlakuan T1B6 sebesar 5.33 % dan yang terendah pada perlakuan T1B2 yaitu sebesar 3.00 %. Luas pertumbuhan koloni bakteri endofit yang tertinggi adalah pada perlakuan T2B2 yaitu sebesar 47,47 %, diikuti perlakuan T2B3 sebesar 41.57 %, perlakuan T2B1 sebesar 40.50 %, perlakuan T2B6 sebesar 26.67 %, perlakuan T2B4 sebesar 23,77 %, perlakuan T1B4 sebesar 14.60 %, perlakuan T1B5 sebesar 11.00 %, perlakuan T1B3 sebesar 7.20 %, perlakuan T1B1 sebesar 6.79 % dan yang terendah pada perlakuan T1B2 yaitu sebesar 2.06 %.
Latar Belakang
Kedelai (Glycine max (L) Merrill) mempunyai peranan cukup besar dalam
memenuhi kebutuhan gizi masyarakat. Komoditi tersebut merupakan sumber
protein nabati yang efesien dan menduduki tempat pertama diantara tanaman
kacang-kacangan (Sumarno dan Harnoto, 1983).
Produksi kedelai tahun 2009 berdasarkan data BPS mencapai 974.510 ton
meningkat 198.800 ton atau 25,63% dibandingkan dengan tahun sebelumnya.
Berdasarkan angka ramalan BPS, produksi kedelai tahun 2010 turun 47.130 ton
atau 4,84% dibandingkan dengan tahun sebelumnya. Penurunan produksi itu
diperkirakan terjadi akibat penurunan luas panen seluas 44.350 ha atau 6,14%.
Sementara itu, produktivitas diperkirakan naik 0,02 lon per ha atau 1,41% menjadi
1,38 ton per ha dibandingkan dengan tahun lalu 1,35 ton per ha. Perkiraan
penurunan produksi kedelai itu sangat berkebalikan dengan target swasembada
kedelai pada 2014.
Salah satu penghambat yang dapat menurunkan produksi kedelai adalah
gangguan penyakit yang disebabkan oleh serangan jamur Sclerotium rolfsii Sacc.
Semangun (1991) mengemukakan bahwa penyakit oleh S. rolfsii Sacc merupakan
penyakit potensial pada tanaman kedelai karena tanaman yang terserang akan mati
dan patogen dapat bertahan lama di dalam tanah dalam bentuk sklerotia.
Penyakit oleh S. rolfsii Sacc ini sering ditemukan serangannya pada kedelai baik
sebesar 5-55 %. Tingkat serangan lebih dari 5 % di lapang sudah dapat merugikan
secara ekonomi, tanaman kedelai yang terserang hasilnya akan rendah atau sama
sekali gagal panen. Kehilangan hasil oleh S. rolfsii Sacc dapat mencapai 30 %,
kerugian ini sering terjadi pada lahan-lahan yang selalu ditanami tanaman kedelai
dan kacang-kacangan lainnya (Wahyuningsih, 2005).
Pengendalian S. rolfsii selama ini hanya secara mekanis dengan mencabut
dan membuang tanaman yang sakit. Cara pengendalian tersebut kurang efektif
karena patogen masih mampu bertahan lama di dalam tanah, dengan membentuk
organ pembiakan, yaitu sklerosia. Sklerosia merupakan pemampatan dari
himpunan miselia jamur, warnanya kecoklatan, berbentuk butiran kecil dengan
diameter 1 mm, berkulit keras, dan mampu bertahan lama (dorman) di tanah dan
residu tanaman.(Rahayu, 2008)
Punja (1988) menyatakan bahwa S. rolfsii dapat dikendalikan melalui
beberapa cara seperti aplikasi fungisida, solarisasi tanah, rotasi tanaman, dan
penggunaan mikroorganisme antagonis dalam upaya pengendalian penyakit secara
hayati. Saat ini pengendalian hayati semakin mendapat perhatian dalam
perlindungan tanaman dari serangan organisme pengganggu. Pengendalian hayati
adalah cara pengendalian yang ramah lingkungan dan prospektif dikembangkan
untuk mengurangi penggunaan fungisida kimia yang semakin mahal. Dalam
pengendalian hayati digunakan berbagai jenis mikroba yang bersifat antagonis
terhadap patogen, sehingga mampu berperan sebagai biopestisida
(Hamdan et al. 1991). Salah satu agen pengendali hayati adalah bakteri endofit
yang diisolasi langsung dari dalam jaringan tanaman. Bakteri endofit adalah
hidup dengan membentuk koloni dalam jaringan tanaman tanpa membahayakan
inangnya. Setiap tanaman tingkat tinggi dapat mengandung beberapa mikroba
endofit yang mampu menghasilkan senyawa biologi atau metabolit sekunder yang
diduga sebagai akibat koevolusi atau transfer genetik (genetic recombination) dari
tanaman inangnya ke dalam mikroba endofit (Tan RX.,et al. 2001).
Tujuan Penelitian
Penelitian ini bertujuan untuk menguji daya antagonisme beberapa bakteri
endofit terhadap Sclerotium rolfsii Sacc penyebab penyakit busuk batang pada
tanaman kedelai (Glycine max (L) Merrill.)
Hipotesis Penelitian
1. Beberapa bakteri endofit mempunyai daya antagonisme dan mampu
menghambat perkembangan jamur Sclerotium rolfsii Sacc.
2. Teknik pengujian antagonisme berpengaruh terhadap daya hambat bakteri
endofit.
3. Terdapat interaksi antara bakteri endofit dan cara inokulasi terhadap
pertumbuhan jamur Sclerotium rolfsii Sacc.
Kegunaan Penelitian
1. Sebagai salah satu syarat untuk melaksanakan penelitian di Departemen
Hama dan Penyakit Tumbuhan Fakultas Pertanian, Universitas Sumatera
Utara, Medan.
TINJAUAN PUSTAKA
Biologi Penyebab Penyakit
Jamur penyebab penyakit rebah semai ini dapat diklasifikasikan sebagai berikut :
Kingdom : Fungi
Divisi : Basidiomycota Kelas : Basidiomycetes Ordo : Agaricales Famili : Typhulaceae Genus : Sclerotium
Spesies : Sclerotium rolfsii Sacc. (http://
Gambar 1 : Pengamatan mikroskopis S. rolfsii
Sumber : http://61.136.251.3/enshi/MOYU/ZSTX/BCH/baijuan.htm
Dalam lingkungan yang lembab, jamur S. rolfsii membentuk miselium
tipis, berwarna putih, teratur seperti bulu pada pangkal batang dan permukaan
tanah di sekitarnya. Pada miselium ini, kelak akan terbentuk banyak butir-butir
kecil ini mula-mula berwarna putih, kemudian menjadi coklat muda sampai coklat
tua. Butiran ini dinamakan sklerotium. Sklerotium berperan sebagai alat
bertahannya jamur karena memiliki sifat yang sangat tahan terhadap lingkungan
yang tidak mendukung (Agrios, 1997). S. rolfsii adalah jamur yang polifag yaitu
dapat menyerang bermacam macam tanaman, antara lain kedelai, kacang tanah,
tembakau, cabai dan terong (Sunardi, 1988). Dalam sistem klasifikasi, S. rolfsii
dimasukan dalam filum Basidiomycota, kelas Basidiomycetes, karena jamur ini
tidak diketemukan spora seksual maupun aseksualnya atau disebut dengan miselia
sterilia (Alexopoulos dan Mims, 1979).
Gambar 2 : Biakan murni Sclerotium rolfsii Sacc Sumber : Foto Langsung
Gejala Serangan
Penyakit layu yang disebabkan oleh jamur S. rolfsii merupakan penyakit
yang umum terdapat pada tanaman kedelai (Semangun, 1991). Penyakit ini sering
juga disebut sebagai penyakit busuk pangkal batang atau busuk Sclerotium,
S. rolfsii juga dapat menyerang daun, tangkai dan polong apabila kondisi sangat
lembab (Takaya dan Sudjono, 1987).
Infeksi S. rolfsii pada kedelai biasanya mulai terjadi di awal pertumbuhan
tanaman dengan gejala busuk kecambah atau rebah semai. Pada tanaman kedelai
berumur yang lebih tua 2-3 minggu, gejalanya berupa busuk pangkal batang dan
layu, pada bagian terinfeksi terlihat bercak berwarna coklat pucat dan di bagian
tersebut tumbuh miselia jamur berwarna putih (Punja 1988; Semangun 1993).
Tanaman yang sakit layu dan menguning perlahan-lahan. Pada pangkal
batang dan permukaan tanah di dekatnya terdapat benang-benang jamur berwarna
putih seperti bulu. Benang-benang ini kemudian membentuk sklerotium atau
gumpalan benang yang berwarna putih akhirnya menjadi cokelat seperti biji sawi
dengan garis tengah 1-1,5 mm. Karena mempunyai dinding yang keras,
sklerotium dapat dipakai untuk mempertahankan diri terhadap kekeringan, suhu
tinggi dan lain-lain yang merugikan. (Semangun, 1993)
Pangkal batang membusuk sehingga penyakit ini sering disebut penyakit
busuk pangkal batang atau busuk sklerotium. S. rolfsii juga menyerang kecambah
atau semai dan menyebabkan penyakit semai (damping off).
(Takaya dan Sudjono, 1987).
Faktor Yang Mempengaruhi Penyebaran Penyakit
Perkembangan penyakit ini dipengaruhi oleh keaadan lingkungan. Dalam
keadaan yang sangat lembab jamur juga dapat menyerang daun, tangkai dan
polong (Takaya dan Sudjono, 1987).
Pengelolaan Penyakit
Untuk mencegah meluasnya penyakit, tanaman yang sakit dicabut dan
dibakar. Harus diusahakan tanah yang mengandung miselium sklerotium jangan
tersebar, karena hal ini dapat menyebarkan jamur. Pada umumnya tidak
diperlukan upaya yang khusus untuk mengendalikan penyakit ini. Jika diperlukan,
penyakit dapat dikurangi dengan penggarapan tanah yang lebih baik, perbaikan
drainase, dan penanaman dengan jarak tanam yang lebih besar (Oka, 1971).
Bakteri Endofit
Bakteri endofit merupakan mikroba yang hidup di dalam jaringan tanaman
pada periode tertentu dan mampu hidup dengan membentuk koloni dalam jaringan
tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat
mengandung beberapa mikroba endofit yang mampu menghasilkan senyawa
biologi atau metabolit sekunder yang diduga sebagai akibat koevolusi atau
transfer genetik (genetic recombination) dari tanaman inangnya ke dalam mikroba
endofit (Tan et.al. 2001).
Beberapa bakteri endofit mempunyai daya antagonis terhadap jamur
patogen tular tanah seperti Sclerotium, Phytium, Fusarium. Pengendalian biologi
dengan menggunakan bakteri endofit merupakan salah satu alternatif
pengendali hayati yaitu mampu meningkatkan ketersediaan nutrisi, menghasilkan
hormon pertumbuhan dan mengendalikan penyakit tumbuhan
(Kloepper et.al. 1992) serta dapat menginduksi ketahanan tanaman
(Hallmann, 2001).
Corynebacterium
Corynebacterium/bakteri korin merupakan bakteri antagonis yang
mempunyai bentuk elevasi cembung dengan warna coklat susu keruh.
Cara pengendalian ini seiring dengan meningkatnya kesadaran untuk menjaga
lingkungan sehat, mendorong aplikasi teknologi yang ramah lingkungan bahkan
mengarah pada sistem usaha tani organik.Corynebacterium sangat cocok untuk
mencegah layu yang disebabkan oleh bakteri dan jamur pada tanaman
hortikultura, maupun palawija.
Gambar 4 : Morfologi sel bakteri Corynebacterium
1. Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Penyakit Tumbuhan,
Departemen Hama dan Penyakit Tumbuahan, Fakultas Pertanian Universitas
Sumatera Utara, Medan dengan ketinggian tempat 25 m dpl. Penelitian ini
dilaksanakan mulai bulan Januari dan selesai bulan Juli 2010.
2. Bahan dan Alat
Adapun bahan yang digunakan adalah adalah alkohol, spirtus, aquades,
PDA, NA, King’s B, aluminium foil, cling wrap, tanaman kedelai asal Kab. Deli
Serdang, biakan murni Corynebacterium yang didapat dari Balai Besar
Pengendalian Organisme Pengganggu Tumbuhan (BBPOPT) Jatisari, Karawang ,
Jawa Barat.
Alat-alat yang digunakan dalam penelitian ini adalah spatula, cawan petri,
tabung reaksi, erlenmeyer, oven, kertas saring, botol, autoclav, bunsen, laminar
airflow dan freezer.
3. Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Lengkap (RAL) Faktorial
dengan 2 faktor penelitian yaitu :
1. Faktor Teknik Pengujian antagonis (T) dengan 3 taraf yaitu :
T2 : Metode dua biakan (kertas saring yang ditetesi suspensi bakteri +
koloni jamur)
T3 : Metode pencampuran jamur pada media
2. Faktor Bakteri Endofit (B) dengan 6 taraf yaitu :
B1 : Bakteri Endofit A
B2 : Bakteri Endofit B
B3 : Bakteri Endofit C
B4 : Bakteri Endofit D
B5 : Bakteri Endofit E
B6 : Corynebacterium
Diperoleh kombinasi perlakuan sebanyak 18 kombinasi yaitu :
T1B1 T1B4 T2B1 T2B4 T3B1 T3B4
TIB2 T1B5 T2B2 T2B5 T3B2 T3B5
T1B3 T1B6 T2B3 T2B6 T3B3 T3B6
Untuk menentukan banyaknya ulangan ditentukan dengan rumus :
T (r-1) ≥ 15
18 (r-1) ≥ 15
18r - 18 ≥ 15
18r ≥ 33
r ≥ 1,3
r = 3 ulangan
Data hasil penelitian dianalisis dengan menggunakan sidik ragam
berdasarkan model linier sebagai berikut :
Dimana :
Yijk : nilai pengamatan pada suatu percobaan yang memperoleh perlakuan
taraf ke-i dari faktor i dan taraf ke j
µ : rata-rata
αi : pengaruh dari faktor A dari taraf ke-i
βj : pengaruh dari faktor A dari taraf ke-j
(αβ)jk : interaksi dari faktor A pada taraf ke-i dengan faktor B pada taraf ke-j
∑ijk : efek error dari faktor A pada taraf ke-i dengan faktor B pada taraf ke-j
(Bangun, 1994).
4. Pelaksanaan Penelitian 4.1. Pembuatan Media PDA
Kentang dikupas dan dicuci bersih lalu ditimbang 250 gr, dipotong dadu
berukuran 1-2 cm, kemudian kentang dimasak dengan aquades 500 ml pada oven
selama 30 menit, lalu disaring ekstraknya dengan kain muslin sampai volume 500
ml. Masukkan dextrose sebanyak 20 gr dan agar sebanyak 20 gr kedalam beaker
glass, tambahkan aquades sebanyak 500 ml, aduk sampai merata. Masukkan
ekstak kentang yang telah disaring (500 ml) kedalam larutan dextrose+agar, aduk
hingga homogen dan didihkan diatas oven selama 30 menit. Masukkan kedalam
Erlenmeyer masing-masing 200 gr. Selanjutnya Erlenmeyer ditutup dengan kapas
steril dan aluminium foil lalu balut dengan cling wrap atau isolasi. Selanjutnya
masukkan kedalam autoclave untuk disterilkan selama 30 menit dengan suhu
4.2. Pembuatan Media NA
Disediakan difco nutrient agar sebanyak 23 gr, letakkan di dalam beaker
glass kemudian dicampur dengan aquades sebanyak 1000 ml, diaduk hingga
homogen. Panaskan campuran ini hingga mendidih. Setelah itu tuang kedalam
Erlenmeyer 200 gr, Tutup erlenmeyer dengan kapas steril dan aluminium foil lalu
balut dengan cling wrap atau isolasi. Selanjutnya masukkan kedalam autoclave
untuk disterilkan selama 30 menit dengan suhu 120-1210 C pada tekanan 1,5 atm.
4.3. Pembuatan Media King’s B
Disediakan bahan-bahan berikut : bactopeptone 20 gr, K2PO4 2,5 gr,
glycerol 15 ml, MgSO4.7H2O 6 gr, agar/bacto agar 15 gr. Keseluruhan bahan
tersebut campurkan dalam beaker glass kemudian ditambahkan aquadest sebanyak
1000 ml, aduk hingga homogen kemudian panaskan dengan oven hingga
mendidih. Setelah itu tuang kedalam Erlenmeyer ukuran 200 gr, Tutup erlenmeyer
dengan kapas steril dan aluminium foil lalu balut dengan cling wrap atau isolasi.
Selanjutnya masukkan kedalam autoclave untuk disterilkan selama 30 menit
dengan suhu 120-1210 C pada tekanan 1,5 atm.
4.4. Isolasi Bakteri Endofit
Isolat bakteri endofit diperoleh dengan cara mengisolasi langsung dari
tanaman kedelai yang paling sehat dari suatu pertanaman kedelai, karena diduga
pada tanaman kedelai yang sehat terdapat bakteri yang bersifat antagonis terhadap
penyakit yang disebabkan oleh jamur patogen. Kedelai yang akan dijadikan
sampel diambil dari beberapa lokasi di Kabupaten Deli Serdang.
Untuk mengisolasi bakteri endofit, pertama-tama dipotong seluruh daun
kedelai sehingga yang tertinggal hanya batang, akar, dan nodul, lalu cuci dengan
air hingga bersih. Setelah bersih, di potong masing-masing bagian tersebut dan
tempatkan pada beaker glass steril. Rendam bagian-bagian tersebut dengan
Na3OCl 5,25 % selama 5 menit, kemudian bilas dengan aquades steril, lakukan
pembilasan ini sebanyak 3 kali. Setelah itu gerus masing-masing bagian (akar,
batang, nodul) dengan menggunakan mortal steril dan tambahkan aquades steril
secukupnya.
Hasil gerusan tersebutlah yang akan ditanam kedalam media (NA) dengan
perlakuan : langsung tanam (tanpa pengenceran), pengenceran 10-1 dan
pengenceran 10-2. Selanjutnya inkubasi pada temperatur kamar selama 2-3 hari.
4.5. Isolasi Jamur Sclerotium rolfsii Sacc
Jamur diisolasi dari tanaman kedelai yang terserang penyakit rebah semai
(Sclerotium rolfsii Sacc.). dimana pada tanaman yang terserang penyakit ini
biasanya timbul sclerotia pada pangkal batang. Sclerotia inilah yang dibiakkan
pada media PDA setelah sebelumnya direndam dengan larutan klorox 0,1 %
selama 3 menit. Setelah ditanam diinkubasi selama 2-3 hari.
4.6. Identifikasi Jamur
Jamur yang tumbuh pada media biakan diambil kemudian diamati
4.7. Identifikasi Morfologi Koloni Bakteri
Bakteri endofit yang berhasil diisolasi dan telah murni ditumbuh biakan
dalam media NA cawan dengan metode streak kuadran. Setelah diinkubasi selama
± 48 jam kemudian diamati morfologi koloni bakteri tersebut. Adapun yang
diamati adalah : warna, ukuran, bentuk, elevasi, permukaan, dan margin dari
masing-masing koloni bakteri endofit.
4.8. Identifikasi Morfologi Sel Bakteri
Biakan murni bakteri endofit yang telah ditanam pada cawan petri
diidentifikasi morfologi sel nya dengan cara pewarnaan sederhana dan pewarnaan
gram.
• Pewarnaan Sederhana
Pewarnaan sederhana dilakukan dari biakan cair dan biakan padat. Bila
menggunakan biakan cair, biakan dikocok terlebih dahulu setelah itu pindahkan
setetes biakan keatas objek glass dengan pipet tetes atau dapat juga dipindahkan
dengan jarum inokulum. Jika menggunakan biakan padat, maka biakan
dipindahkan dengan jarum inokulum, satu ulasan saja kemudian diberi akuades
dan disebarkan supaya sel merata. Keringkan ulasan tersebut sambil
memfiksasinya dengan api bunsen (lewatkan di atas api 2-3 kali). Setelah
benar-benar kering dan tersebar selanjutnya ditetesi dengan pewarna (dapat digunakan
Methylen blue, Safranin, Crystal Violet) dan tunggu kurang lebih 30 detik. Cuci
Gambar 5 : Prosedur pewarnaan sederhana
Sumber: http://ekmon-saurus.blogspot.com/2008/11/bab-5.html
• Pewarnaan Gram
Dengan menggunakan metode ini bakteri dapat dipisahkan secara umum
menjadi dua kelompok besar yaitu : (1) organisme yang dapat menahan
kompleks warna ungu kristal iodium sampai akhir prosedur (sel-sel tampak
biru gelap dan ungu), disebut Gram positif; (2) organisme yang kehilangan
kompleks warna ungu kristal pada waktu pembilasan dengan alcohol namun
kemudian terwarnai oleh pewarna tandingan, safranin (sel-sel tampak merah
muda), disebut Gram negatif. Karena kemampuannya membedakan suatu
kelompok bakteri tertentu dari kelompok lainnya, pewarnaan Gram disebut
juga pewarnaan differential.
Langkah pertama yang dilakukan adalah menyediakan olesan bakteri yang
telah difiksasi panas, kemudian genangi olesan bakteri dengan pewarna primer
yaitu kristal ungu selama 1 menit, miringkan kaca obyek diatas bak warna lalu
dibilas dengan air dari botol pijit. Setelah itu genangi olesan dengan iodium
warna yaitu etanol 95 %, tetes demi setetes selama 30 detik atau sampai zat
warna ungu kristal tidak lagi terlihat mengalir dari kaca obyek, kemudian cuci
segera dengan air dari botol pijit lalu tiriskan. Genangi olesan dengan pewarna
tandingan yaitu safranin selama 30 detik, miringkan kaca obyek untuk
membuang kelebihan safranin, lalu bilaslah dengan air dari botol pijit.
Tiriskan kaca obyek dan seraplah kelebihan air pada obyek dengan kertas
serap. Kemudian amati di bawah mikroskop.
Gambar 6 : Prosedur pewarnaan Gram
Sumber : http://ekmon-saurus.blogspot.com/2008/11/bab-5-html.
4.9. Uji Motilitas Bakteri Endofit
Tanam biakan pada media NA tegak atau Media Motilitas dengan cara
selama 1x 24 jam, setelah itu diamati pertumbuhan bakteri. Bakteri motil akan
bermigrasi ke seluruh permukaan agar dan bekas tusukan.
4.10. Uji Pendar Flour
Pengujian ini dilakukan untuk mengetahui bakteri mana dari beberapa
isolat bakteri endofit yang didapat yang merupakan bakteri pendar flour.
Pengujian dilakukan dengan cara membiakkan bakteri endofit dalam
media king’s B, setalah bakteri tumbuh pada kemudian bakteri dipaparkan dengan
sinar ultra violet. Bakteri yang pendar flour akan kelihatan berwarna hijau
kebiruan.
4.11. Uji antagonisme bakteri endofit terhadap jamur Sclerotium rolfsii Sacc. • Metode Dua Biakan (Koloni jamur + Koloni bakteri endofit)
Uji antagonisme dilakukan dengan cara menanam koloni dari
biakan murni bakteri endofit dan jamur Sclerotium rolfsii Sacc. pada satu
cawan petri. Kedua koloni tersebut diletakkan secara berhadapan.
Selanjutnya diamati pertumbuhan dan zona hambat (inhibiting zone) dari
bakteri dan jamur tersebut.
Gambar 7 : Metode dua biakan (Koloni jamur + Koloni bakteri endofit)
(Purwantisari, 2009)
X Y
X = Koloni jamur S. rolfsii
• Metode Dua Biakan (Koloni jamur + Kertas saring yang ditetesi
suspensi bakteri endofit)
Uji antagonisme dilakukan dengan cara menanam koloni dari biakan
murni jamur Sclerotium rolfsii Sacc. pada satu sisi cawan petri dan disisi lain
diletakkan potongan kertas saring yang sama ukurannya dengan koloni jamur,
setelah itu diteteskan 10 µ l suspensi bakteri endofit ke atas kertas saring tersebut.
Cawan petri diinkubasi pada suhu 300 selama 1-7 hari atau hingga terbentuk
inhibiting zone.
X = koloni dari biakan murni jamur S. rolfsii Y = kertas saring yang ditetesi susppensi
bakteri endofi
Gambar 8 : Metode dua biakan (Koloni jamur + Kertas saring yang ditetesi suspensi bakteri endofit)
• Metode Pencampuran Jamur Pada Media Tanam (PDA)
Uji antagonisme dengan cara ini dilakukan dengan cara sebagai berikut :
jamur S. rolfsii ditumbuhkan dalam media kemudian dilarutkan menggunakan
aquades steril, suspensi yang didapat ditransfer ke dalam cawan petri sebanyak
kurang lebih 1 ml kemudian dituangkan potato dextrose agar (PDA) yang bersuhu
35-400 C kedalam cawan petri tersebut, media digoyang agar homogen dan
didiamkan beberapa saat hingga dingin dan beku, setelah itu diletakkan kertas
saring steril berdiameter 0,5 cm tepat ditengah-tengah cawan petri. Kemudian
dalam larutan garam fisiologis tepat diatas kertas saring. Cawan petri diinkubasi
pada suhu 300 selama 1-3 hari.
Gambar 9 : Metode pencampuran jamur ke media tanam (PDA)
(Melliawati, dkk. 2006)
4.12. Menghitung Luas Miselium Jamur dan Luas Koloni Bakteri Endofit Luas miselium jamur S. rolfsii dan luas koloni bakteri endofit dihitung
dengan menggunakan planimeter.
Gambar 10 : Planimeter Sumber : Foto Langsung
Adapun prosedur penggunaan planimeter adalah sebagai berikut :
Diletakkan objek yang akan diukur diatas meja Diletakkan planimeter diatas meja
yang rata, kemudian ditimpahkan tracer tepat diatas objek yang akan diukur luas
nya. Setelah itu gerakkan tracer mengikuti alur/garis dari objek yang akan diukur.
Dilihat berapa luas dari objek yang diukur pada angka di skala yang tertera di
planimeter.
Media tanam yang telah dicampur dengan suspensi jamur S. rolfsii
Kertas saring yang ditetesi suspensi bakteri endofit
5. Parameter Yang Diamati
5.1. Morfologi Koloni Bakteri Endofit
Morfologi bakteri dilihat dengan cara menumbuhkan bakteri pada media
NA cawan dengan streak kuadran dan NA tegak dengan stab inoculation. Adapun
yang diamati adalah : warna, bentuk, elevasi, permukaan, dan margin dari
masing-masing koloni bakteri endofit.
Gambar 11 : Mofologi koloni bakteri pada NA cawan
Sumber:
5.2. Morfologi Sel Bakteri Endofit
Morfologi sel bakteri dapat diamati dengan cara pewarnaan sederhana dan
pewarnaan Gram. Pewarnaan sederhana untuk mengetahui bentuk dari sel bakteri,
sedangkan pewarnaan gram untuk mengetahui jenis Gram dari masing-masing
Gambar 12 : Morfologi sel bakteri
Sumber : http://ekmon-saurus.blogspot.com/2008/11/bab-5html
5.3. Motilitas Bakteri Endofit
Motilitas bakteri endofit dilihat dari pertumbuhan koloni bakteri yang
dibiakkan pada media NA tegak dengan metode stap inoculation. Hasil positif
(motil) jika bakteri tumbuh pada seluruh permukaan media, hasil negatif
menunjukan bakteri hanya tumbuh pada daerah tusukan saja.
Gambar 13 : Motility Test
Sumber : http://ekmon-saurus.blogspot.com/2008/11/bab-5html.
5.4. Bakteri Endofit Pendar Flour
Pengujian pendar flour dilakukan dengan cara menumbuhkan bakteri pada
mengeluarkan warna hijau kebiruan berarti bakteri tersebut merupakan bakteri
pendar flour.
5.5. Luas Pertumbuhan Miselium Jamur Sclerotium rolffsi Sacc
Pengamatan luas pertumbuhan miselium jamur Sclerotium rolffsi Sacc
dilakukan setiap hari setelah penginokulasian jamur sampai hari ke-6 setelah
inkubasi.
5.6. Luas Pertumbuhan Koloni Bakteri Endofit
Pengamatan dilakukan setiap hari sampai terjadi zona penghambat
pertumbuhan (inhibiting zone).
5.7. Persentase Zona Penghambat Pertumbuhan
Pengamatan persentase zona penghambat pertumbuhan ini dilakukan
sekali saja yaitu pada saat miselium jamur Sclerotium rolffsi Sacc bertemu dengan
koloni bakteri endofit. Persentase zona penghambat pertumbuhan ini dapat
dihitung dengan rumus sebagai berikut :
Keterangan :
P = Persentase zona Penghambatan Pertumbuhan
R1 = Jari-jari koloni bakteri Endofit
R2 = Jari-jari koloni jamur Sclerotium rolffsi Sacc yang tumbuh
(Rahayu, 2008).
Dari hasil isolasi bakteri dari tanaman kedelai yang berasal dari Kab. Deli
Serdang didapat 5 isolat bakteri endofit, masing-masing bakteri diberi kode isolat
yaitu : B1, B2, B3, B4, B5. Isolat dengan kode B1 dan B2 berasal dari nodul
tanaman kedelai, isolat dengan kode B3 dan B4 berasal dari akar tanaman kedelai,
sedangkan isolate dengan kode B5 berasal dari batang tanaman kedelai.
1.Morfologi Koloni Bakteri
Morfologi koloni bakteri diamati dari biakan murni bakteri endofit.
Pengamatan dilakukan secara langsung dengan melihat warna, bentuk,
permukaan, elevasi dan margin dari masing-masing bakteri endofit.
Tabel 1 : Morfologi koloni bakteri endofit
Morfologi
Koloni Kode Isolat
B1 B2 B3 B4 B5 B6*
Warna Putih Kuning
kehijauan Crem Putih Putih Crem
Bentuk Circular Circular Circular Circular Circular Irregular
Permukaan Halus Kasar Kasar Halus Kasar Halus
Elevasi Raised Raised Convex Raised Raised Convex
Margin Undulate Entire Undulate Filiform Curled Undulate
*Corynebacterium
2.Morfologi Sel Bakteri
Morfologi sel bakteri diamati dengan mikroskop setelah diberi pewarnaan
sederhana dan pewarnaan Gram.
Tabel 2 : Morfologi sel bakteri endofit
Kode Isolat
Morfologi Sel
Bentuk Sel Jenis Gram
B1 Bacilli Negatif
B2 Bacilli Negatif
B3 Bacilli Positif
B4 Streptobacilli Negatif B5 Streptobacilli Negatif B6
(Corynebacterium)
3. Motilitas Bakteri Endofit
Hasil uji motilitas bakteri endofit dapat dilihat dari pertumbuhan bakteri
pada NA tegak dengan metode stab inoculation . Hasilnya dapat dilihat pada tabel
di bawah ini.
Tabel 3 : Hasil uji motilitas bakteri
NO ISOLAT BAKTERI MOTILITAS
1 B1 Negatif
2 B2 Negatif
3 B3 Negatif
4 B4 Negatif
5 B5 Negatif
6 B6 (Corynebacterium) Negatif
4. Bakteri Endofit Pendar Flour
Dari hasil uji pendar flour pada media king’s B, hanya 1 bakteri yang
bersifat pendar flour yaitu bakteri dengan kode isolat B2.
Ciri khas bakteri pendar flour adalah kemampuannya memproduksi
siderofor flourescens ke dalam media king’s B yang nampak berpendar dengan
warna hijau kebiruan bila dipapar sinar ultra violet. Siderofor adalah senyawa
organik ekstraseluler dengan berat molekul rendah dengan afinitas yang sangat
kuat terhadap Fe, larut dalam air, berpendar di bawah penyinaran ultra violet, dan
berperan sebagai antibiotik sehingga bermanfaat sebagai biokontrol untuk
5.1. Pengaruh inokulasi bakteri endofit (B) terhadap pertumbuhan (%) miselium jamur S. rolffsi.
Hasil pengamatan pengaruh inokulasi bakteri endofit (B) terhadap
pertumbuhan miselium jamur S. Rolfsii dari 1-6 hsi dapat dilihat pada lampiran 3.
Dari hasil analisis sidik ragam dapat dilihat bahwa faktor inokulasi bakteri endofit
berpengaruh sangat nyata terhadap pertumbuhan miselium jamur S. Rolfsii. Untuk
mengetahui perlakuan mana yang berbeda sangat nyata maka dilakukan Uji Jarak
Duncan. Hasilnya dapat dilihat pada tabel 3 :
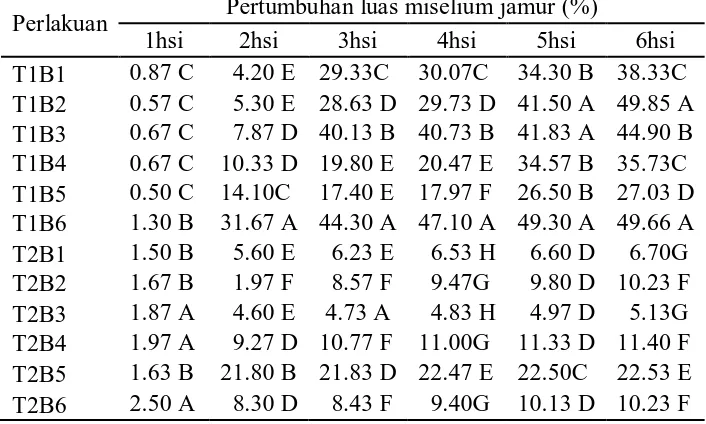
Tabel 4. Beda uji rataan pengaruh inokulasi bakteri endofit terhadap pertumbuhan (%) miselium jamur S. Rolffsi pada pengamatan 1 – 6 hsi.
Perlakuan Pertumbuhan luas miselium jamur (%)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
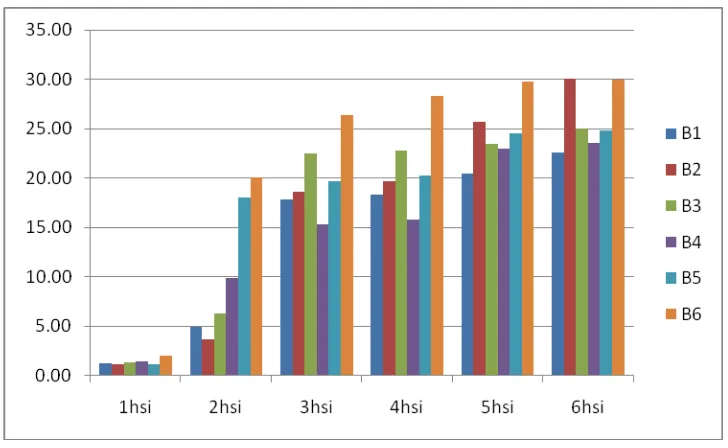
Dari tabel dapat dilihat bahwa pada pengamatan 6 hsi, perlakuan B1
berbeda sangat nyata dengan semua perlakuan. Sedangkan perlakuan B3 tidak
berbeda sangat nyata terhadap perlakuan B4 dan B5.
Pada pengamatan 1-6 hsi pertumbuhan luas miselium jamur S. Rolfsii yang
tertinggi terdapat pada pengamatan 6 hsi perlakuan B2 yaitu sebesar 30,04 %
sedangkan yang terendah pada pengamatan 1 hsi perlakuan B1 yaitu sebesar
Untuk dapat melihat perbedaan yang sangat nyata antara perlakuan bakteri
endofit (B) yang berbeda terhadap terhadap pertumbuhan miselium jamur
S. Rolfsii dapat dilihat pada gambar dibawah ini.
Gambar 15 : Histogram pengaruh inokulasi bakteri endofit terhadap pertumbuhan (%) miselium jamur S. Rolffsi pada pengamatan 1 – 6 hsi.
5.2.Pengaruh teknik pengujian (T) terhadap pertumbuhan (%) miselium jamur S. rolffsi.
Tabel 5 : Beda uji rataan pengaruh teknik pengujian (T) terhadap pertumbuhan (%) miselium jamur S. rolffsi pada pengamatan 1 – 6 hsi.
Perlakuan Pertumbuhan luas miselium jamur (%)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
T1 1.93B 12.24 B 29.93B 31.01B 38.00B 40.92B T2 1.76A 8.59 A 10.09A 10.62A 10.89A 11.04A
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
Dari tabel 5 hasil penelitian menunjukkan bahwa faktor teknik pengujian
(T) perlakuan T1 (Metode dua biakan (koloni bakteri + koloni jamur) ) dan T2
berbeda sangat nyata dari mulai 1 hsi sampai 6 hsi. Hal ini dapat dikarenakan pada
perlakuan T1 bakteri di inokulasikan dalam bentuk koloni padat sehingga
penyebaran koloni lebih lambat dan daya hambatnya kecil. Karena daya hambat
nya kecil maka miselium jamur dapat berkembang lebih besar dari pada koloni
bakteri endofit.
0.00 5.00 10.00 15.00 20.00 25.00 30.00 35.00 40.00 45.00
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
T1
T2
5.3.Pengaruh interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap pertumbuhan (%) miselium jamur S. rolffsi.
Dari hasil analisis sidik ragam dapat dilihat bahwa interaksi faktor
perlakuan teknik pengujian (T) dengan bakteri endofit (B) berpengaruh sangat
nyata terhadap pertumbuhan luas miselium jamur S. Rolffsi.
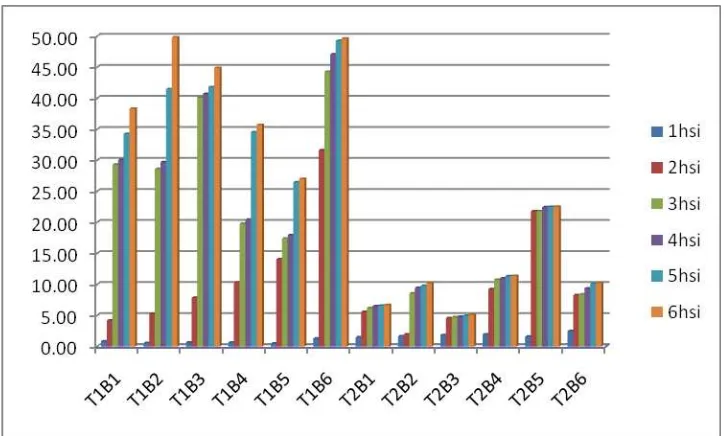
Tabel 6 : Beda uji rataan interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap pertumbuhan (%) miselium jamur S. rolffsi pada pengamatan 1 – 6 hsi
Perlakuan Pertumbuhan luas miselium jamur (%)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
Dari tabel di atas pada perlakuan T1 (Metode dua biakan (koloni bakteri +
koloni jamur)) pengamatan 6 hsi dapat dilihat bahwa pertumbuhan luas miselium
jamur yang tertinggi adalah 49.85 % dan yang terendah sebesar 27.03 %,
sedangkan pada perlakuan T2 (Metode dua biakan (kertas saring yang ditetesi
suspensi bakteri + koloni jamur)) pertumbuhan luas miselium jamur yang tertinggi
adalah 22.53 % dan yang terendah sebesar 5.13 %. Jika kita bandingkan antara
kedua perlakuan tersebut (T1 dan T2) terdapat perbedaan pertumbuhan luas
perlakuan T1 jauh lebih besar jika dibandingkan dengan pertumbuhan luas
miselium pada perlakuan T2. Hal ini dikarenakan pada perlakuan T1 koloni
bakteri kurang terdispersi secara luas sehingga miselium jamur dapat berkembang
lebih pesat, sedangkan pada perlakuan T2 koloni bakteri terdispersi dengan baik
sehingga mampu menekan pertumbuhan miselium jamur.
6.1. Pengaruh inokulasi jamur S. Rolffsi terhadap pertumbuhan (%) koloni bakteri endofit.
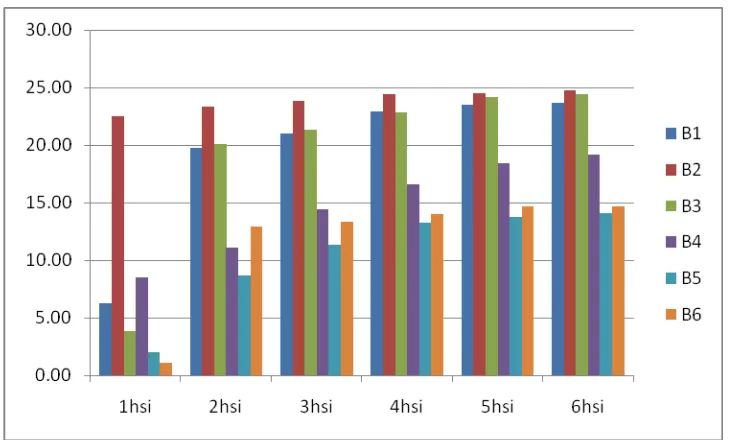
Tabel 7. Beda uji rataan pengaruh inokulasi jamur S. Rolffsi terhadap pertumbuhan (%) koloni bakteri endofit pada pengamatan 1 – 6 hsi.
Perlakuan Pertumbuhan luas koloni bakteri endofit (%)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
B1 6,25 C 19,77B 21,02A 22,93A 23,48A 23,65A B2 22,52A 23,35A 23,83A 24,45A 24,54A 24,76A B3 3,85 D 20,07B 21,33A 22,80A 24,18A 24,38A B4 8,47 B 11,12C 14,40B 16,6 B 18,40B 19,18B B5 2,02 E 8,70 D 11,37B 13,25B 13,75C 14,12B B6 1,09 E 12,93C 13,33B 14,00B 14,63C 14,63B
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
Dari hasil analisis sidik ragam dapat dilihat bahwa perlakuan B1 tidak
berbeda sangat nyata terhadap perlakuan B2 dan B3. Sedangkan perlakuan B3
berbeda sangat nyata dengan perlakuan B4. Perlakuan B4 tidak berbeda sangat
nyata terhadap perlakuan B5 dan B6.
Dari tabel diatas pada pengamatan 6 hsi dapat kita lihat bahwa
pertumbuhan koloni bakteri endofit yang tertinggi adalah pada perlakuan B2
yaitu sebesar 24,76 % dan yang terendah pada perlakuan B5 yaitu sebesar
Gambar 18: Histogram pengaruh inokulasi jamur S. Rolffsi terhadap pertumbuhan (%) koloni bakteri endofit.
Dari histogram diatas dapat kita lihat bahwa pertumbuhan koloni bakteri
endofit antara bakteri yang satu dengan bakteri yang lainnya tidak sama, hal ini
menandakan bahwa masing-masing bakteri endofit mempunyai kemampuan yang
berbeda dalam berkembang dan menekan pertumbuhan jamur pathogen. Bakteri
endofit yang mempunyai daya hambat yang besar terhadap jamur pathogen maka
lebih besar luas pertumbuhan koloni nya dibanding dengan bakteri yang
mempunyai daya hambat yang lebih kecil. Hal ini sesuai dengan pernyataan
Soesanto (2008) yang menyatakan bahwa setiap agensia pengendali hayati
(termasuk bakteri endofit) yang ditemukan selalu mempunyai mekanisme
penghambatan yang tidak sama dengan agensia pengendali hayati lainnya.
Adakalanya, bahkan sering dijumpai suatu agensia pengendali hayati mempunyai
lebih dari satu mekanisme penghambatan, yang masing-masing jenis mekanisme
penghambatan tersebut saling berpengaruh, baik terhadap penghambatan
6.2. Pengaruh teknik pengujian (T) terhadap pertumbuhan (%) koloni bakteri endofit.
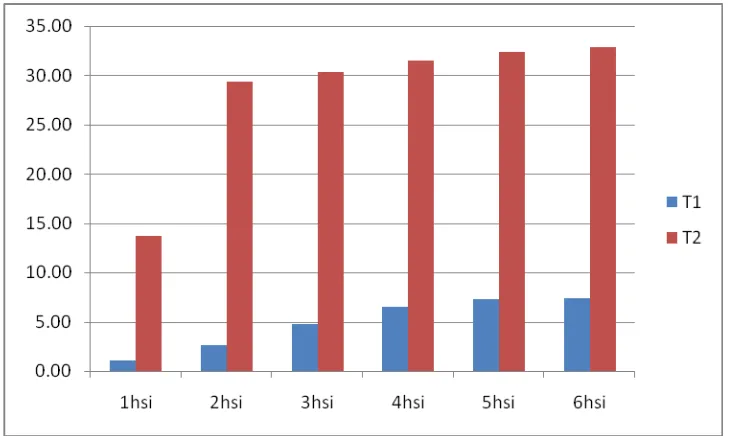
Tabel 8 : Beda uji rataan pengaruh teknik pengujian (T) terhadap pertumbuhan (%) bakteri endofit pada pengamatan 1 – 6 hsi.
Perlakuan Pertumbuhan luas koloni bakteri endofit (%)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
T1 1,03 B 2,64 B 4,75 B 6,55 B 7,32 B 7,37 B T2 13,7A 29,34A 30,34A 31,47A 32,34A 32,87A
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
Dari tabel dapat kita lihat bahwa pada setiap pengamatan (1-6 hsi), faktor
teknik pengujian T1 (Metode dua biakan (koloni bakteri + koloni jamur)) berbeda
sangat nyata terhadap perlakuan T2 (Metode dua biakan (kertas saring yang
ditetesi suspensi bakteri + koloni jamur)).
Dari histogram diatas dapat kita lihat bahwa faktor teknik pengujian (T)
perlakuan T1 (Metode dua biakan (koloni bakteri + koloni jamur) ) dan T2
(Metode dua biakan (kertas saring yang ditetesi suspensi bakteri + koloni jamur) )
berbeda sangat nyata dari mulai 1 hsi sampai 6 hsi. Hal ini dapat dikarenakan pada
perlakuan T2 bakteri yang diinokulasikan dalam bentuk suspensi sehingga lebih
mudah menyebar dan berkembang sehingga lebih bisa menyebarkan zat antagonis
yang dimiliki oleh bakteri tersebut. Sedangkan pada perlakuan T1 bakteri di
inokulasikan dalam bentuk koloni padat sehingga penyebaran koloni lebih lambat
dan daya hambatnya kecil. Graham and Mitchel 1998 menyatakan bahwa interaksi
mikroba tanah (bakteri endofit) dengan jamur tular tanah S. rolfsii menyebabkan
jamur tersebut dirugikan karena pertumbuhannya dihambat dan bentuk interaksi
6.3.Pengaruh interaksi teknik pengujian (T) dan jamur S. rolffsi terhadap pertumbuhan (%) koloni bakteri endofit.
Pengamatan pertumbuhan luas koloni bakteri endofit pada interaksi teknik
pengujian (T) dengan jamur S. Rolffsi dapat dilihat pada lampiran 3.
Dari hasil analisis sidik ragam dapat dilihat bahwa faktor interaksi
perlakuan teknik pengujian (T) berpengaruh sangat nyata terhadap pertumbuhan
luas koloni bakteri endofit.
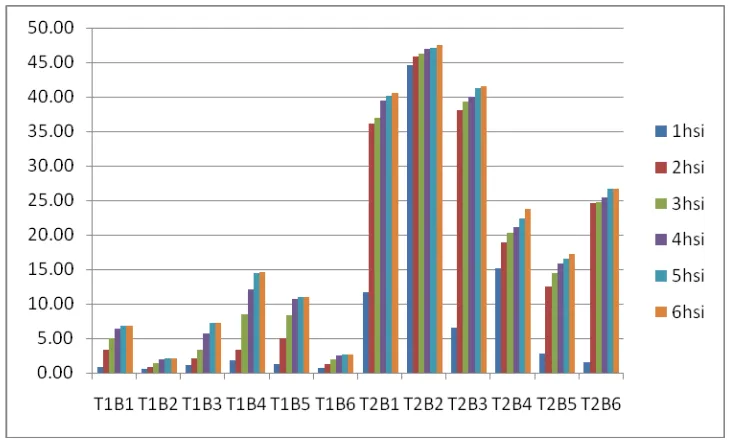
Tabel 9 : Beda uji rataan interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap pertumbuhan (%) miselium jamur S. rolffsi pada pengamatan 1 – 6 hsi
Perlakuan Pertumbuhan luas koloni bakteri endofit (%)
1hsi 2hsi 3hsi 4hsi 5hsi 6hsi
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
Dari tabel dapat kita lihat bahwa pertumbuhan luas koloni bakteri endofit
yang terendah adalah pada perlakuan T1B1 pengamatan 1 hsi dan pertumbuhan
luas koloni bakteri endofit yang tertinggi adalah pada perlakuan T2B2
pengamatan 6 hsi.
Pertumbuhan koloni bakteri endofit pada perlakuan T2B2 menjadi
bakteri dinokulasikan dalam bentuk larutan sehingga mudah menyebar dan
berkembang, disamping itu bakteri B2 juga merupakan bakteri yang setelah
dilakukan uji pigmentasi merupakan bakteri pendar flour yang memiliki zat
antagonis untuk menghambat pertumbuhan patogen sehingga dapat berkembang
lebih luas, hal ini sesuai dengan literatur yang menyatakan bahwa bakteri
berpigmen fluoresen adalah salah satu mikroba antagonis yang intensif diteliti
manfaatnya sebagai agensia hayati. Kemampuannya menekan patogen tanaman
karena mampu memproduksi senyawa metabolit seperti siderofor fluoresen,
antibiotik, atau enzim-enzim ekstraselluler yang toksik terhadap patogen
(Hamdan et al. 1991; Bagnasco et al. 1998).
7. Persentase Zona Penghambat Pertumbuhan.
Hasil pengamatan pengaruh interaksi teknik pengujian (T) dan bakteri
endofit (B) terhadap zona penghambat pertumbuhan dapat dilihat pada lampiran 5.
Pengamatan dilakukan apabila miselium dari jamur S. Rolffsi telah bertemu
dengan koloni bakteri endofit.
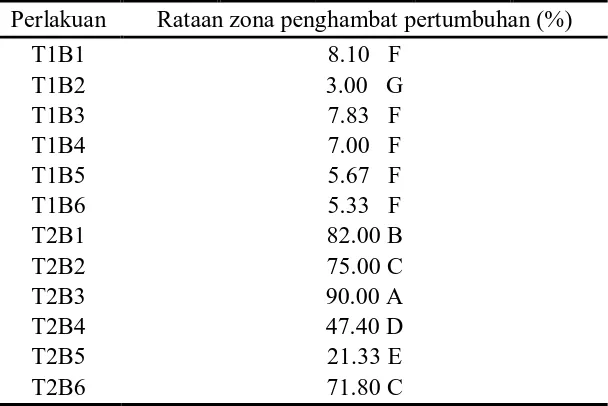
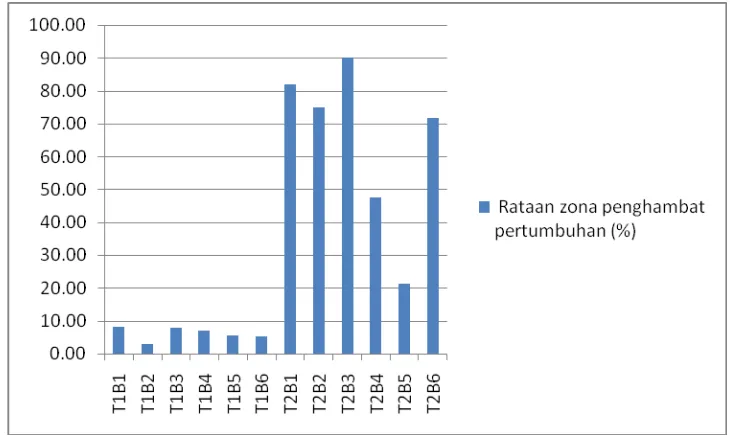
Tabel 10. Beda uji rataan interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap zona penghambat pertumbuhan (%)
Perlakuan Rataan zona penghambat pertumbuhan (%)
T1B1 8.10 F
Keterangan : Angka yang diikuti dengan notasi huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 1 % menurut Uji Jarak Duncan.
Dari hasil analisis sidik ragam dapat dilihat bahwa interaksi faktor
perlakuan teknik pengujian (T) dengan bakteri endofit (B) berpengaruh sangat
nyata terhadap zona penghambat pertumbuhan.
Dari tabel diatas dapat kita lihat bahwa persentase zona penghambat yang
tertinggi adalah pada perlakuan T2B3 ( Koloni jamur S. rolfsii + Suspensi Bakteri
endofit C yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual
T1B2 (Koloni Bakteri endofit B + Koloni S. rolfsii, diinokulasikan dengan cara
dual culture method.) yaitu sebesar 3 %.
Gambar 21: Histogram interaksi teknik pengujian (T) dan bakteri endofit (B) terhadap zona penghambat pertumbuhan (%)
Dari histogram diatas dapat dilihat bahwa terdapat perbedaan persentase
zona penghambat yang sangat nyata antara faktor perlakuan T1 dan faktor
perlakuan T2. Pada faktor perlakuan T1 zona penghambat tertinggi hanya 8.10 %
sedangkan pada faktor perlakuan T2 zona penghambat yang terendah saja sudah
mencapai 21.33 % . Perbedaan ini dikarenakan cara penginokulasian bakteri
endofit yang berbeda, pada perlakuan T1 bakteri yang diinokulasikan adalah
dalam bentuk padat (diambil dari biakan murni bakteri pada media NA) sehingga
pergerakan bakteri lebih lambat dan massa bakteri juga lebih sedikit jika
dibandingkan dengan perlakuan T2 (bakteri yang diinokulasikan dalam bentuk
cairan yang diteteskan diatas kertas saring) sehingga bakteri lebih bisa menyebar
8. Hasil Pengujian Daya Antagonisme Bakteri Endofit Terhadap Jamur S. rolfsii Dengan Teknik Pencampuran Jamur ke dalam Media (T3).
Pengamatan dari hasil pengujian daya antagonisme bakteri endofit dengan
teknik pencampuran jamur ke dalam media (T3) dilakukan dengan data kualitatif.
Tabel 11. Hasil Pengujian Dengan Teknik Pencampuran Jamur ke dalam Media (T3)
Perlakuan Hasil Pengujian Terhadap Jamur S. rolfsii
T3B1 ++
Keterangan : ++ = koloni bakteri menutupi 75 % petri; +++ = koloni bakteri menutupi semua permukaan (100%) petri; + = bakteri kurang efektif (tumbuh miselium jamur
Dari tabel diatas dapat kita ketahui bahwa semua perlakuan memiliki daya
antagonisme yang tinggi terhadap jamur S. rolfsii kecuali perlakuan T3B5. Pada
perlakuan T3B1 dan T3B2 koloni bakteri endofit tumbuh dan berkembang hingga
75 % dari seluruh permukaan media dan pada perlakuan ini tidak ada miselium
jamur yang tumbuh.
Pada perlakuan T3B3, T3B4, dan T3B6 koloni bakteri endofit tumbuh dan
berkembang menutupi seluruh permukaan media dan tidak ada miselium jamur
yang tumbuh, miselium jamur tidak dapat tumbuh dikarenakan terhambat oleh
pertumbuhan bakteri endofit atau dengan kata lain bakteri endofit dengan zat
antagonisnya mampu menekan pertumbuhan dari jamur patogen sehingga jamur
Kesimpulan
1. Pertumbuhan luas miselium jamur S. Rolffsi yang tertinggi adalah pada
perlakuan B2 yaitu sebesar 30.04 %, diikuti dengan perlakuan B6 sebesar
29.95 %, perlakuan B3 sebesar 25.02 %, perlakuan B5 sebesar 24.78 %,
perlakuan B4 sebesar 23.57 % dan yang terendah pada perlakuan B1 yaitu
sebesar 22.5 %.
2. Interaksi teknik pengujian (T) dan bakteri endofit (B) sangat berpengaruh
terhadap pertumbuhan luas miselium jamur S. Rolffsi dengan pertumbuhan
tertinggi pada perlakuan T1B2 (Koloni Bakteri endofit B + Koloni S.
rolfsii, diinokulasikan dengan cara dual culture method) yaitu sebesar
49.85 % dan terendah pada perlakuan T2B3 (Koloni jamur S. rolfsii +
Suspensi Bakteri endofit C yang diteteskan di atas kertas saring,
dinokulasikan dengan cara dual culture method) yaitu sebesar 5.13 %.
3. Luas pertumbuhan koloni bakteri endofit yang tertinggi adalah pada
perlakuan B2 yaitu sebesar 24.76 %, diikuti dengan perlakuan B3 sebesar
24.38 %, perlakuan B1 sebesar 23.65 %, perlakuan B4 sebesar 19.18 %,
perlakuan B6 sebesar 14.63 % dan yang terendah pada perlakuan B5 yaitu
sebesar 14.12 %.
4. Teknik pengujian (T) sangat berpengaruh terhadap pertumbuhan luas
koloni bakteri endofit, luas koloni bakteri endofit tertinggi pada perlakuan
5. Luas pertumbuhan koloni bakteri endofit yang tertinggi adalah pada
perlakuan T2B2 yaitu sebesar 47,47 %, diikuti perlakuan T2B3 sebesar
41.57 %, perlakuan T2B1 sebesar 40.50 %, perlakuan T2B6 sebesar 26.67
%, perlakuan T2B4 sebesar 23,77 %, perlakuan T1B4 sebesar 14.60 %,
perlakuan T1B5 sebesar 11.00 %, perlakuan T1B3 sebesar 7.20 %,
perlakuan T1B1 sebesar 6.79 % dan yang terendah pada perlakuan T1B2
yaitu sebesar 2.06 %.
6. Zona penghambat pertumbuhan yang tertinggi adalah pada perlakuan
T2B3 yaitu sebesar 90 %, perlakuan T2B1 sebesar 82. 00 %, perlakuan
T2B2 sebesar 75.00 %, perlakuan T2B6 sebesar 71.80 %, perlakuan T2B4
sebesar 47.40 %, perlakuan T2B5 sebesar 21.33 %, perlakuan T1B1
sebesar 8.10 %, perlakuan T1B3 sebesar 7.83 %, perlakuan T1B4 sebesar
7.00 %, perlakuan T1B5 sebesar 5.67 %, perlakuan T1B6 sebesar 5.33 %
dan yang terendah pada perlakuan T1B2 yaitu sebesar 3.00 %.
Saran
Perlu diadakan penelitian tingkat lanjut tentang pemanfaatan bakteri
DAFTAR PUSTAKA
Agrios, G.N. 1997. Plant Pathology. Academic Press. London.
Alexopoulos, C.J. and Mims, C.W. 1979. Introductory Mycology. Third edition. John Wiley & Sons. New York.
BPS Sumut, 2008, Berita Resmi Statistik Provinsi Sumatera Utara No. 16/02/12Th. XI, Statistika Tanaman Padi dan Palawija Sumatera Utara Tahun 2007 dan Ramalan Kondisi Tahun 2008. dikutip dari September 2008, Medan.
Bangun, M.K. 1994. Perancangan Percobaan Untuk Pertanian. Fakultas Pertanian, Universitas Sumatera Utara, Medan.
Hallmann J. 2001. Plant interaction with endophytic bacteria. In: JEGER MJ. and SPENCE NJ, editor. Biotic Interaction In Plant-Pathogen Associations. CAB International. p.87-119.
Hamdan, H. D.M. Weller, and L.S. Thomashow. 1991. Relative importance of fluorescent siderophores and other factors in biological control of Gaeumannomyces graminis var. Tritici by Pseudomonas fluorescens 2-79 and M4-80. Appl. Environ. Microbiol. 57:3270-3277.
Howell, C.R. and R.D. Stipanovic. 1980. Supression of pytium ultimum induced damping-off of cotton seedling by Pseudomonas fluorescens and its antibiotic pyoluteorin. Phytopathol. 70:712-715.
http:/ tanggal 9 Juli 2010.
http:/ Mofologi koloni
bakteri. Diakses pada tanggal 9 Juli 2010
http:/ Prosedur
pewarnaan sederhana. Diakses pada tanggal 9 Juli 2010
http:/ Morfologi sel
bakteri. Diakses pada tanggal 9 Juli 2010
http:/ Prosedur
pewarnaan Gram. Diakses pada tanggal 9 Juli 2010
Kloepper Jw, Rodriguez-Kabana R, Mcinroy Ja, Young Rw. 1992. Rhizosphere bacteria antagonistis to soybean cyst (Heterodera glycines) and root knot (Meloidogyne incognita) nematodes: Identification by fatty acid analysis and foliar diseases. Australasian Plant Pathol. 28(1):21-26. Melliawati, R., D.N. Widyaningrum, A.C. Djohan, H. Sukiman. 2006.
Pengkajian Bakteri Endofit Penghasil Senyawa Bioaktif Untuk Proteksi Tanaman.Jurnal Biodeversitas Vol. 7 No. 3. 221-224 p.
Oka, I.N. 1971. Penyakit-penyakit Utama Kedele. Seri Proteksi Tanaman, Jawatan Pertan. Prop. Jawa barat, no. 19, 8 hlm.
Punja, Z.K. 1988. Sclerotium (Athelia) rolfsii, a pathogen of many plant species. Advances in Plant Pathology. 6:523-535.
Purwantisari, S. dan Rini B. 2009. Uji Antagonisme Jamur Patogen Phythopthora infestans Penyebab Penyakit Busuk Daun dan Umbi Tanaman Kentang Dengan Menggunakan Trichoderma spp Isolat Lokal. Buletin Bioma Vol. 11 No. 1 Hlm. 24-32. Undip, Jawa Tengah. Rahayu, M. 2008. Efikasi Isolat Pseudomonas flourescens terhadap Penyakit
Rebah Semai Pada kedelai. Buletin Penelitian Tanaman Pangan Vol. 27 No. 3 2008, Malang.
Semangun, H. 1993. Penyakit-penyakit tanaman pangan di Indonesia. Gadjah Mada University Press. Yogyakarta. 449 p.
Sumarno dan Hartono, 1983, Kedelai dan Cara Bercocok Tanamnya, Buletin No. 6. Pusat Penelitian dan Pengembangan Tanaman Pangan Bogor, Bogor.
Sunardi. 1988. Laporan Survei Hama dan Penyakit serta Penggunaan Pestisida pada Sayuran Dataran Rendah di Indonesia. Kerjasama Proyek ATA-395 dan Balai Penelitian Horttik. Lembang.
Takaya, S. and M.S. Sudjono. 1987. Pathogenicity of Sclerotium rolfsii and Rhizoctonia sp. To Soybean. Prosiding Kongres Nasional IX PFI; Surabaya,November 1987.
Tan,RX and WX Zou. 2001. Endophytes : a rich source of functional metabolites. Nat Prod.Rep. 18 : 448-459.
Keterangan :
KO : Kontrol
T1B1 : Koloni Bakteri endofit A + Koloni S. rolfsii, dinokulasikan dengan cara dua l culture method
TIB2 : Koloni Bakteri endofit B + Koloni S. rolfsii, diinokulasikan dengan cara dual culture method.
T1B3 : Koloni Bakteri endofit C + Koloni S. rolfsii, diinokulasikan dengan cara dual culture method.
T1B4 : Koloni Bakteri endofit D + Koloni S. rolfsii, diinokulasikan dengan cara dual culture method.
T1B5 : Koloni Bakteri endofit E + Koloni S. rolfsii, diinokulasikan dengan cara dual culture method.
T1B6 : Koloni Corynebacterium + Koloni S. rolfsii, diinokulasikan dengan cara dual culture method.
T2B1 : Koloni jamur S. rolfsii + Suspensi Bakteri endofit A yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual culture method.
T2B2 : Koloni jamur S. rolfsii + Suspensi Bakteri endofit B yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual culture method.
T2B3 : Koloni jamur S. rolfsii + Suspensi Bakteri endofit C yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual culture method.
T2B4 : Koloni jamur S. rolfsii + Suspensi Bakteri endofit D yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual culture method.
T2B5 : Koloni jamur S. rolfsii + Suspensi Bakteri endofit E yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual culture method.
T2B6 : Koloni jamur S. rolfsii + Suspensi Corynebacterium yang diteteskan di atas kertas saring, dinokulasikan dengan cara dual culture method.
T3B1: Jamur S. rolfsii yang telah dicampur dalam media + Suspensi Bakteri endofit A yang diteteskan di atas kertas saring.
T3B3: Jamur S. rolfsii yang telah dicampur dalam media + Suspensi Bakteri endofit C yang diteteskan di atas kertas saring.
T3B4: Jamur S. rolfsii yang telah dicampur dalam media + Suspensi Bakteri endofit D yang diteteskan di atas kertas saring.
T3B5: Jamur S. rolfsii yang telah dicampur dalam media + Suspensi Bakteri endofit E yang diteteskan di atas kertas saring.
Lampiran 2 : Foto Penelitian
Gambar : Bagan Penelitian
T2B1 T2B2
T2B3 T2B4
Hasil Pengujian Perlakuan T3 (Teknik Pencampuran Jamur ke dalam Media)
T3B1 T3B2
T3B3 T3B4
Lampiran 3 :
Pengenalan bagian dan fungsi setiap bagian planimeter :
1. Pole berfungsi sebagai penahan/penyangga dari seluruh bagian planimeter
agar planimeter statis.
2. Pole arm merupakan bagian yang menghubungkan pole dengan pivot
3. Pivot merupakan bagian siku dari planimeter berfungsi sebagai engsel
supaya planimeter dapat digerakkan ke segala arah.
4. Wheel berfungsi sebagai penunjuk skala angka yang menunjukkan luas
dari objek yang dihitung
5. Tracer arm merupakan penyangga yang menghubungkan tracer ke bagian
wheel.
6. Tracer merupakan penunjuk atau bagian yang digunakan untuk
menghitung luas objek yang dihitung. Tracer ini lah yng digerakkan
mengikuti lekuk garis dari objek yang akan dihitung.
Prinsip kerja planimeter :
Saat bagian tracer digerakkkan mengikuti lekuk garis dari objek yang akan
menunjukkan luas dari objek yang sedang diukur dalam bentuk angka. Apabila
tracer berhenti digerakkan maka angka pada bagian wheel juga akan berhenti
bergerak.
Cara Penggunaan Planimeter :
1. Diletakkan planimeter diatas permukaan yang rata.
2. Diletakkan objek yang akan di diukur luas nya tepat dibawah tracer dari
planimeter.
3. Atur angka pada skala ke angka nol
4. Gerakkan tracer mengikuti alur/garis dari objek yang akan diukur
5. Liat angka pada skala (wheel) dari planimeter, wheel dibagi menjadi 2
bagian. Bagian kanan menunjukkan satuan centimeter (cm) dan bagian kiri
menunjukkan satuan millimeter (mm), cara pembacaan nya sama seperti
Lampiran 4 :
Rataan Luas Pertumbuhan Jamur S. rolfsii (1 Hsi)
Perlakuan Ulangan Total Rataan
I II III
Pengujian Total Rataan