ABSTRAK
PEMANFAATAN NITRAT ANORGANIK PADA FASE LAG Tetraselmis sp.
Oleh
Reinita Orchid Febrisca Emilly
Tetraselmis sp. merupakan salah satu mikroalga yang potensial untuk dibudidayakan sebagai pakan alami. Siklus hidup Tetraselmis sp. sangat dipengaruhi oleh fase adaptasi atau fase lag. Pada fase lag, kondisi lingkungan mempengaruhi lamanya waktu fase lag, yang berimplikasi terhadap semakin lamanya waktu kultur Tetraselmis sp. Perlu dilakukan suatu usaha untuk mempercepat waktu kultur, salah satu caranya adalah memanipulasi lingkungan dengan cara pengurangan nitrat anorganik (NaNO3) pada pupuk Conwy.
Penelitian dilakukan pada tanggal 1-12 Juli 2014 bertempat di Laboratorium Budidaya Perairan Fakultas Pertanian Universitas Lampung. Berdasarkan hasil uji t yang diperoleh dari penelitian menunjukkan bahwa pengurangan nitrat anorganik (NaNO3) pada pupuk Conwy belum memberikan pengaruh yang nyata
terhadap kepadatan Tetraselmis sp. dan kosentrasi nitrat anorganik pada media kultur. Pada saat kondisi kekurangan kadar nitrat (NO3-), nitrat pada media kultur
lebih digunakan untuk proses pembentukan protein daripada untuk proses pertumbuhan sel Tetraselmis sp.
ABSTRACT
UTILIZATION OF INORGANIC NITRATE ON LAG PHASE OF Tetraselmis sp.
By
Reinita Orchid Febrisca Emilly
Tetraselmis sp. is a potential for cultivation of microalgae as a natural food. The life cycle of Tetraselmis sp. greatly influenced by the adaptation phase or phase lag. In the lag phase, the environmental conditions affecting the duration of the lag phase, which has implications for the length of time the culture of Tetraselmis sp. There needs to be an effort to speed up the time of culture, one way is to manipulate the environment by reduction of inorganic nitrate (NaNO3) in Conwy
medium. The study was conducted on 1-12 July 2014 held at the Laboratory of Aquaculture, Faculty of Agriculture, University of Lampung. Based on t test results obtained from the study showed that the reduction of inorganic nitrate (NaNO3) in Conwy medium has not significant effect on the density of
Tetraselmis sp. and the concentration of inorganic nitrate in the culture medium. By the time the condition of insufficient blood levels of nitrate (NO3), nitrate in
the culture medium is used for the formation of the protein rather than to the process of cell growth Tetraselmis sp
RIWAYAT HIDUP
Penulis dilahirkan di Yogyakarta pada tanggal 24 Februari
1992, sebagai anak kedua dari tiga bersaudara dari pasangan
Bapak Ir. Emil Aprillo dan Ibu K. Rina Estuningtyas.
Pendidikan formal penulis diawali dari Sekolah Dasar Negeri
(SDN) 1 Beringin Raya pada tahun 1998-2004, di lanjutkan Sekolah Menengah
Pertama (SMP) Negeri 14 Bandar Lampung pada tahun 2004-2007, dan Sekolah
Menengah Atas (SMA) Negeri 3 Bandar Lampung pada tahun 2007-2010. Pada
tahun 2010 penulis terdaftar sebagai mahasiswa Program Studi Budidaya
Perairan, Fakultas Pertanian, Universitas Lampung melalui jalur Seleksi Nasional
Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama kuliah, penulis pernah ditunjuk sebagai Asisten Dosen Mata Kuliah
Manajemen Kualitas Air periode 2013-2014. Penulis juga aktif dalam organisasi
HIDRILA (Himpunan Mahasiswa Budidaya Perairan Unila) periode 2010/2011
sebagai anggota biasa, 2011/2012 sebagai Anggota Bidang Minat dan Bakat dan
Penulis melaksanakan Praktik Umum (PU) di Unit Kerja Budidaya Air Tawar
Cangkringan, Yogyakarta pada bulan Juli-Agustus 2013 dan melaksankan Kuliah
Kerja Nyata Tematik di Desa Gedung Ratu, Kecamatan Tulang Bawang Udik,
Kabupaten Tulang Bawang Barat dengan tema”Pemberdayaan Masyarakat” pada bulan Januari 2014. Penulis menyelesaikan tugas akhir perkuliahan dengan
menulis skripsi yang berjudul “Pemanfaatan Nitrat Anorganik Pada Fase Lag
ALHAMDULILLAH, dengan penuh rasa syukur kepada Allah SWT,
kupersembahkan karya kecilku ini kepada
Papa Emil dan mama Rina
,
Yang selalu memberikan kasih sayang yang tiada henti,
Yang selalu memberikan semangat disaat-saat terpuruk dalam hidupku,
Hanya sebuah kado kecil yang dapat ku berikan dari bangku kuliahku yang
memiliki sejuta makna, sejuta cerita, sejuta kenangan, pengorbanan, dan
perjalanan untuk dapatkan masa depan yang ku inginkan atas restu dan
dukungan yang kalian berikan
Kakak Occe, adek Rara dan keponakanku Azka,
yang selalu memberikan perhatiaan dan keceriaan meskipun tinggal berjauhan,
semoga kita bisa bersama-sama membahagiakan papa dan mama, amiin..
Agus Tri Maulana,
Yang selalu menjadi sahabat hati terbaik berbagi canda tawa,
Yang selalu menjadi penyemangat disaat-saat terpuruk
Sejawat terhebatku ketika berkonsultasi, jagoan terkuat ketika ku lemah..
Thanks for all...
Almamater tercinta
Universitas Lampung
Teman satu angkatan dan seperjuangan
Yang telah bersama sama memperjuangkan dan menimba ilmu
diprogram studi
Hasbunallah wa ni mal wakiil
cukuplah Allah menjadi penolong kami dan Allah adalah sebaik-baik
pelindung
(Ali Imran:173)
Salah satu penemuan terbesar umat manusia adalah bahwa mereka
bisa melakukan sesuatu hal yang sebelumnya mereka sangka tidak
dapat mereka lakukan..
(Henry Ford)
Tetaplah bermimpi dan berusaha meraih mimpi
Selama mimpimu tidak menyakiti orang lain..
(Herjunot Ali)
Kemarin memberikan pengalaman dalam setiap inci langkah kita,
semalam adalah teladan pembelajaran untuk menghadapi hari esok,
jadikan lah kemarin dan semalam itu sebagai pedoman dalam
menjalani sebuah penghidupan
(Reinita Orchid F.E)
Smile, because you re beautiful..
SANWACANA
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan
hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi dengan
judul “Pemanfaatan Nitrat Anorganik Pada Fase LagTetraselmissp.” disusun sebagai salah satu syarat memperoleh gelar Sarjana Perikanan di Universitas
Lampung.
Dalam kesempatan ini penulis menyampaikan ucapan terima kasih kepada:
1. Allah SWT. yang telah memberikan kesehatan, kebahagiaan dan kelancaran
dalam proses penyelesaian skripsi.
2. Papa dan Mama tercinta, Ir Emil Aprillo dan K. Rina Estuningtyas yang selalu
berdoa, bersabar, berkorban dan yang selalu menjadi penyemangat dalam
hidupku.
3. Kakak dan adik tersayang, Reina Rose Novertha Emilly dan Reinata Jasmine
Sephalovita Emilly yang selalu memberikan semangat dan doa yang tiada
henti. Terimakasih, kalian telah menjadi kakak dan adik terhebat di dunia.
4. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas
Pertanian Universitas Lampung.
5. Ibu Ir. Siti Hudaidah, M.Sc., selaku Ketua Program Studi Budidaya Perairan
sekaligus dosen pembahas yang telah memberi masukan, kritik, dan saran
6. Bapak Moh. Muhaemin, S.Pi., M.Si., selaku pembimbing utama dan juga
selaku pembimbing akademik yang telah memberikan dukungan, nasehat, dan
bimbingan selama menimba ilmu di program studi Budidaya Perairan serta
membimbing dan membantu penulis selama proses penyusunan skripsi ini.
7. Bapak Eko Efendi, S.T., M.Si., selaku pembimbing kedua yang telah
membimbing, memberi masukan, kritik, saran, serta memberi motivasi dalam
proses penyusunan skripsi ini.
8. Seseorang yang selalu setia mendampingi, memberi dukungan dan memberi
motivasi selama menyelesaikan skripsi,Thanks for All “Agus Tri Maulana”. 9. Teman seperjuangan penelitian, Dwi Angga Kusuma yang berjuang
bersama-sama dari awal hingga akhir penyelesaian skripsi.
10. Rosi Dona Simatupang, Pratica Fajrin dan Duma Oktorina yang selalu
menemani hari-hari penulis selama melaksanakan penelitian di laboratorium,
terima kasih atas segala semangat dan dukungan selama penyusunan skripsi.
11. Sahabat-sahabat terbaik dan tersayang Afrima Nur darajatun, Dike Fransiska,
Dwinda Pangentasari, Jelita Noviantina, Nyi Ayu Ika Pratiwi, Sera Hardiyani,
Yuli Widayati, atas kebersamaan menghadapi suka duka perkuliahan dan
warna-warni persahabatan yang diberikan selama masa perkuliahan hingga
waktu yang tak terbatas.
12. Teman terbaik sejak SMA, Fitriana Arisca yang selalu menemani dan berbagi
keluh kesah, terima kasih untuk pertemanan yang indah ini, semoga kita tetap
kompak hingga tua nanti.
13. Teman-teman seperjuangan angkatan 2010, Ardi, Assovaria, Safrina, Olip,
Winda, Windi, Nikky, Ajil, Andi, Adit, Memed, Baihaqi, Fauzi, Erwin,
Robert, Imam, Jumidi, Azis, Shoffan, Roma, Eltsyn, Aan, Ali, Febri, Priyo,
Sandi, Soma dan Selvi, terima kasih atas keceriaan dan kebersamaan kita
selama ini.
14. Kiyai-Atu angkatan 2004-2009 dan adik-adik angkatan 2011-2014.
15. Semua pihak yang terlibat dalam penyelesaian skripsi.
Semoga Allah SWT memberikan berkah, rahmat, dan hidayah-Nya atas kebaikan
dan pengorbanan kita. Penulis berharap semoga skripsi ini dapat bermanfaat bagi
kita semua. Amin.
Bandar Lampung, Oktober 2014
Penulis,
xi DAFTAR ISI
Halaman
DAFTAR ISI... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR... xv
DAFTAR LAMPIRAN ... xvi
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian ... 4
C. Manfaat Penelitian ... 4
D. Kerangka Pemikiran... 4
II. TINJAUAN PUSTAKA A.Tetraselmissp. ... 7
B. Faktor Pembatas yang Mempengaruhi KehidupanTetraselmissp .. 9
B.1 Lingkungan ... 9
B.2 Nutrien... 10
C. Pertumbuhan ... 11
D. Nitrogen ... 13
E. Protein ... 14
III. METODE PENELITIAN A. Waktu dan Tempat ... 16
B. Materi Penelitian ... 16
B.1 Biota Uji ... 16
B.2 Media Uji... 16
B.3 Alat dan Bahan ... 18
B.4 Rancangan Penelitian ... 18
xii
C.1 Persiapan Penelitian... 19
C.2 Perhitungan Kepadatan SelTetraselmissp. ... 19
C.3 Pelaksanaan Penelitian ... 20
D. Parameter yang Diamati... 21
D.1 Kepadatan SelTetraselmissp. ... 21
D.2 Konsentrasi Protein Total ... 22
D.3 Konsentraasi Nitrat Anorganik Pada Media Kultur ... 22
E. Analisis Data ... 22
IV. HASIL DAN PEMBAHASAN A. Hasil ... 25
A.1 Korelasi Nilai Absorbansi dengan KepadatanTetraselmissp. . 25
A.2 Pengaruh Pengurangan Nitrat Pada Pupuk Terhadap Kepadatan 26 A.3 Pengaruh Perbedaan Konsentrasi Nitrat Anorganik Dalam Pupuk Terhadap Kandungan Nitrat Anorganik pada Media Kultur ... 27
A.4 Hubungan Antar Variabel ... 28
a. Perubahan Kandungan Protein Total... 28
b. Hubungan Polinomial Nitrat Anorganik Dalam Media Kultur Dengan KepadatanTetraselmissp. ... 29
c. Hubungan Polinomial Antara Kepadatan dengan kandungan Protein TotalTetraselmissp... 30
d. Hubungan Polinomial Nitrat Anorganik Pada Media Kultur Dengan Protein totalTetraselmissp. ... 31
B. Pembahasan... 32
B.1 Korelasi Nilai Absorbansi dengan KepadatanTetraselmissp. . 32
B.2 Pengaruh Pengurangan Nitrat Pada Pupuk Terhadap Kepadatan 33 B.3 Pengaruh Pengurangan Nitrat Pada Pupuk Terhadap Kandungan Nitrat Anorganik pada Media Kultur ... 34
B.4 Hubungan Antar Variabel... 35
a. Perubahan Kandungan Protein Total... 35
b. Hubungan Polinomial Nitrat Anorganik Pada Media Kultur Dengan KepadatanTetraselmissp. ... 36
c. Hubungan Polinomial Antara Kepadatan dengan kandungan Protein TotalTetraselmissp... 37
xiii V. KESIMPULAN DAN SARAN
A. Kesimpulan ... 39 B. Saran... 39
DAFTAR PUSTAKA... 40
xiv DAFTAR TABEL
Tabel Halaman
1. Komposisi pupukConwyuntuk fitoplankton skala laboratorium
(1 liter)... 17
2. Komposisi pupukConwyuntuk fitoplankton skala laboratorium
Dengan pengurangan kadar NaNO350% (1 liter) ... 17
3. Alat yang digunakan pada penelitian ... 18
xvi DAFTAR LAMPIRAN
Lampiran Halaman
1. Langkah Perhitungan Persamaan Garis Regresi Linier ... 46
2. Prosedur Pelaksanaan Penelitian... 47
3. Uji Proksimat Protein Menggunakan Metode Gunning... 48
4. Uji Kandungan Nitrat... 49
5. KepadatanTetraselmissp ... 50
6. Nitrat Anorganik pada Media Kultur ... 52
7. Kandungan Protein Total ... 54
xv DAFTAR GAMBAR
Gambar Halaman
1. Diagram Kerangka Pikir Penelitian ... 6
2.Tetraselmissp. ... 8
3. SelTetraselmissp. ... 8
4. Daur Hidup Dan Cara ReproduksiTetraselmissp... 9
5. Kurva PertumbuhanTetraselmissp. ... 13
6. Tahapan Alur Penelitian... 21
7. Korelasi Nilai Absorbansi dengan KepadatanTetraselmissp. ... 25
8. KepadatanTetraselmissp. pada Fase Lag Pada Kedua Perlakuan Kultur ... 26
9. Perubahan Konsentrasi Nitrat Anorganik Pada Media Kultur Tetraselmissp. pada Kedua Perlakuan. ... 27
10. Perubahan Protein Total Pada Kedua Perlakuan... 28
11. Hubungan Polinomial Antara Nitrat Anorganik Pada Media Kultur Dengan KepadatanTetraselmissp. pada Tiap Perlakuan ... 29
12. Hubungan Polinomial Kepadatan dengan Protein Total Tetraselmissp. pada Tiap Perlakuan... 30
I. PENDAHULUAN
A. Latar Belakang
Pakan alami memiliki peran penting dalam usaha akuakultur, terutama pada
proses pembenihan. Peran pakan alami hingga saat ini belum dapat tergantikan
secara menyeluruh. Disamping sebagai sumber protein, karbohidrat dan lemak,
pakan alami terutama mikroalga merupakan sumber utama asam lemak esensial
yang dibutuhkan untuk pertumbuhan larva (Renaud et.al, 1999). Pemberian pakan yang berkualitas dan diberikan dalam jumlah yang cukup akan memperkecil
persentase mortalitas larva ikan atau udang (Mujiman, 1984).
Salah satu upaya untuk memenuhi tersedianya pakan bagi larva adalah dengan
memproduksi pakan alami, karena pakan alami mudah dicerna dan
dibudidayakan, memiliki nilai gizi tinggi, memiliki ukuran yang sesuai dengan
bukaan mulut larva, dan memiliki kemampuan berkembang biak dengan cepat
dalam waktu yang relatif singkat (Harun dkk, 2010).
Mikroalga merupakan jasad renik yang potensial dimanfaatkan sebagai pakan
alami. Jenis mikroalga yang dimanfaatkan sebagai pakan alami dalam budidaya
2
Tetraselmis sp. berperan sebagai sumber protein bagi larva ikan dan udang karena
Tetraselmis sp. memiliki kandungan protein tinggi yang sangat baik bagi pertumbuhan larva ikan dan udang (Isnansetyo dan Kurniastuty, 1995).
Terdapat lima fase dalam pertumbuhan mikroalga, yaitu fase lag, fase
eksponenial, fase penurunan laju pertumbuhan, fase stasioner dan fase kematian.
Fase yang paling mempengaruhi kelangsungan hidup mikroalga adalah fase lag.
Pada fase lag, mikroalga beradaptasi dengan lingkungan yang baru (Lavens and
Sorgeloos, 1996).
Fase lag sangat dipengaruhi oleh kondisi lingkungan seperti nutrien dan faktor
eksternal seperti cahaya, pH, suhu dan salinitas. Perubahan faktor lingkungan
tersebut akan mempengaruhi pola adaptasi dan pertumbuhan mikroalga, sehingga
menyebabkan penggunaan nutrien yang kurang optimal. Selain itu, kondisi
lingkungan juga mempengaruhi lamanya fase lag pada mikroalga, semakin
ekstrim kondisi suatu lingkungan maka semakin panjang fase lag pada mikroalga
tersebut. Apabila waktu pada fase lag semakin panjang, maka waktu pemeliharaan
juga akan semakin lama dan resiko kegagalan kulturpun akan semakin tinggi
(Isnansetyo dan Kurniastuty, 1995).
Ketersediaan unsur nitrogen anorganik dalam media budidaya akan
mempengaruhi pertumbuhan Tetraselmis sp. sehingga ukuran selnya meningkat dan terjadi sintesis protein. Sintesis protein dapat berjalan dengan baik apabila
3 Beberapa penelitian telah dilakukan untuk melihat pengaruh dari pengurangan
konsentrasi nitrogen yang berbeda dalam media kultur terhadap pertumbuhan,
pembentukan biomassa dan kandungan essensial mikroalga. Pada Chlorella pyrenoidosa pengurangan kandungan nitrogen pada media kultur berdampak terhadap penurunan pembentukan biomassa tetapi meningkatkan kandungan
lipidnya (Nigam et.al, 2011). Pengurangan konsentrasi nitrogen pada media kultur Spirulina fusiformis memberikan dampak berupa penurunan pembentukan biomasa, penurunan kandungan protein, dan penurunan kandungan protein
(Chrismadha, et.al, 2006). Menurut Hudaidah dkk (2013), pengurangan nutrien berupa nitrat anorganik pada media kultur mampu menekan pengaruh lingkungan
eksternal berupa salinitas. Kemampuan menekan pengaruh salinitas tersebut
diduga berkaitan dengan semakin singkatnya waktu fase lag.
Jika fase lag pada mikroalga dapat dipercepat, maka akan memperpendek waktu
panen bagi mikroalga tersebut dan meningkatkan produksi mikroalga. Dengan
demikian, produksi pakan alami yang berprotein tinggi bagi larva ikan akan
semakin melimpah.
Penelitian pemanfaatan nitrogen anorganik pada fase lag Tetraselmis sp. belum banyak dilakukan sehingga perlu adanya penelitian mengenai pengaruh
pengurangan kadar nitrogen anorganik pada media kultur pada fase lag
Tetraselmis sp. Pengamatan fase lag pada kultur Tetraselmis sp. penting untuk mengamati peluang mempersingkat waktu kultur atau fase pertumbuhan sehingga
4 B. Tujuan Penelitian
Tujuan dari penelitian antara lain yaitu :
1. Mengetahui pengaruh pengurangan nitrat anorganik dalam pupuk terhadap
kepadatan Tetraselmis sp. pada fase lag.
2. Mengetahui pengaruh pengurangan konsentrasi nitrat anorganik pada pupuk
terhadap konsentrasi nitrat anorganik pada media kultur Tetraselmis sp. pada fase lag.
3. Menganalisis hubungan antara variabel kepadatan, nitrat anorganik pada
media kultur dan kandungan protein total Tetraselmis sp. pada fase lag.
C. Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan informasi konsentrasi nutrien yang
sesuai bagi pertumbuhan Tetraselmis sp. sehingga mempercepat waktu fase lag pada kultur Tetraselmis sp. tersebut.
D. Kerangka Pemikiran
Pakan alami memiliki peranan penting dalam proses budidaya, karena pakan
alami tersedia dalam jumlah yang banyak, memiliki nilai nutrisi yang tinggi,
mudah dibudidayakan, ukurannya sesuai dengan bukaan mulut larva, serta
pergerakannya mampu memberikan rangsangan bagi ikan untuk mangsanya.
Salah satu mikroalga yang potensial untuk dibudidayakan sebagai pakan alami
5 lingkungan yang baru. Semakin ekstrim kondisi lingkungan kultur, maka akan
semakin lama waktu fase lag, yang berimplikasi terhadap semakin lamanya
waktu kultur Tetraselmis sp.. Apabila waktu fase lag pada kultur Tetraselmis sp. semakin singkat, maka semakin singkat pula waktu pemeliharaan dan resiko
kegagalan kultur bagi Tetraselmis sp. semakin kecil.
Salah satu cara untuk mempersingkat waktu fase lag yaitu dengan memanipulasi
lingkungan berupa pengurangan konsentrasi nitrat. Dengan adanya manipulasi
lingkungan tersebut, diharapkan pula mampu meningkatkan pertumbuhan dan
kandungan protein total Tetraselmis sp.. Sehingga produksi Tetraselmis sp. sebagai pakan alami bagi larva ikan akan tersedia melimpah. Diagram kerangka
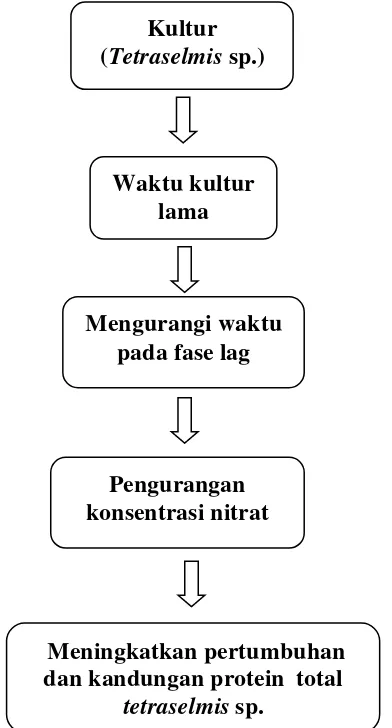
6 Gambar 1. Diagram kerangka pikir penelitian
Kultur (Tetraselmis sp.)
Waktu kultur lama
Mengurangi waktu pada fase lag
Meningkatkan pertumbuhan dan kandungan protein total
II. TINJAUAN PUSTAKA
A.Tetraselmis sp.
Menurut B u t c h e r ( 1 9 5 9 ) klasifikasi Tetraselmis sp. adalah sebagai berikut:
Filum : Chlorophyta
Kelas : Chlorophyceae
Ordo : Volvocales
Sub ordo : Chlamidomonacea
Genus : Tetraselmis
Spesies : Tetraselmis sp.
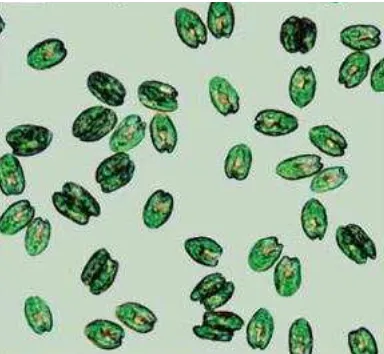
Tetraselmis sp. merupakan alga bersel tunggal, berbentuk oval elips dan memiliki empat buah flagella yang berukuran 0,75 – 1,2 kali panjang tubuhnya, yang
bergerak aktif seperti hewan (Gambar 2). Inti sel jelas dan kecil serta dinding sel
mengandung bahan selulosa dan pektosa (B u t c h e r , 1 9 5 9 ).
Memiliki klorofil sehingga berwarna hijau cerah yang terdapat pada kloroplas.
Pigmen klorofilnya terdiri dari dua macam yaitu karoten dan xantofil. Tiap satu
8 Gambar 2. Tetraselmis sp. (14–20 μm x 8–12 μm) (Biondi, 2011).
Gambar 3. Sel Tetraselmis sp
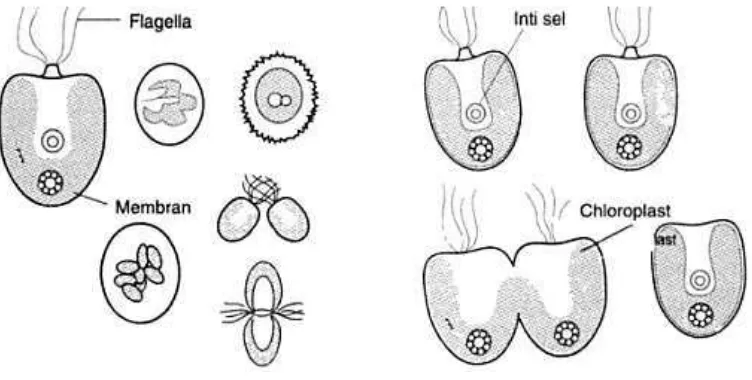
Tetraselmis sp. berkembang biak secara vegetatif aseksual dan seksual (Gambar 4). Reproduksi aseksual dengan cara membelah protoplasma menjadi 2, 4 dan 8
sel dalam bentuk zoospore yang kemudian dilengkapi dengan 4 buah flagella pada
masing-masing sel (Inansetyo dan Kurniastuti (1995). Sedangkan reproduksi
secara seksual yaitu setiap sel memiliki gamet yang identik (isogami) melalui
konjugasi (bertemunya gamet jantan dan gamet betina) menghasilkan zigot yang
9 Gambar 4. Daur hidup dan cara reproduksi Tetraselmis sp. (Rostini, 2007)
Tetraselmis sp. hidup pada zona eufotik yaitu zona dimana intensitas cahaya masih didapat untuk melakukan proses fotosintesis. Banyak faktor yang dapat
menyebabkan mikroalga di suatu perairan melimpah sedangkan di perairan
lainnya sangat sedikit. Faktor-faktor tersebut diantaranya angin, arus, nutrien,
variasi kadar garam, kedalaman perairan, aktivitas pemangsaan serta adanya
pencampuran massa air (Davis, 1955).
B. Faktor Pembatas yang mempengaruhi Kehidupan Tetraselmis sp.
B.1 Lingkungan
Tetraselmis sp. merupakan mikroalga yang hidupnya sangat peka terhadap perubahan lingkungan. Apabila lingkungan tempat hidupnya mengalami
perubahan yang sangat kecil sekalipun, maka akan mempengaruhi kehidupan serta
10 mentoleransi suhu antara 15-35°C (kondisi optimal 23°-25°C) (Fabregas et.al, 1984 dalam Rostini, 2007).
pH optimum untuk kultur Tetraselmis sp. berkisar 7-8 (Redjeki dan Ismail, 1993). Menurut Barsanti dan Gualtieri (2006) pH yang sesuai untuk kultur fitoplankton
adalah antara 7-8 dengan rentang optimum 8,2-8,7. Rentang pH untuk kultur
kebanyakan spesies alga adalah antara 7-9 dan rentang optimumnya antara
8,2-8,7 (Lavens and Sorgeloos, 1996).
Intensitas cahaya maksimum bagi pertumbuhan Tetraselmis sp. yaitu 3.000-10.000 lux. Cahaya dalam kultur fitoplankton diperoleh dari penyinaran lampu neon. Penyinaran cahaya harus sesuai untuk kultur, apabila cahaya terlalu terang
akan menghambat proses fotosintesis, durasi pencahayaan buatan minimum harus
18 jam (Lavens and Sorgeloos, 1996). Sari dan Manan (2012) menjelaskan bahwa
untuk kultur skala laboratorium cahaya didapat dari cahaya lampu TL dengan
kapasitas sebesar 1.450 lux.
B.2 Nutrien
Menurut Suriawira (1985), mikroalga memerlukan media untuk pertumbuhan dan
perkembangbiakannya, baik yang berbentuk bahan alami maupun bahan buatan.
Media yang digunakan untuk mengkultur Tetraselmis sp. berbentuk cair dan tersusun dari senyawa kimia (pupuk) yang merupakan sumber nutrien untuk
11 nutrien yang di absorbsi dari luar sehingga ketersediaan unsur hara makro dan
mikro harus terdapat di media tumbuhnya.
Becker (1995) dan Andersen (2005) menyatakan bahwa untuk untuk
pertumbuhannya, mikroalga Tetraselmis sp. memerlukan nutrien yang terdiri dari makro nutrien dan mikro nutrien. Makro nutrien yang diperlukan antara lain N
(termasuk nitrat), P, Fe, Mg, S dan K. Sedangkan mikro nutrien yang digunakan
pada media kultur dapat diperoleh dari Mn, Zn, Cu, Mo, dan Co.
C. Pertumbuhan
Pertumbuhan didefinisikan sebagai pertambahan jumlah sel dalam populasi.
Pertumbuhan mikroalga dapat digambarkan dalam suatu kurva yang terdiri dari
beberapa fase yaitu fase lag, fase eksponensial, fase pengurangan pertumbuhan,
fase stasioner dan fase kematian (Peleza et.aldalam Reny, 2003). 1. Fase Lag
Fase lag ditandai dengan kecilnya peningkatan kepadatan sel. Pertumbuhan pada
fase lag merupakan fase adaptasi fisiologis dari metabolisme sel untuk tumbuh,
seperti peningkatan enzim serta metabolisme yang dilibatkan pada pembelahan
sel dan fiksasi karbon. Pada saat beradaptasi, sel mengalami defisiensi enzim atau
koenzim, sehingga harus disintesis terlebih dahulu untuk keberlangsungan
aktivitas biokimia sel selanjutnya (Madigan et.al, 2000).
Fase lag sangat dipengaruhi oleh kondisi lingkungan. Semakin ekstrim kondisi
12 lamanya waktu pada fase lag dapat menyebabkan waktu kultur juga akan semakin
lama. Apabila waktu pada fase lag dikurangi, maka dapat menyebabkan semakin
pendek waktu kultur. Pada fase lag, pertumbuhan Tetraselmis sp. dikaitkan dengan adaptasi fisiologis metabolisme sel pertumbuhan fitoplankton, seperti
peningkatan kadar enzim dan metabolit yang terlibat dalam pembelahan sel dan
fiksasi karbon (Lavens and Sorgeloos, 1996)
2. Fase Eksponensial
Merupakan fase dimana fitoplankton memiliki laju pertumbuhan yang tetap. Laju
pertumbuhan spesifik biasanya tergantung pada jenis mikroalga, intensitas cahaya
dan temperatur. Waktu penggandaan tercepat biasanya terjadi pada fase
eksponensial yaitu fase dimana sel-sel membelah dengan cepat dan konstan
mengikuti kurva logaritmik (Becker, 1995 ; Andersen, 2005).
3. Fase pengurangan pertumbuhan
Ditandai dengan terjadinya penurunan pertumbuhan dibandingkan dengan fase
eksponensial. Pembelahan sel menurun ketika nutrien, cahaya, pH, karbon
dioksida atau komponen fisika maupun kima lainnya menjadi faktor pembatas
bagi pertumbuhan mikroalga (Isnansetyo, 1995).
4. Fase stasioner
Pada fase ini laju repoduksi seimbang dengan laju kematian sehingga laju
pertumbuhan fitoplankton akan relatif konstan. Pada saat kultur mencapai fase
13 karena kandungan nitrat pada media kultur terbatas sehingga mengakibatkan
kandungan karbohidrat meningkat hingga dua kali lipat dari kandungan protein
(Brown et al. 1997).
5. Fase kematian
Pada fase kematian, kualitas air memburuk dan kandungan nutrisi semakin
menurun hingga mikroalga tidak mampu melangsungkan pertumbuhan. Jumlah
sel menurun akibat laju reproduksi lebih lambat dari laju kematian. Kematian sel
dapat disebabkan oleh mulai berkurangnya nutrisi yang tersedia sehingga tidak
mampu mendukung pertumbuhan sel, penurunan kualitas air, dan akumulasi
metabolit (NO2-dan NH4+) (Lavens and Sorgeloos, 1996).
[image:32.595.124.513.432.598.2]Kurva pertumbuhan populasi Tetraselmis sp. dapat dilihat pada Gambar 4.
Gambar 5. Kurva pertumbuhan Tetraselmis sp.
D. Nitrogen
Nitrogen memiliki peranan penting dalam siklus organik sebagai penghasil asam
amino penyusun protein. Meskipun ditemukan dalam jumlah yang cukup banyak
di atmosfer, nitrogen tidak dapat dimanfaatkan oleh makhluk hidup secara Keterangan:
1. Fase lag
2. Fase eksponensial 3. Fase lambat 4. Fase stasioner 5. Fase kematian Nt = populasi t = Waktu 3
4 5
2
1 Nt
14 langsung (Dugan, 1972). Nitrogen harus mengalami fiksasi terlebih dahulu
menjadi NH3, NH4, dan NO3..
Nitrat merupakan bentuk utama nitrogen yang terdapat diperairan alami dan
merupakan nutrien utama bagi pertumbuhan tanaman dan alga. Ion nitrat bersifat
stabil dan cenderung mudah larut dalam air. Ion nitrat dihasilkan dari oksidasi
sempurna senyawa nitrogen yang berlangsung secara anaerob (Effendi, 2003).
Oksidasi dilakukan oleh bakteri kemotrofik yaitu bakteri yang mendapat energi
dari proses kimiawi, pada oksidasi ammoniak menjadi nitrit dilakukan oleh
bakteri Nitrosomonas sedangkan oksidasi nitrit menjadi nitrat dilakukan oleh bakteri Nitrobacter (Novotny and Olem, 1994).
Nitrat (NO3) merupakan bentuk inorganik dari derivat senyawa Nitrogen.
Senyawa nitrat ini biasanya digunakan oleh tanaman hijau untuk proses
fotosintesis. Telah disebutkan bahwa Nitrogen adalah unsur utama protein,
sehingga nitrat (NO3) sebagai derivat Nitrogen juga sebagai unsur penting dalam
protein. Dalam hal ini nitrat sangat dibutuhkan untuk sintesa protein hewan dan
tumbuhan (Davis and Cornwell, 1991).
E. Protein
Protein merupakan komponen penting dalam pembentukan sel-sel tubuh. Protein
berfungsi sebagai sumber energi bagi tubuh. Protein juga berfungsi sebagai
biokatalisator yang berupa enzim jika terjadi kekurangan karbohidrat dan lemak
15 Protein dapat digunakan oleh organisme hidup setelah diuraikan menjadi asam
amino. Ketersediaan asam amino yang merupakan komponen dari protein dalam
pakan dapat mempengaruhi tingkat kelangsungan hidup larva. Asam amino
dibutuhkan oleh larva sebagai suplai energi untuk proses metabolisme tubuh
(Putra, 2008).
Komposisi unsur kimia yang terdapat pada protein antara lain adalah karbon
50%, hidrogen 7%, oksigen 23%, nitrogen 16%, sulfur 0-3%, dan fosfor 0-3%,
sehingga dapat ditentukan jumlah protein dalam tubuh juga ditentukan dengan
III. METODE PENELITIAN
A.Waktu dan Tempat
Penelitian dilaksanakan pada bulan Juni-Juli 2014 bertempat di Laboratorium
Budidaya Perikanan, Jurusan Budidaya Perairan, Fakultas Pertanian, Universitas
Lampung. Uji protein dilakukan di Laboratorium Teknologi Hasil Pertanian
Politeknik Negeri Lampung, dan uji kandungan nitrat dilakukan di Laboratorium
Kualitas Air Balai Besar Pengembangan Budidaya Laut (BBPBL), Lampung.
B. Materi Penelitian
B.1 Biota Uji
Biota uji yang digunakan dalam penelitian ini adalah Tetraselmis sp. yang diperoleh dari balai Besar Pengembangan Budidaya Laut (BBPBL) Lampung.
Tetraselmis sp. yang digunakan dikultur secara semi masal dengan menggunakan akuarium volume 100 l dengan kepadatan 1-2 x 105 sel/ml.
B.2 Media Uji
Media yang digunakan untuk kultur Tetraselmis sp. merupakan media cair atau larutan yang tersusun dari senyawa kimia (pupuk) yang merupakan sumber
nutrient untuk pertumbuhan biota uji. Pupuk yang digunakan dalam penelitian ini
17 berbeda. Pertama pupuk dengan komposisi standar (Tabel 1) dan kedua pupuk
[image:36.595.112.511.223.420.2]dengan komposisi pengurangan kadar NaNO3 sebanyak 50% dari jumlah standar
[image:36.595.111.511.487.684.2](Tabel 2).
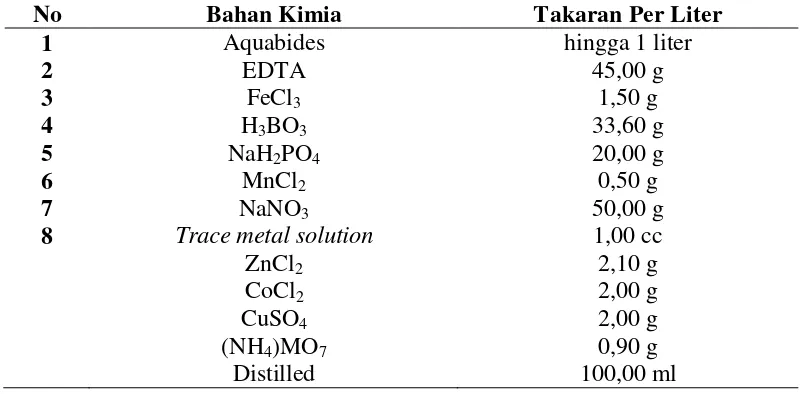
Tabel 1. Komposisi pupuk Conwy untuk fitoplankton skala laboratorium (1 liter)
No Bahan Kimia Takaran Per Liter
1 Aquabides hingga 1 liter
2 EDTA 45,00 g
3 FeCl3 1,50 g
4 H3BO3 33,60 g
5 NaH2PO4 20,00 g
6 MnCl2 0,50 g
7 NaNO3 100,00 g
8 Trace metal solution 1,00 cc
ZnCl2 2,10 g
CoCl2 2,00 g
CuSO4 2,00 g
(NH4)MO7 0,90 g
Distilled 100,00 ml
Tabel 2. Komposisi pupuk Conwy untuk fitoplankton skala laboratorium dengan pengurangan kadar NaNO3 50% (1 liter)
No Bahan Kimia Takaran Per Liter
1 Aquabides hingga 1 liter
2 EDTA 45,00 g
3 FeCl3 1,50 g
4 H3BO3 33,60 g
5 NaH2PO4 20,00 g
6 MnCl2 0,50 g
7 NaNO3 50,00 g
8 Trace metal solution 1,00 cc
ZnCl2 2,10 g
CoCl2 2,00 g
CuSO4 2,00 g
(NH4)MO7 0,90 g
18 B.3 Alat dan Bahan
Tabel 3. Alat yang digunakan pada penelitian
No Alat Jumlah
1. Akuarium ukuran 15x15x30 cm 26 buah
2. Toples volume 4 liter 4 buah
3. Selang dan aerasi 30 buah
4. Kertas whatman 30 buah
5. Haemacytometer 1 buah
6. Spektrofotometer 1 buah
7. Lampu TL 36 watt 4 buah
8. pH meter 1 buah
9. DO meter 1 buah
10. Thermometer 1 buah
11. Plastic wrap 1 buah
12. Cawan petri 42 buah
Tabel 4. Bahan yang digunakan dalam penelitian
No. Bahan Jumlah
1. Bibit Tetraselmis sp. 1-2 x 104 sel/ml
2. Air laut steril ± 50 l
3. Pupuk Conwy ± 1 l
B.4 Rancangan Penelitian
Penelitian ini menggunakan dua perlakuan, dengan tujuh kali pengamatan dan
masing-masing tiga kali ulangan.
Perlakuan A : Pemberian NaNO3 sebanyak 100%, sesuai komposisi pupuk
standar.
Perlakuan B : Pemberian NaNO3 sebanyak 50%, pengurangan jumlah dari
komposisi pupuk standar
[image:37.595.106.511.362.415.2]19 C. Prosedur Penelitian
C.1 Persiapan Penelitian
Alat dan bahan yang akan digunakan disterilkan, agar terbebas dari mikroba,
sehingga tidak merusak media dan tidak mengkontaminasi. Selang dan batu
aerasi direndam dalam larutan kaporit 150 ppm, lalu dicuci bersih dan disemprot
alkohol.
Sterilisasi air laut dilakukan dengan ozonisasi dan diberi penyinaran UV. Setelah
itu direbus dua kali selama ±30 menit dan disaring menggunakan planktonet
berukuran 20 µm.
C.2 Perhitungan Kepadatan sel Tetraselmis sp.
Perhitungan kepadatan sel Tetraselmis sp. diperoleh melalui persamaan garis hubungan regesi linier antara kepadatan Tetraselmis sp. dan absorbansi yang terbaca pada spektrofotometer. Muhaemin (2008) menyatakan bahwa optical density (OD) spektofotometer yang optimal dalam pengukuran kepadatan fitoplankton adalah sebesar 650 nm. Langkah perhitungan persamaan garis regesi
20 C.3 Pelaksanaan Penelitian
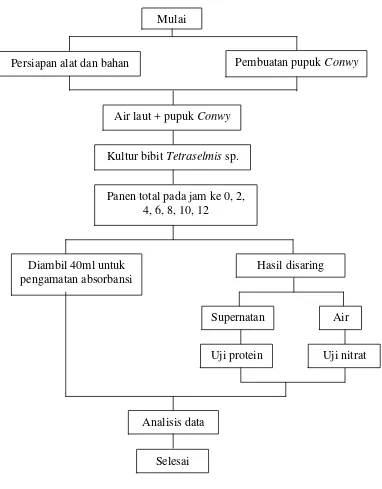
Tahap awal dalam penelitian ini yaitu persiapan alat dan bahan serta pembuatan
pupuk Conwy. Setelah itu wadah kultur disiapkan disusun diatas rak kultur dan diberi aerasi serta pencahayaan lampu, kemudian diisi air dan diberi pupuk Conwy
dengan perbandingan 1ml/l kultur. Lalu bibit Tetraselmis sp. dikultur dengan
kepadatan awal 10-20 x 104 sel/ml. Tetraselmis sp. dipanen total pada jam kultur ke 0, 2, 4, 6, 8, 10, dan 12. Kemudian diambil sebanyak 40 ml untuk pengamatan
absorbansi, sisa hasil kemudian disaring menggunakan kertas Whatman. Hasil saring berupa supernatan kemudian dilakukan uji protein dan pada airnya
dilakukan uji kandungan nitrat (lampiran 2). Pelaksanaan penelitian secara ringkas
disajikan dalam Gambar 5.
D.Parameter yang diamati
D.1 Kepadatan Sel Tetraselmis sp.
Kepadatan fitoplankton dihitung dari hasil panen total yang diambil sebanyak 40
ml. kemudian diamati absorbansinya menggunakan spektrofotometer. Hasil yang
diperoleh dimasukkan ke persamaan garis Y=ax+b untuk mengetahui
21 Gambar 6. Tahapan alur penelitian
Mulai
Persiapan alat dan bahan Pembuatan pupuk Conwy
Air laut + pupuk Conwy
Kultur bibit Tetraselmis sp. Panen total pada jam ke 0, 2,
4, 6, 8, 10, 12
Diambil 40ml untuk pengamatan absorbansi
Hasil disaring
Air Supernatan
Uji protein Uji nitrat
Analisis data
22 D.2 Konsentrasi Protein Total
Nilai protein total didapatkan dari uji proksimat protein pada Tetraselmis sp. dengan menggunakan metode Gunning (lampiran 3). Nilai persentasi protein
diperoleh menggunakan rumus berikut:
% Protein = % N X Faktor Konversi
D.3 Kandungan Nitrat Anorganik Pada Media Kultur
Uji kandungan nitrat dalam Tetraselmis sp. dilakukan pada air laut steril (N-1),
saat setelah pupuk dimasukkan (N0) dan pada jam kultur ke- 0, 2, 4, 6, 8, 10 dan
12 dengan menggunakan spektrofotometer. Cara pengujian nitrat secara rinci
digambarkan pada lampiran 4.
E. Analisis Data
Analisis data yang digunakan pada penelitian ini menggunakan uji t untuk
mengetahui ada tidaknya pengaruh perlakuan terhadap kepadatan dan kandungan
nitrat pada media kultur. Uji t (t-test) digunakan untuk membandingkan dua nilai
tengah contoh bebas apabila n1 = n2 = n, dengan anggapan bahwa kedua populasi
menyebar normal dan memiliki ragam sama yang tidak diketahui nilainya (Steel
23
t =
̅ ̅̅ ̅
S
2=
( ) ( )
S
x1-x2=
√
Keterangan:
n = jumlah sampel
t = Koefisien t ̅ = rata-rata sampel
S2 = ragam
S = simpangan baku
db = derajat bebas = 2 (n-1)
Analisis regesi dan korelasi digunakan untuk mempelajari hubungan antara nitrat
anorganik pada media kultur dengan kepadatan, kepadatan dengan kandungan
protein total, serta nitrat pada media kultur dengan kandungan protein total.
Analisis regresi tersebut digunakan dengan maksud bahwa dari hubungan tersebut
dapat memperkirakan besarnya dampak kuantitatif yang terjadi dari perubahan
satu kejadian terhadap kejadian lainnya. Regesi polinomial merupakan model
hubungan antara dua variabel berdasarkan persamaan garis polinomial berikut
24
Koefisen korelasi merupakan tingkat hubungan antara dua variabel atau lebih.
Korelasi merupakan ukuran atau besaran yang menyatakan ada atau tidaknya
hubungan diantara variabel-variabel yang bersangkutan dinyatakan dengan notasi
(r). Nilai korelasi (r) dapat diartikan sebagai tingkat kekuatan hubungan antara
dua variabel atau lebih (besarnya kontribusi yang diberikan oleh variabel yang
mempengaruhi), baik secara langsung maupun tidak langsung. Tingkat korelasi
bernilai antara -1 < r < 1, dijelaskan bahwa jika r mendekati -1 nilai korelasi
berlawanan yang artinya korelasi negatif. Jika r mendekati 1, maka nilai korelasi
searah yang artinya korelasi positif (Supangat, 2007).
Penentuan nilai korelasi menggunakan persamaan berikut (Supangat, 2007):
√[
][
]
Keterangan: r = nilai korelasi
n = jumlah sampel
V. KESIMPULAN DAN SARAN
A. Kesimpulan
1. Pengurangan kadar nitrat (NO3-) sebanyak 50% pada pupuk Conwy dapat
mempercepat waktu pada fase lag, tetapi tidak berpengaruh terhadap
kepadatan Tetraselmis sp. dan konsentrasi nitrat anorganik pada media kultur. 2. Korelasi nitrat pada media kultur dengan kepadatan, kepadatan dengan
kandungan protein total serta kandungan nitrat pada media kultur cenderung
erat.kuat sehingga pada saat kondisi kekurangan kadar nitrat (NO3-), nitrat
pada media kultur lebih digunakan untuk proses pembentukan protein
daripada untuk proses pertumbuhan sel Tetraselmis sp.
B. Saran
Pengurangan nitrat anorganik sebanyak 50% dapat digunakan dalam kultur
40 DAFTAR PUSTAKA
Andersen, R.A. 2005. Algal Culturing Technique. Elsevier Academic Press. UK. Balai Budidaya Laut. 2005. Budidaya Phytoplankton. Seri ke sembilan. Sebuah
Kerjasama antara Badan Penelitian dan Pengembangan Pertanian Sub Balai Penelitian Budidaya Pantai Bojonegara dengan Japan International Cooperation Agency (JICA). Serang Banten.
Barsanti, L. and P. Gualtieri. 2006. Algae : Anatomy, Biochemistry, and Biotechnology. CRC Press. United States of America. 301 hal.
Becker, E.W. 1995. Microalgae Biotechnology and Microbiology Cambridge. University Press Greet Britain: England
Biondi, N. and M. Tredici. 2011. Algae and Aquatic Biomass for a Sustainable Production of 2nd Generation Biofuels. UNIFI. Page 148-150
Brown, M. R., Jeffrey, S. W., Volkman, J. K., & Dunstan, G. A. 1997. Nutritional Properties of Microalgae for Mariculture. Aquaculture. 151: 315-331. Butcher, R.W. (1959). An Introductory Account of the Smaller Algae of British
Coastal Waters. Part I: Introduction and Chlorophyceae. Vol. ser. IV (Part 1) pp. 74. Great Britain: Minist. Agric. Fish. Food, Fish. Invest.
Chrismadha, Tjandra, Lily M.P, dan Yayah M. 2006. Pengaruh Konsentrasi Nitoden dan Fosfor Terhadap Pertumbuhan, Kandungan Protein, Karbihidrat dan Fikosiain pada Kultur Spirulina fusiformis. Berita Biologi. 8(3)
Davis, N.L and Cornwell, D.A. 1991. Introduction of Environmental Engineering.
Second Edition. MC Grow-Hill, Inc. New York. 822p
Determann, S., J.M. Lobbes, R. Reuter, dan J. Rullkötter. 1998. Ultraviolet Fluorescence Excitation and Emission Spectroscopy of Marine Algae and Bacteria. Journal Marine Chemistry. Vol. 62: 137-156.
41 Effendi, H. 2003. Telaah Kualitas Air. Penerbit Kanisius. Yogyakarta. Hal.
66-156.
Erlina, A. dan Hastuti, W. (1986). Kultur Plankton. Direktorat Jendral Perikanan (Ditjenkan-IDRC), Jakarta.
Fabregas, Jaime. 1984. Growth of Marine Microalga Tetraselmis in Batch Culture with Different Salinities and Concemtration. Publisher. B.V. Amsterdam Forján, E., L. Garbayo, C. Casal, dan C. Vílchez. 2007. Enhancement of
Carotenoid Production in Nannochloropsis by Phosphate and Sulphur Limitation. Journal Communicating Current Reaserch and Educational Tropics and Trends in Applied Microbiology. Hal 356-364.
Griffitsh, M.J. & S.T.L. Harrison. 2009. Lipid Productivity As a Key Characteristic for Choosing Algal Species for Biodiesel production. J.Appl. Phycol. 21:493-507
Guzman-Murillo, M.A, C. Lopes-Bolanos, T. Ledesma-Verdejo, G. Roldan-libenson, M.A. Cadena-Roa, F. Ascencio. 2007. Effect of Fertilizer-based Culture Media on the Production of exocelullar Polysaccharides and Cellular Superoxide Dismutase by Phaeodactylum tricornotum. Journal of Applied Phycology, v.19, p. 33-41.
Harun, R., M. Singh, G.M. Forde, and M.K. Danquah. 2010. Bioprocess Engineering of Microalgae to Produce a Variety of Consumer Products. Renewable and Sustainable Energy Reviews. Vol. 14: 1037–1047.
Hudaidah, S., M. Muhaemin dan Rosdinar. 2013. Strategy of Nannochloropsis Againts Environment Starvation: Population Density and Crude Lipid Contents. Maspari Journal. Vol. 5 (2): 64-68.
Hu, H. and K. Gao. 2006. Response of Growth and Fatty Acid Compositions of Nannochloropsis sp. to Environmental Factors Under Elevated CO2
Concentration. Journal Biotechnol Lett. Vol. 28: 987-992.
Inansetyo, A dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan Zooplankton. Pakan Alami Untuk Pembenihan Organisme Laut. Erlangga. Jakarta
Laurenco, S.O. 2006. Cultivation of Microalgae Marinhas: Principle the Application. Sao Carlos:Rima
42 Madigan, M.T., J.M Martinko & J.P Parker. 2000. Brok: Biology of
Microorganisme. New Jersey. Prentice Hall International Inc.
Mujiman, Ahmad. 1984. Makanan Ikan. Cetakan 14. Penebar Swadaya. Jakarta. Nigam, Subhasha, Monika P.R and Rupali Sharma. 2001. Effect of Nitrogen on
Growth and Lipid Content of Chlorela pyrenoidos. American Journal of Biochemistry and Biotechnology. 7(3):126-131
Novotny, V and Olem, H. 1994. Water Quality,Prefention, Identification and Management of Diffuse Pollution. Van Nostrans ein Hold. New York. 1054p
Otero. A & Jaime Fabregas. 1997. Changes in the Nutrient Composition of Tetraselmis suecica Cultured Semicontinously with Different Nutrient Concentrations and Renewal rates. Aquaculture. 159: 111-123
Poedjiadi, A. 1994. Dasar-dasar Biokimia. Jakarta.UI-Press. 472 hlm.
Putra, A. N. 2008. Aplikasi Pemberian Taurine Pada Larva Ikan Kerapu Bebek (Cromileptes altivelis). Skripsi. Program Studi Teknologi dan Manajemen Akuakultur. Fakultas Perikanan dan Ilmu Kelautan. IPB. Bogor.
Redjeki, S. dan A. Ismail. 1993. Mikroalga Sebagai Langkah Awal Budidaya Laut. Dalam Prosiding Seminar asional Bioteknologi mikroalga. Pusat Penelitian dan Pengembangan Bioteknologi LIPI
Renaud, S. M., L-V. Thinh and D. L. David. 1999. The gross chemical composition and fatty acid composition of 18 species oftropical Australian microalgae forpossible use inmariculture. Aquaculture (170): 147-159. Renny N. 2003. Teknik Kultur Nannochloropsis sp di Balai Budidaya Lampung.
Universitas Lampung. Lampung
Rostini I. 2007. Kultur Fitoplankton (Chlorella sp. dan Tetraselmis chuii) Pada Skala Laboratorium. Karya Ilmiah. Universitas Padjajaran Fakultas Perikanan dan Ilmu Kelautan. Jatinangor.
Santos R.L., Tsolis R.M., Baumler A.J. and Adams L.G. 2003. Patogenesis of Salmonella-Induced Enteritis. Brazilian Journal of Medical and Biological Research (2003) 36: 3-12
Sari, I.P. dan A. Manan. 2012. Pola Pertumbuhan Nannochloropsis oculata pada Kultur Skala Laboratorium, Intermediet, dan Masal. Jurnal Ilmiah Perikanan dan Kelautan. Vol. 4 (2): 123-127.
43 Suminto. 2009. Penggunaan Jenis Media Kultur Teknis Terhadap Produksi dan
Kandungan Nutrisi Sel Spirulina platensis. Jurnal Saintek Perikanan. Vol. 4 (2): 53-61.
Supangat. A. 2007. Statistika. Prenada Media Group. Jakarta. Hal 334-350.
Tonon. T, D. Harvey, T.R Larison, I. Graham. 2002. Long Chain polyunsaturated Fatty Acid production and Partitioning to Triacylglycerols in Four Mikroalgae.Phytochemistry, V.61, P:15-24.
Utting. D. S. 1985. Influence of Nitrogen Availability on the Biochemical Composition of Three Unicelullar marine Algae of Commercial Importance.
Aquacultural Engineering. 4:175-190
Wikfors G.H, J.w Twarong., & R. Ukeles. 1984 Influence of Chemical Composition of Algal Food Sources on Growth of Juvenile Oysters, Crasostrea virginica. Biol. Bull., 167: 251-263.