ABSTRAK
PROFIL NITRAT ANORGANIK DAN PROTEIN TOTAL INTRASELULER PADA FASE LAG BIOMASSA Nannochloropsis sp.
Oleh
ROSI DONA SIMATUPANG
Nannochloropsis sp. merupakan pakan alami yang memiliki kandungan protein intraseluler yang
cukup tinggi. Perubahan nitrat anorganik dapat mempengaruhi protein total intaseluler dan pertumbuhan Nannochloropsis sp. Penelitian bertujuan untuk mengetahui hubungan korelasi
perubahan nitrat anorganik terhadap protein total intaseluler dan pertumbuhan Nannochloropsis
sp. pada konsentrasi nitrat anorganik. Penelitian dilaksanakan pada tanggal 13 hingga 21 Januari 2014 bertempat di Laboratorium Budidaya Perikanan, Jurusan Budidaya Perairan, Fakultas Pertanian, Universitas Lampung. Penelitian terdiri dari dua perlakuan yaitu perlakuan A (NO3-
100%) dan perlakuan B (NO3- 50%) dengan masing – masing tiga ulangan. Parameter utama
yang diamati adalah kepadatan sel dan kandungan protein total intraseluler (dianalisis uji t –
test). Peningkatan rasio P/Nt sebesar 10,24% sedangkan peningkatan rasio P/ NO3- sebesar 42,
647 %. Hasil uji t – test menunjukkan bahwa peningkatan dan defisiensi nitrat anorganik berpengaruh terhadap kepadatan sel Nannochloropsis sp. akhir kultur tetapi tidak berpengaruh
terhadap kandungan protein total intraseluler Nannochloropsis sp.
ABSTRACT
THE PROFILE OF INORGANIC NITRATE AND INTRACELULLER CRUDE PROTEIN ON Nannochloropsis sp. LAG PHASE
By
Rosi Dona Simatupang
Nannochloropsis sp. is a natural feed with a high intraceluller crude protein content. Inorganic
nitrate fluctuation influenced the intraceluller crude protein and Nannochlropsis sp. growth. The
aim research was know correlation of inorganic nitrate changing to the the intraceluller crude protein and lag phase of growth Nannochlropsis sp. on different inorganic nitrate consentration.
The research done on January 13 – 21, 2014 at Laboratory of Aquculture, Aquaculture Department, Faculty of Agriculture, University of Lampung. The research consists of two treatment and was done in triplicate. Those were treatment A (NO3- 100%) and treatment B
(NO3- 50%). The main parameters analyzed cell density and intracelluller crude protein by
analyzes t – test. The increasing of of P/ Nt ratio was 10,424%; while increasing of P/ NO3- ratio
was 42,647%. T test showed that the increasing and deficiency in inorganic nitrate effected cell density but has not effected on intraceluller crude protein content Nannochloropsis sp.
RIWAYAT HIDUP
Penulis dilahirkan di Plaju, Provinsi Sumatera Selatan pada tanggal 30 Oktober 1992, sebagai anak ketiga dari tiga bersaudara dari pasangan Bapak Marudut Govrient Simatupang dan Mama Erna Debora.
Penulis mengawali pendidikan di Sekolah Dasar Patra Mandiri, Plaju, Sumatera Selatan pada tahun 1998-2004, di lanjutkan Sekolah Menengah Pertama (SMP) Patra Mandiri, Plaju, Sumatera Selatan pada tahun 2005-2006 dilanjutkan Sekolah Menengah Pertama (SMP) Xaverius 4 Way Halim Permai, Bandar Lampung pada tahun 2006-2007, dan Sekolah Menengah Atas (SMA) FRANSISKUS Bandar Lampung pada tahun 2007-2010. Pada tahun 2010 penulis terdaftar sebagai mahasiswa Program Studi Budidaya Perairan, Fakultas Pertanian, Universitas Lampung melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
Selama kuliah, penulis pernah ditunjuk sebagai Asisten Dosen Mata Kuliah Ikhtiologi periode 2011-2012. Penulis juga aktif dalam organisasi HIDRILA (Himpunan Mahasiswa Budidaya Perairan Unila) periode 2009/2010 sebagai Sekretaris Bidang Kerohanian dan periode 2012/2013.
(PU) di Pusat Budidaya Perikanan (PUSDAKAN) Ciganjur, Jakarta Selatan pada tahun 2013.
Skripsi ini dibuat untuk Tuhan Yesus Kristus,
keluarga tercinta (Bapak, Mama, Kakakku Corlina and
AbangJulius), sahabat-sahabat terbaik
serta seseorang yang selalu memberikan kasihnya yang
terindah di setiap waktu.
Teman angkatan 2010 dan seperjuangan
Yang telah bersama - sama memperjuangkan dan menimba
ilmu di program studi
BUDIDAYA PERAIRAN UNILA
M o t t o :
Iman adalah dasar dari segala sesuatu yang kita
harapkan dan bukti dari segala sesuatu yang tidak
kita liat (Ibrani 11: 1),
Tidak ada yang mustahil bagi orang percaya
(Markus 9: 23b).
Pengharapan itu adalah sauh yang kuat dan aman
bagi jiwa kita, yang telah dilabuhkan sampai ke
belakang tabir (Ibrani 6: 19)
What do you thinking and feeling is becoming in fact
Pengharapan, Kasih, Kekuatan, Keberanian dan
Keyakinan adalah pondasi kokoh meraih
Saya adalah sebuah pensil kecil di dalam tangan
Tuhan yang sedang menulis surat cinta kepada
dunia sehingga apa yang kamu simpan untuk dirimu
sendiri akan lenyap, apa yang kamu berikan pada
orang lain akan kamu miliki selamanya.
(Mother Teresa)
Jika
kau ingin menjadi seseorang dalam hidup…
Jika kau ingin mendapatkan sesuatu…
Jika kau ingin memenangkan sesuatu, selalu dengarkan kata
hatimu, dan jika itu juga tak memberimu jawaban…
Tutup kedua matamu dan pikirkan kedua orangtuamu, maka
semua rintangan dan halangan akan hancur, dan engkau akan
mendapatkan yang dirimu inginkan.
Kemenangan hanya milikmu dan hanya milikmu.
SANWACANA
Puji syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa atas kasih karunia- Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi dengan judul “ Profil Nitrat Anorganik dan Protein Total Intraseluler Pada Fase Lag Biomassa
Nannochlropsis sp.” ini disusun sebagai salah satu syarat memperoleh gelar Sarjana Perikanan di Universitas Lampung.
Dalam kesempatan ini penulis menyampaikan ucapan terima kasih kepada:
1. Bapak dan Mama yang selalu berdoa, bersabar, berkorban dan yang selalu menjadi penyemangat dalam hidupku. Kakakku Corline, Abangku Julius dan abang Joni serta keponakan ku Alicia and Simon yang selalu menyemangati, mendoakan dan mengingatkanku.
2. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas Pertanian Universitas Lampung.
3. Ibu Ir. Siti Hudaidah, M.Sc. selaku Ketua Program Studi Budidaya Perairan dan selaku pembimbing utama yang telah membimbing, memberi masukan, kritik, saran, serta memberi motivasi dalam proses penyusunan skripsi ini.
5. Ibu Henni Wijayanti M, S.Pi., M. Si selaku pembimbing kedua yang telah membimbing, membantu serta memberi dukungan penulis dalam proses penyusunan skripsi ini.
6. Bapak Herman Yulianto, S.Pi., M. Si. selaku pembahas yang telah memberi masukan, kritik, dan saran dalam proses penyusunan skripsi ini.
7. Pratica Fajrin sebagai patner selama penelitian hingga akhir skripsi.
8. Duma, Jelita, Nikky, Sera, Tita, dan Angga yang selalu ceria, bulinya terima kasih atas kebersamaan kita yang telah mendukung selama proses skripsi dan masa kompre.
9. Sahabatku Lonik, Kak Olivia dan Nova (bu ketua) thanks for pengertianmu and Syevia, Onya, Ci Ddew
10. Sesosok pribadi yang datang membawa insipirasi, motivasi, perhatian, dan kesaksian yang indah di hari – hari terakhir perjalanan penulis sebagai mahasiswa. Terima kasih karena sudah hadir di saat- saat tersulit, ketika penulis hampir kehilangan harapan. “Lingkaranmu berbeda dengan punyaku, kupikir
banyak yang bisa kulakukan. Mungkin aku bisa membuat lingkaranmu semakin
indah dan baik. Tapi keliru, sejauh ini malah dirimu yang membuat lingkaranku
menjadi lebih indah”.
jamal, Erwin (bebeb), ali (bos cupang), ableh (waketum, bibir), salsin (udo), yuti, shoffan (minjemin genset), andi (omes), bg dio, ajil (lele), rudi, rico (kepala besar), hermawan (komodo), ajiz, imam, jamed, robert.
Serta semua teman dan pihak yang tidak dapat disebutkan satu persatu. Akhir kata, saya berharap Tuhan Yang Maha Kuasa berkenan membalas segala kebaikan semua pihak yang telah membantu. Semoga skripsi ini membawa manfaat bagi pengembangan ilmu.
Bandar Lampung, Agustus 2014 Penulis,
ii
2.1.1 Klasifikasi dan Morfologi Nannochloropsis sp. ... 6
2.1.2 Pertumbuhan dan Perkembangan Nannochloropsis sp. ... 9
ii
b. Sterilisasi air ... 24
c. Pembuatan Stok Pupuk Conwy ... 25
3.5.2 Pelaksanaan Penelitian ... 25
3.6 Parameter yang Diamati ... 26
3.6.1 Uji Proksimat Protein ... 26
3.6.2 Uji Kandungan Nitrat ... 28
3.6.3 Pembuatan Kurva Standar Absorbansi ... 26
3.6.4 Penghitungan Kepadatan Nannochloropsis sp. ... 30
3.7 Analisis data ... 30
3.7.1 Hubungan Antar Dua Variabel Dependen ... 30
IV. HASIL DAN PEMBAHASAN ... 32
4.1 Hubungan Linier Absorbansi Spektrofotometer dan Kepadatan Sel Nannochloropsis sp. ... 32
4.2 Pertumbuhan Nannochloropsis sp. ... 33
4.3 Perubahan Konsentrasi Nitrat Anorganik Pada Media Kultur Nannochloropsis sp. ... 36
4.4 Kandungan Protein Total Intraseluler Pada Nannochloropsis sp. .. 40
4.5 Hubungan Polonomial Antara Kepadatan dengan Protein Total Intraseluler ... 42
4.6 Hubungan Polonomial Antara Kepadatan dengan Nitrat Anorganik Pada Media Kultur ... 44
iii DAFTAR TABEL
Tabel Halaman
1. Komposisi Pupuk Conwy Skala Laboratorium ... 20
iv DAFTAR GAMBAR
Gambar Halaman
1. Diagram kerangka pikir penelitian ... 5
2. Koloni Nannochloropsis sp. ... 7
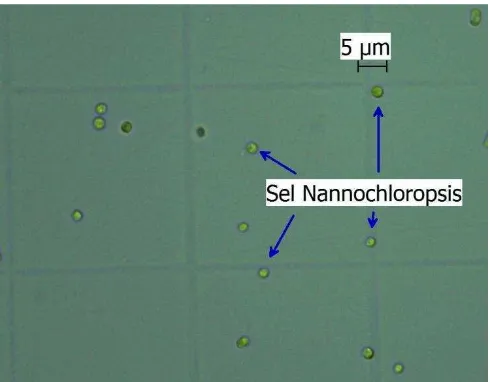
3. Sel Nannochloropsis sp... 7
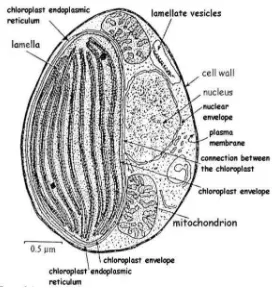
4. Morfologi Nannochloropsis sp. ... 8
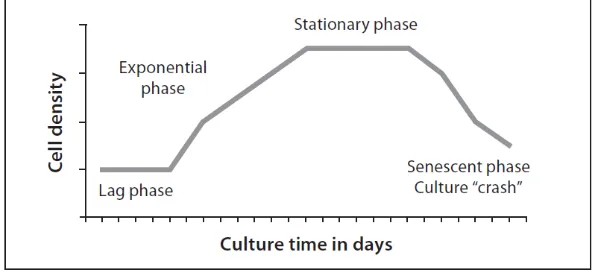
5. Fase - fase pertumbuhan fitoplankton ... 10
6. Siklus Nitrogen ... 16
7. Proses Perubahan Nitrat Menjadi Protein ... 17
8. Tata letak wadah kultur Nannochloropsis sp.. ... 22
9. Tahapan alur peneltian.. ... 23
10. Hubungan linier antara kepadatan sel Nannochloropsis sp. dengan nilai absorbansi spektrofotometer 650 nm pada panjang gelombang 650 nm ... 32
11. Kepadatan Nannochloropsis sp. pada tiap perlakuan (A) NaNO3 100% (B) NaNO3 50%. ... 34
12. Kurva perubahan konsentrasi nitrat anorganik pada media Nannochloropsis sp. (A) NaNO3 100% (B) NaNO3 50%. ... 37
v 14. Hubungan polinomial kepadatan (Nt) dengan protein total intraseluler
Nannochloropsis sp. pada tiap perlakuan (A) NaNO3 100%
(B) NaNO3 50% ... 40
15. Hubungan Linier Kepadatan (Nt) dengan Nitrat Anorganik
Nannochloropsis sp. pada tiap perlakuan seperti (A) NaNO3 100%;
(B) NaNO3 50% ... 46
16. Hubungan Polonomial Nitrat Anorganik dengan Protein Total Intraseluler pada tiap perlakuan seperti (A) NaNO3 100%;
vi DAFTAR LAMPIRAN
Lampiran Halaman
1. Uji Kepadatan rata – rata sel Nannochloropsis sp. . ... 55
2. Uji t protein total intraseluler Nannochloropsis sp. . ... 56
3. Uji t nitrat anorganik plankton intraseluler Nannochloropsis sp. . . 57
4. Cara Kerja Spektrofotometer Genesys 20. . ... 58
5. Penyimpanan sampel uji . ... 59
1
I. PENDAHULUAN
1. 1. Latar Belakang
Perairan laut Indonesia memiliki keunggulan dalam keragaman hayati
seperti ketersediaan mikroalga. Mikroalga merupakan tumbuhan air berukuran
mikroskopik yang memiliki kemampuan tumbuh yang cepat serta tidak
memerlukan area yang luas untuk kegiatan produksi. Ketersediaan mikroalga
sebagai pakan alami merupakan faktor penting dalam budidaya ikan dan krustase
terutama pada fase benih (Widjaja, 2009).
Mikroalga laut yang sering digunakan sebagai pakan hidup adalah
Nannochloropsis sp.. Nannochloropsis sp. mempunyai kecepatan pertumbuhan
yang tinggi sehingga masa panennya cepat (Griffiths dan Harrison, 2009).
Pertumbuhan Nannochloropsis sp. berkaitan dengan ketersediaan unsur makro (N,
P, K, S, Na, Si dan Ca) dan unsur mikro (Fe, Zn, Mn, Cu, Mg, Ca, B, C dan H)
pada habitat atau pun media kultur. Senyawa N merupakan unsur dasar yang
sangat berpengaruh terhadap pertumbuhan Nannochloropsis sp. karena
dibutuhkan dalam jumlah paling banyak dibandingkan unsur makro lainnya
(Handayani, 2003).
Nannochloropsis sp. memiliki peran sebagai sumber protein karena
mengandung protein yang tinggi bagi pertumbuhan larva ikan. Perannya dalam
2
rusak (Isnansetyo dan Kurniastuty, 1995) dan pembentukan biomolekul
(Sudarmaji et al., 1997). Menurut Yanuaris et al., (2012) sintesis protein akan
berjalan baik apabila nitrogen tersedia dalam jumlah yang cukup. Sumber nitrogen
didapatkan dari kotoran sapi yang telah difermentasi Actinobacillus sp. Nitrogen
pada kotoran tersebut dapat dimanfaatkan Nannochloropsis sp. sebagai media
kultur pertumbuhan yang optimal sebesar 1,4497 %.
Menurut Lavens dan Sorgeloos (1996) faktor lingkungan sangat
menentukan dalam kultur mikroalga. Lingkungan pertumbuhan mikroalga
dipengaruhi oleh parameter yaitu suhu, pH, cahaya, temperatur, salinitas dan
nutrien. Keberadaan mikroalga berkaitan erat dengan pengkayaan nutrien yang
tersedia seperti nitrogen, posfor, logam berat dan vitamin (Creswell, 1993 dalam
Creswell, 2010)
Media kultur harus mengandung nutrien yang digunakan untuk
pertumbuhan mikroalga (Gunawan, 2012). Nutrien dapat mempengaruhi efisiensi
fotosintesis dan menentukan pertumbuhan mikroalga. Pertumbuhan mikroalga
dapat ditandai dengan bertambah besarnya ukuran sel atau jumlah selnya
(Isnanstyo dan Kuniastuty, 1995). Menurut Lavens dan Sorgeloos (1996) bahwa
fase pertumbuhan plankton ada 5 fase yaitu fase lag, fase eksponensial, fase
menurunnya pertumbuhan relatif, fase stasioner, dan fase kematian. Fase lag
merupakan fase adaptasi Nannochloropsis sp. terhadap lingkungan yang baru. Nannochloropsis sp. telah mengalami metabolisme tetapi belum mengalami
pembelahan sel. Yanuaris et al., (2012) menyatakan bahwa ketersediaan unsur
nitrogen anorganik akan mempengaruhi pertumbuhan Nannochloropsis sp.
3
Nannochloropsis sp. yang meningkat akan mempengaruhi nutrien yang ada di
media kultur. Nitrogen memiliki peran penting pada pertumbuhan mikroalga.
Nitrat merupakan salah satu faktor pembatas pertumbuhan penting yang
berpengaruh dominan terhadap pertumbuhan sel mikroalga (Hu dan Gao, 2006).
Konsentrasi nutrien dan lingkungan berpengaruh pada pertumbuhan
Nannocholoropsis sp. yang dapat dilihat dari pertambahan densitas mikroalga.
Profil nitrat anorganik dan protein total intraseluler pada fase lag biomassa
Nannochloropsis sp. bertujuan untuk untuk mengetahui pengaruh peningkatan dan
defisiensi kandungan nitrogen anorganik pada fase Nannocholoropsis sp. tersebut.
1. 2. Tujuan penelitian
Tujuan penelitian ini adalah:
1. Mengetahui pertumbuhan ada fase lag Nannochloropsis sp. pada konsentrasi
nitrat anorganik yang berbeda.
2. Menganalisis hubungan antara pemanfaatan nitrat anorganik dan kandungan
protein total pada fase lag Nannochloropsis sp.
1. 3. Manfaat
Penelitian diharapkan dapat memberikan informasi mengenai profil nitrat
4
1. 4. Perumusan Masalah
Mikroalga merupakan salah satu bagian dalam proses budidaya yang
digunakan sebagai sumber makanan larva, ikan kecil, dan krustase. Salah satu
mikroalga yang digunakan adalah Nannochloropsis sp.. Nannochloropsis sp.
merupakan salah satu pakan alami yang dapat digunakan dalam kegiatan kultur
larva ikan karena memiliki kandungan protein tinggi (Wisnu, 2006). Pertumbuhan
mikroalga dalam kultur dapat ditandai dengan bertambah banyaknya jumlah sel
melalui fase pertumbuhan. Fase lag merupakan fase adaptasi Nannochloropsis sp.
terhadap lingkungan yang baru sehingga pada saat fase lag seringkali lebih
panjang dari waktu duplikasi (doubling time). Hal tersebut disebabkan
kemampuan nitrat anorganik mampu menekan pengaruh lingkungan eksternal.
Perubahan kondisi lingkungan akan mempengaruhi fase adaptasi dan
pertumbuhan Nannochloropsis sp. Hudaidah et al., (2013) mengindikasikan
bahwa pengurangan nutrien berupa nitrat anorganik ternyata mampu menekan
pengaruh lingkungan eksternal berupa salinitas. Kemampuan tersebut muncul
5
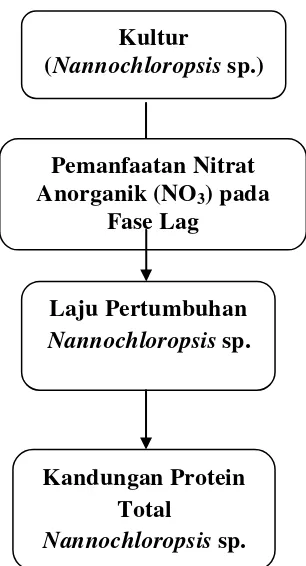
Gambar 1. Diagram kerangka pikir penelitian
1.5 Hipotesis
Hipotesis yang diuji adalah terdapat pengaruh nitrat anorganik (sebagai
nutrien) terhadap kepadatan dan protein total intraseluler pada fase lag
pertumbuhan Nannochloropsis sp.
Kultur
(Nannochloropsis sp.)
Laju Pertumbuhan Nannochloropsis sp.
Kandungan Protein Total
Nannochloropsis sp. Pemanfaatan Nitrat Anorganik (NO3) pada
6
II. TINJAUAN PUSTAKA
2.1Biologi Nannochloropsis sp.
2.1.1 Klasifikasi dan Morfologi Nannochloropsis sp.
Mikroalga merupakan tanaman yang mendominasi lingkungan perairan.
Morfologi mikroalga berbentuk uniseluler atau multiseluler tetapi belum ada
pembagian tugas yang jelas pada sel – sel komponennya. Hal tersebut yang
membedakan mikroalga dengan tumbuhan tingkat tinggi. Nannochloropsis sp.
merupakan fitoplankton berukuran 2 - 4 μm, berwarna kehijauan, tidak motil, dan
tidak berflagel. Selnya berbentuk bola dan berukuran kecil. Klasifikasi
Nannochloropsis sp. menurut Hoek et al., 1998 sebagai berikut :
Kingdom : Eukaryotes
Divisi : Heterokontophyta
Kelas : Eustigmatophyceae
Genus : Nannochloropsis
Spesies : Nannochloropsis sp.
Sel Nannochloropsis sp. memiliki kloroplas dan nukleus yang dilapisi
membran. Kloroplas memiliki stigma (bintik mata) yang bersifat sensitif terhadap
cahaya. Nannochloropsis sp. dapat berfototosintesis karena memiki klorofil.
Ciri khas dari Nannochloropsis sp. adalah memiliki dinding sel yang terbuat dari
7 Gambar 2. Koloni Nannochloropsis sp. (Biondi, 2011)
8 Gambar 4. Morfologi Nannochloropsis sp. (Hoek et al., 1998)
Nannochloropsis sp. dapat hidup pada suhu 25o - 30o C tetapi masih dapat
bertahan hidup pada suhu 40o C namun pertumbuhannya tidak normal sedangkan
pada rentang salinitas 35 ‰. Selain itu fitoplankton ini dengan pH 8 - 9,5 dan
intensitas cahaya 1.000 – 10.000 lux (Balai Budidaya Laut, 2002).
Nannochloropsis sp. berbentuk bulat memanjang dengan diameter sel
berkisar 2-4 μm dan dapat melakukan fotosintesis karena memiliki klorofil a yang
terdapat di kloroplas. Tiap satu sel Nannochloropsis sp. hanya memiliki satu
9 2. 1. 2 Pertumbuhan dan Perkembangan Sel Nanochloropsis sp.
Nannochloropsis sp. lebih dikenal dengan Chlorella laut karena memiliki
nilai nutrisinya sangat tinggi, mudah dikultur secara massal, tidak menimbulkan
racun, pertumbuhannya relatif cepat, memiliki kandungan antibiotik dan
ukurannya sangat kecil 2 - 5 μm (Ari, 2000).
Nannochloropsis sp. berkembang biak secara aseksual dengan cara
membelah diri dan membentuk autospora. Setiap sel yang sudah masak akan
membelah diri dan menghasilkan dua dan empat autospora. Autospora adalah
spora non flagela yang bentuknya menyerupai sel induknya, tetapi mempunyai
ukuran tubuh lebih kecil. Autospora yang telah dihasilkan dibebaskan dari sel
induk melalui penghancuran dinding sel dewasa dan berkembang hingga
mencapai ukuran sel induknya (Barsanti and Gualtieri, 2006).
Penggandaan sel Nannochloropsis sp. terjadi sangat cepat. Hal tersebut
dikarenakan sumber nutrien yang mencukupi (Barsanti and Gualtieri, 2006).
Adanya pertumbuhan dalam kultur fitoplankton ditandai dengan bertambahnya
ukuran sel fitoplankton dan bertambah besarnya ukuran sel. Menurut Lavens dan
Sorgeloos (1996) pertumbuhan fitoplankton dibagi dalam beberapa fase yaitu:
1. Fase Lag
Fase lag mengalami sedikit peningkatan densitas sel. Pada fase pertumbuhan
lag disebabkan fisiologis adaptasi metabolisme sel pertumbuhan, seperti
meningkatnya tingkat enzim dan metabolit yang terlibat dalam pembelahan sel
dan fiksasi karbon. Pada saat beradaptasi, sel mengalami defisiensi enzim atau
koenzim, sehingga harus disintesis terlebih dahulu untuk keberlangsungan
10 2. Fase Logaritmik atau Eksponensial
Pada fase eksponensial sel fitoplankton telah mengalami pembelahan dan
laju pertumbuhannya tetap. Pertumbuhan fitoplankton dapat maksimal tergantung
pada spesies alga, intensitas cahaya dan temperatur.
3. Fase berkurangnya pertumbuhan relatif
Pertumbuhan sel mulai melambat ketika nutrien, cahaya, pH, CO2 atau
faktor kimia dan fisika lain mulai membatasi pertumbuhan.
4. Fase Stasioner
Pada fase keempat faktor pembatas dan tingkat pertumbuhan seimbang.
Laju kematian fitoplankton relatif sama dengan laju pertumbuhannya sehingga
kepadatan fitoplankton pada fase ini relatif konstan.
5. Fase Kematian
Pada fase kematian, kualitas air memburuk dan nutrien habis hingga ke level
tidak sanggup menyokong kehidupan fitoplankton. Kepadatan sel menurun
dengan cepat karena laju kematian fitoplankton lebih tinggi daripada laju
pertumbuhannya hingga kultur berakhir.
11 2. 2 Protein
Komponen penting dan terutama pada sel hewan atau manusia adalah protein,
karena protein berperan sebagai zat utama dalam pembentukan tubuh. Protein juga
penting sebagai enzim yang bertanggung jawab untuk mengkatalisis ribuan reaksi
biokimia (Stickney, 2005). Protein merupakan suatu polipeptida yang memiliki
bobot yang bervariasi dan memiliki sifat yang berbeda - beda. Protein ada yang
memiliki sifat mudah larut di dalam air dan ada yang sulit larut di dalam air.
Protein memiliki empat sifat struktur dasar yaitu struktur primer, sekunder, tersier
dan kuaterner (Poedjiadi, 1994).
Struktur primer menunjukkan jumlah, jenis, dan urutan asam amino dalam
molekul protein. Ikatan antar asam amino merupakan ikatan peptida, maka
struktur primer protein juga menunjukkan ikatan peptida yang urutannya
diketahui. Pada rantai polipeptida terdapat banyak gugus > C = O dan gugus
> N – H. Kedua gugus ini berikatan satu dengan yang lain karena terbentuknya
ikatan hidrogen antara atom oksigen dari gugus > C = O dengan atom hidrogen
dari gugus > N – H. Gugus – gugus yang terdapat dalam satu rantai polipeptida
akan terbentuk struktur heliks. Ikatan hidrogen terjadi antara dua rantai
polipeptida atau lebih dan akan membentuk konfigurasi alpha yaitu bukan bentuk
heliks tetapi rantai sejajar yang berkelok – kelok dan disebut struktur lembaran
berlipat. Struktur alfa heliks dan lembaran berlipat merupakan struktur sekunder
protein.
Struktur tersier menunjukkan kecenderungan polipeptida membentuk lipatan
atau gulungan, dan dengan demikian membentuk struktur yang lebih kommpleks.
12 yang membentuk protein. Struktur kuartener menunjukkan derajat kumpulan
protein. Sebagian besar protein globular terdiri atas beberapa rantai polipeptida
yang terpisah. Rantai polipeptida saling berinteraksi membentuk kumpulan
protein (Poedjiadi, 1994).
Protein merupakan suatu polipeptida yang mempunyai bobot molekul yang
bervariasi sehingga akan menghasilkan asam amino (Poedjiadi, 1994). Protein
dalam tumbuhan dihasilkan dari CO2, H2O, dan senyawa nitrogen. Nitrogen
merupakan nutrien yang dibutuhkan paling banyak untuk pertumbuhan
fitoplankton yaitu sebagai unsur penting dalam pembentukan protein (Isnansetyo
dan Kurniastuty, 1995).
2.3Faktor Pembatas
Pertumbubuhan mikroalga sangat erat kaitannya dengan ketersediaan unsur
hara dan dipengaruhi oleh kondisi lingkungan sebagai faktor pembatas seperti pH,
suhu, nutrien dan cahaya (Isnansetyo dan Kurniastuty, 1995).
a. Suhu
Suhu merupakan salah satu faktor yang mempengaruhi pertumbuhan
fitoplankton. Suhu optimal pada mikroalga antara 23 - 250 C, tergantung pada komposisi medium kultur, spesies dan tempat budidaya (Sari dan Manan, 2012).
13 adalah 25- 320 C. Suhu optimum bagi perkembangan Nannochlropsis sp. adalah
23 - 260 C (Taw, 1990 dalam Fitriani, 2012).
b. Cahaya
Mikroalga merupakan organisme autotrof yang mampu membentuk
senyawa organik dan senyawa – senyawa anorganik melalui fotosintesis.
Mikroalga dapat melakukan proses asimilasi bahan organik. Intensitas cahaya
terlalu tinggi dapat menyebabkan penghambatan fotosintesis. Durasi pencahayaan
buatan harus minimum18 jam cahaya per hari (Lavens dan Sorgeloos, 1996). Pada
kultur skala laboratorium cahaya didapat dari cahaya lampu TL dengan kapasitas
sebesar 1450 lux (Sari dan Manan, 2012).
c. Power of Hidrogen (pH)
Faktor lingkungan yang perlu mendapat perhatian adalah pH (derajat
keasaman) agar metabolisme sel mikroalga tidak terganggu. pH sebagai log
negatif dari konsentrasi ion hidrogen. Skala pH berjalan 0 sampai 14 dengan nilai
yang netral. Nilai di bawah 7 bersifat asam. Kisaran pH dalam sistem air tawar
antara 6 dan 9, sedangkan pH air asin di atas 7. Artinya, untuk setiap kenaikan
satu unit pH, misalnya meningkat dari pH 6 sampai pH 7, air menjadi 10 kali
lebih sedikit asam. Dalam sirkulasi sistem air akumulasi asam organik dari zat -
zat dalam pakan akan bersama - sama akumulasi karbon dioksida akibat respirasi
dan menyebabkan penurunan pH. Sistem air tawar, pH antara 6,5 dan 8,5.
Sedangkan, pada sistem air laut seperti moluska akan berusaha menekati pH
netral. Hal tersebut dikarenakan kalsium karbonat cangkang moluska akan mulai
larut pada kondisi asam. Jika pH mendekati di bawah 7, senyawa penyangga harus
14 karbonat atau bikarbonat. Keduanya terdiri dari kalsium karbonat, yang
perlahan-lahan akan larut menjadi masing-masing ion. Maka anion akan bergabung dengan
ion hidrogen untuk menghasilkan bikarbonat (Stickney, 2005).
Derajat optimal keasaman atau pH digambarkan sebagai keberadaan ion
hidrogen. Derajat keasaman (pH) berpengaruh terhadap kelarutan dan
ketersediaan ion mineral sehingga mempengaruhi penyerapan nutrien oleh sel
(Gunawan, 2012). Rentang pH untuk kultur kebanyakan spesies alga adalah antara
7 - 9 dan rentang optimumnya antara 8,2 - 8,7 (Lavens dan Sorgeloos, 1996).
Perubahan nilai pH yang signifikan dapat menghambat proses fotosintesis dan
pertumbuhan mikroalga (Gunawan, 2012).
d. Nutrien
Mikroalga mendapatkan nutrien dari air laut yang sudah mengandung
nutrien yang cukup lengkap. Nutrien tersebut dibagi menjadi makronutrien dan
mikronutrien, makronutrien meliputi nitrat dan posfat ( Taw, 1990). Unsur makro
seperti N, P, K, S, Na, Si, dan Ca serta unsur mikro seperti Fe, Zn, Mn, Cu, Mg,
Mo, Co, B, dan lain lain masing-masing memiliki fungsi pada pertumbuhan
fitoplankton. (Isnansetyo dan Kurniastuty, 1995).
Nutrien berperan penting dalam pengaturan produksi, biomassa, dan
keragaman spesies. Mikroalga membutuhkan makronutrien (nitrat dan posfat) dan
mikronutrien (Fe, Zn, Mn, Cu, Mg, Mo, Co, B, dan vitamin) (Isnansetyo dan
Kurniastuty, 1995; Taw, 1990). Keterbatasan nutrien dapat menghambat dinamika
15 2.4Nitrogen
Nitrogen yang ditemui di perairan bukan dalam bentuk gas melainkan berupa
nitrogen organik dan nitrogen anorganik. Nitrogen organik berupa protein, asam
amino dan urea, sedangkan nitrogen anorganik terdiriatas ammonia (NH3),
ammonium (NH4), nitrit (NO2), nitrat (NO3) dan molekul nitrogen dalam bentuk
gas (N). Nitrogen merupakan unsur yang tidak reaktif (sulit bereaksi dengan unsur
lain) sehingga dalam penggunaan nitrogen pada makhluk hidup diperlukan
berbagai proses, yaitu fiksasi nitrogen, mineralisasi, nitrifikasi, denitrifikasi
(Campbell et al., 2003).
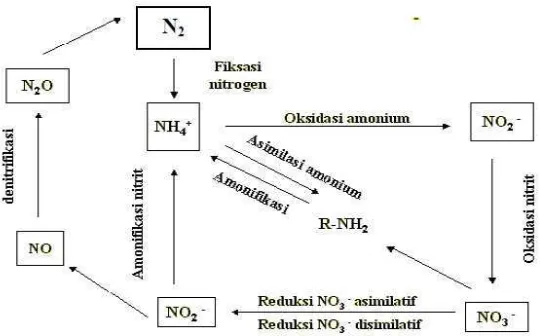
Siklus nitrogen adalah suatu proses konversi senyawa yang mengandung unsur
nitrogen menjadi berbagai macam bentuk kimiawi yang lain. Siklus
nitrogen sangat dibutuhkan dalam ekologi karena ketersediaan nitrogen dapat
mempengaruhi tingkat proses ekosistem kunci, termasuk produksi primer dan
dekomposisi. Nitrogen yang terdapat di lingkungan berbagai bentuk kimia
termasuk nitrogen organik, amonium, nitrit, nitrat, dan gas nitrogen. Nitrogen
organik dapat berupa organisme hidup, atau humus, dan dalam produk antara
dekomposisi bahan organik atau humus yang dibentuk. Proses siklus
nitrogen mengubah nitrogen dari satu bentuk kimia lain yang dibantu oleh
mikroba baik untuk menghasilkan energi atau menumpuk nitrogen dalam bentuk
yang dibutuhkan untuk pertumbuhan. Produk fotosintesis ini akan dikonsumsi
oleh binatang dan mikroba yang hidup bebas. Bakteri yang membusuk mendapat
energi dari memecah senyawa ini. Pemecahan tersebut membebaskan senyawa
anorganik seperti nitrat yang merupakan nutrien dasar. Siklus nitrogen menjadi
16 bakteri mengonsumsi zat organik terlarut atau perubahan senyawa organik ke zat
anorganik, penggabungan nitrogen sehingga bakteria lain bisa mengikat molekul
nitrogen ke dalam nutrien nitrat yang lebih berguna. Sebaliknya, bakteri
denitrifikasi mengubah nitrat ke dalam molekul nitrogen. Ketersediaan nitrogen
membatasi aktivitas fotosintesis dalam air yang dingin (temperatur air). Sebagian
besar karena konversi nitrogen organik kembali ke nutrien nitrat ketika
pengonversian selesai, nitrat akan tenggelam dekat zona euphotik. Sekitar 48%
gas terlarut di air laut adalah nitrogen, berbalik dengan kandunganya di atmosfer,
sekitar 78% dari volume seluruhnya. Ketika nitrogen monoksida bercampur
dengan hujan, akan membentuk cairan asam nitrit yang akan membunuh ikan
(Campbell et al., 2003). Siklus nitrogen ditampilkan pada Gambar 6.
Gambar 6. Siklus Nitrogen (Sitaresmi, 2002 dalam Angraini, 2009)
Nitrat sebagai sumber nitrogen untuk penyusun protein pada tumbuhan
diperoleh dari proses konversi. Proses tersebut dapat dilihat pada persamaan
reaksi (Effendi, 2003).
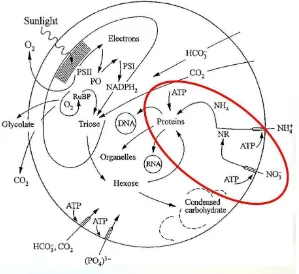
17 Perubahan nitrat menjadi protein dalam tubuh fitoplankton diilustrasikan
dalam Gambar 7.
Gambar 7. Proses perubahan nitrat menjadi protein (Reynolds, 2006)
Salah satu senyawa nitrogen yang penting bagi mikroalga adalah senyawa
nitrat. Nitrat merupakan sumber nitrogen yang penting bagi fitoplankton baik di
air laut maupun di air tawar (Taw, 1990). Nitrat merupakan bentuk dari nitrogen
di perairan yang bersifat mudah larut dalam air dan bersifat stabil. Nitrat diperoleh
dari proses oksidasi sempurna dari senyawa oksigen di perairan. Kadar nitrat –
nitrogen pada perairan hampir tidak pernah lebih dari 0,1 mg/liter sehingga
menggambarkan terjadinya eutrofikasi di perairan (Effendi, 2003).
Nitrogen merupakan salah satu unsur yang terpenting pada pertumbuhan
fitoplankton sebagai penghasil asam amino dan penyusun protein (Campbell et al., 2003; Suminto, 2009). Kandungan nitrogen yang tinggi dalam NaNO3 pada
18 kandungan protein yang tinggi (Suminto, 2009). Reynolds (2006) menjelaskan
bahwa nitrogen merupakan unsur gas dibutuhkan dalam jumlah terbatas pada
ekologi dan pertumbuhan fitoplankton setelah asam amino. Apabila fitoplankton
mengalami kekurangan nitrogen dalam NaNO3 akan mengakibatkan rendahnya
jumlah protein. Pada proses sintesis asam amino nitrogen diperlukan sebagai
19
III. METODOLOGI
3.1 Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada tanggal 13 - 21 Januari 2014 bertempat di
Laboratorium Budidaya Perikanan, Jurusan Budidaya Perairan, Fakultas
Pertanian, Universitas Lampung. Uji protein dilakukan di Laboratorium
Teknologi Hasil Pertanian Politeknik Negeri Lampung, dan uji kandungan nitrat
dilakukan di Laboratorium Kualitas Air Balai Besar Pengembangan Budidaya
Laut (BBPBL), Lampung.
3.2 Materi Penelitian 3.2.1 Biota Kultur
Biota kultur yang digunakan dalam penelitian adalah Nannochloropsis sp.
yang dikultur pada skala laboratorium di BBPBL Lampung.
3.2.2 Media Kultur
Media yang dipergunakan dalam kultur Nannochloropsis sp. berbentuk
cair atau larutan yang tersusun dari senyawa-senyawa kimia (pupuk) yang
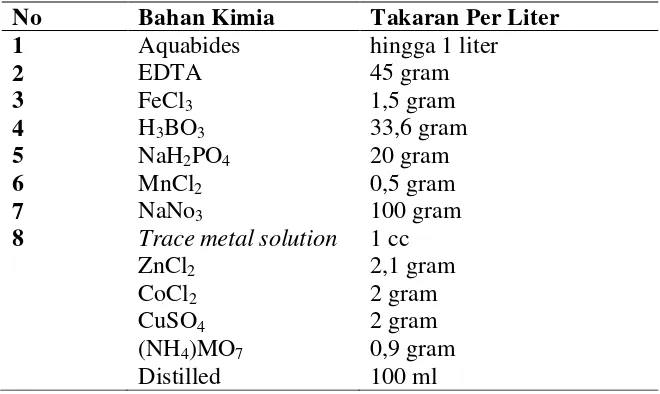
merupakan sumber nutrien. Pupuk yang akan digunakan dalam penelitian adalah
20 standar (Tabel 1) dan komposisi pupuk dengan pengurangan NaNO3 sebanyak
50%.
Tabel 1. Komposisi pupuk Conwy skala laboratorium (BBPBL Lampung)
No Bahan Kimia Takaran Per Liter
1 Aquabides hingga 1 liter
pertama, perbedaannya adalah adanya konsentrasi NaNO3 yang dikurangi hingga
50% dibanding komposisi pupuk Conwy standar.
3.3 Alat dan Bahan Penelitian 3.3.1Alat
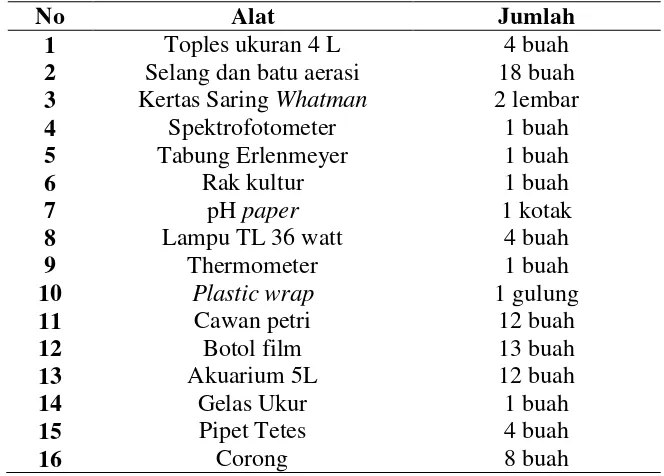
Penelitian menggunakan beberapa alat untuk mendukung jalannya
21 Tabel 2. Alat yang digunakan dalam penelitian
No Alat Jumlah
1 Toples ukuran 4 L 4 buah
2 Selang dan batu aerasi 18 buah
3 Kertas Saring Whatman 2 lembar
4 Spektrofotometer 1 buah
5 Tabung Erlenmeyer 1 buah
Penelitian menggunakan beberapa bahan untuk mendukung jalannya
penelitian. Bahan-bahan yang digunakan dalam penelitian adalah bibit
Nannochloropsis sp., air laut steril dan Pupuk Conwy (100%, dan 50%), H2SO4,
NaOH, sodium arsenit, dan brucine.
3.4 Rancangan Penelitian
Rancangan yang digunakan dalam penelitian yang terdiri dari 2 perlakuan
dan 3 kali ulangan, masing-masing perlakuan dilakukan 7 kali waktu pengambilan
contoh. Perlakuan tersebut adalah sebagai berikut :
Perlakuan A : kultur Nannochloropsis sp. tanpa pengurangan sumber nitrogen
(NaNO3) 100%
Perlakuan B : kultur Nannochloropsis sp. dengan pengurangan sumber nitrogen
22 Waktu pengambilan contoh kepadatan Nannochloropsis sp. dan analisis
kandungan nitrat dan uji protein total dilakukan pada jam kultur ke- 0, 2, 4, 6, 8,
10, dan 12. Peletakan wadah kultur dilakukan secara acak dan deskripsikan pada
Gambar 8.
Peletakan wadah kultur dilakukan secara acak disajikan pada Gambar 8.
Gambar 8. Tata letak wadah kultur Nannochloropsis sp.
Keterangan:
PA : Perlakuan pertama (penggunaan komposisi Pupuk Conwy standar 100%)
PB : Perlakuan kedua (penggunaan komposisi NaNO3 pada pupuk Conwy
dikurangi hingga 50%)
U1 : Ulangan pertama pada pengambilan sampel
U2 : Ulangan kedua pada pengambilan sampel
U3 : Ulangan ketiga pada pengambilan sampel
P
B
U
3
P
A
U
2
P
A
U
1
23 3.5Prosedur Penelitian
Penelitian dilakukan pada skala laboratorium. Persiapan penelitian
dilakukan dengan cara mensterilisasikan alat dan air yang akan digunakan selama
penelitian. Prosedur penelitian disajikan pada Gambar 9.
Gambar 9. Tahapan alur penelitian Sterilisasi air laut
Homogenisasi air laut
Pemberian Pupuk Conwy dan Homogenisasi
Kultur bibit Nannochloropsissp.
Pengukuran kualitas air pada fase lag Nannochloropsissp.
24 3.5.1Persiapan
Tahap awal yang dilakukan adalah mempersiapkan seluruh alat dan bahan
yang akan digunakan dalam penelitian. Alat dan bahan yang digunakan untuk
kultur Nannochloropsis sp. harus dalam keadaan steril agar tidak terjadi
kontaminasi dengan organisme lain yang dapat menjadi predator bagi
Nannochloropsis sp.
a. Sterilisasi alat
Sterilisasi alat kultur seperti toples, akuarium dan cawan petri tersebut
dicuci, lalu dibilas menggunakan air tawar diulang dua kali untuk mencegah
protozoa. Alat-alat kultur yang telah dibilas disemprot dengan alkohol 70%.
Sedangkan untuk selang dan batu aerasi, setelah, dicuci, dibilas dengan air tawar,
lalu direndam desinfeksi dan direbus selama 15 menit.
b. Sterilisasi air
Air laut yang akan digunakan disterilisasi dengan beberapa tahapan.
Tahapan pertama adalah ozonisasi. Ozonisasi air laut yang akan digunakan
disterilisasi dengan cara air dididihkan selama 30 menit selanjutnya air
didinginkan selama 30 menit kemudian disaring. Selanjutnya dididihkan dan
disaring untuk kedua kalinya untuk memastikan tidak ada pesaing predator
25 c. Pembuatan stok pupuk Conwy
Pupuk Conwy yang digunakan pada kultur Nannochloropsis sp. skala
laboratorium yaitu pupuk Conwy PA (Pro Analis) yang memiliki kemurnian
bahan mencapai 100%. Pemberian pupuk pada kultur tersebut dengan
menggunakan rasio 1 ml/liter air yang digunakan. Adapun cara pembuatan pupuk
Conwy untuk stok (Muhaemin, 2009) yaitu:
1. Bahan pembuatan pupuk Conwy dipersiapkan dan ditimbang secara berurutan
sesuai takaran (Tabel 1) dengan menggunakan timbangan digital dan
dipersiapkan juga alat seperti, pipet tetes, gelas baker dan sendok.
2. Setelah semua bahan ditimbang, aquabides dimasukkan ke dalam gelas baker
sebanyak 800 ml, kemudian bahan-bahan pupuk Conwy dimasukkan secara
berurutan mulai dari EDTA 45 g (Tabel 1. No.2) dimasukkan ke dalam gelas
baker dan dilarutkan air aquades, begitu seterusnya (No.3, No.4, No.5, No.6)
larut secara berurutan hingga NaNO3 100g/liter (No.7) larut.
3. Selanjutnya trace metal solution (Tabel 1 No.8) dimasukkan dan dilarutkan
satu persatu masing-masing 1 ml.
4. Setelah semua larut, ditambahkan lagi aquabides ke dalam larutan pupuk
hingga menjadi 1 liter.
3.5.2 Pelaksanaan Penelitian
Penelitian dilakukan untuk memperoleh data dari masing-masing perlakuan
yang akan diteliti. Prosedur kultur yang dilakukan yaitu :
1. Akuarium kultur disusun pada rak kultur dengan susunan acak dan diberi
26 2. Air laut steril disiapkan sebanyak 3,5 liter tiap akuarium kultur.
3. Air laut dihomogenisasi dengan memasang aerasi kuat.
4. Pupuk Conwy diberikan sebanyak 1 ml/liter dalam akuarium kultur.
5. Air laut yang diberi pupuk Conwy dihomogenisasi kembali dengan aerasi
kuat.
6. Bibit awal Nannochloropsis sp. disiapkan dengan kepadatan sekitar 5.106
sel/ml dan diencerkan dengan volume air kultur 4 liter masing-masing pada 7
(2 perlakuan × 3 ulangan) buah toples plastik volume 4 liter.
7. Kualitas air diukur diawal dan diakhir pada fase awal lag.
8. Pengamatan kepadatan Nannochloropsis sp. dilakukan menggunakan
spektrofotometer dengan optical density (OD) 650 nm.
9. Kemudian kultur Nannochloropsis sp. dipanen secara total dengan cara dibuat
dan disaring dengan menggunakan kertas saring sampai didapat sampel
plankton segar. Tiap sampel disimpan ke dalam cawan petri dan ditutup
dengan plastic wrap sedangkan air dari penyaringan berupa supernatan
dimasukkan ke dalam botol film.
10. Langkah terakhir yang dilakukan yaitu sampel yang telah disimpan dalam
cawan petri dibawa untuk dilakukan uji protein dan supernatan dilakukan uji
nitrat.
3.6 Parameter yang Diamati 3.6.1 Uji Proksimat Protein
Uji proksimat protein dilakukan pada jam kultur ke- 0, 2, 4, 6, 8, 10, dan 12.
27 Negeri Lampung. Uji proksimat protein pada Nannochloropsis sp. dengan
menggunakan metoda Gunning. Tahapan isolasi sebelum sampel diuji adalah
sampel protein disaring terlebih dahulu untuk memisahkan air dan
Nannochloropsis sp. Sampel protein yang telah disaring lalu dimasukkan ke
dalam cawan petri dan dibungkus dengan plastik dan selanjuntnya sampel diuji.
1. Bahan ditimbang 0,5 – 1,0 gr dimasukkan dalam labu kjeldahl, ditambahkan
10 gr K2S atau Na2SO4 anhidrat, dan 10 – 15 ml H2SO4 pekat. Kalau distruksi
sukar dilakukan perlu ditambah 0,1 – 0,3 gr CuSO4 dan dikocok.
2. Kemudian dilakukan distruksi diatas pemanas listrik dalam lemari asam, mula
mula dengan api kecil, setelah asap hilang api dibesarkan, pemanasan diakhiri
setelah cairan menjadi jernih tak berwarna lagi.
3. Dibuat perlakuan blangko yaitu seperti perlakuan diatas tanpa contoh.
4. Setelah dingin tambahkan kedalam labu kjeldahl akuades 100 ml, serta
larutan NaOH 45% sampai cairan bersifat basis, pasanglah labu kjeldahl
dengan segera pada alat distilasi.
5. Labu Kjeldahl dipanaskan sampai amonia menguap semua, distilat ditampung
dalam erlenmeyer berisi 25 ml HCl 0,1N yang sedang diberi indikator
PhenolPtalein 1 % beberapa tetes. Distilasi diakhiri setelah distilat tertampug
sebanyak 150 ml atau setelah distilat yang keluar.
6. Kelebihan HCl 0,1 N dalam distilat dititrasi dengan larutan basa standar
(larutan NaOH 0,1 N).
Perhitungan kandungan protein dalam sampel dihiting menggunakan rumus:
% = � – � � × �× �, �
�.� � ×
28 Keterangan:
Faktor Konversi = 6,25 (setara dengan 0,16 gram nitrogen per gram protein)
3.6.2 Uji Kandungan Nitrat (NO3)
a. Pembuatan Reagen
Reagen untuk uji kandungan nitrat dibuat dengan metode dari BBPBL adalah
sebagai berikut:
1) Sodium Arsenit (NaAsO2)
0,5 gram sodium arsenit dilarutkan dengan aquades menjadi 50 ml.
2) Brucine (C23H26N2O)
5 gram brucine dilarutkan dengan asam asetat glacial (C2H4O2) menjadi
100 ml.
3) Asam Sulfat (H2SO4)
125 ml asam sulfat pekat ditambahkan dengan 31,25 ml aquades.
Uji kandungan nitrat dalam Nannochloropsis sp. dilakukan pada saat sebelum
pupuk dimasukkan (N-1), saat setelah pupuk dimasukkan (N0), dan pada jam
kultur ke- 0, 2, 4, 6, 8, 10, dan 12 dengan menggunakan spektrofotometer. Cara
pengujian nitrat adalah sebagai berikut:
1. Sampel supernatan disaring dengan menggunakan whatman paper lalu
diambil sebanyak 5 ml lalu dimasukkan ke dalam baker glass 50 ml.
2. Ditambahkan 1 tetes sodium arsenit dan 0,25 ml brucine
29 4. Setelah 10 menit dalam suhu ruang, sampel diukur dengan menggunakan
spektrofotometer dengan panjang gelombang (λ) 410 nm
5. Nilai Absorbance yang terbaca pada tampilan layar spektrofotometer
bersatuan mg/l
3.6.3Pembuatan Kurva Standar Absorbansi Sel Nannochloropsis sp.
Pengukuran kepadatan dibuat dengan menggunakan hubungan regresi linier
antara kepadatan Nannochloropsis sp. dan absorbansi yang terbaca pada
spektrofotometer. Menurut penelitian Muhaemin (2008), panjang gelombang
spektofotometer yang optimal dalam pengukuran kepadatan fitoplankton adalah
sebesar 650 nm. Cara mencari regresi linier tersebut adalah sebagai berikut:
1. Sampel bibit kultur diambil sebanyak 50 ml
2. Sampel diencerkan sebanyak 20 ml menggunakan akuades dengan selang
sampel yang digunakan adalah 20, 18, 16, 14, 12, 10, 8, 6, 4, dan 2 ml.
3. Setelah diencerkan sampel bibit dimasukkan ke dalam spektrofotometer dan
dicatat nilai absorbansinya
4. Sampel selanjutnya diamati kepadatannya di bawah mikroskop dengan
menggunakan haemocytometer. Pengamatan dilakukan terus menerus pada
tiap pengenceran.
5. Hasil kepadatan dan absorbansi yang didapat selanjutnya di cari nilai regresi
liniernya dengan menggunakan kurva standar yang nantinya akan dijadikan
acuan untuk menghitung kepadatan Nannochloropsis sp. dengan
30 3.6.4Penghitungan Kepadatan Nannochloropsis sp.
Kepadatan fitoplankton dihitung dengan menggunakan spektrofotometer.
Menurut penelitian Muhaemin (2008), spektofotometer yang optimal dalam
pengukuran kepadatan fitoplankton adalah optical density (OD) 650 nm. Cara
menghitung kepadatan Nannochloropsis sp. adalah sebagai berikut:
1. Sampel bibit kultur diambil sebanyak 20 ml
2. Sampel bibit dimasukkan ke dalam cuvet dan dicatat nilai absorbansinya.
3. Sampel diambil pada jam kultur ke- 0, 2, 4, 6, 8, 10, dan 12.
4. Hasil dari kepadatan pada pengamatan dikonversikan dengan nilai regresi
linier absorbansi spektrofotometer (Å) dalam kepadatan sel Nannochloropsis
sp. yang diperoleh
3.7 Analisis Data
3.7.1Hubungan Antar Dua Variabel Dependen
Hubungan antara pemanfaatan nitratan organik dengan kandungan protein
total pada Nannochloropsis sp. dianalisis menggunakan model persamaan regresi
linier dan polinomial, dengan model persamaan regresi linier Y = aX + b; dan
model persamaan regresi polinomial Y = aX2 + bX + c, koefisien korelasi (r) Pearson dan koefisien determinasi (R2) (Supangat, 2007), di mana r adalah:
r = n ∑XY −(∑X ∑Y)
� ∑X2 − ∑X 2 [n∑X2− ∑Y 2]
Sedangkan analisis untuk menguji koefisien regresi secara individual adalah
dengan menggunakan uji t (t-test) untuk membandingkan dua nilai tengah contoh
31 normal dan memiliki ragam sama yang tidak diketahui nilainya (Steel dan Torrie,
1993).
a = kemiringan kurva/slope
V. KESIMPULAN DAN SARAN
5.1Kesimpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa
a. Konsentrasi NO3- pada pupuk Conwy 100 % mengalami peningkatan
pertumbuhan pada kultur Nannochloropsis sp. sedangkan pada
konsentrasi NO3- pada pupuk Conwy hingga 50% mengalami penurunan
pertumubuhan Nannochloropsis sp..
b. Penurunan konsentrasi nitrat anorganik (NO3-) pada pupuk Conwy hingga
50% mengakibatkan penurunan protein total intraseluler Nannochloropsis
sp. akan tetapi, protein total intraseluler Nannochloropsis sp. tidak
memberi respon yang signifikan terhadap perubahan kandungan nitrat
anorganik pada media kultur.
c. Nilai absorbansi spektrofotometer dapat mewakili untuk menghitung
kepadatan sel Nannochloropsis sp.
5.2 Saran
Perlu dilakukan penelitian sejenis baik terhadap biota maupun perlakuan
DAFTAR PUSTAKA
Anggraini, E. 2009. Aktivitas Reduksi Nitrat Dan Kinetika Bakteri Denitrifikasi dari Muara Sungai Pada Konsentrasi Oksigen Yang Berbeda. Tesis. Institut Pertanian Bogor.
Balai Budidaya Laut. 2002. Budidaya Fitoplankton dan Zooplankton. Direktorat
Jendral Perikanan. Departemen Kelautan dan Perikanan. 9: 7-8.
Barsanti, L and Gualtieri, P. 2006. Algae Anatomy, Biochemistry, and Biotechnolgy. CRC Press. United United States of America.
Biondi, N. and M. Tredici. 2011. Algae and Aquatic Biomass for a Sustainable Production of 2nd Generation Biofuels. UNIFI. Page 148-150
Brezonik, P.L. 1994. Chemical Kinetics and Process Dynamics in Aquatic Systems. CRC Press. United States of America. 752 hal.
Campbell, N.A, J. B Reece, L.G. Mitchell. 2003. Biologi Edisi Kelima jilid II.
Jakarta: Erlangga.
Chilmawati Diana dan Suminto. 2010. Penggunaan Media Kultur Yang Berbeda Terhadap Pertumbuhan Chorella sp.Jurnal Saintek Perikanan Vol. 6, No. 1,
2010, 71-78
Creswell, L. 2010. Phytoplankton Culture for Aquaculture feed. SRAC Publication No 5004
Chrismadha, T., Lily P. dan Yayah M. 2006. Pengaruh Konsentrasi Nitrogen dan Fosfor terhdap Pertumbuhan, Kandungan Protein, Karbohidrat dan Fikosianin pada Kultur Spirulina fusiformis. Berita Biologi Volume. 8 No. 3
Determann, S., J.M. Lobbes, R. Reuter, dan J. Rullkötter. 1998. Ultraviolet Fluorescence Excitation and Emission Spectroscopy of Marine Algae and Bacteria. Journal Marine Chemistry. Vol. 62: 137-156.
Dwidjoseputro, 1986. Pengantar Fisiologi Pertumbuhan. Gramedia. Jakarta Effendi, H. 2003. Telaah Kualitas Air. Penerbit Kanisius. Yogyakarta. hal.
Forján, E., L. Garbayo, C. Casal, dan C. Vílchez. 2007. Enhancement of Carotenoid Production in Nannochloropsis by Phosphate and Sulphur
Limitation. Journal Communicating Current Reaserch and Educational Tropics and Trends in Applied Microbiology. Hal 356-364.
Griffiths, M.J. & S.T.L. Harrison. 2009. Lipid productivity as a key characteristic for choosing algal species for biodiesel production. J. Appl. Phycol., 21: 493–507.
Gunawan. 2012. Pengaruh Perbedaan pH pada Pertumbuhan Mikroalga Klas
Chlorophyta. Jurnal Bioscientiae. 9 (2): 62 – 65.
Hoek, C. Van Den, D. G. Mann and H. M. Jahns. 1998. Algae: An Introduction to Phycology. Cambridge University Press. Melbourne.
Hudaidah, S., M. Muhaemin dan Rosdinar. 2013. Strategy of Nannochloropsis
Againts Environment Starvation: Population Density and Crude Lipid Contents. Maspari Journal. Vol. 5 (2): 64-68.
Handayani, L. 2003. Pertumbuhan Spirulina platensis yang Dipupuk dengan
Pupuk Komersil Dan Kotoran Puyuh Pada Konsentrasi Berbeda. Fakultas Perikanan dan Ilmu Kelautan. Institut Pertanian Bogor. Bogor.
Hu, H. and K. Gao. 2006. Response of Growth and Fatty Acid Compositions of
Nannochloropsis sp. to Environmental Factors Under Elevated CO2
Concentration. Journal Biotechnol Lett. Vol. 28: 987-992.
Isnansetyo, A. dan Kurniastuty. 1995. Teknik Kultur Fitoplankton dan Zooplankton Pakan Alami untuk Pembenihan Organisme Laut. Kanisius.
Yogyakarta.
Lavens, P. and P. Sorgeloos, 1996. Manual On The Production And Use Of Live Food For Aquculture. FAO Fisheries Technical Paper : Belgium
Madigan, M.T.; Martinko, J.M.; Stahl, D.; Clark, D.P. 2010. Brock Biology of Microorganisms (dalam bahasa Inggris) (ed. 13). Boston: Benjamin
Cummings.
Malensang, J.S., H. Komalig dan D. Hatidja. 2012. Pengembangan Model Regresi Polinomial Berganda pada Kasus Data Pemasaran. Jurnal Ilmiah Sains. Vol.
12 (2): 149-152.
Muhaemin, M., R.F. Kaswadji, dan T. Pratono. 2005. Kemampuan Pengikatan Metaloprotein Asam Amino Methionin Terhadap Pb pada Dunaliella salina. Jurnal Pertanian Terapan. Vol VI (2): 160-165. Politeknik Universitas
Muhaemin, M. 2009. Cadmium-Peptides Complexes in Dunaliella salina Cells. Journal of Coastal Development. Vol 13 (1): 54 - 58.
Pirt, S.J. 1975. Principles of Microbe and Cell Cultivation. Oxford: Blackwell.
Poedjiadi, A. 1994. Dasar-dasar Biokimia. Jakarta.UI-Press. 472 hlm.
Reynolds, C.S. 2006. Ecology of Phytoplankton. Cambridge University Press.
New York. Hal. 535
Sari, I.P. dan A. Manan. 2012. Pola Pertumbuhan Nannochloropsis oculata pada
Kultur Skala Laboratorium, Intermediet, dan Masal. Jurnal Ilmiah Perikanan dan Kelautan. Vol. 4 (2): 123-127.
Stickney, R. R. 2005. Aquaculture An Intoductory Text. CABI Publishing. UK by
Biddles Ltd, Kings Lynn. Hal. 220
Suminto, 2009. Penggunaan Jenis Media Kultur Teknis Terhadap Produksi dan Kandungan Nutrisi Sel Spirulina platensis. Jurnal Saintek Perikanan. Vol. 4
(2): 53-61.
Sudarmaji, S., Haryono, B., dan Suhadi, 1997. Prosedur Analisa Untuk Bahan Makanan dan Pertanian, edisi keempat. Liberty. Yogyakarta.
Supangat. A. 2007. Statistika. Prenada Media Group. Jakarta. Hal. 334-350 Petunjuk Kultur Murni dan Massal Mikroalga. UNDP. FAO.
Steel, R.G.D. dan J.H.Torrie. 1993. Prinsip dan Prosedur Statistika: Suatu Pendekatan Biometrik. PT Gramedia Pustaka Utama. Jakarta.
Taw Nyan, DR. 1990. Petunjuk Pemeliharaan Kultur Murni dan Massal Mikromikroalga. Proyek Pengembangan Budidaya Udang: United Nations
Development Programme Food dan Agriculture Organization Of The United Nations. US. 34 hal (diterjemahkan oleh: Budiono M dan Indah W).
Widianingsih, Hartati Retno, Endrawati H., Yudiati Ervia, R. Iriani Valentina. 2011. Pengaruh Pengurangan Konsentrasi Nutrien Fosfat dan Nitrat Terhadap Kandungan Lipid Total Nannochlropsis oculata. Jurnal Ilmu Kelautan. Vol. 16 (1) 24-29
Widjaja, A. 2009. Lipid Production From Microalgae As A Promising Candidate For Biodiesel Production. Makara Teknologi Vol. 13(1): 47- 51
Yanuaris, L, M., Rahayu K. dan Kismiyati. 2012. Pengaruh Fermentasi
Actinobacillus sp. Pada Kotoran Sapi Sebagai Pupuk Terhadap
Pertumbuhan Nannochloropsis sp. Jurnal Ilmiah Perikanan dan Kelautan, Fakultas Perikanan dan Kelautan. Universitas Airlangga. Surabaya. Vol. 4.