ABSTRACT
PRODUCTION, CHARACTERIZATION AND ADSORPTION TEST OF ACTIVATED CARBON FROM CANDLENUT SHELLS (Aleurites
moluccana) FOR METHYLENE BLUE
By
Siti Nur Halimah
In this study, activated carbon from candlenut shells was produced by physical activation, specified as KAF, and chemical activation, specified as KAK were analyzed using Scanning Electron Microscope (SEM) to determine the surface morphology. Methylene blue adsorbed on KAF, KAK and commercial activated carbon (KAC) was analyzed by spektrofotometer UV-Vis. Series of batch experiments were studied such as determine the optimum adsorbent dose, pH, and parameters adsorption of methylene blue on activated carbon. Optimum adsorption of methylene blue 100 mg L-1 took place at 200 mg with adsorbed 1.612 mg g-1. The interaction of methylene blue with KAF and KAC optimum at pH 8 with adsorbed by 85.80% and 90.58%, while KAK at pH 10 with adsorbed by 99.89%. The kinetic data conformed to the pseudo second order kinetic model with the reaction rate of KAF, KAK, and KAC respectively 0.099; 0.210; and 0.281 g mmol-1 min-1, isotherm adsorption conformed to the Freundlich isotherm model.
ABSTRAK
PEMBUATAN DAN KARAKTERISASI SERTA UJI ADSORPSI KARBON AKTIF TEMPURUNG KEMIRI (Aleurites moluccana) TERHADAP
METILEN BIRU
Oleh Siti Nur Halimah
Pada penelitian ini telah dilakukan pembuatan karbon aktif dari tempurung kemiri yang diaktivasi secara fisika (KAF) dan kimia (KAK). Karakterisasi material karbon aktif dilakukan dengan menggunakan Scanning Electron Microscope
(SEM)untuk mengetahui morfologi permukaannya. Metilen biru yang teradsorpsi pada KAF, KAK, dan karbon aktif komersil (KAC) dianalisis dengan spektrofotometer UV-Vis. Serangkaian eksperimen adsorpsi dilakukan dengan metode batch untuk mengetahui dosis optimum adsorben, pH optimum, dan parameter adsorpsi metilen biru pada adsorben karbon aktif. Adsorpsi metilen biru 100 mg L-1 optimum pada dosis adsorben sebesar 200 mg dengan metilen biru teradsorpsi 1,612 mg g-1. Interaksi metilen biru dengan KAF dan KAC optimum pada pH 8 dengan metilen biru teradsorpsi sebesar 85,80 dan 90,58% sedangkan KAK pada pH 10 dengan metilen biru teradsorpsi sebesar 99,89%. Data kinetika adsorpsi metilen biru pada KAF, KAK, dan KAC cenderung mengikuti model kinetika pseudo orde dua dengan laju reaksi masing-masing sebesar 0,099; 0,210; 0,281 g mmol-1menit-1sedangkan isoterm adsorpsi metilen biru pada KAF, KAK, dan KAC cenderung mengikuti model isoterm Freundlich.
PEMBUATAN DAN KARAKTERISASI SERTA UJI ADSORPSI KARBON AKTIF TEMPURUNG KEMIRI (Aleurites moluccana )TERHADAP
METILEN BIRU
(Skripsi)
Oleh
SITI NUR HALIMAH
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
ABSTRACT
PRODUCTION, CHARACTERIZATION AND ADSORPTION TEST OF ACTIVATED CARBON FROM CANDLENUT SHELLS (Aleurites
moluccana) FOR METHYLENE BLUE
By
Siti Nur Halimah
In this study, activated carbon from candlenut shells was produced by physical activation, specified as KAF, and chemical activation, specified as KAK were analyzed using Scanning Electron Microscope (SEM) to determine the surface morphology. Methylene blue adsorbed on KAF, KAK and commercial activated carbon (KAC) was analyzed by spektrofotometer UV-Vis. Series of batch experiments were studied such as determine the optimum adsorbent dose, pH, and parameters adsorption of methylene blue on activated carbon. Optimum adsorption of methylene blue 100 mg L-1 took place at 200 mg with adsorbed 1.612 mg g-1. The interaction of methylene blue with KAF and KAC optimum at pH 8 with adsorbed by 85.80% and 90.58%, while KAK at pH 10 with adsorbed by 99.89%. The kinetic data conformed to the pseudo second order kinetic model with the reaction rate of KAF, KAK, and KAC respectively 0.099; 0.210; and 0.281 g mmol-1 min-1, isotherm adsorption conformed to the Freundlich isotherm model.
ABSTRAK
PEMBUATAN DAN KARAKTERISASI SERTA UJI ADSORPSI KARBON AKTIF TEMPURUNG KEMIRI (Aleurites moluccana) TERHADAP
METILEN BIRU
Oleh Siti Nur Halimah
Pada penelitian ini telah dilakukan pembuatan karbon aktif dari tempurung kemiri yang diaktivasi secara fisika (KAF) dan kimia (KAK). Karakterisasi material karbon aktif dilakukan dengan menggunakan Scanning Electron Microscope
(SEM)untuk mengetahui morfologi permukaannya. Metilen biru yang teradsorpsi pada KAF, KAK, dan karbon aktif komersil (KAC) dianalisis dengan spektrofotometer UV-Vis. Serangkaian eksperimen adsorpsi dilakukan dengan metode batch untuk mengetahui dosis optimum adsorben, pH optimum, dan parameter adsorpsi metilen biru pada adsorben karbon aktif. Adsorpsi metilen biru 100 mg L-1 optimum pada dosis adsorben sebesar 200 mg dengan metilen biru teradsorpsi 1,612 mg g-1. Interaksi metilen biru dengan KAF dan KAC optimum pada pH 8 dengan metilen biru teradsorpsi sebesar 85,80 dan 90,58% sedangkan KAK pada pH 10 dengan metilen biru teradsorpsi sebesar 99,89%. Data kinetika adsorpsi metilen biru pada KAF, KAK, dan KAC cenderung mengikuti model kinetika pseudo orde dua dengan laju reaksi masing-masing sebesar 0,099; 0,210; 0,281 g mmol-1menit-1sedangkan isoterm adsorpsi metilen biru pada KAF, KAK, dan KAC cenderung mengikuti model isoterm Freundlich.
PEMBUATAN DAN KARAKTERISASI SERTA UJI ADSORPSI KARBON AKTIF TEMPURUNG KEMIRI (Aleurites moluccana )TERHADAP
METILEN BIRU
Oleh
SITI NUR HALIMAH
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
RIWAYAT HIDUP
Penulis dilahirkan di Lampung Timur, pada tanggal 23 Juni 1994, sebagai anak kedua dari dua bersaudara, putri dari Sujito dan Mujiati. Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SDN 4 Rantau Fajar, Raman Utara, Lampung Timur, diselesaikan pada tahun 2006. Madrasah Tsanawiyah (MTs) di MTs Nurul Huda, Seputih Raman, Lampung Tengah diselesaikan pada tahun 2009, dan Sekolah Menengah Atas (SMA) di SMAN 1 Seputih Raman, Lampung Tengah diselesaikan pada tahun 2012. Tahun 2012, penulis terdaftar sebagai Mahasiswa Jurusan Kimia FMIPA Unila melalui jalur SNMPTN-Tertulis (Seleksi Nasional Masuk Perguruan Tinggi Negeri) dan merupakan salah satu penerima beasiswa BIDIK MISI angkatan ke III di Universitas Lampung.
MOTO
Sesungguhnya jika kamu bersyukur, pasti Aku akan
menambah (nikmat) kepadamu, dan jika kamu mengingkari
(nikmat-Ku), maka sesungguhnya azab-Ku sangat pedih
(Q.S Ibrahim: 7)
Barang siapa menginginkan kebahagiaan di dunia dan di
akhirat maka haruslah memiliki banyak ilmu
(HR. Ibnu Asakir)
Barang siapa keluar untuk mencari ilmu maka dia berada di
jalan Allah
(HR. Turmudzi)
Jangan mengeluhkan hal-hal buruk yang datang dalam
hidupmu. Tuhan tidak pernah memberinya, kamulah yang
membiarkannya datang
(R.A. Kartini)
Kerja Keras ! Yang bekerja keras saja belum tentu sukses apalagi
yang malas
Bismillahirrohmannirrahiim
Dengan mengucap Alhamdulillahirabbil alamin kepada Allah SWT
yang Maha Segalanya.
Kupersembahkan karya sederhana ini kepada :
Kedua Orang tuaku, Bapak Sujito dan Ibu Mujiati (almh) yang
telah memberikan kasih sayang, cinta, pengorbanan, serta doa
indah untukku. Terima Kasih karena kalianlah inspirasi dan
motivatorku selama ini.
Mbak Yati, Kang To tersayang beserta keluarga dan Dek Latif
beserta keluarga.
Keluarga besar Mbah Toiman dan Mbah Yasir yang telah
mendukungku dan mendoakanku.
Ibu Prof. Dr. Buhani, M.Si., Bapak Prof. Suharso, Ph.D., Bapak
Prof. Dr. Sutopo Hadi, S.Si., M.Sc., dan Ibu Dr. Noviany, S.Si.,
M.Si., Ph.D. atas bimbingannya selama saya mengerjakan penelitian
dan tugas akhir, serta Bapak dan Ibu Dosen Jurusan Kimia FMIPA
Unila yang telah memberikan ilmu pengetahuan selama menempuh
pendidikan di kampus.
Guru-guru yang selalu membagi ilmunya untukku.
Seluruh sahabat dan teman-teman yang telah mengajarkan arti
kebersamaan, kekeluargaan, dan kebahagiaan.
SANWACANA
Assalamu’alaikum Wr. Wb.
Alhamdulillah puji dan syukur Penulis ucapkan atas kehadirat Allah SWT, karena
atas segala rahmat dan karunia-Nya skripsi ini dapat diselesaikan.
Skripsi dengan judul“PEMBUATAN DAN KARAKTERISASI SERTA UJI ADSORPSI KARBON AKTIF TEMPURUNG KEMIRI (Aleurites
moluccana )TERHADAP METILEN BIRU”adalah salah satu syarat untuk memperoleh gelar Sarjana Sains pada Jurusan Kimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam, Universitas Lampung.
Dalam pelaksanaan dan penulisan skripsi ini tidak lepas dari kesulitan dan
rintangan, namun itu semua dapat penulis lalui berkat rahmat dan ridha Allah SWT serta bantuan dan dorongan semangat dari orang-orang yang hadir di
kehidupan penulis. Dalam kesempatan ini, penulis menyampaikan terimakasih setulus-tulusnya kepada :
1. Ibu Prof. Dr.Buhani, M.Si., selaku pembimbing I penelitian dan Kepala
semangat, perhatian, serta kesabaran membimbing penulis dalam
menyelesaikan skripsi ini.
2. Bapak Prof. Suharso, Ph.D., selaku pembimbing II penelitian yang telah
memberikan ilmu, bimbingan, kritik, saran, dan arahan kepada penulis sehingga skripsi ini terselesaikan dengan baik.
3. Bapak Prof. Dr. Sutopo Hadi, S.Si., M.Sc., selaku penguji penelitian dan
Wakil Dekan Bidang Akademik dan Kerjasama FMIPA Unila yang telah memberikan ilmu, perhatian, motivasi, nasehat, kritik, serta saran kepada
penulis sehingga skripsi ini terselesaikan dengan baik.
4. Ibu Noviany, S.Si., M.Si., Ph.D. selaku pembimbing akademik atas bimbingan, nasehat, dan motivasi yang telah diberikan kepada penulis.
5. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T., selaku ketua Jurusan Kimia FMIPA Unila.
6. Bapak Prof. Warsito, S.Si., D.E.A., Ph.D., selaku Dekan Fakultas Matematika
dan Ilmu Pengetahuan Alam Universitas Lampung.
7. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Unila yang telah mendidik dan
memberikan ilmu pengetahuan yang sangat bermanfaat kepada penulis selama kuliah.
8. Mba Liza Apriliya S, S.Si., selaku Laboran Laboratorium Kimia
Anorganik/Fisik yang telah banyak membantu penulis untuk mendapatkan zat dan bahan kimia, serta terimakasih juga kepada Ibu Rahmawaty dan seluruh
9. Kedua orangtuaku, Bapak Sujito dan Ibu Mujiati (almh) atas segala cinta,
kasih sayang, pengorbanan, kesabaran, keikhlasan, dan do’a yang tulus.
10. Kakakku tercinta Kang Darmanto dan Mbak Siti Nur Hayati. Mamas Ipar
Supriyadi dan Mbak Ipar Sulistiah. Ponakanku tercinta Bima, Alda, Arvin, Haura, dan Zaki. Terimakasih banyak atas do’a dan segala dukungannya selama ini.
11. Mak Ikak dan Mak Uti beserta keluarga, terimakasih banyak atas doa dan dukungannya selama ini.
12. Sepupuku tersayang Latif Fatunna’imah sekaligus teman sekamarku, terimakasihbanyak do’a, motivasi, semangat, dan pinjaman notebooknya. 13. Keluarga besar Mbah Toiman dan Mbah Yasir, terimakasih atas do’a,
nasehat, dan motivasi yang telah diberikan.
14. Guru-guruku yang telah memberikan ilmu, semangat, dan motivasinya. Semoga Allah membalas semua kebaikan kalian semua.
15. Buhani’sResearch Group(Indah, Indry, dan Rifki) atas kerjasama, bantuan, motivasi, kritik, dan saran dalam menyelesaikan penelitian dan skripsi ini.
Mbak Rina, Mbak Yunia, Mbak Ditam, Kak Rio, Mbak Hersinta, dan Bu Rahmawaty.Anorganik Research Group: Siti Aisah, Sukamto, S.Si., Murni Fitria, S.Si., Jean Pitaloka, S.Si., Adi Setiawan, S.Si., Tiand Reno, Nila
Amalin Nabilah, dan Khoirul Anwar, terimakasih atas bantuan, saran, dan semangat untuk menyelesaikan penelitian ini.
Setianingrum, Deborah Jovita, Derry Vardella, Dewi Aniatul Fatimah, S.Si.,
Diani Iska Miranti, Dwi Anggraini, S.Si., Edi suryadi, S.Si., Eka
Hurwaningsih, Elsa Zulha, Erlita Aisyah, Febita Glyssenda, Feby Rinaldo
Pratama Kusuma, Fenti Visiamah, S.Si., Ferdinand Haryanto Simangunsong, Fifi Adriyanthi, Handri Sanjaya, Hiqi Alim, Indah Wahyu Purnamasari, Indry Yani Saney, Intan Mailani, S.Si., Ismi Khomsiah, S.Si., Jean Pitaloka, S.Si.,
Jenny Jessica Sidabalok, Khoirul Anwar, Maria Ulfa, Meta Fosfi Berliyana, Muhammad Rizal Robbani, Murni Fitria, S.Si., Nila Amalin Nabilah, Putri
Ramadhona, Radius Uly Artha, Riandra Pratama Usman, S.Si., Rifki Husnul Khuluk, Rizal Rio Saputra, Rizki Putriyana, Ruliana Juni Anita, Ruwaidah Muliana, Siti Aisah, Sofian Sumilat Rizki, S.Si., Sukamto, S.Si., Susy Isnaini
Hasanah, S.Si., Suwarda Dua Imatu Dela, S.Si., Syathira Assegaf, Tazkiya Nurul, S.Si., Tiand Reno, Tiara Dewi Astuti, Tiurma Debora Simatupang, S.Si., Tri Marital, Ulfatun Nurun, Wiwin Esty Sarwita, Yepi Triapriani, S.Si.,
Yunsi’U Nasy’Ah,S.Si., dan Zubaidi. Terimakasih persahabatan, pertemanan, dan kekeluargaannya selama ini, semoga selamanya masih
terjaga dengan baik.
17. Sahabatku yang selalu memberi keceriaan Cin Kamto, Aisah Al-fadilah Mukaromah Assafur, Fenti, Ajeng, Ismi, Dudung, Ulfahh, Erlita, Maul, Meta,
dan sahabat Tiliseae Mami Agung, Ana, Fifi, Eka, Aim, dan Mami Rio.
Rommate-ku, Indry (Isuk Anggi) dan Ayuuningruum yang bersedia berbagi
kamarnya selama beberapa bulan terakhir.
19. Sahabat tersayang Beb Fitri, Beb Nurma, Beb Tian, Azis, dan Said.
Terimakasih atas keceriaan, nasehat, semangat, dan kasih sayangnya selama ini.
20. Keluarga Asrama Angansaka Mbak Esti, Mami Agung, Dona, Mbak Winda, Widy, Mbak Eka, Okta, Mbak Wiwin (almh), Uli, Dewi, Kak Ijal, Mas Dani, Mbak Tiwi, Ayub, Seto, Candro, Song, Mbak Tari, Nitya, Mbak Okta, dan
yang lain yang tidak bisa penulis sebut satu persatu, terimakasih keceriaan dan kekeluargaannya selama ini.
21. Seorang Hamba Allah yang akan menjadi imam di keluargaku kelak. 22. Keluarga Bapak Hisam dan teman-teman KKN Toto Projo (Singgih Widy
Prasetyo, Abi Putra Nababan, Rika Maida Putri, dan Aliza Puspita (Aming))
dan Taman Negeri (Adi, Amel, Ageng, Jorgi, Fira, Bella, dan Putri) atas kebersamaan dan kerjasamanya selama disana.
23. Teman-teman SMA, SMP, SD, dan teman sejak kecil hingga sekarang,
terimakasih atas segalanya.
24. Almamater tercinta Universitas Lampung.
25. Semua pihak yang tidak dapat penulis sebutkan satu persatu yang secara tulus dan ikhlas memberikan bantuan moril dan materil kepada penulis.
Penulis berharap semoga skripsi yang sederhana ini dapat berguna dan bermanfaat
bagi kita semua. Aamiin.
Bandar Lampung, September 2016 Penulis
DAFTAR ISI
Halaman
DAFTAR ISI... i
DAFTAR TABEL... iii
DAFTAR GAMBAR... v
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Penelitian... 4
C. Manfaat Penelitian... 4
II.TINJAUAN PUSTAKA A. Karbon Aktif ... 5
1. Klasifikasi Karbon Aktif ... 7
2. Proses Pembuatan Karbon Aktif ... 8
a. Pemilihan Bahan Dasar ... 8
b. Karbonisasi... 9
c. Aktivasi... 10
3. Sifat Adsorpsi Karbon Aktif ... 12
a. Sifat Adsorben ... 12
b. Ukuran Partikel ... 13
c. Sifat Adsorbat ... 13
d. Temperatur ... 13
e. Derajat Keasaman (pH) ... 13
f. Waktu Kontak ... 14
B. Kemiri... 14
C. Metilen Biru ... 17
D. Adsorpsi ... 19
1. Kinetika Adsorpsi... 20
2. Kapasitas Adsorpsi ... 23
a. Model Isoterm Adsorpsi Langmuir ... 23
b. Model Isoterm Adsorpsi Freundlich ... 24
E. Karakterisasi ... 27
ii
2.Scanning Electron Microscope(SEM) ... 30
III.METODE PENELITIAN A. Waktu dan Tempat Penelitian ... 32
B. Alat dan Bahan Penelitian ... 32
C. Prosedur Penelitian... 33
1. Penyiapan Karbon Aktif... 33
a. Karbon Aktif Komersil... 33
b. Karbon Aktif Tempurung Kemiri ... 33
2. Karakterisasi Material ... 34
3. Pembuatan Larutan Induk Metilen Biru 1000 mg L-1... 34
4. Uji Adsorpsi ... 34
a. Penentuan Dosis Optimum Adsorben ... 34
b. Penentuan pH Optimum ... 34
c. Waktu Kontak... 35
d. Isoterm Adsorpsi ... 35
IV.HASIL DAN PEMBAHASAN A. Pembuatan dan Karakterisasi ... 36
1. Pembuatan Karbon Aktif dengan Aktivasi Fisika dan Kimia ... 36
2. Karakterisasi denganScanning Electron Microscope(SEM)... 37
B. Uji Adsorpsi ... 38
1. Penentuan Dosis Optimum Adsorben ... 39
2. Penentuan pH Optimum ... 40
3. Laju Adsorpsi ... 42
4. Isoterm Adsorpsi ... 46
V.KESIMPULAN DAN SARAN A. Kesimpulan ... 52
B. Saran ... 53 DAFTAR PUSTAKA
iii
DAFTAR TABEL
Tabel Halaman
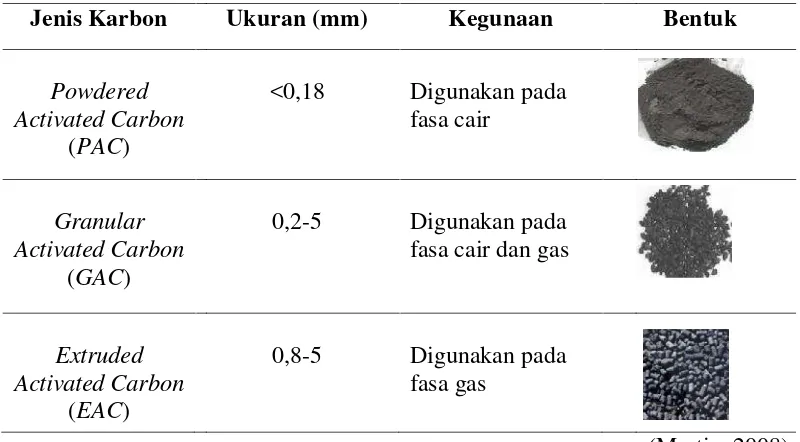
1.Klasifikasi karbon aktif berdasarkan bentuknya ... 7
2.Nama dan struktur kimia kromofor... 18
3.Parameter kinetika adsorpsi metilen biru oleh KAF, KAK, dan KAC... 45
4.Parameterisoterm adsorpsi Langmuir dan Freundlich ... 50
5. Penentuan kurva standar metilen biru ... 62
6.Adsorpsi metilen biru pada adsorben dengan variasi dosis adsorben... 63
7.Adsorpsi metilen biru pada adsorben dengan variasi pH... 63
8.Adsorpsi metilen biru pada adsorben dengan variasi waktu adsorpsi... 63
9.Adsorpsi metilen biru pada adsorben dengan variasi konsentrasi metilen biru... 64
10.Data perhitungan hasil kinetika pseudo orde satu pada KAFterhadap metilen biru... 64
11.Data perhitungan hasil kinetika pseudo orde satu pada KAKterhadap metilen biru ... 66
iv
metilen biru ... 68
14.Data perhitungan hasil kinetika pseudo orde dua pada KAKterhadap metilen biru ... 70
15.Data perhitungan hasil kinetika pseudo orde dua pada KAC terhadap metilen biru... 71 16. Data perhitungan menggunakan model persamaan Langmuir pada
adsorpsi metilen biru oleh KAF ... 72 17. Data perhitungan menggunakan model persamaan Langmuir pada
adsorpsi metilen biru oleh KAK ... 74 18. Data perhitungan menggunakan model persamaan Langmuir pada
adsorpsi metilen biru oleh KAC ... 75
19. Data perhitungan menggunakan model persamaan Freundlich pada
adsorpsi metilen biru oleh KAF ... 76 20. Data perhitungan menggunakan model persamaan Freundlich pada
adsorpsi metilen biru oleh KAK ... 78 21. Data perhitungan menggunakan model persamaan Freundlich pada
v
DAFTAR GAMBAR
Gambar Halaman
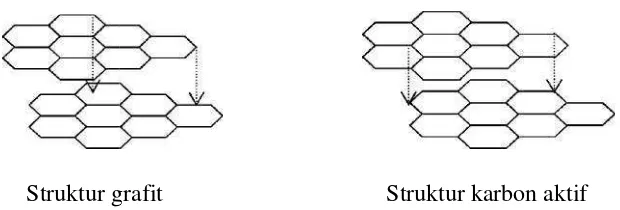
1. Perbedaan struktur grafit dan karbon aktif... 6
2. Skema umum pembuatan karbon aktif... 8
3. Tempurung kemiri... 17
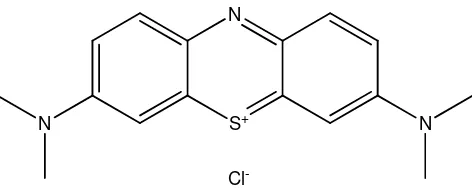
4. Struktur metilen biru ... 18
5. Model isoterm adsorpsi Langmuir ... 24
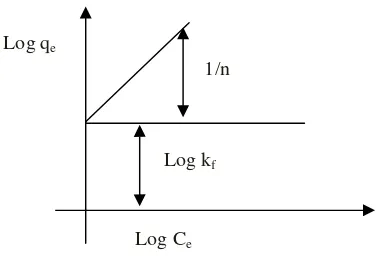
6. Model isoterm adsorpsi Freundlich... 26
7. Skema alat spektrofotometer UV-Vis ... 28
8. Hasil preparasi sampel (a) KAF, (b) KAK, dan (c) KAC ... 37
9.Hasil SEM dengan perbesaran 4.000x pada permukaan sampel (a) KAF, (b) KAK, dan (c) KAC... 38
10. Dosis optimum adsorben pada proses adsorpsi metilen biru ... 39
11. pH optimum proses adsorpsi metilen biru pada rentang pH 2-12... 40
12. Waktu optimum proses adsorpsi metilen biru oleh adsorben ... 43
13. Analisis kinetika pseudo orde satu pada KAF, KAK, dan KAC terhadap metilen biru ... 44
vi
15. Hubungan antara jumlah metilen biru yang teradsorpsi dengan
konsentrasi awal metilen biru dalam larutan yang digunakan pada
proses adsorpsi oleh adsorben... 47
16. Kurva isoterm adsorpsi menurut model Langmuir pada metilen biru oleh KAF, KAK, dan KAC... 48 17. Kurva isoterm adsorpsi menurut model Freundlich pada metilen biru
oleh KAF, KAK, dan KAC... 49 18. Kurva hasil pengukuran panjang gelombang maksimum metilen biru... 62
19. Kurva standar metilen biru... 62 20. Pola kinetika pseudo orde satu pada KAF terhadap metilen biru ... 65 21. Pola kinetika pseudo orde satu pada KAK terhadap metilen biru ... 66
22. Pola kinetika pseudo orde satu pada KAC terhadap metilen biru... 67 23. Pola kinetika pseudo orde dua pada KAF terhadap metilen biru... 69 24. Pola kinetika pseudo orde dua pada KAK terhadap metilen biru ... 70
25. Pola kinetika pseudo orde dua pada KAC terhadap metilen biru ... 71 26. Pola isoterm adsorpsi menurut model Langmuir pada metilen biru oleh
KAF... 73 27. Pola isoterm adsorpsi menurut model Langmuir pada metilen biru oleh
KAK ... 74
28. Pola isoterm adsorpsi menurut model Langmuir pada metilen biru oleh KAC ... 75
vii
30. Pola isoterm adsorpsi menurut model Freundlich pada metilen biru oleh
KAK ... 78 31. Pola isoterm adsorpsi menurut model Freundlich pada metilen biru oleh
1
I. PENDAHULUAN
A. Latar Belakang
Pencemaran lingkungan mengakibatkan berubahnya tatanan lingkungan karena
kegiatan manusia atau proses alam, sehingga kualitas lingkungan mengalami penurunan sampai tingkat tertentu yang menyebabkan lingkungan tidak dapat berfungsi sebagaimana mestinya. Sebagian besar pencemaran lingkungan
disebabkan oleh limbah industri. Peningkatan jumlah industri akan diikuti oleh pertambahan jumlah limbah, baik limbah padat, cair maupun gas (Nriagu,1979).
Saat ini pencemaran air limbah oleh pewarna organik dari industri seperti tekstil,
pembuatan kertas, plastik, kosmetik, dan percetakan telah menarik banyak perhatian (Gupta and Suhas,2009; Sharmaet al., 2011; Wanget al., 2014).
Industri tekstil menempati urutan pertama dalam penggunaan zat warna untuk pewarnaan serat (Kanawade dan Gaikwad, 2011). Pembuangan zat warna ke lingkungan menimbulkan masalah besar untuk berbagai bentuk kehidupan. Salah
satu zat warna yang paling umum adalah metilen biru. Metilen biru ini banyak digunakan untuk pencelupan warna pada kapas, kayu, dan sutra (Hameedet al.,
2
Menurut Kumaret al. (2011), metilen biru dapat menyebabkan beberapa efek
yang berbahaya seperti peningkatan denyut jantung, muntah,shock, pembentukan badan Heinz (HzB), sianosis, ikterus, quadriplegia, serta nekrosis pada manusia.
Ambang batas metilen biru dalam limbah cair industri tekstil sesuai dengan keputusan Kementerian Lingkungan Hidup No 51 Tahun 1995 adalah 10 mg L-1. Oleh karena itu, penghilangan zat warna tersebut dari limbah sangat perlu
dilakukan. Beberapa metode fisika, kimia, dan biologi, termasuk adsorpsi, biosorpsi, koagulasi/ flokulasi, oksidasi tinggi, ozonisasi, filtrasi membran, dan
ekstraksi cair-cair telah banyak digunakan untuk menghilangkan zat warna dalam air limbah. Keuntungan dan kerugian dari setiap teknik penghilangan zat warna telah diulas secara ekstensif (Hameed, 2009; Sallehet al., 2011). Beberapa
metode tersebut memiliki kelemahan seperti penghilangan yang tidak sempurna, penggunaan reagen yang banyak dan menimbulkan endapan beracun atau produk limbah lain, biaya yang tinggi, upaya intensif, dan lain-lain (Chowdhury and
Saha, 2010; Sahaet al., 2010; Chowdhuryet al., 2011).
Salah satu metode yang efektif untuk penghilangan zat warna dari limbah-limbah yaitu proses adsorpsi (Deans and Dixon, 1992; Nigamet al., 2000). Adsorpsi
membutuhkan biaya yang sedikit, mudah dilakukan, sensitif terhadap zat-zat beracun, serta dapat menghilangkan zat warna walaupun dalam larutan encer.
3
Karbon aktif bisa dibuat dari tempurung kelapa (Suhartana, 2006; Budiono dkk.,
2009; Verlina dkk., 2015), kulit biji kopi (Purnomo, 2010), tongkol jagung (Suhendra dan Gunawan, 2010), ampas penggilingan tebu (Suhendarwati dkk.,
2013), sekam padi (Rahman dkk., 2012; Dargoet al., 2014), serbuk gergaji (Pari dkk., 2000; Prasetya, 2012), kayu keras (Sudrajat, 1993), batubara (Saragih, 2008), tempurung kemiri (Suhadak, 2005; Hendra dan Darmawan, 2007; Prabarini
dan Okayadnya, 2014), dan lain-lain. Beberapa studi telah dilakukan untuk mencari kemungkinan pembuatan karbon aktif yang harganya murah (Hala dkk.,
2010). Karbon aktif yang sudah banyak beredar dalam bentuk komersil adalah karbon aktif yang berbahan dasar tempurung kelapa. Namun, pada penelitian ini dilakukan pembuatan karbon aktif dari tempurung kemiri, karena di beberapa
daerah tempurung kemiri hanya dibuang dan baru sedikit yang dimanfaatkan sebagai bahan baku pembuatan karbon aktif.
Berdasarkan penelitian Suhadak (2005), diketahui bahwa prosentase masa buah
kemiri menjadi tempurungnya sebesar 64,57% dan tergolong sangat tinggi bila dibandingkan dengan tempurung kelapa dan tempurung kelapa sawit yang tidak lebih dari 30%. Hal ini tentunya menunjukkan bahwa tempurung kemiri memang
sangat potensial untuk dijadikan bahan baku pembuatan karbon aktif. Arang dari tempurung kemiri perlu diaktivasi terlebih dahulu sebelum diaplikasikan sebagai
adsorben. Melalui proses aktivasi, arang akan memiliki daya adsorpsi yang tinggi karena volume dan diameter porinya bertambah (Budiono dkk., 2009). Terdapat dua metode aktivasi yang dapat digunakan dalam pembuatan karbon aktif,
diantaranya aktivasi fisika dan kimia. Aktivasi fisika dilakukan dengan
4
kimia dilakukan dengan menggunakan bahan-bahan kimia seperti H3PO4
(Haimour dan Emeish, 2006), H2SO4(Martinet al., 2003; Prabarini dan
Okayadnya, 2014), NaOH (Rahim dan Octania, 2010), atau ZnCl2(Tayet al.,
2001). Oleh karena itu, pada penelitian ini dilakukan studi tentang pengaruh aktivasi karbon aktif tempurung kemiri secara fisika dan kimia menggunakan ZnCl2terhadap daya adsorpsinya pada metilen biru. Selanjutnya dibandingkan
kemampuan adsorpsinya dengan karbon aktif komersil.
B. Tujuan Penelitian
Tujuan penelitian ini adalah sebagai berikut:
1. Mempelajari cara pembuatan dan karakterisasi material karbon aktif dari tempurung kemiri.
2. Mempelajari kinetika danisoterm adsorpsi metilen biru oleh karbon aktif dari tempurung kemiri dan karbon aktif komersil.
3. Membandingkan efektifitas adsorpsi metilen biru oleh karbon aktif tempurung kemiri dengan karbon aktif komersil.
C. Manfaat Penelitian
5
II. TINJAUAN PUSTAKA
A. Karbon Aktif
Karbon aktif merupakan senyawa amorf yang dihasilkan dari bahan-bahan yang mengandung karbon atau arang yang diperlakukan secara khusus untuk
mendapatkan daya adsorpsi yang tinggi. Karbon aktif dapat mengadsorpsi gas
dan senyawa-senyawa kimia tertentu atau sifat adsorpsinya selektif, tergantung pada besar atau volume pori-pori dan luas permukaan (Hendra dan Darmawan,
2007).
Menurut Sembiring dan Sinaga (2003), arang atau karbon merupakan residu hitam berbentuk padatan berpori yang mengandung 85-95% karbon yang nantinya akan dihasilkan dengan menghilangkan kandungan air dan komponen volatil dari
bahan-bahan yang mengandung karbon melalui pemanasan pada suhu tinggi. Sebagian dari pori-porinya masih tertutup hidrokarbon, tar, dan senyawa organik lain.
Komponennya terdiri dari karbon terikat (fixed carbon), abu, air, nitrogen, dan sulfur (Djamitko dan Widjaja, 1985).
Berdasarkan Fauziah (2009) penilaian kualitas karbon dapat dilakukan
berdasarkan:
2. Sifat fisik, misalny
kalor, dan berat jen 3. Analisa karbon, me
karbon sisa, dan za 4. Suhu maksimum k
Dalam proses pembuat
setengah jadinya, seda sedemikian rupa sehing umumnya berbentuk la
karbon biasa terletak p (microcrystalin) sepert
Struktur g
Gambar 1.Perbed
Menurut Purnomo (20 amorf yang memiliki p serap tinggi. Menurut
mendapat perlakuan de sekali untuk menyerap
nya berupa warna, bunyi, nyala, kekerasan, ker
jenis.
mencakup beberapa analisa seperti analisa kadar
zat mudah menguap.
karbonisasi dan kemurnian karbon.
uatan karbon aktif, arang atau karbon merupakan
dangkan karbon aktif merupakan karbon yang dip ingga memiliki daya serap yang tinggi terhadap b larutan atau uap. Perbedaan struktur karbon akti
pada persilangan rantai karbon dan ketebalan lap erti terlihat pada Gambar 1.
grafit Struktur karbon a
edaan struktur grafit dan karbon aktif (Suhartan
2010), karbon aktif adalah suatu bahan yang men i permukaan dalam (internal surface) sehingga m ut Austin (1996), karbon aktif adalah karbon amo
dengan uap dan panas sampai mempunyai afinit ap berbagai bahan. Karbon aktif dapat dihasilka
6
erapuhan, nilai
dar air, kadar abu,
an produk
diproses
bahan organik yang m
perlakuan khusus aga
Luas permukaan aran
dengan struktur pori i gas dan dapat mengur luas permukaan pori-por
aktif sangat besar yait Sinaga, 2003).
1. Klasifikasi Karbon
Tabel 1.Klasifikasi ka Jenis Karbon
mengandung karbon atau dari arang yang telah
gar permukaannya menjadi lebih luas.
ang aktif berkisar 3000-3500 mg g-1dan ini ber
i internal yang menyebabkan arang aktif dapat m urangi zat-zat dari liquida (Kirk and Othmer, 1992 ri-pori maka semakin tinggi daya serapnya. Da
aitu 25-100% terhadap berat arang aktif (Sembi
bon Aktif
si karbon aktif berdasarkan bentuknya
Ukuran (mm) Kegunaan
<0,18 Digunakan pada fasa cair
0,2-5 Digunakan pada fasa cair dan gas
8
2. Proses Pembuatan Karbon Aktif
Karbonisasi Aktivasi Fisika
CO2, uap air, dll
a. Proses Aktivasi Kimia b. Perendaman/Pemanasan/
Pencucian
Gambar 2.Skema umum pembuatan karbon aktif (Marsh and Francisco, 2006).
Gambar 2 menjelaskan proses pembuatan karbon aktif secara umum. Ada 2
metode yang digunakan untuk mengaktivasi karbon yaitu metode aktivasi fisika (physical/ thermal activation) dan aktivasi kimia (chemical activation). Pada
dasarnya, terdapat 3 proses pembuatan karbon aktif, diantaranya:
a. Pemilihan Bahan Dasar
Karbon aktif bisa dibuat dari berbagai macam bahan, selama bahan tersebut mengandung unsur karbon seperti batubara, tempurung kelapa, kayu, sekam padi, tulang binatang, kulit biji kopi, dan lain-lain. Bila bahan-bahan tersebut
dibandingkan, tempurung kelapa merupakan bahan terbaik yang dapat dibuat menjadi karbon aktif karena karbon aktif yang terbuat dari tempurung kelapa
memiliki mikropori yang banyak, kadar abu yang rendah, kelarutan dalam air yang tinggi, dan reaktivitas yang tinggi (Subadra dkk., 2005).
Arang Karbon
Aktif Material
Arang
Karbon
9
b. Karbonisasi
Karbonisasi adalah suatu proses dimana unsur-unsur oksigen dan hidrogen dihilangkan dari karbon dan akan menghasilkan rangka karbon yang memiliki struktur tertentu. Hassler (1951) berpendapat bahwa untuk menghasilkan arang
yang sesuai untuk dijadikan karbon aktif, karbonisasi dilakukan pada temperatur lebih dari 600°C akan tetapi hal itu juga tergantung pada bahan dasar dan metode
yang digunakan pada aktivasi. Saat karbonisasi terjadi beberapa tahap yang meliputi penghilangan air atau dehidrasi, perubahan bahan organik menjadi unsur karbon dan dekomposisi tar sehingga pori-pori karbon menjadi lebih besar.
Tingginya kadar air yang terdapat pada arang aktif sebelum dilakukan proses
aktivasi disebabkan oleh sifat higroskopis arang aktif dan juga adanya molekul uap air yang terperangkap di dalam kisi-kisi heksagonal arang aktif sedangkan rendahnya kadar air yang terdapat pada arang aktif menunjukkan bahwa
kandungan air bebas dan air terikat yang terdapat dalam arang aktif telah menguap selama proses karbonisasi (Verlina dkk., 2015). Hampir 80% unsur karbon
diperoleh pada suhu 400-600°C (Serranoet al., 1996).
Menurut Sudrajat (1993), proses karbonisasi memiliki 4 tahapan tertentu, yaitu: 1. Pada suhu 100-270 °C penguapan air akan berlangsung. Saat suhu mencapai
270 °C mulai terjadi penguapan selulosa. Destilat yang dihasilkan akan mengandung asam organik dan sedikit metanol.
2. Pada suhu 270-310 °C reaksi eksotermik berlangsung. Pada suhu ini selulosa
10
didih rendah seperti asam cuka dan metanol, sedangkan gas kayu terdiri atas
CO dan CO2.
3. Pada suhu 310-500 °C lignin mulai mengalami penguraian sehingga akan
dihasilkan lebih banyak tar. Larutan pirolignat akan menurun dan produksi gas CO2pun ikut menurun. Namun hal berbeda terjadi pada gas CO, CH4, dan H2
yang jumlahnya meningkat.
4. Pada suhu 500-1000 °C merupakan tahap terjadinya pemurnian arang atau peningkatan kadar karbon.
c. Aktivasi
Aktivasi adalah bagian dalam proses pembuatan karbon aktif yang bertujuan
untuk menambah atau mengembangkan volume pori dan memperbesar diameter pori yang telah terbentuk pada proses karbonisasi serta untuk membuat beberapa pori baru. Melalui proses aktivasi arang akan memiliki daya adsorpsi yang
semakin meningkat, karena arang hasil karbonasi biasanya masih mengandung zat yang masih menutupi pori-pori permukaan arang (Budiono dkk., 2009).
Adanya interaksi antara zat pengaktivasi dengan struktur atom-atom karbon hasil
karbonisasi adalah mekanisme dari proses aktivasi. Selama aktivasi, karbon dibakar pada suasana oksidasi yang akan menambah jumlah atau volume pori dan
luas permukaan produk melalui proses eliminasi atau penghilangan volatil produk pirolisis. Aktivator dapat meningkatkan keaktifan adsorben melalui mekanisme sebagai berikut:
1. Aktivator menembus celah atau pori-pori diantara pelat-pelat kristalit karbon
11
atau pori-pori tersebut, sehingga terjadi pengikisan pada permukaan kristalit
karbon.
2. Menurut teori interkalasi, struktur dari suatu komposisi senyawa akan
mengalami modifikasi jika disisipkan ion atau atom lain ke dalam struktur tersebut. Pada aktivasi, maka ion atau atom yang disisipkan adalah aktivator. 3. Aktivasi dapat berupa aktivasi fisik dimana digunakan gas-gas inert seperti
uap air (steam), CO2dan N2sedangkan pada aktivasi kimia digunakan
aktivator yang berperan penting untuk meningkatkan luas permukaan
adsorben dengan cara mengusir senyawa nonkarbon dari pori-pori (Serranoet al., 1996).
Menurut Elly (2008), terdapat dua metode aktivasi yang dapat digunakan dalam
pembuatan karbon aktif, yakni:
1. Aktivasi kimia yakni pengaktifan arang atau karbon dengan menggunakan bahan-bahan kimia sebagaiactivating agentyang dilakukan dengan cara
merendam arang dalam larutan kimia, seperti H3PO4(Haimour dan Emeish,
2006), H2SO4(Martinet al., 2003; Prabarini dan Okayadnya, 2014), NaOH
(Rahim dan Octania, 2010), atau ZnCl2(Tayet al., 2001) dalam suasana inert.
2. Aktivasi fisika yakni pengaktifan arang atau karbon dengan menggunakan panas, uap, dan CO2dengan suhu tinggi dalam sistem tertutup tanpa udara
12
Berdasarkan dua jenis proses aktivasi, Suhendra dan Gunawan (2010)
mengemukakan bahwa aktivasi kimia memiliki berbagai keunggulan tertentu dibandingkan dengan aktivasi fisika, diantaranya adalah:
1. Dalam proses aktivasi kimia, zat kimia pengaktif sudah terdapat dalam tahap penyiapannya sehingga proses karbonisasi dan proses aktivasi karbon
terakumulasi dalam satu langkah yang umumnya disebutone-step activationatau
metode aktivasi satu langkah.
2. Dalam proses aktivasi kimia, suhu yang digunakan umumnya lebih rendah
dibanding pada aktivasi fisika.
3. Efekdehydrating agentpada aktivasi kimia dapat memperbaiki pengembangan pori di dalam struktur karbon.
4. Produk yang dihasilkan dalam aktivasi kimia lebih banyak dibandingkan dengan aktivasi fisika.
3. Sifat Adsorpsi Karbon Aktif
Sifat adsorpsi karbon aktif yang paling utama adalah daya serap. Ada beberapa
faktor yang mempengaruhi daya serap adsorpsi, yaitu:
a. Sifat Adsorben
Semakin banyak pembentukan luas permukaan internal yang berukuran mikro atau meso menyebabkan pori-pori karbon aktif semakin bertambah, akibatnya
13
b. Ukuran Partikel
Semakin kecil ukuran partikel akan menyebabkan semakin cepatnya proses adsorpsi. Untuk meningkatkan kecepatan adsorpsi digunakan karbon aktif yang telah dihaluskan (Surdia, 1983).
c. Sifat Adsorbat
Adsorpsi akan semakin besar jika molekul adsorbat lebih kecil dari pori adsorben. Karbon aktif mampu menyerap molekul lain yang mempunyai ukuran lebih kecil atau sama dengan diameter pori adsorben. Proses adsorpsi oleh karbon aktif
terjadi karena terjebaknya molekul adsorbat dalam rongga karbon aktif.
d. Temperatur
Dalam penggunaan karbon aktif dianjurkan untuk menyelidiki temperatur pada saat berlangsungnya proses adsorpsi karena tidak ada ketentuan umum mengenai
temperatur yang digunakan dalam adsorpsi. Faktor yang mempengaruhi temperatur proses adsorpsi adalah viskositas dan stabilitas termal senyawa
serapan. Jika pemanasan tidak mempengaruhi sifat-sifat senyawa serapan, seperti
terjadi perubahan warna maupun dekomposisi, maka perlakuan dilakukan pada titik didihnya. Untuk senyawa volatil, adsorpsi dilakukan pada temperatur kamar
atau bila memungkinkan pada temperatur yang lebih kecil.
e. Derajat Keasaman (pH)
Nilai pH dapat mempengaruhi proses adsorpsi zat warna metilen biru pada
14
adsorpsi terhadap metilen biru naik 80% hingga 100 % (Zendehdelet al., 2011).
Hal ini dapat dilakukan dengan penambahan larutan basa Arrhenius karena ion OH-akan membuat permukaan adsorben bermuatan negatif, sehingga metilen biru
yang bermuatan positif akan terikat pada adsorben.
f. Waktu Kontak
Apabila karbon aktif ditambahkan dalam suatu cairan, dibutuhkan waktu untuk mencapai kesetimbangan. Waktu yang dibutuhkan berbanding terbalik dengan
jumlah arang aktif yang digunakan. Untuk larutan yang memiliki viskositas tinggi, dibutuhkan waktu kontak yang lebih lama (Sembiring dan Sinaga, 2003).
B. Kemiri
Kemiri (Aleurites moluccana) merupakan salah satu tanaman tahunan yang termasuk dalam familiEuphorbiaceae(jarak-jarakan). Umur produktif tanaman
mencapai 25-40 tahun. Ketinggian tanaman dapat mencapai 40 meter. Daunnya selalu hijau sepanjang tahun dan menghasilkan buah kemiri yang merupakan bagian tanaman yang bernilai ekonomis. Daging buahnya kaku dan mengandung
1-2 biji yang diselimuti oleh kulit biji yang keras. Secara sistematis, tanaman ini diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
15
Familia : Euphorbiaceae
Genus : Aleurites
Spesies :Aleurites moluccana(Sunanto, 1994).
Tanaman kemiri tersebarl uas di daerah tropis dan subtropis. Tanaman kemiri mempunyai banyak manfaat bagi kehidupan manusia karena hampir semua
bagian tanaman ini dapat digunakan. Kayu kemiri yang ringan, berserat halus dan berwarna putih digunakan untuk kayu bakar dan berpotensi sebagai bahan
industri. Buah kemiri digunakan sebagai bumbu masak yang mengandung kadar gizi, energi, dan minyak yang sangat tinggi. Minyak kemiri dalam perdagangan internasional dikenal dengan istilahcandlenut oil(terdapat dalam biji sebanyak
60%) yang dimanfaatkan dalam industri catata upernis, tekstil, farmasi, dan kecantikan (Ketaren, 1986).
Bagian tempurung atau cangkang kemiri dapat digunakan sebagai arang untuk
bahan bakar, sedangkan ampas sisa pembuatan minyak kemiri dapat dimanfaatkan sebagai pupuk dan pakan ternak (Paimin, 1997). Daging kemiri diperoleh setelah pengupasan dari kulit biji (tempurung) yang keras. Pengupasan kulit biji
dilakukan dengan memanaskan biji langsung di atas api kemudian direndam dalam air dingin atau langsung dibanting hingga pecah. Cara tradisional lainnya
yang dapat dilakukan antara lain dengan penjemuran lalu ditumbuk, pemanasan dengan oven kemudian direndam semalaman dalam air dingin hingga biji pecah dengan sendirinya. Minyak kemiri yang dikenal dengan istilahcandlenut oil
16
Diameter biji kemiri mencapai 1,5-2 cm yang di dalamnya terdapat daging biji
berwarna putih yang kaku (merupakan bagian endosperm yang digunakan sebagai bumbu masak). Biji kemiri mempunyai kulit biji yang dikenal sebagai tempurung
atau cangkang yang sangat keras. Tempurung ini beratnya mencapai 65-75% dari berat biji seluruhnya, dan tebal tempurung 3-5 mm. Permukaan luarnya kasar dan berlekuk serta berwarna coklat kehitaman. Tempurung biji merupakan bagian
buah yang paling keras sehingga untuk mendapatkan inti atau daging buah, maka tempurungnya harus dipecah (Sunanto, 1994).
Pengeringan biji dilakukan dengan cara menjemur di bawah sinar matahari
dengan lama penjemuran antara 3 sampai 6 hari tergantung cuaca sampai mencapai kadar air 7-10%. Pada kondisi ini biji dijamin bebas dari gangguan
cendawan atau serangga. Selanjutnya biji dapat disimpan, dijual atau dikupas bijinya. Petani menjual biji kemiri dalam keadaan utuh atau biji kemiri yang sudah dikupas. Untuk memperoleh keuntungan yang lebih besar, petani akan
menjual dalam keadaan biji kupas (Paimin, 1997).
Tempurung kemiri hasil kupasan seperti yang terlihat pada Gambar 3 dapat
dimanfaatkan sebagai bahan dasar pembuatan briket. Briket adalah sumber energi panas alternatif yang digunakan sebagai bahan bakar. Pembuatan briket
dilakukan dengan menggunakan tepung kanji sebagai bahan perekat dengan perbandingan antara tempurung kemiri dan kanji (80:20), kemudian dicetak
17
perkebunan kemiri di Indonesia mencapai 212,518 ha dengan produksi mencapai
89,155 ton (Saptoadi dkk., 2007).
Gambar 3.Tempurung kemiri
C. Metilen Biru
Metilen biru memiliki rumus kimia C16H18N3SCl yang membentuk struktur
seperti Gambar 4 merupakan senyawa hidrokarbon aromatik yang beracun dan termasuk zat warna kationik dengan daya adsorpsi yang sangat kuat. Pada
umumnya metilen biru digunakan sebagai pewarna sutra,wool, tekstil, kertas, peralatan kantor, dan kosmetik. Senyawa ini berupa kristal berwarna hijau gelap.
Ketika dilarutkan, metilen biru dalam air atau alkohol akan menghasilkan larutan berwarna biru. Metilen biru memiliki berat molekul 319,86 gr/mol, dengan titik lebur 105°C dan daya larut sebesar 4,36 x 104mg/L (Palupi, 2006). Konsentrasi
metilen biru yang berada dalam larutan dapat dianalisis dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 664 nm (Honget al., 2009;
18
S+ N
N N
Cl
-Gambar 4.Struktur metilen biru
Gugus kromofor adalah gugus yang menyebabkan molekul menjadi berwarna. Pada Tabel 2 dapat dilihat beberapa nama gugus kromofor dan struktur kimianya yang memberi daya ikat terhadap serat yang diwarnainya. Kromofor zat warna
reaktif biasanya merupakan sistem azo dan antrakuinon dengan berat molekul relatif kecil. Daya serap terhadap serat tidak besar sehingga zat warna yang tidak
bereaksi dengan serat mudah dihilangkan.
Tabel 2.Nama dan struktur kimia kromofor
Nama Gugus Struktur Kimia
Nitroso NO atau (-N-OH)
Nitro NO2atau (NN-OOH)
Grup Azo
-N=N-Grup Etilen
-C=C-Grup Karbonil
-CO-Grup Karbon-Nitrogen -C=NH ;
CH=N-Grup Karbon Sulfur -C=S ;
-C-S-S-C-(Manurung dkk., 2004).
Gugus-gugus penghubung dapat mempengaruhi daya serap dan ketahanan zat
warna terhadap asam atau basa. Gugus-gugus reaktif merupakan bagian-bagian dari zat warna yang mudah lepas. Dengan lepasnya gugus reaktif ini maka zat
19
D. Adsorpsi
Menurut Alberty dan Daniel (1987), adsorpsi merupakan fenomena yang terjadi pada permukaan. Adsorpsi secara umum didefinisikan sebagai akumulasi sejumlah molekul, ion atau atom yang terjadi pada batas antara dua fasa. Fasa
yang menyerap disebut adsorben dan fasa yang terserap disebut adsorbat. Kebanyakan adsorben adalah bahan-bahan yang memiliki pori karena adsorpsi
berlangsung terutama pada dinding-dinding pori atau pada letak-letak tertentu di dalam adsorben.
Gaya tarik-menarik dari suatu padatan dibedakan menjadi dua jenis gaya, yaitu gaya fisika dan gaya kimia yang masing-masing menghasilkan adsorpsi fisika
(physisorption)dan adsorpsi kimia(chemisorption)(Oscik, 1982). Menurut Martell and Hancock (1996), adsorpsi fisika adalah proses interaksi antara adsorben dengan adsorbat yang melibatkan gaya-gaya antar molekul seperti gaya
Van der Waals, sedangkan adsorpsi kimia terjadi jika interaksi adsorben dan adsorbat melibatkan pembentukan ikatan kimia. Dalam proses adsorpsi
melibatkan berbagai macam gaya yakni gaya Van der Waals, gaya elektrostatik, ikatan hidrogen serta ikatan kovalen.
Dalam adsorpsi fisika, molekul-molekul teradsorpsi pada permukaan dengan
ikatan yang lemah. Adsorpsi ini umumnya bersifat reversibel sehingga substansi yang telah teradsorpsi relatif mudah dilepaskan kembali dengan cara menurunkan tekanan gas atau konsentrasi zat terlarut. Energi yang menyertai fisisorpsi
20
Pada adsorpsi kimia terjadi pembentukan dan pemutusan ikatan, sehingga energi
adsorpsinya berada pada kisaran yang sama dengan reaksi kimia. Ikatan antara adsorben dan adsorbat cukup kuat sehingga tidak terjadi spesiasi karena zat
teradsorpsi menyatu dengan adsorben membentuk lapisan tunggal dan relatif reversibel. Batas minimal suatu adsorpsi dikategorikan sebagai kemisorpsi memiliki harga energi adsorpsi sebesar 20,92 kJ/mol (Adamson and Gast, 1997).
Energi yang menyertai adsorpsi kimia relatif tinggi yaitu berkisar 42-420 kJ/mol. Hal ini diperkuat oleh studi spektroskopi bahwa terjadi transfer elektron dan
terbentuk ikatan kimia antara adsorben dan adsorbat.
Menurut Shaw (1980), proses adsorpsi larutan secara teoritis berlangsung lebih rumit dibandingkan proses adsorpsi pada gas, uap atau cairan murni. Hal ini
disebabkan pada adsorpsi larutan melibatkan persaingan antara komponen larutan dengan situs adsorpsi. Proses adsorpsi larutan dapat diperkirakan secara kualitatif dari polaritas adsorben dan komponen penyusun larutan. Adsorben polar
cenderung lebih kuat menyerap adsorbat polar dibandingkan adsorbat non-polar, begitu pula sebaliknya. Kelarutan adsorbat dalam pelarut merupakan faktor yang menentukan dalam proses adsorpsi, umumnya subtansi hidrofilik sukar
teradsorpsi dalam larutan encer.
1. Kinetika Adsorpsi
Kinetika adalah deskripsi tentang kecepatan (laju) reaksi dan bagaimana proses reaksi berlangsung. Laju reaksi merupakan laju yang diperoleh dari perubahan
21
mengalami kesetimbangan. Laju reaksi bergantung pada konsentrasi reaktan,
tekanan, temperatur, dan pengaruh katalis (Oxtoby, 1990).
Urutan reaksi mendefinisikan ketergantungan laju reaksi pada konsentrasi spesi kimia yang bereaksi. Orde reaksi ditentukan secara empiris, tetapi tidak berkaitan
dengan stoikiometri reaksi. Kinetika dapat digunakan untuk menentukan
kecepatan adsorpsi yang berlangsung dan menentukan kapasitas kesetimbangan.
Tingkat adsorpsi keseluruhan dipengaruhi oleh perubahan sifat dan komponen pelarut, serta ukuran partikel dan suhu. Kinetika reaksi adsorpsi juga dipengaruhi oleh gugus fungsional dan konsentrasi. Tingkat substitusi yang tinggi oleh gugus
fungsional pada polimer inert dapat meningkatkan laju reaksi keseluruhan (Allen
et al.,2004).
Analisis kinetika didasarkan pada kinetika reaksi terutama pseudo orde pertama atau mekanisme pseudo pertama bertingkat. Untuk mengetahui mekanisme
adsorpsi, digunakan persamaan sistem pseudo orde pertama oleh Lagergren dan mekanisme pseudo orde kedua (Buhaniet al., 2010). Model kinetika (pseudo
orde pertama dan persamaan orde dua) dapat digunakan dengan asumsi bahwa konsentrasi diukur sama dengan konsentrasi permukaan adsorben. Tingkat persamaan orde pertama Lagergren adalah salah satu yang paling banyak
digunakan untuk adsorpsi zat terlarut dari larutan cair (Liuet al.,2004).
Persamaan pseudo orde satu adalah persamaan yang biasa digunakan untuk menggambarkan adsorpsi dan ditentukan dengan persamaan berikut:
22
Dimana qeadalah jumlah ion yang teradsorpsi pada keadaan setimbang (mg g-1),
qtadalah jumlah ion yang teradsorpsi pada waktu tertentu (mg g-1), t adalah waktu
(menit) dan k1adalah konstanta laju pseudo orde pertama (menit-1). Persamaan
dapat diintegrasi dengan memakai kondisi-kondisi batas qt=0 pada t=0 dan qt=qt
pada t=t, persamaan menjadi:
t
Model persamaan pseudo orde dua dapat dinyatakan dalam bentuk:
2
Dengan qeadalah jumlah ion yang teradsorpsi pada keadaan setimbang (mg g-1), qt
adalah jumlah ion yang teradsorpsi pada waktu tertentu (mg g1), k2adalah
konstanta laju pseudo orde kedua (dalam g mmol-1menit-1). Setelah integrasi dan penggunaan kondisi-kondisi batas qt=0 pada t=0 dan qt=qtpada t=t, persamaan
linier dapat diperoleh sebagai berikut :
e
Laju penyerapan awal, h (mg g-1menit) sedangkan t=0 dapat didefinisikan sebagai berikut :
2 2
q
ek
h
(5)Laju adsorpsi awal (h), kapasitas adsorpsi kesetimbangan (qe) dan konstanta
lajupseudo orde dua (k2) dapat ditentukan secara eksperimen dari slop dan
23
2. Kapasitas Adsorpsi
Model kesetimbangan adsorpsi yang sering digunakan untuk menentukan kesetimbangan adsorpsi adalah isotermal Langmuir dan Freundlich.
a. Model Isoterm Adsorpsi Langmuir
Menurut Oscik (1982), teori Langmuir ini didasarkan pada asumsi bahwa laju
adsorpsi akan bergantung pada faktor ukuran dan struktur molekul adsorbat, sifat pelarut dan porositas adsorben, situs pada permukaan yang homogen dan adsorpsi terjadi secaramonolayer. Proses adsorpsi memiliki dua tahap, yaitu perpindahan
adsorbat dari fasa larutan ke permukaan adsorben dan adsorpsi pada permukaan adsorben. Tahap pertama akan bergantung pada sifat pelarut dan adsorbat yang
terkontrol.
Bagian yang terpenting dalam proses adsorpsi yaitu situs yang dimiliki oleh
adsorben yang terletak pada permukaan, akan tetapi jumlah situs-situs ini akan berkurang jika permukaan yang tertutup semakin bertambah (Husin and Rosnelly,
2007).
Model isoterm adsorpsi Langmuir dapat dinyatakan dalam persamaan:
b
dimana C adalah konsentrasi kesetimbangan (mg L-1), m adalah jumlah zat yang
24
C/m versus C maka dapat ditentukan nilai b dari kemiringan (slop) dan k dari
intersep kurva. Energi adsorpsi (Eads) yang didefinisikan sebagai energi yang
dihasilkan apabila satu mol zat teradsorpsi dalam adsorben dan nilainya ekuivalen
dengan nilai negatif dari perubahan energiGibbs standar, Δ G°, dapat dihitung menggunakan persamaan:
(7)
Dengan R adalah tetapan gas umum (8,314 J mol-1K), T adalah temperatur (K) dan k adalah konstanta kesetimbangan adsorpsi yang diperoleh dari persamaan
Langmuir, sehingga energi total adsorpsi E harganya sama dengan negatif energi bebas Gibbs (Oscik, 1982).
Adapun grafik isoterm adsorpsi Langmuir diperlihatkan pada Gambar 5 berikut
ini:
Gambar 5. Model isoterm adsorpsi Langmuir (Husin and Rosnelly, 2007).
b. Model Isoterm Adsorpsi Freundlich
Model isoterm Freundlich menerangkan bahwa proses adsorpsi pada permukaan adalah heterogen dimana tidak semua permukaan adsorben mempunyai daya
adsorpsi. Model isoterm Freundlich menunjukkan lapisan adsorbat yang C/m (g L-1)
C (mg L-1)
25
terbentuk pada permukaan adsorben adalahmultilayer. Hal tersebut berkaitan
dengan ciri-ciri dari adsorpsi secara fisika dimana adsorpsi dapat terjadi pada banyak lapisan (multilayer) (Husin dan Rosnelly, 2007).
Asumsi yang digunakan:
a. Tidak ada asosiasi dan disosiasi molekul-molekul adsorbat setelah teradsorpsi pada permukaan padatan.
b. Hanya berlangsung mekanisme adsorpsi secara fisis tanpa adanya adsorpsi kimia.
c. Permukaan padatan bersifat heterogen (Nollet al., 1992).
Bentuk persamaan Freundlich adalah sebagai berikut:
(8)
Dengan qeadalah jumlah zat yang teradsorpsi per gram adsorben (mg g-1), Ce
adalah konsentrasi setimbang adsorbat dalam fase larutan (mg L-1), kfadalah
faktor kapasitas Freundlich (mol g-1), dan n adalah faktor intensitas
Freundlich. Dari rumus pada Persamaan 8 dapat dibuat grafik seperti pada Gambar 6.
26
Gambar 6. Model isoterm adsorpsi Freundlich (Rousseau, 1987).
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan dengan cara memplotkanC/QterhadapCe. Konstanta Freundlich kfdapat
diperoleh dari kemiringan garis lurusnya dan 1/n merupakan harga slop. Bila n diketahui kfdapat dicari, semakin besar harga kfmaka daya adsorpsi akan
semakin baik dan dari harga kfyang diperoleh maka energi adsorpsi akan dapat
dihitung (Rousseau, 1987).
Selain itu, untuk menentukan jumlah zat warna teradsorpsi, rasio distribusi dan koefisien selektivitas pada proses adsorpsi metilen biru terhadap adsorben karbon
aktif dapat digunakan persamaan berikut:
Q = (Co-Ce)V/W (9)
Dimana Q menyatakan jumlah metilen biru teradsorpsi (mg g-1), Codan Ce
menyatakan konsentrasi awal sebelum teradsorpsi dan konsentrasi metilen biru setelah teradsorpsi (mmol L-1), W adalah massa adsorben (g), V adalah volume
larutan metilen biru (L) (Buhaniet al., 2009). Log qe
1/n
Log kf
27
E. Karakterisasi
1. Spektrofotometer UV-Vis
Spektrofotometri UV-Vis merupakan salah satu teknik analisis spektroskopi yang memakai sumber radiasi elektromagnetikultraviolet(UV) (190-380 nm) dan sinar tampak atauvisible(Vis) (380-780 nm) dengan memakai instrumen
spektrofotometer. Spektrofotometri UV-Vis melibatkan energi elektronik yang cukup besar pada molekul yang dianalisis, sehingga spektrofotometri UV-Vis
lebih banyak dipakai untuk analisis kuantitatif daripada kualitatif (Mulja dan Suharman, 1995). Spektrofotometer terdiri atas spektrometer dan fotometer. Spektro menghasilkan sinar dari spektrum dengan panjang gelombang tertentu
dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Spektrofotometer tersusun atas sumber spektrum yang
kontinyu, monokromator, sel pengabsorpsi untuk larutan sampel atau blanko dan
suatu alat untuk mengukur perbedaan absorpsi antara sampel dan blanko ataupun pembanding (Khopkar, 1984).
Spektrofotometer UV-Vis dapat digunakan dalam penentuan terhadap sampel
yang berupa larutan, gas, atau uap. Sampel yang berupa larutan perlu diperhatikan pelarut yang dipakai antara lain:
1. Pelarut yang dipakai tidak mengandung sistem ikatan rangkap terkonjugasi pada struktur molekulnya dan tidak berwarna.
28
Komponen-komponen pokok dari spektrofotometer yang ditunjukkan pada
Gambar 7 meliputi:
1. Sumber tenaga radiasi yang stabil, sumber yang biasa digunakan adalah lampu
wolfram.
2. Monokromator untuk memperoleh sumber sinar yang monokromatis. 3. Sel absorpsi, pada pengukuran di daerah sinar tampak menggunakan kuvet
kaca, tetapi untuk pengukuran pada UV menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini.
4. Detektor radiasi yang dihubungkan dengan sistem meter atau pencatat. Peranan detektor penerima adalah memberikan respon terhadap cahaya pada berbagai panjang gelombang (Khopkar, 1984).
Berikut ini merupakan skema alat spektrofotometer UV-Vis
Gambar 7.Skema alat spektrofotometer UV-Vis (Harvey, 2000).
Serapan cahaya oleh molekul dalam daerah spektrum UV dan Vis tergantung pada struktur elektronik dari molekul. Serapan UV dan Vis dari
29
elektronik. Transisi-transisi tersebut biasanya terjadi antara orbital ikatan atau
orbital pasangan elektron bebas dan orbital non ikatan tak jenuh atau orbital anti ikatan. Panjang gelombang serapan merupakan ukuran dari pemisahan tingkat
energi orbital yang bersangkutan. Spektrum UV dan Vis berupa gambar hubungan antara panjang gelombang atau frekuensi serapan dengan intensitas serapan (transmitansi atau absorbansi). Sering juga data ditunjukkan sebagai
grafik atau tabel yang menyatakan hubungan antara panjang gelombang dengan serapan molar atau log dari serapan molar,εmax, atau logεmax(Sastrohamidjojo,
2001).
Sumber tenaga radiasi terdiri dari benda yang tereksitasi menuju ke tingkat yang lebih tinggi oleh sumber listrik bertegangan tinggi atau oleh pemanasan listrik.
Monokromator adalah komponen yang digunakan untuk mengubah cahaya polikromatik menjadi cahaya monokromatik. Monokromator ini dapat berupa prisma atau grating (Khopkar, 1984). Sel yang biasa digunakan berbentuk persegi
maupun berbentuk silinder dengan ketebalan 10 mm. Sel tersebut adalah sel pengabsorpsi yang digunakan untuk menaruh cairan ke dalam spektrofotometer. Sel memiliki kemampuan meneruskan energi cahaya pada daerah spektral yang
sesuai. Sebelum digunakan, sel dibersihkan dengan air atau dapat dicuci dengan larutan detergen atau asam nitrat panas apabila dikehendaki (Sastrohamidjojo,
2001).
30
Monokromator kemudian akan mengubah cahaya polikromatis menjadi cahaya
monokromatis (tunggal). Berkas-berkas cahaya dengan panjang tertentu kemudian akan dilewatkan pada sampel yang mengandung suatu zat dalam
konsentrasi tertentu. Oleh karena itu, terdapat cahaya yang diserap (diabsorpsi) dan ada pula yang dilewatkan. Cahaya yang dilewatkan ini kemudian diterima oleh detektor. Detektor kemudian akan menghitung cahaya yang diterima dan
mengetahui cahaya yang diserap oleh sampel. Cahaya yang diserap sebanding dengan konsentrasi zat yang terkandung dalam sampel sehingga akan diketahui
konsentrasi zat dalam sampel secara kuantitatif (Khopkar, 1984).
2. Scanning Electron Microscope(SEM)
Scanning Electron Microscope(SEM) adalah alat yang digunakan untuk
mempelajari morfologi permukaan objek pada skala yang amat kecil. Prinsip kerja SEM, dengan cara mengalirkan arus pada kawat filamen dan perlakuan
pemanasan, sehingga dihasilkan elektron. Elektron tersebut dikumpulkan dengan tegangan tinggi dan berkas elektron difokuskan dengan sederetan lensa
elektromagnetik. Ketika berkas elektron mengenai target, informasi dikumpulkan
melalui tabung sinar katoda yang mengatur intensitasnya. Setiap jumlah sinar yang dihasilkan dari tabung sinar katoda dihubungkan dengan jumlah target, jika
terkena berkas elektron berenergi tinggi dan menembus permukaaan target, elektron kehilangan energi, karena terjadi ionisasi atom dari cuplikan padatan. Elektron bebas ini tersebar keluar dari aliran sinar utama, sehingga terbentuk lebih
31
detektor dan selanjutnya dicatat sebagai suatu foto (Wagiyo dan Handayani,
32
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian ini telah dilakukan pada bulan Maret hingga Juni 2016 di Laboratorium
Kimia Anorganik/Fisik FMIPA Universitas Lampung (Unila), analisisScanning Electron Miscroscope(SEM) dilakukan di Laboratorium SEM FMIPA Institut Teknologi Bandung (ITB), serta analisis spektrofotometer UV-Vis dilakukan di
Laboratorium Kimia Anorganik/Fisik FMIPA Unila.
B. Alat dan Bahan Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah peralatan gelas, neraca analitik, tanur Heraus KR 170E, pompavacumPH 137AC, pengaduk magnet,
oven, kertas saringWhatmanNo. 42, pH indikator universal,Scanning Electron
Miscroscope(SEM) JEOL-JSM-6510LA, dan spektrofotometer UV-Vis Cary
100.
Bahan-bahan yang digunakan dalam penelitian ini adalah arang tempurung kemiri, karbon aktif komersil Meikelin, metilen biru Solarbio, NaOH 0,1 M, HCl
33
C. Prosedur Penelitian
1. Penyiapan Karbon Aktif
a. Karbon Aktif Komersil
Karbon aktif komersil yang diperoleh dikarakterisasi dan langsung digunakan dalam uji adsorpsi.
b. Karbon Aktif Tempurung Kemiri
Arang tempurung kemiri yang telah dibuat dihaluskan. Selanjutnya diayak dengan ukuran 600 µm. Arang tempurung kemiri yang telah diayak kemudian diaktivasi dengan 2 cara, yaitu aktivasi fisika dan kimia.
• Aktivasi Fisika
Sebanyak 50 gram arang tempurung kemiri dibakar dalam tanur pada suhu 700 ºC selama 1 jam. Kemudian dimasukkan dalam desikator agar suhunya stabil.
• Aktivasi Kimia
Karbon aktif hasil aktivasi fisika direndam dalam larutan ZnCl210% selama 24 jam.
Setelah itu dilakukan penyaringan dan pencucian menggunakan aquades hingga pH 6. Pengeringan dilakukan dalam oven pada suhu 100 ºC selama 1 jam.
34
2. Karakterisasi Material
Adsorben yang diperoleh dari aktivasi kimia dan fisika, serta karbon aktif komersil dikarakterisasi menggunakan SEM untuk mengetahui morfologi permukaannya. Untuk mengetahui kadar metilen biru yang teradsorpsi oleh
adsorben, dilakukan analisis menggunakan spektrofotometer UV-Vis pada panjang gelombang 664,0 nm sesuai dengan penentuan panjang gelombang
maksimum metilen biru seperti yang tersaji pada Gambar 17 (Lampiran 1).
3. Pembuatan Larutan Induk Metilen Biru 1000 mg L-1
Sebanyak 1 g metilen biru dimasukkan dalam labu takar 1000 mL, kemudian
ditambah aquades hingga tanda terra dan dihomogenkan.
4. Uji Adsorpsi
a. Penentuan Dosis Optimum Adsorben
Sebanyak 20 mL larutan metilen biru 100 mg L-1ditambah adsorben dengan variasi dosis 50; 100; 200; 300; dan 500 mg. Campuran tersebut diaduk selama 1 jam kemudian disaring. Filtrat yang dihasilkan dianalisis dengan
spektrofotometer UV-Vis pada panjang gelombang 664,0 nm.
b. Penentuan pH Optimum
35
campuran diaduk selama 1 jam dengan variasi pH 2, 4, 6, 8, 10, dan 12.
Penurunan pH dilakukan dengan penambahan HCl 0,1 M sedangkan peningkatan pH dilakukan dengan penambahan NaOH 0,1 M. Selanjutnya campuran disaring
untuk memisahkan filtrat dan residunya. Filtrat yang dihasilkan dianalisis dengan spektrofotometer UV-Vis pada panjang gelombang 664,0 nm.
c. Waktu Kontak
Sebanyak 20 mL larutan metilen biru 100 mg L-1ditambah adsorben dengan dosis optimum. Kemudian dilakukan pengaturan pH pada pH optimum. Setelah
tercapai pH optimum, dilakukan pengadukan. Pengadukan dilakukan dengan variasi waktu yaitu 20, 40, 60, 80,100, dan 120 menit. Setelah itu, dilakukan
pemisahan filtrat dan residu melalui penyaringan. Selanjutnya filtrat dianalisis dengan spektrofotometer UV-Vis pada panjang gelombang 664,0 nm untuk mengetahui kadar metilen biru yang teradsorpsi.
d. Isoterm Adsorpsi
Sebanyak 20 mL larutan yang mengandung metilen biru dengan variasi
konsentrasi 50, 100, 150, 200, dan 250 mg L-1masing-masing ditambah adsorben
dengan dosis optimum pada pH yang optimum. Kemudian masing-masing campuran tersebut diaduk dengan lama pengadukan sesuai dengan waktu kontak.
Setelah selesai, filtrat dipisahkan dari residunya dengan penyaringan. Filtrat yang didapat dianalisis menggunakan spektrofotometer UV-Vis pada panjang
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan maka dapat disimpulkan bahwa:
1. Pembuatan karbon aktif dengan aktivasi fisika dan kimia telah berhasil
dilakukan yang ditunjukkan dengan karakterisasi menggunakan SEM. Adanya
rongga pada permukaanmenunjukkan bahwa pori-pori telah terbentuk pada permukaan karbon aktif yang diaktivasi.
2. Adsorpsi metilen biru oleh karbon aktif optimum pada dosis 200 mg. Adsorpsi metilen biru oleh KAF dan KAC optimum pada pH 8 sedangkan untuk KAK optimum pada pH 10.
3. Laju adsorpsi metilen biru olehKAF, KAK, dan KAC cenderung mengikuti model kinetika pseudo orde dua dengan nilai konstanta laju masing-masing 0,099; 0,210; 0,281 g mmol-1menit-1.
53
B. Saran
Pada penelitian lebih lanjut disarankan:
1. Melakukananalisis karakterisasi karbon aktif tempurung kemiri secara kuantitatif dengan menggunakan instrumen lain agar melengkapi hasil penelitian sebelumnya.
54
DAFTAR PUSTAKA
Adamson, A.W. and A.P. Gast. 1997.Physical Chemistry of Surface.6thedition. John Willy and Sons Inc. New York.
Alberty, R.A. and F. Daniel.1987.Physical Chemistry. 5thedition. SI Version. John Willey and Sons Inc. New York.
Allen, S.J., G. Mckay, and J.F. Porter.2004. Adsorption Isotherm Models for Basic Dye Adsorption by Peat in Single and Binary Component Systems.Journal of Colloid and Interface Science.280: 322-333.
Ambarsari, L.P., I. Ulfi, N. Widiastuti. 2010. Adsorpsi Metilen Biru dengan Abu Dasar PT. IPMOMI Purbolinggo Jawa Timur dengan Metode Kolom.
Prosiding Skripsi Semester Genap 2009/2010. FMIPA Institut Teknologi Sepuluh Nopember.
Austin, G.T. 1996. Industri Proses Kimia. Jilid 1. Edisi Kelima. Penerbit Erlangga. Jakarta.
Budiono, A., Suhartana, dan Gunawan. 2009. Pengaruh Aktivasi Arang Tempurung Kelapa dengan Asam Sulfat dan Asam Fosfat untuk Adsorpsi Fenol. E-Journal Universitas Diponegoro. pp. 1-12.
Buhani, Narsito, Nuryono, and E.S. Kunarti. 2009. Amino and Merkapto-Silika Hybrid for Cd (II) Adsorption in Aqueous Solution.Indonesian Journal of Chemistry.9(2): 170-176.
Buhani, Suharso, and Sumadi. 2010. Adsorption Kinetics and Isotherm of Cd (II) Ion onNannochloropsissp Biomass Imprinted Ionic Polymer.Desalination.259: 140-146.
55
Chowdurry, S., R. Mishra, P. Saha, and P. Kushwaha. 2011. Adsorption
Thermodynamics, Kinetics and Isosteric Heat of Adsorption of Malachite Green onto Chemically Modified Rice Husk.Desalination.265: 159-168. Dargo, H., N. Gabbiye, and A. Ayalew. 2014. Removal of Methylene Blue Dye from
Textile Wastewater using Activated Carbon Prepared from Rice Husk.
International Journal of Innovation and Scientific Research.9(2): 317-325. Deans,J.R. and B.G. Dixon. 1992. Uptake of Pb2+and Cu2+by Novel Biopolymers.
Water Research.26(4): 469-472.
Djatmiko,B dan A.P. Widjaja. 1985.Teknologi Minyak dan Lemak. Departemen THP IPB. Bogor.
Elly,K. 2008.Pemanfaatan Cangkang Kelapa Sawit sebagai Arang Aktif.Jurnal Penelitian Ilmu-Ilmu Teknik.8(2): 96-103.
Fauziah, N. 2009.Pembuatan Arang Aktif secara Langsung dari Kulit Acasia mangium Wild dengan Aktivasi Fisika dan Aplikasinya sebagai Adsorben.
IPB. Bogor.
Gao, J.J., Y.B. Qin., T. Zhou., and D.D. Cao. 2013. Adsorption of Methylene Blue Onto Activated Carbon Produced from Tea (Camellia sinensis L.) Seed Shells: Kinetics, Equilibrium, and Thermodynamics Studies.Journal of Zhejiang University-SCIENCE B (Biomedicine & Biotechnologi).14(7): 650-658.
Gupta, V.K., Suhas, and V.K. Saini. 2004. Removal of Rhodamine B, Fast Green, and Methylene Blue from Wastewater Using Red Nud, an Alumunium Industry Waste.Journal International Chemical Engineering Research.43: 1740-1747.
Gupta, V.K. and Suhas. 2009. Application of Low-Cost Adsorbents for Dye Removal–A Review.Journal Environment Management.90: 2313–2342. Gürses, A., S. Karaca, C. Dogar, R. Bayrak, M. Acikyildiz, and M. Yalcin. 2004. Determination of Adsorptive Properties of Clay/Water System: Methylene Blue Sorption.Journal Colloid International Science.269: 310-314. Haimour, N.M. and S. Emeish. 2006. Utilization of Date Stones for Production of
Activated Carbon Using Phosphoric Acid.Waste Management.26: 651–660. Hala, Y., P.Taba., dan A.B. Susilawati. 2010. Adsorpsi Rhodamin B dalam Air oleh