DESORPSI TIMBAL PADA KERANG DARAH (Anadara
granosa) MENGGUNAKAN EKSTRAK AIR KULIT JERUK
SIAM DAN PEKTINNYA
MINARTI SA’DIAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUANALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Desorpsi Timbal pada Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air Kulit Jeruk Siam dan Pektinnya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2013
Minarti Sa’diah
ABSTRAK
MINARTI SA’DIAH. Desorpsi Timbal pada Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air Kulit Jeruk Siam dan Pektinnya. Dibimbing oleh ETI ROHAETI dan ZULHAN ARIF.
Kerang darah (Anadara granosa) dari beberapa perairan dilaporkan memiliki kadar timbal (Pb) di atas ambang batas yang ditetapkan oleh Standar Nasional Indonesia (SNI). Pada penelitian ini, kadar Pb dalam kerang darah dikurangi menggunakan ekstrak air kulit jeruk siam dan pektinnya. Ekstrak air diperoleh dengan menghancurkan kulit jeruk siam yang ditambahkan air (1:3). Pektin diekstraksi menggunakan HCl 0.1 N pada pH 1.5, suhu 95 °C selama 40 diukur. Proses desorpsi dilakukan dengan merendam daging kerang dalam ekstrak air kulit jeruk siam dan dalam larutan pektin 0.2% selama 60 menit. Ekstrak air kulit jeruk siam menurunkan kadar Pb sebesar 46%, sedangkan larutan pektin menurunkan kadar Pb sebesar 48%.
Kata kunci: Anadara granosa, desorpsi, kulit jeruk siam, pektin, timbal
ABSTRACT
(SNI). In this experiment, orange peel extract and its pectin were used to reduce the lead content on blood cockles. Aqueous extract orange peels were obtained by crushing the peels and mixed with in proportion of 1:3. Pectin was extracted from the peels using HCl 0.1 N at pH 1.5, and temperature 95 °C for 40 minutes. The pectin yield was 10.18%, equivalent weight 1180.45 g/eq, methoxyl content 6.52% (w/w), galacturonic acid 57.65% (w/w), and degree of estherification 64.24% (w/w). Samples of blood cockles purchased from Pasar Anyar Bogor. The result showed that lead content was below SNI threshold. The samples of blood cockle meat were soaked in lead solution and desorption of lead could be measured. Desorption process were performed by soaking the samples in the extract solution and in 0.2% pectin solution for 60 minutes. The aqueous extract of orange peel reduced lead content by 46%, whereas pectin solution was able to reduced for 48%.DESORPSI TIMBAL PADA KERANG DARAH (Anadara
granosa) MENGGUNAKAN EKSTRAK AIR KULIT JERUK
SIAM DAN PEKTINNYA
MINARTI SA’DIAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Desorpsi Timbal pada Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air Kulit Jeruk Siam dan Pektinnya
Nama : Minarti Sa’diah NIM : G44090069
Disetujui oleh
Dr Eti Rohaeti, MS Zulhan Arif, SSi, MSi
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul Desorpsi Timbal pada Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air Kulit Jeruk Siam dan Pektinnya. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada Februari-Juli 2013 di Laboratorium Kimia Analitik dan Laboratorium Bersama, Departemen Kimia, Institut Pertanian Bogor. Penulis mengucapkan terima kasih kepada Ibu Dr Eti Rohaeti, MS selaku pembimbing pertama dan Bapak Zulhan Arif, SSi, MSi selaku pembimbing kedua. Ucapan terima kasih juga penulis ucapkan kepada Bapak Eman, Ibu Nunung, Bapak Wawan, dan seluruh staf bagian Kimia Analitik atas bantuan teknis dan saran selama penulis melakukan penelitian. Ungkapan terima kasih juga disampaikan kepada kedua orang tua tercinta, keluarga, dan semua teman-teman atas segala doa dan semangatnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2013
3
Waktu dan Lokasi Penelitian 3
BAHAN DAN METODE 3
Bahan dan Alat 3
Metode Penelitian 3
Penentuan Kadar Air Kulit Jeruk Siam (AOAC 2005) 3 Penentuan Kadar Abu Kulit Jeruk Siam (AOAC 2005) 3
Pembuatan Ekstrak Air Kulit Jeruk Siam 4
Isolasi Pektin dari Kulit Jeruk Siam (Budiyanto dan Yulianingsih 2008) 4
Analisis Spektrum FTIR Pektin 4
Penentuan BE Pektin (Ismail et al. 2012) 4
Penentuan Kadar Metoksil Pektin (Ismail et al. 2012) 4 Penentuan Kadar Galakturonat dan DE Pektin (Ismail et al. 2012) 4 Uji adsorpsi Pb2+ pada Limbah Buatan oleh Pektin 5 Perendaman Daging Kerang Darah dengan Larutan Pb2+ 5 Desorpsi Pb pada Daging Kerang Darah dengan Larutan Pektin 5 Desorpsi Pb pada Daging Kerang Darah dengan Ekstrak Air Kulit Jeruk
Siam 5
Analisis kadar Pb pada daging kerang darah dengan AAS 5
HASIL DAN PEMBAHASAN 5
Limbah Kulit Jeruk Siam 5
Isolat Pektin Kulit Jeruk Siam 6
Ciri-ciri Pektin Kulit Jeruk Siam Hasil Isolasi 7 Nilai Adsorpsi (%), Kapasitas Adsorpsi (q), dan Konstanta Kesetimbangan
Adsorpsi (K) 10
Nilai Desorpsi Pb Ekstrak Air dan Pektin Kulit Jeruk Siam 11
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 16
DAFTAR TABEL
1 Hasil analisis proksimat daging kerang darah (Hayati 2012) 1 2 Gugus fungsi pada pektin hasil isolasi dan pektin pembanding 7 3 Gugus fungsi pada pektin komersial (Gnanasambandam dan Proctor
2000) 9
4 Ciri-ciri pektin kulit jeruk siam dan persyaratan mutu pektin 10
5 Nilai adsorpsi, q, dan K 10
6 Kadar Pb pada daging kerang darah sebelum dan sesudah proses desorpsi
(tanpa perendaman dengan larutan Pb) 12
7 Kadar Pb pada daging kerang darah sebelum dan sesudah proses desorpsi
(dengan perendaman dengan larutan Pb) 12
DAFTAR GAMBAR
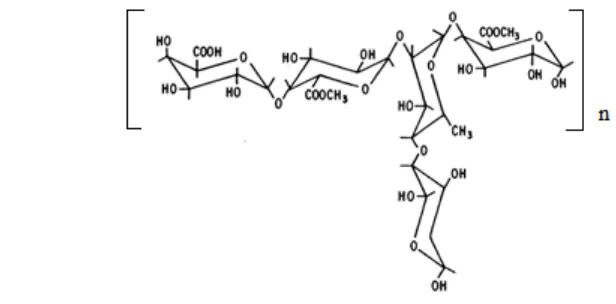
1 Struktur pektin (Fishman 1988) 2
2 Pektin hasil isolasi 6
3 Spektrum pektin hasil isolasi (a) dan pektin pembanding (b) 8 4 Spektrum FTIR pektin komersial (Gnanasambandam dan Proctor 2000) 8 5 Pengikatan logam bivalen oleh pektin (Srivastava dan Malviya 2011) 11
6 Kerang darah 11
DAFTAR LAMPIRAN
1 Bagan alir penelitian 16
2 Hasil analisis kulit jeruk siam 17
3 Hasil analisis pektin hasil isolasi 19
4 Hasil analisis uji adsorpsi Pb pada limbah buatan oleh pektin 22 5 Kadar Pb pada daging kerang darah sebelum dan setelah proses desorpsi
dengan air kulit jeruk siam dan pektin (tanpa perendaman dalam larutan
Pb) 24
6 Kadar Pb pada daging kerang darah sebelum dan setelah proses desorpsi dengan air kulit jeruk siam dan pektin (dengan perendaman dalam larutan
1
PENDAHULUAN
Latar Belakang
Daging kerang darah merupakan salah satu bahan makanan yang digemari oleh masyarakat Indonesia. Daging kerang darah merupakan sumber protein dan mineral (Nurjanah et al. 2005), serta sumber vitamin dan asam lemak takjenuh yang baik (Inswiasri et al. 1995). Indonesia mempunyai potensi sebagai penghasil kerang darah. Pada tahun 2011, produksi kerang darah Indonesia mencapai 39 000 ton (KKP 2012).
Hasil analisis proksimat daging kerang darah yang dilakukan oleh Hayati (2012) disajikan pada Tabel 1. Berdasarkan tabel tersebut, dapat disimpulkan bahwa daging kerang darah memiliki kandungan gizi yang cukup tinggi sehingga baik untuk dikonsumsi.
Tabel 1 Hasil analisis proksimat daging kerang darah (Hayati 2012) Parameter Kandungan (%) feeder). Kerang darah umumnya hidup menetap dan gerakannya lambat sehingga memiliki kemampuan untuk mengikat logam berat dari perairan lebih besar daripada hewan laut lainnya. Salah satu logam berat yang dapat diakumulasi oleh kerang darah adalah timbal (Pb). Nurjanah et al. (1999) melaporkan bahwa kerang darah yang berasal dari Pasar Ikan Muara Angke tercemar Pb sebesar 5.282 mg/kg. Cemaran tersebut terus mengalami peningkatan, dan telah mencapai 12.4 mg/kg (Hayati (2012). Cemaran tersebut telah melewati ambang batas yang ditetapkan oleh Standar Nasional Indonesia (BSN 2009), yaitu maksimum 1.5 ppm (mg/kg). Bahan pangan yang mengandung Pb berbahaya bila dikonsumsi karena dapat menyebabkan kerusakan ginjal, sistem reproduksi, hati, otak, dan sistem syaraf pusat (Manahan 2005). Oleh karena itu, perlu adanya upaya menurunkan kadar Pb pada kerang darah untuk meminimum efek racun yang ditimbulkan.
Penurunan kadar Pb pada kerang darah diupayakan menggunakan bahan yang aman dan tidak mengubah kandungan gizi terutama protein. Nurjanah et al.
(Sirait 2007). Rantai tersebut disisipi oleh L-ramnosa dan memiliki rantai cabang berupa gula (Gambar 1) (Fishman 1988). Pektin dapat digunakan untuk mengurangi kadar logam berat karena mempunyai gugus karboksilat yang dapat mengikat ion logam bivalen seperti Pb.
Gambar 1 Struktur pektin (Fishman 1988)
Penggunaan pektin untuk mengurangi kadar Pb pada daging kerang belum pernah dilaporkan, tetapi beberapa penelitian menunjukkan bahwa pektin dapat mengurangi kadar logam berat dalam media air. Harel et al. (1998) telah memanfaatkan pektin buah bit sebagai adsorben Cd. Wong et al. (2010) memanfaatkan pektin kulit jeruk dan kulit durian sebagai adsorben Pb, Cd, Cu, Zn, dan Ni. Pada penelitian tersebut, pektin kulit jeruk dan kulit durian mampu mengurangi kadar Pb pada limbah buatan berturut-turut 23.92% dan 13.93% dari kadar Pb awal.
Salah satu sumber pektin yang potensial adalah kulit jeruk siam. Menurut Direktorat Hortikultura Kementerian Pertanian RI (2012) dan BPS (2013), jumlah produksi jeruk Indonesia pada tahun 2011 mencapai 1 807 808 ton dan 1 818 949 ton. Menurut Erliza et al. (2007), 16.11% buah jeruk siam tersusun atas kulit buah. Kulit jeruk siam memiliki kandungan pektin cukup tinggi. Hariyati (2006) telah mengekstraksi pektin dari ampas jeruk pontianak (siam) pada pH 1.5 dengan variasi suhu dan waktu ekstraksi menghasilkan rendemen 13.67–16.32 %. Menurut Budiyanto dan Yulianingsih (2008), kondisi optimum ekstraksi pektin dari ampas jeruk siam adalah pH 1.5, suhu 95 °C, dan waktu ekstraksi 40 menit.
Kulit jeruk siam juga mengandung sejumlah asam yang larut dalam air. Asam tersebut juga dapat digunakan untuk mengikat logam berat. Oleh karena itu, pada penelitian ini proses desorpsi Pb dari kerang darah menggunakan ekstrak air dari limbah kulit jeruk siam dan pektinnya.
Tujuan Penelitian
3
Waktu dan Lokasi Penelitian
Penelitian dilaksanakan pada Februari–Juli 2013 di Laboratorium Kimia Analitik dan Laboratorium Bersama Departemen Kimia, Kampus IPB Dramaga.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah kerang darah dari Pasar Anyar Bogor, limbah kulit jeruk siam yang didapat dari penjual makanan dan minuman di sekitar Kampus IPB Dramaga, pektin pembanding dari Laboratorium Kimia Organik, HCl 0.1 N, HCl 0.25 N, HCl pekat, etanol 95%, AgNO3, NaOH 0.1 N, NaOH 0.25 N, NaCl, (COOH)2. 2 H2O, larutan standar Pb2+ 1000 mg/L, Pb(NO3)2, HNO3 pekat, indikator fenol merah, indikator fenolftalein, air suling, kertas saring, dan kain blacu.
Alat-alat yang digunakan adalah blender, radas ekstraksi, hot plate, oven, tanur, desikator, neraca analitik, buret, cawan porselen, peralatan gelas analitis, spektrofotometer serapan atom (AAS), dan spektrofotometer Fourier Transform Infrared (FTIR).
Metode Penelitian
Penelitian dilakukan dalam 7 tahap (Lampiran 1), yaitu analisis kulit jeruk siam (kadar air dan kadar abu), pembuatan ekstrak air kulit jeruk siam, ekstraksi dan isolasi pektin dari kulit jeruk siam, pencirian pektin kulit jeruk siam (analisis spektrum FTIR, kadar air, kadar abu, bobot ekuivalen (BE), kadar metoksil, kadar galakturonat, dan derajat esterifikasi (DE) pektin), uji adsorpsi Pb2+ pada limbah buatan oleh pektin, desoprsi Pb pada kerang darah menggunakan ekstrak air kulit kulit jeruk siam dan larutan pektin, dan analisis kadar Pb pada daging kerang darah.
Penentuan Kadar Air Kulit Jeruk Siam (AOAC 2005)
Wadah kosong dikeringkan di dalam oven pada suhu 105 ⁰C selama 3 jam kemudian didinginkan di dalam desikator dan ditimbang bobotnya. Sebanyak 3 gram sampel ditimbang di dalam wadah yang telah diketahui bobotnya. Wadah berisi sampel dikeringkan di dalam oven suhu 105 ⁰C selama 3 jam kemudian didinginkan di dalam desikator dan ditimbang bobotnya. Proses pengeringan dilakukan hingga bobot konstan.
Penentuan Kadar Abu Kulit Jeruk Siam (AOAC 2005)
terbuka hingga tidak terbentuk lagi asap. Cawan ditempatkan di dalam tanur dalam keadaan tertutup, kemudian pengabuan dilakukan pada suhu 550 ⁰C hingga diperoleh residu yang berwarna abu-abu. Abu yang telah diperoleh didinginkan di dalam desikator dan ditimbang sampai diperoleh bobot konstan.
Pembuatan Ekstrak Air Kulit Jeruk Siam
Kulit jeruk dibersihkan dan ditambahkan air sebanyak 3 kali bobot bahan kemudian dihancurkan dengan menggunakan blender. Bubur kulit jeruk kemudian disaring dan diambil filtratnya. Filtrat ini disebut ekstrak air kulit jeruk.
Isolasi Pektin dari Kulit Jeruk Siam (Budiyanto dan Yulianingsih 2008) Kulit jeruk dibersihkan dan ditambahkan air sebanyak 3 kali bobot bahan kemudian dihancurkan dengan menggunakan blender. Bubur kulit jeruk diasamkan dengan HCl 0.1 N hingga pH 1.5 dan diekstraksi pada suhu 95 ⁰C selama 40 menit. Campuran yang telah diekstrak disaring menggunakan kain blacu dan diperas untuk memisahkan filtrat dari ampasnya. Filtrat didinginkan hingga suhu kamar kemudian dilakukan pengendapan pektin menggunakan etanol 95% yang telah diasamkan dengan menambahkan 2 mL HCl pekat ke dalam 1 liter etanol. Perbandingan filtrat dan etanol yang ditambahkan adalah 1 : 1.5. Pengendapan dilakukan selama 12 jam. Endapan pektin yang terbentuk disaring dengan menggunakan kain blacu. Endapan pektin tersebut dicuci dengan etanol 95% hingga bebas klorida. Uji klorida dilakukan dengan menambahkan beberapa tetes AgNO3 pada cairan hasil pencucian. Bila masih terbentuk endapan AgCl artinya endapan pektin belum bebas klorida. Pektin basah dikeringkan dalam oven bersuhu 40 ⁰C selama 8 jam. Pektin kering digiling menjadi tepung pektin.
Analisis Spektrum FTIR Pektin
Sampel pektin dan pektin pembanding dicampur dengan KBr dan digerus halus. Campuran tersebut kemudian dijadikan pelet dan diukur spektrumnya menggunakan spektrofotometer FTIR pada bilangan gelombang 4000400 cm-1
.
Penentuan BE Pektin (Ismail et al. 2012)
Penentuan BE pektin dilakukan dengan titrasi asam basa. Sebanyak 0.5 gram sampel pektin ditambahkan 5 mL etanol 95% dan dilarutkan dalam 100 mL air suling bebas karbonat yang berisi 1 gram NaCl. Larutan tersebut dititrasi perlahan-lahan dengan NaOH 0.1 N memakai indikator fenol merah sampai terjadi perubahan warna menjadi merah kekuningan (pH 7.5) yang bertahan minimum 30 detik.
Penentuan Kadar Metoksil Pektin (Ismail et al. 2012)
Larutan netral dari penentuan BE ditambahkan 25 mL NaOH 0.25 N, dikocok dan dibiarkan selama 30 menit pada suhu kamar dalam keadaan tertutup. Selanjutnya ditambahkan 25 mL HCl 0.25 N dan dititrasi dengan NaOH 0.1 N dengan indikator fenol merah sampai titik akhir seperti pada penentuan BE pektin.
Penentuan Kadar Galakturonat dan DE Pektin (Ismail et al. 2012)
5
Uji adsorpsi Pb2+ pada Limbah Buatan oleh Pektin
Sebanyak 0.1, 0.2, 0.5 dan 1.0 g pektin dimasukkan ke dalam 50 mL larutan Pb2+ kemudian diaduk dengan kecepatan konstan pada suhu ruang selama 2 jam. Kadar Pb pada cairan sebelum dan sesudah perlakuan diukur menggunakan AAS pada panjang gelombang 217 nm. Setiap perlakuan dilakukan sebanyak 3 kali ulangan.
Perendaman Daging Kerang Darah dengan Larutan Pb2+
Perlakuan ini bertujuan menaikkan kadar Pb pada daging kerang sehingga pengurangan kadar Pb dapat lebih terlihat setelah perlakuan desorpsi. Daging kerang segar yang direndam dalam larutan Pb2+ dengan perbandingan 1 : 5 (b/v) selama 3 jam. Kemudian daging kerang dipisahkan dari cairandan dibilas dengan air suling.
Desorpsi Pb pada Daging Kerang Darah dengan Larutan Pektin
Larutan pektin 0.2% dibuat dengan melarutkan 0.2 gram pektin dengan air suling hingga volumenya 100 mL. Sebanyak 10 gram daging kerang darah dari perlakuan sebelumnya direndam dalam larutan tersebut selama 60 menit. Daging kerang darah dipisahkan dari cairan dan ditiriskan. Percobaan dilakukan sebanyak 3 kali ulangan.
Desorpsi Pb pada Daging Kerang Darah dengan Ekstrak Air Kulit Jeruk Siam
Sebanyak 10 gram daging kerang direndam dengan 100 mL ekstrak air kulit jeruk selama 60 menit. Daging kerang darah dipisahkan dari cairan dan ditiriskan. Percobaan dilakukan sebanyak 3 kali ulangan.
Analisis kadar Pb pada daging kerang darah dengan AAS
Sampel daging kerang sebelum dan sesudah proses desorpsi ditimbang sebanyak 10 gram lalu dimasukkan ke dalam labu kjehdahl dan ditambahkan 10 mL HNO3 pekat. Proses destruksi dilakukan sampai larutan menjadi jernih. Setelah dingin, campuran disaring dan cairannya dimasukkan ke dalam labu takar 25 mL dan ditera menggunakan HNO3 0.01%. Larutan hasil destruksi diukur absorbansnya dengan AAS pada panjang gelombang 217 nm. Kadar Pb dihitung dengan memasukkan nilai absorbans sampel ke dalam sebuah persamaan linear yang dihasilkan dari pembacaan absorbans standar sebagai fungsi dari konsentrasi. Konsentrasi Pb dinyatakan dalam satuan ppm (mg Pb/kg sampel).
HASIL DAN PEMBAHASAN
Limbah Kulit Jeruk Siam
mencerminkan kandungan mineral pada sampel. Mineral-mineral tersebut antara lain kalsium, besi, magnesium, fosforus, kalium, natrium, dan sulfur (Davios dan Albrigo 1994). Kulit jeruk juga memiliki kadar asam sebesar 0.07%. Keasaman tersebut dipengaruhi oleh adanya asam-asam organik pada kulit jeruk, baik berupa bentuk asam bebas maupun garamnya. Asam yang terdapat pada kulit antara lain asam oksalat, asam malat, asam malonat, dan asam sitrat (Ladaniya 2009). Hasil analisis limbah kulit jeruk selengkapnya dapat dilihat pada Lampiran 2.
Limbah yang dimanfaatkan berupa kulit (albedo dan flavedo) dan bagian kantung buah jeruk (segmen atau locule). Bagian albedo dan locule inilah mengandung senyawaan pektat (Ladaniya 2009). Sampel yang digunakan adalah kulit jeruk siam atau pontianak. Jeruk siam memiliki ciri fisik antara lain kulitnya tipis, agak melekat dan sulit terlepas dari daging buah. Bentuk buah bulat dan licin. Daging buahnya mengandung banyak air (Sarwono 1994). Limbah tersebut umumnya berasal dari buah jeruk yang sudah matang dan kulitnya berwarna hijau kekuningan dengan ukuran yang beragam.
Isolat Pektin Kulit Jeruk Siam
Pektin kulit jeruk siam hasil isolasi berbentuk serbuk kering berwarna putih kekuningan (Gambar 2). Rendemen pektin yang dihasilkan berkisar 8.3113.67% atau rerata 10.18%. Hasil tersebut lebih rendah dibandingkan dengan penelitian Budiyanto dan Yulianingsih (2008) yang melaporkan bahwa limbah kulit jeruk siam yang diekstraksi pada suhu 95 °C selama 40 menit menghasilkan rendemen pektin sebesar 14.89%. Perbedaan tersebut dapat disebabkan oleh perbedaan tingkat kematangan, kesegaran, dan tempat tumbuh buah jeruk. Pada buah yang belum matang, kandungan protopektinnya lebih tinggi. Selama proses pematangan, protopektin secara alami diubah menjadi pektin yang larut dalam air (Winarno 1997).
Gambar 2 Pektin hasil isolasi
Pada penelitian ini, bahan awal yang diekstraksi kulit jeruk segar tanpa pengeringan. Menurut Hariyati (2006), kulit jeruk pontianak atau siam yang segar menghasilkan rendemen pektin lebih tinggi daripada kulit jeruk yang sudah dikeringkan.
7
bertujuan melarutkan ion-ion polivalen, menghidrolisis protopektin yang tidak larut air menjadi pektin yang larut air, dan memisahkannya dari selulosa. Asam yang digunakan dapat berupa asam organik atau asam mineral. Namun asam mineral lebih banyak dipilih karena menghasilkan rendemen yang lebih tinggi. Hal ini berkaitan dengan kekuatan asam mineral yang lebih tinggi daripada asam organik. Meilina (2003) melaporkan bahwa mengekstraksi pektin kulit lemon dengan HCl menghasilkan rendemen yang lebih besar daripada dengan asam sitrat. Suhu tinggi selama ekstraksi dapat mempercepat difusi asam ke dalam dinding sel. Ekstrak dan residu dipisahkan dengan penyaringan. Pektin diendapkan dari ekstrak dengan menggunakan etanol 95%. Etanol akan mendehidrasi pektin dan mengganggu kestabilan koloidnya sehingga pektin terkoagulasi. Pengendap lain yang dapat digunakan adalah isopropanol atau aluminium klorida sebagai pereaksi salting out (Joye dan Luzio 2000). Pektin yang terendapkan dipisahkan dengan cara penyaringan.
Ciri-ciri Pektin Kulit Jeruk Siam Hasil Isolasi
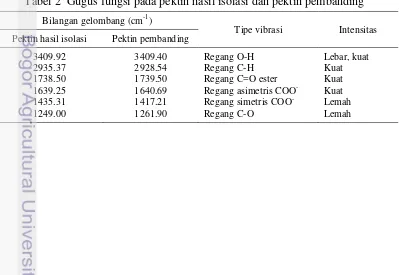
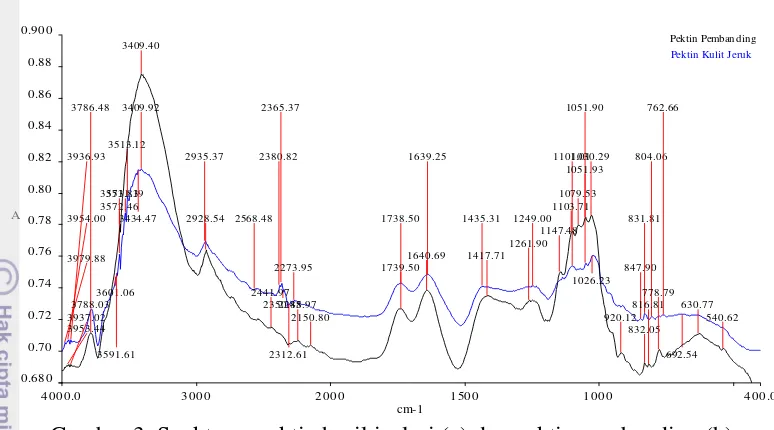
Pektin dicirikan secara kualitatif dan kuantitatif. Analisis kualitatif pektin bertujuan membuktikan bahwa senyawa yang diisolasi adalah pektin melalui analisis gugus fungsi menggunakan spektrofotometer FTIR. Secara umum, spektrum FTIR pektin hasil isolasi mempunyai kemiripan pola dengan pektin pembanding (Gambar 3). Kemiripan tersebut terlihat dari puncak-puncak pada spektrum FTIR pektin hasil isolasi maupun pembanding yang muncul pada bilangan gelombang hampir sama. Kemiripan kedua spektrum tersebut belum dapat membuktikan bahwa senyawa yang diisolasi adalah pektin karena pembanding yang digunakan juga merupakan hasil isolasi bukan pektin standar atau pektin komersial. Namun, pada spektrum pektin hasil isolasi dan pembanding muncul puncak-puncak serapan yang mencerminkan gugus-gugus fungsi yang khas pada senyawa pektin, antara lain regang –OH, regang C=O ester, dan regang COO-. Hasil analisis gugus fungsi pada pektin hasil isolasi dan pembanding disajikan pada Tabel 2.
Tabel 2 Gugus fungsi pada pektin hasil isolasi dan pektin pembanding Bilangan gelombang (cm-1)
Tipe vibrasi Intensitas Pektin hasil isolasi Pektin pembanding
Gambar 3 Spektrum pektin hasil isolasi (a) dan pektin pembanding (b) Spektrum pektin hasil isolasi juga memiliki kemiripan dengan spektrum pektin komersial pada penelitian Gnanasambandam dan Proctor (2000). Pada spektrum pektin komersial juga muncul puncak regang –OH, regang C=O ester, dan regang COO- pada bilangan gelombang yang tidak jauh berbeda dengan pektin hasil isolasi. Hal ini memperkuat dugaan bahwa senyawa yang diisolasi adalah pektin. Spektrum FTIR pektin komersial dan hasil analisis gugus fungsi pada pektin komersial tersebut disajikan pada Gambar 4 dan Tabel 3.
9
Tabel 3 Gugus fungsi pada pektin komersial (Gnanasambandam dan Proctor 2000)
Bilangan gelombang (cm-1) Tipe vibrasi Intensitas
36002500 Regang O-H Lebar, kuat 30002800 Regang C-H Kuat 17601745 Regang C=O ester Kuat 16401620 Regang asimetris COO- Kuat 1400 Regang simetris COO- Lemah 1380 Tekuk C-H Lemah 13001000 Regang C-O Lemah
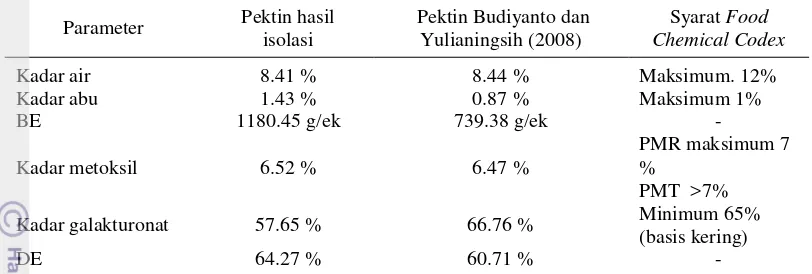
Pencirian pektin secara kuantitatif meliputi penentuan kadar air, kadar abu, BE, kadar metoksil, kadar galakturonat, dan DE. Hasil analisis tersebut dapat dilihat pada Lampiran 3. Hasil analisis menunjukkan bahwa pektin kulit jeruk siam hasil isolasi termasuk pektin metoksil rendah karena memiliki kadar metoksil 7%. Hasil ini sesuai dengan penelitian Budiyanto dan Yulianingsih (2008) yang melaporkan bahwa pektin ampas jeruk siam termasuk pektin metoksil rendah.
Kadar air pektin sesuai dengan persyaratan Food Chemical Codex. Namun, kadar abu dan kadar galakturonat pektin hasil isolasi tidak sesuai dengan persyaratan Food Chemical Codex. Kadar abu pektin sebesar 1.43%. Hasil ini lebih tinggi dari pada persyaratan Food Chemical Codex. Bahan baku dan pereaksi yang memiliki jumlah mineral yang tinggi akan menghasilkan pektin dengan kadar abu tinggi. Selama ekstraksi, asam dapat melarutkan mineral. Mineral tersebut ikut terendapkan bersama pektin saat penambahan etanol. Banyaknya mineral yang larut tergantung pada kekuatan asam yang digunakan saat ekstraksi. Kadar abu pada pektin meningkat dengan bertambahnya kekuatan asam (Kalaphaty dan Proctor 2001).
Kadar galakturonat menunjukkan jumlah unit asam D-galakturonat pada rantai pektin. Kadar galakturonat pektin hasil isolasi sebesar 57.65%. Hasil ini lebih rendah daripada persyaratan Food Chemical Codex. Kadar galakturonat mencerminkan kemurnian pektin. Selain unit asam D-galakturonat, pektin juga memiliki sejumlah gula-gula netral seperti ramnosa, galaktosa, dan xilosa yang merupakan rantai cabang pektin (Fishman 1988).
Tabel 4 Ciri-ciri pektin kulit jeruk siam dan persyaratan mutu pektin
Keterangan: PMR = Pektin metoksil rendah; PMT = Pektin metoksil tinggi
Nilai Adsorpsi (%), Kapasitas Adsorpsi (q), dan Konstanta Kesetimbangan Adsorpsi (K)
Nilai adsorpsi Pb2+ oleh pektin dihitung sebagai perbandingan antara kadar Pb2+ yang terjerap dan kadar awal Pb2+ pada cairan. Kadar Pb2+ yang terjerap meningkat dengan bertambahnya bobot pektin yang ditambahkan walaupun peningkatannya tidak linear. Hal ini menyebabkan nilai q pektin menurun seiring meningkatnya bobot. Nilai q merupakan banyaknya Pb yang dapat dijerap oleh pektin per satuan bobot. Hasil analisis juga menunjukkan bahwa penggunaan pektin sebanyak 0.1 gram paling baik dari segi efektivitasnya karena menghasilkan nilai q yang paling besar. Nilai K merupakan perbandingan antara jumlah Pb yang dijerap oleh pektin per satuan bobot dan kadar Pb yang tersisa pada cairan saat kesetimbangan. Pada kondisi suhu yang sama, seharusnya nilai K ini tetap pada setiap perlakuan. Nilai K yang didapat berbeda pada masing-masing perlakuan, namun perbedaannya tidak terlalu besar. Nilai adsorpsi, q, dan K disajikan pada Tabel 5.
11
(Dronnet et al. 1996). Pengikatan ion logam bivalen oleh pektin ditunjukkan pada Gambar 5.
Gambar 5 Pengikatan logam bivalen oleh pektin (Srivastava dan Malviya 2011) Selain Pb, pektin juga dapat menjerap ion logam bivalen lainnya. Namun selektivitas pengikatan pektin terhadap Pb lebih besar daripada kation bivalen lainnya. Urutan selektivitas tersebut adalah Pb2+ Cu2+ > Zn2+ > Cd2+ Ni2+ > Ca2+. Hal ini berkaitan dengan stabilitas kompleks kation logam dengan gugus pendonor oksigen. Stabilitas kompleks tersebut menurun mulai dari Pb2+ > Cu2+ > Zn2+Ni2+ > Cd2+ > Ca2+ (Dronnet et al. 1996).
Nilai Desorpsi Pb Ekstrak Air dan Pektin Kulit Jeruk Siam
Kerang darah didapat dari Pasar Anyar Bogor dan berasal dari Muara Angke, Jakarta. Ukuran kerang darah beragam mulai dari 2 1.5 cm sampai 3 2.5 cm (Gambar 6).
Gambar 6 Kerang darah
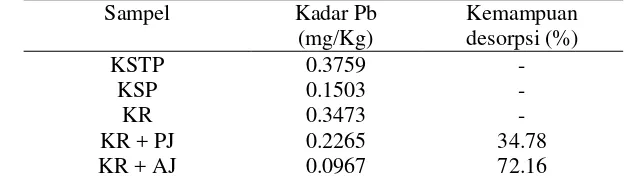
Tabel 6 Kadar Pb pada daging kerang darah sebelum dan sesudah proses desorpsi (tanpa perendaman dengan larutan Pb)
Sampel Kadar Pb dan daging kerang rebus kurang dari 0.5 mg/kg atau di bawah 0.3 mg/L (standar Pb terkecil) (Lampiran 5). Hal ini menunjukkan bahwa kadar Pb pada kerang darah yang berasal dari Pasar Anyar tidak melewati ambang batas yang ditetapkan oleh SNI (BSN 2009), yaitu maksimum 1.5 mg/kg. Kadar Pb tersebut lebih rendah bila dibandingkan dengan kerang darah yang didapat dari perairan Tanjung Bunga Makassar (Jalaludin dan Ambeng 2005) dan Pasar Ikan Muara Angke yaitu sebesar 5.282 mg/kg (Nurjanah et al. 1999) dan 12.40 mg/kg (Hayati 2012). Hasil pengukuran juga menunjukkan bahwa kerang rebus memiliki kadar Pb yang lebih rendah daripada kerang segar. Hal ini disebabkan karena Pb bersifat larut dalam air panas. Namun bila dilihat dari nilai absorbans sampel, hasil pengukuran kadar Pb pada percobaan ini sebenarnya tidak dapat dipastikan karena semua nilai absorbans sampel berada di bawah daerah linearitas kurva standar sehingga hasil yang diperoleh belum tentu tepat. Kadar Pb dihitung berdasarkan asumsi bahwa daerah di bawah kurva standar memiliki linearitas yang sama dengan linearitas kurva standar. Nilai absorbans sampel sebenarnya dapat ditingkatkan dengan meningkatkan bobot sampel.
Pada kondisi percobaan yang lain, sebelum dilakukan proses desorpsi daging kerang darah direndam terlebih dahulu di dalam larutan Pb2+. Hal ini dilakukan agar kadar Pb sebelum dan sesudah desorpsi dapat diukur dan diketahui secara tepat. Hasil pengukuran kadar Pb pada daging kerang darah pada kondisi ini (Lampiran 6) lebih baik daripada kondisi sebelumnya (tanpa perendaman dalam larutan Pb2+). Kedua perlakuan desorpsi dapat menurunkan kadar Pb pada kerang darah. Perendaman dengan ekstrak air kulit jeruk siam dapat menghilangkan Pb sebesar 46.05%, sedangkan larutan pektin 0.2% sebesar 48.02%. Kadar Pb pada daging kerang darah sebelum dan setelah proses desorpsi disajikan pada Tabel 7.
Tabel 7 Kadar Pb pada daging kerang darah sebelum dan sesudah proses desorpsi (dengan perendaman dengan larutan Pb)
Perlakuan
Ekstrak air kulit jeruk siam 8.8050 4.7507 46.05
Larutan pektin 0.2% 8.8050 4.5771 48.02
13
kulit jeruk siam. Sampel yang digunakan adalah kulit jeruk siam yang sudah matang sehingga ada kemungkinan sejumlah protopektin telah berubah menjadi pektin yang larut air selama proses pematangan (Winarno 1997). Selain itu, kulit jeruk juga mengandung asam organik yang larut air seperti asam sitrat. Asam sitrat pada sari buah jeruk nipis telah diketahui dapat mengurangi kadar Pb pada udang windu (Armanda 2009) dan ikan (Nurdiani 2012). Selain asam sitrat, kulit jeruk juga mengandung asam oksalat, asam malat, dan asam malonat (Ladaniya 2009). Sama seperti pektin, asam-asam tersebut memiliki gugus karboksilat yang dapat mengikat Pb dari daging kerang darah. Asam oksalat, asam malat, dan asam malonat memiliki 2 gugus karboksilat pada setiap molekulnya, sedangkan asam sitrat memiliki 3 gugus karboksilat.
Pada habitat aslinya, kerang darah terpapar Pb dalam waktu yang cukup lama. Logam berat seperti Pb akan terakumulasi dan berikatan dengan senyawa organik yang ada pada tubuh kerang. Pada percobaan ini, kerang darah sengaja dipapar Pb selama 3 jam sehingga kemungkinan Pb hanya masuk ke dalam pori-pori permukaan daging. Hal ini menyebabkan sebagian besar Pb yang terdesorpsi pada kedua perlakuan diduga berasal dari permukaan daging kerang darah.
SIMPULAN DAN SARAN
Simpulan
Ekstrak air kulit jeruk siam dan larutan pektinnya dapat menurunkan kadar Pb pada kerang darah. Kemampuan larutan pektin menurunkan kadar Pb pada kerang darah lebih besar dibandingkan dengan ekstrak air. Perendaman dengan ekstrak air kulit jeruk dapat menghilangkan Pb sebesar 46.05%, sedangkan larutan pektin 0.2% sebesar 48.02%. Pektin termasuk pektin metoksil rendah dengan kadar metoksil 6.52%
Saran
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington (US): Association of Official Analytical Chemist, Inc.
Armanda F. 2009. Studi pemanfaatan buah jeruk nipis (Citrus aurantifolia
Swingle) sebagai chelator logam Pb dan Cd dalam udang windu (Penaeus monodon) [skripsi]. Medan (ID): Universitas Sumatera Utara.
[BPS] Badan Pusat Statistik. 2012. Produksi Buah-buahan di Indonesia. [internet] [diacu 2013 Januari 4]. Tersedia dari: http://bps.go.id/tab_sub/view. php?kat=3&tabel=1&daftar=1&id_subyek=55¬ab=4.
[BSN] Badan Standardisasi Nasional. 2009. SNI 7387:2009 Batas Maksimum Cemaran Logam Berat dalam Pangan. Jakarta (ID): Badan Standardisasi Nasional.
Budiyanto A, Yulianingsih. 2008. Pengaruh suhu dan waktu ekstraksi terhadap karakter pektin dari ampas jeruk siam (Citrus nobilis L). J Pascapanen
5(2):37-44.
Darmono. 1995. Logam Dalam Sistem Biologi Makhluk Hidup. Jakarta (ID): UI Press.
Davies FS, Albrigo LG. 1994. Citrus. Wallingford (GB): CAB International. Direktorat Hortikultura Kementrian Pertanian RI. 2012. Volume Ekspor Impor
Total Buah 2011. [internet] [diacu 2013 Januari 28]. Tersedia dari: http://hortikultura.deptan.go.id/?q=node/397.
Dronet VM, Renard CMGC, Axelos MAV, Thibault JF. 1996. Characterisation and selectivity of divalent metal ions binding by citrus and sugar beet pectins. Carbohydrate Polymer 30:253-263.
Erliza, Setyadjit, Setiabudi DA. 2007.Ultrafiltrasi untuk menghilangkan limonin dan naringin serta reverse osmosis untuk pemekatan pada produksi konsentrat jus jeruk siam (Citrus nobilis L var. microcarpa). Ringkasan Eksekutif Hasil-hasil Penelitian 2007:164-165.
Fishman ML. 1988. Physical and Chemical Properties of Pectin. Philadelphia (US): US Departement of Agriculture.
Fitriani V. 2003. Ekstraksi dan karakterisasi pektin dari kulit jeruk lemon (Citrus medica var Lemon) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Food Chemical Codex. 1996. Pectins. [internet] [diacu 2012 Desember 28]. Tersedia dari: http://arjournals.annualreviews.org/doi/abs/10.1146/annurev. bi.20.070151. 000435.
Gnanasambandam R, Proctor A. 2000. Determination of pectin degree of esterification by diffuse reflectance Fourier transform infrared spectroscopy.
Food Chemistry 68:327-332.
Harel P, Mignot L, Sauvage JP, Junter GA. 1998. Cadmium removal from dilute aqueous solution by gel beads of sugar beet pectin. Industrial Crops and Product 7:210-247.
15
Hayati A. 2012. Pengaruh perendaman asam organik terhadap kelarutan mineral kerang darah (Anadara granosa) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Inswiasri, Tugaswati TA, Lubis A. 1997. Kadar logam Cu, Pb, Cd, dan Cr dalam ikan segar dan kerang dari Teluk Jakarta tahun 1995/1996. Bul Penelit Kesehat 25(1):19-26.
Ismail NSM, Ramli N, Hani NM, Meon Z. 2012. Extraction and characterization of pectin from dragon fruit (Hylocereus polyrhizus) using various Extraction condition. Sains Malaysiana 41(1):41–45.
Jalaluddin MN, Ambeng. 2005. Analisis logam berat (Pb, Cd, dan Cr) pada kerang laut (Hiatula chinensis, Anadara granosa, dan Marcia optima).
Marina Chimica Act 6 (2):17-20.
Joye DD, Luzio GA. 2000. Process for selective extraction of pectins from plant material by differential pH. Carbohydrate Polymers 43:337-342.
Kalapathy U, Proctor A. 2001. Effect of acid extraction and alcohol precipitation condition on the yield and purity of soy hull pectin. Food Chemistry 73: 393-396.
[KKP] Kementerian Kelautan dan Perikanan. 2012. Statistik Tangkap Perairan Laut. [internet] [diacu 2013 Agustus 26]. Tersedia dari: http://statistik.kkp.go.id.
Ladaniya MS. 2009. Citrus Fruit: Biology, Technology, and Evaluation. London (GB): Elsevier.
Manahan SE. 2005. Environmental Chemistry. Ed. VIII. Boca Raton: CRC Press.. Meilina H. 2003. Produksi pektin dari kulit jeruk lemon (Citrus medica var.
Lemon) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Nurdiani D. 2012. Ekstrak Jeruk Nipis (Citrus aurantifolia) Dapat Menurunkan Kadar Logam (Pb dan Cd) Pada Ikan. [internet] [diacu 2013 Agustus 27]. Tersedia dari: http://vedca.siap.web.id/2012/03/14/.
Nurjanah, Hartanti, Nitibaskara RR. 1999. Analisa kandungan logam berat Hg, Cd, Pb, As, dan Cu dalam tubuh kerang konsumsi. Buletin THP 1 (4):28-31. Sarwono B. 1994. Jeruk dan Kerabatnya. Jakarta (ID): Penebar Swadaya.
Sirait M. 2007. Penuntun Fitokimia dalam Farmasi. Bandung (ID): Penerbit ITB. Srivastava P, Malviya R. 2011. Source of pectin, extraction, and its application in
pharmaceutical industry – An overview. Indian Journal of Natural Product and Resources 2(1):11-18.
Ranganna S. 1977. Manual Analysis and Vegetable Products. New Delhi (IN): Mc-Graw Hill.
Wong WW, AlKarkhi AFM, Easa AM. 2010. Comparing biosorbent ability of modified citrus and durian rind pectin. Carbohydrate Polymer 79:584-589. doi: 10.1016/j.carbpol.2009.09.018.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta (ID): PT Gramedia Pustaka
LAMPIRAN
17
Lampiran 2 Hasil analisis kulit jeruk siam
(a)Kadar air ampas jeruk siam
Perlakuan Ulangan ke-
1 2 3
Bobot wadah kosong (a) 1.9119 3.8506 1.9790 Bobot wadah + sampel
Sebelum pengeringan (b) 3.9134 5.9333 4.0111 Setelah pengeringan ke-1 2.3205 4.2934 2.4271 Setelah pengeringan ke-2 2.3109 4.2810 2.4106 Setelah pengeringan ke-3 2.3086 4.2780 2.4078 Setelah pengeringan ke-4 (c) 2.3060 4.2760 2.4062
Kadar air (%) 80.31 79.57 78.98
Rerata (%) 79.62
Contoh perhitungan:
adar air a
. g . g . g . g .
(b)Kadar abu kulit jeruk siam
Perlakuan Ulangan ke-
1 2 3
Bobot wadah kosong (a) 23.4240 22.6114 27.6174 Bobot wadah + sampel
Sebelum pengabuan (b) 26.2308 25.6572 30.6017 Setelah pengabuan ke-1 23.4458 22.6367 27.6379 Setelah pengabuan ke-2 23.4450 22.6354 27.6374 Setelah pengabuan ke-3 (c) 23.4451 22.6361 27.6374 Kadar abu (%) 0.76 0.81 0.67
Rerata (%) 0.75
Contoh perhitungan:
adar a u a
a
. g . g
(c) Kadar asam kulit jeruk siam Ulangan
ke- Bobot sampel (g) Volume titran (mL) Kadar asam (%)
1
33.3350
0.60 0.07
2 0.70 0.08
3 0.60 0.07
Rerata 0.07
Contoh perhitungan:
adar asam volume NaOH m N NaOH
o ot kulit jeruk mg
19
Lampiran 3 Hasil analisis pektin hasil isolasi
(a) Rendemen pektin
Bobot wadah kosong (a) 28.5981 30.6394 26.8091 Bobot wadah + sampel
(c) Kadar abu pektin
Perlakuan Ulangan ke-
1 2 3
Bobot wadah kosong (a) 28.5981 30.6394 26.8091 Bobot wadah + sampel
Sebelum pengabuan (b) 29.0983 31.1395 27.3093 Setelah pengabuan ke-1 28.6049 30.6443 26.8152 Setelah pengabuan ke-2 28.6062 30.6456 26.8167 Setelah pengabuan ke-3 28.6072 30.6463 26.8170 Setelah pengabuan ke-4 28.6064 30.6456 26.8161 Kadar abu (%) 1.66 1.24 1.40
Rerata (%) 1.43
Contoh perhitungan:
adar a u a
a
. g . g
. g . g .
(d)Bobot ekuivalen pektin
Ulangan ke- Bobot pektin (g) Volume titran (mL) BE (g/ek)
1 0.5004 4.20 1198.62 2 0.5002 4.20 1198.14 3 0.5006 4.40 1144.59
Rerata 1180.45
Contoh perhitungan:
volume NaOH m N NaOH o ot pektin g
. m . mek m . g . g ek
(e) Kadar metoksil
Ulangan ke- Bobot pektin (g) Volume titran (mL) Kadar metoksil (%)
1 0.5004 10.40 6.40
2 0.5002 10.80 6.65
3 0.5006 10.60 6.52
21
Contoh perhitungan:
adar metoksil volume NaOH m N NaOH metoksil o ot pektin mg
. m . N mg mek . mg .
(f)Kadar galakturonat dan derajat esterifikasi pektin
Ulangan ke- Kadar galakturonat (%) Derajat esterifikasi(%)
1 56.63 64.16
2 58.19 64.88
3 58.14 63.67
Rerata 57.65 64.27
Contoh perhitungan:
adar galakturonat mek NaOH o ot pektin mg – o ot air – o ot a u mek NaOH metoksil asam pektat
. N . m . m mg mek . mg . . mg .
Derajat esterifikasi kadar galakturonat g ekkadar metoksil g ek
Lampiran 4 Hasil analisis uji adsorpsi Pb pada limbah buatan oleh pektin
(a) Bobot pektin
Perlakuan Bobot pektin (g)
1 2 3
0.1 g 0.1004 0.1002 0.1001 0.2 g 0.2005 0.2002 0.2006 0.5 g 0.5006 0.5006 0.5000 1 g 1.0003 1.0000 1.0001
(b) Nilai absorbans standar Pb
Konsentrasi (ppm) Absorbans
2.0000 0.0898 4.0000 0.1768
7.0000 0.2903
10.0000 0.3917 12.0000 0.4615
(c) Kurva standar Pb
y = 0.0368x + 0.0243 r = 0.9990
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
0.0000 2.0000 4.0000 6.0000 8.0000 10.0000 12.0000 14.0000
A
b
sor
b
an
s
23
(d) Nilai adsorpsi (%), kapasitas adsorpsi (q), dan konstanta adsorpsi (K)
Perlakuan
Kontrol 1 digunakan untuk perlakuan 0.1 dan 0.2 g Kontrol 2 digunakan untuk perlakuan 0.5 dan 1.0 g
Lampiran 5 Kadar Pb pada daging kerang darah sebelum dan setelah proses desorpsi dengan air kulit jeruk siam dan pektin (tanpa perendaman dalam larutan Pb)
(a) Nilai absorbans standar Pb 1
Konsentrasi (ppm) Absorbans
(c) Kadar Pb pada kerang darah pada berbagai perlakuan Kode
sampel Bobot (g) Absorbans
Kadar Pb
0.0000 2.0000 4.0000 6.0000 8.0000 10.0000 12.0000
25
Keterangan:
KSTP = Kerang segar tanpa pencucian KSP = Kerang segar dengan pencucian KR = Kerang rebus
KR + PJ = Kerang rebus setelah direndam larutan pektin
KR + AJ = Kerang rebus setelah sirendam ekstrak air kulit jeruk siam
Contoh perhitungan:
y = 0.0439x - 0.0013 0.0061 = 0.0439x - 0.0013
x = (0.0061 + 0.0013)/ 0.0439
x = 0.1686 mg/L
Dalam 25 ml, bobot Pb = (25 ml/1000 ml) 0.1686 mg = 0.0042mg
Kadar Pb = bobot Pb (mg)/bobot sampel (kg) = 0.0042 mg/10.0524 10-3
kg = 0.4195 mg/kg
Desorpsi kadar P se elum perlakuan – kadar P setelah perlakuankadar P se elum perlakuan . mg kg– . mg kg
Lampiran 6 Kadar Pb pada daging kerang darah sebelum dan setelah proses desorpsi dengan air kulit jeruk siam dan pektin (dengan perendaman dalam larutan Pb)
(a) Nilai absorbans standar Pb 2
Konsentrasi (ppm) Absorbans
(c) Kadar Pb pada kerang darah pada berbagai perlakuan Kode
sampel Bobot (g) Absorbans
Faktor
0.0000 2.0000 4.0000 6.0000 8.0000 10.0000
Abs
o
rba
ns
27
Keterangan:
KS = kerang segar
KSA = kerang setelah direndam Pb KPJ = kerang setelah direndam pektin
KAJ = kerang setelah direndam ekstrak air kulit jeruk siam
Contoh perhitungan:
y = 0.0445x + 0.0062 0.1515 = 0.0445x + 0.0062
x = (0.1515 - 0.0062070)/ 0.0445
x = 3.2619 mg/L
Dalam 25 ml, bobot Pb = (25 ml/1000 ml) 3.2619 mg = 0.0815 mg
Kadar Pb = bobot Pb (mg)/bobot sampel (kg) = 0.0815 mg/10.0592 10-3
kg = 8.1068 mg/Kg
Desorpsi kadar P SA – kadar P setelah perlakuankadar P se elum perlakuan . mg kg– . mg kg
RIWAYAT HIDUP
Penulis lahir di Karawang pada 11 Agustus 1990. Penulis merupakan anak pertama dari 2 bersaudara dari pasangan Ahmad omaruddin dan Siti Sa’adah Sastradidjaja. Penulis lulus dari SMP Negeri 1 Klari pada tahun 2005 dan lulus dari SMAK bogor pada 2009. Penulis melanjutkan studi di Departemen Kimia Institut Pertanian Bogor pada tahun 2009 melalui jalur USMI.
Selama menjadi mahasiswa, penulis pernah menjadi staf Departemen Pengembangan Usaha Kimia Ikatan mahasiswa kimia (IMASIKA) periode 2010-2011. Penulis juga pernah menjadi asisten praktikum pada mata kuliah Kimia TPB (2010), Elektroanalitik dan Teknik Pemisahan (2012), Kimia Biologis (2012), dan Teknik Pemisahan (2013).