DESORPSI LOGAM Pb DARI KERANG DARAH
(
Anadara granosa
) MENGGUNAKAN EKSTRAK AIR DAN
PEKTIN KULIT PISANG KEPOK (
Musa paradisiaca
)
KARTIKA EKASARI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
2
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Desorpsi Logam Pb dari Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air dan Pektin Kulit Pisang Kepok (Musa paradisiaca) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
2
ABSTRAK
KARTIKA EKASARI. Desorpsi Logam Pb dari Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air dan Pektin Kulit Pisang Kepok (Musa paradisiaca). Dibimbing oleh ETI ROHAETI dan LATIFAH K DARUSMAN.
Pencemaran Pb pada bahan pangan seperti daging kerang darah perlu ditanggulangi sebab Pb bersifat karsinogenik. Keamanan bahan pangan dari berbagai bahaya pencemar perlu diupayakan. Penelitian ini bertujuan memanfaatkan ekstrak air dan larutan pektin dari limbah kulit pisang kepok (Musa paradisiaca) sebagai media untuk mendesorpsi kandungan Pb dari daging kerang darah (Anadara granosa). Ekstrak air diperoleh dengan cara menghancurkan kulit pisang dengan air (1:3). Pektin diperoleh dengan cara mengekstraksi kulit pisang menggunakan air pada pH 2 dengan suhu 90 °C selama 1 jam dan mengendapkan pektin terlarut dengan menambahkan etanol 96%. Diperoleh pektin dengan rendemen 3% (b/b) dengan kadar air 13.9%, kadar abu 4.2%, bobot ekuivalen 1755 g/ek, kadar metoksil 1.40 %, kadar galakturonat 18%, dan derajat esterifikasi 44%. Kemampuan larutan pektin 0.20% untuk mendesorpsi Pb dari kerang sebesar 51%, lebih rendah daripada desorpsi ekstrak air sebesar 58%.
Kata kunci: desorpsi Pb, kerang darah, kulit pisang kepok, pektin
ABSTRACT
KARTIKA EKASARI. Desorption of Lead from Blood Cockle (Anadara granosa) Using Water Extract and Pectin Extract of Kepok Peels (Musa paradisiaca). Supervised by ETI ROHAETI and LATIFAH K DARUSMAN.
Lead pollutant on foodstuffs such as in meat blood cockle must be solved because lead is carcinogenic. Efforts for foodstuff safety from various pollutants must be supported. The objectives of this research were utilizing water extract and pectin solution from waste of kepok peels (Musa paradisiaca) as the medium for desorption lead from blood cockle (Anadara granosa). Water extract was obtained by destructing kepok peels with water (1:3). Pectin was obtained by extracting kepok peels using water at pH 2, temperature 90 °C for 1 hour, and precipitated the dissolved pectin by adding 96% ethanol. The pectin yield was 3% (b/b) with loss on drying 13.9%, ash content 4.2%, equivalent weight 1755 g/eq, methoxyl 1.40%, galacturonic acid 18%, and degree of esterification 44%. The ability of 0.20% pectin solution for desorption lead from sample was 51%, which was lower than that by using water extract of 58%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DESORPSI LOGAM Pb DARI KERANG DARAH
(
Anadara granosa
) MENGGUNAKAN EKSTRAK AIR DAN
PEKTIN KULIT PISANG KEPOK (
Musa paradisiaca
)
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
4
Judul Skripsi : Desorpsi Logam Pb dari Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air dan Pektin Kulit Pisang Kepok (Musa paradisiaca)
Nama : Kartika Ekasari NIM : G44090102
Disetujui oleh
Dr Eti Rohaeti, MS Prof Dr Ir Latifah K Darusman, MS
Pembimbing I Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
6
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya
ilmiah yang berjudul “Desorpsi Logam Pb dari Kerang Darah (Anadara granosa) Menggunakan Ekstrak Air dan Pektin Kulit Pisang Kepok (Musa paradisiaca)”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Maret hingga Juli 2013 di Bagian Kimia Analitik, Departemen Kimia, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih atas semua bimbingan, dukungan, dan kerja sama yang telah diberikan oleh Ibu Dr Eti Rohaeti, MS selaku pembimbing I dan Ibu Prof Dr Ir Latifah K Darusman, MS selaku pembimbing II. Terima kasih pula kepada staf Bagian Kimia Analitik yang telah membantu selama penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, adik, serta keluarga atas segala doa, dukungan, dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat. Terima kasih.
Bogor, Oktober 2013
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Pembuatan Ekstrak Air Kulit Pisang Kepok 3
Pembuatan Larutan Pektin 0.20% dari Kulit Pisang Kepok 3
Analisis Pektin Kulit Pisang Kepok 4
Desorpsi Pb 4
Pengukuran Kadar Pb 6
HASIL DAN PEMBAHASAN 6
Hasil Pencirian Pektin 7
Pencirian Kualitatif Pektin Hasil Isolasi 9
Desorpsi Pb dari Daging Kerang Darah 9
SIMPULAN DAN SARAN 12
Simpulan 12
Saran 12
DAFTAR PUSTAKA 12
LAMPIRAN 15
vii
DAFTAR TABEL
1 Rendemen pektin 2 jenis bahan baku 6
2 Hasil pencirian pektin 8
3 Persentase Pb terdesorpsi dari daging kerang darah akibat pencucian,
perebusan, dan perendaman 10
4 Persentase Pb terdesorpsi dari daging kerang perlakuan Pb (KPb)
sebelum dan sesudah perendaman 11
DAFTAR GAMBAR
1 Struktur kimia pektin 1
2 Bagan alir metode penelitian 3
3 Kerang darah segar 5
4 Rancangan preparasi sampel kerang perlakuan Pb (KPb) 5 5 Pektin dari kulit pisang segar dan pektin dari kulit pisang setelah 2 hari 7 6 Spektrum FTIR pektin kulit pisang dibandingkan dengan pektin
komersial 9
7 Pengikatan logam berat oleh pektin 11
DAFTAR LAMPIRAN
1 Perhitungan rendemen pektin 15
2 Kadar air kulit pisang segar 15
3 Kadar air pektin hasil isolasi 15
4 Kadar abu pektin hasil isolasi 16
5 Penentuan bobot ekuivalen pektin 16
6 Penentuan kadar metoksil pektin 16
7 Penentuan % asam galakturonat dan derajat esterifikasi pektin 17
8 Grafik linearitas kurva standar Pb (1) 17
9 Hasil pengukuran kadar Pb pada daging kerang darah tanpa pencucian,
dengan pencucian, dan daging kerang rebus 18
10 Grafik linearitas kurva standar Pb (2) 19
1
PENDAHULUAN
Kulit pisang merupakan bahan potensial yang belum termanfaatkan dengan baik. Pisang tumbuh baik di daerah beriklim tropis termasuk Indonesia. Pisang merupakan tanaman holtikultura yang berbuahnya sepanjang tahun tanpa mengenal musim. Produksi pisang di Indonesia pada tahun 2012 mencapai 6,071,043 ton pertahun (BPS 2013). Selama ini, tanaman pisang hanya dimanfaatkan bagian buah, batang, dan daunnya saja. Sementara kulit pisang hanya digunakan sebagai makanan ternak dan penghasil alkohol (Rukmana 1999). Pemanfaatan kulit pisang belum maksimal dan banyak diketahui, padahal bobot kulit pisang dapat mencapai 40% dari buahnya (Tchobanoglous et al. 2003).
Diketahui bahwa kulit pisang dapat dimanfaatkan sebagai biosorben. Salah satu contoh pemanfaatannya, yaitu untuk meningkatkan kualitas minyak goreng bekas dengan menurunkan kadar airnya sebesar 45.98% (Kasyfita 2007). Selain itu, Ashraf et al. (2011) melaporkan bahwa biomassa kulit pisang dalam bentuk larutan dengan konsentrasi 25 mg/mL dapat menghilangkan 94.80% Pb, 86.81% Cu, 84.63% Zn, dan 82.36% Ni.
Penggunaan kulit pisang sebagai biosorben dikarenakan kandungan pektin dan selulosanya. Menurut Chanakya et al. (2008) kandungan kulit pisang sekitar 80% disusun oleh selulosa, hemiselulosa, dan pektin. Selulosa dan pektin memiliki gugus hidroksil, hal inilah yang menyebabkan kulit pisang memiliki potensi yang cukup baik sebagai adsorben logam berat melalui mekanisme pertukaran ion (Yantri 1998).
Beberapa penelitian telah melaporkan bahwa pektin memiliki kemampuan dalam menjerap logam berat. Wong et al. (2008) memanfaatkan pektin yang berasal dari kulit durian untuk menjerap logam Pb, Cd, Cu, Zn, dan Ni. Selanjutnya Mata et al. (2009) melaporkan bahwa laju biosorpsi logam berat oleh pektin, yaitu Cu>Pb>Cd. Kemampuan menjerap logam berat oleh pektin dikarenakan pektin memiliki gugus karboksil, sehingga proses pertukaran ion H+ dari gugus karboksil dengan ion logam dapat terjadi (Hariyati 2006). Adapun struktur kimia pektin dapat dilihat pada Gambar 1.
n
Gambar 1 Struktur kimia pektin (Khazaei et al. 2013)
2
kulit pisang juga dapat dilakukan secara enzimatik menggunakan enzim α-amilase dengan suhu 85.5 oC, pH 1.5, waktu ekstraksi 2 jam menghasilkan rendemen sebesar 1.06%, seperti penelitian yang dilakukan oleh Qiu et al. (2010).
Kerang merupakan sumber bahan makanan yang potensial tercemari oleh logam berat. Hal ini dikarenakan kerang memiliki mobilitas yang rendah dan tahan terhadap pencemaran lingkungan (Darmono 2001). Persyaratan mutu dan keamanan pangan Standar Nasional Indonesia (SNI) No. 3460.1-2009 untuk daging kerang yang dikonsumsi manusia kandungan maksimum yang boleh ada, yaitu untuk Pb 1 mg/kg, Hg 0.5 mg/kg, dan Cd 1 mg/kg (BSN 2009). Berdasarkan pemaparan inilah maka perlu ada upaya untuk menghilangkan logam berat dari kerang melalui proses desorpsi yang tentunya juga aman bagi manusia sebagai konsumen.
Kulit pisang memiliki kandungan pektin yang dapat digunakan sebagai media desorpsi logam berat yang terjerap pada kerang, contohnya kerang darah (Anadara granosa). Suyono (2006) menjelaskan bahwa logam berat seperti Pb, Zn, dan Cu dapat terikat pada daging kerang pada bagian jaringan lendir insang yang dapat mengakibatkan rusaknya fungsi insang dalam menyaring makanan. Diketahui bahwa kulit pisang sendiri sudah dapat dimanfaatkan sebagai biosorben, oleh karena itu penelitian ini dilakukan untuk membandingkan ekstrak air kulit pisang dan pektin hasil isolasi dari kulit pisang dalam mendesorpsi logam berat, yaitu Pb pada daging kerang darah (Anadara granosa). Kulit pisang yang digunakan, yaitu pisang kepok yang banyak diperoleh dari masyarakat.
METODE
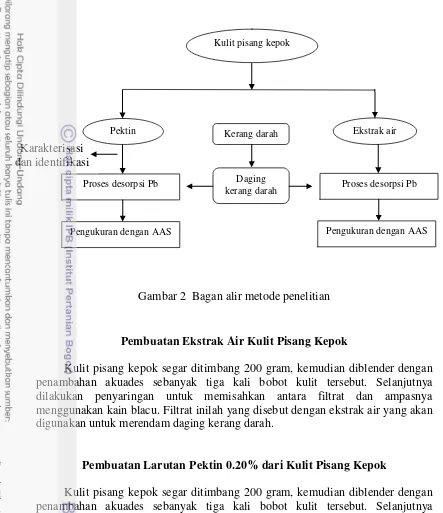
Penelitian ini terbagi dalam 5 tahap, yaitu pembuatan ekstrak air kulit pisang kepok, ekstraksi pektin dari kulit pisang kepok, karakterisasi pektin, proses desorpsi Pb dari kerang darah, serta proses pengukurannya menggunakan spektrofotometer serapan atom (AAS). Pektin diidentifikasi menggunakan spektrofotometer FTIR dan dibandingkan dengan pektin komersial yang ada di pasaran. Bagan alir dari penelitian ini dapat dilihat pada Gambar 2.
Bahan dan Alat
Bahan yang digunakan pada penelitian ini adalah kulit pisang kepok segar yang didapatkan dari pedagang pisang goreng di daerah Cibinong. Bahan kimia yang digunakan adalah HCl 1 N, etanol 96%, air destilat, HCl pekat, HNO3 pekat,
larutan standar Pb 10 mg/L, NaCl, NaOH, indikator merah fenol, dan pektin komersial yang berasal dari buah apel (merek Sigma Aldrich, CAS No. 9000-69-5). Sampel yang digunakan, yaitu kerang darah yang diperoleh dari Pasar Anyar, Bogor.
3
Gambar 2 Bagan alir metode penelitian
Pembuatan Ekstrak Air Kulit Pisang Kepok
Kulit pisang kepok segar ditimbang 200 gram, kemudian diblender dengan penambahan akuades sebanyak tiga kali bobot kulit tersebut. Selanjutnya dilakukan penyaringan untuk memisahkan antara filtrat dan ampasnya menggunakan kain blacu. Filtrat inilah yang disebut dengan ekstrak air yang akan digunakan untuk merendam daging kerang darah.
Pembuatan Larutan Pektin 0.20% dari Kulit Pisang Kepok
Kulit pisang kepok segar ditimbang 200 gram, kemudian diblender dengan penambahan akuades sebanyak tiga kali bobot kulit tersebut. Selanjutnya ditambahkan HCl 1 N hingga pH 2. Campuran tersebut direfluks pada suhu 90 oC selama 1 jam. Setelah itu campuran tersebut disaring dan filtratnya didinginkan hingga suhu ruang. Filtrat yang telah dingin diendapakan menggunakan etanol asam (satu liter etanol 96% diasamkan dengan 1 mL HCl pekat) sebanyak 1.5 kali volume filtrat, kemudian didiamkan selama 24 jam.
Endapan pektin disaring dan dikeringkan dalam oven hingga kering, lalu diblender hingga menjadi serbuk. Serbuk yang dihasilkan kemudian ditimbang dan dihitung rendemennya. Larutan pektin 0.20% didapatkan dengan cara melarutkan 0.20 gram serbuk pektin dengan air panas hingga 100 mL.
Kulit pisang kepok
Proses desorpsi Pb
Ekstrak air
Proses desorpsi Pb Kerang darah
Daging kerang darah
Karakterisasi dan identifikasi
Pektin
4
Analisis Pektin Kulit Pisang Kepok
Kadar Air (AOAC 2005)
Tahap pertama yang dilakukan pada analisis kadar air adalah mengeringkan cawan porselen menggunakan oven pada suhu 105 oC selama 30 menit. Cawan tersebut diletakkan di dalam desikator ± 30 menit hingga suhu ruang kemudian ditimbang. Sampel sebanyak 0.3 gram ditimbang ke dalam cawan dan dimasukkan ke dalam oven dengan suhu 105 oC selama 4 jam lalu dimasukkan ke dalam desikator kemudian ditimbang.
Kadar Abu (AOAC 2005)
Cawan porselen dibersihkan dan dikeringkan di dalam oven bersuhu 105 oC selama 30 menit. Cawan tersebut kemudian dimasukkan ke dalam desikator ± 30 menit dan ditimbang. Sampel sebanyak 0.3 gram ditimbang dan dimasukkan ke dalamnya. Selanjutnya dibakar di atas hotplate sampai tidak berasap, kemudian dimasukkan ke dalam tanur suhu 600 oC selama 7 jam. Cawan tersebut dimasukkan ke dalam desikator, dibiarkan sampai dingin kemudian ditimbang.
Karakterisasi pektin secara kuantitatif (Ismail et al. 2012)
Pektin sebanyak 0.5 gram dimasukkan ke dalam labu erlenmeyer, kemudian ditambahkan 5 mL etanol 96%, 1 gram NaCl, dan 100 mL air suling bebas CO2.
Campuran tersebut dikocok hingga larut, lalu dititrasi dengan NaOH 0.1 N menggunakan indikator merah fenol sampai terjadi perubahan warna menjadi merah kekuningan (pH 7.5) yang bertahan ± 30 detik. Sehingga dapat diitung bobot ekuivalen pektin.
Larutan netral tersebut ditambahkan 25 mL NaOH 0.25 N, dikocok, dan dibiarkan selama 30 menit pada suhu ruang dalam keadaan tertutup. Selanjutnya ditambahkan 25 mL larutan HCl 0.25 N dan dititrasi dengan larutan NaOH 0.1 N menggunakan indikator merah fenol sampai titik akhir merah kekuningan. Maka dapat dihitung kandungan metoksil pektin tersebut.
Kadar galakturonat dihitung dari mek (miliekuivalen) NaOH yang diperoleh dari penentuan bobot ekuivalen dan kandungan metoksil. Derajat esterifikasi dihitung dari kadar metoksil dan kadar galakturonat yang telah diperoleh.
Identifikasi gugus fungsi
Spektrum FTIR digunakan untuk memperoleh informasi mengenai gugus fungsi dari pektin kulit pisang dan pektin komersial yang terdapat di pasaran, kemudian membandingkan keduanya. Data FTIR diperoleh dengan menggunakan bilangan gelombang 4000-400 cm-1.
Desorpsi Pb
5
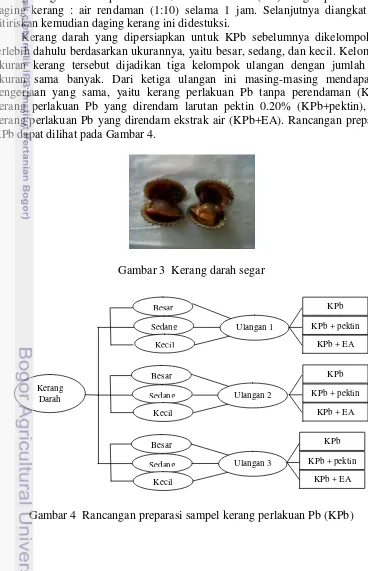
antara 2 x 1.5 dan 3 x 2.5 cm2. Sebelum digunakan kerang tersebut dicuci terlebih dahulu dengan air untuk menghilangkan lumpur dan kotoran pada cangkang.
Daging kerang darah yang digunakan pada penelitian ini terdiri dari dua jenis. Pertama, daging kerang rebus (KR) yang didapatkan dengan cara merebus daging kerang darah yang masih dalam cangkang dengan air mendidih, kemudian cangkang akan terbuka dan dagingnya dikeluarkan. Kedua, daging kerang perlakuan Pb (KPb) yang didapatkan dengan cara mengeluarkan daging kerang segar dari cangkangnya, lalu dibersihkan dengan air, dan direndam dengan larutan Pb buatan dengan perbandingan 1:5 selama 3 jam.
Daging kerang darah, baik KR maupun KPb dicacah lalu direndam masing-masing dengan larutan pektin 0.20% dan ekstrak air (EA) dengan perbandingan daging kerang : air rendaman (1:10) selama 1 jam. Selanjutnya diangkat dan ditiriskan kemudian daging kerang ini didestuksi.
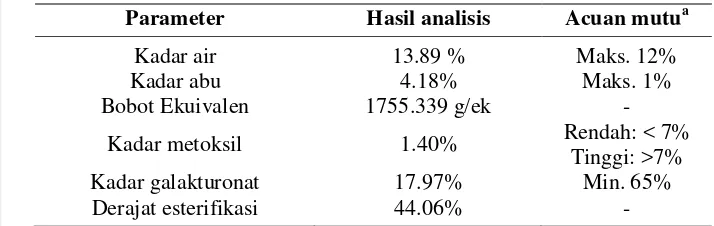
Kerang darah yang dipersiapkan untuk KPb sebelumnya dikelompokkan terlebih dahulu berdasarkan ukurannya, yaitu besar, sedang, dan kecil. Kelompok ukuran kerang tersebut dijadikan tiga kelompok ulangan dengan jumlah tiap ukuran sama banyak. Dari ketiga ulangan ini masing-masing mendapatkan pengerjaan yang sama, yaitu kerang perlakuan Pb tanpa perendaman (KPb), kerang perlakuan Pb yang direndam larutan pektin 0.20% (KPb+pektin), dan kerang perlakuan Pb yang direndam ekstrak air (KPb+EA). Rancangan preparasi KPb dapat dilihat pada Gambar 4.
Gambar 3 Kerang darah segar
6
Pengukuran Kadar Pb
Pengukuran kadar Pb menggunakan spektrofotometer serapan atom dengan nyala. Larutan sampel disiapkan dengan metode destruksi basah berdasarkan AOAC (2005). Sampel kerang darah sebelum dan sesudah perendaman baik menggunakan larutan pektin 0.20% maupun ekstrak air kulit pisang ditimbang sebanyak 10 gram. Selanjutnya sampel dimasukkan ke dalam labu kjeldahl lalu ditambahkan 10 mL HNO3 pekat. Campuran tersebut dipanaskan di atas hotplate
di dalam lemari asam. Proses destruksi dilakukan sampai larutan jernih dan uap nitratnya hilang. Setelah dingin, sampel disaring dan dipindahkan ke dalam labu takar 25 mL kemudian ditera menggunakan HNO3 0.01%.
Larutan yang telah ditera diukur absorbansnya menggunakan AAS pada panjang gelombang 217 nm. Nilai absorbans yang diperoleh harus berada dalam rentang nilai absorbans kurva larutan standar Pb. Konsentrasi Pb dalam sampel ditentukan berdasarkan persamaan linear dari kurva larutan standar yang didapatkan.
HASIL DAN PEMBAHASAN
Kulit buah pisang kepok yang digunakan sebagai bahan baku terdiri atas kulit yang masih segar dengan warna kuning cerah dan yang sudah mengalami proses penyimpanan selama ± 2 hari dengan warna agak cokelat. Kedua asal bahan baku ini ternyata menghasilkan rendemen yang berbeda. Rendemen yang diperoleh kulit segar lebih besar, yaitu 3.01% dibandingkan dengan kulit setelah 2 hari yang hanya 2.69% (Tabel 1). Cara perhitungan rendemen ini dapat dilihat pada Lampiran 1. Selain itu warna pektin dari kulit segar lebih cerah dibandingkan dengan kulit setelah 2 hari (Gambar 5).
Warna coklat pada pektin yang diisolasi dari kulit pisang yang telah disimpan selama 2 hari dikarenakan pada kulit tersebut terjadinya reaksi browning atau pencoklatan. Menurut Putri (2004) warna pektin dari kulit buah kakao menjadi cokelat dikarenakan bahan ini banyak mengandung senyawa fenolik yang mudah teroksidasi. Untuk mencegah reaksi pencoklatan dibutuhkan suatu bahan yang bersifat sebagai inhibitor reaksi tersebut. Penambahan inhibitor tidak dilakukan pada penelitian ini karena dikhawatirkan dapat mengurangi rendemen.
Tabel 1 Rendemen pektin 2 jenis bahan baku
Bahan baku Rendemen (%)
Kulit segar 3.01
7
Gambar 5 Pektin dari kulit pisang segar (a) dan Pektin dari kulit pisang setelah 2 hari (b)
Ekstraksi merupakan upaya untuk melepaskan analit yang terikat pada bahan baku menggunakan pelarut dan kondisi yang sesuai. Ekstraksi pektin menggunakan pelarut air pada pH 2 dan suhu 90 oC selama 1 jam, dipilih berdasarkan modifikasi penelitian yang dilakukan oleh Hanum et al. (2012) yaitu pada pH 1.5, suhu 90 oC, dan waktu 80 menit. Pektin dalam jaringan tanaman banyak terdapat sebagai protopektin yang tidak larut dalam air, namun setelah dihidrolisis dengan asam akan menghasilkan pektin yang lebih mudah larut dalam air. Selain itu, kondisi suhu ekstraksi yang tinggi diperlukan untuk meningkatkan energi kinetik larutan sehingga proses difusi pelarut ke dalam jaringan dan difusi pektin ke luar jaringan menjadi lebih mudah (Hanum et al. 2012).
Pemilihan kondisi pH yang tepat saat pelarutan pektin sangat penting. Kondisi pH rendah dibutuhkan untuk menghidrolisis protopektin menjadi pektin. Ion H+ akan menggantikan Ca atau Mg yang terikat dalam protopektin. Selain itu asam juga akan memutus ikatan antara pektin dan selulosa serta menghidrolisis gugus metil ester pektin. Namun apabila pH yang digunakan terlalu rendah dapat menyebabkan molekul pektin yang dihasilkan berukuran sangat kecil sehingga memengaruhi proses pengendapan dengan etanol (Kalapathy et al. 2001).
Hasil Pencirian Pektin
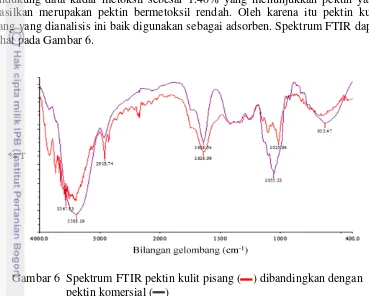
Pencirian terhadap pektin meliputi beberapa parameter kuantitatif, yaitu kadar air, kadar abu, bobot ekuivalen, kadar metoksil, kadar galakturonat, derajat esterifikasi, dan karakterisasi gugus fungsi menggunakan spektrofotometer FTIR. Hasil analisis tersebut dibandingkan dengan standar acuan mutu pektin yang dikeluarkan oleh Food Agriculture Organization (FAO) tahun 2009 (Tabel 2).
Kadar air pektin didapatkan sebesar 13.89%. Kadar air merupakan parameter penting karena dapat memengaruhi daya tahan pektin terhadap pertumbuhan mikroorganisme. Kadar air ini tidak sesuai dengan acuan mutu FAO (2009) yaitu maksimal 12%. Hasil ini juga menunjukkan adanya perbedaan dengan hasil penelitian Hanum et al. (2012) terhadap bahan yang sama dengan waktu ekstraksi 80 menit dan menghasilkan kadar air 11.88%. Perbedaan waktu ekstraksi, pemanasan, dan kondisi penyimpanan dapat menyebabkan kadar air yang dimiliki pektin pada penelitian ini lebih tinggi. Penyimpanan pektin yang tidak kedap udara menyebabkan pektin menjerap air dari udara sekitarnya. Perhitungan kadar air pektin ini dapat dilihat pada Lampiran 3.
8
Kadar abu yang diperoleh sebesar 4.18%. Kadar abu ini lebih tinggi dibandingkan dengan acuan mutu pektin yaitu maksimal 1%. Hasil ini juga berbeda dengan penelitian Hanum et al. (2012) yang mendapatkan kadar abu sebesar 0.98%. Hal ini menunjukkan bahwa waktu ekstraksi yang lebih lama dapat menurunkan kadar abu pektin. Kadar abu menunjukkan kandungan mineral dan kemurnian dari suatu bahan. Mineral pada pektin hasil isolasi dapat berasal dari bahan baku yaitu protopektin yang terdapat dalam bentuk garam magnesium kalsium pektinat. Perhitungan kadar abu pektin dapat dilihat pada Lampiran 4.
Bobot ekuivalen merupakan ukuran terhadap kandungan gugus asam galakturonat bebas dalam rantai molekul pektin. Bobot ekuivalen yang diperoleh sebesar 1755.339 g/ek. Menurut Hanum et al. (2012) semakin tinggi suhu dan lama ekstraksi menghasilkan bobot ekuivalen semakin rendah sehingga meningkatkan jumlah gugus asam bebasnya. Perhitungan bobot ekuivalen pektin ini dapat dilihat pada Lampiran 5.
Kadar metoksil pektin hasil isolasi sebesar 1.40%. Hasil tersebut menunjukkan pektin yang diperoleh termasuk ke dalam jenis bermetoksil rendah dengan kadar kurang dari 7%. Pektin yang dihasilkan memiliki lebih banyak gugus karboksil yang belum teresterifikasi dibanding gugus metoksilnya, sehingga berpotensi sebagai adsorben logam berat. Perhitungan kadar metoksil ini dapat dilihat pada Lampiran 6.
Kadar galakturonat dari pektin yang dihasilkan sebesar 17.97%. Hasil ini tidak memenuhi standar mutu pektin yaitu minimal 65%. Hal tersebut dikarenakan selain asam galakturonat, pektin juga mengandung senyawa-senyawa lain yaitu gula netral seperti D-galaktosa, L-arabinosa, dan L-ramnosa. Perhitungan kadar asam galakturonat sangat penting untuk mengetahui kemurnian pektin dan sebagai salah satu parameter dalam perhitungan derajat esterifikasi.
Nilai derajat esterifikasi yang diperoleh sebesar 44.06%. Derajat esterifikasi menunjukkan persentase jumlah residu asam D-galakturonat yang gugus karboksilnya teresterifikasi oleh etanol terhadap jumlah residu asam D-galakturonat total. Hasil ini menunjukkan bahwa masih ada lebih dari 50% gugus karboksil yang belum teresterifikasi. Data ini mendukung data kadar metoksil dan kemampuan pektin sebagai adsorben logam berat. Perhitungan kadar galakturonat dan derajat esterifikasi ini dapat dilihat pada lampiran 7.
Tabel 2 Hasil pencirian pektin
Parameter Hasil analisis Acuan mutua
Kadar air 13.89 % Maks. 12%
Kadar abu 4.18% Maks. 1%
Bobot Ekuivalen 1755.339 g/ek -
Kadar metoksil 1.40% Rendah: < 7%
Tinggi: >7%
Kadar galakturonat 17.97% Min. 65%
Derajat esterifikasi 44.06% -
a
9
Pencirian Kualitatif Pektin Hasil Isolasi
Pencirian pektin menggunakan FTIR bertujuan mengetahui gugus fungsi yang dimilikinya serta seberapa besar intensitasnya dibandingkan dengan pektin komersial yang ada di pasaran. Spektrum FTIR menunjukkan intensitas gugus C=O asam karboksilat lebih besar dibandingkan dengan gugus C=O ester. Hal ini mendukung data kadar metoksil sebesar 1.40% yang menunjukkan pektin yang dihasilkan merupakan pektin bermetoksil rendah. Oleh karena itu pektin kulit pisang yang dianalisis ini baik digunakan sebagai adsorben. Spektrum FTIR dapat dilihat pada Gambar 6.
Gambar 6 Spektrum FTIR pektin kulit pisang ( ) dibandingkan dengan pektin komersial ( )
Spektrum FTIR pektin kulit pisang memiliki puncak serapan pada bilangan gelombang 3567.83 menunjukkan ulur –OH, bilangan gelombang 2918.74 menunjukkan ulur -CH, bilangan gelombang 1771.20 menunjukkan ulur C=O ester, bilangan gelombang 1636.99 menunjukkan ulur C=O asam karboksilat, dan bilangan gelombang 1015.94 cm-1 menunjukkan ulur –COC– pada gugus asam galakturonat sebagai monomer pektin. Spektrum FTIR ini menunjukkan pola dan nilai serapan yang hampir sama dengan pektin komersial.
Desorpsi Pb dari Daging Kerang Darah
Metode yang dipakai yaitu destruksi basah dengan asam pengoksidasi HNO3 pekat. Metode ini dipilih karena menggunakan suhu yang relatif rendah,
sehingga hilangnya kandungan logam akibat penguapan dapat dihindari. Selain itu peralatan yang digunakan lebih sederhana, bahan kimia yang dipakai juga sedikit, dan waktu destruksi lebih singkat, yaitu dengan waktu 1 jam larutan sudah jernih dan tidak ada lagi uap nitratnya.
10
perendaman (KR), kerang rebus yang sudah direndam larutan pektin 0.20% (KR+pektin), dan kerang rebus yang sudah direndam ekstrak air kulit pisang (KR+EA) mendapatkan pengerjaan yang sama.
Sebelum pengukuran sampel, dilakukan terlebih dahulu penentuan linearitas kurva standar Pb dan menghasilkan nilai persamaan garis y = 0.0439x – 0.0013 dan nilai R2 sebesar 0.9995 (Lampiran 8). Nilai absorbans yang didapatkan dari pengukuran sampel menggunakan AAS dan cara perhitungan kemampuan desorpsi Pb dari daging kerang darah oleh larutan pektin 0.20% dan ekstrak air kulit pisang dapat dilihat pada Lampiran 9.
Hasil pengukuran menunjukkan bahwa proses pencucian daging kerang darah dengan air dan perebusan dapat mengurangi kandungan Pb pada daging kerang. Daging kerang rebus setelah direndam menggunakan larutan pektin 0.20% mengandung Pb lebih sedikit dibandingkan dengan daging kerang rebus yang direndam ekstrak air. Larutan pektin 0.20% memiliki kemampuan mendesorpsi Pb dari daging kerang darah rebus sebesar 52.85%, lebih besar dibandingkan dengan ekstrak air kulit pisang kepok yang hanya 23.05 (Tabel 3).
Tabel 3 Persentase Pb terdesorpsi dari daging kerang darah akibat pencucian, perebusan, dan perendaman diadsorp terlebih dahulu oleh daging kerang darah dan kemudian didesorpsi kembali oleh larutan pektin 0.20% dan ekstrak air. Berdasarkan penentuan linearitas kurva standar Pb (Lampiran 10) didapatkan persamaan regresi linear yaitu y = 0.0445x + 0.0062 dengan R2= 0.9989.
Sampel yang diukur menggunakan AAS meliputi daging kerang segar perlakuan Pb (KPb), daging kerang perlakuan Pb yang sudah direndam larutan pektin 0.20% (KPb+pektin), dan daging kerang perlakuan Pb yang sudah direndam ekstrak air (KPb+EA). Nilai absorbans yang didapatkan dan perhitungan % Pb terdesorpsi dari daging kerang darah oleh larutan pektin 0.20% dan ekstrak air kulit pisang dapat dilihat pada Lampiran 11.
11
Tabel 4 Persentase Pb terdesorpsi dari daging kerang perlakuan Pb (KPb) sebelum dan sesudah perendaman
Sampel [Pb] (mg/kg) % Pb terdesorpsi
KPb 6.5919 -
KPb + pektin 3.2482 50.72
KPb + EA 2.7624 58.09
Terdapat perbedaan persentase Pb terdesorpsi dari daging kerang darah oleh larutan pektin 0.20% dan ekstrak air antara sampel kerang rebus (KR) dan kerang perlakuan Pb (KPb). Namun data yang diambil yaitu data menggunakan KPb, hal ini dikarenakan nilai absorbans pada KR tidak masuk ke dalam rentang deret larutan standar Pb.
Perbedaan kemampuan desorpsi Pb yang tidak berbeda jauh antara larutan pektin 0.20% dan ekstrak air dikarenakan keduanya sama-sama memanfaatkan pektin atau asam pektinat yang terkandung dalam kulit pisang. Ekstrak air mengisolasi pektin secara kasar sedangkan larutan pektin 0.20% mengisolasi pektin lebih murni. Diketahui bahwa mekanisme desorpsi ini dipengaruhi oleh kandungan gugus asam karboksilat yang dimiliki oleh pektin (Srivastava et al. 2011). Kadar metoksil yang rendah, yaitu 1.40% menunjukkan bahwa banyak gugus asam karboksilat bebas yang terkandung pada pektin tersebut sehingga kemungkinan pertukaran ion antara Pb2+ dari daging kerang darah dan 2 ion H+ pada pektin lebih besar. Adapun penjerapan logam berat bervalensi dua oleh pektin seperti terlihat pada Gambar 7.
Gambar 7 Pengikatan logam berat oleh pektin
Bila dikaitkan antara hasil pencirian pektin dan kemampuannya untuk mendesorpsi Pb dari daging kerang darah, ada dua hal yang bisa dilakukan untuk memperbesar kemampuan desorpsi oleh pektin. Pertama, adanya proses pengeringan serbuk pektin hingga kadar airnya di bawah 12% sebelum pektin tersebut dilarutkan dengan air panas. Kedua, derajat esterifikasi dapat diperkecil dengan adanya proses hidrolisis ester sehingga gugus asam karboksilatnya menjadi lebih banyak.
12
SIMPULAN DAN SARAN
Simpulan
Kandungan Pb dalam daging kerang darah segar yang berasal dari Pasar Anyar, Bogor masih dalam batas aman konsumsi yaitu kurang dari 1 mg/kg. Proses pencucian dengan air bersih dan perebusan dapat menghilangkan 36.27% dan 23.80% Pb yang terkandung dalam daging kerang darah segar. Sementara dalam ekstrak air kulit pisang kepok dan larutan pektin hasil isolasi dari kulit pisang kepok jumlah Pb terdesorpsi sebesar 58.09% dan 50.72%. Pektin kulit pisang kepok potensi sebagai adsorben logam karena tergolong pektin bermetoksil rendah.
Saran
Perlu dilakukan percobaan untuk mengetahui pengaruh variasi konsentrasi larutan pektin terhadap jumlah Pb terdesorpsi dari daging kerang darah. Diperlukan pula proses hidrolisis ester untuk meningkatkan jumlah gugus fungsi asam karboksilat. Perlu dilakukan analisis proksimat untuk memastikan perendaman oleh larutan pektin dan ekstrak air tidak memengaruhi nilai gizi daging kerang darah.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington: The Association of Official Analytical Chemist, Inc.
Ashraf MA, Wajid A, Mahmood K, Maah MJ, Yusoff I. 2011. Low cost biosorbent banana peel (Musa sapientum) for the removal of heavy metals. Academic Journals 6(19):4055-4064.doi:10.5897/SRE11.303.
[BPS] Badan Pusat Statistik. 2013. Statistika Produksi Buah-buahan di Indonesia Tahun 1995-2012 [Internet]. [diunduh 2013 September 5]. Tersedia pada: http://www.bps.go.id/tab_sub/view.php?kat=3&tabel=1&daftar=1&id_suby ek=55¬ab=5.
[BSN] Badan Standardisasi Nasional. 2009. Kerang Beku (SNI 3460.1-2009). Jakarta: Badan Standardisasi Nasional.
Chanakya HN, Sharma I, Ramachandra TV. 2008. Micro-scale anaerobic digestion of point source components of organic fraction of municipal solid waste. J. Waste Management. doi:10.1016/j.wasman.2008.09.014.
Darmono. 2001. Lingkungan Hidup dan Pencemaran. Jakarta (ID): Universitas Indonesia.
Emaga TH, Sĕbastian N, Ronkart, Robert C, Wathelet B, Paquot M. 2008.
13
different conditions using an experimental design. Food Chemistry 108:463-471. doi:10.1016/j.foodchem.2007.10.078 pengolahan jeruk pontianak (citrus nobilis var microcarpa) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Ismail NSM, Ramli N, Hani NM, Meon Z. 2012. Extraction and characterization of pectin from dragon fruit (Hylocereus polyrhizus) using various extraction conditions. Sains Malaysiana 41(1): 41-45.
Kaban IMD, Martha A, Farida H. 2012. Ekstraksi pektin dari kulit buah pisang raja (Musa sapientum). J. Teknik Kimia USU : 1-6.
Kalapathy U, Proctor A. 2001. Effect of acid extraction and alcohol precipitation conditions on the yield and purity of soy hull pectin. Food Chemistry 73: Sonogashira reaction catalyzed by palladium nanoparticles supported on pectin. Catalysis Communications Journal 37: 1-122. doi:10.1016/j.catcom.2013.03.013
Mata YN, Blazquez ML, Ballester A, Gonzalez F, Munoz JA. 2009. Sugar-beet pulp pectin gels as biosorbent for heavy metals: preparation and determination of biosorption and desorption characteristics. Chemical Engineering Journal 150: 289-301.
Putri LD. 2004. Pemisahan dan pencirian pektin dari kulit buah kakao [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Qiu L, Zhao G, Wu H, Jiang L, Li X, dan Liu J. 2010. Investigation of combined effects of independent variables on extraction of pectin from banana peel using response surface methodology. Carbohydrate Polymers 80: 326-331. doi:10.1016/j.carbpol.2010.01.018.
Rukmana R. 1999. Usaha Tani Pisang. Yogyakarta (ID): Penerbit Kanisius. Suyono CA. 2006. Bioakumulasi logam berat melalui sistim jaringan makanan
dan lingkungan pada kerang bulu Anadara Inflata. Ilmu Kelautan 11 (1): 19-22.
Srivastava P, Malviya R. 2011. Source of pectin, extraction, and its application in pharmaceutical industry – An overview. Indian Journal of Natural Product and Resources 2(1): 11-18.
14
Wong WW, Abbas FMA, Liong MT, Azhar ME. 2008. Modification of durian rind pectin for improving biosorbent ability. International Food Research Journal 15(3): 363-365
15
Lampiran 1 Perhitungan rendemen pektin Bobot kulit pisang segar = 100 gram Bobot pektin = 0.5687 gram
Lampiran 2 Kadar air kulit pisang segar
Ulangan Pengeringan I Pengeringan II Pengeringan
III
1 1.9285 2.0190 2.3377 2.3356 2.3348 79.87
2 1.9059 2.0123 2.2742 2.2730 2.2721 81.80
3 2.0335 2.0162 2.4067 2.4048 2.4041 81.62
Rerata 81.09
Lampiran 3 Kadar air pektin hasil isolasi
Ulangan Pengeringan I Pengeringan II Pengeringan
III
B = Berat wadah yang diisi sampel (gram)
16
Lampiran 4 Kadar abu pektin hasil isolasi
Ulangan Pengabuan I Pengabuan II Pengabuan
III
B = Berat wadah dengan sampel (gram)
C = Berat wadah dengan sampel setelah diabukan (gram)
Lampiran 5 Penentuan bobot ekuivalen pektin
Ulangan
Lampiran 6 Penentuan kadar metoksil pektin
17
Lampiran 7 Penentuan % asam galakturonat dan derajat esterifikasi pektin
Ulangan % AUA % DE
1 18.91 44.43
2 16.87 41.37
3 18.14 46.01
Rerata 17.97 44.06
% Asam galakturonat =mek (BE + metoksil) × 176 × 100
bobot sampel (mg)
DE(%) =kadar metoksil × 176 × 100
kadar galakturonat × 31
Contoh perhitungan ulangan 1: % Asam galakturonat
= 1.50 mL × 0.1013 N + 1.20 mL × 0.1013 N × 176 g/ek × 100 254.6 mg
= 18.91%
DE = 1.48%×176 g/ek ×100
18.91%×31 g/ek = 44.43%
Lampiran 8 Grafik linearitas kurva standar Pb (1) [standar Pb] (mg/L) Absorbans
0.3000 0.0111
0.6000 0.0251
1.0000 0.0428
5.0000 0.2244
7.0000 0.2994
18
Lampiran 9 Hasil Pengukuran kadar Pb pada daging kerang darah tanpa pencucian, dengan pencucian, dan daging kerang rebus
Absorbans Absorbans
KSTC = kerang segar tanpa pencucian dengan air
KSC = kerang segar dengan pencucian menggunakan air KR = kerang rebus tanpa perendaman
KR + pektin = kerang rebus yang sudah direndam larutan pektin 0.20% KR + EA = kerang rebus yang sudah direndam ekstrak air kulit pisang
Absorbans terkoreksi = absorbans sampel – absorbans blangko
[Pb] (mg/L) = Absorbans terkoreksi +0.0013
0.0439
0,0000 2,0000 4,0000 6,0000 8,0000 10,000012,0000
Abs
o
rba
ns
19
Bobot kerang(gram) × 10−3
(%) Pb terdesorpsi =
Pb sampel sebelum perendaman − Pb sampel sesudah perendaman
Pb sampel sebelum perendaman × 100%
Contoh perhitungan:
[Pb] KSTC ulangan 1 = 0.0093+0.0013
0.0439 = 0.2415 mg/
(%) Pb terdesorpsi akibat pencucian
=
0.5568−0.35480.5568 x 100%
= 36.27 %
Lampiran 10 Grafik linearitas kurva standar Pb (2) [standar Pb] (mg/L) Absorbans
0.2000 0.0156
0,0000 2,0000 4,0000 6,0000 8,0000 10,0000
Abs
o
rba
ns
20
Lampiran 11 Hasil Pengukuran kadar Pb pada daging kerang darah perlakuan Pb
Absorbans Absorbans
Kontrol = larutan Pb buatan
Filtrat = sisa larutan Pb sisa perlakuan KPb = kerang segar perlakuan Pb
KPb + pektin = kerang segar perlakuan Pb direndam larutan pektin 0.20% KPb + EA = kerang segar perlakuan Pb direndam ekstrak air kulit pisang
[Pb] (mg/L) = Absorbans terkoreksi −0.0062
0.0445
Bobot kerang(gram) × 10−3
(%) Pb terdesorpsi =
Pbsampel sebelum perendaman− Pb sampel sesudah perendaman
Pbsampel sebelum perendaman × 100%
Contoh perhitungan:
[Pb] KPb ulangan 1 = 0.1263−0.0062
21
Kadar Pb KPb ulangan 1 = 2.6989 ( mg
L )×10−
3×25 mL
10.1065 (gram )×10−3 = 6.6761 mg/Kg
(%) Pb terdesorpsi pada KPb + pektin = 6.5919 −3.2482
22
RIWAYAT HIDUP
Penulis dilahirkan di Larantuka pada tanggal 21 Mei 1990 dari Ayah Ujang Supriadi dan Ibu Sopiah Indraniati. Penulis merupakan anak pertama dari dua bersaudara. Penulis menyelesaikan studi di SMK Analis Kimia Bogor pada tahun 2009. Pada tahun yang sama penulis diterima di Institut Pertanian Bogor (IPB) melalui jalur SNMPTN pada Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti masa perkuliahan penulis pernah aktif dalam organisasi kemahasiswaan Ikatan Mahasiswa Kimia (Imasika) pada tahun 2010–2012. Penulis merupakan salah satu penyusun dari karya tulis yang didanai oleh Dikti dalam Program Kreativitas Mahasiswa (PKM) pada tahun 2012 yang berjudul
“Isolasi dan identifikasi proanthocyanidin ekstrak biji anggur (Vitis vinifera) berpotensi antioksidan”.