PENGKLASIFIKASIAN PROPOLIS LEBAH MADU
TRIGONA
SPP.
DARI EMPAT WILAYAH DI INDONESIA DENGAN
MENGGUNAKAN PENDEKATAN METABOLOMIK
BERBASIS FTIR
NANANG NASRULLOH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertas berjudul Pengklasifikasian Propolis Lebah Madu Trigona spp. dari Empat Wilayah di Indonesia dengan
Menggunakan Pendekatan Metabolomik Berbasis FTIR adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Jakarta, Januari 2013
Nanang Nasrulloh
NIM F25108011
RINGKASAN
NANANG NASRULLOH. Pengklasifikasian Propolis Lebah Madu Trigona spp. dari Empat Wilayah di Indonesia dengan Menggunakan Pendekatan
Metabolomik Berbasis FTIR. Dibimbing oleh C.HANNY WIJAYA dan NANCY DEWI YULIANA.
Propolis merupakan bahan yang diproduksi lebah madu yang dikumpulkan dari berbagai macam tanaman. Propolis diketahui memiliki kemampuan sebagai antioksidan. Meskipun beberapa penelitian terhadap bioaktivitas propolis telah dilakukan, namun informasi mengenai propolis yang berasal dari Indonesia khususnya Trigona spp. masih belum ditemukan. Beberapa studi menyatakan
bahwa propolis memiliki beragam bioaktivitas diantaranya antimikroba, antikanker dan antioksidan. Kemampuan ini dipengaruhi komponen asam aromatik, senyawa fenol dan flavonoid. Efek antioksidan propolis diteliti secara tidak langsung melalui kemampuannya melindungi produk pangan dan kemampuan penangkapan radikal bebas. Sifat dan komposisi kimia propolis sangat kompleks yang berbeda tergantung lokasi dan asal tanaman. Perbedaan komposisi ini akan mempengaruhi bioaktivitasnya. Indonesia memiliki berbagai jenis lebah lokal. Salah satu lebah lokal penghasil propolis adalah Trigona spp.
Pada penelitian ini, pemilihan sumber propolis didasarkan atas perbedaan karakteristik fisik dan ketersediaannya.
Beberapa kajian dilakukan untuk melihat hubungan kandungan fenol, flavonoid dan aktivitas antioksidan propolis. Meskipun demikian korelasi flavonoid, fenol dan aktivitas antioksidan tidak selalu terjadi. Oleh sebab itu dapat diketahui lebih lanjut dengan menggunakan pendekatan metabolomik. Pendekatan metabolomik dapat digunakan untuk mengetahui propolis dari daerah yang potensial sebagai sumber antioksidan. Metabolomik adalah proses analisis metabolit yang ada pada suatu organisme secara komperehensif, baik secara kuantitatif maupun kualitatif. Pendekatan metabolomik dalam penelitian ini diarahkan untuk pengklasifikasian sampel sehingga diketahui perbedaan propolis antar wilayah dan kaitannya dengan aktifitas antioksidan.
Penelitian ini bertujuan untuk menggunakan pendekatan metabolomik untuk pengklasifikasian propolis dari berbagai wilayah yaitu Sulawesi Selatan, Kalimantan Barat, NTB dan Jawa Barat, khususnya propolis lebah madu Trigona spp. Selanjutnya mengevaluasi kapasitas antioksidan, kandungan fenol dan
flavonoid propolis. Selain itu, dikaji hubungan kapasitas antioksidan dengan kandungan total fenol dan flavonoid propolis. Pendekatan metabolomik menggunakan FTIR digunakan untuk mengetahui perbedaan komposisi kimiawi propolis setiap daerah dan mengkorelasikannya dengan profil antioksidannya.
Hasil analisis aktifitas antioksidan menggunakan metode DPPH menunjukkan IC50 propolis ke empat wilayah bervariasi yaitu mulai dari 0,54 µg/ml hingga 2,90 µg/ml. IC50 terendah dimiliki oleh propolis Kalimantan Barat dan tertinggi oleh propolis NTB. Adapun dibandingkan dengan propolis komersial, nilai IC50 lebih rendah daripada propolis ke empat wilayah. Nilai IC50 dari propolis empat wilayah tersebut secara signifikan lebih rendah dari trolox dan vitamin C.
Hasil analisis PCA memperlihatkan bahwa propolis Jawa Barat, Kalimantan Barat, Sulawesi Selatan dan propolis komersial cenderung menjadi satu kelompok. Pada kelompok ini gugus fungsi dominan yang mempengaruhi terjadinya pengelompokkan ditandai oleh C=O, C-O, C-H aromatik yang diperkirakan merupakan senyawa fenolik dan flavonoid. Di lain pihak, propolis NTB terpisah menjadi kelompok lain yang berarti komposisi kimia yang dimilikinya berbeda dengan gugus fungsi yang mendominasi adalah ikatan O-H, C-O dan C-C alifatik yang diduga merupakan senyawa asam lemak, dan adanya gugus C-N, N-H serta N-O yang menandakan keberadaan senyawa asam amino.
Hasil analisis PLS menunjukkan propolis Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan propolis komersial berada pada satu kelompok, sedangkan propolis NTB pada kelompok lain. Propolis NTB memperlihatkan aktifitas antioksidan yang rendah dengan senyawa yang berpengaruh ditunjukkan oleh gugus fungsi N-H, C-N, C=C, C=O, C-H alifatik yang menandakan senyawa terpen, asam lemak dan juga asam amino. Adapun propolis Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan propolis komersial memiliki aktifitas antioksidan lebih tinggi dibandingkan dengan NTB. Sumbangan konstituen yang berperan besar pada pengelompokan ini diduga berasal dari gugus O-H, C-H, C=C, C=O dari sampel yang mengarah pada senyawa fenol dan flavonoid
Hasil analisis menunjukkan bahwa kandungan total fenol ekstrak propolis ke empat wilayah berkisar antara 39,9–97,4 mg EAG/g. Propolis dari Kalimantan Barat mengandung total fenol paling tinggi dibandingkan lainnya yaitu sekitar 97,4 mg EAG /g dan terendah adalah propolis NTB. Adapun kadar total flavonoid juga bervariasi yaitu mulai dari 3,12-20,22 mg EK/g dengan kadar tertinggi dimiliki propolis Kalimantan Barat dan terendah Sulawesi Selatan. Secara keseluruhan total fenol dan flavonoid propolis komersial memiliki nilai tertinggi dibandingkan propolis ke empat wilayah.
Keseluruhan total fenol, total flavonoid dan aktivitas antioksidan ekstrak propolis ke empat wilayah menunjukkan korelasi positif (r > 0,9). Oleh karena itu gugus fungsi yang mengacu pada spektrum FTIR membuktikan bahwa senyawa yang berpengaruh terhadap aktivitas antioksidan propolis mengarah pada keberadaan senyawa fenol dan flavonoid.
SUMMARY
NANANG NASRULLOH. Classification of Propolis Extract of Trigona spp Bee
from Four Regions in Indonesia Using FTIR based Metabolomic Approach. Supervised by C. HANNY WIJAYA and NANCY DEWI YULIANA.
Propolis is a resinous substance collected by honeybees from various plant sources. Propolis obviously possesses antioxidant activity, as reported by many researchers. Although numerous researchers have reported the biological activities of propolis collected worldwide, information about Indonesian propolis, particularly from Trigona spp., is only a few. Some studies reported that propolis
has various bioactivities including antimicrobial, anticancer and antioxidant. These properties are influenced by phenols and flavonoids compounds.. The complex constituents and properties of propolis is different from each other depends on location and plant of origin. This variation will have an effect on its bioactivity. Indonesia has many local honey bees; one of them that produce propolis is Trigona spp. The location of propolis source used in this research may
relate to its physical and chemical characteristics.
Some researches have examined the correlation between phenol and flavonoid content with antioxidant activity of propolis. It was found that for some cases there is no correlation which implies that other compounds may have influence to the antioxidant activity. Therefore metabolomic is further used to observe this possibility. Metabolomic approach is capable of determination which regions have a potential propolis as a source of antioxidant. Metabolomic is defined as metabolite process analysis of the organism comprehensively quantitatively or qualitatively. Metabolomic approach in this study is focussed on classification of propolis as a result the difference of regions and its correlation to antioxidant activity.
The objective of this research is to apply metabolomic in classification of propolis from four regions based on its FTIR metabolite profile and its antioxidant activity. Those four regions are West Nusa Tenggara, West Java, West Kalimantan and South Sulawesi. Since the composition of propolis varies with its origin, the intensity of antioxidant activity should be different as well. Metabolomic approach was used to identify which region has propolis with better antioxidant activity. FTIR based metabolomic was applied to measure the spectra of propolis in order to examine the differences among propolis samples then to classify them. For this purpose, the FTIR spectra were analyzed by PCA and PLS. In addition, the correlation between propolis phenol and flavonoid content to its antioxidant capacity was also determined.
confirmation by targeted analysis of propolis total phenol and flavonoid content and its correlation to propolis antioxidant activity are required.
Antioxidant potential of propolis from four regions in Indonesia was accessed by analyze propolis scavenging effect on DPPH radicals which IC50 were in the range 0,54-2,90 µg/mL. Low values of IC50 on DPPH scavenging assay were obtained for West Kalimantan and West Java propolis are 0,54 µg/mL and 0,86 µg/mL, respectively. The IC50 of propolis from four regions of Indonesian were found to be lower as compared to commercial propolis. All IC50 of propolis from four regions were also lower than reference IC50 of trolox and vitamin C.
According to PCA score plot, the propolis samples were classified into two groups. Propolis from West Kalimantan, West Java, South Sulawesi and commercial tend to group itself which imply chemical composition similarities, meanwhile West Nusa Tenggara can be remarked as being totally different. The three members of the first group were recognized by the presence of C=O, C-O, C-H aromatic bond which are interpreted as phenol and flavonoid compound. By contrast, the second group was designated by O-H, C-O, C-C aliphatic which are interpreted as fatty acid, then C-N, N-H and N-O that refers to amino acid.
Based on PLS, the propolis samples were classified in the same clusters as in PCA. Propolis from West Nusa Tenggara as group 2 demonstrates lower antioxidant activity than group 1 which consist of propolis from West Kalimantan, West Jaca, South Sulawesi and commercial. The major compounds in group 2 were attributed by N-H, C-N, C=C, C=O, C-H aliphatic bonds which shows the existence of terpene, fatty acid and amino acid. Then, the three members of the group 1 which have higher antioxidant activity have predominant O-H, C-H, C=C, C=O bonds which indicate the presence of phenol and flavonoid compounds. From this, the assumption that the composition of complex chemical constituent and antioxidant activity do vary according to its geographical origin was proven.
Total flavonoid and phenols contents of extracts of propolis samples were determined by using aluminium nitrate and Folin–Ciocalteu colorimetric methods were in the range of 39.9 – 97.4 mg/mL of GAE and 3.12 – 20.2 mg/mL of QE, respectively. Both phenol and flavonoid contents of commercial propolis was higher as compared to propolis from four regions of Indonesian.
All the samples exhibited strong positive correlation between phenolic, flavonoid content and its antioxidant activity. Therefore, it is concluded that the result from PLS analysis which mentioned functional groups of phenol and flavonoids as a major difference between propolis with good antioxidant activity and those with lower antioxidant activity was proven.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
PENGKLASIFIKASIAN PROPOLIS LEBAH MADU
TRIGONA
SPP
. DARI EMPAT WILAYAH DI INDONESIA DENGAN
MENGGUNAKAN PENDEKATAN METABOLOMIK
BERBASIS FTIR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Pengklasifikasian Propolis Lebah Madu Trigona spp. dari Empat
Wilayah di Indonesia dengan Menggunakan Pendekatan Metabolomik Berbasis FTIR
Nama : Nanang Nasrulloh NIM : F251080111
Disetujui oleh Komisi Pembimbing
Ketua
Prof Dr Ir C. Hanny Wijaya, MAgr
Anggota
Dr Nancy Dewi Yuliana, STP, MSc
Diketahui oleh
Ketua Program Studi Ilmu Pangan
Dr Ir Ratih Dewanti-Hariyadi, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas
segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2012 sampai Oktober 2012 ini adalah metabolomik, dengan judul Pengklasifikasian Lebah Madu
Trigona spp dari Empat Wilayah di Indonesia dengan Menggunakan Pendekatan
Metabolomik Berbasis FTIR.
Penulis menyampaikan terima kasih kepada Ibu Prof. Dr. C. Hanny Wijaya, MAgr dan Ibu Dr. Nancy Dewi Yuliana, STP, MSc selaku pembimbing yang memberikan nasehat dan saran kepada penulis. Pernyataan terima kasih juga disampaikan kepada Ibu Dr.Ir. Ratih Dewanti-Hariyadi, MSc selaku Ketua Program Studi Ilmu Pangan dan Ibu Dr. Ir. Endang Prangdimurti, MSc sebagai dosen penguji dari pihak Program Studi Ilmu Pangan serta Ibu Dr. Didah Nur Faridah, STP, MSi selaku dosen penguji luar komisi. Penghargaan disampaikan kepada Bapak Mahani serta Ibu Nunung Nurjanah sebagai pihak yang memberikan sampel propolis Trigona spp. sehingga penelitian ini dapat
dilaksanakan.
Terima kasih juga penulis ucapkan kepada Mas Nono sebagai sahabat yang sangat membantu sejak awal kuliah. Selain itu disampaikan pula terima kasih kepada Mbak Ira, Ibu Maria, Pak Taufik, Mbak Ari, Mbak Ayu, Bu Andi, Bu Yanti, Pak Imam Budiono, Pak Imam Sutowo, Mbak Fite, Pak Beni dan rekan-rekan IPN 2008 serta semua pihak yang telah membantu selama penelitian ini.
Ucapan terima kasih juga disampaikan kepada almarhum Enyak dan almarhum Babe, Ibu Asni dan almarhum Bapak Syafri selaku mertua, Ibu Ratu selaku ibu angkat, Bang Judin, Uda Romi, Uni Helmi, Pamanda Ci H.Alwi, Ibu Molina, Bapak Arif, Ibu Kurni, Mbak Lia serta seluruh keluarga. Akhir kata, ungkapan terima kasih sedalam-dalamnya disampaikan kepada istri tercinta Litdia, terima kasih atas doa, cinta dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Jakarta, Januari 2013
DAFTAR ISI
DAFTAR TABEL iv
DAFTAR GAMBAR iv
DAFTAR LAMPIRAN iv
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 3
Hipotesis 4
Manfaat Penelitian 4
2 TINJAUAN PUSTAKA 5
Lebah Dan Produk Lebah 5
Lebah Madu Trigonaspp. 5
Propolis 7
Ekstraksi Propolis 9
Karakteristik Propolis 12
Komposisi Kimiawi Propolis dan Bioaktivitasnya 13
Antioksidan 15
Metode Uji Antioksidan 16
Metabolomik 16
Fourier Transform Infrared (FTIR) 17
Principal Component Analysis (PCA) dan Partial Least Square (PLS) 19
3 METODE PENELITIAN 21
Tempat dan Waktu 21
Bahan dan Alat 21
Metode Penelitian 21
4 HASIL DAN PEMBAHASAN 26
Iklim dan Vegetasi Daerah Asal Propolis 27
Analisis Fingerprint Propolis (FTIR) 27
Aktivitas Antioksidan DPPH 30
Analisis PCA 32
Analisis PLS 37
Kadar Fenol 44
Kadar Flavonoid 47
Korelasi Kandungan Fenol Terhadap Aktivitas Antioksidan 49 Korelasi Kandungan Flavonoid Terhadap Aktivitas Antioksidan 52
5 SIMPULAN DAN SARAN 55
Simpulan 55
Saran 55
DAFTAR PUSTAKA 56
iv
DAFTAR TABEL
Tabel 1 Rendemen Propolis 12
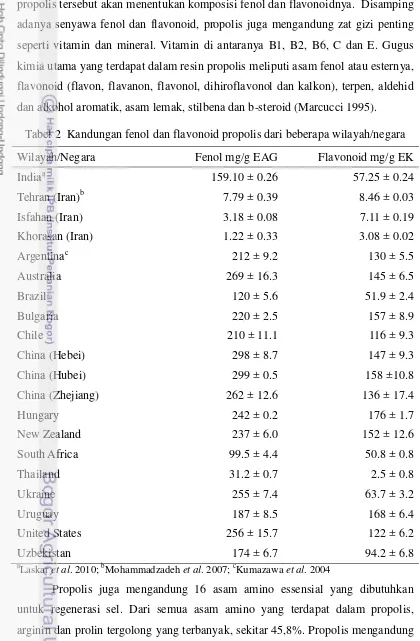
Tabel 2 Kandungan fenol dan flavonoid propolis dari beberapa wilayah/negara 14
Tabel 3 Aktivitas antioksidan propolis 15
Tabel 4 Iklim dan vegetasi daerah asal propolis Trigona spp. 26
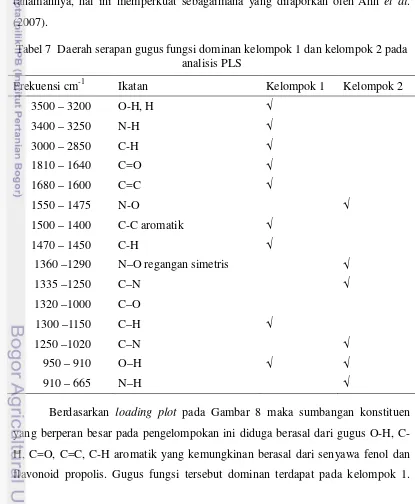
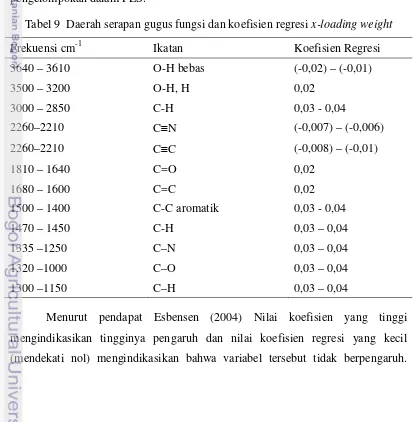
Tabel 5 IC50 sampel ekstrak propolis ke empat wilayah dan sampel referensi 30 Tabel 6 Daerah serapan gugus fungsi dominan kelompok 1 dan 2 analisis PCA 35 Tabel 7 Daerah serapan gugus fungsi dominan kelompok 1 dan 2 analisis PLS 39 Tabel 8 Daerah serapan gugus fungsi dan koefisien regresi 41 Tabel 9 Daerah serapan gugus fungsi dan koefisien regresi x-loading weight 43
Tabel 10 Kandungan total fenol propolis 46
Tabel 11 Kandungan total flavonoid propolis 48
DAFTAR GAMBAR
Gambar 1 Lebah Trigona spp. 7
Gambar 2 Propolis mentah 8
Gambar 3 Propolis mentah dari empat wilayah 9
Gambar 4 Ekstrak propolis 10
Gambar 5 Diagram alir ekstraksi propolis 11
Gambar 6 Spektrum FTIR 28
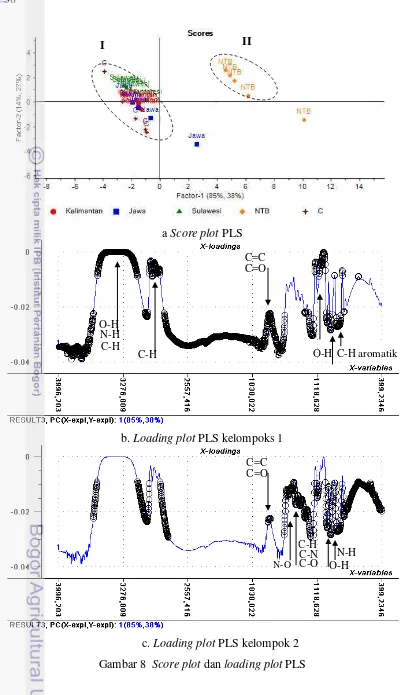
Gambar 7 Score plot dan loading plot PCA 34
Gambar 8 Score plot dan loading plot PLS 38
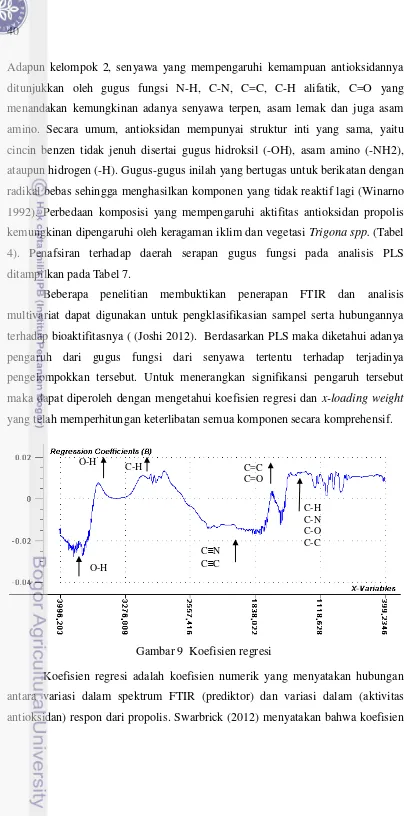
Gambar 9 Koefisien regresi 40
Gambar 10 X-loading weight 42
Gambar 11 Korelasi total fenol dan aktivitas antioksidan 50 Gambar 12 Korelasi total flavonoid dengan aktivitas antioksidan 53
DAFTAR LAMPIRAN
Lampiran 1 Total Fenol 64
Lampiran 2 Kurva Standar Asam Galat dan Regresinya 64 Lampiran 3 Hasil Analisis Ragam (ANOVA) Total Fenol 65
Lampiran 4 Total Flavonoid 66
Lampiran 5 Kurva Standar Kuersetin dan Regresinya 66 Lampiran 6 Hasil Analisis Ragam (ANOVA) Total Flavonoid 67
Lampiran 7 Aktifitas Antioksidan (IC50) 68
Lampiran 8 Perhitungan Inhibition Concentration 50 (IC50) 68 Lampiran 9 Hasil Analisis Ragam (ANOVA) Aktifitas Antioksidan (IC50) 69 Lampiran 10 Korelasi Fenol Aktifitas Antioksidan 70 Lampiran 11 Korelasi Flavonoid Aktifitas Antioksidan 73 Lampiran 12 Tabel Interpretasi Koefisien Nilai r 76
1
PENDAHULUAN
Latar Belakang
Dewasa ini, penggunaan bahan tambahan pangan atau produk alami semakin menarik perhatian karena dipercaya lebih aman dibanding bahan tambahan pangan yang dibuat dari bahan sintetik kimia. Terdapat kecenderungan industri pangan, industri kosmetik dan farmasi berupaya menemukan komponen bioaktif dari produk alam melalui proses ekstraksi dan pemurnian.
Sifat dari komponen bioaktif diantaranya adalah kemampuannya sebagai antioksidan. Senyawa antioksidan diketahui mampu memperpanjang masa simpan produk pangan dengan mekanisme diantaranya penghambatan terhadap reaksi peroksidasi lipid, yang merupakan salah satu reaksi yang mempercepat kerusakan produk selama pengolahan dan penyimpanan (Halliwel 1997). Komponen antioksidan merupakan unsur mikro dalam bahan pangan yang dapat menghambat oksidasi lemak melalui reaksi penghambatan inisiasi atau propagasi reaksi berantai oksidasi, serta melalui serangkaian penangkapan radikal bebas.
Salah satu produk alami yang memiliki kemampuan antioksidan adalah propolis. Propolis merupakan bahan yang diproduksi oleh lebah madu. Beberapa studi menyatakan bahwa propolis memiliki beragam bioaktivitas diantaranya antimikroba, antikanker, dan antioksidan (Ishida 2011). Kemampuan tersebut diperkirakan sebagian besar dipengaruhi komponen asam aromatik, senyawa fenol dan flavonoid (Grange & Davey, 1990). Efek antioksidan propolis diteliti secara tidak langsung melalui kemampuannya dalam melindungi produk pangan dan kemampuan penangkapan radikal bebas (Krol et al. 1990). Oleh karena itu,
propolis menjadi penting karena manfaat dan potensi penggunaannya di industri farmasi, makanan dan minuman. Penelitian terdahulu menunjukkan bahwa propolis memperpanjang masa simpan sosis dan produk daging (Ali et al. 2010;
Tosi et al. 2007), mentega (Ozcan & Ayar 2003), biskuit (Salam & Samiha 2000),
susu (Yang et al. 2009) dan sebagai pengemas makanan (Tosi et al. 2007).
2
pada lokasi dan asal tanaman propolis (Bankova et al. 2000). Sifat dan komposisi
kimia propolis yang berbeda pada dasarnya disebabkan oleh perbedaan asal tanaman (Markham et al. 1996). Menurut Bankova (2005) perbedaan komposisi
kimia ini mempengaruhi kemampuan aktivitas biologisnya Meskipun demikian masih belum jelas mekanisme aktivitas dan sifat dari komponen bioaktif tersebut.
Saat ini, produk propolis yang beredar di Indonesia didominasi oleh produk impor yang berasal dari lebah Apis mellifera. Lebah ini merupakan jenis
lebah yang terkenal di dunia, termasuk di Indonesia. Padahal, Indonesia memiliki berbagai jenis lebah lokal. Salah satu lebah lokal yang diketahui sebagai penghasil propolis adalah Trigona spp.
Lebah Trigona spp. sebelumnya tidak populer karena menghasilkan
sedikit madu dan sulit diesktrak tetapi propolis yang dihasilkan lebih banyak dibanding lebah yang lain (Hasan 2007). Penelitian mengenai propolis telah umum dilakukan pada lebah madu genus Apis namun masih sedikit pada Trigona spp. Lebah Trigona spp. sendiri merupakan lebah liar di Indonesia yang sudah
dapat dibudidayakan di lima provinsi, yaitu Bengkulu, Jawa Barat, Kalimantan Barat, Sulawesi Selatan, dan Nusa Tenggara Barat (Mahani et al. 2011). Pada
penelitian ini, pemilihan sumber propolis di keempat wilayah tersebut didasarkan atas perbedaan karakteristik fisik dan ketersediaannya.
Meskipun banyak senyawa bioaktif terkandung dalam propolis, namun sejauh ini penelitian terhadap kaitan kandungan total fenol dan flavonoid terhadap aktivitas antioksidan propolis yang diperoleh dari beberapa lokasi di Indonesia belum pernah dilaporkan. Beberapa kajian dilakukan untuk melihat hubungan kandungan fenol, flavonoid dan aktivitas antioksidan propolis. Namun sejauh ini penelitian kaitan kandungan fenol dan flavonoid terhadap aktivitas antioksidan propolis dari beberapa tempat di Indonesia belum ada. Meskipun demikian korelasi flavonoid, fenol dan aktivitas antioksidan tidak selalu terjadi. Hal ini bisa berarti ada senyawa lain yang berperan dalam aktivitas antioksidan. Oleh karena itu penyebab perbedaan aktivitas antioksidan propolis dari masing-masing daerah tersebut secara lebih lanjut dapat diketahui menggunakan pendekatan metabolomik.
3 mana yang potensial sebagai sumber antioksidan. Metabolomik adalah proses analisis metabolit yang ada pada suatu organisme secara komperehensif secara kuantitatif dan kualitatif (Dunn & Ellis 2005). Pendekatan metabolomik dalam penelitian ini diarahkan untuk pengklasifikasian sampel sehingga diketahui perbedaan propolis antar masing-masing wilayah dan aktifitas antioksidannya. Salah satu instrumen yang dapat digunakan dalam penelitian berbasis metabolomik adalah FTIR. Penggunaan spekstroskopi FTIR dilakukan karena mudah, praktis dan terjangkau. Penggunaan teknik kemometrik yaitu PCA dan PLS pada pendekatan metabolomik digunakan untuk membedakan propolis baik berdasarkan wilayah dan aktifitas antioksidannya.
Studi ini bertujuan untuk menggunakan pendekatan metabolomik dalam mengklasifikasikan propolis dari berbagai wilayah di Indonesia yaitu Sulawesi Selatan (Kabupaten Luwu), Kalimantan Barat (Kabupaten Sambas), NTB (Kabupaten Lombok), Kabupaten Ciamis (Jawa Barat), khususnya propolis lebah madu Trigona spp. Selanjutnya mengevaluasi kapasitas antioksidan, kandungan
fenol dan flavonoid propolis. Selain itu, dikaji hubungan kapasitas antioksidan dengan kandungan total fenol dan flavonoid propolis. Pendekatan metabolomik dengan menggunakan FTIR digunakan untuk mengetahui perbedaan komposisi kimiawi propolis setiap daerah dan mengkorelasikannya dengan profil antioksidannya.
Tujuan Penelitian
Tujuan penelitian ini yaitu:
1. Mengidentifikasi sidik jari metabolomik (metabolomic fingerprint) propolis
dari ke empat wilayah dan mengkorelasikannya dengan profil antioksidannya. 2. Mengevaluasi propolis yang potensial sebagai antioksidan dari beberapa
wilayah tersebut.
3. Menganalisis aktivitas antioksidan, kandungan fenol dan flavonoid dari propolis yang dihasilkan lebah madu spesies Trigona spp. dari berbagai daerah
di Indonesia yaitu Sulawesi Selatan (Kabupaten Luwu), Kalimantan Barat (Kabupaten Sambas), Nusa Tenggara Barat (Kabupaten Lombok), Kabupaten Ciamis (Jawa Barat).
4
Hipotesis
Terdapat perbedaan komposisi kimiawi propolis Trigona spp. dari berbagai
daerah di Indonesia yaitu Sulawesi Selatan (Kabupaten Luwu), Kalimantan Barat (Kabupaten Sambas), Nusa Tenggara Barat (Kabupaten Lombok), Kabupaten Ciamis dan Majalengka (Jawa Barat). Perbedaan ini akan mempengaruhi aktivitas antioksidannya.
Manfaat Penelitian
Hasil penelitian ini dapat digunakan sebagai data untuk pengembangan propolis lebah madu Trigona spp. pada daerah yang memiliki potensi sebagai
2
TINJAUAN PUSTAKA
Lebah Dan Produk Lebah
Di dunia terdapat beberapa jenis lebah madu. Lebah madu merupakan hewan serangga bersayap termasuk family Apidiae yang mempunyai tiga genus: Apis, Trigona dan Melipona (Murtidjo 1991). Spesies lebah sangat banyak, yang telah dibudidayakan adalah Apis cerana, Apis mellifera, Apis nigrocincta, Apis nuluensis dan Apis koschevnikovi serta Trigona spp.
Lebah madu sepanjang hidupnya selalu bekerja. Selain membantu penyerbukan tumbuhan, lebah madu memproduksi berbagai zat yang bermanfaat bagi kesehatan. Produk yang umum dikenal adalah madu. Padahal sebenarnya banyak produk lain yang dihasilkan yaitu royal jelly, bee pollen, lilin lebah, racun lebah dan propolis.
Lebah Madu Trigonaspp.
Salah satu jenis lebah madu yang mampu menghasilkan propolis dalam jumlah banyak yaitu jenis Trigona spp. (Salatino et al. 2005). Lebah ini
merupakan lebah asli Asia dari genus trigona yang memiliki sifat yaitu jarang sekali hijrah serta harga produk madunya lebih tinggi dibandingkan dengan madu produk lebah genus Apis. Karakteristik lain dari Trigona spp. yaitu menghasilkan
madu dengan aroma yang khas yaitu rasa campuran manis dan asam seperti lemon, namun tahan terhadap fermentasi (Suranto 2010). Aroma tersebut berasal dari resin tumbuhan dan bunga yang dihinggapi lebah.
Di kalangan konsumen, madu Trigona dianggap lebih bagus sehingga harga madunya lebih mahal dibandingkan dengan madu produksi lebah genus Apis. Selain madu, Trigona spp. juga menghasilkan propolis berkualitas tinggi.
Hal ini ditunjukkan melalui kandungan antioksidannya yaitu flavonoid. Hasan (2009) melaporkan bahwa kadar flavonoid propolis trigona mencapai 4%, sedangkan propolis apis hanya 1,5%.
Lebah Trigona spp. merupakan lebah liar di Indonesia yang sebelumnya
6
spp. termasuk lebah yang tidak memiliki sengat atau disebut stingless bee
sehingga untuk mempertahankan diri lebah ini akan menggigit sebagai bentuk pertahanan ketika sarangnya diganggu. Meskipun lebah Trigona spp. tidak
memiliki sengat, mekanisme pertahanan diri yang unik adalah berupaya melindungi koloni dengan upaya yang lebih keras, yakni memproduksi propolis dalam jumlah besar. Hal inilah yang menjadikan propolis lebah Trigona spp. lebih
banyak dibanding lebah lainnya.
Produksi propolis lebah anggota famili Meliponidae itu mencapai 80% atau lima kali produksi propolis lebah madu Apis cerana dan Apis mellifera yang
hanya menghasilkan propolis sekitar 15%. Dalam satu koloni, produksi propolis Trigona dapat mencapai 3 kg per tahun; lebah genus Apis berkisar 20—30 gram per tahun. Keistimewaan lainnya dari lebah Trigona spp. menurut Mahani et al.
(2011) adalah kemudahan untuk dibudidayakan, ketahanan terhadap hama penyakit, komponen fitokimia lebih beragam karena keragaman rasa dan warna propolis baku dan tidak mengenal masa paceklik sehingga propolis dapat diproduksi sepanjang tahun dengan hasil yang lebih tinggi
Pengembangan budi daya propolis lebah lokal di Indonesia memiliki potensi yang sangat tinggi karena didukung oleh jenis vegetasi yang beragam di Indonesia dan juga hutan yang sangat luas, yaitu sekitar 200 juta hektar (Mahani
et al. 2011). Lebah Trigona spp. sendiri sudah dapat dibudidayakan di lima
provinsi, yaitu Bengkulu, Jawa Barat, Kalimantan Barat, Sulawesi Selatan, dan Nusa Tenggara Barat.
Saat ini ada tiga provinsi yang telah berhasil membudidayakan lebah
Trigona spp, yaitu Jawa Barat, Sulawesi Selatan, dan Nusa Tenggara Barat.
Propolis di masing-masing provinsi tersebut dapat dipanen setiap empat bulan sekali. Free (1982) menyatakan bahwa lebah Trigona spp. merupakan salah satu
7
Divisi : Animalia Filum : Arthopoda Kelas : Insekta Ordo : Hymenoptera Famili : Apidea Genus : Trigona
Spesies : Trigona spp. (Free 1982)
Propolis
Propolis merupakan suatu zat yang dihasilkan lebah madu. Propolis adalah sejenis resin yang karena teksturnya lengket seperti lem disebut sebagai lem lebah (bee glue) (Hausen et al. 1987 dalam Hasan 2010). Propolis berperan dalam
pembangunan sarang, jika kekurangan maka sarang tidak akan sempurna. Menurut Bankova et al. (2000) propolis dalam sarang digunakan oleh lebah
pekerja untuk menutup celah-celah, mendempul retakan-retakan, memperkecil dan menutup lubang.
Propolis dihasilkan lebah dengan cara mengumpulkan resin dari berbagai macam tumbuhan. Resin dikumpulkan dari kuncup, kulit atau bagian lain dari tumbuhan, kemudian resin dicampur dengan saliva dan enzim pada lebah sehingga menjadi resin baru yang berbeda dengan resin asalnya (Pereira et al.
2002). Selanjutnya dicampur dengan wax (lilin) dan serbuk sari bunga. Campuran dibuat menjadi elastis. Produk campuran elastis inilah yang disebut propolis. Bentuk propolis mentah sebelum diekstraksi yang diperoleh dari sarang lebah disajikan pada Gambar 2.
8
(Salatino et al. 2005). Hal ini karena meskipun propolis merupakan produk hasil
hewan, komponen penyusunnya sebagian besar merupakan turunan dari tumbuhan. (Kumazawa et al. (2004) mengemukakan bahwa flavonoid pada
propolis dipastikan memiliki asal usul sebagaimana flavonoid pada tumbuhan.
Perhatian terhadap sampel propolis dari zona tropis seperti Indonesia dengan keanekaragaman hayati yang luas semakin meningkat secara ilmiah dan secara ekonomi. Hubungan antara komposisi kimia propolis dari daerah geografis yang berbeda dengan aktivitas biologis mengarah pada identifikasi prinsip-prinsip aktif, alat fundamental untuk mencapai standarisasi dari produk lebah.
Pada penelitian ini, pemilihan propolis Trigona spp. dari ke empat wilayah
yaitu Jawa Barat, Kalimantan Barat, Sulawesi Selatan dan Nusa Tenggara Barat didasarkan atas aspek perbedaan karakteristik fisik dan ketersediaan propolisnya. Karakteristik fisik propolis mentah dari ke empat wilayah itu berbeda-beda. Propolis Sulawesi Selatan memiliki warna terang (dominan warna merah-kuning) dan sangat aromatik. Sebaliknya propolis Jawa berwarna gelap (dominan hitam) dan hampir tidak memiliki aroma.
Adanya perbedaan karakterisitik fisik propolis ini kemungkinan mempengaruhi pula perbedaan sifat-sifat kimiawi, klinis dan sebagainya. Sementara itu untuk aspek ketersediaan, sebenarnya propolis Trigona spp. dapat
diproduksi hampir di semua propinsi di Indonesia. Tetapi sentra produksi propolis
Trigona spp. di Indonesia pada saat ini masih terbatas di empat wilayah tersebut.
9
Ekstraksi Propolis
Ekstrak propolis diperoleh dari CV Nutrima yang mengumpulkan propolis mentah dari empat wilayah yaitu dari Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan NTB. Adapun propolis mentah dari ke empat lokasi tersebut ditunjukkan pada Gambar 3.
Sebagian besar sampel propolis mentah ini memiliki bau yang khas dengan warna dari kuning sampai coklat kehitaman. Propolis dikumpulkan oleh lebah madu Trigona spp. dari beragam sumber. Komposisi yang tepat dari
propolis mentah bervariasi tergantung sumbernya sehingga kandungan kimia seperti fenol dan flavonoid dalam propolis bervariasi. Propolis mentah tersebut kemudian diekstraksi untuk memperoleh ekstrak propolis. Hasil ekstrak propolis diperlihatkan pada Gambar 4 berikut.
Metode yang digunakan CV Nutrima untuk mengekstrak propolis adalah berdasarkan metode Mahani (2011). Pelarut yang digunakan adalah etanol 70% karena memiliki sifat semipolar sehingga komponen aktif dengan kepolaran berbeda yang terdapat dalam propolis dapat terekstrak dengan waktu yang
a. Kalimantan Barat b. Jawa Barat
10
berbeda. Jumlah rendemen dipengaruhi oleh metode ekstraksi, warna propolis, dan komposisi zat aktif di dalam propolis kasar. Diagram alir proses ektraksi propolis dapat dilihat pada Gambar 5.
Propolis mentah terlebih dahulu dibekukan dalam refrigerator atau freezer. Propolis memiliki sifat membeku dan membentuk padatan keras dan rapuh pada suhu kurang dari 15°C. Tahapan berikutnya adalah pemecahan bahan propolis mentah menggunakan pisau. Proses pemecahan harus dilakukan dengan cepat, saat propolis mentah masih membeku. Untuk memastikan propolis dapat dipecah dengan cepat, propolis mentah sebelumnya dibuat menjadi lempengan dengan ukuran panjang x lebar x tinggi : 20 cm x 8 cm x 2,5 cm. Setiap lempengan propolis mentah ini kira-kira memiliki bobot 1 kg. Pecahan propolis yang dihasilkan harus segera disimpan kembali pada suhu kurang dari 15°C. Pecahan propolis mentah tersebut siap untuk memasuki tahapan proses ekstraksi.
a. Kalimantan Barat b. Jawa Barat
c. Sulawesi Selatan d. NTB
11
Gambar 5 Diagram alir ekstraksi propolis
Proses ekstraksi dengan menambahkan pelarut etanol 70% pada pecahan propolis mentah menggunakan blender berlangsung 5 menit. Tahapan proses ekstraksi adalah; sebanyak 1 kg pecahan propolis mentah dimasukkan ke dalam blender dan segera ditambahkan pelarut etanol 70% dengan perbandingan propolis : pelarut = 1 : 2,5 (B/V). Proses pehancuran ini akan mengubah pecahan propolis menjadi bubur propolis, dengan ukuran butiran propolis yang sangat kecil. Butiran propolis pada bubur tersebut lolos saringan 30 mesh.
Propolis Mentah
Pembekuan (disimpan pada lemari
Pemecahan Propolis
Penghancuran & Pelarutan menggunakan blender 5 menit
• Perbandingan propolis:etanol = 1:2,5 (1) • Perbandingan propolis:etanol = 1:1,5 (2)
Bubur propolis Diendapkan 1 malam
Filtrat
Penguapan menggunakan Rotavapor
Ekstrak Propolis
Penambahan Propilen Glikol
• Ekstrak propolis:propilen glikol=1:12
Propolis Cair
12
Untuk mendapatkan filtrat propolis, bubur propolis diendapkan pada wadah tertutup (kedap cahaya dan udara) selama 12 jam. Filtrat dipisahkan dari ampas dan ditampung pada wadah terpisah (kedap cahaya dan udara). Filtrat yang dihasilkan bersifat pekat. Ampas propolis, ditambahkan lagi pelarut etanol 70% dengan perbandingan (1:1,5 B/V) lalu diblender kembali selama 5 menit. Proses yang sama diulangi hingga 3 kali.
Proses selanjutnya yaitu penguapan/pengentalan filtrate propolis yang dihasilkan. Pengentalan dilakukan dengan alat rotary evaporator yang dihubungkan dengan vacuum pump, pada suhu maksimum 50°C, kecepatan
putaran 3 rpm. Selama proses penguapan/pengentalan, filtrat propolis akan mengalami perubahan warna. Awal proses penguapan/pengentalan, filtrat propolis berwarna coklat gelap. Jika etanol telah habis menguap, dan tersisa air dan propolis, filtrat propolis berubah menjadi coklat susu. Filtrat propolis akan berubah warna kembali menjadi coklat gelap apabila air yang tersisa telah habis menguap. Proses penguapan/pengentalan dihentikan bila dihasilkan ekstrak kental propolis dan berwarna coklat gelap. Pada proses akhir, ekstrak propolis yang diperoleh ditambahkan filler cair (propilen glikol) sesuai konsentrasi yang diinginkan sehingga dihasilkan propolis cair.
Tabel 1 Rendemen Propolis Asal Propolis Propolis Mentah
berat (g)
Propolis Ekstrak berat (g)
Rendemen %
Nusa Tenggara Barat 100 8,2 8,2
Sulawesi Selatan 100 10,1 10,1
Jawa Barat 100 8,2 8,2
Kalimantan Barat 100 8,5 8,5
Berdasarkan informasi dari CV Nutrima maka perbandingan rendemen ekstrak propolis yang diperolah ditampilkan pada Tabel 1. Berdasarkan Tabel 1 maka propolis dari Jawa Barat, Kalimantan Barat dan Nusa Tenggara Barat memiliki yield lebih rendah dibanding propolis Sulawesi Selatan.
Karakteristik Propolis
13 jenis tumbuhan asal resin merupakan faktor utama yang menimbulkan perbedaan komposisi senyawa kimia dari propolis. Perbedaan komposisi senyawa kimia yang menyusun propolis menyebabkan perbedaan warna dan aroma propolis pada jenis yang berbeda. Aroma yang tercium merupakan senyawa aromatik yang bersifat mudah menguap (Salatino et al. 2005).
Pada suhu 25-45o
Komposisi Kimiawi Propolis dan Bioaktivitasnya
C tekstur propolis menjadi lengket dan lentur, sedangkan di atas suhu tersebut propolis semakin lengket menyerupai permen karet. Adapun pada suhu rendah, propolis memiliki tekstur keras dan rapuh. Sementara pada suhu 60-70C propolis akan mencair (Suranto 2007).
Secara kimia, komponen kimiawi propolis sangat kompleks dan kaya akan senyawa terpena, asam benzoat, asam kafeat, asam sinamat, dan asam fenolat. Propolis juga mengandung banyak senyawa fenol khususnya flavonoid sehingga propolis merupakan sumber senyawa flavonoid yang baik (Mihai et al. 2011).
Krol et al. (1994) menyatakan bahwa flavonoid merupakan kelompok senyawa
kimia yang diketahui memiliki aktivitas antioksidan terutama kemampuannya dalam mengikat radikal bebas (free radical scavenging) dan sifat mengkelat
logam (metal chelating).
Senyawa fenol umumnya terdapat pada tumbuhan yang dilaporkan memiliki beragam kemampuan bioaktivitas termasuk aktivitas antioksidan (Kahkonen et al. 1999). Viuda et al. (2008) melaporkan bahwa salah satu ikatan
fenol yang ada dalam propolis yaitu Caffeic Acid Phenethyl Ester (CAPE) yang kadarnya mencapai 50% dari keseluruhan komponen. CAPE merupakan sisi aktif flavonoid yang bekerja untuk memaksimalkan aktivitas scavenger terhadap radikal bebas, dengan cara menurunkan aktivitas radikal hidroksil (●OH) sehingga tidak terlalu reaktif lagi (Cadenas & Packer 2002).
Menurut Kumazawa et al. (2004) kandungan fenol diperkirakan
bertanggung jawab sebagai antioksidan utama pada propolis. Penelitian kandungan fenol dan flavonoid propolis yang diperoleh dari lebah Apis dari beberapa negara (Laskar et al. 2010, Mohammadzadeh et al. 2007 dan Kumazawa et al. 2004) disajikan pada Tabel 2. Tabel 2 memperlihatkan adanya perbedaan
14
[image:30.595.68.488.109.750.2]vegetasi dari daerah asal propolis sehingga perbedaan lokasi geografis asal propolis tersebut akan menentukan komposisi fenol dan flavonoidnya. Disamping adanya senyawa fenol dan flavonoid, propolis juga mengandung zat gizi penting seperti vitamin dan mineral. Vitamin di antaranya B1, B2, B6, C dan E. Gugus kimia utama yang terdapat dalam resin propolis meliputi asam fenol atau esternya, flavonoid (flavon, flavanon, flavonol, dihiroflavonol dan kalkon), terpen, aldehid dan alkohol aromatik, asam lemak, stilbena dan b-steroid (Marcucci 1995).
Tabel 2 Kandungan fenol dan flavonoid propolis dari beberapa wilayah/negara Wilayah/Negara Fenol mg/g EAG Flavonoid mg/g EK
Indiaa 159.10 ± 0.26 57.25 ± 0.24
Tehran (Iran)b 7.79 ± 0.39 8.46 ± 0.03
Isfahan (Iran) 3.18 ± 0.08 7.11 ± 0.19
Khorasan (Iran) 1.22 ± 0.33 3.08 ± 0.02
Argentinac 212 ± 9.2 130 ± 5.5
Australia 269 ± 16.3 145 ± 6.5
Brazil 120 ± 5.6 51.9 ± 2.4
Bulgaria 220 ± 2.5 157 ± 8.9
Chile 210 ± 11.1 116 ± 9.3
China (Hebei) 298 ± 8.7 147 ± 9.3
China (Hubei) 299 ± 0.5 158 ±10.8
China (Zhejiang) 262 ± 12.6 136 ± 17.4
Hungary 242 ± 0.2 176 ± 1.7
New Zealand 237 ± 6.0 152 ± 12.6
South Africa 99.5 ± 4.4 50.8 ± 0.8
Thailand 31.2 ± 0.7 2.5 ± 0.8
Ukraine 255 ± 7.4 63.7 ± 3.2
Uruguay 187 ± 8.5 168 ± 6.4
United States 256 ± 15.7 122 ± 6.2
Uzbekistan 174 ± 6.7 94.2 ± 6.8
aLaskar
et al. 2010; bMohammadzadeh et al. 2007; c
Propolis juga mengandung 16 asam amino essensial yang dibutuhkan untuk regenerasi sel. Dari semua asam amino yang terdapat dalam propolis, arginin dan prolin tergolong yang terbanyak, sekitar 45,8%. Propolis mengandung
15 semua mineral, kecuali sulfur. Zat besi (Fe) dan seng (Zn) adalah kandungan yang terbanyak. Kandungan mineral ini sangat dipengaruhi oleh lingkungan tempat tumbuh tanaman. Berdasarkan penelitian terdahulu disimpulkan bahwa perbedaan komposisi propolis dipengaruhi daerah asal propolis (Bankova 2009).
Antioksidan
Antioksidan sangat bermanfaat bagi kesehatan dan berperan penting untuk mempertahankan mutu produk pangan. Antioksidan berguna untuk mencegah ketengikan, perubahan nilai gizi, perubahan warna dan aroma, serta kerusakan fisik lain pada produk pangan karena oksidasi dapat dihambat oleh antioksidan ini (Yu 2008). Senyawa antioksidan memiliki berat molekul kecil, tetapi mampu menginaktivasi berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal (Winarsi 2007). Propolis mempunyai aktivitas antioksidan yang paling kuat dalam melawan oksidan dan radikal bebas (radikal H2O2, O2● -, OH●) dibandingkan dengan hasil produk lebah lainnya (Nakajima et al. 2009).
Aktifitas antioksidan propolis berbeda-beda berdasarkan asal wilayahnya sebagaimana disajikan pada Tabel 3. Propolis pada tabel tersebut merupakan propolis dari lebah madu Apis (Laskar et al. 2010; Moreira et al. 2008;
Kumazawa et al. 2004). Tabel 3 menampilkan perbedaan aktivitas antioksidan
dari masing-masing wilayah/negara. Perbedaan aktivitas tersebut dipengaruhi asal daerah propolis.
Tabel 3 Aktivitas antioksidan propolis
Asal wilayah/negara IC50 (mg/ml)
Indiaa 0.07
Bomes (Portugal)b 0.006 ± 0.003
Fundao (Portugal) 0.052 ± 0.003
Brasilc 0,79 ± 0,23
aLaskar et al. 2010; b
Aktivitas antioksidan propolis dipengaruhi oleh komposisi kimiawinya. Oleh karena komposisi kimiawi propolis tersebut berbeda-beda tergantung daerah asalnya yaitu dipengaruhi vegetasinya maka intensitas aktivitas antiokisan dari propolis tersebut kemungkinan juga berbeda-beda.
16
Metode Uji Antioksidan
Banyak metode yang bisa digunakan untuk mengukur aktivitas antioksidan. Metode yang sering digunakan antara lain daya pereduksi atau FRAP, penangkapan radikal 3-etilbenzotiazolin-6-asam sulfonat atau ABTS, besi(III) tiosianat atau FTC, asam tiobarbiturat atau TBA, penangkapan radikal 1,1-difenil-2-pikrilhidrazil atau DPPH (Ozyurt et al. 2006).
Salah satu metode yang sekarang populer digunakan adalah metode DPPH (Molyneux 2004). DPPH banyak digunakan untuk menguji kemampuan mengikat radikal bebas pada berbagai macam sampel (Pereira et al. 2006; Sousa et al. 2008)
seperti buah, sayuran, atau pun biji. Pengukuran aktivitas antioksidan pada metode ini menggunakan spektrofotometer ultraviolettampak (UV-Vis) karena relatif sederhana, mudah dioperasikan, waktu analisisnya relatif cepat, hasilnya memiliki ketelitian yang cukup memadai, dan aplikasinya dapat menjangkau berbagai bidang analisis antara lain bidang anorganik, organik, polimer, klinis, dan mikrobiologi. Disamping itu, metode ini tidak memerlukan substrat sehingga memiliki keuntungan yaitu peka, murah dan memerlukan sedikit sampel (Marghitas et al. 2009)
Metabolomik
Metabolomik adalah proses analisis metabolit yang ada pada suatu organisme secara komperehensif, secara kuantitatif dan kualitatif (Dunn & Ellis 2005). Penentuan metabolit tersebut dapat dihubungkan dengan karakter tertentu seperti terkait dengan penyakit, respon pengobatan, metabolisme obat, perlakuan kimiawi dan sebagainya. Fave et al. (2009) mengemukakan bahwa analisis
metabolomik sangat ditentukan oleh keakuratan terhadap berbagai senyawa metabolit yang terkandung dalam bahan yang hendak dianalisis.
Metabolomik merupakan proses menggambarkan keberadaan berbagai objek dalam suatu target sehingga berbagai senyawa yang ada harus terekam secara accurate (teliti) dan precise (tepat). Dengan demikian dipilih metode
instrumentasi yang sesuai kriteria sensitivitas dan selektivitas serta dapat mengakomodasi serta mendeteksi berbagai senyawa dengan kisaran BM rendah ke tinggi sesuai tujuan analisis (Kemsley et al. 2006)
17 metabolom dalam suatu sistem biologis, baik itu untuk kuantifikasi metabolit maupun hanya untuk klasifikasi sampel. Strategi tersebut adalah metabolite profiling, metabolite targetted analysis, metabolite fingerprinting dan metabonomic. Dua strategi pertama utamanya digunakan untuk identifikasi dan
kuantifikasi metabolit, sedangkan dua yang terakhir terutama digunakan untuk klasifikasi sampel. Pada penelitian ini, pendekatan metabolomik diarahkan untuk pengklasifikasian sampel yaitu metabolite fingerprinting untuk mengetahui
perbedaan propolis dari masing-masing wilayah tersebut (Dunn & Ellis 2005). Ke empat strategi ini diimplementasikan melalui beberapa teknik analisis seperti kromatografi, spektroskopi, spektrometri massa dan kombinasi diantara ketiganya. Menurut Hussain et al. (2009) salah satu teknik spektroskopi yang
umum digunakan dalam kajian metabolomik adalah FTIR (Fourier Transform Infrared). FTIR menggunakan karakteristik vibrasi dalam molekul untuk
menghasilkan suatu spektra sidik jari yang fitur-fiturnya didefinisikan dari gugus fungsi yang ada dalam sampel. Keistimewaan dari spektra FTIR suatu sampel dengan kemudahan, kecepatan serta reprodusibilitas data yang dihasilkannya, menjadikan FTIR sebagai metode pilihan dalam klasifikasi sampel berdasarkan asal atau sifat biologisnya.
Adapun penggunaan teknik spekstroskopi FTIR untuk analisis sidik jari (fingerprint) propolis masih terbatas. Oleh karena itu, dalam penelitian ini
digunakan penggunaan teknik spektroskopi FTIR metabolite fingerprinting.
Karakteristik sidik jari spektra FTIR ekstrak propolis dari beberapa wilayah di Indonesia akan dikaitkan dengan bioaktivitasnya (aktivitas antioksidan) dan spektra FTIR akan digunakan untuk memprediksi komponen bioaktif yang terlibat.
Fourier Transform Infrared (FTIR)
18
Hampir setiap senyawa yang memiliki ikatan kovalen akan menyerap berbagai frekuensi radiasi elektromagnetik dalam daerah spektrum inframerah. Daerah spektrum elektromagnetik inframerah terletak pada panjang gelombang sekitar 400 cm-1 sampai 4000 cm-1. Seperti halnya dengan tipe penyerapan energi yang lebih tinggi bila menyerap radiasi inframerah, penyerapan radiasi inframerah merupakan proses kuantisasi. Hanya energi tertentu dari radiasi inframerah akan diserap oleh molekul.
Menurut Kemsley et al. (2006) setiap tipe ikatan yang berbeda mempunyai
sifat frekuensi vibrasi yang berbeda, dan karena tipe ikatan yang sama dalam dua senyawa yang berbeda terletak dalam lingkungan yang sedikit berbeda, maka tidak akan ada dua molekul yang berbeda strukturnya akan mempunyai bentuk serapan inframerah atau spektrum inframerah yang tepat sama. Transisi yang terjadi didalam serapan inframerah berkaitan dengan perubahan-perubahan vibrasi dalam molekul. Daerah radiasi spektroskopi inframerah berkisar pada panjang gelombang 1280-10 cm-1 atau pada 0,78-1000 cm-1.
Ada 2 jenis instrumentasi untuk absorbsi inframerah yaitu, instrumentasi dispersi (konvensional) yang hanya digunakan untuk analisis kualitatif dan instrumentasi yang menggunakan Fourier Transform Infrared (FTIR) dapat
digunakan untuk analisis kuantitatif dan kualitatif (Shulaeva 2008). Spektroskopi FTIR (Fourier Transform Infrared) merupakan salah satu teknik yang sangat baik
dalam proses identifikasi struktur molekul suatu senyawa (Joshi, 2012). Komponen utama spektroskopi FTIR adalah interferometer Michelson yang
mempunyai fungsi menguraikan (mendispersi) radiasi inframerah menjadi komponen-komponen frekuensi.
Penggunaan interferometer Michelson tersebut memberikan keunggulan
metode FTIR dibandingkan metode spektroskopi inframerah konvensional maupun metode spektroskopi yang lain. Keunggulan tersebut diantaranya adalah informasi struktur molekul dapat diperoleh secara tepat dan akurat (memiliki resolusi yang tinggi). Keuntungan yang lain dari metode ini adalah dapat digunakan untuk mengidentifikasi sampel dalam berbagai fase (gas, padat atau cair). Mengacu Kemsley et al. (2006) maka pembagian daerah spektra inframerah
19 1. Daerah frekuensi gugus fungsional
Terletak pada daerah radiasi 4000–1400 cm-1. Pita-pita absorpsi pada daerah ini utamanya disebabkan oleh vibrasi dua atom, sedangkan frekuensinya karakteristik terhadap massa atom yang berikatan dan konstanta gaya ikatan.
2. Daerah sidik jari (fingerprint)
Daerah sidik jari adalah daerah yang terletak pada 1400–400 cm-1
Principal Component Analysis (PCA) dan Partial Least Square (PLS) . Pita-pita absorpsi pada daerah ini berhubungan dengan vibrasi molekul secara keseluruhan. Setiap atom dalam molekul akan saling mempengaruhi sehingga dihasilkan pita-pita absorpsi yang khas untuk setiap molekul (Kemsley et al.
2006)
Menurut Maraschin et al. (2012), spektroskopi inframerah mengandung
banyak serapan yang berhubungan dengan sistem vibrasi yang berinteraksi dalam suatu molekul akan memberikan puncak-puncak yang sangat karakteristik dalam spektra. Corak puncak ini dikenal sebagai sidik jari (fingerprint) molekul yang
merupakan daerah yang mengandung sejumlah besar vibrasi yang tidak dapat dimengerti. Dengan cara membandingkan spektra inframerah dari dua senyawa yang diperkirakan identik maka dapat dinyatakan kedua senyawa tersebut identik atau tidak. Hal penting dalam area sidik jari ini adalah setiap senyawa yang berbeda menghasilkan pola lembah yang berbeda-beda pada spektrum bagian ini.
Penelitian ini mencoba mengetahui perbedaan propolis dari beberapa wilayah berdasarkan pola khas kimiawi, dalam hal ini adalah pola spektrum FTIR pada daerah sidik jari. Data dari FTIR ini dapat dikorelasikan dengan aktivitas antioksidan propolis yang berasal dari beberapa wilayah di Indonesia.
Studi metabolomik memerlukan metode statistik yang dapat mencakup banyak data. Informasi nilai chemical shift, berat molekul tertentu (BM) dan
intensitas puncak tidak bermakna jika tidak dilakukan integrasi dengan data lain. Analisis terhadap perbedaan antar sampel menjadi sulit jika mengobservasi range setiap data sedemikian sehingga metode statistik harus dilibatkan.
20
FTIR tersebut, diperlukan suatu metode statistik kemometrik berupa analisis multivariat (Kemsley et al. 2006).
Analisis multivariat menyediakan metode untuk mengurangi dimensi data berukuran besar yang diperoleh dari instrumen seperti spektrofotometer (Esbensen, 2004). Metode statistik multivariat yang sering digunakan adalah PCA (Principal Component Analysis). Setelah analisis PCA kemudian dilanjutkan
dengan metode supervised PLS (Partial Least Square) yang akan memperlihatkan
kontribusi dari komponen dalam sampel (senyawa) terhadap bioaktivitas.
PCA merupakan suatu metode analisis peubah ganda yang bertujuan memperkecil dimensi peubah asal sehingga diperoleh peubah baru (principal component, PC) yang tidak saling berkorelasi tetapi menyimpan sebagian
informasi yang terkandung pada peubah asal. Adapun PLS digunakan untuk memperkirakan serangkaian peubah tidak bebas (respons) dari peubah bebas (prediktor) yang jumlahnya sangat banyak, memiliki struktur sistematik linear atau nonlinear, dengan atau tanpa data yang hilang, dan memiliki kolinearitas yang tinggi (Herve 2007). Metode ini membentuk model dari peubah-peubah yang ada untuk membentuk serangkaian respons dengan menggunakan regresi kuadrat terkecil dalam bentuk matriks.
Analisis PCA terhadap spektrum FTIR sampel terhadap kisaran bilangan gelombang secara keseluruhan maupun pada daerah sidik jarinya dapat mengelompokkan tiap sampel berdasarkan daerahnya (Ellis et al. 2004). Adapun
3
METODE PENELITIAN
Tempat dan Waktu
Penelitian dilakukan di Laboratorium Kimia Pangan SEAFAST Center Institut Pertanian Bogor dan Laboratorium Pusat Studi Biofarmaka Bogor. Pelaksanaan Penelitian selama tiga bulan dari Agustus-Oktober 2012.
Bahan dan Alat
Bahan
Bahan yang digunakan dalam penelitian ini adalah propolis dari daerah Sulawesi Selatan (Kabupaten Luwu), Kalimantan Barat (Kabupaten Sambas), NTB (Kabupaten Lombok), Kabupaten Ciamis (Jawa Barat). Sampel Ekstrak propolis diperoleh dari CV Nutrima, Bogor. Propolis mentah dari ke empat wilayah diekstrak oleh CV Nutrima untuk kemudian diperoleh propolis cair. Ekstrak propolis yang diterima sebanyak dua botol ukuran 100 ml. Ekstrak propolis kemudian disimpan di lemari pendingin untuk keperluan analisis selanjutnya. Sebelum dianalisis sampel dikocok terlebih dahulu untuk homogenisasi.
Bahan kimia untuk analisis yang digunakan untuk uji aktivitas antioksidan meliputi kristal 1,1-difenil-2-pikrilhidrazil (DPPH) dan Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-Carboxylic Acid) sebagai pembanding. Bahan-bahan untuk penentuan total fenol adalah etanol 70%, akuades, Na2CO3 5%, reagen Folin-Ciocalteau 50%, dan asam galat. Bahan-bahan untuk penentuan total flavonoid adalah kuersetin , NaNO2 dan AlCl3
Alat
. Bahan analisis FTIR adalah KBr.
Peralatan yang digunakan antara lain timbangan digital, spektrofotometer UV-Vis, spektrofotometer FTIR Tensor 37 (Bruker), tabung reaksi dan vortex.
Metode Penelitian
22
Analisis Sampel Menggunakan Spektroskopi FTIR
Preparasi sampel dilakukan dengan teknik pengolesan yaitu sampel propolis diteteskan pada window (lapisan tipis KBr) sebanyak 1 tetes (0,2 ml) kemudian diratakan ke seluruh permukaan window sampai bisa tertembus oleh
sinar. Kemudian dicari terlebih dahulu spektrum dari pelarut propilen glikol yang digunakan yang berfungsi sebagai background. Setelah mendapatkan background
kemudian data background disimpan sebagai acuan. Kemudian window yang telah
diolesi sampel dimasukkan kedalam sample holder pada alat FTIR. Kemudian
operasikan alat FTIR sampai didapatkan suatu spektrum dari sampel tersebut. Ulangan dilakukan sebanyak lima kali terhadap masing-masing sampel sehingga diperoleh lima spektrum untuk setiap sampel, sedangkan total spektrum FTIR dari ke empat sampel (Jawa Barat, Kalimantan Barat, Sulawesi Selatan, NTB) adalah 20 spektrum. Selain sampel dianalisis pula spektrum dari propolis komersial sebagai pembanding yang diulang sebanyak 5 kali. Spektrum IR dalam format OPUS disimpan dalam format data point table (DPT) yang dapat dibuka
dengan menggunakan perangkat lunak Microsoft Excel. Data spektrum yang
digunakan ialah data keseluruhan serapan. Spesifikasi dan parameter alat:
• Sumber cahaya = MIR (Medium Infrared) • Background scanning = 32 scans
• Sample scanning = 32 scans
• Detektor = DLATGS (Deuterated Lanthanum Triglycine Sulfate) • Spectrum results = transmittance
Penentuan Aktivitas Antioksidan
Analisis Aktivitas Antioksidan Metode DPPH
23 Persentase penghambatan aktivitas radikal bebas diperoleh dari nilai absorbansi sampel. Hambatan (persentase) dihitung dengan rumus :
% Inhibisi = Absorbansi blanko – Absorbansi sampel x 100 Absorbansi blanko
Nilai konsentrasi dan hambatan ekstrak diplot masing-masing pada sumbu x dan y. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dan presentase penghambatan aktivitas radikal bebas.
Nilai konsentrasi penghambatan aktivitas radikal bebas sebanyak 50% (IC50) dihitung dengan menggunakan persamaan regresi. Nilai IC50 diperoleh dengan memasukkan Y=50 serta nilai A dan B yang telah diketahui. Nilai x sebagai IC50
Penentuan Senyawa Bioaktif
dapat dihitung dengan persamaan : y = A + B ln(x) Keterangan :
y = persen inhibisi A = slope
B = intercept
x = konsentrasi sampel (mg/l) Analisis Statistik PCA dan PLS
Spektrum FTIR sebanyak 25 spektrum yaitu setiap sampel sebanyak lima spektrum dalam format OPUS disimpan dalam format tabel titik data (DPT) yang dapat dibuka dengan menggunakan peranti lunak Microsoft Excel 2007. Analisis data PCA dan PLS dilakukan dengan menggunakan peranti lunak The Unscrambler X 10.2. Pengelompokan sampel dilakukan oleh PCA dengan
memanfaatkan data serapan spektrum FTIR yang terukur, sedangkan pengelompokan yang dikorelasikan dengan aktivitas antioksidan dilakukan oleh PLS. Analisis PCA dan PLS pada FTIR digunakan sebagai analisis untuk mengetahui pengelompokkan propolis berdasarkan asal daerah dan aktivitas antioksidannya.
1) Penentuan Kandungan Total Fenol
Kandungan total fenol ditentukan dengan menggunakan metode Kolorimetri Folin-Ciacolteau (Kumazawa et al. 2002). Asam galat digunakan
24
(GAE) per 100 gram sampel.
Sebanyak 0,5 mL propolis dimasukkan ke dalam tabung reaksi, ditambah 0,5 mL reagen Folin-Ciocaluteu. Campuran kemudian dihomogenkan dengan vortex selama tiga menit. Selanjutnya ditambahkan 0,5 mL larutan Na2CO3 10%, campuran didiamkan dalam ruang gelap selama 60 menit. Absorbansi dibaca pada 760 nm dengan spektrofotometer. Sampel dihitung hingga konsentrasi akhir pada 20µg/mL. Hasilnya dinyatakan sebagai mg asam galat/g sampel.
2) Penentuan Kandungan Total Flavonoid
Kandungan total flavonoid propolis diukur dengan menggunakan metode aluminium klorida kolorimeteri (Chang et al. 2002). Senyawa kuersetin
digunakan sebagai standar dengan hasil yang diperoleh merupakan sejumlah mg dari ekivalen kuersetin (QE) per 100 gram ekstrak sampel.
Ke dalam 0,5 mL propolis ditambahkan 2,8 mL aquades. Kemudian larutan ditambahkan 0,1 mL NaNO2
Analisis Statistik
1M. Setelah 6 menit, campuran ditambahkan 0,1 mL aluminium klorida 10% dan campuran divortek hingga homogen serta didiamkan 30 menit. Selanjutnya absorbansinya diukur pada 415 nm. Kurva standar kalibrasi menggunakan kuersetin dalam metanol dengan konsentrasi antara 12,5 hingga 100 µg/mL. Kandungan flavonoid dinyatakan sebagai sejumlah mg dari ekivalen kuersetin per 100 mg sampel.
Rancangan penelitian yang digunakan untuk analisis statistik adalah Rancangan Acak Lengkap (RAL) non faktorial (satu faktor) dengan tiga ulangan (Gaspers, 1991), sedangkan faktor perlakuannya yaitu pengaruh asal daerah propolis dengan lima taraf perlakuan sebagai berikut:
A1. Propolis dari Kabupaten Luwu (Sulawesi Selatan), A2. Propolis dari Kabupaten Sambas (Kalimantan Barat), A3. Propolis dari Kabupaten Lombok (Nusa Tenggara Barat), A4. Propolis dari Kabupaten Ciamis (Jawa Barat)
A5. Propolis Komersial
Hipotesis rancangan acak lengkap (RAL) total fenol, total flavonoid dan aktivitas antioksidan propolis adalah sebagai berikut:
25 flavonoid dan aktivitas antioksidan propolis (αi = 0)
H1: asal daerah propolis berpengaruh nyata terhadap total fenol, total flavonoid dan aktivitas antioksidan propolis (αi ≠ 0)
Model rancangan acak lengkap yang digunakan untuk menganalisis data adalah:
Yij = + αi + εij
Keterangan :
Yij = hasil pengamatan terhadap total fenol, total flavonoid dan aktivitas antioksidan propolis (i) pada ulangan ke-j
= rataan umum
αi = pengaruh asal daerah propolis
εij = sisaan akibat pengaruh asal daerah propolis taraf ke-i pada ulangan ke-j Analisis data menggunakan analisis ragam (ANOVA). Jika analisis ragam menunjukkan hasil berbeda nyata maka dilakukan uji lanjut Duncan untuk melihat pengaruh perbedaan antar perlakuan.
Analisis Data mengenai Hubungan Nilai Total Fenol, Flavonoid dan
Kapasitas Antioksidan
Untuk melihat korelasi kandungan fenol, flavonoid dengan aktivitas antioksidan digunakan analisis korelasi Pearson (Pearson’s product moment correlation) yang dinyatakan sebagai koefisien korelasi (r) (Gomez and Gomez
4
HASIL DAN PEMBAHASAN
Sampai saat ini, penelitian mengenai propolis lebih banyak dilakukan terhadap propolis yang dihasilkan lebah madu Apis mellifera. Adapun kajian
terhadap propolis dari lebah madu Trigona spp. yang merupakan lebah madu tidak
bersengat (stingless bee) masih jarang dikaji lebih lanjut. Padahal berdasarkan
[image:42.595.88.489.213.782.2]penelitian terdahulu, potensi propolis dari lebah madu tidak bersengat memiliki bioaktifitas dan ketersediaan yang lebih baik. Kajian pada penelitian ini berupaya menjelaskan profil propolis yang dihasilkan dari beberapa daerah di Indonesia. Sampel propolis diperoleh dari Kabupaten Luwu (Sulawesi Selatan), Kabupaten Sambas (Kalimantan Barat), Lombok (Nusa Tenggara Barat) dan Ciamis (Jawa Barat).
Tabel 4 Iklim dan vegetasi daerah asal propolis Trigona spp.
Daerah Tipe Iklim Vegetasi
1 Desa Sepantai
Kecamatan Sejangkung Kabupaten Sambas Kalimantan Barat
Curah Hujan 3.000 mm/tahun
Ketinggian 70 m (dpl) Suhu 21,4°C - 33,3°C Iklim curah hujan dan kelembaban yang tinggi
Putri malu, Salak, Medang, Cempedak, Damar, Akasia, Rotan
2 Desa Cieurih Kec.Cipaku Kabupaten Ciamis
Jawa Barat
Curah Hujan 2.987 mm/tahun
Ketinggian 562 m Suhu 20°C - 30°C Iklim curah hujan yang cenderung tinggi Mangga, Jeruk Singkong Pahit, Waluh, Nangka, Pepaya, Pinus, Mahoni, 3 Desa Radda,
Kecamatan Baebunta Kabupaten Luwu Utara Sulawesi Selatan
Curah Hujan 2.000 mm/tahun
Ketinggian 197 m Suhu 25°C – 31,6°C Iklim kering, kelembaban rendah, suhu relatif lebih tinggi Mangga, Jeruk, Singkong Pahit, Nangka, Durian, Dadap, Damar, Uru, Mahoni, Rengas 4 Desa Lendang Nangka Utara
Kecamatan Masbagik Kabupaten Lombok Timur NTB
Curah Hujan 1882 mm/tahun Ketinggian 206 m
Suhu 20°C-33°C
27
Iklim dan Vegetasi Daerah Asal Propolis
Propolis dikumpulkan lebah dari resin berbagai macam bagian tanaman. Oleh karena itu komposisi kimiawi resin sangat tergantung pada jenis tanaman yang dijadikan asal resin tersebut. Lingkungan yang berbeda dengan jenis vegetasi yang berbeda secara tidak langsung memberikan kandungan kimiawi propolis yang berbeda pula (Bankova 2009). Perbedaan musim pada suatu tempat umumnya tidak menyebabkan perbedaan kandungan kimiawi propolis. Musim yang berbeda hanya menyebabkan perbedaan kuantitas zat kimia yang ada dalam propolis (Bankova et al. 1998). Menurut Valencia et al. (2007) perubahan musim
hanya mengakibatkan perbedaan jumlah propolis yang dapat dipanen.
Iklim dan vegetasi daerah asal Trigona spp. disajikan pada Tabel 4. Iklim
daerah-daerah ini memungkinkan berbagai macam tumbuhan dapat hidup di dalamnya. Hal tersebut yang kemudian menjadi awal pembentukan vegetasi yang unik bagi lebah Trigona spp. Vegetasi seperti inilah yang menyediakan
bahan-bahan untuk pembentukan propolis sarang lebah. Informasi mengenai iklim dan vegetasi diperlukan untuk dapat menjelaskan karakteristik propolis dari daerah yang berbeda.
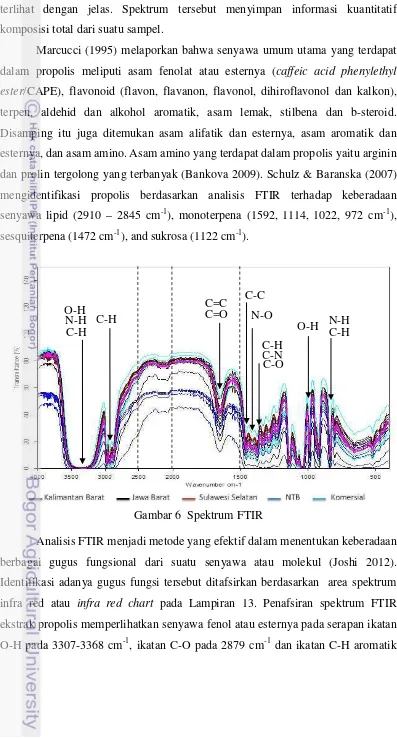
Analisis Fingerprint Propolis (FTIR)
FTIR merupakan perangkat yang digunakan dalam penentuan sidik jari metabolik/metabolic fingerprinting. Pengujian FTIR untuk memperoleh informasi
profil komposisi kimia dilakukan pada sampel propolis dari Jawa Barat, NTB, Kalimantan Barat dan Sulawesi Selatan. FTIR mengukur vibrasi dari ikatan antara gugus fungsi dan menghasilkan spektrum yang dapat dianggap sebagai sidik jari metabolik (metabolic fingerprint). Data spektrum FTIR yang digunakan berada
pada kisaran bilangan gelombang 3996.21 sampai 399.24 cm-1
Gambar 6 menunjukkan spektrum IR sampel propolis dari empat daerah berbeda dan propolis komersial, dengan ulangan pengukuran sebanyak lima kali untuk setiap daerah. Hasil spektrum yang diperoleh dari keseluruhan sampel memiliki kemiripan dan berbeda hanya pada nilai kuantitatif serapan spektrumnya masing-masing. Secara visual, tidak ada perbedaan yang signifikan pada karakteristik pita penyerapan tetapi intensitas panjang gelombang tertentu berbeda
28
satu sama lain. Perbedaan spektrum IR dari masing-masing daerah tidak dapat terlihat dengan jelas. Spektrum tersebut menyimpan informasi kuantitatif komposisi total dari suatu sampel.
Marcucci (1995) melaporkan bahwa senyawa umum utama yang terdapat dalam propolis meliputi asam fenolat atau esternya (caffeic acid phenylethyl ester/CAPE), flavonoid (flavon, flavanon, flavonol, dihiroflavonol dan kalkon),
[image:44.595.85.482.104.842.2]terpen, aldehid dan alkohol aromatik, asam lemak, stilbena dan b-steroid. Disamping itu juga ditemukan asam alifatik dan esternya, asam aromatik dan esternya, dan asam amino. Asam amino yang terdapat dalam propolis yaitu arginin dan prolin tergolong yang terbanyak (Bankova 2009). Schulz & Baranska (2007) mengidentifikasi propolis berdasarkan analisis FTIR terhadap keberadaan senyawa lipid (2910 – 2845 cm-1), monoterpena (1592, 1114, 1022, 972 cm-1), sesquiterpena (1472 cm-1), and sukrosa (1122 cm-1).
Gambar 6 Spektrum FTIR
Analisis FTIR menjadi metode yang efektif dalam menentukan keberadaan berbagai gugus fungsional dari suatu senyawa atau molekul (Joshi 2012). Identifikasi adanya gugus fungsi tersebut ditafsirkan berdasarkan area spektrum infra red atau infra red chart pada Lampiran 13. Penafsiran spektrum FTIR
ekstrak propolis memperlihatkan senyawa fenol atau esternya pada serapan ikatan O-H pada 3307-3368 cm-1, ikatan C-O pada 2879 cm-1 dan ikatan C-H aromatik
O-H N-H C-H C-H
C=C C=O
C-C N-O
C-H C-N C-O
29
3100–3000 cm-1. Adanya pergeseran serapan ke daerah 3000 cm-1 menunjukkan senyawa mempunyai gugus karboksilat karena ada korelasi gugus C=O dengan gugus O-H. Adapun adanya senyawa flavonoid ditandai dengan adanya gugus karbonil (C=O) yang memberikan serapan kuat pada 1651-1659 cm-1 dan di puncak sempit dan tajam pada 2972, 2933, 2879 cm-1, yang juga menunjukkan adanya C-H dan C-H aromatik serta didukung dengan ikatan O-H pada 3500– 3200 cm-1, ikatan C-O pada 1320–1000 cm-1 dan serapan di daerah 1500-1600 cm-1 menunjukkan adanya regang C=C aromatik. Disamping itu ketersediaan senyawa dengan ikatan C=C dengan serapan lemah yang terlihat pada 1651-1659 cm-1, ikatan C-O pada 1320–1000 cm-1 mengindikasikan adanya senyawa terpen. Sampel ekstrak propolis juga memperlihatkan ikatan N–O simetris dan C-N pada 1334-1290 cm-1 serta N-H pada 3400–3250 cm-1 yang menunjukkan adanya asam amino serta amina aromatis. Selain itu ikatan C-O dan O-H pada 1200-1000 cm-1 mengarahkan pada keberadaan asam lemak, stilbena, b-steroid dan gugus asam karboksilat. Serapan di daerah 1100-1300 cm-1 menunjukkan adanya uluran C-C-C Yang berarti senyawa mengandung gugus C=O keton. Serapan di daerah 1500-1600 cm-1 menunjukkan adanya regang C=C aromatik. Vibrasi Asil CH2 and CH3 dari asam lemak pada 3050–2800 cm-1, polisakarida (C–O and vibrasi cincin) pada 1090 cm-1
Spektrum FTIR sangat kompleks, mengandung banyak variabel setiap sampelnya sehingga analisis secara visual menjadi sulit. Data keluaran FTIR berupa persen transmisi dan bilangan gelombang umumnya berupa matriks data berukuran besar. Selain itu, perbedaan intensitas dan karakteristik serapan konstituen tidak dapat teramati, informasi ini hanya dapat diamati oleh analisis multivariat/teknik kemometrik yaitu PCA dan PLS. Metode ini dapat mengungkap kemiripan pola antar sampel propolis, menyederhanakan dimensi sampel dan
.
30
menghasilkan interpretasi yang sesuai tanpa kehilangan informasi yang penting terkait komposisi kimia propolis.
Aktivitas Antioksidan DPPH
Aktivitas antioksidan didefinisikan sebagai kemampuan suatu senyawa untuk menghambat degradasi oksidatif seperti peroksidasi lipid (Akoh & Min, 2002). Oksidasi adalah proses yang sangat kompleks dengan mekanisme yang berbeda. Dengan demikian, tidak ada metode tunggal yang secara tepat dapat mengevaluasi kapasitas antioksidan. Propolis diketahui memiliki aktifitas antioksidan potensial yang tinggi. Untuk mengetahui aktivitas antioksidan suatu sampel maka metode DPPH adalah metode yang mudah, cepat dan sensitif.
DPPH, sebuah radikal bebas stabil, sering digunakan untuk mengukur aktivitas penangkapan (scavenging) radikal bebas dari suatu sampel. Penangkapan
(scavenging) radikal bebas adalah salah satu mekanisme yang diketahui pada
antioksidan dalam menghambat oksidasi lipid (Yu 2008). Pico (2012) mengemukakan bahwa DPPH telah banyak digunakan untuk menguji aktivitas penangkapan radikal bebas terhadap berbagai macam sampel. Adapun menurut Heim et al. (2002) kemampuan penangkapan radikal bebas DPPH oleh
antioksidan ditunjukkan oleh adanya hidrogen yang diberikan ke radikal bebas. DPPH yang bereaksi dengan antioksidan akan mengalami perubahan warna dari jingga ke kuning, intensitas warna tergantung kemampuan dari antioksidan (Pico 2012). Semua sampel propolis menunjukkan aktivitas penangkapan radikal bebas sebagaimana ditampilkan pada Tabel 5 berikut.
Tabel 5 IC50 Asal Propolis
sampel ekstrak propolis ke empat wilayah dan sampel referensi IC50 (µg/ml)
Ciamis (Jawa Barat) 0,87 ± 0,14 a
Lombok (NTB) 2,90 ± 0,55
Luwu (Sulawesi Selatan)
c
1,76 ± 0,35 Sambas (Kalimantan Barat)
b
0,54 ± 0,06 Propolis Komersial
a
0,19 ± 0,07 Troloks
d 501,97 ± 141,13 Vitamin C
e
31
propolis dengan aktivitas penangkapan radikal bebas DPPH tinggi ditunjukkan dengan nilai IC50 (konsentrasi yang diperlukan untuk menangkap 50% radikal bebas) yang rendah. Propolis dengan aktivitas penangkapan radikal bebas DPPH tinggi ditunjukkan dengan nilai IC50 yang rendah. Peningkatan konsentrasi sampel hasil dalam peningkatan aktivitas penangkapan pada berbagai konsentrasi sampel dibandingkan dengan sampel referensi (Vitamin C dan Troloks) yang digunakan sebagai kontrol positif. Konsentrasi ekstrak propolis yang rendah untuk penangkapan