4 HASIL DAN PEMBAHASAN
Sampai saat ini, penelitian mengenai propolis lebih banyak dilakukan terhadap propolis yang dihasilkan lebah madu Apis mellifera. Adapun kajian terhadap propolis dari lebah madu Trigona spp. yang merupakan lebah madu tidak bersengat (stingless bee) masih jarang dikaji lebih lanjut. Padahal berdasarkan penelitian terdahulu, potensi propolis dari lebah madu tidak bersengat memiliki bioaktifitas dan ketersediaan yang lebih baik. Kajian pada penelitian ini berupaya menjelaskan profil propolis yang dihasilkan dari beberapa daerah di Indonesia. Sampel propolis diperoleh dari Kabupaten Luwu (Sulawesi Selatan), Kabupaten Sambas (Kalimantan Barat), Lombok (Nusa Tenggara Barat) dan Ciamis (Jawa Barat).
Tabel 4 Iklim dan vegetasi daerah asal propolis Trigona spp.
Daerah Tipe Iklim Vegetasi
1 Desa Sepantai Kecamatan Sejangkung Kabupaten Sambas Kalimantan Barat Curah Hujan 3.000 mm/tahun Ketinggian 70 m (dpl) Suhu 21,4°C - 33,3°C Iklim curah hujan dan kelembaban yang tinggi
Putri malu, Salak, Medang, Cempedak, Damar, Akasia, Rotan
2 Desa Cieurih Kec.Cipaku Kabupaten Ciamis Jawa Barat Curah Hujan 2.987 mm/tahun Ketinggian 562 m Suhu 20°C - 30°C Iklim curah hujan yang cenderung tinggi Mangga, Jeruk Singkong Pahit, Waluh, Nangka, Pepaya, Pinus, Mahoni, 3 Desa Radda, Kecamatan Baebunta Kabupaten Luwu Utara Sulawesi Selatan
Curah Hujan 2.000 mm/tahun
Ketinggian 197 m Suhu 25°C – 31,6°C Iklim kering, kelembaban rendah, suhu relatif lebih tinggi Mangga, Jeruk, Singkong Pahit, Nangka, Durian, Dadap, Damar, Uru, Mahoni, Rengas 4 Desa Lendang Nangka Utara
Kecamatan Masbagik Kabupaten Lombok Timur NTB
Curah Hujan 1882 mm/tahun Ketinggian 206 m
Suhu 20°C-33°C
Iklim kering, kelembaban rendah, suhu relatif lebih tinggi Mangga, Jeruk, Singkong pahit, Nangka, Pepaya, Cempedak, Johar, Mete
27 Iklim dan Vegetasi Daerah Asal Propolis
Propolis dikumpulkan lebah dari resin berbagai macam bagian tanaman. Oleh karena itu komposisi kimiawi resin sangat tergantung pada jenis tanaman yang dijadikan asal resin tersebut. Lingkungan yang berbeda dengan jenis vegetasi yang berbeda secara tidak langsung memberikan kandungan kimiawi propolis yang berbeda pula (Bankova 2009). Perbedaan musim pada suatu tempat umumnya tidak menyebabkan perbedaan kandungan kimiawi propolis. Musim yang berbeda hanya menyebabkan perbedaan kuantitas zat kimia yang ada dalam propolis (Bankova et al. 1998). Menurut Valencia et al. (2007) perubahan musim hanya mengakibatkan perbedaan jumlah propolis yang dapat dipanen.
Iklim dan vegetasi daerah asal Trigona spp. disajikan pada Tabel 4. Iklim daerah-daerah ini memungkinkan berbagai macam tumbuhan dapat hidup di dalamnya. Hal tersebut yang kemudian menjadi awal pembentukan vegetasi yang unik bagi lebah Trigona spp. Vegetasi seperti inilah yang menyediakan bahan-bahan untuk pembentukan propolis sarang lebah. Informasi mengenai iklim dan vegetasi diperlukan untuk dapat menjelaskan karakteristik propolis dari daerah yang berbeda.
Analisis Fingerprint Propolis (FTIR)
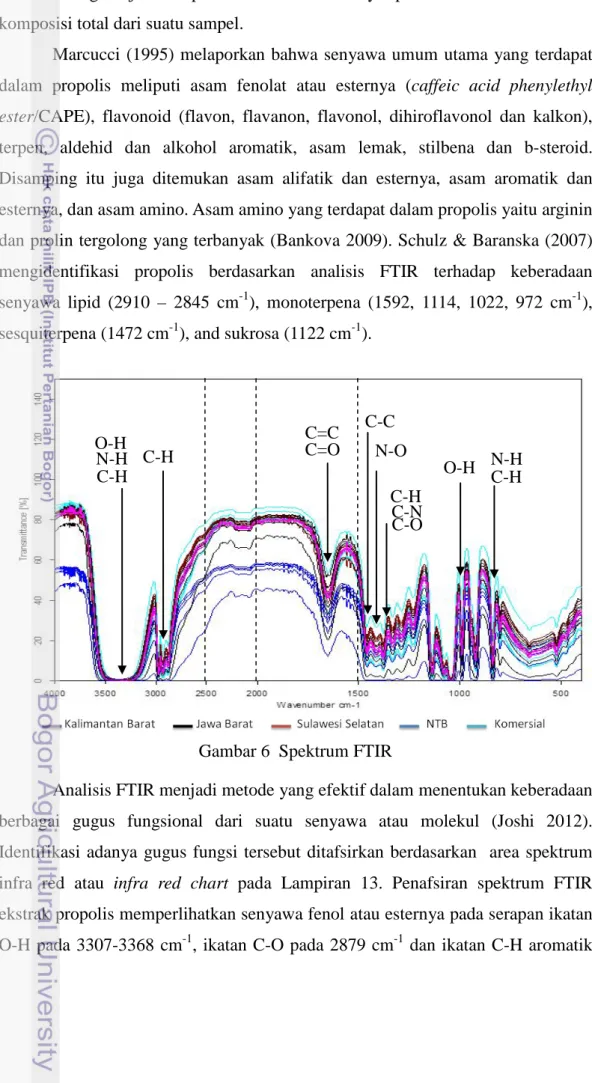
FTIR merupakan perangkat yang digunakan dalam penentuan sidik jari metabolik/metabolic fingerprinting. Pengujian FTIR untuk memperoleh informasi profil komposisi kimia dilakukan pada sampel propolis dari Jawa Barat, NTB, Kalimantan Barat dan Sulawesi Selatan. FTIR mengukur vibrasi dari ikatan antara gugus fungsi dan menghasilkan spektrum yang dapat dianggap sebagai sidik jari metabolik (metabolic fingerprint). Data spektrum FTIR yang digunakan berada pada kisaran bilangan gelombang 3996.21 sampai 399.24 cm-1
Gambar 6 menunjukkan spektrum IR sampel propolis dari empat daerah berbeda dan propolis komersial, dengan ulangan pengukuran sebanyak lima kali untuk setiap daerah. Hasil spektrum yang diperoleh dari keseluruhan sampel memiliki kemiripan dan berbeda hanya pada nilai kuantitatif serapan spektrumnya masing-masing. Secara visual, tidak ada perbedaan yang signifikan pada karakteristik pita penyerapan tetapi intensitas panjang gelombang tertentu berbeda
. Berdasarkan hasil analisis FTIR, pola spektrum tersebut ditampilkan pada Gambar 6.
28
satu sama lain. Perbedaan spektrum IR dari masing-masing daerah tidak dapat terlihat dengan jelas. Spektrum tersebut menyimpan informasi kuantitatif komposisi total dari suatu sampel.
Marcucci (1995) melaporkan bahwa senyawa umum utama yang terdapat dalam propolis meliputi asam fenolat atau esternya (caffeic acid phenylethyl
ester/CAPE), flavonoid (flavon, flavanon, flavonol, dihiroflavonol dan kalkon),
terpen, aldehid dan alkohol aromatik, asam lemak, stilbena dan b-steroid. Disamping itu juga ditemukan asam alifatik dan esternya, asam aromatik dan esternya, dan asam amino. Asam amino yang terdapat dalam propolis yaitu arginin dan prolin tergolong yang terbanyak (Bankova 2009). Schulz & Baranska (2007) mengidentifikasi propolis berdasarkan analisis FTIR terhadap keberadaan senyawa lipid (2910 – 2845 cm-1), monoterpena (1592, 1114, 1022, 972 cm-1), sesquiterpena (1472 cm-1), and sukrosa (1122 cm-1).
Gambar 6 Spektrum FTIR
Analisis FTIR menjadi metode yang efektif dalam menentukan keberadaan berbagai gugus fungsional dari suatu senyawa atau molekul (Joshi 2012). Identifikasi adanya gugus fungsi tersebut ditafsirkan berdasarkan area spektrum infra red atau infra red chart pada Lampiran 13. Penafsiran spektrum FTIR ekstrak propolis memperlihatkan senyawa fenol atau esternya pada serapan ikatan O-H pada 3307-3368 cm-1, ikatan C-O pada 2879 cm-1 dan ikatan C-H aromatik
O-H N-H C-H C-H C=C C=O C-C N-O C-H C-N C-O O-H N-H C-H
29 3100–3000 cm-1. Adanya pergeseran serapan ke daerah 3000 cm-1 menunjukkan senyawa mempunyai gugus karboksilat karena ada korelasi gugus C=O dengan gugus O-H. Adapun adanya senyawa flavonoid ditandai dengan adanya gugus karbonil (C=O) yang memberikan serapan kuat pada 1651-1659 cm-1 dan di puncak sempit dan tajam pada 2972, 2933, 2879 cm-1, yang juga menunjukkan adanya C-H dan C-H aromatik serta didukung dengan ikatan O-H pada 3500– 3200 cm-1, ikatan C-O pada 1320–1000 cm-1 dan serapan di daerah 1500-1600 cm-1 menunjukkan adanya regang C=C aromatik. Disamping itu ketersediaan senyawa dengan ikatan C=C dengan serapan lemah yang terlihat pada 1651-1659 cm-1, ikatan C-O pada 1320–1000 cm-1 mengindikasikan adanya senyawa terpen. Sampel ekstrak propolis juga memperlihatkan ikatan N–O simetris dan C-N pada 1334-1290 cm-1 serta N-H pada 3400–3250 cm-1 yang menunjukkan adanya asam amino serta amina aromatis. Selain itu ikatan C-O dan O-H pada 1200-1000 cm-1 mengarahkan pada keberadaan asam lemak, stilbena, b-steroid dan gugus asam karboksilat. Serapan di daerah 1100-1300 cm-1 menunjukkan adanya uluran C-C-C Yang berarti senyawa mengandung gugus C=O keton. Serapan di daerah 1500-1600 cm-1 menunjukkan adanya regang C=C aromatik. Vibrasi Asil CH2 and CH3 dari asam lemak pada 3050–2800 cm-1, polisakarida
(C–O and vibrasi cincin) pada 1090 cm-1
Spektrum FTIR sangat kompleks, mengandung banyak variabel setiap sampelnya sehingga analisis secara visual menjadi sulit. Data keluaran FTIR berupa persen transmisi dan bilangan gelombang umumnya berupa matriks data berukuran besar. Selain itu, perbedaan intensitas dan karakteristik serapan konstituen tidak dapat teramati, informasi ini hanya dapat diamati oleh analisis multivariat/teknik kemometrik yaitu PCA dan PLS. Metode ini dapat mengungkap kemiripan pola antar sampel propolis, menyederhanakan dimensi sampel dan
.
Penafsiran spektrum FTIR mengenai keberadaan senyawa berdasarkan identifikasi gugus fungsi tersebut belum dapat dipastikan. Konfirmasi keberadaan senyawa seperti fenol dan flavonoid yang berperan terhadap kemampuan antioksidan propolis dapat diketahui melalui analisis total fenol, total flavonoid yang dikorelasikan dengan aktivitas antioksidannya. Adanya korelasi dengan aktivitas antioksidan mengindikasikan senyawa fenol dan flavonoid tersebut.
30
menghasilkan interpretasi yang sesuai tanpa kehilangan informasi yang penting terkait komposisi kimia propolis.
Aktivitas Antioksidan DPPH
Aktivitas antioksidan didefinisikan sebagai kemampuan suatu senyawa untuk menghambat degradasi oksidatif seperti peroksidasi lipid (Akoh & Min, 2002). Oksidasi adalah proses yang sangat kompleks dengan mekanisme yang berbeda. Dengan demikian, tidak ada metode tunggal yang secara tepat dapat mengevaluasi kapasitas antioksidan. Propolis diketahui memiliki aktifitas antioksidan potensial yang tinggi. Untuk mengetahui aktivitas antioksidan suatu sampel maka metode DPPH adalah metode yang mudah, cepat dan sensitif.
DPPH, sebuah radikal bebas stabil, sering digunakan untuk mengukur aktivitas penangkapan (scavenging) radikal bebas dari suatu sampel. Penangkapan (scavenging) radikal bebas adalah salah satu mekanisme yang diketahui pada antioksidan dalam menghambat oksidasi lipid (Yu 2008). Pico (2012) mengemukakan bahwa DPPH telah banyak digunakan untuk menguji aktivitas penangkapan radikal bebas terhadap berbagai macam sampel. Adapun menurut Heim et al. (2002) kemampuan penangkapan radikal bebas DPPH oleh antioksidan ditunjukkan oleh adanya hidrogen yang diberikan ke radikal bebas. DPPH yang bereaksi dengan antioksidan akan mengalami perubahan warna dari jingga ke kuning, intensitas warna tergantung kemampuan dari antioksidan (Pico 2012). Semua sampel propolis menunjukkan aktivitas penangkapan radikal bebas sebagaimana ditampilkan pada Tabel 5 berikut.
Tabel 5 IC50
Asal Propolis
sampel ekstrak propolis ke empat wilayah dan sampel referensi IC50 (µg/ml)
Ciamis (Jawa Barat) 0,87 ± 0,14 a
Lombok (NTB) 2,90 ± 0,55
Luwu (Sulawesi Selatan)
c
1,76 ± 0,35 Sambas (Kalimantan Barat)
b 0,54 ± 0,06 Propolis Komersial a 0,19 ± 0,07 Troloks d 501,97 ± 141,13 Vitamin C e 6873,87 ± 1309,93 f Pada Tabel 5, hasil analisis aktivitas antioksidan dengan menggunakan metode DPPH menunjukkan variasi dalam setiap pengujian. Sampel ekstrak
31 propolis dengan aktivitas penangkapan radikal bebas DPPH tinggi ditunjukkan dengan nilai IC50 (konsentrasi yang diperlukan untuk menangkap 50% radikal
bebas) yang rendah. Propolis dengan aktivitas penangkapan radikal bebas DPPH tinggi ditunjukkan dengan nilai IC50 yang rendah. Peningkatan konsentrasi sampel
hasil dalam peningkatan aktivitas penangkapan pada berbagai konsentrasi sampel dibandingkan dengan sampel referensi (Vitamin C dan Troloks) yang digunakan sebagai kontrol positif. Konsentrasi ekstrak propolis yang rendah untuk penangkapan radikal DPPH menunjukkan bahwa sampel propolis efektif sebagai penangkap radikal bebas.
Berdasarkan Tabel 5, evaluasi terhadap aktivitas scavenging radikal bebas propolis diketahui bahwa propolis dari Kalimantan Barat menangkap radikal bebas lebih efisien daripada propolis dari daerah lainnya. Nilai IC50 propolis
Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan NTB adalah masing-masing 0,54, 0,87, 1,76 dan 2,90 µg/mL. Konsentrasi ekstrak propolis yang rendah untuk penangkapan radikal DPPH menunjukkan bahwa sampel propolis efektif sebagai penangkap radikal bebas.
Konsentrasi penghambatan 50% (IC50) tertinggi yang diperoleh propolis
Kalimantan Barat tidak berbeda nyata dengan propolis Jawa Barat. Nilai IC50
yang rendah menunjukkan aktivitas antioksidan yang tinggi untuk kedua ekstrak propolis ini. Nilai IC50 propolis Kalimantan Barat adalah 0,54 µg/mL sedangkan
Jawa Barat 0,87 µg/mL. Dibandingkan dengan propolis komersial, nilai IC50
Nilai IC
propolis dari ke empat wilayah lebih rendah daripada propolis komersial. Hal ini kemungkinan dipengaruhi asal propolis komersial, cara ekstraksi dan juga konsentrasi propolis pada produk komersial tersebut. Propolis komersial yang dianalisis merupakan produk propolis impor yang diperoleh dari lebah madu Apis. Selain itu, ekstrak propolis dari ke empat wilayah menggunakan metode Mahani (2012) yang berbeda dengan propolis komersial.
50 propolis dari beberapa wilayah tersebut secara signifikan lebih
rendah dari trolox dan vitamin C. Dengan demikian sampel ekstrak propolis dari keempat wilayah tersebut memiliki kemampuan antioksidan yang baik. Urutan konsentrasi penghambatan 50% dari yang paling kecil hingga yang paling besar sebagai berikut yaitu propolis Kalimantan Barat, Jawa Barat, Sulawesi Selatan,
32
NTB. Perbedaan hasil analisis aktivitas antioksidan DPPH menunjukkan adanya perbedaan aktivitas senyawa yang terkandung di dalam propolis. Perbedaan aktivitas ini diduga karena adanya perbedaan kandungan senyawa flavonoid ataupun fenolik yang berfungsi sebagai antioksidan pada propolis maupun kandungan senyawa lain yang juga dapat berfungsi sebagai antioksidan.
Aktivitas penangkapan radikal bebas yang ditunjukkan oleh nilai IC50
Analisis PCA
ditandai dengan keberadaan gugus yang berperan sebagai donor elektron (Thirugnanasampandan 2012). Senyawa golongan fenolik dan turunannya seperti golongan flavonoid merupakan golongan senyawa yang memiliki kemampuan dalam menangkap radikal bebas dengan cara mendonorkan elektron untuk menstabilkan radikal bebas (Vermerris & Nicholson 2006). Golongan fenol dan flavonoid memiliki spektrum keberagaman yang luas yang dibedakan berdasarkan gugus fungsi yang menyertainya.
Perbedaan gugus fungsi pada golongan flavonoid sangat mungkin menyebabkan perbedaan aktivitas antioksidannya. Sehingga disamping perbedaan jumlah fenol dan flavonoid, perbedaaan komposisi penyusun fenolik dan flavonoid juga berpengaruh terhadap aktivitas antioksidan. Berkaitan dengan adanya perbedaan aktifitas antioksidan propolis maka dapat dikatakan bahwa komposisi kimia propolis dipengaruhi tidak hanya berdasarkan atas lokasi asal propolis, tetapi juga berhubungan dengan sifat antioksidan propolis tersebut.
Penggunaan spektrum FTIR sebagai alat bantu untuk penentuan struktur molekul suatu senyawa kimia biasanya terbatas hanya melibatkan informasi serapan pada daerah tertentu saja sebagai tanda pengenal gugus fungsi tertentu. Pemanfaatan ini membatasi informasi lain yang dimiliki oleh suatu spektrum IR, terlebih lagi bila spektrum tersebut merupakan spektrum yang bersifat multidimensi. Spektrum multidimensi mengandung informasi kuantitatif yang dapat menggambarkan ciri khas suatu objek pengamatan. Informasi ini tidak dapat diamati dengan melihat pola serapan spektrum propolis saja.
Untuk mendapatkan informasi perbedaan dari sampel propolis tersebut membutuhkan alat bantu analisis multivariat berupa teknik ekstraksi pola spektrum atau teknik kemometrik. Teknik kemometrik yang digunakan untuk
33 mengenali pengelompokan pola spektrum propolis dari keempat wilayah dilakukan dengan menggunakan PCA. PCA menyederhanakan variabel-variabel yang dimiliki oleh spektrum menjadi beberapa variabel utama saja. Tahapan ini menyebabkan sampel propolis terkelompokkan berdasarkan korelasi informasi variabel yang dimiliki dalam kelompok.
Teknik PCA dapat mengurangi dimensi dari data awal, yaitu dari ribuan dimensi (sebanyak jumlah bilangan gelombang spektrum IR) menjadi hanya beberapa dimensi saja. Proyeksi sampel terhadap beberapa variabel baru ini ditunjukkan pada score plot. Score plot untuk dua komponen utama (Principal
Component/PC) pertama biasanya paling berguna dalam analisis karena keduanya
mengandung banyak variasi dalam data. Sampel propolis yang mirip satu sama lain akan memiliki plot yang berdekatan (Esbensen, 2004).
Analisis PCA dilakukan dengan melibatkan 1876 titik. Ada beberapa sampel terlihat sangat terpisah dari kelompoknya dan program The Unscrambler
X 10.2 mengidentifikasinya sebagai pencilan. Pencilan ini dapat disebabkan oleh
adanya galat pengukuran, sampel dari kategori lain, atau kesalahan instrumental (Esbensen 2004). Berdasarkan perhitungan, penghilangan pencilan tidak mampu memperbaiki pengelompokan sampel berdasarkan wilayahnya sehingga pencilan tetap diikutkan dalam pengolahan selanjutnya. Score plot dan loading plot PCA ditampilkan pada Gambar 7.
Berdasarkan Gambar 7, ekstrak propolis dapat dikelompokkan dengan baik menggunakan PCA berdasarkan asal daerahnya. Adapun Gambar 7a menunjukkan score plot dari ke 25 spektrum IR sampel propolis dari empat daerah berbeda dan propolis komersial. Pengelompokan propolis diperlihatkan pada score plot dua dimensi. Gambar 7a memperlihatkan bahwa score plot dua PC pertama dari data spektrum FTIR mampu menjelaskan 99% dari variansi total (PC1 = 87%, PC2 = 12%). Plot ini memperlihatkan pola yang terdapat pada spektrum FTIR, semakin dekat plot masing-masing sampel, maka semakin besar kemiripan di antara spektrum FTIR sampel tersebut. Sampel yang mirip satu sama lain akan memiliki plot yang berdekatan. Pengelompokan diperoleh berdasarkan daerah asal sampel ekstrak propolis. Pengelompokan terlihat jelas dari saling berdekatannya sampel yang berasal dari satu daerah.
34
a. Score plot PCA
b. Loading plot PCA kelompok 1
c. Loading plot PCA kelompok 2 Gambar 7 Score plot dan loading plot PCA
C-H O-H C-H N-H I II C=C C=O C-N O-H C-H C-H C-N C-O N-O O-H N-H
35 Berkelompoknya plot sampel propolis menunjukkan bahwa komposisi kimia propolis tersebut yang direfleksikan oleh spektrum FTIR pada kelompok yang sama memiliki ciri yang mirip satu sama lain. Propolis dari Jawa Barat, Kalimantan Barat, Sulawesi Selatan dan propolis komersial cenderung menjadi satu kelompok (kelompok 1), dengan demikian komposisi kimia propolis dari dari wilayah tersebut memiliki kemiripan. Di lain pihak, propolis dari NTB terpisah menjadi satu kelompok lain (kelompok 2) yang berarti komposisi kimia yang dimilikinya berbeda dengan kelompok 1. Berdasarkan hal ini maka dapat diasumsikan bahwa komposisi kimia propolis bervariasi sesuai asal daerahnya.
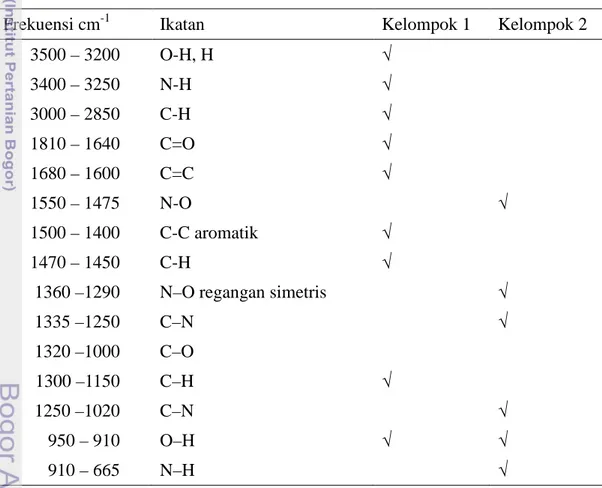
Tabel 6 Daerah serapan gugus fungsi dominan kelompok 1 dan kelompok 2 pada analisis PCA
Frekuensi cm-1 Ikatan Kelompok 1 Kelompok 2
3500 – 3200 O-H, H √ 3400 – 3250 N-H √ 3000 – 2850 C-H √ 1810 – 1640 C=O √ 1680 – 1600 C=C √ 1550 – 1475 N-O √ 1500 – 1400 C-C aromatik √ 1470 – 1450 C-H √ 1360 –1290 N–O √ 1335 –1250 C–N √ 1320 –1000 C–O √ 1300 –1150 C–H √ 1250 –1020 C–N √ 950 – 910 O–H √ √ 910 – 665 N–H √
Berdasarkan loading plot (Gambar 7), maka diperkirakan gugus fungsi yang berpengaruh pada terjadinya pengelompokan disebabkan gugus fungsi C=O, C-O, C-H aromatik yang dominan pada kelompok 1 mengindikasikan senyawa fenolik dan flavonoid, sedangkan pada NTB (kelompok 2) yang mendominasi adalah gugus O-H, C-O dan C=C yang diduga merupakan senyawa asam lemak,
36
dan adanya gugus C-N, N-H serta N-O yang menandakan senyawa asam amino. Penafsiran terhadap daerah gugus fungsi tersebut disajikan pada Tabel 6.
Kondisi pengelompokan ini dapat terjadi sebagai hasil identifikasi PCA terhadap variasi komposisi kimia propolis yang dapat disebabkan adanya perbedaan komposisi kimia dari propolis. Meskipun demikian analisis PCA juga mempertimbangkan fakta bahwa propolis diketahui merupakan sumber senyawa fenol seperti asam fenolat dan flavonoid. Senyawa fenol secara umum terdapat pada sebagian besar tumbuhan dan berpengaruh terhadap komposisi kimia propolis. Komposisi yang berbeda tersebut dipengaruhi oleh keragaman iklim dan vegetasi Trigona spp. sebagai bahan penyusun propolis (Tabel 4).
Bahan utama propolis adalah resin yang umumnya terdapat pada tumbuhan. Lebah madu mengumpulkan resin tersebut terutama dari bunga dan pucuk daun, kemudian mengolahnya dengan bantuan enzim untuk membentuk propolis. Semakin banyak sumber resin, yang ditandai dengan banyaknya ragam vegetasi, maka semakin banyak dan beragam komponen kimiawi propolis tersebut. Hal ini yang menentukan diperolehnya propolis dengan aktivitas antioksidan yang baik. Tabel 4 memperlihatkan bahwa daerah seperti Kalimantan Barat, Jawa Barat dan Sulawesi Selatan memiliki iklim dengan curah hujan yang lebih tinggi dibanding daerah Nusa Tenggaara Barat. Iklim seperti ini menyebabkan kemungkinan beragam dan banyaknya vegetasi yang dapat tumbuh di daerah tersebut sehingga mempermudah lebah madu dalam mengumpulkan bahan resin untuk membentuk propolis. Dibandingkan dengan daerah NTB yang curah hujan rendah sehingga vegetasi pun menjadi lebih sedikit. Hal ini kemungkinan menjadikan komposisi kimia propolisnya yang berpengaruh terhadap aktivitas antioksidannya juga menjadi rendah. Ahn et al. (2007), Mohammadzadeh et al. (2007) dan Da Silva (2006) mengungkapkan bahwa komposisi propolis berkaitan dengan iklim dan vegetasi dari daerah asalnya. Perbedaan goegrafis ini menyebabkan propolis dari Eropa, Amerika Selatan dan Asia memiliki komposisi yang berlainan (Marcucci 1995 & Kumazawa et al. 2004). Propolis dari Eropa dan Asia mengandung banyak senyawa flavonoid and asam fenolat (Bankova et al. 2000 & Thirugnanasampandan et al. 2012). Sebaliknya, komponen pada propolis dari Brasil terutama terpenoid dan turunan
37 asam kumarat (Marcucci & Bankova 1999). Oleh karena komposisi kimia tersebut berbeda maka bioaktifitas propolisnya juga berbeda sesuai asal daerahnya.
Analisis PLS
Pendugaan keterkaitan antara spektrum FTIR ekstrak propolis dan aktivitas antioksidan memerlukan metode pemodelan lain, yaitu PLS. Bila PCA mengekstrak informasi spektrum secara keseluruhan maka PLS mengekstrak informasi spektrum yang relevan dengan suatu karakter kimia tertentu yang dibutuhkan, yang dalam hal ini adalah aktifitas antioksidannya.
Metode PLS digunakan untuk menemukan hubungan antara matriks X (penduga) dan Y (respons) untuk membuat prediksi Y di dalam fungsi X (Esbensen 2004). Matriks X mengandung data yang dihasilkan dari pengukuran contoh dengan FTIR dan matriks Y mengandung data dari pengukuran dengan FTIR dan aktifitas antioksidan metode DPPH. Dalam hal ini, nilai serapan digunakan sebagai variabel x (penduga/prediktor) dan aktivitas antioksidannya sebagai variabel y (respons).
Pemodelan analisis PLS dilakukan dengan mengunakan peranti lunak The
Unscrambler versi X 10.2 dengan memanfaatkan sarana regresi multivariat PLS. Score plot dan loading plot PLS disajikan pada Gambar 8. Analisis PLS untuk
propolis dilakukan dengan teknik PLS-1 karena hanya melibatkan satu komponen respons dari spektrum yaitu aktifitas antioksidan propolis.
Gambar 8 memperlihatkan score plot PLS dari data spektrum FTIR. Kelompok-kelompok ekstrak propolis melalui PC 1 dan PC 2 memperlihatkan adanya pemisahan ekstrak propolis, yang bila dihubungkan dengan aktivitas antioksidannya terdapat dua kelompok besar yaitu kelompok ekstrak yang bersifat aktif dan kelompok yang bersifat kurang aktif. Berdasarkan Gambar 8 dapat disimpulkan bahwa berkelompoknya plot sampel propolis menunjukkan bahwa kemampuan antioksidan propolis tersebut yang direfleksikan oleh spektrum inframerah memiliki ciri yang mirip satu sama lain. Gambar 8 menunjukkan propolis Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan propolis komersial berada pada satu kelompok (kelompok 1), sedangkan propolis NTB terpisah (kelompok 2).
38
a Score plot PLS
b. Loading plot PLS kelompoks 1
c. Loading plot PLS kelompok 2 Gambar 8 Score plot dan loading plot PLS
I II O-H N-H C-H C-H C=C C=O O-H C-H aromatik C=C C=O C-H C-N C-O O-H N-H N-O
39 Propolis NTB memperlihatkan aktifitas antioksidan yang rendah, sedangkan propolis Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan propolis komersial memiliki aktifitas antioksidan yang lebih tinggi dibandingkan dengan NTB. Pengelompokan propolis Kalimantan Barat, Jawa Barat, Sulawesi Selatan dan propolis komersial juga membuktikan bahwa komposisi kimia yang berkorelasi dengan aktifitas antioksidan dari keempat jenis sampel tersebut tidak berbeda jauh. Oleh karena itu, perbedaan propolis masing-masing daerah berdasarkan aktifitas antioksidannya dipengaruhi oleh perbedaan lokasi dan asal tanamannya, hal ini memperkuat sebagaimana yang dilaporkan oleh Ahn et al. (2007).
Tabel 7 Daerah serapan gugus fungsi dominan kelompok 1 dan kelompok 2 pada analisis PLS
Frekuensi cm-1 Ikatan Kelompok 1 Kelompok 2
3500 – 3200 O-H, H √ 3400 – 3250 N-H √ 3000 – 2850 C-H √ 1810 – 1640 C=O √ 1680 – 1600 C=C √ 1550 – 1475 N-O √ 1500 – 1400 C-C aromatik √ 1470 – 1450 C-H √
1360 –1290 N–O regangan simetris √
1335 –1250 C–N √ 1320 –1000 C–O 1300 –1150 C–H √ 1250 –1020 C–N √ 950 – 910 O–H √ √ 910 – 665 N–H √
Berdasarkan loading plot pada Gambar 8 maka sumbangan konstituen yang berperan besar pada pengelompokan ini diduga berasal dari gugus O-H, C-H, C=O, C=C, C-H aromatik yang kemungkinan berasal dari senyawa fenol dan flavonoid propolis. Gugus fungsi tersebut dominan terdapat pada kelompok 1.
40
Adapun kelompok 2, senyawa yang mempengaruhi kemampuan antioksidannya ditunjukkan oleh gugus fungsi N-H, C-N, C=C, C-H alifatik, C=O yang menandakan kemungkinan adanya senyawa terpen, asam lemak dan juga asam amino. Secara umum, antioksidan mempunyai struktur inti yang sama, yaitu cincin benzen tidak jenuh disertai gugus hidroksil (-OH), asam amino (-NH2), ataupun hidrogen (-H). Gugus-gugus inilah yang bertugas untuk berikatan dengan radikal bebas sehingga menghasilkan komponen yang tidak reaktif lagi (Winarno 1992). Perbedaan komposisi yang mempengaruhi aktifitas antioksidan propolis kemungkinan dipengaruhi oleh keragaman iklim dan vegetasi Trigona spp. (Tabel 4). Penafsiran terhadap daerah serapan gugus fungsi pada analisis PLS ditampilkan pada Tabel 7.
Beberapa penelitian membuktikan penerapan FTIR dan analisis multivariat dapat digunakan untuk pengklasifikasian sampel serta hubungannya terhadap bioaktifitasnya ( (Joshi 2012). Berdasarkan PLS maka diketahui adanya pengaruh dari gugus fungsi dari senyawa tertentu terhadap terjadinya pengelompokkan tersebut. Untuk menerangkan signifikansi pengaruh tersebut maka dapat diperoleh dengan mengetahui koefisien regresi dan x-loading weight yang telah memperhitungan keterlibatan semua komponen secara komprehensif.
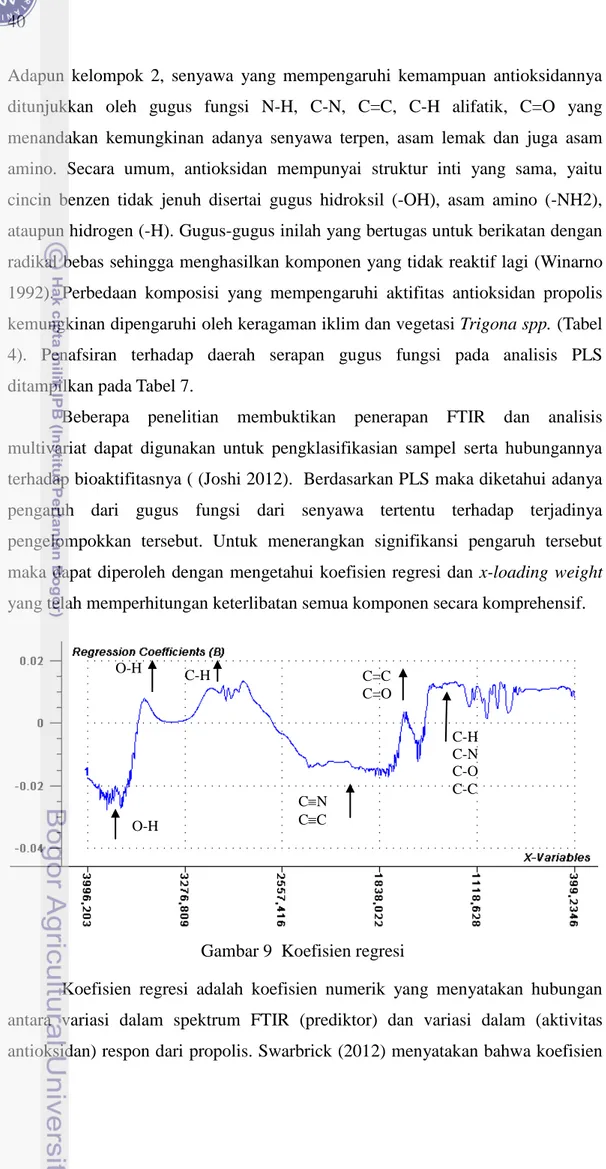
Koefisien regresi adalah koefisien numerik yang menyatakan hubungan antara variasi dalam spektrum FTIR (prediktor) dan variasi dalam (aktivitas antioksidan) respon dari propolis. Swarbrick (2012) menyatakan bahwa koefisien
Gambar 9 Koefisien regresi
O-H C-H C=C C=O C-H C-N C-O C-C O-H C≡N C≡C
41 regresi tersebut merangkum hubungan antara seluruh preditor dan respon yang diberikan. Pada analisis data berupa spektrum, koefisien regresi harus menunjukkan karakteristik spektrumnya, pada FTIR ditunjukkan oleh bilangan gelombang yang mencirikan serapan dari gugus fungsi tertentu. Koefisien regresi ditunjukkan pada Gambar 9. Koefisien regresi tersebut memberikan gambaran keseluruhan gugus fungsi yang penting (Esbensen 2004).
Koefisien regresi diperoleh dari pengolahan data dengan perangkat lunak
The Unscrambler X 10.2. Regresi dapat digunakan untuk menggambarkan dan
menafsirkan hubungan antara variabel X (spektrum FTIR) dan variabel Y (aktifivitas antioksidan). Variabel X dengan nilai koefisien regresi besar memiliki peran penting; nilai koefisien yang positif menunjukkan hubungan positif terhadap respon dan koefisien negatif menunjukkan hubungan negatif. Prediktor dengan nilai koefisien yang rendah dapat diabaikan.
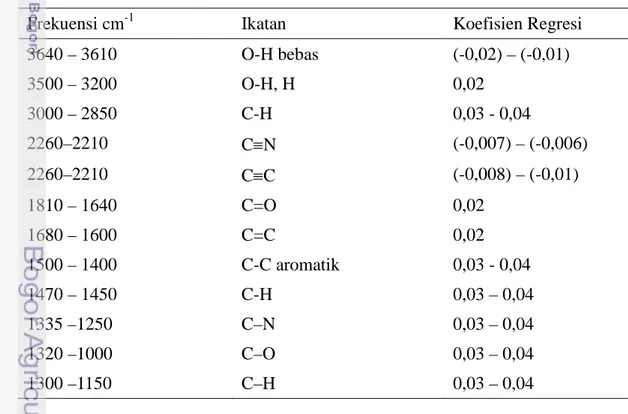
Tabel 8 Daerah serapan gugus fungsi dan koefisien regresi
Frekuensi cm-1 Ikatan Koefisien Regresi
3640 – 3610 O-H bebas (-0,02) 3500 – 3200 O-H, H 0,007 3000 – 2850 C-H 0,01 2260–2210 C≡N (-0,01) 2260–2210 C≡C (-0,01) 1810 – 1640 C=O 0,004 1680 – 1600 C=C 0,004 1500 – 1400 C-C aromatik 0,01 1470 – 1450 C-H 0,01 1335 –1250 C–N 0,01 1320 –1000 C–O 0,02 1300 –1150 C–H 0,02
Gambar 9 memperlihatkan adanya beberapa bilangan gelombang, mewakili gugus fungsi senyawa tertentu, yang berpengaruh terhadap pengelompokkan dalam PLS. Interpretasi terhadap spektrum FTIR pada koefisien regresi pada Gambar 9 ditampilkan pada Tabel 8. Terdapat beberapa koefisien regresi yang nilainya positif diantaranya pada gugus O-H, CH aromatik, C=C,
42
C=O, C-O, C-N dan C-H. Adapun gugus O-H bebas serta ikatan rangkap tiga C≡N dan C≡C memiliki nilai koefisien negatif. Untuk koefisien regresi positif maka gugus fungsi dari senyawa tersebut berkontribusi terhadap pengelompokkan propolis asal daerah dan aktifitas antioksidannya. Gugus fungsi yang menunjukkan koefisien regresi negatif berarti keberadan gugus fungsi tersebut kemungkinan akan menurunkan kemampuan antioksidan propolis.
Berdasarkan gambar 9 ditampilkan koefisien regresi (regression coefficient
B) untuk setiap gugus fungsi. Hal ini ditandai dengan adanya beberapa bilangan
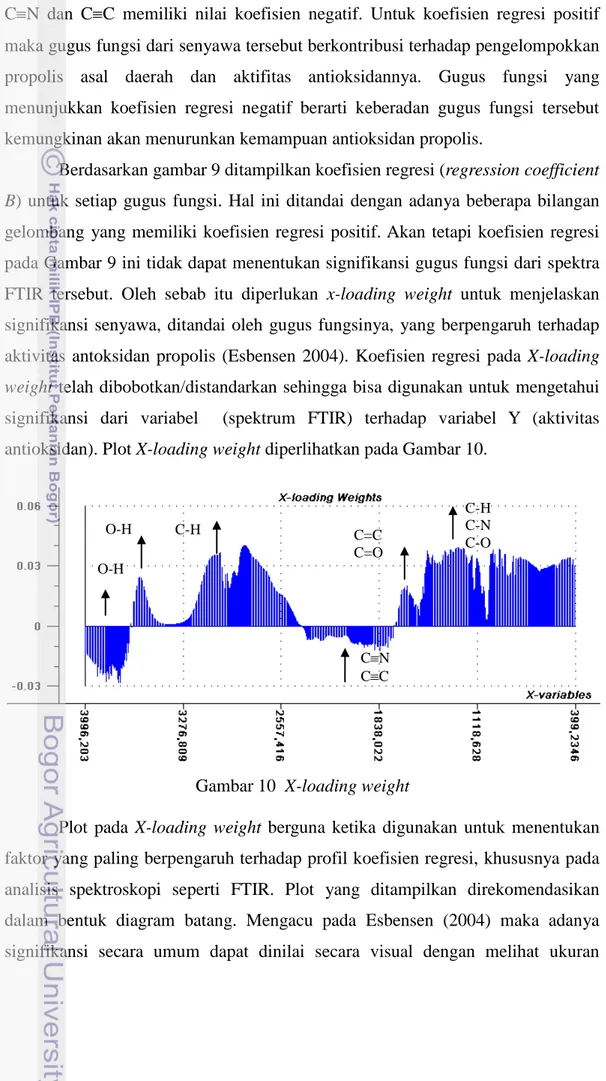
gelombang yang memiliki koefisien regresi positif. Akan tetapi koefisien regresi pada Gambar 9 ini tidak dapat menentukan signifikansi gugus fungsi dari spektra FTIR tersebut. Oleh sebab itu diperlukan x-loading weight untuk menjelaskan signifikansi senyawa, ditandai oleh gugus fungsinya, yang berpengaruh terhadap aktivitas antoksidan propolis (Esbensen 2004). Koefisien regresi pada X-loading
weight telah dibobotkan/distandarkan sehingga bisa digunakan untuk mengetahui
signifikansi dari variabel (spektrum FTIR) terhadap variabel Y (aktivitas antioksidan). Plot X-loading weight diperlihatkan pada Gambar 10.
Plot pada X-loading weight berguna ketika digunakan untuk menentukan faktor yang paling berpengaruh terhadap profil koefisien regresi, khususnya pada analisis spektroskopi seperti FTIR. Plot yang ditampilkan direkomendasikan dalam bentuk diagram batang. Mengacu pada Esbensen (2004) maka adanya signifikansi secara umum dapat dinilai secara visual dengan melihat ukuran
Gambar 10 X-loading weight
O-H C-H C=C C=O C-H C-N C-O O-H C≡N C≡C
43 koefisien regresi, yaitu jika koefisien variabel dari variabel lebih besar dari 0,2 maka pengaruh dari variabel tersebut kemungkinan menjadi sangat penting, sedangkan jika nilai lebih kecil dari 0,1 maka pengaruhnya dapat diabaikan dan jika nilai koefisien regresi antara 0,1 dan 0,2 maka tidak ada kesimpulan apapun yang dapat diberikan.
Gambar 10 mengindikasikan keterlibatan beberapa gugus fungsi senyawa tertentu, yang berpengaruh terhadap pengelompokkan dalam PLS. Interpretasi terhadap spektrum FTIR pada koefisien regresi pada Gambar 10 ditampilkan pada Tabel 9. Terdapat beberapa koefisien regresi yang nilainya lebih besar dari 0,2 diantaranya pada gugus O-H, CH aromatik, C=C, C=O, C-O, C-N dan C-H. Sebaliknya terdapat ikatan rangkap tiga C≡N dan C≡C memiliki nilai koefisien negatif dibawah 0,2 sehingga pengaruhnya dapat diabaikan. Selanjutnya adalah ikatan O-H bebas yang nilainya koefisien regresinya negatif antara 0,1 dan 0,2 maka tidak dapat disimpulkan pengaruhnya terhadap aktivitas antioksidan dan pengelompokan dalam PLS.
Tabel 9 Daerah serapan gugus fungsi dan koefisien regresi x-loading weight
Frekuensi cm-1 Ikatan Koefisien Regresi
3640 – 3610 O-H bebas (-0,02) – (-0,01) 3500 – 3200 O-H, H 0,02 3000 – 2850 C-H 0,03 - 0,04 2260–2210 C≡N (-0,007) – (-0,006) 2260–2210 C≡C (-0,008) – (-0,01) 1810 – 1640 C=O 0,02 1680 – 1600 C=C 0,02 1500 – 1400 C-C aromatik 0,03 - 0,04 1470 – 1450 C-H 0,03 – 0,04 1335 –1250 C–N 0,03 – 0,04 1320 –1000 C–O 0,03 – 0,04 1300 –1150 C–H 0,03 – 0,04
Menurut pendapat Esbensen (2004) Nilai koefisien yang tinggi mengindikasikan tingginya pengaruh dan nilai koefisien regresi yang kecil (mendekati nol) mengindikasikan bahwa variabel tersebut tidak berpengaruh.
44
Semakin tinggi koefisien regresi maka semakin besar gugus fungsi tersebut, yang diinterpretasikan dari bilangan gelombang, berkontribusi terhadap pengelompokkan. Gugus fungsi yang menunjukkan senyawa tertentu akan memiliki koefisien regresi yang tinggi atau rendah yang menunjukkan kontribusi gugus fungsi tersebut pada terjadinya pengelompokkan berdasarkan asal daerah yang berkorelasi dengan aktifitas antioksidannya.
Koefisien regresi yang tinggi pada gugus fungsi sebagaimana ditunjukkan pada Gambar 10 dan Tabel 9 tersebut mencirikan senyawa fenol dan flavonoid. Informasi tersebut mengindikasikan bahwa aktivitas antioksidan dan asal daerah dipengaruhi oleh senyawa fenol dan flavonoid yang merupakan senyawa dominan pada propolis. Dengan demikian dapat disimpulkan bahwa aktivitas antioksidan berkaitan erat dengan adanya senyawa fenol dan flavonoid.
Nilai ini sesuai dengan jumlah hasil fenol yang ditemukan dalam propolis dari wilayah berbeda. Sampel propolis Kalimantan Barat memperlihatkan konsentrasi fenol total yang sangat tinggi dan menunjukkan aktifitas penangkapan yang kuat terhadap radikal DPPH. Dengan demikian, sampel dengan jumlah fenol tertinggi menunjukkan aktivitas antioksidan yang tinggi pula. Menurut Kumazawa
et al. (2004) perbedaan kandungan fenol total dianggap senyawa aktif utama yang
bertanggung jawab terhadap aktivitas antioksidan dari ekstrak yang berbeda. Bahkan Pereira et al. (2008) dan Sousa et al. (2008) membuktikan bahwa nilai-nilai IC50
Kadar Fenol
secara statistik berhubungan dengan kandungan total fenol dalam sampel walnut dan minyak zaitun.
Hasil analisis PCA dan PLS mengindikasikan adanya bilangan gelombang tertentu yang mewakili gugus fungsional yang diduga berasal dari senyawa fenol dan flavonoid. Dengan demikian, senyawa fenol/flavonoid merupakan senyawa penting yang berperan terhadap aktivitas antioksidan propolis.
Fenol merupakan senyawa kimia dengan cincin aromatik dan memiliki satu atau lebih gugus hidroksil dengan spektrum keragaman senyawa yang luas. Kandungan fenol merupakan antioksidan yang paling banyak dan paling efektif dalam propolis (Mihai et al. 2011). Selain itu senyawa fenolik juga berperan
45 penting pada stabilitas oksidasi dan aktivitas antioksidannya. Oleh karena itu penentuan kadar total fenol diperlukan untuk mengetahui hubungan antara kadar total fenol dengan aktivitas antioksidan propolis. Korelasi positif yang terjadi akan mengkonfirmasikan keberadaan senyawa tersebut dan pengaruhnya terhadap aktivitas antioksidan.
Penentuan total fenol dilakukan untuk menentukan kadar senyawa fenol yang terdapat dalam setiap sampel propolis, adapun metode penentuan yang digunakan yaitu metode Ciocalteu. Uji ini menggunakan reagen Folin-Ciocalteu dan pengukuran dilakukan pada panjang gelombang 760 nm. Hasil yang diperoleh dinyatakan sebagai ekivalen asam galat (EAG).
Hamasaka et al. (2004) menyatakan bahwa metode Folin-Ciocalteu bermanfaat untuk mengevaluasi berbagai macam sampel propolis karena propolis banyak mengandung berbagai jenis senyawa fenol. Metode kolorimetri Folin-Ciocalteu merupakan metode yang sesuai untuk menganalisis kandungan total fenol propolis (Chang et al. 2002). Meskipun metode lainnya yaitu teknik kromatografi yang digabungkan dengan analisis spektrum penyerapan dan spektrometri massa memberikan informasi yang pasti dalam mengkuantifikasi senyawa fenol dalam propolis, namun metode ini membutuhkan instrumen canggih, standar beragam dan waktu analisis lebih lama. Woisky dan Salatino (1998) juga menggunakan metode ini untuk menganalisis propolis yang dalam hal ini bermanfaat dalam mengevaluasi mutu dan sifat propolis.
Asam galat merupakan standar untuk mengukur sampel pada makanan atau minuman yang diperkirakan mengandung senyawa fenol. Pengujian ini dilakukan karena senyawa fenol berkontribusi langsung terhadap kapasitas antioksidan. Nilai absorbansi yang terukur menyatakan intensitas senyawa fenol yang terdapat pada sampel. Semakin besar nilai absorbansi yang dihasilkan maka kandungan senyawa fenol pada propolis tersebut semakin tinggi.
Hasil yang diperoleh menunjukkan bahwa kandungan total fenol (mg EAG/100g propolis) yang ditentukan dengan metode Folin-Ciocalteau bervariasi antar sampel propolis. Kandungan total fenol dalam ekstrak propolis berbeda-beda menurut wilayah berkisar antara 39,9– 97,4 mg EAG/g sebagaimana disajikan pada Tabel 10 berikut.
46
Propolis dari daerah Kalimantan Barat mengandung total fenol yang paling tinggi dibandingkan yang lainnya yaitu sekitar 97,4 mg EAG/g. Hal ini membuktikan propolis Kalimantan Barat memiliki keunggulan dibandingkan dengan propolis dari daerah lain yaitu adanya kelompok senyawa fenol yang lebih banyak. Jumlah nilai total fenol tinggi juga ditemukan dari sampel propolis yang berasal dari daerah Jawa Barat yaitu 85,1 mg EAG/g. Urutan kadar total fenol pada propolis yang diuji dari yang paling kecil hingga besar adalah sebagai berikut propolis asal NTB, Sulawesi Selatan, Jawa Barat dan Kalimantan Barat. Variasi kandungan total fenol mencerminkan variasi komposisi kimia dari ekstrak propolis (Tabel 10).
Tabel 10 Kandungan total fenol propolis
Asal Propolis Total Fenol (mg/g) EAG
Nusa Tenggara Barat (Lombok) 39,9 ± 5,4 a
Sulawesi Selatan (Luwu) 54,1 ± 5,2
Jawa Barat (Ciamis)
b
85,1 ± 8,2 Kalimantan Barat (Sambas)
c
97,4 ± 0,2 Komersial
d
376,3 ± 18,8 e Jika dibandingkan dengan salah satu propolis komersial, ternyata nilai total fenol propolis komersial jauh melampaui propolis dari beberapa wilayah tersebut. Propolis komersial memiliki nilai total fenol yaitu mg 376,3 EAG/g. Tingginya propolis komersial ini dipengaruh perbedaan asal propolisnya yaitu propolis komersial umumnya merupakan propolis yang diperoleh dari lebah madu Apis. Disamping itu, kemungkinan ada perbedaan cara ekstraksi yang digunakan serta konsentrasi propolis yang dipakai tidak diketahui dengan pasti meskipun pada label kemasan menyatakan konsentrasi propolis sebesar 50%. Propolis ke empat wilayah diekstraksi dengan metode Mahani (2012) dengan konsentrasi propolis dengan propilen glikol sebesar 1:12. Karena itu nilai total fenol dari propolis komersial tersebut lebih tinggi yang berarti bahwa propolis komersial lebih baik dibanding propolis dari keempat wilayah di Indonesia tersebut.
Propolis diperdagangkan di berbagai belahan dunia dan diketahui sebagai sumber penting senyawa dengan sifat-sifat farmakologis. Senyawa fenol biasanya ditemukan pada bagian tanaman dan dilaporkan memiliki beberapa efek biologis,
47 termasuk aktivitas antioksidan (Kahkonen et al. 1999). Ragam senyawa fenolik sangatlah luas, mulai dari senyawa sederhana dengan satu atau beberapa gugus hidroksil hingga senyawa fenol dengan beberapa gugus aromatik dan hidroksil yang beragam.
Komposisi propolis sangat tergantung pada tanaman asal daerah tempat propolis dikumpulkan. Komposisi komponen aktif dalam tanaman tergantung pada biologi, kimia tanaman dan kondisi iklim. Dengan demikian menjadi beralasan untuk menduga bahwa propolis dari lokasi yang berbeda semestinya berbeda pula sifat karakteristiknya. Oleh karena itu, kandungan fenol propolis sangat dipengaruhi oleh flora, asal geografis dan karakteristik iklim tempat asal propolis. Variasi total fenol mencerminkan variasi komposisi kimia ekstrak propolis. Perbedaan kandungan fenol mungkin disebabkan perbedaan lokasi propolis dipanen. Hal ini sesuai dengan Ahn et al. (2007) yang melaporkan bahwa perbedaan komposisi kimia propolis dipengaruhi flora lokal yang tersedia untuk lebah. Dengan demikian karakteristik iklim dan vegetasi pada Tabel 4 mempengaruhi kandungan fenol dari propolis tersebut.
Beberapa penelitian lain telah dikembangkan mengenai komposisi fenol sampel propolis (Mihai et al. 2011). Senyawa yang dilaporkan diantaranya adalah asam kaffeat, asam p-kumarat, asam 3,4-dimetoksisinnamat; kuercetin; pinobanksin 5-metil eter, apigenin, kaempferol; pinobanksin; asam sinnamilideneasetat; krisin; pinokembrin; galangin; pinobanksin 3-asetat; phenetil kaffeat; sinnamol kaffeat; tektokrisin; artepillin C (Marcucci & Bankova 1999; Kumazawa et al. 2004). Meskipun senyawa jenis fenol dikaitkan dengan aktivitas antioksidan tanaman dan penentu utama antioksidan pada makanan (Heim et al. 2002), namun aktivitas antioksidan yang baik tidak selalu berkorelasi dengan keberadaan sejumlah besar senyawa fenol. Di samping itu, menurut Atoui et al. (2005) respon senyawa fenol dalam uji Folin-Ciocalteau tergantung pada struktur kimianya.
Kadar Flavonoid
Propolis mengandung berbagai macam senyawa fenol, terutama flavonoid (Kahkonen et al. 1999). Flavonoid terdiri dari ribuan senyawa diantaranya golongan flavonol, flavon, katekin, flavonon, antosianidin dan isoflavonoid.
48
Analisis total flavonoid dilakukan untuk mendapatkan jumlah kandungan flavonoid yang diduga bertanggung jawab terhadap aktivitas antioksidan.
Salah satu uji yang digunakan untuk menentukan kandungan total flavonoid diantaranya metode spektroskopi sinar tampak menggunakan AlCl3 dan NaOH sebagai pewarna (Pico 2012). Dalam penelitian ini, metode tersebut dipakai untuk menentukan kandungan total flavonoid sampel propolis. Kandungan flavonoid total dinyatakan sebagai dinyatakan dalam mg ekivalen kuersetin per g (mg EK/100 g). Kuersetin digunakan sebagai senyawa standar karena merupakan salah satu flavonoid yang banyak tersebar dalam sampel propolis dan memiliki absorbansi yang kuat pada konsentrasi rendah dari 100 ppm pada 415 nm karena adanya gugus fungsional hidroksil yang lain. Menurut Vermerris and Nicholson (2006) senyawa flavonoid dapat menyumbangkan hidrogen untuk memutuskan reaksi berantai dan dengan demikian melindungi lipid terhadap kerusakan oksidasi
Tabel 11 Kandungan total flavonoid propolis
Asal Propolis Total Flavonoid (mg/g) EK
Ciamis (Jawa Barat) 10,19 ± 1,47 b
Lombok (NTB) 4,25 ± 0,98
Luwu (Sulawesi Selatan)
a
3,12 ± 1,26 Sambas (Kalimantan Barat)
a
20,22 ± 2,45 Komersial
c
42,56 ± 6,19 d Kandungan total flavonoid yang diyakini menjadi penentu aktifitas antioksidan propolis hasilnya ditampilkan pada Tabel 11. Kadar total flavonoid seperti halnya total fenol juga bervariasi mulai dari 3,12 mg EK/g hingga 20,22 mg EK/g dengan kadar tertinggi dimiliki oleh propolis Kalimantan Barat dan terendah oleh propolis Sulawesi Selatan. Urutan kadar total flavonoid pada propolis yang dianalisis dari yang paling kecil hingga yang paling besar sebagai berikut Sulawesi Selatan, NTB, Jawa Barat, Kalimantan Barat.
Berdasarkan hasil diatas urutan kadar total flavonoid tidak mengikuti urutan yang sama dengan kadar total fenol. Hal ini dapat terjadi karena dalam penentuan total fenol hampir semua senyawa golongan fenolik seperti flavonoid maupun asam fenolat akan terukur. Sebagai contoh, propolis Sulawesi Selatan
49 merupakan propolis yang memiliki kadar fenol lebih tinggi dibanding NTB, namun kadar flavonoidnya lebih rendah dibanding NTB. Jadi, dapat saja flavonoid merupakan penyumbang terbesar grup fenolik ataupun penyumbang yang tidak terlalu dominan.
Jika dibandingkan dengan salah satu propolis komersial, ternyata nilai total flavonoid propolis komersial lebih tinggi dibanding propolis dari beberapa wilayah tersebut. Propolis komersial memiliki nilai total flavonoid yaitu mg 42,56 EAG /g. Nilai total flavonoid propolis komersial yang tinggi ini jika dibandingkan propolis keempat wilayah tersebut kemungkinan disebabkan adanya beberapa perbedaan sebagaimana dijelaskan sebelumnya sehingga propolis komersial dapat dikatakan lebih baik dibanding propolis keempat wilayah di Indonesia.
Beberapa penelitian menyatakan bahwa kemampuan antioksidan propolis tergantung pada beberapa senyawa fenol seperti flavonoid (Da Silva et al. 2006). Selanjutnya Mello et al. (2010) menyatakan bahwa kandungan total flavonoid yang tinggi menunjukkan kuatnya aktivitas antioksidan propolis. Flavonoid dilaporkan sebagai yang paling melimpah dan paling efektif sebagai antioksidan dalam propolis Flavonoid disintesis oleh tanaman sebagai respon terhadap stres lingkungan dan infeksi mikroba, dan diketahui memiliki sifat sebagai antioksidan, antiinflamasi dan antimikroba (Bankova 2005; Pietta 2000).
Kahkonen et al. (1999) mengungkapkan bahwa variasi kandungan flavonoid dalam propolis terutama disebabkan oleh perbedaan asal tanaman yang dikumpulkan oleh lebah madu Trigona spp. Kajian oleh Chen et al. (2008) juga menunjukkan bahwa variasi komponen bioaktif propolis tergantung pada daerah asal, iklim dan atau vegetasinya. Hal ini sesuai dengan iklim dan vegetasi daerah asal Trigona spp. yang berbeda-beda sebagaimana ditampilkan pada Tabel 4.
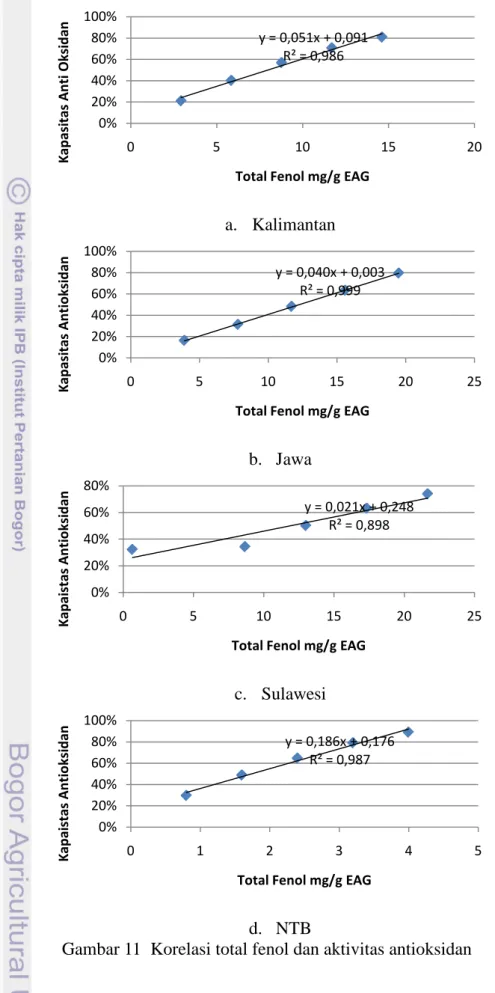
Korelasi Kandungan Fenol Terhadap Aktivitas Antioksidan
Semua sampel propolis menunjukkan aktivitas antioksidan. Dengan membandingkan dua metode yang digunakan untuk penentuan aktivitas antioksidan, memperlihatkan adanya korelasi. Hubungan antara aktivitas penangkapan (scavenging) radikal DPPH dari propolis sampel dan jumlah total fenol sampel propolis diplot pada Gambar 11 dan diamati korelasi positifnya (R2). Interpretasi nilai r berdasarkan korelasi Pearson dapat dilihat pada Lampiran 12.
50
a. Kalimantan
b. Jawa
c. Sulawesi
d. NTB
Gambar 11 Korelasi total fenol dan aktivitas antioksidan y = 0,051x + 0,091 R² = 0,986 0% 20% 40% 60% 80% 100% 0 5 10 15 20 Ka pa sit as A nt i O ks id an
Total Fenol mg/g EAG
y = 0,040x + 0,003 R² = 0,999 0% 20% 40% 60% 80% 100% 0 5 10 15 20 25 Ka pa sit as A nt io ks id an
Total Fenol mg/g EAG
y = 0,021x + 0,248 R² = 0,898 0% 20% 40% 60% 80% 0 5 10 15 20 25 Ka pa is ta s A nt io ks id an
Total Fenol mg/g EAG
y = 0,186x + 0,176 R² = 0,987 0% 20% 40% 60% 80% 100% 0 1 2 3 4 5 Ka pa is ta s A nt io ks id an
51 Senyawa fenol adalah senyawaan kimia yang berpotensi sebagai antioksidan, tetapi aktivitas antioksidan tidak hanya disebabkan oleh senyawaan fenol. Senyawaan triterpena pentasiklik, vitamin C, zat warna seperti klorofil, senyawaan sulfur, ataupun nitrogen juga dapat berperan sebagai zat antioksidan (Khamsah et al. 2006). Berdasarkan Gambar 11 terlihat hubungan antara antioksidan aktivitas ekstrak propolis dan kandungan senyawa fenol yang menunjukkan adanya korelasi yang positif.
Analisis regresi antara kekuatan antioksidan dan kandungan total fenol menunjukkan korelasi linier. Koefisien R2 diperoleh untuk setiap propolis. Hasil ini menunjukkan bahwa antioksidan propolis dipengaruhi senyawa fenol yang memiliki kemampuan mereduksi. Kekuatan antioksidan propolis mungkin berhubungan juga dengan pereduksi lain yang ada pada konsentrasi rendah dan tidak diungkapkan prosedur Folin-Ciocalteau. Meskipun demikian, analisis kualitatif dan kuantitatif yang lebih rinci terhadap senyawa dengan aktivitas antioksidan diperlukan untuk menjelaskan aktivitas antioksidan dari propolis.
Korelasi antara kandungan fenol dengan aktivitas antioksidan tidak selalu terjadi. Jika demikian, berarti ada senyawa lain dalam sampel yang berperan dalam menyumbangkan aktivitas antioksidan karena adanya senyawa‐senyawa lain selain senyawa fenol. Berdasarkan perhitungan menggunakan perangkat lunak SPSS diketahui bahwa korelasi Pearson antara aktivitas antioksidan metode DPPH propolis dari empat wilayah dengan kandungan fenolnya berkorelasi positif (r = 0,9). Dengan demikian terlihat hubungan korelasi positif dan kuat antara total fenol dan aktivitas antioksidan propolis dari ke empat wilayah tersebut.
Berdasarkan hasil tersebut dapat dinyatakan bahwa aktivitas antioksidan disebabkan oleh kandungan total fenol dari propolis. Hasil ini sesuai dengan Valencia et al. (2011) yang membuktikan bahwa senyawa fenolik propolis berkorelasi nyata dengan sifat antioksidan pada sampel propolis dari Mexico. Selain itu Pereira et al. (2008) dan Sousa et al. (2008) juga membuktikan bahwa nilai IC50
Dengan adanya perbedaan yang ditemukan berkaitan dengan aktivitas antioksidan propolis maka dapat disimpulkan bahwa tidak hanya wilayah
secara statistik berhubungan dengan total fenol dalam sampel walnut dan minyak zaitun.
52
geografis dimana propolis dipanen mempengaruhi komposisi kimia, tetapi juga kemampuan antioksidannya. Kesimpulannya, sampel dengan jumlah tertinggi total fenol menunjukkan aktivitas antioksidan tinggi. Kumazawa et al. (2004) berpendapat bahwa kandungan fenol total dianggap bertanggung jawab utama terhadap aktivitas antioksidan dari ekstrak yang berbeda Oleh karena itu, diperlukan penyelidikan mengenai identifikasi dari senyawa utama yang bertanggung jawab terhadap sifat antioksidan propolis.
Korelasi Kandungan Flavonoid Terhadap Aktivitas Antioksidan
Aktivitas penangkapan radikal bebas DPPH tampaknya berhubungan dengan aktivitas antioksidan. Namun, analisis kualitatif dan kuantitatif secara lebih rinci dari senyawa dengan aktivitas antioksidan diperlukan untuk menjelaskan aktivitas antioksidan propolis (Choi et al. 2006). Untuk hubungan antara aktivitas antioksidan dan total flavonoid maka korelasi yang tinggi ditemukan ketika menghubungkan aktivitas antioksidan dan total flavonoid.
Flavonoid memiliki peran penting dalam aktivitas antioksidan dari propolis. Berdasarkan evaluasi terhadap aktivitas antioksidan dan flavonoid propolis menurut asal daerah sebagaimana disajikan pada Gambar 12, ditemukan bahwa kandungan flavonoid dalam propolis berkorelasi dengan efek antioksidannya. Semua sampel propolis memiliki kandungan flavonoid yang tinggi dan untuk mengetahui hubungannya terhadap aktivitas antioksidan dilakukan perhitungan korelasi Pearson.
Perhitungan korelasi Pearson antara kandungan total flavonoid terhadap aktivitas antioksidan menunjukkan korelasi positif yang tinggi (r = 0,9). Hal ini berarti terlihat hubungan korelasi yang positif dan kuat antara total flavonoid dan aktivitas antioksidan propolis dari ke empat wilayah tersebut. Berdasarkan hasil tersebut maka dapat dinyatakan bahwa aktifitas antioksidan disebabkan oleh kandungan total flavonoid dari propolis. Hasil ini sesuai dengan laporan yang menyatakan bahwa flavonoid sebagai antioksidan paling banyak dan paling efektif dalam propolis (Bonvehi & Coll 1994; Isla et al. 2001).
53
a. Kalimantan
b. Jawa
c. Sulawesi
d. NTB
Gambar 12 Korelasi total flavonoid dengan aktivitas antioksidan y = 0,027x + 0,137 R² = 0,978 0% 20% 40% 60% 80% 100% 0 5 10 15 20 25 30 Ka pa is ta s A nt io ks id an Total Flavonoid mg/g EK y = 0,046x + 0,029 R² = 0,997 0,00% 20,00% 40,00% 60,00% 80,00% 100,00% 0 5 10 15 20 Ka pa sit as A nt io ks id an Total Flavonoid mg/g EK y = 0,046x + 0,083 R² = 0,986 0% 20% 40% 60% 80% 100% 0 5 10 15 20 Ka pa sit as A nt io ks id an Total Flavonolid mg/g EK y = 0,173x + 0,281 R² = 0,964 0% 20% 40% 60% 80% 100% 120% 0 1 2 3 4 5 Ka pa sit as A nt io ks id an Total Flavonoid mg/g EK
54
Korelasi kandungan flavonoid terhadap antioksidan tersebut berpengaruh signifikan, meskipun dimungkinkan adanya faktor lain yang terlibat. Krol et al. (1990) mengemukakan bahwa aktivitas antioksidan dari ekstrak propolis ditandai dengan tingginya kandungan flavonoid dalam propolis Propolis dari Kalimantan Barat adalah salah satu propolis dengan kandungan flavonoid tertinggi, senyawa ini diakui memiliki aktifitas penangkapan radikal bebas tertinggi pula. Hasil ini jelas menunjukkan bahwa ada korelasi positif antara kandungan total flavonoid propolis dan aktifitas antioksidannya.
Banyak penelitian telah melaporkan aktivitas antioksidan untuk fenol, yang karena kemampuan mereka untuk mengurangi pembentukan radikal bebas dan mengikat radikal bebas (Pietta 2000; Heim et al. 2002; Ahn et al. 2004) namun di sisi lain menunjukkan bahwa dalam kasus propolis ini penangkapan radikal bebas adalah berkaitan juga dengan kandungan flavonoid. Disamping itu, Kumazawa et al. (2004) juga melaporkan bahwa aktifitas antioksidan berkorelasi dengan kandungan total flavonoid ekstrak propolis.
Berdasarkan analisis FTIR pada Gambar 6 serta korelasi kandungan fenol dan flavonoid terhadap aktifitas antioksidan yang memberi korelasi positif linier yang tinggi (Gambar 11 dan Gambar 12) maka gugus fungsi sebagaimana ditunjukkan pada spektrum FTIR yang berpengaruh terhadap aktifitas antioksidan propolis mengarah pada keberadaan senyawa fenol dan flavonoid.
Aktivitas antioksidan dari senyawa fenol dan flavonoid disebabkan sifat reduksi dan oksidasinya sehingga memiliki kemampuan sebagai agen pereduksi, donor hidrogen, menghentikan oksigen singlet dan mengkelat logam. Senyawa fenol berperan sebagai antioksidan karena tersedianya gugus hidroksil dan strukturnya yang aromatik. Struktur aromatik tersebut menjadikan senyawa tersebut mampu dalam menangkap radikal bebas (Mihai et al. 2011)
Senyawa golongan fenolik dan turunannya seperti flavonoid merupakan senyawa yang memiliki kemampuan dalam menangkap radikal bebas dengan cara mendonorkan elektron untuk menstabilkan radikal bebas. Golongan fenol dan flavonoid memiliki spektrum keberagaman yang luas yang dibedakan berdasarkan gugus fungsi yang menyertainya. Perbedaan gugus fungsi pada golongan flavonoid menyebabkan perbedaan aktivitas antioksidannya.