ANALISIS KERAGAMAN GENETIKA TANAMAN KUNYIT
DAN TEMULAWAK SECARA
Random Amplified Polymorphic
DNA-Polymerase Chain Reaction
(RAPD-PCR)
MENGGUNAKAN PRIMER OPA-OPD 6-10
DEFFY PRAHADITYA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ANALISIS
KERAGAMAN
GENETIKA
TANAMAN
KUNYIT
DAN
TEMULAWAK SECARA
Random Amplified Polymorphic DNA-Polymerase
Chain Reaction
(RAPD-PCR) MENGGUNAKAN PRIMER OPA-OPD 6-10.
Dibimbing oleh EDI DJAUHARI P dan POPI ASRI KURNIATIN.
Selama ini penelitian mengenai kunyit (
Curcuma domestica
Val.) dan
temulawak (
Curcuma xanthorrizha
Roxb.) asal Indonesia hanya berkisar pada
kandungan metabolit sekunder tetapi penelitian mengenai informasi keragaman
genetika tanaman kunyit dan temulawak belum pernah dilakukan sebelumnya.
Penelitian ini bertujuan untuk menganalisis pola sidik jari tanaman kunyit dan
temulawak asli Indonesia dengan menggunakan primer seri OPA-OPD 6-10
sehingga didapatkan pohon filogenetik dari tanaman kunyit dan temulawak.
Analisis Tahapan penelitian ini dimulai dari isolasi DNA, amplifikasi DNA,
hingga analisis dan konstruksi pohon filogenetik menggunakan metode UPGMA
(
Unweighted Pair Group Method Arithmatic Mean
) dengan
software
NTSYS.
Hasil isolasi DNA yang menunjukkan pita yang bagus dan memiliki ukuran
diantara 11000-12000 bp dengan hasil kemurnian berkisar antara 1.091-2.625.
Amplifikasi DNA dengan 20 primer acak OPA-OPD 6-10 menghasilkan 259 pita
(100% polimorfik). Analisis kemiripan genetik menunjukkan nilai koefisien
kemiripan genetik sebesar 0.3033-0.6721 untuk tanaman kunyit dan
0.1939-0.9082 untuk tanaman temulawak. Nilai tersebut menunjukkan tanaman kunyit
dan temulawak asal Indonesia memiliki tingkat keragaman genetik yang tinggi.
ABSTRACT
DEFFY PRAHADITYA. Analysis of Genetic Diversity in Turmeric and Wild
Ginger Plants Using Random Amplified Polymorphic DNA - Polymerase Chain
Reaction (RAPD-PCR) with OPA-OPD 6-10 Primers. Under direction of EDI
DJAUHARI P and POPI ASRI KURNIATIN.
There are many studies on turmeric (
Curcuma domestica
Val.) and wild
ginger (
Curcuma xanthorrizha
Roxb.) from Indonesia is only about the content of
secondary metabolites, but research on the genetic diversity information of
turmeric and wild ginger plants has never been done before. This study was aimed
to analyze the fingerprint pattern of Indonesian native turmeric and wild ginger
plants by using OPA-OPD 6-10 primer series to obtain a phylogenetic tree of
these plants. The steps of this research were DNA isolation, amplification of
DNA, then analysis and construction of phylogenetic trees using the UPGMA
(unweighted pair group method arithmetic mean) with NTSYS software. The
resulted DNA showed good bands and had a size between 11000-12000 bp with
the range of purity between 1091-2625. DNA amplification with 20 random
OPA-OPD 6-10 primers produced 259 bands (100% polymorphic). Analysis of genetic
similarity indicated a genetic similarity coefficient 0.3033-0.6721 for turmeric
plant and 0.1939-0.9082 for wild ginger plant. This value indicated that the
turmeric and wild ginger plants from Indonesia has a high level of genetic
diversity.
ANALISIS KERAGAMAN GENETIKA TANAMAN KUNYIT
DAN TEMULAWAK SECARA
Random Amplified Polymorphic
DNA-Polymerase Chain Reaction
(RAPD-PCR)
MENGGUNAKAN PRIMER OPA-OPD 6-10
DEFFY PRAHADITYA
G84080025
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Analisis
Keragaman
Genetika
Tanaman
Kunyit
dan
Temulawak secara
Random Amplified Polymorphic
DNA-Polymerase Chain Reaction
(RAPD-PCR) Menggunakan
Primer OPA-OPD 6-10
Nama
: Deffy Prahaditya
NIM
: G84080025
Disetujui
Komisi Pembimbing
Diketahui
Tanggal Lulus:
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
Drs. Edy Djauhari P, M.Si.
Ketua
PRAKATA
Alhamdulillah, segala puji dan syukur penulis panjatkan kepada Allah SWT
atas segala karunia-Nya. Shalawat dan salam semoga selalu tercurah kepada Nabi
Muhammad SAW dan para pengikutnya sampai akhir zaman sehingga penulis
dapat menyelesaikan penelitian ini. Penelitian ini berjudul Analisis Keragaman
Genetika Tanaman Kunyit dan Temulawak secara
Random Amplified
Polymorphic DNA-Polymerase Chain Reaction
(RAPD-PCR) Menggunakan
Primer OPA-OPD 6-10.
Kegiatan penelitian ini dilakukan dari bulan Februari
hingga Juli 2012, bertempat di Laboratorium Penelitian Biokimia IPB dan
Laboratorium Genetika Molekuler Fakultas Peternakan IPB.
Terima kasih penulis ucapkan kepada semua pihak yang telah membantu
dalam penyelesaian penelitian ini, terutama kepada Drs. Edy Djauhari P. K, M.Si.
selaku ketua pembimbing dan Popi Asri Kurniatin S.Si, Apt, M.Si selaku anggota
pembimbing dalam memberikan saran, kritik, dan bimbingannya serta orang tua
dan keluarga yang selalu memberikan doa, dukungan, motivasi, dan semangat
bagi penulis untuk menyelesaikan penelitian ini. Tak lupa pula ucapan
terimakasih kepada mas Opik, mas Eka, mba Eli, bu Meri, bu Martini, pak Nana,
pak Yadi dan segenap staf di Laboratorium Penelitian Biokimia, Institut Pertanian
Bogor serta mas Erik dan mas Ferdy dan segenap staf Laboratorium Genetika
Peternakan, Fakultas Peternakan, Institut Pertanian Bogor atas peran, bantuan, dan
kerjasamanya dalam menyelesaikan penelitian ini
.
Penulis juga menyampaikan terima kasih kepada rekan selama penelitian
Nur, Anissa Utami, Riani, Rian, Yoan, Lusi, dan Aros. Selain itu penulis juga
berterimakasih kepada Puan Maharany atas dukungan moril serta semangat dan
semua pihak yang tidak dapat disebutkan satu-persatu dalam memberikan
bantuan, kritik, dan saran bagi penulis. Penulis menyadari masih banyak
kekurangan dalam penelitian ini. Semoga penelitian ini mampu memberikan
informasi dan manfaat bagi yang memerlukan.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada tanggal 16 Februari 1990 dari ayah Juma
Sanjaya dan ibu Anah Nurjannah. Penulis merupakan anak pertama dari tiga
bersaudara.
Pendidikan penulis dimulai dari SDI Yakmi dan melanjutkan pendidikan ke
SMPN 3 Tangerang. Penulis lulus tahun 2008 dari SMAN 101 Jakarta Barat dan
pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi
Masuk IPB (USMI). Penulis memilih mayor Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis pernah menjadi ketua kelas pada
tingkat Tahap Persiapan Bersama 2008-2009. Selain itu, penulis pernah mengikuti
Go Field
IPB dengan tema Pemulihan Lahan Pertanian Pasca Erupsi Merapi di
kabupaten Magelang tahun 2011. Penulis pernah melakukan Praktik Lapangan
(PL) di Balai Pengkajian Bioteknologi, Badan Pengkajian dan Penerapan
Teknologi Kompleks PUSPIPTEK, Tangerang selama periode Juli 2011 hingga
Agustus 2011 dengan judul Optimasi Isolasi DNA Daun Tanaman Aglaia Dari
berbagai Metode Isolasi DNA
Organisasi yang diikuti penulis selama perkuliahan yakni Himpunan Profesi
Mahasiswa Biokimia (CREBs) tahun 2009-2010 bidang informasi dan
komunikasi dan tim drama musikal
Ceboch’s
tahun 2009-2011. Penulis juga
pernah mengikuti berbagai kepanitiaan seperti Kesehatan dan Keselamatan Kerja
tahun 2009 dan 2011, Lomba Karya Ilmiah Populer tahun 2011, koordinator
logistik dan transportasi Masa Pengenalan Departemen tahun 2010, Seminar
Kesehatan Biokimia tahun 2011, dan ketua pelaksana Malam Keakraban Biokimia
45 tahun 2012.
DAFTAR ISI
Halaman
DAFTAR TABEL ... . ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ...
x
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Kunyit (
Curcuma domestica
Val.) ...
1
Temulawak (
Curcuma xanthorrhiza
ROXB.) ...
2
Isolasi DNA ...
3
Keragaman Genetika ...
4
Random Amplified Polymorphism DNA-Polymerase Chain Reactio
n
(RAPD-PCR)... 4
BAHAN DAN METODE
Alat dan Bahan ...
5
Metode...
5
HASIL DAN PEMBAHASAN
Isolasi DNA Kunyit dan Temulawak dengan Metode Orozco-Castillo
(1994) ... ... 7
Hasil Analisis Kualitatif DNA Kunyit dan Temulawak ...
8
Hasil Analisis Kuantitatif DNA Kunyit dan Temulawak ...
9
Amplifikasi DNA Kunyit dan Temulawak dengan Primer Acak
OPA-OPD 6-10 ... 10
Analisis Hubungan Kekerabatan Genetik Kunyit dan Temulawak... 12
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
Halaman
1 Sampel dan asal sampel yang digunakan ... 7
2 Hasil analisis kuantitatif DNA tanaman kunyit dan temulawak ... 10
DAFTAR GAMBAR
Halaman
1 Tanaman kunyit (
Curcuma domestica
Val.) ... 2
2 Rimpang tanaman kunyit ... 2
3 Tanaman temulawak (
Curcuma xanthorrhiza
ROXB.) ... 3
4 Skema proses PCR-RAPD ... 5
5 Elektroforegram hasil kualitatif DNA kunyit dan temulawak ... 9
6 Elektroforegram sampel temulawak sragen ... 11
7 Elektroforegram sampel kunyit ciemas ... 11
8 Dendogram 4 sampel tanaman kunyit ... 12
9 Dendogram 5 sampel tanaman temulawak ... 12
DAFTAR LAMPIRAN
Halaman
1 Strategi penelitian ... 16
2 Daftar urutan basa primer yang digunakan dalam penelitian... 17
3 Hasil analisis kuantitatif DNA dengan spektrofotometer ... 18
4 Jumlah pita DNA tampak tiap sampel hasil amplifikasi PCR-RAPD
menggunakan primer OPA-OPD 6-10 ... 19
5 Dendogram dan koefisien kemiripan genetik 4 sampel tanaman kunyit
berdasarkan proporsi fragmen yang dimiliki... 20
6 Dendogram dan koefisien kemiripan genetik 4 sampel temulawak
berdasarkan proporsi fragmen yang dimiliki ... 21
7 Elektroforegram hasil RAPD tanaman kunyit dan temulawak dengan
PENDAHULUAN
Perkembangan teknologi dan transportasi yang pesat di zaman modern ini menyebabkan pola hidup sebagian besar masyarakat Indonesia berubah menjadi pola hidup instan dan tidak sehat mengikuti perkembangan yang terjadi. Masyarakat cenderung untuk mengonsumsi makanan instan atau cepat saji yang berbahaya bagi kesehatan manusia dan lupa untuk berolahraga. Pertumbuhan transportasi yang pesat di kota-kota besar Indonesia juga menyebabkan udara menjadi kotor sehingga dapat menyebabkan timbulnya penyakit dan radikal bebas dalam tubuh manusia. Kebiasaan buruk sebagian besar masyarakat Indonesia yang gemar merokok juga menyebabkan banyak terjadi kasus kanker paru-paru. Konsumsi rokok menyebabkan 200.000 kematian setiap tahunnya di Indonesia yang disebabkan penyakit kanker paru-paru (Sarah et al. 2008).
Negara Indonesia dengan keanekaragaman hayati yang tinggi memiliki berbagai jenis tanaman rimpang yang dapat dimanfaatkan untuk kesehatan. Beberapa diantaranya yaitu tanaman kunyit (Curcuma domestica Val.) dan temulawak (Curcuma xanthorriza Roxb.) yang memiliki kemampuan untuk menangkal radikal bebas serta berfungsi sebagai antioksidan. Zat yang berperan sebagai antioksidan yang menangkal radikal bebas adalah kurkuminoid yang terdapat pada kunyit dan temulawak. Kurkuminoid adalah komponen yang memberikan warna kuning yang bersifat sebagai antioksidan dan berkhasiat antara lain sebagai hipokolesteromik, kolagogum, koleretik, bakteriostatik, spasmolitik. Berbagai penelitian telah membuktikan khasiat kurkuminoid dalam pengobatan terutama sebagai antihepatoksik dan antikolesterol, serta obat tumor dan kanker (Nagabhushan & Bhide 1992; Chan & Fong dalam Craig 1999).
Tanaman kunyit dan temulawak merupakan tanaman obat yang banyak digunakan pada industri jamu tradisional Indonesia. Selain dimanfaatkan sebagai tanaman obat, kunyit juga memiliki banyak manfaat lain diantaranya sebagai bahan baku kosmetik, makanan, dan minuman. Rimpang kunyit juga dimanfaatkan untuk mencegah dan mengatasi kanker karena mengandung zat kurkuminoid yang terdiri dari demektoksikurkumin, bisdemetoksikurkumin, dan kurkumin. Tanaman temulawak juga dapat dipergunakan sebagai obat
hepatoproteksi, antiinflamasi, antikanker, antidiabetes, antimikroba, antihiperlipidemia, antikolera, antibakteri dan antioksidan (Hwang 2006; Darusman et al. 2007; Rukayadi et al. 2006; Masuda et al. 1992; Yasni S et al. 1994).
Selama ini penelitian mengenai kunyit dan temulawak asal Indonesia hanya berkisar pada kandungan metabolit sekunder. Penelitian mengenai informasi keragaman genetika tanaman kunyit dan temulawak asal Indonesia belum pernah dilakukan sebelumnya. Penelitian ini bertujuan untuk menganalisis pola sidik jari tanaman kunyit dan temulawak asli Indonesia dengan menggunakan primer seri OPA-OPD 6-10 sehingga didapatkan pohon filogenetik dari tanaman kunyit dan temulawak. Hipotesis dari penelitian ini adalah didapatkannya informasi mengenai pola sidik jari dan didapatkan pohon filogenetik tanaman kunyit dan temulawak. Manfaat penelitian ini yaitu informasi pola sidik jari tanaman kunyit dan pohon filogenetik dari tanaman kunyit dan temulawak asli Indonesia dapat digunakan untuk pembuatan bibit unggul.
Teknik Random Amplified Polymorphic DNA (RAPD-PCR) digunakan karena relatif sederhana, mudah dalam preparasi, memberikan hasil lebih cepat, dan menghasilkan karakter yang relatif tidak terbatas sehingga sangat membantu untuk keperluan analisis variabilitas genetik tanaman yang tidak diketahui latar belakang genomnya.
TINJAUAN PUSTAKA
Kunyit
Kunyit (Curcuma domestica Val.) tergolong dalam ordo Zingiberales, famili
Zingiberacea dan genus Curcuma. Tanaman kunyit adalah tanaman berumur panjang yang berasal dari wilayah Asia tenggara. Kunyit memiliki daun besar berbentuk lonjong dengan ujung yang meruncing dan berwarna hijau serta memiliki tinggi 40-100 cm (Gambar 1). Perkembangbiakan tanaman kunyit menggunakan bagian akarnya atau biasa disebut rimpang. (Sudarsono et al.
1996).
2
filandrena, sebinena, cineol, borneol, zingiberena, kurkumin turmeron, kamfena, kamfor, sesquiterpena, asam kaprilat, asam metoksinamik, dan tolimetol karbinol. Rimpang kunyit juga mengandung tepung dan zat warna yang mengandung alkaloid kurkumin sehingga memiliki manfaat untuk bahan obat tradisional, bahan baku industri jamu dan kosmetik, dan bahan bumbu masak. Selain itu rimpang tanaman kunyit juga bermanfaat sebagai anti inflamasi, anti oksidan, anti mikroba, anti diabetes, pencegah kanker, dan anti tumor (Syukur 2010).
Pemanfaatan rimpang kunyit untuk mencegah dan mengatasi kanker sudah banyak dilakukan. Berbagai penelitian juga telah membuktikan khasiat rimpang kunyit dalam pengobatan terutama sebagai antihepatoksik dan antikolesterol, serta obat tumor dan kanker (Nagabhushan & Bhide 1992; Chan & Fong dalam Craig 1999). Rimpang kunyit mengandung komponen aktif yaitu kurkuminoid yang meliputi kurkumin, demetoksikurkumin, bisdemetoksikurkumin, dan 1,7-bis(4-hidroksifenil)-1,4,6-heptatrien-3-on menurut Syukur (2010) yang bersifat sebagai antioksidan dan berkhasiat antara lain sebagai hipokolesteromik, kolagogum, koleretik, bakteriostatik, spasmolitik. Selain itu rimpang kunyit juga mengandung
ribosome inacting protein (RIP) yang berfungsi menonaktifkan perkembangan sel kanker, merontokkan sel kanker tanpa merusak jaringan sekitarnya,dan memblokir pertumbuhan sel kanker (Syukur 2010).
Gambar 1 Tanaman kunyit (Curcuma domestica Val.)
Gambar 2 Rimpang tanaman kunyit
Temulawak
Temulawak (Curcuma xanthorrhiza
Roxb.) tergolong dalam kingdom Plantae, divisi Spermatophyta, subdivisi
Angiospermae, kelas Monocotyledonae, ordo
Zingiberales, famili Zingiberacea dan genus
Curcuma (Rukmana 1995). Tanaman
temulawak termasuk salah satu jenis temu-temuan yang paling banyak digunakan sebagai bahan baku obat tradisional. Selain sebagai bahan baku obat tradisional, temulawak juga bisa dimanfaatkan sebagai sumber bahan pangan, pewarna, bahan baku industri seperti industri kosmetika, maupun dibuat makanan ataupun minuman segar (Dalimartha 2007).
Temulawak digunakan untuk mengobati hepatitis, radang hati, radang empedu, radang ginjal, batu empedu, kurang nafsu makan, diare, wasir, dan kolesterol tinggi. Ramuan atau jamu temulawak yang dikonsumsi secara teratur bisa menjaga kesehatan organ hati atau bertindak sebagai hepatoprotektor. Hal ini dikarenakan dalam tanaman temulawak, khususnya bagian rimpang mengandung berbagai komponen kimia seperti zat warna kuning (kurkumin), desmetoksi kurkumin, glukosa, kalium oksalat, protein, serat, pati, dan minyak atsiri (Wijayakusuma 2007).
Kandungan kurkumin dan xanthorrhizol di dalam rimpang temulawak menyebabkan temulawak memiliki berbagai macam khasiat (Taryono et al. 1987). Xanthorrizhol merupakan salah satu komponen dari minyak atsiri yang terdapat pada rimpang temulawak. Selain xanthorrhizol, minyak atsiri pada rimpang kunyit terdiri dari berbagai komponen seperti d-kamfer, siklo isoren, mirsen, p-tuloil metilkarbonil, falanndren, borneol, tumerol, sineol, isufuranogermakren, zingiberen, zingiberol, turmeron, artmeron, sabinen, germakron, dan atlantone (Wijayakusuma 2007). Minyak atsiri pada temulawak juga berkhasiat fungistatik pada beberapa jenis jamur dan bakteriostatik pada mikroba Staphylococcus sp. dan Salmonella
sp. (Dalimartha 2007).
3
yang ramping (Gambar 3). Tanaman temulawak mempunyai ukuran rimpang yang besar dan bercabang-cabang dengan rimpang induk berbentuk bulat dan disampingnya terbentuk 3-4 rimpang cabang yang memanjang. Rimpang temulawak berwarna coklat kemerahan atau kuning tua dengan warna daging rimpang kuning jingga atau jingga kecoklatan (Wijayakusuma 2007).
Gambar 3 Tanaman temulawak (Curcuma xanthorrizha Roxb.)
Isolasi DNA
DNA genom merupakan seluruh materi genetik yang dimiliki oleh suatu organisme termasuk di dalamnya DNA yang berinteraksi dengan protein dan RNA (Weaver & Hedrick 1997). Isolasi DNA adalah pemisahan molekul DNA dari molekul lain seperti dinding sel, membran sel, dan membran inti sehingga strukturnya dapat terlihat dengan jelas. Tujuannya adalah mengidentifikasi dan mengkarakterisasi DNA yang dibutuhkan untuk proses analisis biomolekuler lainnya. Tahap-tahap dalam isolasi DNA tanaman yaitu pengambilan sampel (jaringan), lisis dinding sel dan membran sel, purifikasi serta presipitasi (Kephart 1999).
Menurut Sudjadi (2008), teknik pemecahan sel dapat dilakukan secara fisik maupun kimia. Pemecahan sel secara fisik dapat dilakukan secara mekanik, yaitu dengan cara penggerusan. Sel juga dapat dipecah dengan cara kimia, yaitu penambahan lisozim (pada sel bakteri), ethylenediaminetetraasetic acid (EDTA) untuk sel tanaman, dan sodium dodesyl sulphate (SDS) untuk sel hewan.
Berbagai teknik analisis dalam pemuliaan tanaman dan biologi molekuler berdasarkan pada hibridisasi molekuler dan polymerase chain reaction (PCR) membutuhkan DNA dalam jumlah yang cukup dan kualitas yang baik. Kandungan senyawa sekunder dalam sel tanaman berbeda-beda maka setiap tanaman membutuhkan prosedur isolasi yang optimum agar diperoleh DNA genom yang dapat digunakan untuk proses analisis biomolekuler
lainnya. Isolasi DNA tanaman kunyit dan temulawak ini menggunakan modifikasi metode Castillo (1994) untuk memperoleh konsentrasi DNA dalam jumlah yang cukup.
Menurut Cruz et al. (1997), proses isolasi DNA tanaman pada umumnya sulit dilakukan, karena tanaman mengandung senyawa polisakarida dalam jumlah yang cukup besar. Selain itu, tanaman juga memiliki senyawa polifenol dan menghasilkan berbagai metabolit sekunder yang mengganggu proses isolasi dan manipulasi DNA. Metabolit sekunder yang dihasilkan tanaman antara lain flavonoid (Shahzadi et al. 2010; Khanuja et al. 1999), alkaloid, etanol, terpen, dan kuinon (Khanuja et al. 1999). Protein merupakan salah satu makromolekul yang juga menjadi kontaminan dalam pemurnian DNA. Protein dapat dihilangkan dari larutan DNA melalui pengendapan dengan larutan yang mengandung fenol (Ausubel et al. 1990) atau campuran fenol : kloroform : isoamilalkohol, selain itu protein juga dapat dihilangkan dengan menggunakan enzim proteinase K (Sudjadi 2008). Kloroform berperan untuk menstabilkan fase antara fenol dan supernatan, sedangkan isoamil alkohol berperan sebagai antifoam (Ausubel et al. 1990).
DNA hasil isolasi perlu dimurnikan terlebih dahulu. Pemurnian DNA bertujuan untuk memperoleh DNA yang terbebas dari kontaminasi senyawa dan makromolekul lain. Enzim-enzim restriksi dan enzim-enzim lain yang berperan dalam proses modifikasi DNA akan terganggu akibat adanya kontaminan (Ausubel et al. 1990). Tahapan yang dilakukan untuk memperoleh DNA murni yaitu membebaskan DNA dari dinding dan membran sel, disosiasi kompleks DNA-protein dengan cara denaturasi atau proteolisis, serta pemisahan DNA dari berbagai makromolekul lain (Rodriguez & Tait 1983).
4
Keragaman Genetika
Keragaman genetika (Genetic diversity) merupakan variasi genetika di dalam setiap spesies yang mencakup aspek biokimia, struktur, dan sifat organisme yang diturunkan secara fisik dari induknya dan dibentuk dari DNA. Keragaman genetika dapat terjadi karena adanya perubahan nukleotida penyusun DNA. Perubahan ini mungkin dapat mempengaruhi fenotipe suatu organisme yang dapat dipantau dengan mata telanjang atau mempengaruhi reaksi individu terhadap lingkungan tertentu. Secara umum keragaman genetika dari suatu populasi dapat terjadi karena adanya mutasi, rekombinasi atau migrasi gen dari satu tempat ke tempat lain.
Informasi mengenai keragaman genetika sangat diperlukan untuk mendukung berbagai macam kegiatan seperti konservasi dan pemuliaan tanaman untuk menghasilkan bibit unggul (Poerba & Yuzammi 2008). Besarnya keragaman genetika mencerminkan sumber genetik yang diperlukan untuk adaptasi ekologi dalam jangka waktu pendek dan evolusi dalam jangka panjang sehingga memudahkan dalam kegiatan konservasi. Dalam proses pemuliaan tanaman, efisiensi strategi pemuliaan tanaman biasanya diukur berdasarkan kepada kemajuan genetika untuk setiap unit waktu informasi keragaman genetika suatu populasi tanaman akan memungkinkan dilakukannya perbaikan karakter-karakter tanaman yang diinginkan (Edy 2008).
Analisis keragaman genetika suatu populasi tanaman menurut Asiedu et al.
(1989) dan Melchinger (1990) dapat dilakukan secara morfologis (bentuk, ukuran), sitologis (karyotipe kromosom), dan molekuler contohnya studi isozim, random amplified polymorphic DNA (RAPD), restriction fragment length polymorphism
(RFLP) serta amplified fragment length polymorphism (AFLP), dan simple sequence repeat (SSR). Metode molekuler seperti teknik RAPD paling banyak digunakan dalam analisis keragaman genetika karena memliki beberapa keunggulan, antara lain tidak membutuhkan latar belakang pengetahuan tentang genom yang akan dianalisis, bisa menggunakan primer-primer untuk organisme prokariotik maupun eukariotik, mampu menghasilkan karakter sampai mendekati jumlah yang tak terhingga, menggunakan bahan-bahan yang relatif murah kecuali enzim
Taq polimerase, cocok untuk membuat diagnosis silsilah (filogeni) suatu spesies dan
amplifikasinya tidak bergantung pada radioaktif (Surahman et al. 2007).
Random Amplified Polymorphism DNA-Polymerase Chain Reaction (RAPD-PCR)
Analisis keragaman genetik tanaman dapat diketahui dengan identifikasi secara molekuler. Salah satu teknik molekuler yang dapat digunakan adalah metode RAPD (Dwiamini et al. 2003). Metode RAPD dikembangkan berdasarkan PCR yang mampu mengamplifikasi sekuen DNA secara acak. Teknik ini melibatkan penempelan primer yang dirancang secara khusus sepuluh oligonukleotida pada cetakan DNA yang komplementer, selanjutnya akan dibentuk menjadi utas DNA baru. Jumlah produk amplifikasi PCR berhubungan langsung dengan jumlah dan orientasi sekuen yang komplementer terhadap primer di dalam genom tanaman (Azrai 2005).
Marka RAPD diperoleh berdasarkan kemungkinan adanya suatu sekuen DNA homolog dengan suatu sekuen primer oligonukleotida. Primer oligonukleotida acak akan menempel di dua tempat yang komplementer terhadap sekuens cetakan DNA genomik dalam orientasi yang berlawanan. Apabila kedua tempat penempelan primer berada dalam jarak yang berdekatan (< 4000 pasang basa), maka primer tunggal oligonukleotida akan mengawali terjadinya amplifikasi DNA secara eksponensial pada suatu reaksi PCR. Pada umumnya dengan menggunakan primer oligunukleotida 10-mer, setiap primer secara terus menerus mempromosikan pembentukan beberapa produk amplifikasi yang berbeda dan fragmen tersebut dianggap berasal dari lokus-lokus genetik yang berbeda. Setiap primer akan mengamplifikasi beberapa lokus yang diskrit di dalam genom (Surahman et al. 2007).
Keberhasilan amplifikasi ditentukan oleh kemampuan primer mengamplifikasi DNA cetakan dengan bantuan enzim DNA polimerase, dNTP (dATP, dTTP, dCTP, dan dGTP), suhu yang sesuai untuk mengurai DNA cetakan menjadi utas tunggal, pelekatan primer pada situs DNA cetakan, dan polimerisasi DNA. Keberhasilan suatu primer dalam mengamplifikasi DNA cetakan ditentukan oleh ada tidaknya homologi sekuen nukleotida primer dengan sekuen nukleotida DNA cetakan. Selain itu juga dipengaruhi oleh kualitas dan kuantitas DNA, konsentrasi MgCl2, enzim Taq DNA polimerase, dan suhu
5
Teknik RAPD memiliki beberapa keunggulan yaitu relatif sederhana dan hanya membutuhkan kuantitas DNA yang yang lebih sedikit (0.5-50 ng DNA) dalam setiap rantai PCR (Pandey et al. 1998). Selain itu teknik RAPD mampu menampilkan hasil dalam waktu relatif singkat. Hasil dapat segera divisualisasi setelah proses amplifikasi DNA. Karakter yang muncul relatif tidak terbatas tergantung pada primer yang digunakan sehingga sangat membantu untuk keperluan analisis keanekaragaman organisme yang tidak diketahui latar belakang genomnya. Kelemahan teknik RAPD yaitu
reproducibility atau hasil pengulangan yang rendah namun dapat diatasi dengan konsistensi kondisi PCR (Prana & Hartati 2003).
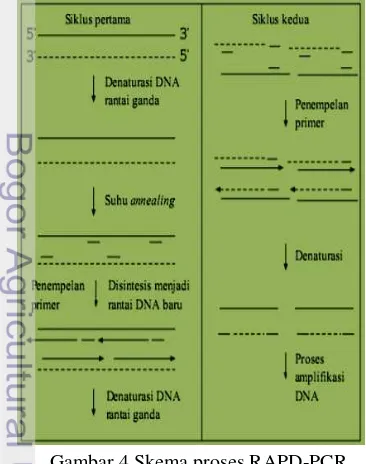
Proses RAPD-PCR pada dasarnya sama saja dengan proses PCR biasa yang terdiri atas dua tahap siklus. Tahap pertama berlangsung selama satu kali siklus meliputi proses denaturasi awal, denaturasi, penempelan primer, dan perpanjangan rantai. Tahap kedua berlangsung selama 44 siklus yang meliputi proses denaturasi, penempelan primer, perpanjangan rantai, dan perpanjangan rantai terakhir. Tahap yang membedakan proses RAPD-PCR yaitu penempelan primer karena primer yang digunakan pada RAPD-PCR hanya terdiri dari 8-10 oligonukleotida. Marka atau primer yang digunakan yaitu OPA–OPD seri 6-10. Marka tersebut dipilih karena merupakan rangkaian seri awal dari marka RAPD-PCR. Marka OPA-OPD seri 6-10 memiliki 10 oligonukleotida yang berbeda satu sama lain.
Gambar 4 Skema proses RAPD-PCR
BAHAN DAN METODE
Alat dan Bahan
Peralatan yang digunakan dalam isolasi DNA adalah mortar, tabung sentrifuse, sentrifus Beckman Coulter AllegraTM 64R Centrifuge, penangas air, pipet mikro, pipet Mohr, bulp, sudip, tabung mikro, neraca analitik Scaltec, dan dan spektrofotometer UV-VIS Beckman Coulter DU 530. Amplifikasi DNA dilakukan dengan alat berupa PCR Biogenesys. Alat-alat untuk elektroforesis terdiri atas perangkat elektroforesis, parafilm, cetakan gel, sisir,
power supply, dan alat untuk dokumentasi hasil pengamatan elektroforesis UV (AlphaImager EP). Selain itu digunakan juga autoklaf, gelas piala, labu erlenmeyer, gelas ukur, program AlphaInnotech dan program statistik khusus NTSYS versi 2.02 dengan menggunakan metode UPGMA (Unweighted Pair Group Method Arithmatic Mean).
Bahan-bahan yang digunakan untuk isolasi DNA adalah daun tanaman kunyit (Sukabumi, BPTO, Turina 1, Turina 2, Ngawi, Ciemas, Wonogiri) dan temulawak (Sukabumi, Sragen, Cursina 3, Wonogiri, BPTO) , PVP,
β-merkaptoetanol, bufer ekstraksi, kloroform : isoamilalkohol (24:1), isopropanol, ddH2O,
Molecular Water, Na-asetat 3 M pH 5.2, etanol absolut, dan etanol 70%. Bufer ekstraksi merupakan campuran akuades steril, Tris-HCl 1 M pH 8.0, ethyline diamine tetraacetic acid (EDTA) 0.5 M pH 8.0, NaCl 5 M, dan cetyltrimethylammonium bromide
(CTAB) 10%. Bahan untuk elektroforesis yaitu loading buffer (bromfenol blue 2.5% : sukrosa 40%), agarosa, Ethidium bromide
(EtBr) 1% (w/v), bufer TBE (Tris Base
EDTA) 0.5X, dan marker 100bp plus DNA
ladder (Fermentas). Bahan untuk amplifikasi meliputi complete buffer, dNTPs, Taq DNA Polimerase (Fermentas) , primer OPA, OPB, OPC, dan OPD (6-10).
Metode
Isolasi DNA dengan Metode Castillo (1994)
Sampel daun kunyit dan temulawak ditimbang sampai beratnya dipastikan mencapai 0.2 gram. Daun yang telah ditimbang ditaruh dalam mortar dan ditambahkan PVP sebanyak 0.3 gram, kemudian digerus sampai menjadi pasta. Pasta tersebut lalu dipindahkan ke dalam tabung effendorf 2 ml kemudian ditambahkan 1 mL buffer ekstraksi (10% CTAB, 0.5 M EDTA pH 8, 1 M Tris-HCl pH 8.0, 5 M NaCl,
6
Kocok sampel hingga homogen selanjutnya diinkubasi pada suhu 65°C selama 60 menit.
Pemurnian DNA dilakukan dengan menambahkan 0.7 mL buffer ekstraksi (CI 24:1) kemudian disentrifus dengan kecepatan 10000 rpm selama 10 menit, diambil supernatannya dengan hati-hati menggunakan mikropipet lalu dipindahkan ke tabung effendorf baru. Supernatan yang didapat ditambahkan 1 mL buffer ekstraksi (CI 24:1) dikocok bolak-balik secara perlahan kemudian disentrifus dengan kecepatan 10000 rpm selama 10 menit. Selanjutnya ambil supernatan dengan hati-hati menggunakan mikropipet lalu dipindahkan ke tabung effendorf baru kemudian ditambahkan 1/10 V 3 M Na-Asetat pH 5.2 dan 2x V etanol absolut dingin. Bolak-balik sampel perlahan kemudian inkubasi overnight pada suhu -20°C. Sampel yang sudah diinkubasi disentrifus pada kecepatan 12000 rpm selama 15 menit. Buang supernatan kemudian pelet yang didapatkan dari proses sentrifugasi dikeringkan. Pelet kemudian ditambahkan
Molecular Water (MW) 25 µL kemudian di ketuk-ketuk hingga larut.
Sampel DNA yang di dapat kemudian dimurnikan dengan ditambahkan RNAse. Volume RNAse yang ditambahkan adalah 1/100 dari volume DNA atau sebanyak 0.25 µL. Campuran larutan DNA dan RNAse dimasukkan dalam inkubator pada suhu 37º C selama 1 jam. Setelah proses inkubasi selesai kemudian sentrifus dengan kecepatan 12000 rpm selama 10 menit. Buang supernatan kemudian pelet yang didapatkan dari proses sentrifugasi dikeringkan kemudian ditambah larutan etanol 70% dingin. Sentrifus dengan kecepatan 12000rpm selama 10 menit. Buang supernatan kemudian pelet yang didapatkan dari proses sentrifugasi dikeringkan lalu ditambahkan Molecular Water (MW) 25 µL kemudian di ketuk-ketuk hingga larut. Setelah DNA larut, seluruh tabung DNA dimasukkan ke dalam freezer -20°C sebagai
stock DNA.
Uji Kualitatif DNA
Tujuan pengujian ini yakni untuk mengetahui DNA tanaman kunyit dan temulawak yang berhasil diisolasi sehingga dapat diketahui kualitas DNA yang diperoleh. Mulanya dibuat gel agarosa 1% untuk elektroforesis dengan dilarutkannya agarosa 0.25 g dalam 25 mL larutan TBE 0.5X. Kemudian dipanaskan hingga larut dan didinginkan pada suhu kamar hingga hangat. Selanjutnya ditambahkan 5 µL EtBr dan
dituang ke dalam cetakan gel elektroforesis yang telah dipasangi sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke dalam bak elektroforesis yang berisi TBE 0.5X. Sampel yang akan dielektroforesis dicampur dengan loading buffer dengan perbandingan 1:5 pada
parafilm. Setelah tercampur maka diinjeksi ke dalam sumur gel agarosa. Marker yang digunakan adalah 1 kb plus DNA ladder
sebanyak 1 µL. Setelah semua sampel selesai diinjeksi maka alat elektroforesis dihubungkan pada power supply yang dialiri tegangan listrik 100 volt selama ± 45 menit. Hasil elektroforesis diamati dengan bantuan lampu UV dalam trasnsilluminator dan dianalisis dengan program PhotoCaptMw.
Uji Kuantitatif DNA
Pengujian dilakukan dengan metode spektrofotometri. Suspensi DNA hasil isolasi sebanyak 3.5 µL diencerkan menjadi 350 µL dengan ditambahkannya Molecular Water. Hal ini untuk menghindari kesalahan yang timbul akibat sampel yang terlalu pekat. Selanjutnya dibaca absorban pada panjang
gelombang ( ) 260 nm, 280 nm, dan 230 nm.
Pengukuran pada panjang gelombang 280 nm dilakukan untuk mengetahui adanya kontaminasi protein sedangkan pada panjang gelombang 230 nm untuk mengetahui kontaminasi polisakarida dan fenol. Tingkat kemurnian DNA ditentukan dengan nilai perbandingan A260/A280. Nilai perbandingan
A260/A280 yang baik sekitar 1.6-1.8. Serapan
maksimum radiasi UV oleh DNA berada pada panjang gelombang 260 nm. Konsentrasi DNA yang baik belum sepenuhnya menjamin kualitas DNA juga baik.
RAPD-PCR DNA (Williams et al. 1990)
Pembuatan mix PCR dilakukan pada tabung mikro dengan komposisi antara lain 2 µL sampel DNA (50 ng), 2 µL buffer complette 10X, 2 µL dNTPs 10 mM, 0.8 µL primer acak RAPD 10 µM, 0.125 µL Taq
DNA polimerase, 13.075 µL MW (Molecular Water) sehingga volume total menjadi 20 µL. Campuran tersebut kemudian dihomogenisasi dengan diketuk-ketuk selama beberapa saat kemudian dimasukkan ke dalam mesin PCR.
7
72°C selama 1 menit untuk tahapan perpanjangan rantai. Untuk siklus berikutnya program suhu yang digunakan 92°C selama 1 menit untuk denaturasi DNA, 35°C selama 1 menit untuk penempelan primer, 72°C selama 2 menit untuk tahapan perpanjangan rantai hingga sebanyak 44 kali siklus, serta 72°C selama 7 menit terakhir untuk memastikan DNA yang diamplifikasi terdenaturasi seluruhnya. Hasil PCR kemudian dilihat dan dipisahkan dengan menggunakan elektroforesis gel agarosa.
Elektroforesis Hasil Amplifikasi
Elektroforesis hasil amplifikasi dilakukan menggunakan gel agarosa 1.7%. Sebelum dilakukan elektroforesis, hasil amplifikasi dicampurkan dengan loading buffer terlebih dahulu dengan perbandingan 1:5. Marker yang digunakan adalah 100 bp plus DNA
ladder sebanyak 1 µL. Elektroforesis dialiri tegangan listrik 100 volt selama ± 60 menit. Hasil elektroforesis diamati dengan bantuan lampu UV dalam trasnsilluminator.
Analisis Hasil Elektroforesis
Fragmen hasil amplikasi yang dilakukan merupakan lokus DNA yang bersifat dominan. Evaluasi dari pita-pita yang dihasilkan dilihat dari fragmen DNA yang mempunyai berat molekul tertentu. Ada atau tidaknya marka RAPD diskor menggunakan program AlphaInotech. Kriteria penskoran berdasarkan muncul tidaknya lokus, lokus yang muncul diberi skor 1 dan yang tidak muncul diberi skor 0. Data biner yang diperoleh selanjutnya diolah menjadi dendrogram atau disebut dengan pohon filogenetik dengan menggunakan program NTSYS 2.0.2 (Rohlf 1993).
HASIL DAN PEMBAHASAN
Isolasi DNA Kunyit dan Temulawak
Isolasi DNA telah dilakukan pada 7 sampel kunyit dan 5 sampel temulawak. Isolasi DNA kunyit dan temulawak menggunakan metode Orozco Castillo (1994) yang telah dimodifikasi. Nama sampel dan asal sampel yang digunakan bisa dilihat pada Tabel 1. Metode isolasi Orozco Castillo dipilih karena merupakan metode yang umum digunakan untuk isolasi DNA dari berbagai tanaman seperti kelapa sawit (Mathius et al.
2001), kakao (Triastanto et al. 2006), pisang (Sukartini 2008), dan lain-lain. Menurut
Rogers & Bendich (1994) metode ini mudah digunakan dan kemungkinan adanya enzim pengdegradasi DNA lebih kecil dibanding dengan metode yang lain. Metode ini pada dasarnya sama dengan metode isolasi DNA dengan CTAB (Cetyltrimethylammonium bromide) yang dikembangkan oleh Murray dan Thompson (1980). Perbedaannya terdapat pada penggunaan PVP ( Polyvinylpoly-pyrrolidone) dan β-Merkaptoetanol yang berfungsi untuh mencegah oksidasi yang dapat merusak DNA.
Tabel 1. Sampel dan asal sampel yang digunakan
Sampel Asal sampel Kunyit ciemas Sukabumi Kunyit wonogiri Wonogiri Kunyit BPTO Karanganyar Kunyit sukabumi Sukabumi Kunyit Turina 1 Bogor Kunyit Turina 2 Bogor Kunyit ngawi Ngawi Temulawak BPTO Karanganyar Temulawak sragen Sragen Temulawak sukabumi Sukabumi Temulawak wonogiri Wonogiri Temulawak Cursina 3 Bogor
DNA dapat diisolasi dari berbagai jenis bagian dari tanaman, antara lain daun, batang, bunga, buah maupun akar. Hal itu dapat dilakukan karena setiap bagian dari tanaman yang sama akan memiliki DNA dengan susunan dan ukuran yang sama. Bagian yang dipilih dari tanaman kunyit dan temulawak untuk diisolasi adalah bagian daunnya. Daun dipilih karena bagian tersebut merupakan bagian yang mudah untuk diambil serta memiliki jaringan mesofil yang paling mudah diisolasi, sel-selnya tersusun secara renggang sehingga enzim-enzim lisis mudah mencapai dinding sel jika dibandingkan dengan bagian lain (Muslim 2009). Daun yang dipilih adalah daun muda karena banyak mengandung DNA. Daun muda sedang aktif dalam melakukan proses pembelahan dan pertumbuhan sel sehingga banyak mengandung DNA.
8
Bufer ekstraksi Castillo juga ditambahkan ke dalam mortar setelah daun kunyit atau temulawak yang telah ditambahkan PVP menjadi halus. Bufer ekstraksi Castilo terdiri atas berbagai macam campuran bahan yang memiliki fungsi yang berbeda-beda. Salah satunya adalah CTAB yang merupakan deterjen kationik yang berfungsi membantu proses pemecahan dinding sel. Larutan deterjen berfungsi untuk menurunkan tegangan permukaan cairan dan melarutkan lipid sehingga membran sel mengalami degradasi dan organel-organel didalamnya dapat keluar dari sel. Kemampuan CTAB dalam melisis membran sel akan aktif pada kondisi panas, oleh karena itu setelah ditambahkan bufer ekstraksi Castillo sampel di inkubasi pada suhu 65°C. Selain berfungsi untuk melisis membran sel CTAB yang bermuatan positif pada bufer ekstrasi juga berfungsi untuk memisahkan polisakarida dari DNA dengan cara mengikat DNA yang bermuatan negatif.
Bufer ekstraksi Castillo juga mengandung senyawa kimia etilendiamin tetraasetat (EDTA) yang berfungsi menghancurkan sel secara kimiawi. EDTA menghancurkan sel dengan cara mengikat ion magnesium sebagai prekursor enzim sehingga enzim menjadi tidak aktif. Larutan NaCl dan tris-HCl juga terdapat di bufer ektraksi Castillo. Larutan NaCl berfungsi sebagai larutan isotonik yang menjaga tekanan osmotik sel agar DNA tidak rusak dan larutan tris-HCl berfungsi untuk memberikan kondisi pH yang optimum.
DNA yang tercampur dengan polisakarida, protein, dan pengotor lainnya perlu dibersihkan. Pembersihan DNA dilakukan dengan ekstraksi menggunakan larutan kloroform isoamilalkohol (CI) dan sentrifugasi. Larutan kloroform dapat menghilangkan kontaminasi akibat polisakarida sedangkan isoamilalkohol berfungsi untuk mengurangi pembusaan ketika ekstraksi DNA berlangsung (Sambrook & Russel 2001). Sentrifugasi akan memisahkan molekul-molekul berdasarkan bobotnya. Larutan CI sebagai pelarut organik dapat menghancurkan dan mengendapkan protein. Ekstraksi yang dilakukan berulang-ulang bertujuan agar DNA benar-benar terbebas dari pengotor. Ekstraksi dengan cara bertahap juga merupakan cara ekstraksi yang terbaik karena akan menghasilkan jumlah ekstrak yang lebih banyak dibandingkan ekstraksi langsung.
Larutan yang telah disentrifugasi akan menghasilkan tiga fase campuran yang
terpisah. Larutan CI berada di bagian bawah tabung sentrifus karena memiliki densitas yang tinggi. Bagian tengah larutan terdapat protein yang dilarutkan oleh larutan CI. Pada bagian atas terdapat larutan DNA. Larutan DNA dipipet dengan hati-hati agar tdak tercampur dengan fase lainnya lalu dimasukkan ke dalam tabung sentrifus baru dan di ekstraksi kembali dengan larutan CI.
Pemurnian DNA dilakukan dengan etanol absolut yang dapat mengendapkan DNA sedangkan kontaminan yang lain tetap larut (Sambrook & Russel 2001). Proses pemurnian DNA juga ditambahkan Na-asetat yang berfungsi untuk membantu memekatkan dan mengendapkan DNA. Pencucian endapan DNA dengan etanol 70% bertujuan untuk memisahkan senyawa-senyawa yang masih menempel pada DNA. DNA akan lebih stabil dalam bentuk larutan maka dari itu DNA dilarutkan dalam MW (Molecular Water). Pemurnian DNA dari kontaminan RNA dilakukan menggunakan enzim RNAse yang berfungsi mendegradasi RNA sehingga dihasilkan DNA murni yang terbebas dari RNA dan siap untuk di analisis secara kualitatif dan kualitatif serta digunakan untuk proses PCR.
Hasil Analisis Kualitatif DNA Kunyit dan Temulawak
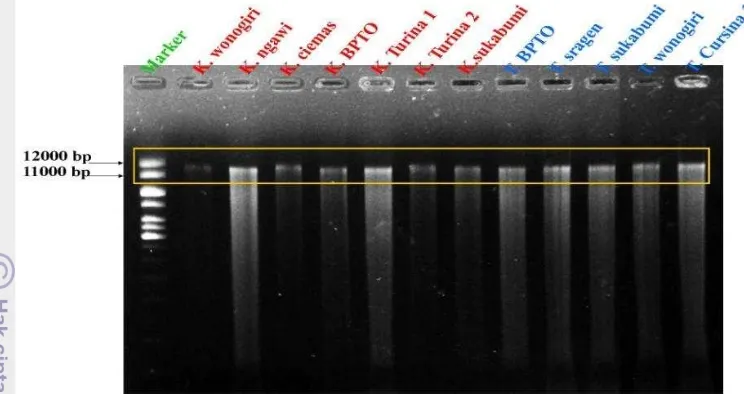
Hasil isolasi DNA tanaman kunyit dan temulawak dapat dilihat hasilnya dengan menggunakan dua parameter, yaitu analisis kualitatif dan analisis kuantitatif. Elektroforegram DNA hasil analisis kualitatif tanaman kunyit dan temulawak menggunakan elektroforesis dapat dilihat pada Gambar 5.
9
Gambar 5 Elektroforegram hasil kualitatif DNA kunyit dan temulawak DNA yang diisolasi dari tumbuhan
seringkali terkontaminasi oleh polisakarida dan metabolit sekunder. Pita-pita DNA pada gambar juga menunjukkan pita DNA tidak dapat terlihat dengan jelas atau smear. Kemungkinan masih terdapat kontaminan seperti polisakarida, protein, atau metabolit sekunder belum hilang pada hasil isolasi DNA tanaman kunyit dan temulawak. Menurut Khanuja et al. (1999) tumbuhan memiliki mengandung komponen bioaktif atau metabolit sekunder dalam jumlah besar yang dapat mempengaruhi kualitas hasil isolasi DNA suatu tumbuhan.
Hasil Analisis Kuantitatif DNA Kunyit dan Temulawak
Analisis kuantitatif dilakukan menggunakan spektrofotometer UV-VIS dengan mengukur absorban pada panjang gelombang ( ) 230 nm, 260 nm dan 280 nm. Nilai absorbansi didapatkan dari hasil serapan sinar UV oleh nukleosida, nukleotida, dan polinukleotida karena adanya ikatan rangkap terkonjugasi pada basa heterosiklik purin dan pirimidin (Murray et al. 2003).
Hasil analisis kuantitatif didapatkan dengan membandingkan absorbansi pada panjang gelombang 260 nm terhadap panjang gelombang 230 dan 280 nm. Perbandingan absorbansi panjang gelombang 260/280 nm atau rasio F1 menunjukkan tingkat kemurnian
terhadap kontaminan protein. Perbandingan absorbansi 260/230 nm atau rasio F2
menunjukkan tingkat kemurnian terhadap polisakarida. Nilai rasio kemurnian yang baik berkisar pada 1.8-2.0 (Sambrook 1989).
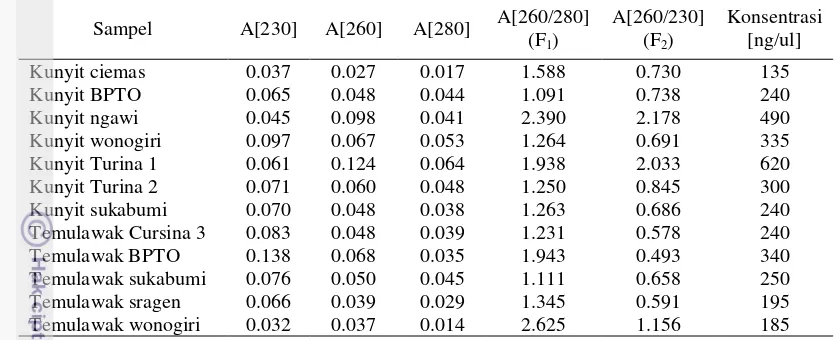
Nilai rasio F1 dari 7 sampel kunyit berada
pada rentang nilai 1.091-2.390 dengan kunyit
T1 yang memiliki nilai rasio F1 terbaik yaitu
1.938. Nilai rasio F2 dari dari ke-7 sampel
kunyit berada pada rentang nilai 0.686-2.178. Sementara pada ke-6 sampel temulawak nilai rasio F1 berada pada rentang nilai 1.111-2.625
dengan temulawak BPTO memiliki nilai rasio F1 terbaik yaitu 1.943. Nilai rasio F2 dari 6
sampel temulawak berada pada rentang nilai 0.578-1.156 yang dapat dilihat pada lampiran 3. Adanya sampel DNA yang memiliki konsentrasi belum murni dapat disebabkan kerusakan DNA akibat endonuklease, tingginya kandungan polisakarida sehingga meningkatkan viskositas hasil isolasi, komponen inhibitor seperti polifenol dan metabolit sekunder lain yang secara langsung atau tidak langsung menghambat reaksi enzim (Weishing et al. 1995).
Selain tingkat kemurnian, konsentrasi juga menjadi parameter penting dari segi kuantitatif. Secara kuantitatif konsentrasi DNA dapat dilihat dengan mengukur rasio absorbansinya pada panjang gelombang 260 nm dengan spektrofotometer UV-VIS. Konsentrasi DNA dihitung dengan pengukuran bahwa pada panjang gelombang 260 nm, nilai 1 unit absorban sebanding
dengan 50 g/ml DNA (Brown 2003; Walker & Wilson 2000). Sehingga konsentrasi DNA bisa didapat melalui pengalian nilai absorban pada panjang gelombang 260 nm dengan
faktor pengenceran dan 50 g/ml (Sambrook
10
Tabel 2. Hasil analisis kuantitatif DNA tanaman kunyit dan temulawak dengan spektrofotometer Sampel A[230] A[260] A[280] A[260/280]
(F1)
A[260/230] (F2)
Konsentrasi [ng/ul] Kunyit ciemas 0.037 0.027 0.017 1.588 0.730 135 Kunyit BPTO 0.065 0.048 0.044 1.091 0.738 240 Kunyit ngawi 0.045 0.098 0.041 2.390 2.178 490 Kunyit wonogiri 0.097 0.067 0.053 1.264 0.691 335 Kunyit Turina 1 0.061 0.124 0.064 1.938 2.033 620 Kunyit Turina 2 0.071 0.060 0.048 1.250 0.845 300 Kunyit sukabumi 0.070 0.048 0.038 1.263 0.686 240 Temulawak Cursina 3 0.083 0.048 0.039 1.231 0.578 240 Temulawak BPTO 0.138 0.068 0.035 1.943 0.493 340 Temulawak sukabumi 0.076 0.050 0.045 1.111 0.658 250 Temulawak sragen 0.066 0.039 0.029 1.345 0.591 195 Temulawak wonogiri 0.032 0.037 0.014 2.625 1.156 185
Amplifikasi DNA kunyit dan Temulawak dengan Primer Acak OPA-OPD 6-10
Setelah diketahui konsentrasi DNA dari ke-12 sampel kunyit dan temulawak selanjutnya dilakukan proses ampifikasi DNA dengan proses RAPD-PCR. Konsentrasi DNA hasil isolasi yang memiliki rentang 135-620 ng/ µL sudah cukup untuk melaksanakan proses amplifikasi karena DNA yang digunakan pada proses PCR RAPD sebesar 50 ng/µL sehingga perlu dilakukan pengenceran. Demeke dan Adams (1994) menyatakan bahwa salah satu kelebihan teknik RAPD yakni jumlah DNA yang dibutuhkan rendah sekitar 0.5-50 ng. Kelebihan teknik RAPD lainnya adalah tingkat kemurnian DNA yang dibutuhkan tidak perlu terlalu tinggi atau dengan kata lain teknik RAPD toleran terhadap tingkat kemurnian DNA (Prana & Hartati 2003). Sehingga dengan tingkat kemurnian DNA dari ke-12 sampel yang berada pada rentang nilai 1.091-2.625 dapat dikatakan sudah cukup untuk proses amplifikasi.
Faktor-faktor lain yang berpengaruh pada proses amplifikasi selain konsentrasi dan kemurnian DNA sampel adalah ukuran panjang primer, komposisi basa primer, konsentrasi ion Mg2+ dan suhu hibridisasi. Suhu hibridisasi primer harus dikontrol dengan hati-hati agar dapat diperoleh pita-pita DNA yang utuh dan baik (Suryanto 2003).
Primer yang digunakan pada penelitian ini adalah 20 primer acak OPA-OPD 6-10 yang memiliki panjang 10 basa dengan urutan basa yang berbeda-beda. Jumlah fragmen tampak yang dihasilkan dari proses PCR menggunakan 20 primer acak OPA-OPD 6-10 pada 12 sampel DNA tanaman kunyit dan temulawak 259 pita DNA. Primer OPB 8 menghasilkan pita DNA terbanyak yaitu 28 pita pada semua sampel (Lampiran 2).
Dari ke-12 sampel, hanya 8 sampel (kunyit ciemas, kunyit BPTO, kunyit Turina 2, kunyit wonogiri, temulawak Cursina 3, temulawak sragen, temulawak BPTO, dan temulawak sukabumi) yang dapat teramplifikasi dengan primer acak OPA-OPD 6-10. Sedangkan 4 sampel (kunyit ngawi, kunyit sukabumi, kunyit Turina 1, dan temulawak wonogiri) tidak teramplifikasi (Lampiran 7).
Sampel yang tidak teramplifikasi dengan primer yang digunakan dapat disebabkan oleh beberapa hal seperti ketidaksesuaian primer, efisiensi, dan optimasi proses PCR. Primer yang tidak spesifik atau sesuai dapat menyebabkan teramplifikasinya daerah lain dalam genom yang tidak dijadikan sasaran atau sebaliknya tidak ada daerah genom yang teramplifikasi (Suryanto 2003).
Analisis Pola Sidik Jari DNA Kunyit dan Temulawak
11
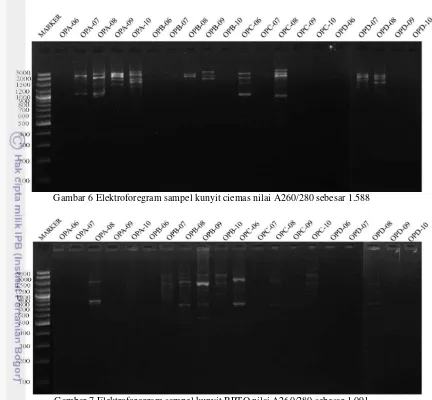
Gambar 6 Elektroforegram sampel kunyit ciemas nilai A260/280 sebesar 1.588
Gambar 7 Elektroforegram sampel kunyit BPTO nilai A260/280 sebesar 1.091 Perbedaan kualitas pola sidik jari selain
dilihat dari jumlah pita yang dihasilkan juga dapat dilihat berdasarkan resolusi fragmen DNA yang diamplifikasi. Pita DNA yang terbentuk pada sampel kunyit ciemas tampak lebih jelas dibandingkan dengan kunyit BPTO walaupun pada kunyit BPTO menghasilkan jumlah pita DNA yang lebih banyak dibandingkan kunyit ciemas. Sampel temulawak juga demikian, temulawak sragen menghasilkan pola pita DNA yang tampak lebih jelas dibandingkan temulawak sukabumi. Perbedaan antara kunyit ciemas dan kunyit BPTO begitu pula temulawak sragen dan temulawak sukabumi adalah kemurnian DNA rasio 260/280. Kunyit ciemas memiliki kemurnian yang lebih tinggi sebesar 1.588 dibandingkan kunyit BPTO sebesar 1.091. Temulawak sragen juga memiliki tingkat kemurnian yang lebih baik sebesar 1.345 sedangkan temulawak sukabumi sebesar 1.111. Walaupun menurut Prana & Hartati (2003), teknik RAPD tidak
memerlukan tingkat kemurnian DNA tidak perlu terlalu tinggi tetapi tampak berpengaruh terhadap resolusi fragmen pola pita DNA sehingga tampak lebih jelas.
Variasi pola sidik jari DNA tanaman kunyit dan temulawak dengan primer OPA-OPB 6-10 yang dilihat pada elektroforegram semua sampel (lampiran 7) menunjukkan tingkat polimorfisme tanaman kunyit dan temulawak asal Indonesia cukup tinggi. Hasil analisis pola sidik jari DNA kunyit dan temulawak menggunakan primer OPA-OPD 6-10 menunjukkan tingkat polimorfisme dari 12 sampel tanaman kunyit dan temulawak asal Indonesia mencapai 100% atau dengan kata lain tidak ada yang identik diantara sampel tanaman kunyit dan temulawak pada tingkat molekular.
12
polimorfisme sebesar 96.84% dari 20 sampel
Curcuma longa asal pakistan dan penelitian Zou et al. (2011) tingkat polimorfisme dari 33 sampel Curcuma asal Cina sebesar 92.17%.
Analisis Hubungan Kekerabatan Genetik Kunyit dan Temulawak
Analisis hubungan kekerabatan genetik antar tanaman dapat ditentukan berdasarkan kemiripan genetik antar individu. Kekerabatan genetik diantara sampel tanaman kunyit dan temulawak dilakukan dengan analisis gerombol (cluster analysis) dalam bentuk dendogram yang pengelompokannya berdasarkan metode pemasangan kelompok aritmatika tidak berbobot (Unweighted Pair Grouping Method with Aritmatic Averaging, UPGMA) dengan perangkat lunak NTSYSpc versi 2.0.2.
Analisis kekerabatan genetik tanaman kunyit dan temulawak dilakukan dengan merubah pita-pita hasil elektroforesis pada gel agarosa menjadi data biner. Setiap pita mewakili satu karakter dan diberi nilai berdasarkan ada tidaknya suatu pita. Angka
satu “1” menunjukan pita yang terbentuk dan
angka nol “0” menunjukan pita yang tidak
terbentuk. Hasil analisis dengan UPGMA menghasilkan dendogram atau pohon filogenetik untuk kelompok tanaman kunyit dan temulawak.
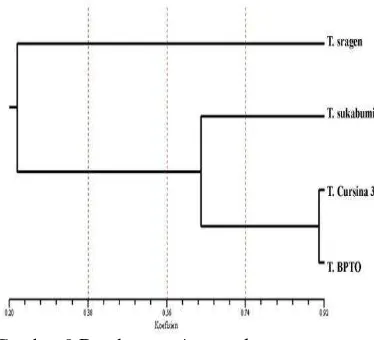
Dendogram atau pohon filogenetik tanaman kunyit pada Gambar 8 menunjukkan nilai koefisien antar tiap sampel. Pohon filogenetik tanaman kunyit memiliki nilai koefisien jarak genetik diantara 0.3033-0.6721 Nilai koefisien menunjukkan angka kedekatan antar tiap sampel. Kemiripan genetik tertinggi terjadi pada sampel kunyit wonogiri dan kunyit BPTO yang memiliki nilai koefisien sebesar 0.6721 (Lampiran 5).
Gambar 8 Dendogram 4 sampel tanaman kunyit
Pohon filogenetik tanaman temulawak (Gambar 9) memiliki nilai koefisien jarak genetik diantara 0.1939-0.9082. Kemiripan genetik tertinggi terjadi pada sampel temulawak BPTO dan temulawak Cursina 3 yang memiliki nilai koefisien sebesar 0.9082. Sedangkan temulawak sragen dengan temulawak sukabumi memiliki kemiripan genetik terendah dengan nilai koefisien sebesar 0.2178 (Lampiran 6).
Gambar 9 Dendogram 4 sampel tanaman temulawak
Analisis kemiripan genetik menunjukkan nilai koefisien kemiripan genetik sebesar 0.3033-0.6721 untuk tanaman kunyit. Nilai koefisien keragaman genetik tanaman temulawak sebesar 0.1939-0.9082. Semakin tinggi nilai koefisien keragaman genetik maka semakin tinggi kemiripan genetik antar spesies tersebut.
SIMPULAN DAN SARAN
Simpulan
Hasil analisis pola pita sidik jari DNA tanaman kunyit dan temulawak menunjukkan 259 pita DNA yang terbentuk seluruhnya polimorfisme (100% polimorfisme). Analisis pohon filogenetik menunjukkan nilai koefisien kemiripan genetik sebesar 0.3033-0.6721 untuk tanaman kunyit dan 0.1939-0.9082 untuk tanaman temulawak. Nilai polimorfisme dan koefisien keragaman genetik yang didapat pada tanaman kunyit dan temulawak asal Indonesia menunjukkan tingkat keragaman genetik yang tinggi.
Saran
13
itu, dapat dilakukan pengujian menggunakan marka molekular yang lebih spesifik seperti RFLP, AFLP, atau SSR.
DAFTAR PUSTAKA
Aseidu, RN, Ter kuile, and A.Mujeeb-Kazi. 1989. Diagnostic Marker in Wheat Wide Crosses, P. In A. Mujeeb-kazi and L.a. Sitch (eds). CYMMIT, Mexico. Review Advances in Plant Biotechnology International Symposium on Genetic Manipulation in Crops
Ausubel FM et al. 1990. Current Protocols in Molecular Biology. Kanada: John Willey&Sons.
Azrai M. 2005. Pemanfaatan Markah Molekuler Dalam Proses Seleksi Pemuliaan Tanaman. J AgroBiogen
1:26-37.
Bintang M. 2010. Teknik Penelitian Biokimia. Jakarta: Erlangga.
Brown TA. 2003. Pengantar Kloning Gen. Muhammad SA, penerjemah. Terjemahan dari: Gene Cloning an Introduction. Yogyakarta: Yayasan Essentia Medika. Castillo et al. 1994. Detection of Genetics
Diversity and Selective Gene Introgression in Coffee Using RAPD Markers. Theor.Appl Genet 87:934 – 940 Craig WJ. 1999. Health-Promoting Properties of Common Herbs. Am. J. Clin. Nutr. , 70 (suppl): 491s-9s.
Cruz M, Ramirez F, Hernandez H. 1997. DNA isolation and amplification from cacti. Plant Molecular Biology Report
(15): 319-325.
Dalimartha, S. 2007. Atlas Tumbuhan Obat Indonesia. Jakarta: Trubus Agriwidya. Darusman, LK, BP Priosoeryanto, M.
Hasanah, M. Rahardjo dan ED Purwakusumah. 2007. Potensi temulawak terstandar untuk menanggulangi flu burung. Bogor: Balitbang Pertanian. Demeke T, Adams RP. 1994. The use of
PCR-RAPD analysis in plant taxonomy and evolution. London: CRC Press.
Dwiamini K., NA Mattjik, H. Aswidinoor, NIT Matius. 2003. Analisis Pengelompokan da Hubungan Kekerabatan Spesies Anggrek
Phalaenopsis Berdasarkan Kunci
Determinasi Fenotifik dan Marka Molekuler RAPD. J Hort. 13:16-27. Edy L. 2008. Keragaman Genetika Plasma
Nutfah Pisang (Musa sp.) di Kabupaten Minahasa Selatan dan Minahasa Tenggara.
J FORMAS 1:302-310.
Hwang JK. 2006. Xanthorrizol; A New Bioactive Natural Compound. Yonsei: Departement of Biotechnology, Yonsei University.
Jan et al. 2011. Assessment of genetic diversity of indigenous turmeric (Curcuma longa L.) germplasm from Pakistan using RAPD markers. J of Medicinal Plant Research Vol 5:823-830.
Kephart D. 1999. Rapid Isolation of genomic DNA from small quantities of human tissue[terhubung berkala]. http://www.promega.com/profiles/203/Pro filesinDNA_203_07.pdf. [28 Januari 2012]
Khanuja SPS, Shasany AK, Darokar MP, Kumar S. 1999. Rapid isolation of DNA from dry and fresh samples of plants producing large amounts of secondary metabolites and essential oil. J Plant Molecular Biology Reporter 17:1-7. Masuda T, Isobe J, Jitoe A, Nakatani N. 1992.
Antioxidative curcuminoids from rhizomes of Curcuma xanthorriza. J Phytochemistry 13:3645-3647.
Mathius et al. 2001. Analisis abnormalitas tanaman kelapa sawit (Eleais guineensis
Jacq) hasil kultur jarigan dengan teknik
Random Amplified Polymorphic DNA
(RAPD). J Menara Perkebunan. 69:58-70 Melchinger, AE. 1990. Use Molecular Marker Inbreeding for Oligogenic Disease Resistance. J Plant Breed 104:1-19 Murray MG, Thompson WF. 1980. Rapid
isolation of high molecular weight plant DNA. J Nucl Acids Res. 8:4321–4325. Murray RK, Granner DK, Mayes PA, Rodwell
VW. 2003. Biokimia Harper. Edisi ke-27. Jakarta : Penerbit Buku Kedokteran EGC Muslim A. 2009. Isolasi Propotoplasma pada
Kultur Jaringan[artikel ilmiah]. SITH. ITB Nagabushan M, SV Bhide. 1992. Curcumin as an inhibitor of cancer. J. Am. Clin. Nutr
14
Pandey, RN, RP Adam, LE Flournoy. 1998. Inhibition of Random Amplified Polymorphic DNAs (RAPDs) by Plant Polysaccarides. Plant Molec. Biol. Reporter 14:15-22.
Poerba YS, Yuzammi. 2008. Pendugaan Keragaman Genetik Amorphophallus titanum Becc. Berdasarkan Marka Random Amplified Polymorphic DNA. J Biodiversitas 9:103-107.
Prana TK, Hartati NS. 2003. Identifikasi Sidik Jari DNA Talas (Colocasia esculante L. Schott) Indonesia dengan Teknik RAPD. J Natur Indonesia 5:107-112.
Rukayadi Y, D.Yong, JK Hwang. 2006. In vitro anticandidal activity of xanthorrhizol isolated from Curcuma xanthorriza Roxb.
J. Antimicrobial Chemotherapy 57:1231-1234.
Rukmana R. 1995. Temulawak, Tanaman Rempah dan Obat. Yogyakarta: Kanisius. Rogers SO, AJ Bendich. 1994. Extraction of
total celullar DNA from plants, algae, and fungi. In S.B. Gelvin & R.A. Schilperoort (Eds.). Plant Molecular Biology Manual Second Edition. Section D1.
Rohlf FJ. 1993. NTSYS – PC Numerical Taxonomy and Multivariate Analysis System. New York : Exeter Software. Sambrook J, Fritsch EF, Manuatis T. 1989.
Moleculer Cloning : A Laboratory Manual. New York : Harbour Lab press Sambrook J, Russel DW. 2001. Ed. Molecular
Cloning: A Laboratory Manual 3rd Ed. New York: Cold Spring Harbor Laboratory Press.
Sarah et al. 2008. Tobacco Economics in Indonesia.Paris: International Union Against Tubercolosis and Lung Disease. Shahzadi I, Ahmed R, Hassan A, Shah MM.
2010. Optimization of DNA extraction from seeds and fresh leaf tissues of wild marigold (Tagetes minuta) for polymerase chain reaction analysis. Genetic and Molecular Research 9:386-393.
Sudarsono et al. . 1996. Kunyit (Curcuma longa Linn.). Yogyakarta: PPOT UGM. Sudjadi. 2008. Bioteknologi Kesehatan.
Yogyakarta: Kanisius.
Sukartini. 2008. Analisis Jarak Genetik dan Kekerabatan Aksesi-aksesi Pisang
berdasarkan Primer Random Amplified Polymorphic DNA. J. Hort. 18:261-266. Sunandar D dan Imron. 2010. Optimalisasi
template DNA genom udang galah,
Macrobrachium rosenbergii dalam proses PCR RAPD. Prodising forum inovasi teknologi akuakultur. 561-565.
Surahman M, Muhamad S, Toding T. 2007.
Perakitan Varietas Semangka (Citrullus lanatus (Thunberg) Matsum & Nakai) Tanpa biji Tahan Terhadap Penyakit Layu Fusarium dengan Memanfaatkan Marka RAPD [laporan penelitian hibah bersaing]. Bogor : Institut Pertanian Bogor.
Suryanto D. 2003. Melihat keanekargaman organisme melalui beberapa teknik genetika molekular. USU Digital Library
[terhubung berkala]. http://www.library.usu.ac.id/modules.php [25 Juli 2012].
Syukur, Cheppy. 2010. Turina, Varietas Unggul Kunyit Kurkumin Tinggi. J Sinar Tani Edisi 3-9 November 2010.
Taryono EM, S Rahmat, A Sardina. 1987. Plasma Nutfah Tanaman Temu-temuan. J Edisi Khusus Balittro. 3:47-56.
Triastanto OF, M Jusuf, & D Santoso. Identifikasi homolog TcAGL-15 untuk penanda embriogenesis tanaman kakao melalui pendekatan bioinformatika. J. Menara Perkebunan 74: 53-62.
Yasni S et al. 1994. Identification of an active principle in essetial oils and hexane-soluble fraction of Curcuma xanthorrhiza
Roxb. Showing triglyceride lowering action in rats. J Food Chem Toxicol
15
16
Lampiran 1 Strategi Penelitian
Pengambilan
contoh
Sampel daun dari
setiap tanaman
diambil minimal
2 helai daun
Analisis Molekular
- Isolasi DNA
- Pemurnian DNA
- Analisis kualitatif
dan kuantitatif DNA
- Amplifikasi DNA
dengan marka RAPD
- Elektroforesis gel
agarosa
Analisis Data
Molekular
- skoring pita
DNA berdasarkan
penampilan pita
DNA
17
Lampiran 2 Daftar urutan basa primer yang digunakan dalam penelitian
(AITbiotech 2011)
Primer Urutan Basa Jumlah Pita Tampak Pita polimorfik OPA-06 5‟GGTCCCTGAG‟3 12 12 OPA-07 5„GAAACGGGTG‟3 22 22 OPA-08 5„GTGACGTAGG‟3 20 20 OPA-09 5„GGGTAACGCC‟3 18 18 OPA-10 5„GTGATCGCAG‟3 16 16
OPB-06 5„TGCTCTGCGC‟3 8 8
OPB-07 5„GGTGACGCAG‟3 12 12 OPB-08 5„GTCACAACGG‟3 28 28 OPB-09 5„TGGGGGACTC‟3 14 14
OPB-10 5„CTGCTGGGAC‟3 6 6
OPC-06 5„GAACGGACTC‟3 20 20
OPC-07 5„GTCCCGACGA‟3 4 4
OPC-08 5„TGGACCGGTG‟3 24 24 OPC-09 5„CTCACCGTCC‟3 10 10
OPC-10 5„TGTCTGGGTG‟3 1 1
OPD-06 5„ACCTGAACGC‟3 0 0
OPD-07 5„TTGGCACGGG‟3 9 9
OPD-08 5„GTGTGCCCCA‟3 21 21 OPD-09 5„CTCTGGAGAC‟3 11 11
OPD-10 5„GGTCTACACC‟3 3 3
18
Lampiran 3 Hasil analisis kuantitatif DNA dengan spektrofotometer
Sampel A[230] A[260] A[280] A[260/280] A[260/230] Konsentrasi [ng/ul] Kunyit ciemas 0.037 0.027 0.017 1.588 0.730 135 Kunyit BPTO 0.065 0.048 0.044 1.091 0.738 240 Kunyit ngawi 0.045 0.098 0.041 2.390 2.178 490 Kunyit wonogiri 0.097 0.067 0.053 1.264 0.691 335 Kunyit T1 0.061 0.124 0.064 1.938 2.033 620 Kunyit T2 0.071 0.060 0.048 1.250 0.845 300 Kunyit sukabumi 0.070 0.048 0.038 1.263 0.686 240 Temulawak C3 0.083 0.048 0.039 1.231 0.578 240 Temulawak BPTO 0.138 0.068 0.035 1.943 0.493 340 Temulawak sukabumi 0.076 0.050 0.045 1.111 0.658 250 Temulawak sragen 0.066 0.039 0.029 1.345 0.591 195 Temulawak wonogiri 0.032 0.037 0.014 2.625 1.156 185
Contoh perhitungan [DNA]:
Fp (Faktor pengenceran) = 100 kali
[DNA]sampel 1 = A260 x Fp x 50 ng/µ L
= 0.027 x 100 x 50 ng/µL
= 135 ng/µ L
A260
: Pengukuran absorbansi DNAA260 / A280
: Pengukuran perbandingan pada panjang gelombang 280 nm
dilakukan untuk mengetahui adanya kontaminasi protein.
A260 / A230
: Pengukuran perbandingan pada panjang gelombang 230 nm
19
Lampiran 4 Jumlah pita DNA tampak tiap sampel hasil amplifikasi PCR-RAPD menggunakan primer OPA-OPD 6-10
Primer Sampel O P A -06 O P A -07 O P A -08 O P A -09 O P A -10 O P B -06 O P B -07 O P B -08 O P B -09 O P B -10 O P C -06 O P C -07 O P C -08 O P C -09 O P C -10 O P D -06 O P D -07 O P D -08 O P D -09 O P D -10 Total
Jumlah pita tampak
20
Lampiran 5 Dendogram dan koefisien kemiripan genetik antara 4 sampel tanaman
kunyit berdasarkan proporsi fragmen yang dimiliki bersama
Sampel Kunyit ciemas Kunyit wonogiri Kunyit Turina 2 Kunyit BPTO Kunyit ciemas 1.0000
Kunyit wonogiri 0.5492 1.0000
Kunyit Turina 2 0.3443 0.6148 1.0000
21
Lampiran 6 Dendogram dan koefisien kemiripan genetik 4 sampel temulawak
berdasarkan proporsi fragmen yang dimiliki
Sampel Temulawak sragen
Temulawak sukabumi
Temulawak Cursina 3
Temulawak BPTO Temulawak sragen 1.0000
Temulawak sukabumi 0.1939 1.0000
Temulawak Cursina 3 0.2245 0.6224 1.0000
22
Lampiran 7 Elektroforegram hasil RAPD-PCR tanaman kunyit dan temulawak dengan primer OPA-OPD 6-10
Kunyit ciemas
Kunyit wonogiri
23
Lanjutan lampiran 7
Kunyit Turina 1
Kunyit Turina 2
24
Lanjutan lampiran 7
Temulawak BPTO
Temulawak sukabumi