ABSTRACT
EFFECT VARIOUS LEVELS OF FRACTION NONI LEAF EXTRACT (Morinda citrifolia L) AGAINST GROWTH Colletotrichum capsici CAUSE OF ANTHRACNOSE DISEASE ON CHILI PEPPER (Capsicum annum L)
BY IN VITRO
By
SEPTYA EKA PRASETIA RANI
Anthracnose caused by Colletotrichum capsici was a major disease to chili pepper plant (Capsicum annum L) in Indonesia. Generally is anthracnose was a serious problem in chili pepper growy area because it could destroy the entire of crop. Much higher losses occur in endemic areas, especially in the wet areas during the rainy season. One of alternative controls used is noni leaf extract which has a potential as biofungicide that effective to control plant pathogens. Chemical substances of noni had the effect of antifungal and antibiotics, namely scopoletin as an anti-fungal and antraquinon that against bacterial and fungal infections. The objective of this research was to determine the effect of various levels of fraction extract of leaf Morinda citrifolia L to the in vitro growth of C. capsici. The result showed that noni leaf extract which dissolved in concentration alcohol 10%, 30%, 50%, 60%, 70%, 90% and noni leaf extract which dissolved in aquades gave the best effect to inhibitory diameter of colony. Aside from inhibit the growth of vegetative, nonni leaft extract also inhibits spore formation
(sporulation) colonies C. capsici which is dissolved in alcohol concentration 10% and 30%.
ABSTRAK
PENGARUH BERBAGAI TINGKAT FRAKSI EKSTRAK DAUN MENGKUDU (Morinda citrifolia L) TERHADAP PERTUMBUHAN Colletotrichum capsici PENYEBAB PENYAKIT ANTRAKNOSA PADA
CABAI (Capsicum annum L) SECARA IN VITRO
Oleh
SEPTYA EKA PRASETIA RANI
Penyakit antraknosa yang disebabkan oleh Colletotrichum capsici merupakan penyakit penting pada tanaman cabai (Capsicum annum L) di Indonesia. Secara umum penyakit antraknosa sangat ditakuti karena dapat menghancurkan seluruh pertanaman. Kerugian jauh lebih tinggi terjadi di daerah endemis, terutama di daerah basah pada musim hujan. Salah satu alternatif pengendalian yang yang mulai dikembangkan saat ini adalah penggunaan ekstrak daun mengkudu
memiliki potensi sebagai biofungisida yang efektif untuk mengendalikan patogen tumbuhan. Kandungan zat kimia yang mempunyai efek antifungi dan antibiotik, yaitu scopoletin sebagai anti jamur dan antraquinon untuk melawan infeksi bakteri dan jamur.
Penelitian ini bertujuan untuk mempelajari pengaruh berbagai fraksi ekstrak daun mengkudu terhadap pertumbuhan Colletotrichum capsici penyebab penyakit antraknosa pada cabai secara in vitro.
Hasil analisis data menunjukkan bahwa perlakuan ekstrak daun mengkudu yang terlarut dalam alkohol konsentrasi 10%, 30%, 50%, 60%, 70%, 90% dan ekstrak daun mengkudu yang terlarut dalam aquades efektif menghambat pertumbuhan diameter pada koloni C. capsici. Selain menghambat pertumbuhan vegetatif, fraksi ekstrak daun mengkudu juga menghambat pembentukan spora (sporulasi) koloni C. capsici yaitu ekstrak daun mengkudu yang terlarut dalam alkohol konsentrasi 10% dan 30%.
PENGARUH BERBAGAI TINGKAT FRAKSI EKSTRAK DAUN MENGKUDU (Morinda citrifolia L) TERHADAP PERTUMBUHAN Colletotrichum capsici PENYEBAB PENYAKIT ANTRAKNOSA PADA CABAI (Capsicum annum L) SECARA IN VITRO
(Skripsi)
Oleh
SEPTYA EKA PRASETIA RANI
DAFTAR GAMBAR
Gambar Halaman
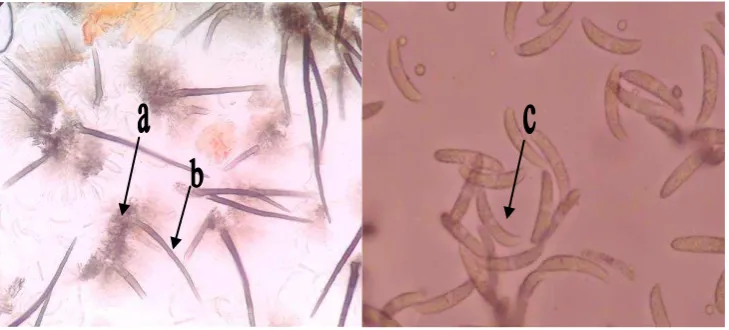
1. (a) Aservulus (b) seta (c) konidia jamur Colletotrichum capsici ...…….. 8
2. Alat yang digunakan untuk mengekstrak daun mengkudu (A= bagian paralon yang berisi daun mengkudu yang telah dihaluskan, B= kain kasa, C= bagian paralon yang berisi arangaktif, D= hasil ekstraksi).…... 14
3. Pertumbuhan koloni C. capsici 2 hari setelah infestasi... ... 49
4. Pertumbuhan koloni C. capsici 3 hari setelah infestasi... ... 50
5. Pertumbuhan koloni C. capsici 4 hari setelah infestasi... ... 51
6. Pertumbuhan koloni C. capsici 5 hari setelah infestasi... ... 52
7. Pertumbuhan koloni C. capsici 6 hari setelah infestasi... ... 53
8. Pertumbuhan koloni C. capsici 7 hari setelah infestasi... ... 54
DAFTAR ISI
Halaman
DAFTAR TABEL ... ..iii
DAFTAR GAMBAR ... vii
I. PENDAHULUAN 1.1 Latar Belakang dan Masalah ... 1
1.2Tujuan ... ..4
1.3Kerangka Pemikiran ... ..4
1.4Hipotesis... ..5
II. TINJAUAN PUSTAKA 2.1. Tanaman Cabai ... .6
2.2. Penyakit Antraknosa ... 7
2.3. Tanaman Mengkudu ... 8
2.4. Pemanfaatan Tanaman Mengkudu Sebagai Pestisida Nabati ... 10
3. BAHAN DAN METODE 3.1.Tempat dan Waktu ... 12
3.2.Alat dan Bahan ... 12
3.3.Rancangan Percobaan ... 12
3.4.Pelaksanaan Penelitian ... 13
3.4.1. Penyiapan Isolat C. capsici ... 13
ii
3.4.3.Penyiapan Media Tumbuh Jamur C. Capsici untuk Perlakuan Pengujian. ... 15 3.4.4.Uji Penghambatan Tumbuhan Colletotrichum capsici ... 15 3.4.5.Pengamatan dan Penghitungan Jumlah Spora ... 16
4. HASIL DAN PEMBAHASAN
4.1.Pengaruh Ekstrak Daun Mengkudu Terhadap Pertumbuhan Diameter C. capsici ... 18
4.2.Pengaruh Ekstrak DaunMengkudu Terhadap JumlahSpora ... 21
V. SIMPULAN DAN SARAN
5.1Simpulan ... .23 5.2 Saran ... 23
iii
DAFTAR TABEL
Tabel Halaman
1. Pertumbuhan (diameter koloni) C. capsici yang diperlakukan ekstrak daun mengkudu pada media PDA
………... 19
2. Persentase penghambatan ekstrak daun mengkudu terhadap C. capsici.. 20
3. Jumlah Spora per ml pada 11 hsi………... 22
4. Diameter koloni C. capsici (cm) pada hari kedua setelah infestasi (hsi) 27 5. Analisis ragam diameter koloni C. Capsici pada hari kedua setelah
infestasi (hsi)………... 27
6. Diameter koloni C. capsici (cm) pada hari ketiga setelah infestasi (hsi) 28 7. Analisis ragam diameter koloni C. capsici pada hari ketiga setelah
infestasi (hsi)………... 28
8. Diameter koloni C. capsici (cm) pada hari keempat setelah infestasi (hsi) 29 9. Analisis ragam diameter koloni C. capsici pada hari keempat setelah
infestasi (hsi)……….. 29
10.Diameter koloni C. capsici (cm) pada hari kelima setelah infestasi (hsi) 30
11.Analisis ragam diameter koloni C. capsici pada hari kelima setelah
iv
Tabel Halaman
12.Diameter koloni C. capsici (cm) pada hari keenam setelah infestasi (hsi) 31
13.Analisis ragam diameter koloni C. capsici pada hari keenam setelah
infestasi (hsi)………... 31
14.Diameter koloni C. capsici (cm) pada hari ketujuh setelah infestasi (hsi) 32 15.Analisis ragam diameter koloni C. capsici pada hari ketujuh setelah
infestasi (hsi)………... 32
16.Diameter koloni C. capsici (cm) pada hari kedelapan setelah
infestasi (hsi)………... 33
17.Analisis ragam diameter koloni C. capsici pada hari kedelapan setelah infestasi (hsi)………... 33
18.Diameter koloni C. capsici (cm) pada hari kesembilan setelah
infestasi (hsi)………... 34
19.Analisis ragam diameter koloni C. capsici pada hari kesembilan setelah
infestasi (hsi)……….. 34
20.Diameter koloni C. capsici (cm) pada hari kesepuluh setelah
infestasi (hsi)………... 35
21.Analisis ragam diameter koloni C. capsici pada hari kesepuluh setelah
infestasi (hsi)………... 35
22.Diameter koloni C. capsici (cm) pada hari kesebelas setelah
infestasi (hsi)………... 36
23.Analisis ragam diameter koloni C. capsici pada hari kesebelas setelah
infestasi (hsi)………... 36
24.Persentase penghamabatan C. capsici (%) pada hari kedua setelah
v
Tabel Halaman
25.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
kedua setelah infestasi (hsi)………... 37
26.Persentase penghamabatan C. capsici (%) pada hari ketiga setelah
infestasi (hsi)………... 38
27.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
ketiga setelah infestasi (hsi)…... 38
28.Persentase penghamabatan C. capsici (%) pada hari keempat setelah
infestasi (hsi)………... 39
29.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
keempat setelah infestasi (hsi)……….... 39
30.Persentase penghamabatan C. capsici (%) pada hari kelima setelah
infestasi (hsi)………... 40
31.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
kelima setelah infestasi (hsi)………... 40
32.Persentase penghamabatan C. capsici (%) pada hari keenam setelah
infestasi (hsi)………... 41
33.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
keenam setelah infestasi (hsi)………... 41
34.Persentase penghamabatan C. capsici (%) pada hari ketujuh setelah
infestasi (hsi)………... 42
35.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
ketujuh setelah infestasi (hsi)……….………... 42
36.Persentase penghamabatan C. capsici (%) pada hari kedelapan setelah
infestasi (hsi)………... 43
37.Analisis ragam penghambatan pertumbuhan C. capsici pada hari
vi
Tabel Halaman
38.Persentase penghamabatan C. capsici (%) pada hari kesembilan setelah
infestasi (hsi)………... 44
39.Analisis ragam penghambatan pertumbuhan C. capsici pada hari kesembilan setelah infestasi (hsi)………... 44
40.Persentase penghamabatan C. capsici (%) pada hari kesepuluh setelah infestasi (hsi)………... 45
41.Analisis ragam penghambatan pertumbuhan C. capsici pada hari kesepuluh setelah infestasi (hsi)………... 45
42.Persentase penghamabatan C. capsici (%) pada hari kesebelas setelah infestasi (hsi)………... 46
43.Analisis ragam penghambatan pertumbuhan C. capsici pada hari kesebelas setelah infestasi (hsi)………. 46
44.Jumlah spora C. capsici dalam haemocytomete rpada volume 0,004 mm3pada 11 hsi……….……… 47
45.Jumlah spora C. capsici per ml pada 11 hsi……….…………... 47
46.Jumlah spora C. capsici per ml (106) pada 11 hsi………... . 48
vii
DAFTAR GAMBAR
Gambar Halaman
1. (a) Aservulus (b) seta (c) konidia jamur Colletotrichum capsici ...…….. 8
2. Alat yang digunakan untuk mengekstrak daun mengkudu (A= bagian paralon yang berisi daun mengkudu yang telah dihaluskan, B= kain kasa, C= bagian paralon yang berisi arangaktif, D= hasil ekstraksi).…... 14
3. Pertumbuhan diameter koloni C. capsici 2 hari setelah infestasi ... ... 49
4. Pertumbuhan diameter koloni C. capsici 3 hari setelah infestasi ... ... 50
5. Pertumbuhan diameter koloni C. capsici 4 hari setelah infestasi ... ... 51
6. Pertumbuhan diameter koloni C. capsici 5 hari setelah infestasi ... ... 52
7. Pertumbuhan diameter koloni C. capsici 6 hari setelah infestasi ... ... 53
8. Pertumbuhan diameter koloni C. capsici 7 hari setelah infestasi ... ... 54
“Sesungguhnya setelah kesulitan itu pasti ada
kemudahan
(Qs. Al-insyirah:6)
“
Jodoh terbaikmu adalah sebaik dirimu, nasib terbaikmu
adalah sebaik upayamu, kebaikanmu adalah untukmu,
dan keburukanmu adalah juga untukmu
.”
(Mario Teguh)
”
Ketika kau berada disuatu tempat, pasti akan terukir kisah
didalamnya”
Puji dan syukur kuhaturkan kehadirat Allah SWT
Kupersembahkan karya ilmiah ini kepada :
Ayah, ibu serta keluarga tercinta.
Orang-orang yang selalu mendoakan kebaikan kepadaku.
Bapak ibu guru, dosen, para pendidik dan pengabdi dalam
bidang ilmu pengetahuan.
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Jaya, Lampung Tengah pada tanggal 04 September 1989, sebagai anak pertama dari empat bersaudara dari pasangan Bapak Joko Siswanto dan Ibu Sriyatun.
Penulis menyelesaikan pendidikan Sekolah Dasar AN-NUR Bandar Jaya pada Tahun 2001, Sekolah Menengah Pertama (SMP) Negeri 03 Terbanggi Besar pada Tahun 2004 dan Sekolah Menengah Atas (SMA) Negeri 01 Terbanggi Besar pada Tahun 2007. Lalu pada tahun 2007, penulis diterima menjadi Mahasiswa Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung melalui jalur
Penelusuran Kemampuan Akademik dan Bakat (PKAB) dan pada tahun 2008 penulis menjadi Mahasiswa Agroekoteknologi disebabkan karena adanya
SANWACANA
Alhamdulillahi rabbi’alamin, puji syukur penulis panjatkan kehadirat Allah SWT,
yang telah melimpahkan taufik, hidayah, serta rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Pada kesempatan ini penulis ingin
mengucapkan terimakasih kepada semua pihak yang telah membantu dalam pelaksanaan penelitian dan penulisan skripsi ini, yaitu:
1. Ir. Efri, M.Si. selaku pembimbing utama dan Ir. Joko Prasetyo, M.P.sebagai pembimbing kedua yang telah mengizinkan terlibat dalam penelitiannya,dan terimakasih juga atas bimbingan, gagasan, ilmu, arahan dan nasihat yang bermanfaat kepada penulis dalam menyelesaikan skripsi ini.
2. Ir. Titik Nur Aeny, M.Sc.selaku pembahas yang telah memberikan arahan, kritik, saran dan nasihat yang bersifat membangun kepada penulis.
3. Bapak, Mamak, Om Muh, dan Adik-adik (Agung, Putri, dan Juana) atas kasih sayang, perhatian, kesabaran, semangat, serta doa yang yang tulus kepada penulis hingga selesainya skripsi ini.
4. Prof. Dr. Hasriadi Mat Akin, M.Sc. selaku pembimbing akademik yang telah memberikan nasihat, motivasi dan semangat kepada penulis.
5. Prof. Dr. Ir. Wan Abas Zakaria, M.S selaku Dekan Fakultas Pertanian Universitas Lampung.
7. Seluruh Dosen Agroteknologi bidang Ilmu Hama Penyakit Tumbuhan khususnya, yang telah memberikan ilmu dan pembelajaran selama penulis menimba ilmu di Universitas Lampung.
8. Rekan sepenelitian Alexander Turnip, Yantiningsih, Weni Septiana, dan Intan Rahayu Ningtyas atas bantuan yang diberikan selama penulis menjalankan penelitian.
9. Mbak Uum, Mas Iwan, dan Pak Paryadi atas bantuannya selama penulis menjadi mahasiswa.
10. Teman-teman angkatan 2007 (Riyut, Stenia, Yani, Riki, Resma, Selvi, Yanti, Yuli, Alwi, Furqon, Leo, Marjuki, Syukur, Badrus, Suparman, Suharyanto, Fajri, Jaya, Teddy, Yosua, Alex, Tere, Uus, Maria, Cici, Eka, Febriana, Juwita, Kristina, Lilis, Meri, Ovi, Juwita, Ovy ), serta teman-teman lain yang tidak bisa disebutkan satu persatu, terima kasih atas semua doa, bantuan semangat dan kebersamaan yang telah diberikan.
11. Teman-teman Ex-Handayani (Pita, Nuria, Lista dan Sapta) atas segala pengertian dan kebersamaannya.
12. Keluarga Besar UKM KSR PMI Unit Unila, atas kebersamaan dan ilmu yang tak ternilai harganya.
Akhirnya penulis mengucapkan terima kasih yang sedalam-dalamnya, semoga Allah SWT mencurahkan rahmat-Nya kepada kita. Semoga skripsi ini dapat berguna dan bermanfaat bagi kita semua. Aamiin.
Bandar Lampung, November 2012
DAFTAR PUSTAKA
Ahmad dan Suryana, I. 2009. Pengujian Aktivitas Ekstrak Daun Sirih (Piper betle Linn.) Secara In Vitro. IPB. Bogor. Buletin Littro. Vol 20 No 1, 92 – 98. Badan Pusat Statistik. 2011. Tabel Statistik Hortikultura. Diakses di
http://bps.go.id. Tanggal 26 Juni 2011..
Bangun, A.P dan B. Sarwono. 2002. Khasiat dan Buah Mengkudu. Agromedia Pustaka. Jakarta. 65.
BPTP Lampung. 2008. Teknologi Budidaya Cabai Merah. Balai Pengkaji Teknologi Pertanian. Bandar Lampung.
Departemen Pertanian, 2011. Basis Data Statistik Pertanian. Diakses di http://aplikasi.deptan.go.id.Tanggal 15 Juni 2011.
Djauhariya, E., Raharjo, M., dan Ma’un. 2006. Karakterisasi Morfologi dan Mutu Buah Mengkudu. Buletin Plasma Nutfah. 12(1) : 1-8.
Efri. 2010. Pengaruh Ekstrak Berbagai Bagian Tanaman Mengkudu (Morinda Citrifolia) Terhadap Perkembangan Penyakit Antraknosa Pada Tanaman Cabe (Capsicum Annum L). J. HPT Tropika. 10 : 52 – 58
Efri., Aeny, T. N. 2004. Keefektifan Ekstrak Mengkudu Pada berbagai
Konsentrasi Terhadap Penghambatan Pertumbuhan Bakteri Ralstonia sp Secara In Vitro. J. HPT Tropika. Vol 4. No 2: 83-88.
Fahri, M. 2010. Teknik Ekstraksi Senyawa Flavanoid dari Alga Coklat Sargassum cristaefollium. Skripsi. Universitas Brawijaya. Malang. 20.
Kusnadi, Sutarya, R., dan Munandar, S. 2009. Pengaruh Biofungisida Bacillus subtilis dan Mulsa Terhadap Serangan penyakit Antraknosa Pada Cabai Merah (Capsicum annum L). Biosainstifika. 1. 124 – 138.
Nurmansyah. 2010. Efektivitas Minyak Seraiwangi dan Fraksi Sitronellal
25
Ogundare AO & Onifade AK. 2009. The Antimicrobial activity of Morinda Lucida leaf extract on Escherichia coli. J. of Medicinal Plants Research 3(4): 319-323.
Pratomo, Aries. 2007. Identifikasi dan Pengendalian Jamur Putih Buah Salak dengan Ekstrak Bunga Kecombrang (Nicolaia speciosa). Laboratorium Pengamatan Hama dan Penyakit. Banyumas.
Prajnanta, F. 2003. Agribisnis Cabai Hibrida. Penebar Swadaya. Jakarta.
Purba, Sardes. 2007. Uji Efektifitas ekstrak daun Mengkudu (Morinda citrifolia) Terhadap Plutella xynostella L (Lepioptera: Plutellidae) di Laboratorium. Skripsi. USU.
Puspita dan Andriani. 2005. Tanaman Obat Keluarga dan Pengobatan Alternatif. Jakarta: Setia Kawan.
Roberts, D. A and Boothoryd. C. W., 1972. Fundamentals of Plant Pathology. Freman and Company. San Fransisco.
Rukmana, R. 2009. Cabai Hibrida Sistem Mulsa Plastik. Kanisius. Yogyakarta. Sarida, M., Tarsim, dan Faizal, I. 2010. Pengaruh Eksrtak Buah Mengkudu
(Morinda citrifolia L) dalam Menghambat Pertumbuhan Bakteri Vibrio Harveyi Secara In vintro. Jurnal Penelitian Sains. 13. 3(D)
Semangun, H. 2004. Penyakit – Penyakit Tanaman Hortikultura di Indonesia. UGM Press. Yogyakarta.
Setiadi. 2000. Bertanam Cabai. Penebar Swadaya. Jakarta. 183. Sibrani, F.M., 2008. Uji Efektivitas Beberapa Fungisida Nabati Untuk
Mengendalikan Penyakit Antraknosa (Colletotrichum capsici) Pada Tanaman Cabai (Capsicum Annum) di lapang. Skripsi. USU. 16.
Sjabana, D dan R.R. Bahalawan. 2002. Pesona Tradisional & Ilmiah Mengkudu (Morinda citrifolia). Salemba Medika. Surabaya. 89.
Sudarmo, S. 2009. Pestisida Nabati Pembuatan dan Pemanfaatannya. Kanisius. Yogyakarta.
26
Waha, L.G. 2001. Sehat dengan mengkudu. MSF Group, Jakarta. hal. 1 - 44.
I. PENDAHULUAN
1.1. Latar Belakang
Cabai merupakan komoditas sayuran yang tidak dapat ditinggalkan masyarakat dalam kehidupan sehari-hari. Selain berguna sebagai penyedap masakan dan pembangkit selera makan, cabai juga mengandung zat-zat gizi yang sangat diperlukan untuk kesehatan manusia. Cabai mengandung protein, lemak, karbohidrat, kalsium, fosfor, besi, vitamin-vitamin, dan mengandung senyawa alkaloid, seperti capsaicin, flavonoid, dan minyak esensial (Prajnanta, 2003).
Beberapa tahun terakhir ini, cabai menempati urutan yang paling atas diantara 18 jenis sayuran komersial yang dibudidayakan di Indonesia. Meskipun harga pasar cabai sering naik dan turun cukup tajam, minat petani tidak pernah surut
(Rukmana, 2009).
Di Propinsi Lampung, cabai merah termasuk salah satu komoditi tanaman sayuran unggulan . Komoditi tersebut banyak diusahakan di lahan kering baik dataran tinggi maupun dataran rendah. Propinsi Lampung mempunyai potensi
2
4,58 ton/hektar. Hasil ini masih termasuk rendah jika dibandingkan dengan rata-rata produktivitas nasional yang mencapai 5,60 ton/hektar.
Penyebab rendahnya produksi cabai antara lain adalah serangan hama dan penyakit. Beberapa penyakit dapat menyerang tanaman cabai, akan tetapi penyakit yang sangat penting dan penyebarannya sangat luas adalah penyakit antraknosa. Penyakit antraknosa disebabkan oleh Colletotrichum capsici (Syd.) Butl. et Bisby, dapat ditemukan pada daun dan batang dan selanjutnya
menginfeksi buah (Semangun, 2004). Selain dipertanaman penyakit antraknosa juga terdapat dipenyimpanan (Setiadi, 2000).
Penyakit antraknosa sangat ditakuti karena dapat menghancurkan seluruh pertanaman. Cabai segar yang disimpan 1-2 hari sebelum dipasarkan pun dapat memperlihatkan gejala serangan penyakit ini karena antraknosa dapat terbawa, tumbuh, dan bertahan di dalam biji selama sembilan bulan (Prajnanta, 2003). Penyakit ini juga banyak terdapat di daerah transmigrasi Lampung, dan dianggap sebagai penyakit yang merugikan (Semangun, 2004).
Beberapa usaha pengendalian yang dilakukan untuk mencegah penyakit
3
Pada umumnya penyakit antraknosa dikendalikan secara kimiawi, menggunakan fungisida sintetik yang banyak digunakan adalah fungisida sistemik berbahan aktif triadianefon dicampur dengan fungisida kontak berbahan aktif tembaga hidroksida seperti Kocide 54WDG, atau yang berbahan aktif Mankozeb seperti Victory 80WP (Departemen Pertanian, 2011). Namun demikian, penggunaan fungisida sintetik dapat menimbulkan dampak buruk bagi lingkungan sekitar seperti terbunuhnya organisme non target, membahayakan kesehatan operator dan lingkungan, serta memerlukan biaya yang cukup besar.
Salah satu alternatif pengendalian yang aman adalah menggunakan pestisida nabati. Penggunaan pestisida nabati selain dapat mengurangi pencemaran lingkungan, harganya relatif murah apabila dibandingkan dengan pestisida sintetis. Pestisida nabati dapat dibuat secara sederhana berupa larutan hasil
perasan, rendaman, ekstrak, dan rebusan bagian tanaman, yaitu berupa akar, umbi, batang, daun, biji, dan buah (Sudarmo, 2009).
Tanaman mengkudu merupakan salah satu tanaman yang berpotensi sebagai pestisida nabati. Kandungan senyawa yang ada dalam daun mengkudu antara lain asam amino, mineral, vitamin, dan alkaloid seperti antraquinon, glikosida, resin (Djauhariya et al., 2006). Menurut Ogundare dan Onifade (2009) ekstrak daun mengkudu pada konsentrasi 25 mg ml-1 mampu menghambat pertumbuhan Escherichia coli dengan zona penghambatan 5 mm. Namun bagian efektif
4
yang terkandung dalam ekstrak dengan cara ekstraksi bertingkat menggunakan konsentrasi pelarut yang berbeda.
1.2. Tujuan
Penelitian ini bertujuan untuk mempelajari pengaruh berbagai fraksi ekstrak daun mengkudu terhadap pertumbuhan C. capsici penyebab penyakit antraknosa pada cabai secara in vitro.
1.3. Kerangka Pemikiran
Antraknosa dikenal sebagai penyakit busuk buah prapanen dan pascapanen yang sangat berperan dalam mempengaruhi hasil produksi cabai (Hidayat et al., 2001dalam Kusnadi et al., 2009). Penyakit ini berkembang pesat sekali pada kondisi kelembaban relatif tinggi (> 95 %) pada suhu sekitar 32º C dan
lingkungan pertanaman yang kurang bersih serta banyak terdapat genangan air (Prajnanta, 2003). Pengendalian penyakit antraknosa yang dilakukan selama ini dengan menggunakan pestisida sintetik sering menimbulkan dampak negatif bagi lingkungan sekitar. Oleh sebab itu, perlu dicari alternatif pengendalian yang efektif dapat menekan sumber infeksi atau sumber inokulum patogen serta ramah lingkungan. Salah satu alternatif pengendalian yang dapat digunakan mempunyai prospek yang cukup baik adalah dengan penggunaan pestisida nabati yaitu ekstrak daun mengkudu.
5
asperuloside, alizarin dan beberapa zat antraquinon telah terbukti sebagai zat anti
bakteri. Zat-zat yang terdapat di dalam buah mengkudu telah terbukti
menunjukkan dapat menekan pertumbuhan jamur-jamur tertentu. Ekstrak daun mengkudu dalam minyak esensial pada konsentrasi 1000 ppm dapat menekan pertumbuhan jamur Aspergillus flavus (Verma et al., 2008 dalam Efri, 2010). Hasil penelitian Efri (2010) ekstrak daun mengkudu dan bunga mengkudu dapat menekan perkembangan keterjadian dan keparahan penyakit antraknosa tanaman cabai. Namun hasil penelitian ini tidak menunjukkan hasil yang konsisten.
Ekstraksi merupakan proses pemisahan suatu senyawa tertentu menggunakan pelarut organik berdasarkan derajat polaritasnya sehingga mendapatkan senyawa yang lebih spesifik (Harborne et al.,1987 dalam Fahri, 2010). Efektifitas ekstrak daun mengkudu kemungkinan dapat ditingkatkan dengan cara memisahkan senyawa-senyawa yang terkandung sehingga menjadi fraksi yang lebih spesifik.
1.4. Hipotesis
II. TINJAUAN PUSTAKA
2.1. Tanaman Cabai
Cabai (Capsicum annum L.) termasuk tanaman semusim berbentuk perdu, berdiri tegak dengan batang berkayu, dan memiliki banyak cabang. Tinggi tanaman dewasa antara 65 - 120 cm. lebar tajuk tanaman 50 - 90 cm (Prajnanta, 2003). Tangkai daunnya horizontal atau miring dengan panjang sekitar 1,5 - 4,5 cm. Panjang daunnya antara 4 - 10 cm dan lebar anatara 1,5 - 4 cm. Posisi buahnya menggangtung dengan warna mahkota putih. Mahkota bunga ini memiliki kelopak sebanyak 5 - 6 helai dengan panjang 1 - 1,5 cm dan lebar 0,5 cm. Warna kepala putik kuning kehijauan, sedangkan tangkai sarinya putih walaupun yang lekat dengan kepala sari ada yang berbecak kecoklatan. Kepala sari berwarna biru atau ungu. Buahnya berbentuk memanjang atau kebulatan dengan biji buahnya berwarna kuning kecoklatan (Setiadi, 2000).
7
pada akhir musim hujan, sedangkan di tegalan ditanam pada musim hujan (BPTP Lampung, 2008).
2.2. Penyakit Antraknosa
Antraknosa disebabkan oleh jamur dari genus Colletotrichum yang merupakan kelompok yang umum dari patogen tanaman, dan jamur ini penyebab penyakit pada banyak spesies tanaman di seluruh dunia. Identifikasi spesies
Colletotrichum biasanya lebih dari satu karakteristik, diantaranya bentuk fisiknya,
kepatogenisitasnya pada tanaman inang. Banyak spesies dari Colletotrichum menginfeksi lebih dari satu tanaman inang dan untuk memudahkan identifikasi, ada 3 spesies dari Colletotrichum yaitu C. gloeosporioides, C. capsici dan C. cocodes yang menyebabkan penyakit pada tanaman cabai di Florida (Roberts et
al., 2006).
Klasifikasi jamur C. capsici menurut Singh (1998) adalah: Divisi : Ascomycotina
Miselium jamur ini terdiri dari beberapa septa. Aservulus dan stroma pada batang berbentuk hemispirakel dan ukuran 70-120 μm. Seta menyebar, berwarna coklat gelap sampai coklat muda, seta terdiri dari beberapa septa dan ukuran +150μm.
8
ukuran 17-18 x 3-4 μm. Konidia dapat berkecambah pada permukaan buah yang hijau atau merah tua. Tabung kecambah akan segera membentuk apresorium (Singh, 1998 dalam Sibrani, 2008).
Gejala pada buah membuat buah busuk. Penyakit dapat menginfeksi buah matang maupun buah muda. Gejala awal adalah bercak kecil seperti tersiram air, luka ini berkembang dengan cepat sampai ada yang bergaris tengah 3-4 cm. Perluasan bercak yang maksimal membentuk lekukan dengan warna merah tua coklat muda, dengan berbagai bentuk konsentrik dari jaringan stromatik cendawan yang
berwarna gelap (BPTP Lampung, 2008).
Gambar 1. (a) Aservulus (b) seta (c) konidia jamur C. capsici
2.3. Tanaman Mengkudu
9
Australia, Mengkudu, Pace di Indonesia dan Malaysia (Waha, 2001). Menurut Djauhariya (2006) di Indonesia tanaman mengkudu sudah dimanfaatkan sejak jaman dahulu. Mengkudu merupakan tanaman asli dari Asia Tenggara, termasuk Indonesia. Mengkudu tumbuh hampir diseluruh kepulauan di Indonesia,
umumnya tumbuh liar di pantai laut, di pinggir hutan, ladang, pinggir jalan dan aliran air, serta pinggir kampung.
Tanaman mengkudu berbuah sepanjang tahun. Mudah tumbuh pada berbagai tipe lahan, dengan daerah penyebaran dari dataran rendah hingga ketinggian 1500 dpl. Ukuran dan bentuk buahnya bervariasi, pada umumnya mengandung banyak biji, dalam satu buah terdapat ≥300 biji, namun ada juga tipe buah mengkudu yang memiliki sedikit biji. Bijinya dibungkus oleh suatu lapisan atau kantong biji, sehingga daya simpannya lama dan daya tumbuhnya tinggi. Dengan demikian, perbanyakan mengkudu dengan biji sangat mudah dilakukan (Djauhariya et al., 2006). Daun mengkudu berwarna hijau dan mengkilap, terletak berhadap-hadapan, besar, tebal, dan tunggal dengan ujung pangkal yang meruncing. Pada bagian tepi daun rata dengan panjang 10 - 40 cm, lebar 5 - 17 cm, pertulangan daun menyirip dan bertangkai pendek (Sjabana dan Bahalawan, 2002).
10
Proxeronin ( jenis asam koloid yang tidak mengandung gula, asam amino atau asam nukleat dengan bobot molekul lebih dari 16.000), dalam jumlah besar (Sarida et al., 2010).
1.4. Pemanfaatan Tanaman Mengkudu Sebagai Pestisida Nabati
Pestisida nabati adalah pestisida yang bahan dasarnya berasal dari tanaman dan sudah lama digunakan oleh petani. Penggunaan pestisida nabati mulai banyak diminati lagi oleh petani karena mahalnya harga pestisida kimiawi. Pestisida nabati dapat dibuat dengan menggunakan teknologi sederhana berupa larutan hasil perasan, rendaman, ekstrak dan rebusan dari tanaman.
Beberapa penelitian ilmiah penggunaan daun mengkudu sebagai pestisida nabati sudah banyak dilakukan. Zat-zat yang terdapat di dalam daun mengkudu telah terbukti menunjukkan kekuatan melawan golongan bakteri infeksi: Pseudomonas aeruginosa, Proteus morganii, Staphylococcus aureus, Bacillus subtilis dan
Escherichia coli (Waha, 2001).
11
Daun mengkudu memiliki kandungan antraquinon, asam amino, glikosida, senyawa fenolik, dan asam ursulat. Kandungan Alkaloid, fenol, glikosida, dan antraquinon ini merupakan suatu zat aktif yang bersifat antimikrobia (Yukti,
2011). Selain itu, mengkudu juga memiliki kandungan zat kimia yang
mempunyai efek antifungi dan antibiotik, yaitu Scopoletin sebagai anti jamur juga telah terbukti dapat membunuh beberapa tipe bakteri, bersifat fungisida
III. METODE PENELITIAN
3.1. Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Penyakit Tumbuhan Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung dari bulan Juli 2011 sampai dengan Maret 2012.
3.2. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah cawan petri, erlenmeyer, mikroskop majemuk, mikro pipet, bunsen, alat potong, pinset, autoclave, alumunium foil, plastik tahan panas, kaca preparat, kaca penutup, bor gabus,
jarum ose, jarum ent, tabung reaksi, selotip, sprayer, plastik, karet gelang, nampan plastik, paralon, penggaris dan alat tulis.
Bahan –bahan yang akan digunakan antara lain daun mengkudu, buah cabai bergejala, biakan C.capsici, alkohol 70% dan 96%, NaOCl 1%, media PDA (Potato Dextrose Agar), arang aktif dan aquades.
3.3. Rancangan Percobaan
13
mengkudu yang terlarut dalam alkohol konsentrasi 10% (DM+10), 20%
(DM+20), 30% (DM+30), 40% (DM+40), 50% (DM+50), 60% (DM+60), 70% (DM+70), 80% (DM+80), dan 90% (DM+90), serta ekstrak daun mengkudu yang terlarut dalam aquades (DM+Aq). Data hasil pengamatan dianalisis
menggunakan sidik ragam dan perbedaan nilai tengah antar perlakuan diuji dengan Uji Jarak Berganda (Duncan) pada taraf nyata 5%.
3.4. Pelaksanaan Percobaan 3.4.1. Penyiapan Isolat C. capsici
C. capsici diisolasi dari buah cabai yang menunjukkan gejala busuk atau
terinfeksi. Jaringan kulit buah yang bergejala dipotong pada bagian perbatasan antara bagian yang sakit dan yang sehat (± 5 mm), kemudian potongan direndam dalam larutan NaOCl 1% selama 2 menit, dan dibilas dengan aquades steril. Selanjutnya potongan kulit buah tersebut ditanam dalam cawan petri yang berisi media PDA dan diinkubasi dalam suhu ruang selama 3 hari. Jamur yang tumbuh kemudian isolasi dan diidentifikikasi.
3.4.2. Pembuatan Ekstrak Daun Mengkudu
Daun mengkudu diperoleh dari tanaman mengkudu di sekitar lingkungan Fakultas Pertanian, Universitas Lampung. Daun mengkudu yang digunakan adalah daun yang tidak terlalu muda dan tidak terlalu tua yaitu pada ruas ke 4 – 5 dari pucuk daun. Daun mengkudu seberat 100 gram dicuci dengan air bersih lalu dikering-anginkan. Kemudian daun mengkudu dipotong-potong dan diblender dengan diberi sedikit air untuk memperoleh bentuk yang lebih halus, selanjutnya
14
40%, 50%, 60%, 70%, 80%, dan 90% menggunakan alat yang dirancang menggunakan paralon (Gambar 2).
Alat yang digunakan untuk mengekstrak dibuat dengan menggunakan paralon berbagai ukuran yang terdiri atas empat sambungan dan setiap sambungannya diberi kain kasa. Pada sambungan kedua diisi arang aktif yang telah dihaluskan sebagai filter. Masing-masing larutan hasil ekstraksi selanjutnya dituang dalam nampan plastik dan diuapkan dalam ruangan dengan suhu kamar, sehingga diperoleh fraksi kering ekstrak daun mengkudu dan disimpan dalam lemari es untuk pengujian selanjutnya.
15
3.4.3. Penyiapan Media Tumbuh Jamur C. capsici untuk Perlakuan Pengujian
Pembuatan media PDA dimulai dengan 250 gr kentang dipotong kecil – kecil, lalu direbus didalam 1250 ml air sambil diaduk, setelah itu rebusan kentang disaring dan dimasukkan ke dalam dua labu erlenmeyer masing - masing berukuran 1 liter dan 250 ml yang sebelumnya telah diberi 20 gr gula dan 20 gr agar pada labu erlenmeyer 1 liter dan 5 gr gula dan 5 gr agar pada labu erlenmeyer 250 ml. Media dalam labu erlenmeyer tersebut disterilisasi di dalam otoklaf. Setelah proses sterilisasi selesai, media PDA 1250 ml tadi dibagi kedalam 11 labu erlenmeyer yang berbeda, masing - masing menjadi 100 ml larutan PDA. Tiap tabung yang telah berisi 100 ml PDA dicampur dengan 10 mg masing-masing fraksi kering ekstrak daun mengkudu.
3.4.4. Uji Penghambatan Pertumbuhan C. capsici
Uji penghambatan pertumbuhan C. capsici dilakukan untuk mengetahui ukuran diameter koloni pada tiap-tiap perlakuan pada media PDA dalam cawan petri. Masing - masing fraksi kering ekstrak daun mengkudu dicampurkan dalam media PDA dengan konsentrasi 100 ppm yaitu 10 mg bagian fraksi kering ekstrak daun mengkudu per 100 ml bagian media PDA dan di tuang ke dalam cawan petri. Jamur C. capsici yang telah dimurnikan diambil dengan bor gabus yang berukuran ± 5 mm dan diletakkan pada bagian tengah cawan petri. Masing - masing
16
Pengamatan dilakukan terhadap diameter koloni jamur sehingga diketahui kemampuan dari masing – masing fraksi ekstrak daun mengkudu dalam
menghambat pertumbuhan C. capsici. Pengamatan ini dilakukan pada hari ke-2 hingga hari ke-11 setelah infestasi. Data pertumbuhan koloni jamur yang didapat merupakan rata - rata empat kali pengukuran diameter pada daerah yang berbeda. Data yang diperoleh selanjutnya digunakan untuk menghitung persentase
penghambatan ekstrak daun mengkudu terhadap C. capsici dengan rumus sebagai berikut (Ahmad dan Suryana, 2009).
100%
Keterangan: P = persentase penghambatan
D1 = Diameter C.capsici. pada kontrol (cm)
D2 = Diameter C. capsici. pada setiap perlakuan (cm)
3.4.5. Pengamatan dan Penghitungan Jumlah Spora
Pengamatan dilakukan untuk mengetahui jumlah spora pada tiap-tiap perlakuan. Pengamatan ini diperlukan sebagai data pendukung dari data pengamatan
pertumbuhan C. capsici. Jumlah spora dihitung menggunakan metode hitungan mikroskopis langsung, dimana sampel diletakkan pada haemocytometer. Jumlah spora dapat dihitung dengan cara mengambil semua spora yang tumbuh pada tiap cawan petri dalam tiap ulangan. Suspensi spora C. capsici kemudian dimasukkan ke dalam 10 ml aquades steril di dalam cawan petri setelah itu dihomogenkan. Selanjutnya suspensi spora C. capsici diteteskan pada ruang hitung
haemocytometer dan ditutup dengan kaca obyek, sehingga suspensi mengalir ke
17
lima kotak sedang di bawah mikroskop. Jumlah spora dihitung dengan rumus menurut Sudibyo (1994) dalam Surtikanti dan Juniarsih (2010) :
K = Jumlah spora x 2,5 x 106
Keterangan : K = kerapatan spora per ml
2,5 = konstanta atau faktor koreksi penggunaan kotak sampel pada haemocytometer
V. SIMPULAN DAN SARAN
5.1 Simpulan
Dari hasil penelitian yang telah dilakukan dapat disimpulkan bahwa.
1. Fraksi ekstrak daun mengkudu yang terlarut dalam alkohol konsentrasi 10%, 30%, 50%, 60%, 70%, 90% dan ekstrak daun mengkudu yang terlarut dalam aquades efektif menghambat pertumbuhan diameter pada koloni C. capsici.
2. Fraksi ekstrak daun mengkudu yang terlarut dalam alkohol konsentrasi 10% dan 30%.selain menghambat pertumbuhan vegetatif juga menghambat pembentukan spora (sporulasi) koloni C. capsici.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut untuk mengoptimalkan aktivitas antifungi dan untuk mengetahui senyawa antifungi yang spesifik berperan dalam