LAMPIRAN
DAFTAR PUSTAKA
Affandi, S.; Setyawan, H.; Winardi, S.; Purwanto, A. and Balgis, R., 2009, A
Facile Method For Production of High – Purity Silica Xerogels from Baggase Ash, Advanced Powder Technology, 20:468-472.
Anonim, B. 2013. http:// Wikipedia.org/wiki/Silika. Diakses 31Mei 2016 pukul 20.30 WIB
Barsoum. 1997. Nano Porous Materials. McGraw Hill Publishing Company, Inc. New York
Bakri, R. 2008. Kaolin Sebagai Sumber SiO2 untuk Pembuatan Katalis Ni/SiO2:
Karakterisasi dan Uji Katalis Pada Hidrogenasi Benzene Menjadi Sikloheksana. Jurnal Sains. 12:37-42.
Basset, J., Mendham, J., and Denney, R. C. 1989. Quantitative Chemical Analysis. Fifth Edition. Longman Scientific & Technical. New York.
Bird, T. 1993. Kimia Fisik Untuk Universitas. Cetakan Kedua. PT Gramedia Pustaka Utama. Jakarta.
Brownell, L. E., and Young, E. H. 1983. Process Equipment Design. Jhon Willey and Sons Inc.New York
Brown, M.E. and Gallaher, P.K. 2003. Thermal Analysis and Calorimetry. Volume 2. Elsevier. Ottawa.
Brinkmann, U., Ettlinger, M., Kerner, D. and Schmoll, R. 2006. Colloidal Silica
Fundamental and Applications. Taylor & Francis Group. California.
Brown, M.E. and Gallaher, P.K. 2003. Thermal Analysis and Calorimetry.Volume 2. Elsevier. Ottawa.
Chakverty., A., Mishra. P and Baherjee. D. 1988. Investigation of Combustion of
Raw and Acid-Leached Rice Husk For Production of Pure Amorphous White Silica. Jurnal of Material Science. 23:21-24
Chandra, A., Miryanti, A., Widjaja, L. B. dan Pramudita, A. 2012. Isolasi dan
Karakterisasi Silika Dari Sekam Padi. Universitas Prahayangan.
Coleman, N.J.; Li, Q. and Raza, A., 2013, Synthesis, Structure and Perfoormance
of Calcium Silicate Ion Exchangers from Recycled Container Glass, Physicochemical Problems of Mineral Processing, 50:5-16
Cullity, B.D. 1978. Elements of X-Ray Diffraction. Second Edition. Addison-Wesley Publishing Company Inc. Canada.
Della, V.P., Kuhn, I. and Hotza, D. 2002. Rice Husk Ash as an Alternate Source
Dian, 2011, Jenis-Jenis Kaca dan Aplikasinya. Teknik Industri. 2011
Gregg, J.S. and Sing, K.S.W. 1991. Adsorption, Surface Area, & Porosity. Second Edition. Academic Press. Sidney.
Iler, R.K. 1979. Silica Gel and Powders. The Chemistry of Silic. New York. Jin, W., Meyer, C. and Baxter, S., 2000. “Glasscrete” – Concrete with Glass
Aggregate, ACI Materials Journal, No. 97.
Jones, T. S. 2000. Silicon. U.S Geological Survey Minerals Yearbook.
Kalapathy, U., Proctor, A. and Shultz, J. 2000. A simple Method for Production of
Pure Silica from Rice Hull Ash. Bioresource Technology. 73:257-162.
Kanellopoulos, N., 2011. Nanoporous Materials : Advanced Techniques for
Characterization, Modeling, and Processing. CRC Press Taylor &
Francis Group. New York.
Khopkar. 2008. Konsep Dasar Kimia Analitik. Universitas Indonesia. Jakarta. Kirk-Otmer. 1967. Encyclopedia of Chemical Tecgnology. Interscience Publisher.
New York.
Liu, X,; Wang, A.; Zhang, T.; T.; Su, D. and Mou, C., 2011, Au-Cu Alloy
Nanoparticles Supported on Silica Gel as Catalyst for CO Oxidation:
Effect of Au/Cu Ratios, Catalysis Today.
Luh, B.S. 1991. Rice. Second Edition. Van Nostrand Reinhold. New York.
Madrid, R., Nougueira, C.A. and Margarido, F. 2012. Production and
Characterisation of Amorphous Silica from Rice Husk Waste. Journal of Materials.
Mars, 2015. Sintesis dan Karakterisasi Mesopori Silika dari Sekam Padi dengan
Metode Kalsinasi. Medan
Mantell, C.L. 1958. Engineering Material Handbook. McGraw-Hill Book Company. New York.
McColm, I.J. 1983. Ceramic Science for Materials Technologists. Chapman and Hall. Michigan.
Ministry of Environment, 2008, Indonesian Domestic Solid Waste Statistic Year
2008, State Ministry of Environment The Republic of Indonesia, Jakarta.
Micheler. 2008. Adsorption of capacity of Coconut Coir Activated carbon in The
Removal of Disperse and Direct dyes from Aqueous Solution. New Delhi.
Mori, H, 2003, Extraction of Silicon Dioxide from Waste Colored Glasses by
Alkali Fusion Using Sodium Hydroxide, Journal of Ceramic Society of Japan, 111:376-381.
Mohan, Jag. 2004. Organic Spectroscopy Principles and Applications Second
Edition. Alpha Science International ltd. India
Mudzakir, A. 2013.Praktikum Kimia Anorganik (KI 425). Bandung: Jurusan Pendidikan Kimia FPMIPA UPI.
Nabeshi, H., Yoshikawa, T., Arimori, A., Yoshida, T., Tochigi, S., Hirai, T., 2011. Effect of Surface Properties of Silica Nanoparticles on their
Cytotoxicity and cellular Distribution in Murine Macrophages.
Nanoscale Research Letter. 6:23
Pahlepi, R., Sembiring, S. dan Pandiangan, D. 2013. Pengaruh Penambahan MgO
Pada SiO2 Berbasis Silika Sekam Padi Terhadap Karakteristik Komposit MgO-SiO2 dan Kesesuaiannya Sebagai Bahan Pendukung Katalis. Jurnal Teori dan Aplikasi Fisika. Vol. 01, No 02
Punkels, 2008. Kegunaan Silica Gel
Rahman, N. A., Widhiana, I. Juliastuti, S. R. and Setyawan, H. 2015. Synthesis of
Mesoporous Silica with Controlled Pore Structure from Bagasse Ash a Silica Source.Journal of Materials. 476:1-7
Rapuan. 2008. Scanning Electron Microscope.Makasar.
Rizki, F., Titin, A., Nelly, W., 2014, Optimasi Waktu Kontak Modifikasi Silika
Gel Dari Limbah Kaca Menggunakan Tributilamina, Fakultas MIPA,
Universitas Tanjung Pura.
R.S Mikhail dan Robens, E, Microstructure and Thermal Analysis of Solid
Surfaces, (New York: , John Wiley Heyden Publication, 1983), hlm. 154
Rouque-Malherbe, R.M.A. 2007. Adsorption and Diffussion in Nanoporous
Material. CRC Press Taylor & Francis Group.
Scherer, G.W., 1989, Mechanics of Syneresis, I. Theory, Journal of Crystalline Solids.
Schubert, U., and Husing, N., 2006. Synthesis of Inorganic Materials, Second Edition. Wiley-VCH Verlag GmbH & Co, KGoA, Weinheim.
Setyawan, 2013. Pengujian Poly (ethylene terephtalate) Menggunakan FTIR. Institut Teknologi Sepuluh November.
Silverstein, R.M., Bassler, G.C and Morrill, T.C. 1986. Spectrometric
Identification of Organic Compound. John Willey and Sons. New York.
Xu, Y.; X. and Chung, D.D.L., 2000, Sodium Silicate Based Thermal Interface
Material For High Thermal Contact Conductance, Journal of Electronic
Packaging
Yun, P.; Tian.; Y.; Wang, Z.; Qu, R.; Liu, X.; Xu, Q. and Tang, Q., 2003,
Synthesis of Functionalized Silica Gel With Poly (Diethylenetriamine Bis (Methylene Phosponic Acid)) and Its Adsorption Properties of Transition Metal Ions, Material Chemistry and Physics.
BAB III
METODE PENELITIAN
3.1Alat
− Neraca Digital AS 220/C/2 Radwag
− Indicator Universal
− Furnace Control Fisher
− Hotplate Stirrer Thermilyte
− Difraktometer Sinar-X
− Fourier Transform Infrared
− Brunauer-Emmett-Teller adsorpmeter
− Scanning Electron Microscope
− Oven
− Peralatan Gelas Pyrex
− Pipet Tetes
− Termometer
− Kertas Saring Whatmann no. 42
3.2Bahan
− Limbah kaca
− HCl P.a
− NaOH P.a
3.3Prosedur Penelitian
3.3.1 Persiapan Bahan Baku Pembuatan Silika
Bahan-bahan yang dipersiapkan terlebih dahulu adalah limbah kaca sebagai sumber silika (Si). Limbah kaca ini dibersihkan dan dikeringkan kemudian dihaluskan hingga halus dan diayak dengan ayakan ≤150 mesh. Serbuk kaca yang digunakan adalah serbuk kaca yang lolos dari ayakan ≤150 mesh.
3.3.2 Kalsinasi Serbuk Kaca
Lima gram (5 g) serbuk kaca yang telah diayak dengan ayakan ≤150 meshditambahkan NaOH pellet sebanyak 7 g lalu dikalsinasi pada suhu900 0C selama 6 jam.
3.3.3 Pembuatan Larutan Natrium Silikat
Setelahdikalsinasi, padatan yang terbentuk berupa padatan natrium silikat. Padatan natrium silikat dilarutkan dalam aquades 500 ml, kemudian diaduk dengan magnetic stirrer dengan temperatur 1000C. Kemudian disaring dan diambil filtrat yang merupakan larutan natrium silikat.
3.3.3 Pembuatan Silika
Larutan natrium silikat kemudian ditambahkan dengan HCl 1 N hingga pH mencapai 7 lalu dibiarkan selama 18 jam. Endapan yang berbentuk gel yang terbentuk dicuci beberapa kali dengan menggunakan aquades lalu disentrifugasi. Silika yang diperoleh dikeringkan di dalam oven pada suhu 120 0C selama 2 jam.
3.3.4. Karakterisasi Silika
Silika yang telah dikeringkan kemudian digerus untuk mendapatkan serbuk silika. Kemudian serbuk silika dikalsinasi kembali pada suhu 9000C. Silika yang telah dimurnikan kemudian dikarakterisasi dengan menggunakan analisa FT-IR, XRD, BET dan SEM.
3.4 Bagan Penelitian 3.4.1 Preparasi Sampel
- Dicuci - Dikeringkan - Dihaluskan
- Diayak dengan ayakan ≤150 mesh Kaca Botol Bening
3.4.2. Kalsinasi Serbuk Kaca
- Ditambah NaOH pellet sebanyak 7 g - Di kalsinasi pada suhu 900 0C selama 6
jam
- Dilarutkan dengan aquadest dan dipanaskan
- Disaring
- Ditambahkan HCl 1 N hinggga pH=7
- Didiamkan selama 18 jam hingga terbentuk gel
- Dicuci dengan 500 ml aquadest - Distrirer selama 20 menit - Disentrifugasi
- Diulangi pencucian beberapa kali
- Dikeringkan dengan oven pada suhu 120 0C selama 2 jam 5 g Serbuk Kaca
Hasil kalsinasi
Residu Filtrat
Silika Gel
3.4.3Karakterisasi Silika
-Dipanaskan pada suhu 9000C selama 4 jam - Dianalisa dengan:
FT-IR, XRD, BET dan SEM Silika
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pemurnian Silika
Setelah melalui proses kalsinasi pada suhu 900 0C dan melalui proses pemurnian maka diperoleh silika yang berwarna putih. Silika hasil pemurnian dapat dilihat pada gambar 4.1
Gambar 4.1 Silika hasil pemurnian pada suhu 9000C
Kaca yang digunakan dalam penelitian ini merupakan kaca bening dan tidak berwarna yang berasal dari botol bekas. Kaca terlebih dahulu dicuci dengan air bersih untuk menghilangkan pengotor yang menempel pada permukaan kaca. Kemudian kaca dihaluskan dan diayak dengan ayakan ukuran 150 mesh agar dihasilkan serbuk kaca dengan ukuran partikel kecil dan homogen.
Tahap awal pembuatan silika dari kaca dilakukan dengan mengekstraksi silika melalui pembentukkan senyawa natrium silikat dengan penambahan natrium hidroksida pellet (NaOH). Campuran serbuk kaca dan natrium hidroksida (NaOH) dikalsinasi pada suhu 9000C selama 6 jam. Kalsinasi serbuk kaca dan NaOH menghasilkan padatan natrium silikat yang masih bercampur dengan oksida logam dalam limbah kaca seperti natrium oksida (Na2O), kalsium oksida
(CaO), Aluminum oksida (Al2O3), magnesium oksida (MgO) dan kalium oksida
(K2O) (Coleman dkk, 2013). Karena natrium silikat merupakan senyawa yang
berwarna putih dan mudah larut dalam air, sehingga senyawa-senyawa oksida logam tersebut dapat dipisahkan dengan menambahkan H2O yang akan
melarutkan padatan natrium silikat sementara oksida logam tetap berbentuk padatan yang tak larut. (Xu dkk, 2000)
Pelarutan natrium silikat dalam air dilakukan dengan proses pemanasan dan pengadukan yang bertujuan untuk meningkatkan terjadinya tumbukan antar molekul di dalam larutan sehingga dapat mempercepat proses pelarutan. Campuran hasil pemanasan kemudian disaring sehingga menghasilkan latutan natrium silikat sebagai filtrat dengan campuran oksida logam dan pengotor lainnya sebagai residu.
Preparasi gel dilakukan dengan menambahkan larutan asam klorida (HCl) ke dalam larutan natrium silikat. Penggunaan HCl lebih baik dibandingkan dengan penggunaan asam sulfat (H2SO4), asam oksalat (C2H2O4) atau asam sitrat
(C6H8O7) karena berhubungan dengan pembentukkan garam natrium. Natrium
sulfat, natrium oksalat dan natrium sitrat memiliki ukuran yang besar sehingga akan terperangkap dan menutupi pori-pori silika gel (Yun dkk, 2003). Sementara itu, natrium klorida memiliki ukuran yang lebih kecil sehingga lebih mudah dihilangkan dengan pencucian menggunakan H2O (Liu , 2011).
Na2SiO3 (aq) + 2HCl(aq) SiO2(s) + 2NaCl(s) + H2O(l)
Pembentukkan hidrogel mulai terjadi pada saat nilai pH berkisar antara 8-10 dan akan membentuk gel kaku pada pH 7. Hal ini sesuai dengan penelitian yang dilakukan sebelumnya yang mendapatkan bahwa hidrogel dapat terbentuk pada kisaran nilai pH 3-10 dan tidak dihasilkan bila nilai pH kurang dari 3 (Liu, 2011)
pembentukkan dan pertumbuhan permukaan gel yang disertai dengan pelepasan molekul H2O dari pori-pori silika gel (Scherer, 1989).
Proses pencucian silika gel dilakukan berulang-ulang hingga pH air cucian netral yang menandakan garam natrium telah larut seluruhnya ke dalam air. Silika gel yang telah netral dikeringkan pada suhu 1200C untuk menghilangkan molekul H2O. Silika yang dihasilkan kemudian dihaluskan dan dipanaskan kembali pada
suhu 9000C untuk mendapatkan silika mesopori (Rahman,N.A, 2015)
4.2 Karakterisasi Silika
4.2.1 Spektrum FT-IR
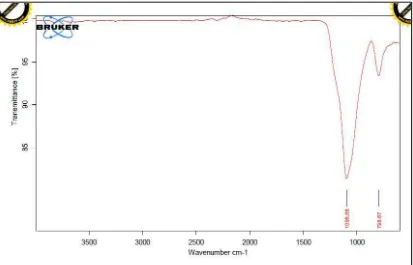
Silika yang diperoleh selanjutnya dianalisis menggunakan FT-IR untuk mengetahui adanya gugus fungsi yang berikatan dengan silika. Hasil FT-IR pada silika yang diperoleh ditunjukkan pada gambar 4.2 berikut ini.
Gambar 4.2 Spektrum FT-IR silika suhu 9000C
Tabel 4.1 Data Literatur Puncak Serapan Silika
Gugus Fungsi dan Bilangan Gelombang (cm-1) Literatur
υas Si-O-Si υs Si-O-Si
Silverstein, et al., 1986
1100-1000 <1000
4.2.2 Difraksi Sinar- X (XRD)
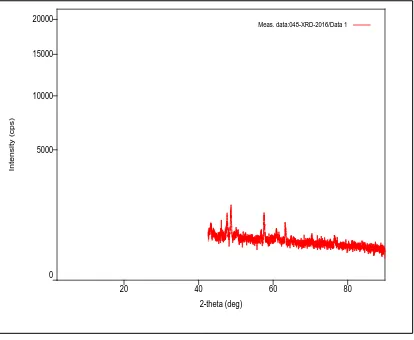
Difraktogram hasil analisis XRD produk silika yang dihasilkan diperlihatkan pada gambar 4.3 berikut ini.
Gambar 4.3 Difraktogram XRD Silika hasil kalsinasi pada suhu 9000C
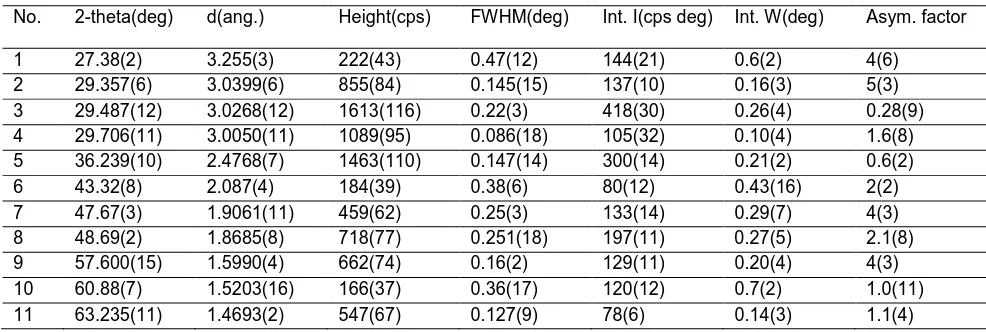
Data difraktogram XRD silika hasil kalsinasi diperlihatkan pada Tabel 4.2.
Meas. data:048-XRD-2016/Data 1
2-theta (deg)
In
ten
sity (cps)
20 40 60 80
Tabel 4.2 Pengukuran Difraktogram Silika Hasil Kalsinasi Pada Suhu 9000C
Data hasil pengukuran difraktogram XRD Silika pada Gambar 4.3 ditunjukkan pada Tabel 4.2. Data yang diperoleh pada tabel 4.2 kemudian dicocokkan dengan data pola difraksi sinar – X dari tabel Standard X-Ray
Diffraction Powder Patterns pada lampiran 1, puncak – puncak yang muncul pada
sudut 2θ = 27,38 ; 29,357 ; 29,487 ; 29,706 ; 36,239 ; 57,600 menunjukkan fasa kristalin silika. Dari data difraktogram yang telah diperoleh, meskipun di dalam silika terbentuk fasa kristalin tetapi fasa amorf lebih banyak. Hal tersebut ditunjukkan dengan terbentuknya puncak yang tidak terlalu tajam dengan intensitas yang relatif rendah. Sehingga dapat diketahui bahwa silika memiliki fasa campuran yaitu fasa kristalin dan fasa amorf dengan fasa amorf yang lebih banyak.
4.2.3 Brunauer – Emment – Teller (BET)
Untuk membuktikan luas permukaan dari silika yang dihasilkan ditentukan dengan menggunakan instrument Quantachrome novawin surface area analyzer menggunakan rumus Brunauer-Emment-Teller (BET). Sebelum analisa, ditentukan beberapa titik adsorbsi yang ingin diukur dinyatakan dalam nilai P/P0.
Alat akan mengukur berapa banyak gas yang terserap pada titik P/P0 yang
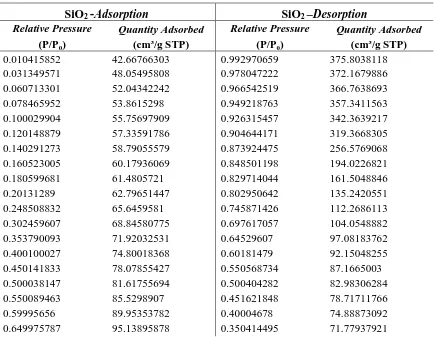
dimasukkan sebelumnya kemudian data akan dinyatakan dalam tabel atau grafik isotherm adsorbsi. Setelah didapat titik – titik data tersebut maka di dalam alat sudah dibekali dengan software untuk penghitungan dengan menggunakan metoda yang diinginkan. Misalnya untuk menghitung luas permukaan, maka tersedia metode BET dan software akan menghitungnya secara cepat. Data adsorbsi - desorbsi isotherm nitrogen dan data distribusi ukuran pori dapat dilihat pada tabel 4.3 dan tabel 4.4
Tabel 4.3 Tabel Adsorbsi – Desorbsi Isotherm Nitrogen
SiO2 -Adsorption SiO2 –Desorption
Relative Pressure Quantity Adsorbed Relative Pressure Quantity Adsorbed
(P/P0) (cm³/g STP) (P/P0) (cm³/g STP)
0.010415852 42.66766303 0.992970659 375.8038118
0.031349571 48.05495808 0.978047222 372.1679886
0.060713301 52.04342242 0.966542519 366.7638693
0.078465952 53.8615298 0.949218763 357.3411563
0.100029904 55.75697909 0.926315457 342.3639217
0.120148879 57.33591786 0.904644171 319.3668305
0.140291273 58.79055579 0.873924475 256.5769068
0.160523005 60.17936069 0.848501198 194.0226821
0.180599681 61.4805721 0.829714044 161.5048846
0.20131289 62.79651447 0.802950642 135.2420551
0.248508832 65.6459581 0.745871426 112.2686113
0.302459607 68.84580775 0.697617057 104.0548882
0.353790093 71.92032531 0.64529607 97.08183762
0.400100027 74.80018368 0.60181479 92.15048255
0.450141833 78.07855427 0.550568734 87.1665003
0.500038147 81.61755694 0.500404282 82.98306284
0.550089463 85.5298907 0.451621848 78.71711766
0.59995656 89.95353782 0.40004678 74.88873092
0.700004954 101.2725478 0.300739568 68.81463743
0.749554548 108.7552521 0.250238749 65.82705642
0.799147576 118.444234 0.200162164 62.82252953
0.820273343 124.5954226 0.140607538 58.98501512
0.847269622 137.3716616 0.080416497 54.28572958
0.871074293 157.2562084
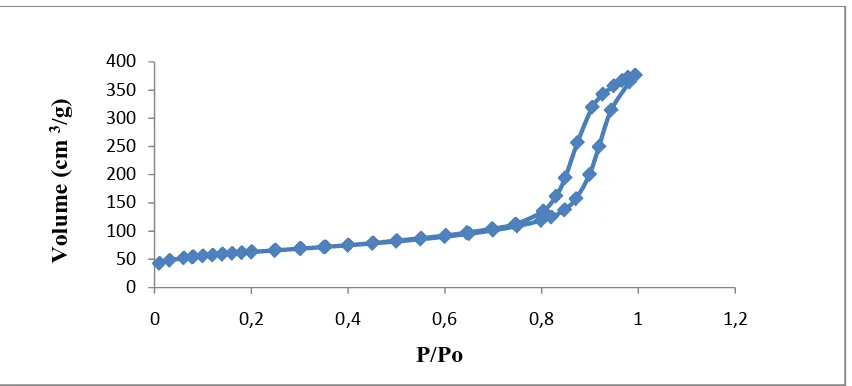
Dari tabel 4.3 diatas, diperoleh grafik adsorbsi – desorbsi nitrogen yang ditunjukkan pada gambar 4.4
Gambar 4.4. Grafik Adsorpsi - Desorpsi isotherm nitrogen
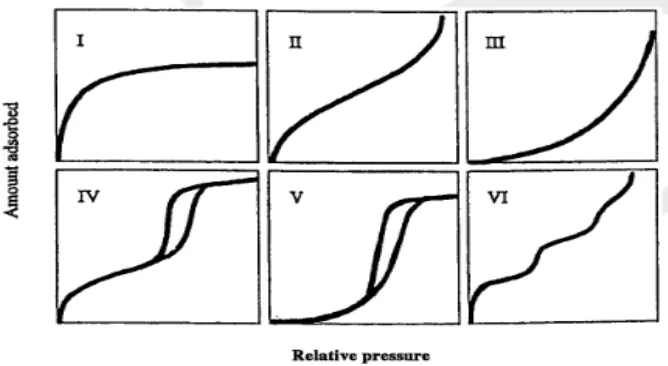
Dari gambar 4.4 terlihat bahwa adsorpsi- desorpsi isotherm nitrogen untuk silika menunjukkan adanya pembentukkan multilayer. Grafik ini menunjukkan adanya adsorbsi pada permukaan mesopori pada tekanan relative (P/Po) antara 0,75 – 0,99. Pembentukkan multilayer ini merupakan adsorbsi isotherm Tipe IV menurut klasifikasi IUPAC (International Union of Pure and Applied Chemistry).
Gambar 4.5 Tipe Grafik Isotherm Adsorbsi Berdasarkan IUPACInternational
Penentuan isotherm adsorbsi-desorbsi merupakan variabel yang sangat penting untuk menentukan tipe pori dan metode BET digunakan untuk menentukan total luas permukaan (Brown,2003). Data distribusi ukuran pori ditunjukkan pada Tabel 4.4
Tabel 4.4 Tabel Distribusi Ukuran Pori
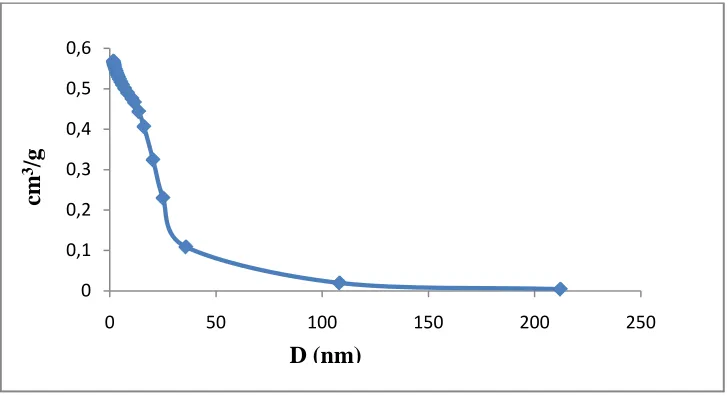
Dari tabel distribusi ukuran pori pada tabel 4.4, diperoleh grafik distribusi ukuran pori yang ditunjukkan pada gambar 4.6
Gambar 4.6 Grafik Distribusi ukuran pori
Pada grafik distribusi ukuran pori menunjukkan bahwa pori dari silika pada suhu 9000C terdistribusi antara 1,93 nm – 13,70 nm, sehingga silika tersebut diklasifikasikan sebagai material mesopori (Greg dan Sing, 1982).
Volume pori dan luas permukaan berdasarkan data BJH pada lampiran 2 diperoleh volume pori silika 0,5683 cm3g-1luas permukaan 210,8715 m2g-1.
Dari data BJH diperoleh data adsorbsi-desorbsi nitrogen, distribusi ukuran pori, volume pori silika dan luas permukaan silika yang ditunjukkan pada tabel 4.5 Tabel 4.5 Data karakterisasi BET silika
4.2.4 Scanning Electron Microscopy (SEM)
Untuk melihat morfologi dari permukaan silika amorf yang dihasilkan, dilakukan analisa menggunakan SEM.
Gambar 4.6 Tampilan SEM silika pada suhu 9000C dengan perbesaran1000 x (D)
Dari hasil analisis SEM pada gambar 4.6 ditunjukkan morfologi dari mesopori silika. Dengan perbesaran 1000 kali terlihat morfologi dari mesopori silika dengan permukaan tidak merata dan bentuk yang tidak beraturan. Dari gambar juga terlihat lubang-lubang yang terdapat pada sebagian besar permukaan silika. Dari morfologi permukaan silika menunjukkan bahwa silika mesopori dari limbah kaca berpotensi digunakan sebagai adsorben.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian yang telah dilakukan diperoleh kesimpulan sebagai berikut : 1. Dari hasil penelitian yang telah dilakukan terhadap limbah kaca bening
diperoleh silika mesopori.
2. Hasil karakterisasi silika mesopori yang diperoleh adalah sebagai berikut : - Hasil analisa FT-IR menunjukkan adanya puncak serapan pada 1096 cm-1 yang merupakan puncak serapan dari gugus asimetri Si-O-Si dan puncak serapan pada 796 cm-1 yang merupakan puncak serapan dari gugus simetri Si-O-Si. Dari hasil analisa XRD, menunjukkan silika yang dihasilkan bersifat amorf.
- Hasil adsorpsi-desorpsi isotherm nitrogen silika memperlihatkan adsorbsi isotherm Tipe IV yang merupakan karakteristik untuk material mesopori dan diperoleh distribusi ukuran pori antara 1,93 nm - 13,70 nm, volume pori dan luas permukaan pori masing-masing 0,568 cm3g-1 dan 210,8715 m2g-1. Data ini diperoleh berdasarkan perhitungan BET.
- Dari hasil analisa SEM menunjukkan morfologi dari silika mesopori. Pada perbesaran 1000 kali terlihat morfologi dari mesopori silika dengan permukaan tidak merata serta bentuk yang tidak beraturan dan terdapat lubang-lubang yang pada sebagian besar permukaan silika.
5.2. Saran
BAB II
TINJAUAN PUSTAKA
2.1 Kaca
Kaca adalah salah satu produk industri kimia yang paling akrab dengankehidupan sehari-hari. Dipandang dari segi fisika kaca merupakan zat cair yang sangat dingin. Disebut demikian karena struktur partikel-partikel penyusunnya yang saling berjauhan seperti dalam zat cair, namun kaca sendiri berwujud padat. Dari segi kimia, kaca adalah gabungan dari berbagai oksida anorganik yang tidak mudah menguap, yang dihasilkan dari dekomposisi dan peleburan senyawa alkali dan alkali tanah, pasir serta berbagai bahan penyusun lainnya (Dian, 2001).
Tabel 2.1 Kandungan kimia dari kaca
Komposisi Oksida Kaca
SiO2 72,42
(Sumber : Value-Added Utilisation of waste Glass in Concrete Research
Jurnal, Shayan, 2002)
Senyawa utama yang terkandung dalam limbah kaca adalah silikon dioksida (SiO2) dengan kadar lebih dari 70% dari total campuran senyawanya
(Coleman dkk, 2013). Tingginya kandungan SiO2 dalam limbah kaca dapat
dimanfaatkan dan diolah menjadi silika gel melalui pembentukkan natrium silikat yang dihasilkan dari reaksi antara SiO2 di dalam limbah kaca dengan natrium
hidroksida (Mori, 2003). Larutan natrium silikat yang dihasilkan dapat direaksikan dengan suatu asam hingga membentuk asam silikat yang akan terpolimerisasi menjadi silika gel (Affandi dkk, 2009).
2.2 Silika (SiO2)
Silika (silicon dioxide) merupakan senyawa kimia dengan rumus molekul SiO2 yang dapat diperoleh dari silika mineral dan sintesis kristal. Silika mineral
adalah senyawa yang banyak mengandung SiO2 yang ditemukan dalam bahan
tambang dan galian yang berupa mineral seperti pasir kuarsa dan granit (Kalapathy, 2000).
Selain terbentuk secara alami, silika dengan struktur kristal trimidit dapat diperoleh dengan cara memanaskan pasir kuarsa pada suhu 8700C dan bila pemanasan dilakukan pada suhu 14700C dapat diperoleh silika dengan struktur kristobalit. Silika juga dapat dibentuk dengan mereaksikan silikon dengan oksigen atau udara pada suhu tinggi (Iler, 1979).
Silika atau dikenal dengan silikon dioksida (SiO2) merupakan
Beberapa sifat umum silika :
Nama IUPAC : Silikon dioksida
Nama lain : Kuarsa, silika, silkat oksida, silikon (IV) oksida Rumus molekul : SiO2
Silika ditemukan sedikitnya dalam dua belas bentuk yang berbeda. Bentuk kristal silika yang umum yakni quartz, trydmit, cristobalit, sedangkan bentuk silika amorf berupa endapan silika, silika gel, koloidal sol silika dan silika pyrogenik. Silika amorf sangat berperan penting pada berbagai bidang seperti digunakan sebagai adsorben dan untuk sintesis ultrafilrasi membran, katalis,
support material, dan bidang permukaan yang aplikasinya berhubungan dengan
porositas (Rouqe-Malherbe, 2007).
Bentuk umum dari Kristal silika tersebut bila ditinjau berdasarkan kestabilannya terhadap kenaikan suhu tinggi dapat dibagi atas 3 (McColm, 1983), yaitu :
a. Quartz, sampai pada suhu 870 0C
b. Trydimit, pada suhu 870 0C sampai 1470 0C c. Cristobalit, pada suhu 1470 0C sampai 1730 0C
Masing-masing dari ketiga bentuk diatas memiliki perubahan pada suhutinggi dan rendah dimana strukturnya hanya sedikit berubah oleh perubahan yang sederhana pada orientasi dari SiO4 yang relatif tetrahedral satu sama lain.
Perubahan bentuk pada suhu tinggi memiliki simetri yang lebih tinggi atau memiliki unit sel yang lebih kecil daripada perubahan bentuk pada suhu yang rendah (McColm, 1983). Perubahan bentuknya dapat dilihat sebagai berikut :
Perubahan bentuk Perubahan bentuk 867 0C 1470 0C
Kuarsa Timidit Kristobalit tinggi tinggi tinggi
Perubahan Perubahan Perubahan struktur struktur struktur 573 0C 160 0C 200 – 270 0 Kuarsa Trimidit Kristobalit
Rendah sedang rendah
Trimidit Rendah
Gambar 2.1. Perubahan Polimorf dari silika (Barsoum, 1997)
2.3 Jenis dan Struktur Silika
Pada sebagian besar silikat, atom Si menunjukkan koordinasi tetrahedral dengan 4 atom oksigen yang mengelilingi sebuah atom Si pusat. Masing-masing dari 4 atom oksigen berikatan kovalen setidaknya satu atom silikon dengan yang lain membentuk siloksan, Si-O-Si atau sebuah silanol Si-O-H (Kirk & Othmer, 2001).Silika memliki bentuk amorf dan kristalin. Silika disebut kristalin jika mempunyai susunan atom yang teratur dan disebut amorf jika mempunyai susunan atom yang kurang teratur. Contoh yang paling umum adalah dilihat dalam bentuk kristal kuarsa SiO2 silika. SiO2 memiliki sejumlah kristal yang
Silika terbentuk melalui ikatan kovalen yang kuat serta memiliki struktur dengan empat atom oksigen terikat pada posisi sudut tetrahedral di sekitar atom pusat yaitu atom silikon memperlihatkan struktur silika tetrahedral.
Gambar 2.1. Struktur Tetrahedral Silika (Anonim B, 2013). 2.3.1 Silika Kristal
Silika kristalin memiliki banyak bentuk, bergantung dari orientasi dan posisi dari tetrahedron yang dibentuk. Fenomena ini yang disebut sebagai
polymorphism. Tiga bentuk umum silika kristalin adalah kuarsa, tridimit dan
kristobalit. Pada tekanan atmosferik, silika kuarsa terbentuk pada temperatur 8700C, trimidit terbentuk pada temperatur 870 – 1470 0C, sementara kristobalit terbentuk pada 1470 0C. Struktur dari silika tergantung pada temperatur dan tekanan terbentuknya atau pada kasus tertentu kecepatan pendinginan sehingga padatan silika membentuk struktur yang berbeda (Jones, 2000)
2.3.2 Silika Amorf
Silika amorf tidak memiliki struktur kristalin sebagai mana terlihat pada pengukuran dengan difraksi sinar X (XRD) ditandai dengan bentuk peak yang melebar. Silika amorf memiliki susunan atom dan molekul berbentuk pola acak dan tidak beraturan. Silika amorf dapat terjadi secara alami dan sintetik, keduanya memiliki permukaan berhidrat atau anhidrat. Pada tahun 1987, agen dari WHO (World Health Organization) yaitu IARC (International Agency for Research on
Cancer), mengevaluasi dan membuktikan bahwa silika kristalin bersifat
karsinogen bagi manusia, sedangkan silika dengan bentuk non kristalin atau amorf tidak bersifat karsinogenbagi manusia. Sehingga silika amorf lebih aman dan banyak digunakan di industri (Kirk-Othmer, 2001).
2.4 Sifat Kimia Silika
Silika dalam bentuk amorf memiliki densitas sebesar 2,21 grcm-3 dengan modulus elastisitas sebesar 10 x 106 psi. Kandungan unsur silikon (Si) dan oksigen (O) pada silika jenis ini, adalah 46,7 persen dan 53,3 persen. Nilai kekerasan material ini pada pembebanan tegak lurus dengan menggunakan indentor intan (metode vickers atau knoop) sebesar 710 kgmm-2 sedangkan pada arah pembebanan dengan sudut elevasi diketahui nilai kekerasannya mencapai 790 kgmm-2 (Mantell, 1958).
2.4.1 Reaksi – reaksi
2.4.1.1 Reaksi dengan Asam
Silika relatif silika tidak reaktif terhadap asam kecuali asam hidrofluorida (Basset,J. 1989) seperti reaksi berikut.
SiO2(s) + 4HF(aq) SiF4(aq) + 2H2O(l)
Dalam asam hidrofluorida berlebih reaksinya menjadi: SiO2(s) + 6HF(aq) H2[SiF6](aq) + 2H2O(l) 2.4.1.2Reaksi dengan Basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, sepertidengan hidroksida alkali (Basset,J. 1989)
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l)
Secara komersial, silika dibuat dengan mencampurkan larutan natrium silikat dengan suatu asam mineral. Reaksi ini menghasilkan suatu dispersi peka yang akhirnya memisahkan partikel dari silika terhidrat, yang dikenal dengan silika hydrosol atau asam silikat yang kemudian dikeringkan pada suhu 110oC agar terbentuk silika gel. Reaksi yang terjadi (Bakri, R. 2008) :
Na2SiO3(aq) + 2HCl(aq) H2SiO3(l) + 2NaCl(aq)
2.5 Porositas
Porositas dapat menggambarkan distribusi ukuran pori yang bisa digunakan untuk menggambarkan penyerapan silika. Menurut IUPAC (International Union of Pure and Applied Chemistry), ukuran pori dapat diklasifikasikan menjadi 3 (Brinkmann dkk, 2006), yaitu :
1. Mikropori, diameter lebih kecil dari 2 nm (d < 2 nm)
2. Mesopori, diameter antara 2 sampai 50 nm (2 nm < d < 50 nm) 3. Makropori, diameter lebih besar dari 50 nm (d > 50 nm)
Suatu padatan dapat dikatakan sebagai berpori apabila memiliki pori-pori berupa lubang, terusan (chanel) atau celah yang lebih dalam dari luasnya. Pori-pori memiliki tipe yang berbeda dan diklasifikasikan berdasarkan aliran zat yang masuk melalui pori seperti gambar 2.2. berikut.
Gambar 2.3 Perbedaan jenis pori (Schubert and Husing, 2006)
Tipe pori umumnya diklasifikasikan menjadi dua tipe yaitu: A. Pori yang terisolasi dari pori yang lain disebut closed-pores (a)
B. Pori yang terbuka kepermukaan luar dari padatan, yang dipengaruhi sifatmakroskopik padatan dan tidak aktif dalam reaksi kimia disebut
open-pores yang terdiri dari: bentuk botol tinta (ink-bottle) (b), bentuk silinder
terbuka (c), bentuk (funnel atau slitshaped) (d), pori terbuka pada kedua ujung (through pores) (e), silinder tertutup (silinder blind) (f) dan porositas yang kasar (roughness) pada permukaan luar (g) (Schubert and Husing, 2006).
Luas permukaan dan porositas merupakan karakteristik yang sangat penting pada berbagai material. Penentuan dari isoterm adsorpsi dan desorpsi merupakan variabel yang sangat penting untuk menentukan struktur pori dan metode BET digunakan untuk menentukan total luas permukaan (Brown, 2003).
Dalam karakterisasi pori sering digunakan istilah seperti yang terdapat pada tabel 2.2 berikut ini:
Tabel 2.2. Istilah yang digunakan dalam karakterisasi pori padatan
Istilah Keterangan
Densitas True density Densitas dari material tidak termasuk pori dan
kekosongan interpartikel (densitas dari jaringan
padatan)
Apparent
density
Densitas dari material tertutup dan pori yang
tidak dapat dilalui
Bulk density Densitas material termasuk pori dan kekosongan
interpartikel (massa per total volume, dengan
volume = fase padatan + pori tertutup + pori
terbuka)
Volume pori Vp Volume pori
Ukuran pori Biasanya disebut lebar pori (diameter); jarak dari
dua dinding yang berlawanan
Porositas Perbandingan dari volume total pori Vp dengan
volume yang terlihat (apparent volume) V dari
partikel atau serbuk
Luas Permukaan Area yang tercapai pada permukaan padatan per
satuan unit material
Gambar 2.4 Tipe Grafik Isotherm Adsorbsi Berdasarkan IUPAC (International Union OfPure and Applied Chemistry)
• Tipe I : merupakan karakteristik material mikropori (d < 2 nm)
• Tipe II dan Tipe III : merupakan karakteristik material yang tidak berpori dan makropori (d > 50 nm)
• Tipe IV dan Tipe V : merupakan karakteristik material mesopori (2 nm < d < 50 nm) dimana terdapat pembentukkan multilayer dari kurva adsorbsi dan desorbsi.
• Tipe VI : merupakan karakteristik padatan dua dimensi yang sangat homogen seperti grafit.
Silika berpori merupakan variasi dari bentuk silika amorf. Material berbahan silika banyak diteliti karena memiliki struktur variasi yang luas, dapat diatur pada reaksi hidrolisis dan kondensasi, stabilitas termal yang tinggi pada jaringan amorf dan memiliki kekuatan grafting pada fungsi organik. Silika berpori dibuat dengan mengasamkan larutan silikat basa berair dan diperoleh gel silika pori. Material padatannya diperoleh dengan proses sol-gel dalam larutan yang dikeringkan pada temperatur rendah dimana terjadi penekanan gel menjadi xerogel (Affandi, 2009).
2.6 Karakterisasi Silika
Jenis silika seperti silika amorf atau kristalin dapat ditentukan menggunakan uji FTIR (Fourier Transform Infra Red Spectroscopy) melalui
pengujian gugus fungsional silika dan XRD (X-ray Diffraction) melalui pengujian struktur Kristal silika. Kemurnian silika juga dapat dianalisis secara kualitatif melalui uji FTIR dan XRD. Analisis mengenai luas permukaan spesifik partikel silika yang dihasilkan dapat dilakukan dengan menggunakan BET (Brunauer,
Emmet, Teller) surface area analyzer.
2.6.1. Spektroskopi Infra Merah (FT-IR)
Spektroskopi inframerah telah digunakan untuk analisis bahan di laboratorium selama lebih dari tujuh puluh tahun. Spektrum inframerah merupakan sidik jari dari sampel dengan puncak serapan yang sesuai dengan frekuensi getaran antara ikatan atom yang membentuk materi. Karena setiap perbedaan material adalah kombinasi unik dari atom, sehingga tidak ada dua senyawa menghasilkan spektrum inframerah yang sama. Oleh karena itu, spektroskopi inframerah dapat menghasilkan identifikasi positif (analisis kualitatif) dari setiap jenis materi yang berbeda. Selain itu, ukuran puncak dalam spektrum merupakan indikasi langsung dari jumlah material (Setyawan dkk. 2013).
Teknik spektroskopi IR digunakan untuk mengetahui gugus fungsional, mengidentifikasi senyawa , menentukan struktur molekul, mengetahui kemurnian dan mempelajari reaksi yang sedang berjalan. Senyawa yang dianalisa berupa senyawa organik maupun anorganik. Hampir semua senyawa dapat menyerap radiasi inframerah ( Mudzakir, 2008 ).
Metode spektroskopi IR banyak digunakan karena : - Cepat dan relatif murah
- Dapat digunakan untuk mengidentifikasi
molekul
- Spektrum inframerah yang dihasilkan oleh suatu senyawa adalah khas dan oleh karena itu dapat menyajikan sebuah finger print (sidik jari) untuk senyawa tersebut (Setyawan dkk. 2013).
spektrum getaran tampak bukan sebagai garis-garis melainkan berupa pita-pita. Letak pita dalam spektrum inframerah disajikan sebagai bilangan gelombang atau panjang gelombang. Satuan bilangan gelombang (cm-1) (Silverstein, 1986).
Penetapan secara kualitatif dapat dilakukan dengan membandingkan tinggi peak (transmitansi) pada panjang gelombang tertentu yang dihasilkan oleh zat yang diuji dan zat yang standar. Dalam ilmu material analisa ini digunakan untuk mengetahui ada tidaknya reaksi atau interaksi antara bahan-bahan yang dicampurkan. Selain itu, nilai intensitas gugus yang terdeteksi dapat menentukan jumlah bahan yang bereaksi atau yang terkandung dalam suatu campuran (Silverstein, 1986)
2.6.2 Spektroskopi Difraksi Sinar – X (XRD)
Spektroskopi difraksi sinar-x (X-Ray diffraction / XRD) merupakan salah satu metode karakterisasi material. Teknik ini digunakan untuk mengidentifikasi fasa kristalin dalam material dengan cara menentukan parameter struktur kisi serta untuk mendapatkaan ukuran partikel. Difraksi sinar-x terjadi pada hamburan elastis foton-foton sinar-x oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar x dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar penggunaan difraksi sinar-x untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg (Cullity, 1978) :
n.λ = 2.d.sin θ ; n =1,2,… λ : panjang gelombang sinar-x yang digunakan
d : jarak antara dua bidang kisi
θ : sudut antara sinar datang dengan bidang normal
n : bilangan bulat yang disebut sebagai orde pembiasan
Berdasarkan persamaan Bragg, ketika seberkas sinar-x menumbuk sampel kristal, maka bidang kristal itu akan mendifraksi sinar-x yang memiliki panjang gelombang sama dengan jarak antar kisi dalam kristal. Semakin banyak jumlah
elektron yang terdapat disekeliling atom pada suatu bidang, makin besar intensitas pantulan yang disebabkan oleh bidang tersebut dan menyebabkan makin jelas spot yang terekam pada film. Dengan menggunakan suatu metoda yang dikenal dengan nama metoda sintesis Fourier, kita dapat menghubungkan intensitas spot dengan kepekatan distribusi elektron yang terdapat dalam unit sel. Dengan mengamati kepekatan distribusi elektron dalam unit sel, kita dapat menduga letak atom dalam unit sel tersebut. Atom akan terletak pada daerah-daerah yang mempunyai kepekatan distribusi elektron maksimum (Bird, 1993). 2.6.3 Metode Adsorpsi Brunauer-Emmet-Teller (BET)
Teori BET adsorpsi multilayer untuk menentukan luas permukaan (S) dikembangkan oleh Brunauer, Emmet dan Teller. Proses adsorpsi digambarkan sebagai proses lapisan dengan lapisan (Layer-by-layer), permukaan secara energetik dianggap homogen, medan adsorpsi sama dalam setiap tempat permukaan. Proses adsorpsi dianggap tidak bergerak (setiap molekul yang diadsorbsi pada sisi dasar adsorbsi pada permukaan). Lapisan pertama molekul yang diadsorbsi memiliki energi interaksi dengan medan adsorbs (Ea0) dan
interaksi vertikal antara molekul setelah lapisan pertama (EL0) sama terhadap
panasadsorbat dan molekul yang diadsorbsi tidak berinteraksi secara menyamping(Roque-Malherbe, 2007).
Untuk menerapkan persamaan isotherm BET terhadap data adsorpsi yang diperoleh digunakan persamaan linier berikut:
� = ��.�.�
(��−�).[1+(�−1).� �⁄ �] ……….. (1)
Atau dapat dituliskan sebagai berikut:
V = volume gas yang terserap pada tekanan p Vm = volume gas terserap pada monolayer
C merupakan parameter yang dapat ditentukan dengan cara berikut:
� =�.����1−��
�� ……… (3)
Dengan A adalah konstanta, E1 merupakan panas yang diserap lapisan
pertama dan El adalah panas yang kondensasi dari gas.
Untuk area yang dilewati setiap molekul dalam monolayer dianggap sempurna, dimana untuk nitrogen (N2) = 0,162 nm2 pada 77K dan argon (Ar) =
0,138 nm2 pada 87K (Kanellopoulos, N. 2011).
Metode BET tidak tepat untuk perhitungan mikropori, karena ketika metode ini diterapkan pada adsorben mikro maka akan terjadi penyerapan pada tekanan yang relatif rendah sehingga memungkinkan volume monolayer yang dihitung lebih dari satu lapisan terserap. Jika nilai ini diubah menjadi luas permukaan BET maka nilai yang dihasilkan akan lebih besar dari nilai yang sebenarnya. Meskipun metode BET tidak menggambarkan keadaan yang sebenarnya, namum metode ini yang lebih umum digunakan untuk analisa isotherm adsorbsi. Ini disebabkan metode BET relatif sederhana dan dianggap memberikan kapasitas adsorpsi yang baik dari adsorben yang digunakan (Kanellopoulos, N. 2011).
2.6.4 Scanning Electron Microscopy (SEM)
Prinsip kerja dari SEM adalah dengan menggambarkan permukaan benda atau material dengan berkas elektron yang dipantulkan dengan energi tinggi. Permukaan material yang disinari atau terkena berkas elektron akan memantulkan kembali berkas elektron atau dinamakan berkas elektron sekunder ke segala arah. Tetapi dari semua berkas elektron yang dipantulkan terdapat satu berkas elektron yang dipantulkan dengan intensitas tertinggi. Detektor yang terdapat di dalam SEM akan mendeteksi berkas elektron berintensitas tertinggi yang dipantulkan oleh benda atau material yang dianalisis (Micheler, 2008).
BAB I
PENDAHULUAN
1.1Latar Belakang
Limbah kaca merupakan salah satu limbah anorganik yang terdapat melimpah dengan jumlah mencapai 0,7 juta ton di Indonesia per tahun dan sebagian besar berasal dari botol, peralatan dapur dan bahan bangunan (Ministry
of Environment, 2008). Bahan kaca merupakan salah satu material padat yang
banyak dimanfaatkan dalam kehidupan manusia. Namun sisa kaca yang tidak terpakai akan menimbulkan penumpukan limbah kaca. Limbah kaca biasanya hanya dimanfaatkan sebagai bahan baku perabotan hias. Dalam bidang riset, limbah kaca dapat dimanfaatkan sebagai salah satu bahan baku alternatif dalam pembuatan silika gel karena memiliki kandungan silika (SiO2) yang cukup tinggi,
yaitu 71 – 81% (Jin dkk, 2000).
Senyawa utama yang terkandung dalam limbah kaca adalah silikon dioksida (SiO2) dengan kadar lebih dari 70% dari total campuran senyawanya
(Colemandkk, 2013). Tingginya kandungan SiO2 dalam limbah kaca dapat
dimanfaatkan dan diolah menjadi silika gel melalui pembentukkan natrium silikat yang dihasilkan dari reaksi antara SiO2 di dalam limbah kaca dengan natrium
hidroksida (Mori, 2003). Larutan natrium silikat yang dihasilkan dapat direaksikan dengan suatu asam hingga membentuk asam silikat yang akan terpolimerisasi menjadi silika gel (Affandi dkk, 2009)
Silika dapat diperoleh dari berbagai bahan baku seperti pasir kuarsa, granit, dan fledsfar namun mineral ini memiliki kadar logam pengotor yang besar sehingga sangat sulit untuk memperoleh silika murni (Luh, 1991). Silika (SiO2)
merupakan salah satu bahan yang sangat penting dalam industri, baik anorganik maupun organologam seperti bahan pengisi (filler), bahan pembuatan keramikdan pembuatan gelas. Kualitas bahan yang dihasilkan ini akan meningkat berdasarkan ukuran diameter dan pori silika (Della, 2002).
Silika dihasilkan melalui penggumpalan sol natrium silikat (Na2SiO3). Sol
mirip agar-agar ini dapat didehidrasi sehingga berubah menjadi padatan atau butiran mirip kaca yang bersifat tidak elastis. (Punkels, 2008).
Silika dapat dimanfaatkan sesuai dengan sifat dan karaketrisasinya. Hal ini berhubungan dengan kemurnian, luas permukaan, dan ukuran pori dari silika. Untuk meningkatkan kualitas dari silika maka ukuran partikel yang seragam sangat sering diperhatikan baik dalam bidang sains maupun dalam aplikasi industri, seperti katalis,farmasi, kosmetik,dan makanan (Nabeshi dkk,2011). Sedangkan silika dengan ukuran mesopori kebanyakan digunakan sebagai adsorben, selain itu juga dapat digunakan sebagai penyokong katalis (Pahlepi, R, 2013).
Beberapa penelitian tentang silika telah banyak dilakukan, diantaranya (Madrid, dkk 2012) telah melakukan penelitian mengenai karakterisasi silika dari limbah sekam padi dengan menggunakan kalsinasi pada suhu 5400C selama 2 jam sehingga diperoleh penurunan kontaminan mencapai 90% dan silika yang diperoleh dari sekam padi bersifat amorf.
Proses sintesis silika mesopori telah dilakukan menggunakan natrium silikat dari abu tanaman tebu dengan menggunakan polietilen glikol. Sehingga dihasilkan ruang pada silika setelah dilakukan kalsinasi pada suhu 600oC yang berukuran mesopori (Rahman, 2015).
Proses sintesis silika mesopori telah dilakukan dengan menggunakan metode kalsinasi dari sekam padi sehingga dihasilkan silika yang berukuran mesopori setelah dilakukan kalsinasi pada suhu 9000C (Mars, 2015)
1.2Permasalahan
1. Bagaimana pengaruh suhu kalsinasi terhadap silika yang diperoleh dari limbah kaca.
2. Bagaimana ukuran poridan luas permukaan silika yang diperoleh dari limbah kaca pada pemanasan 9000C.
1.3Tujuan Penelitian
1. Untuk memperoleh silika mesopori dari limbah kaca bening.
2. Untuk mengetahui karakterisasi silika mesopori yangdiperoleh dari limbah kaca bening.
1.4Manfaat Penelitian
Penelitian mengenai silika dari limbah kaca ini diharapkan dapat meningkatkan nilai tambah terhadap silika darilimbah kaca serta menambah wawasan ilmu pengetahuan.
1.5Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Anorganik FMIPA USU Medan. Analisa XRD dan BET dilakukan di Laboratorium Kimia Universitas Negeri Yogyakarta. Analisa FT-IR dilakukan di Politeknik Kimia Industri (PTKI) Medan. Analisa SEM dilakukan di Universitas Negeri Medan (UNIMED).
1.6Metodologi Penelitian
Limbah kaca yang digunakan terlebih dahulu dicuci dengan air bersih untuk menghilangkan pengotor yang menempel pada permukaan kaca. Limbah kaca kemudian dihaluskan dan diayak dengan ayakan ukuran ≤150 mesh. Kemudian diambil serbuk kaca dan ditambahkan NaOH pellet lalu dikalsinasi pada 9000C selama 6 jam. Serbuk kaca hasil pemanasan ditambahkan dengan aquades kemudian disaring. Filtrat penyaringan ditambahkan HCl 1 N hingga pH=7 lalu didiamkan selama 18 jam. Endapan yang terbentuk dicuci beberapa kali dengan menggunakan aquades lalu dikeringkan pada suhu 1200C selama 2 jam. Silika yang terbentuk digerus hingga menjadi serbuk silika. Kemudian serbuk
SINTESIS DAN KARAKTERISASI SILIKA MESOPORI DARI LIMBAH
KACA BENING
ABSTRAK
Telah dilakukan penelitian mengenai sintesis dan karakterisasi silika mesopori dari limbah kaca dengan suhu kalsinasi 900 oC. Silika yang diperoleh dari limbah kaca diekstraksi dengan NaOH pellet diikuti dengan pengendapan menggunakan HCl untuk memperoleh silika. Silika yang dihasilkan selanjutnya dikarakterisasi dengan FT-IR, XRD, BET dan SEM. Dari data FT-IR diperoleh spektrum FT-IR dengan puncak serapan 1096 cm-1 pada gugus asimetri Si-O-Si dan puncak serapan 796 cm-1 dari gugus simetri Si-O-Si. Grafik XRD menunjukkan bahwa silika berbentuk amorf. Hasil adsorbsi - desorbsi nitrogen isotherm silika memperlihatkan adsorbsi isotherm Tipe IV yang merupakan karakteristik material mesopori dan diperoleh distribusi ukuran pori antara 1,93 sampai 13,70 nm serta volume dan luas permukaan silika berdasarkan perhitungan BJH masing-masing 0,568 cm3g-1 dan luas permukaan 210,8715 m2g-1. Dari hasil analisa SEM dengan perbesaran 1000 kali, struktur permukaan silika yang dihasilkan terlihat tidak merata dengan bentuk yang tidak beraturan dan terdapat lubang-lubang pada sebagian besar permukaan silika. Dari morfologi permukaan silika menunjukkan bahwa silika mesopori yang dihasilkan dari limbah kaca berpotensi digunakan sebagai adsorben.
Kata kunci : limbah kaca, silika, mesopori
SYNTHESIS AND CHARACTERIZATION OF MESOPOROUS SILICA
FROM GLASS WASTE
ABSTRACT
Has done research on the synthesis and characterization of mesoporous silica from glass waste by calcination methods in temperature 900 oC. Silica derived from glass waste were extracted with NaOH pellet followed by re-precipitation using HCl to obtain silica. Silica was produced further characterized by IR, XRD, BET and SEM. The result of IR data from silica obtain FT-IR spectrum with wavenumber 1096 cm-1 from asimetric group Si-O-Si and spectrum with wavenumber 796 cm-1 fromsimetric group of Si-O-Si. XRD graph also show that silica was amorf. Isotherm of nitrogen adsorbtion - desorption silica result show that isotherm adsorbtion Type IV was mesophore characteristic and achieved that distribution of pore size between 1,93 untill 13,70 nm along with volume and silica width surface are based on calculation of BJH each 0,568 cm3g-1and 210,8715 m2g-1. From the result of SEM analysis with magnifying 1000, it was found of that silica surface structure looks with irregular shapes and hole of the silica surface. From the silica surface morphology show that the mesoporous silica was produced from glass waste has potential to be used as a adsorbent.
SINTESIS DAN KARAKTERISASI SILIKA MESOPORI DARI
LIMBAH KACA BENING
SKRIPSI
IMELDA ROSA PAKPAHAN
130822007
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2016
SINTESIS DAN KARAKTERISASI SILIKA MESOPORI DARI
LIMBAH KACA BENING
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelarSarjana Sains
IMELDA ROSA PAKPAHAN
130822007
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Sintesis dan Karakterisasi Silika Mesopori Dari Limbah Kaca Bening
Kategori : Skripsi
Nama : Imelda Rosa Pakpahan
Nomor Induk Mahasiswa : 130822007
Program Studi : Sarjana (S1) Kimia Ekstensi
Departemen : Kimia
Fakultas : Matematika Dan
IlmuPengetahuanAlamUniversitas Sumatera Utara
Disetujui di
Medan,September 2016
KomisiPembimbing :
Pembimbing 2 Pembimbing 1
Dr.Hamonangan Nainggolan, M.Sc Dra. Saur Lumban Raja, M.Si NIP. 195606241983031002 NIP. 195506231986012002
Diketahui/Disetujuioleh:
Departemen Kimia FMIPA USU Ketua,
DR.RumondangBulan,MS NIP. 195408301985032001
PERNYATAAN
SINTESIS DAN KARAKTERISASI SILIKA MESOPORI DARI
LIMBAH KACA BENING
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dan ringkasan yang masing-masing disebutkan sumbernya.Medan, September 2016
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan kasih karuniaNya penulis dapat menyelesaikan penyusunan skripsi ini dengan baik.
Dengan rasa hormat, penulis menyampaikan terima kasih kepada IbuDra.Saur Lumban Raja, M.Si selaku pembimbing 1 dan Bapak Dr. Hamonangan Nainggolan, M.Sc selaku pembimbing 2 yang telah banyak membimbing dan memberi arahan selama penyusunan skripsi ini. Terimakasih juga kepada Bapak Prof. Dr. Seri Bima Sembring selaku Ketua Bidang Kimia Anorganik FMIPA USU dan Bapak Dr. Nimpan Bangun, M.Sc selaku Kepala Laboratorium Kimia Anorganik FMIPA USU yang telah memberikan saran – saran kepada penulis. Terima kasih kepada Ibu Dr. Rumondang Bulan, MS dan Bapak Dr. Albert Pasaribu selaku Ketua Departemen dan Sekretaris Departemen Kimia S1 FMIPA-USU Medan. Terimakasih juga kepada Bapak Dr.Darwin Yunus Nasution, MS selaku Ketua Prodi Kimia Ekstensi.
Terimakasih yang sangat dalam juga penulis ucapkan kepada orangtua tercinta, M. Simbolon yang tak pernah berhenti memberi dukungan moril maupun materil serta selalu mengiringi penulis dalam doa, juga kepada abang Roni Boni Pakpahan, dan adik-adik tercinta Dutri Novharisa Pakpahan, Ekalisa Pakpahan, Dela Marehsa Pakpahan dan Riedenisa Pakpahanyang selalu memberikan semangat bagi penulis.
Ucapan terimakasih juga penulis sampaikan kepada seluruhasisten Laboratorium Kimia Anorganik yang membantu peneliti selama proses penelitian. Terima kasih juga kepada banyak pihak yang tidak bisa disebutkan satu – persatu. Semoga Tuhan Yang Maha Esa selalu melimpahkan berkatNya bagi kita semua.
Penulis menyadari bahwa isi skripsi ini masih jauh dari kata sempurna, namun kiranya dapat membrikan manfaat bagi ilmu pengetahuan khususnya di bidang kimia.
Penulis
SINTESIS DAN KARAKTERISASI SILIKA MESOPORI DARI LIMBAH
KACA BENING
ABSTRAK
Telah dilakukan penelitian mengenai sintesis dan karakterisasi silika mesopori dari limbah kaca dengan suhu kalsinasi 900 oC. Silika yang diperoleh dari limbah kaca diekstraksi dengan NaOH pellet diikuti dengan pengendapan menggunakan HCl untuk memperoleh silika. Silika yang dihasilkan selanjutnya dikarakterisasi dengan FT-IR, XRD, BET dan SEM. Dari data FT-IR diperoleh spektrum FT-IR dengan puncak serapan 1096 cm-1 pada gugus asimetri Si-O-Si dan puncak serapan 796 cm-1 dari gugus simetri Si-O-Si. Grafik XRD menunjukkan bahwa silika berbentuk amorf. Hasil adsorbsi - desorbsi nitrogen isotherm silika memperlihatkan adsorbsi isotherm Tipe IV yang merupakan karakteristik material mesopori dan diperoleh distribusi ukuran pori antara 1,93 sampai 13,70 nm serta volume dan luas permukaan silika berdasarkan perhitungan BJH masing-masing 0,568 cm3g-1 dan luas permukaan 210,8715 m2g-1. Dari hasil analisa SEM dengan perbesaran 1000 kali, struktur permukaan silika yang dihasilkan terlihat tidak merata dengan bentuk yang tidak beraturan dan terdapat lubang-lubang pada sebagian besar permukaan silika. Dari morfologi permukaan silika menunjukkan bahwa silika mesopori yang dihasilkan dari limbah kaca berpotensi digunakan sebagai adsorben.
SYNTHESIS AND CHARACTERIZATION OF MESOPOROUS SILICA
FROM GLASS WASTE
ABSTRACT
Has done research on the synthesis and characterization of mesoporous silica from glass waste by calcination methods in temperature 900 oC. Silica derived from glass waste were extracted with NaOH pellet followed by re-precipitation using HCl to obtain silica. Silica was produced further characterized by IR, XRD, BET and SEM. The result of IR data from silica obtain FT-IR spectrum with wavenumber 1096 cm-1 from asimetric group Si-O-Si and spectrum with wavenumber 796 cm-1 fromsimetric group of Si-O-Si. XRD graph also show that silica was amorf. Isotherm of nitrogen adsorbtion - desorption silica result show that isotherm adsorbtion Type IV was mesophore characteristic and achieved that distribution of pore size between 1,93 untill 13,70 nm along with volume and silica width surface are based on calculation of BJH each 0,568 cm3g-1and 210,8715 m2g-1. From the result of SEM analysis with magnifying 1000, it was found of that silica surface structure looks with irregular shapes and hole of the silica surface. From the silica surface morphology show that the mesoporous silica was produced from glass waste has potential to be used as a adsorbent.
Keywords : silica, glass waste, meshopore
DAFTAR ISI
Daftar Tabel viii
Daftar Gambar ix
Daftar Singkatan x
3.3.2 Kalsinasi Serbuk Kaca 19 3.3.3 Pembuatan Larutan Natrium Silikat 19 3.3.4 Pembuatan Silika 19 3.3.5 Karakterisasi Silika 19
3.4 Bagan Penelitian 20
3.4.1 Preparasi Sampel 20 3.4.2 Kalsinasi Serbuk Kaca 21 3.4.3 Karakterisasi Silika 22 BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil Pemurnian Silika 23
4.2 Karakterisasi Silika 26
4.2.1 Spektroskopi Infra Merah (FT-IR) 26 4.2.2 Spektroskopi Difraksi Sinar - X (XRD) 28 4.2.3 Metode Brunauer - Emment - Teller (BET) 30 4.2.4 Scanning Electron Microscopy (SEM) 35 BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan 37
5.2 Saran 37
DAFTAR PUSTAKA LAMPIRAN
DAFTAR TABEL
No. Tabel Keterangan Halaman
Tabel 2.1 Kandungan Kimia Dari Kaca 5
Tabel 2.2 Istilah yang Digunakan Dalam Karakterisasi Pori Padatan 12 Tabel 4.1 Data Literatur Puncak Serapan Silika 28 Tabel 4.2 Pengukuran Difaktogram Silika Hasil Kalsinasi Pada 900 0C 30 Tabel 4.3 Tabel Adsorbsi - Desorbsi Isotherm Nitrogen 31
Tabel 4.4 Tabel Distribusi Ukuran Pori 34
DAFTAR GAMBAR
No. Gambar Keterangan Halaman
Gambar 2.1 Perubahan Polimorf Dari Silika 8
Gambar 2.2 Struktur Tetrahedral Silika 9
Gambar 2.3 Perbedaan Jenis Pori 11
Gambar 2.4 Klasifikasi Isotherm Adsorbsi menurut IUPAC 13 Gambar 4.1 Silika Hasil Pemurnian Pada Suhu 900 0C 24 Gambar 4.2 Spektrum FT-IR Silika Pada Suhu 900 0C 27 Gambar 4.3 Difaktogram XRD Silika Hasil Kalsinasi Suhu 900 0C 29 Gambar 4.4 Grafik Adsorbsi - Desorbsi Isotherm Nitrogen 32 Gambar 4.5 Klasifikasi Isotherm Adsorbsi Menurut IUPAC 33
Gambar 4.6 Grafik Distribusi Ukuran Pori 35
Gambar 4.7 Tampilan SEM Silika Pada Suhu 900 0C 36
DAFTAR SINGKATAN
XRD : X – Ray Diffraction