DENGAN KALSIUM OKSIDA SERTA DAMPAKNYA
TERHADAP STRES DAN KERUSAKAN KULTUR
Saccharomyces cerevisiae
N O V E L I N A
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NOVELINA. Kajian Pengeringan Kemoreaksi dengan Kalsium Oksida Serta
Dampaknya terhadap Stres dan Kerusakan Kultur Saccharomyces cerevisiae.
Dibawah bimbingan : Soewarno T. Soekarto, Betty Sri Laksmi Jenie, Susono
Saono, dan Maggy T. Suhartono.
Penelitian ini bertujuan menghasilkan kultur Saccharomyces cerevisiae kering
yang mempunyai viabilitas tinggi. Proses pengeringan didasarkan pada reaksi kimia
antara CaO dengan air yang menghasilkan panas, kemudian dimanfaatkan dalam proses
pengeringan. Proses pengeringan terjadi pada suhu kamar dalam ruangan yang kedap
udara dari luar, sehingga diharapkan kultur kering yang dihasilkan mempunyai viabilitas
tinggi. Demikian pula dengan mengurangi faktor penyebab stres dan kerusakan sel
selama penyimpanan, maka viabilitas kultur kering tetap terjaga. Parameter-parameter
dalam penentuan stres dan kerusakan kultur kering adalah meliputi penentuan pola
isotermi sorpsi kultur kering, penentuan pola stres dan kematian, perobahan morfologi
dan mikrostruktur sel serta analisis kebocoran dan kerusakan sel.
Hasil pengeringan menunjukkan faktor ketebalan lapisan dan rasio CaO yang
digunakan akan mempengaruhi kecepatan laju pengeringan. Ketebalan lapisan krim
khamir 1.3 mm dan penggunaan CaO sebanyak 10:1 (w/w) akan menurunkan kadar air
dari 80 % (berat basah) menjadi 4.42 % (berat kering) dalam waktu 24 jam. Viabilitas
kultur kering yang dihasilkan adalah 72 %.
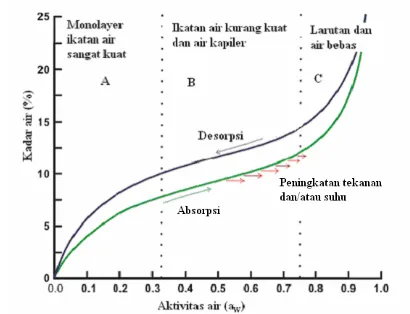
Hasil penentuan isotermi sorpsi air (ISA) dari kultur khamir kering pada RH
(11-97%), diperoleh kurva yang identik dengan pola ISA makanan kering, yaitu sigmoidal
dan terdiri dari 3 area air terikat (primer, sekunder dan tersier). Di daerah air terikat
primer (a
w0-0.25), kebanyakan dari sel kering dalam keadaan dorman. Sementara itu di
daerah air terikat sekunder (a
w0.25-0.77), kebanyakan sel dalam keadaan stres,
sedangkan pada daerah air terikat tersier (a
wdiatas 0.77) kebanyakan sel sudah mati.
Pengamatan morfologi dan mikrostruktur dengan SEM dan TEM, mengungkapkan
bentuk sel dari kultur segar adalah bulat telur dan mempunyai permukaan halus. Dinding
sel bening dan menyatu dengan membran sitoplasma, serta inti sel terlihat jelas. Di
daerah air terikat primer bentuk sel kering berubah dari bulat telur sampai bulat, dinding
sel tebal dan padat, permukaan halus dan inti sel terlihat jelas. Di daerah air terikat
sekunder, bentuk sel adalah bulat, permukaan keriput, dinding sel tipis dan rusak pada
beberapa bagian, dan inti tidak jelas. Di daerah air terikat tersier, sel menempel satu
sama lain dan, tidak berbentuk. Sebagian besar sel rusak, dan sel yang masih utuh
sitoplasmanya berongga dan inti sel tidak terlihat.
Analisa kerusakan dan kebocoran sel dilakukan terhadap tingkat daya hantar
listrik, kadar protein, asam amino, nukleat dan nukleotida serta kadar ion K
+dan Ca
++dari sel khamir. Hasil analisa menunjukkan terjadi peningkatan kebocoran dan
kerusakan sel akibat peningkatan kadar air dari kultur kering. Analisis daya hantar
listrik menunjukkan total ion-ion yang dilepas sel yang rusak kedalam supernatan sel.
Protein dan asam amino komponen utama penyusun sel. Nukleat dan nukleotida
komponen dari inti. Sedangkan K
+dan Ca
++menunjukkan terjadi kebocoran pada
dinding sel dan membran. Kerusakan ini akan mengurangi viabilitas kultur.
NOVELINA. Study of Chemoreaction Drying with Calcium Oxide and Its Impact on the Stress and Damage of Saccharomyces cerevisiae Culture.
Advisor : Soewarno T. Soekarto, Betty Sri Laksmi Jenie, Susono Saono and Maggy T. Suhartono
The objective of the research was to study the parameters of the drying process and their effects on the viability of dried Saccharomyces cerevisiae culture. These parameters include the pattern of water isotherm sorption, the critical water contents, stress and mortality on a variety of bound water conditions, as well as morphological and micro-structural changes of damaged and leaked stressed cells.
Layer thickness of the sample and high ratio used of calcium oxide speed up the drying process. Using a calcium oxide to sample ratio of 10:1 (w/w) for drying, 1.3 mm thickness of sample with 78-80% water content required 24 hours to dry to a final 4.42 % water content. The viability and cell content of the final product were 72% and 109 cells per g dried sample respectively.
A sigmoid curve sorption isotherm pattern consist of 3 bound water regions of the dried yeast culture was similar to that of common dried foods. In the primary area most of the dried cells were dormant, in the secondary area the majority of the cells were under stress condition, while in the tertiary area a lot of them died. Likewise, the viability curve up to aw 0.2 was very low as due to high number of dormant cells, in between aw 0.2 - 0.6 sharply increased due to decreasing number of dormant cells, in between aw 0.6-0.75 sharply decreased due to increasing number of dying cells, and above 0.75 the cells was dying off to totally died.
As shown by SEM observation, normal cells were oval-shaped with a smooth surface. In the primary region the dried cells showed and oval to round shape and small number of deformed cells, in the secondary region wrinkled surface and some number of deformed cells, while in the tertiary region the cells were sticky with wrinkled surface and most cells were damage. Meanwhile, TEM observation showed that the cells in the primary region had a well-defined, thick and solid cell wall with smooth surface with visible nuclei. In the secondary region the cells showed a wrinkled surface with less visible nuclei, while the wall was thin and cracked in some places. In the tertiary region the most number of cells were damaged, the remaining defined cells were flat, empty, irregular shape and no nuclei were visible.
KAJIAN PENGERINGAN KEMOREAKSI
DENGAN KALSIUM OKSIDA SERTA DAMPAKNYA
TERHADAP STRES DAN KERUSAKAN KULTUR
Saccharomyces cerevisiae
NOVELINA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Kajian Pengeringan Kemoreaksi dengan Kalsium
Oksida Serta Dampaknya Terhadap Stres dan
Kerusakan Kultur
Saccharomyces cerevisiae Nama : NovelinaNIM : 975039
Disetujui
Komisi Pembimbing
Prof. Dr. Soewarno T. Soekarto, MSc Prof. Dr.Ir. Betty Sri Laksmi Jenie, MS K e t u a A n g g o t a
Dr. Susono Saono, APU Prof. Dr. Ir. Maggy T. Suhartono A n g g o t a A n g g o t a
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS Prof. Dr. Ir. Syafrida Manuwoto,MSc
Puji syukur ke hadirat Allah SWT, dengan selesainya penulisan disertasi yang
berjudul : Kajian Pengeringan Kemoreaksi Dengan Kalsium Oksida dan Dampaknya
Terhadap Stres dan Kerusakan Kultur Saccharomyces cerevisiae, sebagai salah satu
syarat untuk memperoleh gelar doktor di Program Studi Ilmu Pangan, Sekolah Pasca
Sarjana IPB.
Pada kesempatan ini, penulis menghaturkan terima kasih yang mendalam
disertai penghargaan yang setinggi-tingginya kepada tim pembimbing yaitu Bapak
Prof. Dr. Soewarno Tjokro Soekarto, MSc, sebagai ketua; ibu Prof. Dr. Ir. Betty Sri
Laksmi Jenie, MS; bapak Dr. Susono Saono, APU; dan ibu Prof. Dr. Maggy T.
Suhartono sebagai anggota. Segala saran, petunjuk, perhatian bapak dan ibu sejak dari
perencanaan dan pelaksanaan penelitian hingga proses penulisan disertasi ini telah
memperkaya pengetahuan penulis pada umumnya dan bidang pangan pada khususnya.
Terima kasih kepada bapak Prof. Dr. Rizal Syarief, DSAE, sebagai penguji luar
komisi pada ujian tertutup, bapak Dr. Ir. Ridwan Tahir, MS dan ibu Wellyzar
Syamsuridzal, Ph.D, sebagai penguji luar komisi pada ujian terbuka. Atas saran,
komentar dan masukan yang diberikan, saya pahami sebagai bentuk lain dari
pembimbingan menuju kesempurnaan disertasi ini.
Terima kasih kepada orang tua Bapak Syafri Irsal, BA (Alm) dan ibu Halimah
yang telah menghantarkan penulis untuk dapat menempuh pendidikan S3 ini, serta
kepada adik-adik atas dukungan moril dan doa yang penulis terima. Kepada suami Ir.
Rory Sutanto, MS, terima kasih atas segala dukungan dan semangat yang telah
diberikan selama menempuh pendidikan S3 ini. Kepada putri-putriku yang selalu
menjadi semangat dalam semua kegiatan : Mirsa, Citra, Sinta, dan sikecil Raina yang
hadir diakhir penyelesaian studi ini, terima kasih atas perhatian, dukungan kasih
sayang, pengorbanan, dan doa yang selalu kalian berikan selama ini.
Terima kasih kepada Rektor Universitas Andalas, Dekan Fakultas Pertanian
Penulis dilahirkan pada tanggal 7 November 1957 di kota Padang, Sumatera Barat, merupakan anak ke empat dari sepuluh putra-putri bapak Syafri Irsal, BA (almarhum) dan ibu Halimah.
Penulis menyelesaikan pendidikan sekolah dasar di SD Negeri VIII Padang pada tahun 1971, sekolah menengah pertama di SMP Yos Sudarso Padang pada tahun 1974 dan sekolah menengah atas SMA Negeri I Padang pada tahun 1977. Pada tahun 1977 penulis melanjutkan pendidikan tinggi di Fakultas Pertanian Universitas Andalas Padang dan selesai pada tahun 1983. Pada tahun 1989 penulis berkesempatan melanjutkan pendidikan ke jenjang magister sains program studi Teknologi Pasca Panen, Program Pascasarjana Institut Pertanian Bogor dan selesai pada tahun 1993 dibawah bimbingan Prof. Dr. Soewarno Tjokro Soekarto, Prof. Dr. Ir. Wahjuddin Tjiptadi (almarhum) dan Prof. Dr. Ir. Dedi Fardiaz, MSc. Selanjutnya ada tahun 1997 penulis melanjutkan ke proram doktor pada program studi Ilmu Pangan Sekolah Pascasarjana Institut Pertanian Bogor.
menempuh pendidikan pada jenjang S3.
Terima kasih pada BPPS Departemen Pendidikan Nasional atas dukungan
pembiayaan selama masa studi. Terima kasih pada pimpinan dan staf laboratorium
dilingkungan Jurusan Teknologi Pangan dan Gizi Fateta IPB, PAU Pangan dan Gizi
IPB, PAU Bioteknologi IPB atas bantuan fasilitas dalam pelaksanaan penelitian.
Terima kasih pada pimpinan Lembaga Biologi Molekuler Eijkman Jakarta dan
khususnya pimpinan dan staf laboratorium Mikroskop Elektron atas bantuan fasilitas,
kepercayaan dan kesempatan yang diberikan dalam mempelajari persiapan sampel
hingga penggunaan Mikroskop Elektron Transmisi (TEM). Juga terima kasih pada
pimpinan laboratorium Mikrobiologi dan laboratorium Mikroskop Elektron
US-NAMRU 2 Jakarta atas bantuan fasilitas dan kesempatan mempelajari TEM dan SEM.
Terima kasih kepada bapak dan ibu teknisi yang telah banyak membantu selama
berlangsungnya penelitian, khususnya bapak Mulyono, mbak Ari, mbak Vivi dan juga
rekan-rekan IPN yang banyak memberi dukungan selama masa studi serta kepada
semua pihak yang belum sempat penulis sebutkan satu persatu.
Semoga bantuan, dukungan dan perhatian bapak dan ibu yang penulis terima,
mendapat balasan yang berlipat ganda dari Allah SWT. Akhir kata semoga disertasi
ini dapat memberikan manfaat bagi yang membacanya.
Bogor, Juni 2005
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 5
Proses Pengeringan ... Pengeringan Kultur Mikroba ... 11
Kultur Mikroba Kering ... 15
Stres Kering pada Mikroba ... 19
Khamir Saccharomyces cerevisiae ... 25
Kesetimbangan Kadar Air dan Sorpsi Isotermi Air ... 31
BAHAN DAN METODE ... 38
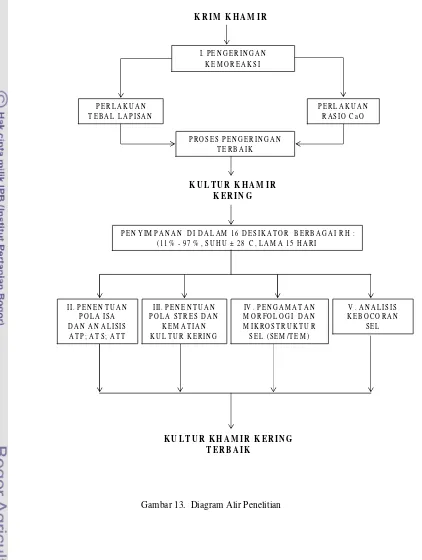
Tempat dan Waktu ... 38
Bahan dan Alat ... 38
Pelaksanaan Percobaan ... 41
Analisis dan Pengamatan ... 53
HASIL DAN PEMBAHASAN ... 56
Produksi kultur Saccharomyces cerevisiae ... 56
Pengeringan Kemoreaksi dengan Kalsium Oksida ... 57
Isotermi Sorpsi Air dan Pengaruh Bahan Pelindung ... 67
Pola Stres dan Kematian Kultur Kering ... 76
Perubahan Morfologi dan Mikrostruktur Kultur Kering ... 86
Kebocoran Sel ... 95
PEMBAHASAN UMUM ... 109
KESIMPULAN DAN SARAN ... 115
DAFTAR PUSTAKA ... 117
LAMPIRAN ... 128
DAFTAR TABEL
Halaman
1. Total impor khamir kering aktif, khamir kering tidak aktif dan
otolisat khamir dari tahun 1998-2003 (BPS 1999 s/d 2004) ... 31
2. Tahapan penelitian, tujuan dan hasil yang diharapkan dari setiap
tahap penelitian ... 44 3. Ringkasan percobaan dari setiap tahap penelitian ... 45 4. Beberapa jenis larutan garam jenuh dan nilai RH yang dihasilkan .... 49 5. Pengaruh tebal lapisan pengeringan terhadap kadar air akhir setelah
pengeringan 48 jam dan viabilitas kultur kering yang dihasilkan ... 62 6. Pengauh rasio pemakaian CaO dan contoh yang dikeringkan terhadap
kadar air akhir dan viabilitas kultur kering yang dihasilkan ... 64 7. Karakteristik khamir kering aktif komersial dan hasil penelitian ... 66 8. Hasil perhitungan kadar air kesetimbangan kultur kering
Saccharomyces cerevisiae pada berbagai pada berbagai nilai aw... 68 9. Perhitungan air terikat primer pada kultur kering kamir dengan model
BET ... 71 10.Perhitungan air terikat sekunder pada kultur kering kamir dengan
model analisis logaritma ... 73 11.Hasil perhitungan air terikat primer, sekunder dan tersier dari kultur
kering Saccharomyces cerevisiae ... 75 12.Hasil pengamatan pertumbuhan kultur kering Saccharomyces
cerevisiae pada berbagai nilai aw ... 78
13.Hasil pengamatan terhadap daya hantar listrik, total ion K dan Ca serta senyawa protein dan asam nukleat yang dilepas dari sel khamir
DAFTAR GAMBAR
Halaman 1. Kurva pengeringan khamir secara mekanis dengan metode
terowongan : Wk1, kandungan air terikat (%); Wp , kadar air khamir setelah pengeringan (%); periode I menunjukan perpindahan air bebas, periode II menunjukan perpindahan
air terikat (Beker dan Rapoport 1987) ... 6
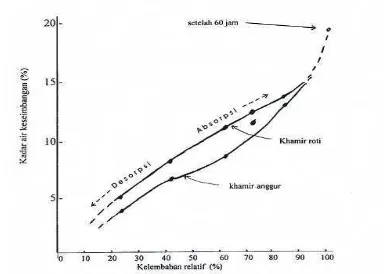
2. Kesetimbangan kadar air khamir tanpa kemasan terhadap kelembaban relatif pada suhu ruang (Dobbs et al. 1982) ... 19
3. Kebocoran dinding sel dan membran plasma S. cerevisiae akibat perlakuan detergen (Y-PER) pembesaran 12 000X (Nowicki dan Liermann, 2002) ... 21
4. Jumlah S. aureus yang tumbuh dari contoh makanan pada aw berbeda setelah 32 hari penyimpanan pada 21.7 0C (Soekarto, 1979)... 22
5. Saccharomyce cerevisiae dengan askus berisi spora dewasa, SW adalah dinding spora, PrM adalah promembran dan N adalah inti (Anonymous, 2004a) ... 24
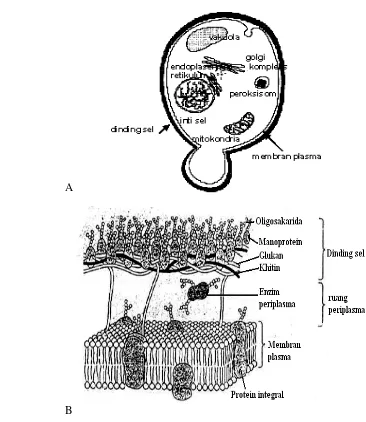
6. A. Skema sel khamir (Van der Rest et al. 1995), B. struktur dinding dan membran sel khamir (Watson et al. 1987) ... 27
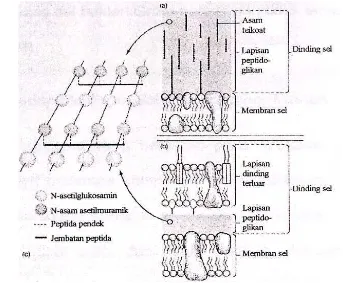
7. Struktur dinding dan membran sel bakteri, (a) Gram positif, (b) Gram negative, (c) lapisan peptidoglikan (Cano dan Calome, 1986) ... 28
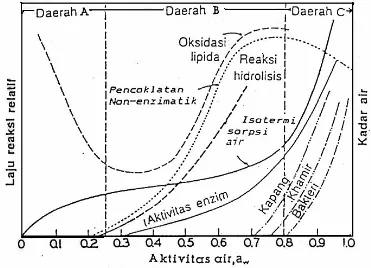
8. Peta stabilitas bahan makanan (Labuza et al. 1970)... 34
9. Klasifikasi kurva isotermi sorpsi air Labuza, 1984)... 35
10.Bentuk umum kurva ISA dengan tiga zona air terikat (Chaplin, 2004) ... 37
11.Kontruksi lemari pengering kemoreaksi dengan 5 rak beserta bagian-bagiannya (Modifikasi Julianti, 2003)... 40
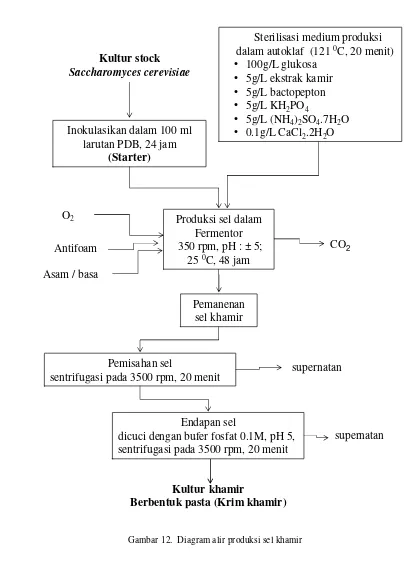
12.Diagram alir produksi sel khamir ... 43
13.Diagram alir penelitian ... 46
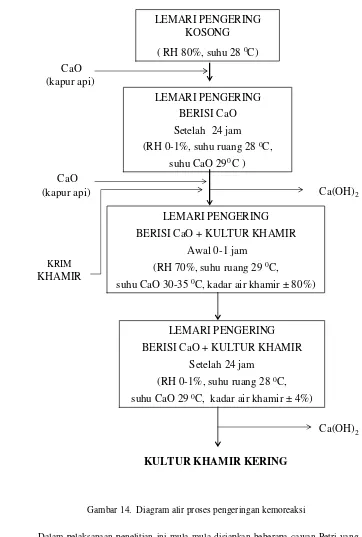
14.Diagram Alir pengeringan kemoreaksi ... 47
15.Kurva pertumbuhan Saccharomyces cerevisiae ... 56
16.Penurunan kadar air dari kultur khamir dengan tiga tingkat ketebalan selama pengeringan kemoreaksi. Lama pengeringan untuk mencapai kadar air 5 % pada ketebalan 1.3 mm adalah t1 dan ketebalan 2.6 adalah t2. ... 56
17. Isotermi sorpsi air kultur khamir kering (Saccharomyces cerevisiae) 69
18.Plot isotermi BET dari kurva isotermi air kltur kering khamir Saccharomyces cerevisiae ... 71
19.Bentuk linear dari isotermi sorpsi kultur kering khamir, terdiri dari air terikat sekunder dan tersier ... 73
20.Jumlah koloni(log N) kultur kering khamir pada daerah air terikat primer, sekunder dan tersier, setelah ditumbuhkan pada media PDA. 79
21.Pola stress dan kematian kultur kering Saccharomyces cerevisiae terhadap aw... 81
23.Log jumlah stres (∆N) khamir kering pada kadar air kesetimbangan
masing-masing daerah air terikat ... 85 24.Persentase stres khamir kering pada kadar air kesetimbangan
masing-masing daerah air terikat ... 85 25.Perubahan morfologi sel dari kultur kering Saccharomyces
cerevisiae pada masing-masing fraksi air, berturut-turut (A) kultur segar, (B) kultur kering pada fraksi air terikat primer,
(C) pada air teikat sekunder, dan (D) pada air terikat tersier ... 88 26.Dinding sel khamir yang pecah dan terbuka ... 89 27.Perubahan mikrostruktur pada kultur kering S. cerevisiae (A) kultur
segar, (B) kultur kering pada fraksi air terikat primer, (C) pada air
teikat sekunder, dan (D) pada air terikat tersier ... 92 28.Penampakan ultra struktur sel kering Saccharomyces cerevisiae
dengan TEM, pembesaran 145 000 kali. Keretakan membrane
plasma (tanda panah) (Beker dan Rapoport, 1987) ... 94 29.Hubungan linear peningkatan daya hantar listrik dengan kadar air
kesetimbangan dari kulutr kering khamir ... 99 30.Hubungan daya hantar listrik dengan viabilitas kultur kering
Saccharomyces cerevisiae... 100 31.Pengaruh berbagai air terikat pada kultur kering Saccharomyces
cerevisiae terhadap jumlah ion-ion K+dan Ca++ yang dilepas... 102 32.Hubungan jumlah ion-ion K+ dan Ca++ yang dilepas terhadap
viabilitas kultur kering Saccharomyces cerevisiae ... 103 33.Pengaruh kondisi air terikat terhadap kebocoran material yang
keluar dari sel yang bocor dan terdeteksi pada panjang gelombang
260 nm dan 280 nm spektrofotometer uv ... 106 34.Hubungan viabilitas kultur kering Saccharomyces cerevisiae
DAFTAR LAMPIRAN
Halaman 1. Pengaruh ketebalan lapisan pengeringan terhadap kadar air
kultur Saccharomyces cerevisiae... 129 2. Pengaruh penggunaan kapur Api (CaO) pada proses pengeringan
kultur Saccharomyces cerevisiae dengan ketebalan lapisan
1.3 mm terhadap kadar air ... 129 3. Data hasil penimbangan kultur kering Saccharomyces cerevisiae
setelah penyimpanan dalam desikator pada berbagai RH ... 130 4. Data hasil penimbangan kultur kering Saccharomyces cerevisiae
+ 2% agar-agar setelah penyimpanan dalam desikator pada
berbagai RH... 131 5. Data hasil penimbangan kultur kering Saccharomyces cerevisiae
+ 2 % CMC setelah penyimpanan dalam desikator pada
berbagai RH ... 132 6. Total koloni kamir kering dari berbagai daerah air terikat, yang
ditumbuhkan pada media PDA dan PDA + 7.5% NaCl... 133 7. Total koloni kamir kering + 2% agar-agar dari berbagai daerah air
terikat, yang ditumbuhkan pada media PDA dan PDA + 7.5% NaCl 134 8. Total koloni kamir kering + 2% CMC dari berbagai daerah air terikat, yang ditumbuhkan pada media PDA dan PDA + 7.5% NaCl ... 135 9. Data pengukuran daya hantar listrik (DHL) dari air rendaman
sel yang bocor karena pengaruh berbagai aw ... 136 10.Data hasil analisis K+ dan Ca++ yang tertinggal dari sel yang
bocor karena pengaruh berbagai aw penyimpanan ... 136 11.Data absorbansi material yang keluar pada air rendaman sel yang
bocor dan terdeteksi pada panjang gelombang 260 dan 280
spektrofotometer uv ... 137 12.Penentuan air terikat primer dengan persamaan BET dari kurva
sorpsi isotermi ... 138 13.Penentuan air terikat sekunder dengan persamaan logaritma
kurva sorpsi isotermi ... 139 14.Penentuan air terikat tersier dengan menggunakan persamaan
polynomial kurva sorpsi isotermi pada ordo 2 ... 140 15.Penentuan air terikat tersier dengan menggunakan persamaan kuadrat 141 16.Komposisi kimia dari kapur api ... 142 17.Contoh perhitungan kadar protein dan asam nukleat berdasarkan
Hukum Beer (Penner, 1994) ... 143
Latar Belakang
Saccharomyces cerevisiae adalah salah satu jenis khamir yang cukup
banyak digunakan sebagai inokulum berbagai proses industri, antara lain dalam
produksi roti, cake, minuman beralkohol, dan industri etanol. Penggunaan
lainnya adalah untuk menghasilkan produk-produk seperti biomassa, ekstrak
khamir, autolisat, komponen flavor, protein sel tunggal dan sebagainya. Kultur
starter yang banyak digunakan untuk mendukung pertumbuhan industri-industri
tersebut adalah dalam bentuk kering, karena akan memudahkan cara
penanganan, penyimpanan, distribusi dan transportasi. Selanjutnya juga
memungkinkan penggunaan starter baru pada setiap lot fermentasi, sehingga
fermentasi lebih terkendali dan kualitas produk yang dihasilkan lebih terjamin.
Kebutuhan khamir kering untuk mendukung industri-industri tersebut
cukup besar dan sampai sekarang produk khamir masih diimpor dari beberapa
negara. Total impor Indonesia terhadap produk khamir kering aktif selama tahun
2003 adalah 2.277.538 kg dengan nilai 5.464.114 US$ (BPS 2004). Jumlah dan
nilai impor ini dari tahun ketahun cenderung terus meningkat dengan
berkembangnya industri makanan di Indonesia (data pada Tabel 1). Diantara
negara-negara yang terbesar nilai impornya ke Indonesia adalah Hongkong,
China, Australia, Amerika Serikat, Turki, Inggris, Belanda, Perancis, dan Belgia.
Metode pengeringan kultur pada saat ini telah semakin berkembang seperti
perkembangan teknologi lainnya, diantaranya adalah metode pengeringan vakum
(vacuum drying), pengeringan semprot (spray drying), pengeringan beku (freeze
drying) dan metode fluidized. Metode pengeringan dengan suhu rendah atau
pengeringan dingin seperti pengeringan beku dan pengering vakum mempunyai
potensi cukup baik dalam mempertahankan viabilitas kultur mikroba, sehingga
mutu dan kestabilan produk yang dihasilkan cukup tinggi. Pengeringan dingin
juga dapat berlangsung dengan udara ambien di daerah yang beriklim sangat
kering, namun proses pengeringannya sangat lama.
Salah satu metode pengeringan dingin yang cukup potensial tetapi belum
atau kemoreaksi. Prinsip pengeringan absorpsi adalah dengan menggunakan
absorben yang akan menyerap uap air dari bahan basah, contoh absorben yang
sering digunakan adalah gel silika. Sedangkan pengeringan kemoreaksi adalah
dengan menggunakan kalsium oksida (CaO) yang terkandung didalam kapur api.
Kalsium oksida (CaO) kemudian bereaksi dengan uap air didalam ruang
pengering dan menghasilkan energi panas. Energi panas dipakai untuk
meng-uapkan air dari bahan lembab, sehingga bahan menjadi kering. Selama proses
pengeringan kemoreaksi berlangsung suhu udara didalam ruang pengering tetap
rendah, sehingga tidak merusak bahan yang sensitif oleh panas.
Kajian tentang CaO pada kapur api telah diteliti di Institut Pertanian
Bogor, diantaranya untuk pengeringan absorpsi terhadap biji lada (Halim 1996
dan Wulandari 2002), mempelajari karakteristik pengeringan dengan CaO
(Fuadi 1999), pengeringan absorpsi benih tomat (Suzana 2000). Disamping itu
juga digunakan untuk pengeringan brem padat di daerah lembab seperti Bogor
(Hersasi 1996), laju pengeringan absorpsi dengan kapur api terhadap filet ikan
(Asikin 1998), dan kajian perilaku pengeringan dengan CaO untuk materi hidup
(Julianti 2003).
Menurut hasil penelitian Julianti (2003) diketahui CaO tidak memiliki
isotermi sorpsi air, dan pengikatan air oleh CaO bukan secara absorpsi tetapi
melalui reaksi kimia (kemoreaksi). Selanjutnya juga diketahui bahwa CaO
merupakan bahan yang sangat reaktif terhadap air dan pada saat penentuan kadar
air kesetimbangan dengan berbagai nilai RH dalam desikator, ternyata CaO
bereaksi dengan semua air yang terdapat dalam desikator. Oleh sebab itu istilah
pengeringan kemoreaksi lebih tepat digunakan dalam proses pengeringan yang
menggunakan CaO (komponen utama pada kapur api).
Pengeringan kemoreaksi lebih ditujukan untuk mengeringkan bahan-bahan
yang mempunyai nilai ekonomis tinggi dan sangat sensitif oleh panas seperti
kultur mikroba yang merupakan komponen hidup, pengeringan bahan volatil
untuk mencegah kehilangan minyak atsiri, dan untuk mempertahankan viabilitas
dalam pengeringan benih.
Proses pengeringan kultur mikroba menyebabkan sel kehilangan air yang
di dalam sel sehingga proses metabolisme dan aktivitas seluler berhenti atau sel
berada pada masa istirahat (dorman). Kondisi kering ini juga menyebabkan sel
mengalami stres, tetapi bila dipindahkan pada medium tumbuh yang sesuai
mikroba akan dapat tumbuh normal kembali. Disamping proses pengeringan,
faktor-faktor lain yang dapat menyebabkan stres pada mikroba adalah
pemanasan, pembekuan, aktivitas air (aw) rendah, radiasi, senyawa anti mikroba,
konsentrasi oksigen rendah dan sebagainya.
Sama dengan produk pangan kering lainnya, kultur kering bersifat sangat
higroskopis sehingga kadar airnya akan meningkat. Hal ini terjadi karena kultur
kering dapat menyerap uap air dari udara lembab dilingkungan penyimpanannya.
Peningkatan kadar air dapat memulai reaksi-reaksi kimia dan biokimia didalam
sel, sehingga kestabilan kultur kering dapat terganggu. Peningkatan kadar air
yang semakin tinggi dapat merusak mikroba yang stres, sehingga mikroba akan
mati.
Kerusakan kultur mikroba kering akibat peningkatan kadar air juga dapat
menyebabkan kebocoran sel. Kebocoran terdeteksi dengan adanya ion-ion
mineral seperti K+, Na+, Ca++, dan Mg++, serta bahan-bahan lain seperti protein
dan nukleotida yang terdapat pada supernatan atau air rendaman sel (Hurst 1984;
Bunduki et al. 1995; dan Park et al. 2003).
Berdasarkan hal diatas perlu diketahui kondisi kadar air kritikal dalam
penyimpanan kultur kering, agar viabilitasnya dapat terjaga dan kerusakan sel
akibat peningkatan kadar air dapat dihindari. Kadar air kritikal dapat ditentukan
dari kurva isotermi sorpsi air dengan menganalisis kapasitas masing-masing
daerah air terikat dari kurva isotermi tersebut.
Tujuan Penelitian
1. Mengkaji metode pengeringan kemoreaksi dengan kalsium oksida serta
menganalisis parameter dalam proses pengeringan yang berpengaruh
terhadap viabilitas kultur kering Saccharomyces cerevisiae yang dihasilkan.
2. Menerangkan pola isotermi sorpsi air dan menganalisis kadar air kritikal
3. Menerangkan pola stres dan kematian kultur kering Saccharomyces
cerevisiae pada berbagai kondisi kadar air terikat.
4. Mengamati perubahan morfologi dan mikrostruktur serta kerusakan kultur
kering.
5. Menganalisis terjadinya kebocoran sel yang mengalami stres dan kerusakan.
Kegunaan Penelitian
1. Mengembangan teknologi pengeringan kemoreaksi dengan kalsium oksida
untuk produksi kultur kering mikroba.
2. Memberikan data dasar tentang faktor-faktor yang berperan dalam proses
pengeringan kemoreaksi dan dampaknya terhadap viabilitas kultur starter
kering sehingga diperoleh efisiensi proses pengeringan dan viabilitas tetap
terjaga.
3. Memberikan data dasar mekanisme stres kering pada kultur Saccharomyces
cerevisiae dan menentukan teknik yang tepat untuk mengurangi stres, yang
berdampak pada perubahan morfologi dan kerusakan serta proses biokimia
TINJAUAN PUSTAKA
Proses Pengeringan
Pengeringan merupakan proses pengurangan kadar air bahan sampai
mencapai kadar air tertentu sehingga dapat menghambat laju kerusakan bahan
makanan sebelum bahan diolah atau dimanfaatkan. Selanjutnya menurut Fellows
(1990) definisi pengeringan adalah proses pengeluaran sebagian besar air yang
secara normal terdapat dalam bahan pangan, melalui proses penguapan atau
sublimasi dengan kondisi yang terkendali.
Parameter-parameter yang mempengaruhi waktu pengeringan adalah suhu,
kelembaban udara, laju aliran udara, kadar air awal dan kadar air bahan kering.
Tujuan utama dari pengeringan adalah untuk memperpanjang umur simpan
bahan pangan melalui penurunan aktivitas air (Fellows 1990).
Batasan umum pengeringan, yaitu suatu proses mengeluarkan air dari
bahan pangan dengan cara penguapan atau sublimasi, hingga terjadi penurunan
kandungan air bahan sampai batas enzim dan reaksi-reaksi yang menyebabkan
kerusakan pada bahan dapat dihambat aktivitasnya, dan bahan menjadi lebih
awet. Proses penguapan air dari bahan dapat dilakukan dengan menggunakan
energi panas (pada pengeringan dengan suhu tinggi) atau dengan cara
dehumi-fikasi (penurunan RH) ruangan sehingga terjadi keseimbangan antara bahan dan
lingkungannya.
Prinsip Pengeringan
Prinsip utama pengeringan adalah pengeluaran air dari bahan berdasarkan
pindah massa internal (Chirifie 1983 didalam Barbosa-Canovas dan
Vega-Mecado 1996). Laju perpindahan uap air dari bahan ke udara tergantung pada
sifat fisik bahan, komposisi bahan, kadar air awal, kelembaban udara, laju aliran
udara, dan tekanan pada permukaan bahan yang langsung berhubungan dengan
udara (Okos et al. 1992).
Selanjutnya menurut Barbosa-Canovas dan Vega-Mercado (1996)
mekanisme fisik untuk menjelaskan gerakan air di dalam bahan terdiri dari 6
cairan karena adanya perbedaan konsentrasi, 3) difusi permukaan, 4) difusi uap
air di dalam pori-pori yang berisi udara, 5) aliran karena adanya perbedaan
tekanan, dan 6) aliran karena terjadinya penguapan dan kondensasi.
Sedangkan mekanisme penguapan air dari bahan pangan menurut Brooker
et al. (1982), meliputi proses : 1) pelepasan ikatan air dari bahan pangan, 2)
difusi air dan uap air ke permukaan, 3) perubahan fase dari air menjadi uap air,
4) perpindahan uap air dari permukaan ke udara sekitar dan 5) perpindahan uap
air di udara.
Menurut Beker dan Rapoport (1987) bentuk kurva pengeringan secara
umum terlihat pada Gambar 1. Laju pengeringan cepat ditunjukkan pada
periode I yang dihubungkan dengan kehilangan air bebas, sedangkan laju
pengeringan lambat pada periode II dihubungkan dengan kehilangan air terikat.
Kecepatan pengeringan dapat dipengaruhi oleh suhu dan kecepatan udara
pengering, kadar air, ukuran dan bentuk granula khamir yang dikeringkan.
Gambar 1. Kurva pengeringan khamir secara mekanis dengan metode tero- wongan: Wk1, kandungan air terikat (%); Wp, kadar air dari khamir
Pengeringan bahan-bahan yang peka terhadap suhu tinggi seperti kultur
mikroba, enzim, vaksin dan bahan-bahan volatil, diperlukan proses pengeringan
pada suhu rendah supaya viabilitas kultur mikroba dan mutu bahan-bahan
tersebut tetap terjaga. Proses pengeringan suhu rendah yang dapat dilakukan
adalah pengering vakum, pengering beku dan pengering absorpsi atau
pengeringan kemoreaksi.
Pengeringan Absorpsi
Proses pengeringan absorpsi adalah proses pengeringan dimana air dalam
bahan diserap oleh suatu material yang bersifat sangat higroskopis yang disebut
absorben. Dalam proses pengeringan absorbsi sejumlah bahan dan absorben
diletakkan dalam suatu ruangan yang tertutup rapat. Absorben yang digunakan
memiliki tekanan uap air yang sangat rendah dibandingkan dengan bahan yang
akan dikeringkan.
Mekanisme yang terjadi adalah proses penarikan air oleh absorben dari
dalam bahan pangan dengan prinsip penyerapan uap air dari bahan tersebut. Air
yang diserap oleh absorben tidak hanya pada bagian permukaan absorben
tersebut, tetapi terdistribusi secara merata keseluruh bagian absorben (Hall
1979). Proses pengeringan absorbsi tidak menggunakan aliran udara pengering
dengan suhu tinggi, tetapi faktor yang mempengaruhi proses pengeringan adalah
kelembaban udara (RH) di dalam ruang pengering.
Menurut Henderson dan Perry (1976) proses pengeringan diterangkan
melalui teori tekanan uap. Air yang diuapkan terdiri dari air bebas dan air
terikat, dalam hal ini air bebas adalah air yang berada di permukaan bahan dan
yang pertama kali mengalami penguapan. Bila air permukaan telah habis, maka
terjadi migrasi air dan uap air dari bagian dalam bahan secara difusi. Migrasi air
dan uap terjadi karena perbedaan konsentrasi atau tekanan uap antara bagian
dalam dan bagian luar bahan.
Material yang sering digunakan sebagai absorben untuk pengeringan
dapat berbentuk gel padat atau cairan, contohnya gel silika, CaCl2, kalsium
sulfat, CaO dan sebagainya. Gel silika adalah absorben berbentuk padat yang
banyak digunakan untuk menjaga kelembaban dalam ruang penyimpanan
digunakan sebagai bahan yang dapat menjaga kestabilan kadar air bahan yang
disimpan dalam desikator. Selama ini penggunaan absorben untuk pengeringan
terutama adalah dalam pengeringan biji-bijian dan produk-produk yang
mempunyai aroma khas seperti kopi dan tembakau.
Berdasarkan percobaan Hu et al. (1998) pengeringan absorpsi
mengguna-kan gel silika terhadap viabilitas benih barley, oat, dan kenaf pengaruhnya
hampir sama dengan pengeringan beku. Keuntungan lainnya yaitu dapat
mencapai kadar air yang lebih rendah dan biayanya jauh lebih murah dari
pengeringan beku, walaupun laju pengeringan absorpsi sedikit lebih lambat.
Bentonit (CaCl2) sering digunakan sebagai desikan dalam proses
pengeringan maupun sebagai dehumidifier udara selama penyimpanan terutama
di malam hari, karena dapat memberi aerasi pada biji-bijian kering serta
mempertahankan kadar air yang seragam dan suhu selama penyimpanan
biji-bijian (Thorruwa et al. 1998). Zeolit digunakan untuk pengeringan biji-biji-bijian
seperti jagung (Alikhani et al. 1992). Kalsium sulfat digunakan untuk
pengeringan kopi beraroma tinggi seperti kopi instan (Cormaci 1994) serta pada
pembuatan anhydrous trehalose (Mandai et al. 1994). Glikol, gliserol dan
polihidrik alkohol lainnya secara rutin digunakan sebagai desikan dan humektan
untuk mengendalikan RH pada sistem gas alam, bahan pangan dan tembakau
(James 1973). Selanjutnya desikan cair dari campuran CaCl2 dengan litium
klorida (LiCl2) dengan perbandingan yang sama, juga digunakan oleh Ertas et
al. (1997) untuk pengeringan kacang tanah.
Kalsium oksida (CaO) merupakan bahan aktif dari kapur api yang selama
ini juga dipakai sebagai absorben atau desikan dalam pengeringan dan
penyimpanan beberapa produk pangan. Sedangkan hasil penelitian Julianti
(2003) menyatakan bahwa CaO tidak memiliki isotermi sorpsi air, dan CaO
merupakan bahan yang sangat reaktif terhadap air, oleh karena itu kemampuan
kapur api untuk menyerap uap air dari lingkungan sekitarnya didasarkan pada
reaktivitas kimia dan bukan melalui absorpsi fisik seperti halnya absorben
lainnya. Oleh karena itu pengeringan dengan kapur api atau CaO lebih tepat
Pengeringan Kemoreaksi
Pengeringan kemoreaksi adalah proses pengeringan yang juga
menggunakan absorben, tetapi melalui mekanisme reaksi kimia antara uap air
dari bahan yang dikeringkan dengan absorben, karena reaktivitas absorben yang
tinggi terhadap air. Kapur api yang mengandung bahan aktif CaO merupakan
absorben yang banyak digunakan dalam proses pengeringan ini. CaO bereaksi
secara kimia dengan uap air yang terdapat di dalam bahan yang dikeringkan
sehingga kadar air bahan akan berkurang.
Mackenzie dan Sharp (1970) menyatakan bahwa CaO terbentuk apabila
batu kapur (CaCO3) dipanaskan pada suhu diatas 650 0C. Sebaliknya reaksi
pembentukan CaO dari CaCO3 merupakan reaksi endoterm yang bersifat
reversibel. Menurut Chang dan Tikkanen (1989) reaksi CaO dengan air
merupakan reaksi eksoterm yang akan melepaskan energi panas sebagai berikut :
CaO (S) + H2O (1) Ca (OH)2 (S) + ∆H = - 64.8 KJ
Kapur api mempunyai kandungan CaO sekitar 96.8% - 97% dan
bahan-bahan lainnya seperti SiO2, R2O3 (gabungan oksida-oksida), MgO dan
bahan-bahan lain yang hilang saat pembakaran. Hasil penelitian (Sucofindo 1991 di
dalam Julianti 2003) diketahui juga bahwa kapur api yang baru keluar dari
pembakaran tidak mengandung air. Oleh karena itu kapur api ini bersifat sangat
higroskopis dan sangat baik digunakan sebagai absorben dalam pengeringan
kemoreaksi.
Kalsium oksida ( CaO) juga dikenal sebagaiQuicklime atau kapur mentah
dan mempunyai kapasitas penyerapan uap air yang lebih besar pada RH rendah
dibanding absorben atau desikan lainnya. Kapasitas penyerapan uap air oleh
CaO minimal adalah 28.5% dari beratnya. Sebagian besar digunakan dalam
pengemasan makanan kering, tetapi penggunaan kemasan makanan harus
diperhatikan karena sifat CaO yang dapat hancur selama penyimpanan (Anonim
2004b).
Menurut Soekarto (2000), prinsip pengeringan dengan CaO di dalam
lemari pengering absorpsi berlangsung melalui proses penting sebagai berikut :
(1) CaO menyerap dan bereaksi dengan uap air dalam ruangan pengering; (2)
pengering; (3) energi panas diserap bahan untuk menguapkan kandungan air
meninggalkan bahan; (4) uap air dari bahan mengalir ke ruang pengering untuk
kemudian diserap CaO. Proses tersebut berlangsung secara terus menerus
sampai tercapai kondisi kesetimbangan atau ekuilibrium.
Antara CaO dan air bereaksi secara eksotermik untuk membentuk
Ca(OH)2. Peningkatan reaksi yang bersifat eksotermik tersebut, menghasilkan
peningkatan suhu selama pengeringan berlangsung konstan (Soekarto 2000).
Reaksi kimia yang terjadi antara CaO dan uap air selama pengeringan adalah :
CaO+ H2O Ca(OH)2 - • H (Joule)
Bahan lembab + • H Produk kering + H2O
CaO + Bahan lembab Produk kering + Ca (OH)2
Keuntungan Pengeringan Kemoreaksi
Beberapa peneliti sebelumnya telah menggunakan teknik pengeringan
dengan CaO dari kapur api untuk mengeringkan berbagai produk, dan hasilnya
ternyata cukup menguntungkan. Diantaranya oleh Halim (1996) untuk
penge-ringan biji lada, dimana penggunaan kapur api sebagai bahan pengering, dapat
menekan penguapan minyak atsiri dari lada segar menjadi 2.8% - 3.1%.
Dibandingkan pengeringan dengan sinar matahari penurunan kadar minyak atsiri
adalah sebanyak 10.65% dan pengeringan dengan oven penurunan minyak atsiri
sebanyak 17.80%.
Wulandari (2002) juga menggunakan kapur api untuk pengeringan lada
pada suhu ruang (29 0C). Selama pengeringan penurunan kadar minyak atsiri
lada relatif kecil yaitu 1.74% - 4.87%. Sedangkan pengeringan dengan metode
oven dan penjemuran, penurunan kadar minyak atsiri berturut-turut adalah 17.8
% (metode oven) dan 10.65% (penjemuran). Rasio (berat/berat) kapur dan lada
R 2 (1:2); R 5 (1:5); dan R 20 (1:20) dapat digunakan untuk mengeringkan lada
sampai kadar air 12 % basis basah. Semakin besar tingkat R waktu pengeringan
semakin singkat yaitu berturut-turut 89 jam (untuk R 20), 92.3 jam (untuk R 5)
dan 119.5 jam (untuk R 2).
Pengeringan terhadap biji pala bertempurung dengan kapur api, waktu
dengan penjemuran yaitu 7 hari (rata-rata penjemuran 3 jam / hari). Rendemen
minyak atsiri kedua metode tersebut juga tidak berbeda nyata, yaitu sebesar 11,
78% pada pengeringan dengan kapur api, dan 10.92% pada penjemuran.
Walaupun demikian, biji pala yang dikeringkan dengan pengeringan
menggunakan kapur api memiliki penampakan yang paling baik (Suryani 1999).
Penggunaan kapur api untuk pengeringan benih tomat selama satu hari
dapat menghasilkan benih tomat kering dengan kadar air 5.5% basis basah. Uji
viabilitas menunjukkan daya kecambah yang cukup baik yaitu antara 70%
sampai 94.5% (Suzana 2000). Sedangkan pengeringan benih cabe oleh Julianti
(2003), diperoleh perbandingan kapur dan benih yang optimal untuk
menghasilkan mutu yang tinggi adalah 3 :1. Kadar air akhir benih cabe yang
dihasilkan adalah sekitar 3.8% (bk) dengan lama pengeringan 45 jam, dan
viabilitas benih yang dihasilkan adalah 100%. Disamping itu terdapat hubungan
yang jelas antara fase laju pengeringan dengan fraksi-fraksi air terikat pada
benih cabe, yaitu periode (1) air yang dikeluarkan air bebas murni, periode (2)
air terikat tersier dan sebagian air terikat sekunder, periode (3) air terikat
sekunder dan air terikat primer, serta periode (4) air terikat primer.
Penggunaan CaO juga dilakukan untuk pengeringan brem padat di daerah
Bogor yang kelembapannya cukup tinggi. Waktu yang diperlukan untuk
mengeringkan brem padat secara tradisional (pada suhu kamar), biasanya
membutuh-kan waktu 18 jam untuk mencapai kadar air 16%. Sedangkan dengan
menggunakan CaO diperlukan waktu 12 jam, disamping itu brem yang
dihasilkan berwarna cerah dan tidak mudah patah (Hersasi 1996).
Pengeringan Kultur Mikroba
Pengeringan kultur mikroba terutama bertujuan untuk menyediakan kultur
starter dalam jumlah banyak yang diperlukan oleh industri produk fermentasi,
seperti industri minuman beralkohol, industri roti, obat-obatan dan sebagainya.
Berbagai metode pengeringan kultur telah banyak dilakukan oleh peneliti,
dimana proses pengeringan kultur pada prinsipnya hampir sama dengan
Metode pengeringan yang umum digunakan untuk pengeringan mikroba
adalah dengan metode terowongan, pengeringan fluidized bed, pengeringan
vakum dan pengeringan semprot, sedangkan untuk pengawetan kultur murni
mikroba digunakan pengeringan beku dan pengeringan vakum.
Pengeringan Vakum
Menurut Tamine dan Robinson (1985) proses pengeringan vakum terhadap
spesies bakteri asam laktat, meliputi penambahan starter cair dengan laktosa dan
Ca-karbonat (untuk menetralkan kelebihan asam), pemisahan whey dan proses
pengeringan dalam kondisi vakum.
Proses pengeringan starter yoghurt dengan metode oven vakum pada suhu
50 0C, tekanan vakum 29 mmHg dan lama pengeringan 4 jam menghasilkan
viabilitas yang lebih tinggi dibandingkan metode pengeringan dengan oven
biasa. Pada pengeringan menggunakan oven vakum diperoleh viabilitas 79%
yang kadar airnya adalah 4.44% hingga 9.05% (Nuraida et al. 1994).
Jenie et al. (1996) menggunakan metode pengeringan vakum pada suhu 40
0
C selama 4 jam untuk produksi kultur starter kering Lactococcus lactis.
Viabilitas sel yang dicapai adalah 58 % yaitu dari perlakuan media pertumbuhan
dengan ekstrak sawi dan pencampuran bahan pengisi tepung beras dan kultur
dengan perbandingan 1:2. Selanjutnya untuk pengeringan kultur Lactobacillus
plantarum dengan metode pengeringan vakum menggunakan suhu 50 0C selama
4 jam, dihasilkan viabilitas tertinggi (87%) dari kultur dengan penambahan
bahan pengikat berupa campuran tepung beras dan tepung onggok sebesar 2 :1.
Kadar air kultur kering yang diperoleh adalah 4.62% - 6.79% berat kering.
Pengeringan Beku (Freeze-drying)
Pengeringan beku berbeda dengan pengeringan biasa, dimana bahan yang
akan dikeringkan terlebih dahulu dibekukan, kemudian dalam keadaan hampa
udara air langsung dikeluarkan dari bahan secara sublimasi. Proses pengeringan
dengan pengeringan beku memerlukan kondisi dibawah suhu kritis yaitu suhu
dibawah 0 0C dan tekanan di dalam ruang pengering berada dibawah 1.0 – 2.0
To dan Etzel (1997) menggunakan metode pengeringan beku untuk
menge-ringkan beberapa spesies bakteri asam laktat. Proses pengeringan beku
diawali dengan pembekuan kultur dalam es kering pada suhu -20 0C selama +
12 jam, kemudian dilanjutkan ke pengering beku yang dioperasikan pada 9000
g/cm dan suhu -53 0C selama 24 jam menghasilkan viabilitas sekitar 60% -
70%. Viabilitas yang dihasilkan ini lebih tinggi dari pada hasil pengeringan
semprot.
Menurut Tamime dan Robinson (1985), selama proses pembekuan dan
pengeringan beku dapat terjadi kerusakan pada sel mikroba. Kerusakan ini dapat
diminimumkan dengan penambahan senyawa-senyawa kriogenik atau senyawa
protektan. Kelemahan pengeringan beku adalah dikhawatirkan penambahan
senyawa kriogenik dapat memberikan efek samping terhadap aktivitas sel serta
mutu produk fermentasi yang dihasilkan. Disamping itu metode pengeringan
beku memerlukan biaya yang tinggi dalam produksi. Diantara senyawa protektan
yang biasa ditambahkan dalam media pengeringan beku mikroba adalah Pepton,
Laktosa, Trehalosa, dan Whey-sukrosa (Anonim 2004d).
Husna (1998) juga meneliti pengeringan beku terhadap kultur starter
yoghurt dan dihasilkan kultur starter kering yang mengandung bakteri asam
laktat cukup tinggi yaitu ± 106 - 107. Bakteri asam laktat yang dihasilkan adalah Lactobacillus dengan total (1.2 - 4.2) x 106 koloni/ gram berat kering, dan
Streptococcus dengan total 8.2 x 105 sampai 1.0 x 106 koloni/gram berat kering.
Kadar air yang dihasilkan pada penelitian ini masih sangat tinggi, yaitu 29.76%
(bb) - 50.47% (bb). Sedangkan penambahan 10% sukrosa menghasilkan kultur
kering dengan kadar air yang lebih besar, karena sukrosa mengikat air sehingga
sulit dilepaskan sewaktu proses pengeringan.
Pengeringan Semprot
Proses utama dalam pengeringan semprot adalah pembentukkan
butiran-butiran halus (droplets) dari cairan yang akan dikeringkan dengan semprotan,
kemudian dikontakkan dengan udara. Langkah pengabutan dalam bentuk butiran
halus yang dihasilkan dengan percikan atau semprotan adalah untuk
spesifik. Pengabutan diakibatkan oleh semprotan cairan yang dicurahkan dalam
bentuk butiran-butiran kecil (Barbosa-Canovas dan Vega-Mercado 1996).
Metode pengeringan semprot dilakukan dengan alat pengering semprot
yang dilengkapi dengan pompa peristaltik untuk membawa suspensi mikroba
kedalam siklon pengering. Udara masuk dipanaskan dengan pemanas elektrik
dan suspensi mikroba dialirkan dengan semprotan kedalam siklon pengering,
sedangkan hasil pengeringan terkumpul pada bagian bawah siklon. Proses
pengeringan semprot untuk mengeringkan beberapa spesies bakteri asam laktat
dengan suhu udara masuk 220 0C dan suhu udara keluar 70 0C – 90 0C selama 30
menit, menghasilkan viabilitas hanya 15 - 34% (To dan Etzel 1997).
Menurut Salgado-Cervantes (2003), penggunaan khamir kering
Saccharo-myces cerevisiae yang diproses dengan pengeringan semprot dalam pembuatan
bir, menunjukkan aktivitas fermentasi yang lebih rendah. Kadar alkohol yang
diperoleh adalah 1.4 – 1.8%, sedangkan dengan khamir segar kadar alkohol yang
diperoleh adalah 5.5%. Selanjutnya juga dilaporkan khamir kering yang
dihasilkan banyak terkontaminasi dengan mikroba lain.
Pengeringan tipe Fluidized-bed
Proses pengeringan Fluidized-bed biasa dilakukan untuk produksi khamir
roti secara komersial dalam bentuk instant. Pada proses ini bahan awal dalam
bentuk krim dengan kadar air sekitar 80 %, dirobah ke dalam bentuk
partikel (diameter 0.2 – 0.5 mm) dengan suatu tekanan, kemudian
partikel-partikel dikeringkan dengan hembusan udara panas 100 0C- 150 0C. Waktu
pengeringan adalah 2 – 4 jam, suhu yang tertinggal pada partikel khamir adalah
sekitar 25 0C - 42 0C, dan kadar air produk akhir adalah 4 – 6% (Reed dan
Nagodawithana 1991).
Menurut Anonim (2004c), proses pengeringan untuk khamir kering instan
hanya menggunakan sistem fluidized-bed. Proses pembuatannya yaitu dengan
memampatkan krim khamir melalui pelat berlubang (alat ekstruder) sehingga
diperoleh bentuk seperti spageti tipis atau partikel-partikel massa khamir dengan
diameter 0.5 – 1 mm, lalu dikeringkan. Sebelumnya krim khamir ditambah
asam askorbat untuk membantu memperkuat adonan dan penambahan sorbitan
massa khamir kering instant lebih kecil dari khamir kering aktif dan untuk
pembuatan khamir kering aktif tidak ditambahkan asam askorbat dan emulsifer.
Sedangkan untuk pembuatan khamir kering aktif proses pengeringannya selain
dengan sistem fluidized-bed dapat juga dengan metoda lain seperti metoda
pengeringan terowongan melalui suatu rangkaian kamar pengering pada
tingkatan suhu berbeda. Pengeringan juga dapat dilakukan dengan alat
pengering tipe drum, yaitu pada drum yang berputar.
Kultur Mikroba Kering
Bentuk Kultur Kering
Berdasarkan proses pengeringannya kultur kering dibedakan atas : 1)
kultur starter yang dikeringkan dengan menambahkan media tumbuh atau bahan
lain yang berperan dalam proses pengeringan. Kultur kering yang dihasilkan
disebut dengan ragi, 2) kultur starter yang dikeringkan tanpa media tumbuh,
tetapi dapat ditambahkan bahan lain dengan jumlah maksimal 2%. Bahan
tambahan tersebut dapat berupa emulsifier atau rehydrating agent, kultur kering
yang dihasilkan adalah berupa kultur kering murni, contohnya kultur kering aktif
dan kultur kering aktif instan.
a. Ragi
Di Indonesia dikenal ragi tape yang dibuat secara tradisional dari tepung
beras. Pertumbuhan mikroba seperti kapang, khamir dan bakteri diperoleh
secara alamiah melalui infeksi dari lingkungan, peralatan yang digunakan dan
melalui seleksi akibat ditambahkannya bermacam-macam bumbu kedalam
tepung beras. Spesies kapang, khamir dan bakteri dalam ragi tersebut dapat
memproduksi gula, asam serta alkohol dari substrat karbohidrat.
Menurut Saono (1982) mikroflora yang lazim terdapat didalam ragi yang
sangat berperan dalam fermentasi tape biasanya didominasi oleh kapang dari
genus Mucor, Rhizopus dan Amylomyces, dan dari khamir yang termasuk
kedalam genus endomycopsis, Saccharomyces, Hansenula dan Candida.
Sedangkan bakteri yang sering terdapat pada ragi adalah dari genus Pediococcus
Fungsi dari masing-masing mikroba adalah: kapang berfungsi sebagai
pemecah pati, serta penghasil enzim-enzim alpha amilase, beta amilase dan
glukoamilase. Khamir berfungsi sebagai penghasil alkohol selama proses
fermentasi, serta dapat menghasilkan enzim-enzim invertase, karboksilase,
maltase dan melibiase. Sedangkan bakteri berfungsi sebagai penghasil asam
laktat dan sakarida (Saono 1982).
b. Kultur Murni Kering
Penyediaan kultur starter dalam bentuk kultur kering, selain ditujukan
untuk pemeliharaan kultur murni, juga untuk menghasilkan kultur kering aktif
secara komersial. Berbeda dengan ragi, kultur starter kering lebih spesifik untuk
satu spesies tertentu atau galur tertentu. Dalam proses pengeringan kultur murni
ini hanya boleh ditambahkan bahan kimia yang berfungsi sebagai pelindung sel,
seperti metil selulosa atau kaboksilmetil selulosa dalam jumlah 1-2% (Langejan
1980). Disamping itu juga dapat ditambahkan bahan pengemulsi seperti
mono-gliserida, gliserol polyester dan sorbitan ester dalam jumlah 0.2-1% (Hill 1987).
Proses pembuatan khamir kering aktif adalah dengan memampatkan
padatan sel khamir pada plat berlubang alat ekstrusi, untuk menghasilkan
butiran-butiran sangat kecil dari massa khamir. Selanjutnya proses pengeringan
dilakukan menggunakan pengering tipe terowongan pada suhu sekitar 60 0C,
selama 2 – 4 jam. Kadar air yang tersisa dalam bahan kering adalah sekitar 7.5 –
8.3%. Pengeringan juga dapat dilakukan dengan metoda fluidized-bed atau
metoda lainnya (Reed dan Nagodawithana 1995).
Untuk menghasilkan krim khamir, padatan sel khamir pada akhir
fermen-tasi sekitar 5%, dipisahkan dengan menggunakan sentrifus pada kecepatan 4000
rpm. Tahap awal pemisahan konsentrasi padatan sel dalam cairan dapat
ditingkatkan menjadi 20 %. Sentrifus kedua akan menghasilkan cairan
supernatan yang bebas sel khamir. Padatan sel yang diperoleh kemudian dicuci
dan dilakukan penyaringan dengan menggunakan tekanan pada 125 - 150 lb/in2 (
646 - 775 cm Hg), sehingga kadar padatan menjadi 27 – 32%. Padatan sel yang
diperoleh disebut krim khamir (yeast cream) dalam bentuk plastis semi padat.
Krim khamir ini dapat disimpan pada suhu 0 0C selama 2 minggu, atau
Menurut Beker dan Rapoport (1987) dalam pengeringan khamir roti
dengan metoda pengering terowongan, titik inversi pengeringan terdapat pada
kadar air 20%. Diatas titik ini perubahan viabilitas sel dan permiabilitas dinding
sel adalah kecil. Kadar air dibawah 20% respirasi berhenti dan unsur sel lepas
jika kultur kering khamir direhidrasi dalam air. Pengeringan dapat dilanjutkan
sampai batas kadar air 7.5-8.5% untuk khamir kering aktif dan 4-6% untuk
khamir kering aktif instan.
Beberapa bentuk khamir roti yang diperdagangkan di Indonesia masih
merupakan produk impor, diantaranya dikenal dengan nama fermipan yang
(diimpor dari Amerika) dan saf-instant (Perancis). Komposisi kedua produk
tersebut terdiri dari khamir instan Saccharomyces cerevisiae, bahan pengemulsi
(emulsifer) dan rehydrating agent.
Kegunaan Kultur Kering
Produksi kultur khamir kering aktif terkait dengan industri-industri besar
makanan dan minuman hasil fermentasi serta industri obat-obatan, karena
umumnya industri ini menggunakan kultur murni dalam bentuk kering aktif.
Jenis-jenis khamir kering aktif yang digunakan adalah khamir untuk industri roti,
khamir untuk industri bir, khamir untuk produksi etanol, khamir untuk
fermentasi sake, dan khamir untuk makanan ternak (Peppler dan Perlman 1979).
Menurut Nuraida et al. (1995) penyediaan kultur starter dalam bentuk
kering akan memudahkan cara penanganan, memungkinkan penggunaan kultur
starter baru pada setiap lot fermentasi, sehingga fermentasi lebih terkontrol dan
kualitas produk lebih terjamin. Disamping itu ketersediaan kultur starter kering
akan mempermudah distribusi dan transportasi, karena kultur starter kering dapat
ditransportasikan dalam jarak jauh tanpa kehilangan aktivitas yang nyata.
Selanjutnya menurut Malik dan Hoffmann (1993) kultur kering khamir
lebih stabil dan tidak terjadi mutasi atau kehilangan sifat-sifatnya yang
diperlukan selama proses pengeringan dan penyimpanan. Dengan demikian
metode pengeringan lebih dipilih sebagai cara untuk pengawetan kultur untuk
Penyimpanan Kultur Kering
Umumnya kultur kering aktif tidak membutuhkan penyimpanan suhu
rendah, bagaimanapun umur simpan dapat bervariasi dari 1-12 bulan, pada
kondisi penyim-panan suhu ruang. Stabilitas kultur kering adalah berbanding
terbalik dengan suhu penyimpanan dan kadar air. Demikian juga jumlah oksigen
dalam udara berakibat buruk terhadap stabilitas kultur kering Kultur khamir
kering aktif konvensional yang mempunyai kadar air 8% dapat disimpan 1-2
bulan, atau bila disimpan dalam kemasan yang diberi nitrogen atau vakum dapat
disimpan 1 tahun pada suhu kamar. Pengeringan kultur kering aktif sampai
kadar air yang lebih rendah (4-6%) meningkatkan stabilitas terhadap panas,
tetapi tidak dapat menghilangkan pengaruh kerusakan oleh oksigen.
Cara penyimpanan dan pendistribusian khamir roti digunakan kantong
kemasan yang kedap udara atau udara dihilangkan dengan memasukan gas.
Kemasan juga dapat berupa kantong aluminium foil dengan permeabilitas
rendah terhadap uap air dan gas oksigen. Aluminium foil harus bebas dari
lobang-lobang penjepit, dilaminasi dengan plastik film yang direkatkan dengan
menggunakan panas seperti saran atau pliofilm. Hill (1987) telah memberikan
komposisi dari empat lapis film komposit sebagai berikut : poliester 20 µ ;
aluminium , 12 µ ; polyester, 12 µ ; polyethylen, 8 µ . Plastik film cocok untuk
kemasan vakum berukuran 500 g dan 10 kg. Ukuran kecil 907 g juga digunakan
kemasan vakum. Kemasan lebih besar 10 kg dengan kaleng harus diberi
nitrogen untuk mencegah pengempisan dibawah kondisi vakum. Bila kemasan
dibuka kultur harus cepat digunakan karena udara dengan kelembaban yang
tinggi akan mempengaruhi stabilitas dari kultur. Hubungan antara kadar air dan
kelembaban terhadap beberapa khamir dapat dilihat pada Gambar 2.
Hasil penelitian Nuraida et al. (1995) terhadap kultur starter yoghurt yang
dikeringkan dengan metode pengeringan beku, dan perlakuan pencampuran
kultur dengan tapioka atau maizena (rasio tepung/kultur 1:2) serta penambahan
media skim 16 % + MSG 1.5%, menghasilkan viabilitas tertinggi. Aktivitasnya
tetap bertahan setelah disimpan 1 bulan pada suhu 7 0C dalam kemasan kantong
Gambar 2. Keseimbangan kadar air khamir tanpa kemasan terhadap kelembaban relatif pada suhu ruang (Dobbs et al. 1982)
Stres Kering pada Mikroba
Stres pada mikroba merupakan tekanan biologi akibat terganggunya proses
metabolisme penting didalam sel. Stres kering terjadi karena kehilangan air
dari sel, sehingga mengurangi turgor sel dan mempengaruhi tekanan osmotik.
Hal ini dapat mempengaruhi kestabilan makromolekul, sehingga menimbulkan
kekakuan membran dan merusak struktur protein (Brown 1990 dan Wiggins
2001). Disamping itu perubahan aktivitas air intrasellular juga menyebabkan
berkurangnya kekuatan ikatan hidrogen dan interaksi elektrostatik lainnya,
sehingga mengganggu struktur dan fungsi makromolekul termasuk asam
nukleat, protein, dan lemak (Brown 1990).
Stres dan Kerusakan Mikroba
Kebanyakan mikroorganisme untuk dapat tumbuh haruslah kontak
dengan air, karena sel hidup memperoleh semua atau sebagian kebutuhan
yang tidak menguntungkan dapat menyebabkan terjadinya stres pada mikroba.
Stres akibat perubahan potensial air ini disebut ‘solute stress’ dan ’dilution
stress’. Solute stress disebabkan oleh peningkatan konsentrasi atau aktivitas dari
larutan ekstraselular dalam lingkungan zat cair. Sedangkan dilution stress
disebabkan karena rendahnya aktivitas larutan ekstraselular (Brown 1990).
Teixeira et al. (1995) dari hasil penelitiannya menyatakan bahwa sel
mikroba yang berada pada kondisi stres menunjukkan telah terjadi kerusakan
membran sitoplasma. Hal ini diketahui dengan peningkatan sensitivitas terhadap
NaCl, peningkatan aktivitas β galaktosidase dan kebocoran isi sel pada fase stasioner. Selanjutnya menurut Bunduki et al. (1995) kebocoran dari substansi
intraseluler juga dapat diketahui dengan menguji material intraseluler yang
dikeluarkan seperti protein dan asam nukleat dengan metoda penyerapan pada
280 dan 260 nm pada spektofotometer. Demikian juga Hurst et al. (1984)
sebelumnya melakukan penelitian pemanasan terhadap S. aureus dan
menyatakan bahwa penyebab utama kerusakan pada sel akibat stres pemanasan
adalah karena kehilangan Mg++ dari sel mikroba. Kehilangan ion-ion mineral
dari sel mikroba ini menandakan telah terjadi kerusakan membran sel, dan
jumlah ion mineral yang hilang dapat diukur dengan menggunakan Atomic
absorption spectroscopy (AAS).
Salah satu bentuk kerusakan membran sel mikroba ditunjukkan dengan
menurunnya atau hilangnya permiabilitas sel, akibatnya terjadi kebocoran dari
komponen-komponen sel. Dalam hal ini Niven dan Mulholland (1998) telah
mengembangkan suatu metode untuk mengukur tingkat permiabilitas sel,
prinsipnya adalah dengan pemberian suatu senyawa marker DNA yang bila
kontak dengan DNA akan berfluoresensi, kemudian fluoresensinya diukur
dengan spektrofluorimeter. Tetapi cara ini hanya efektif tehadap organisme
prokariotik, sedangkan eukariotik letak DNAnya pada inti sel yang terlindung
oleh membran.
Pengamatan secara visual juga dapat dilakukan untuk mengetahui bentuk
kerusakan sel yaitu dengan menggunakan mikroskop elektron scaning (SEM)
untuk mengamati perubahan morfologi sel dan mikroskop elektron transmisi
kebocoran dinding sel dan membran plasma Saccharomyces cerevisiae akibat
perlakuan dengan detergen. Terlihat bentuk dinding sel yang retak atau robek,
dan membran plasmanya hancur, sedangkan mikrostruktur sel yang lainnya tidak
kelihatan. Tanda panah pada Gambar 3 menunjukan sel yang bocor dan dinding
sel yang rusak.
Gambar 3. Kebocoran dinding sel dan membran plasma Saccharomyces cerevisiae akibat perlakuan dengan detergen (Y-PER) pembesaran 12 000X, (Nowicki dan Liermann 2002)
Kematian Mikroba Akibat Kekeringan
Secara garis besar antara stres dan kematian sulit didefinisikan. Umumnya
stres dapat disebabkan oleh peningkatan sensitivitas terhadap adanya inhibitor.
Inhibitor ini pada mikroba tertentu seperti bakteri gram negatif dapat
menyebabkan kerusakan pada membran sitoplasma, sehingga sel kehilangan
cairan, dan terjadi beberapa perubahan biokimia pada organisme. Perubahan ini
dapat memulai stres dan akhirnya menyebabkan kematian (Hurst 1984).
Kematian dinilai, bila tidak ada koloni dalam medium optimal (kompleks).
Medium optimal adalah medium yang dapat ditumbuhi oleh mikroba yang stres
maupun tidak stres (sehat). Sedangkan stres dinilai dengan menghitung koloni
yang terbentuk pada medium optimal, tetapi tidak ada pada medium yang
dapat ditoleransi oleh mikroba yang tidak stres. (Hurst 1984), dalam hal ini
garam sering digunakan sebagai media selektif untuk mikroba.
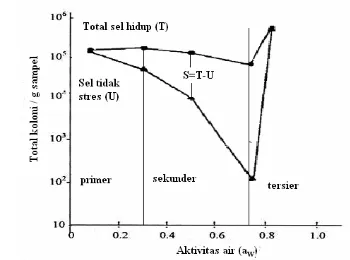
Menurut Soekarto (1979) kondisi aw makanan selama penyimpanan dapat
mempengaruhi pertumbuhan mikroba. Staphylococcus aureus adalah salah satu
mikroba yang sangat toleran pada aw rendah. Pada Gambar 4 dapat dilihat
Staphylococcus aureus dari contoh makanan pada berbagai aw yang disimpan
selama 32 hari, jumlah sel yang hidup (pada media TSAY) masih tinggi pada aw
yang sangat rendah (aw primer), demikian pula dengan sel yang tidak stres (pada
[image:36.612.132.482.288.548.2]media TSAYS).
Gambar 4. Jumlah Staphylococcus aureus yang tumbuh dari contoh makanan pada aw berbeda setelah 32 hari penyimpanan, pada suhu 21.70 C
(Soekarto 1979)
Meningkatnya aw selama penyimpanan (pada daerah sekunder) maka
jumlah sel yang tidak stres menurun tajam hingga aw mendekati 0.8, disamping
itu juga terlihat menurunnya jumlah mikroba yang hidup. Sedangkan pada aw >
0.8 (aw tersier) jumlah sel yang tidak stres meningkat dengan tajam, dan
viabilitasnya lebih tinggi dari viabilitas pada aw primer. Hal ini disebabkan
meningkatkan kadar air contoh makanan pada penelitian ini atau media tumbuh
lainnya. Kondisi sangat menunjang untuk pertumbuhan dan perkembang biakan
mikroba.
Dormansi Mikroba
Dormansi adalah suatu fenomena kehidupan organisme secara luas yang
sebagian besar ditandai dengan berhentinya sintesa protein dan pembelahan sel.
D idalam protista banyak jenis parasit mengubah bentuk menjadi kista sebagai
respon terhadap kondisi lingkungan (Taurancheau et al. 1999).
Sel mikroorganisme yang kondisinya dorman tetap masih hidup atau tidak
mati, tetapi juga tidak dapat tumbuh karena tidak melakukan proses
metabolisme. Dormansi pada mikroba dapat disebabkan oleh beberapa faktor,
diantaranya adalah faktor lingkungan dan pengolahan. Mikroba dikatakan
dorman apabila mengalami masa istirahat, yaitu dengan membentuk spora. Masa
istirahat ini dapat berlangsung relatif lama dan mungkin diperlukan suatu cara
tertentu untuk mengakhiri masa istirahat ini. Seperti halnya benih, untuk
mempersingkat masa dormannya diperlukan perlakuan khusus, misalnya dengan
menaikan kelembaban secara perlahan-lahan (Julianti 2003).
Kondisi dorman dapat terjadi benih apabila benih yang disimpan
mempunyai kadar air dibawah 4%. Benih dikatakan dorman apabila benih
mengalami istirahat total, dimana benih tidak menunjukkan gejala atau
fenomena pertumbuhan meskipun dalam keadaan media pertumbuhan yang
optimum. Benih dorman dapat dilihat melalui proses perkecambahan. Apabila
benih tidak mengalami imbibisi, bearti benih dorman, yang ditandai dengan
volume benih yang tidak berubah sampai akhir proses perkecambahan atau biji
tetap keras (Saenong et al. 1989 di dalam Julianti 2003).
Beberapa teori mengemukakan faktor kunci mengenai mekanisme
dormansi pada spora bakteri adalah pertahanan terhadap dehidrasi di pusat
protoplasma. Dalam hal ini inti sel dijaga dalam kondisi air yang sangat rendah,
tetapi air tetap ada. Korteks peptidoglikan dilibatkan dalam mengelilingi inti sel
dan berfungsi untuk menekan air keluar, atau sebagai osmoregulatory organelle
Menurut Algie (1980) dormansi adalah tindakan perlawanan terhadap
inti yang tertutup atau tumbuh secara radial supaya menekan air tidak ke luar
dari inti, terutama oleh reverse osmoses atau kebalikan osmosa. Sedangkan
menurut Warth (1983) pengurangan aktivitas air (aw) yang efektif di dalam inti
mendekati 0.75 menyebabkan mikroba akan lebih tahan terhadap panas, yakni
dengan membentuk spora, sehingga enzim didalam mikroba akan tahan
terhadap panas.
Pembentukan spora oleh khamir merupakan suatu proses survival di
lingkungan kurang baik, atau perlawanan terhadap proses pengawetan pada
makanan. Spora Saccharomyces cerevisiae adalah askospora yang dibentuk
oleh konjugasi dua sel khamir yang diakibatkan oleh penggabungan sel induk
dengan sel tunas. Banyaknya spora yang dibentuk di dalam suatu askus
bervariasi menurut jenis khamir. Pada lingkungan yang sesuai masing-masing
spora tumbuh kembali menjadi sel khamir.
Bentuk askus yang berisi spora dewasa dari Saccharomyces cerevisiae
dapat dilihat pada Gambar 5. Berdasarkan elektron mikrograf (Gambar 5)
bagian dalam atau lapisan yang jernih adalah manan dan glukan, sedangkan
lapisan sebelah luar yang lebih gelap adalah kitosan dan ditirosin. Material
dinding spora ( SW) dibentuk di dalam lumen pada kompartemen membran
prospora (Prm) (Anonim 2004a).
Gambar 5. Saccharomyce cerevisiae dengan askus berisi spora dewasa, SW adalah dinding spora, PrM adalah promembran dan N adalah inti sel
Dinding spora berfungsi memberi ketahanan pada spora terhadap stres
lingkungan. Setelah penutup prospora membran, sel membangun dinding spora
di dalam lumen antara kedua membran derivat yang diperoleh dari membran
prospora. Dinding dewasa terdiri dari empat lapisan berbeda: satu predominan
manoprotein (lapisan manan); satu residu ikatan beta-1,3 glukosa (lapisan
glukan); satu residu ikatan 1,4 alfa glukosamin ( lapisan kitosan); dan suatu
lapisan struktur indeterminan yang unsur utamanya adalah tirosin ikatan silang
dimers (lapisan ditirosin). Lapisan dinding spora diatur, dari paling dalam ke
paling luar sebagai berikut: manan, glukan, kitosan, dan ditirosin. Manan dan
glukan juga ditemukan di dalam dinding sel tumbuh-tumbuhan. Adanya kitosan
dan ditirosin adalah sangat unik pada spora (Anonim 2004a dan Wagner et al.
1999).
Saccharomyces cerevisiae
Saccharomyces cerevisiae termasuk dalam Filum Ascomycota, Kelas
Hemiascomycetes; Subkelas Hemiascomycetidae; Ordo Endomycetales; Famili
Saccharomycetaceae; Subfamili Saccharomyces. Saccharomyces berasal dari
nama Yunani yaitu sakehar dan mykes. Sakehar artinya gula dan mykes artinya
fungi. Setengah abad yang lalu konsep awal penamaan jenis-jenis khamir
berdasarkan pada penelitian pelopor mengenai teknik pemurnian kultur oleh
Emil Christian Hansen di Carlsberg Laboratories. Hansen membedakan dan
mengelompokan kultur kamir yang diisolasinya dalam bentuk murni
berdasarkan perbedaan morfologi selular dan askospora, asimilasi gula dan
karakteristik fermentasi, serta toleransi khamir terhadap suhu berbeda (Reed dan
Nagodawithana 1991).
Morfologi dan Struktur Sel
Sel khamir berbentuk bulat, lonjong, oval, silinder, ogival yaitu bulat
panjang dengan salah satu ujung runcing, segitiga melengkung (triangular),
bentuk apikulat atau lemon dan sebagainya. Ukuran dari sel khamir sangat
tersebut, tetapi secara umum panjang sel adalah 1– 50 ì m dan lebar adalah 1 – 10 ì m (Miller 1982).
Menurut Pelczar et al. (1977) mikrostruktur sel khamir terdiri dari dinding
sel, membran sitoplasma, matriks sitoplasma, inti sel, vakuola, retikulum
endoplasma, mitokondria, ribosom dan globula lemak. Bagian luar dinding sel
khamir secara umum ditutupi oleh lapisan transparan yang merupakan
polisakarida, termasuk fosfomanan (polimer yang menyerupai pati) dan
heteropolisakarida yaitu polimer yang mengandung lebih dari satu macam unit
gula seperti pentosa, heksosa dan asam glukuronat.
Komponen dinding sel pada Saccharomyces cerevisiae terdiri dari 15 –
30% berat kering sel, penyusun dinding sel terutama adalah manoprotein, β-1,3
glukan, β-1,6 glukan dan kitin dalam jumlah sangat kecil, tetapi berperan sangat
penting. Kompleks β-1,3 glukan-kitin adalah unsur utama dinding sel bagian
dalam, β-1,6 glukan menghubungkan