PERFORMA REPRODUKSI DAN PERTUMBUHAN PASCAPENGHAMBATAN
PEMATANGAN GONAD UDANG GALAH BETINA SECARA HORMONAL
MENGGUNAKAN DOPAMIN DAN
MEDROXYPROGESTERONE
MEGAWATI WIJAYA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Performa Reproduksi dan Pertumbuhan Pascapenghambatan Pematangan Gonad Udang Galah Betina secara Hormonal Menggunakan Dopamin dan Medroxyprogesterone adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2017
Megawati Wijaya
RINGKASAN
MEGAWATI WIJAYA. Performa Reproduksi dan Pertumbuhan Pascapenghambatan Pematangan Gonad Udang Galah Betina secara Hormonal Menggunakan Dopamin dan Medroxyprogesterone. Dibimbing oleh AGUS OMAN SUDRAJAT dan IMRON.
Udang galah Macrobrachium rosenbergii merupakan jenis udang air tawar yang bernilai ekonomis dan banyak diminati oleh masyarakat. Ketersediaan induk menjadi syarat utama untuk kegiatan budidaya udang galah, namun ada kendala yaitu udang galah betina cepat mengalami pematangan gonad. Hal ini dapat merugikan para pembudidaya karena pada saat udang matang gonad, pertumbuhan somatik akan terhambat disebabkan energi yang digunakan untuk pertumbuhan akan digunakan untuk reproduksi. Metode yang dapat digunakan untuk menghambat pematangan gonad, meningkatkan laju pertumbuhan dan mengembalikan pematangan gonad pascapenghambatan yaitu dengan metode hormonal. Aplikasi pemberian dopamin, medroxyprogesterone dan Oodev® dapat dilakukan dengan secara injeksi. Pemberian dopamin dan medroxyprogesterone
dengan dosis yang berbeda diharapkan mampu menghambat pematangan gonad dan meningkatkan laju pertumbuhan. Pemberian Oodev® dengan dosis 1 mL kg-1 diharapkan udang mampu matang gonad pascainduksi penghambatan. Oleh karena itu, penelitian ini bertujuan mengevaluasi penggunaan dopamin dan
medroxyprogesterone sebagai penghambat pematangan gonad serta Oodev® sebagai pematangan gonad udang galah betina pascapenghambatan.
Penelitian ini menggunakan rancangan acak lengkap faktorial (RALF) yang terdiri dari 2 faktor yaitu dopamin dengan dosis 0, 10-5 mol udang-1 dan 10-10 mol udang-1 serta medroxyprogesterone dengan dosis 0, 75 mg 1,5 mL-1 bobot udang-1 dan 150 mg 3 mL-1 bobot udang-1. Terdapat sembilan perlakuan yang terdiri dari kontrol (NaCl 0,1 mL); D1 (Dopamin 10-5 mol); D2 (Dopamin 10-10 mol); M1 dopamin dan medroxyprogesterone sebanyak tiga kali pada minggu ke-0, 2 dan 4 dengan interval waktu dua minggu sekali. Pemberian dopamin dan
medroxyprogesterone dilakukan melalui penyuntikan secara intramuskular pada kaki jalan ketiga. Pemeliharaan udang dilakukan selama tiga bulan pada bak beton yang berukuran 1,5x1x1 m3 dengan padat tebar 15 ekor bak-1. Selama pemeliharaan udang diberi pakan komersial dengan kandungan protein 35%. Parameter yang diuji meliputi konsentrasi estradiol 17-β, indeks kematangan gonad (IKG), histologi gonad, laju pertumbuhan harian (LPH), tingkat kelangsungan hidup (TKH) dan waktu maturasi. Analisis data dengan tabel sidik ragam dilakukan menggunakan software statistik Minitab 16. Histologi gonad, tingkat kelangsungan hidup dan waktu maturasidianalisis secara deskriptif.
Populasi udang pada perlakuan D2 menunjukkan indeks kematangan gonad yang rendah dan laju pertumbuhan harian yang tinggi dibanding kontrol (p<0,05). Konsentrasi estradiol yang rendah dan tingkat kelangsungan hidup yang lebih tinggi dibanding kontrol, meskipun tidak signifikan secara statistika (p>0,05). Gonad berada pada tahap previttelogenic. Populasi udang pada perlakuan M2 menunjukkan indeks kematangan gonad yang rendah dan laju pertumbuhan harian yang tinggi dibanding kontrol (p<0,05). Konsentrasi estradiol yang rendah dan tingkat kelangsungan hidup yang lebih rendah dibanding kontrol, meskipun tidak signifikan secara statistika (p>0,05). Gonad berada pada tahap previttelogenic.
Populasi udang pada perlakuan D2M2 menunjukkan terjadi penurunan konsentrasi estradiol 17-β dan indeks kematangan gonad dibanding kontrol (p<0,05). Laju pertumbuhan harian yang tinggi dibanding kontrol (p>0,05), tingkat kelangsungan hidup yang rendah dan gonad berada pada tahap
previttelogenic. Pascainduksi maturasi perlakuan M2 dan D2M2 memiliki kosentrasi estradiol yang tinggi, nilai IKG lebih tinggi dibanding kontrol dan gonad berada tahap mature tetapi perlakuan D2 memiliki kosentrasi estradiol rendah, nilai IKG rendah dan gonad berada pada tahap previttelogenic
Waktu maturasi diamati setelah pascainduksi maturasi menggunakan hormon Oodev® pada udang yang telah diberikan perlakuan penghambatan (dopamin dan medroxyprogesterone). Hasil penelitian ini menunjukkan perlakuan M2 mampu matang gonad selama 8 hari setelah penyuntikan hormon Oodev® sedangkan pada perlakuan D2 membutuhkan waktu yang lebih lama dibanding perlakuan lainnya yaitu selama 30 hari setelah penyuntikan hormon Oodev®. Hal ini diduga pada perlakuan D2 mampu menekan pematangan gonad pada udang galah betina dan dosis Oodev® yang diberikan belum mampu untuk menginduksi maturasi sehingga membutuhkan waktu maturasi yang lebih lama. Sebagai kesimpulan dari sembilan perlakuan, perlakuan D2, M2 dan D2M2 mampu menghambat pematangan gonad dan meningkatkan laju pertumbuhan tetapi pada perlakuan D2 memiliki waktu maturasi yang lebih lama dibanding perlakuan M2 dan D2M2.
SUMMARY
MEGAWATI WIJAYA.Reproductive and Growth Performances in Female Giant Freshwater Prawn, Following Inhibition of Gonadal Maturation Using Dopamine and Medoxyprogesterone Hormone. Supervised by AGUS OMAN SUDRAJAT and IMRON
Giant freshwater prawn (GFP) Macrobrachium rosenbergii is one of fresh water prawn that has a high economic value and attracts many consumer interest. One of the main problem in GFP culture is early gonadal maturation in female resulting in a reduced growth performance. This problem can cause farmers economic losses. When GFP at gonadal maturation, somatic growth will be inhibited because energy is used for reproduction. Hormonal method may influence inhibition of gonadal maturation, increase growth rate and induce gonad maturation after inhibiton. Application of dopamine, medroxyprogesterone, and Oodev® was done by injection intramuscularly at the third peripod. Applications of dopamine and medroxyprogesterone in different doses could inhibit gonadal maturation and increase growth rate. Application Oodev® dose 1 mL kg-1 could gonadal maturation after inhibition. So, the aim of this research is to evaluate the use dopamine and medroxyprogesterone as gonadal inhibtor and Oodev® hormone as trigger of gonadal maturation after inhibition.
This research used a factorial experimental design (RALF) method. It consisted of two factors i.e dopamine with doses of 0, 10-5 mol shrimp-1 dan 10-10 mol shrimp-1 and medroxyprogesterone with doses 0, 75 mg 1,5 mL-1 bodyweight-1 dan 150 mg 3 mL-1 bodyweight-1. Nine treatments, namely control (NaCl 0,1 mL); D1 (Dopamine 10-5 mol); D2 (Dopamine 10-10 mol); M1 parameters included estradiol 17-β concentration, gonad maturation index, gonad histology, daily growth rate, survival rate and maturation time. Data were analyzed using ANOVA in minitab 16 statistic software. Gonad histology, survival rate and maturation time were analyzed descriptively.
The results showed that administrations of different doses dopamine and
They also showed a trend of decline in estradiol concentrations and low survival rate than those of control although not tatistically significant (p>0,05). Gonad was in a previttelogenic stage. GFP population in treatment D2M2 showed a decrease in the concentration of estradiol 17-β and gonado somatic index than control (p<0,05). Growth rate higher than the control (p> 0,05), life survival rate in low level and gonad in previttelogenic stage. Post-induction of maturation treatment M2 and D2M2 showed a high in estradiol concentration, gonado somatic index value higher than the control and gonads are mature stage but treatment D2 showed a decline in estradiol concentrations, gonado somatic index lower and gonad in a previttelogenic stage.
Maturation time after induction of maturation observed after the use of hormones Oodev® on shrimp that had been given inhibition treatment (dopamine and medroxyprogesterone). The results showed the treatment M2 were able to gonadal maturation for 8 days after hormone injection while on treatment D2 requires a longer time than other treatments, ie 30 days after the injection of Oodev® hormone. It is guessed in the treatment of D2 was able to suppress gonadal maturation in GFP and Oodev® hormon dose have not been able to induce maturation (require longer maturation time). As a conclusion of nine treatments, treatment D2, M2 and D2M2 could inhibit gonadal maturation and increase the growth rate but on the treatment D2 has a maturation time is longer than the treatment M2 and D2M2.
© Hak Cipta Milik IPB, Tahun 2017
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PERFORMA REPRODUKSI DAN PERTUMBUHAN PASCAPENGHAMBATAN
PEMATANGAN GONAD UDANG GALAH BETINA SECARA HORMONAL
MENGGUNAKAN DOPAMIN DAN
MEDROXYPROGESTERONE
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2017
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan Maret 2016 sampai Juni 2016 dengan Tema reproduksi udang galah. Judul penelitian ini adalah “Performa reproduksi dan pertumbuhan pascapenghambatan pematangan gonad udang galah betina secara hormonal menggunakan dopamin dan medroxyprogesterone”.
Penulis menyadari bahwa keberhasilan dalam menyelesaikan penelitian ini tidak semata didapatkan sendiri, namun tidak terlepas dari segala bantuan dan dukungan berbagai pihak, baik ide, pemikiran, tenaga, moril dan material. Oleh karena itu penulis menyampaikan rasa terima kasih mendalam kepada Dr. Ir. Agus Oman Sudrajat, M.Sc. dan Dr. Imron, S.Pi M.Si sebagai komisi pembimbing serta Bapak Hari Krettiawan, S.Si M.Si sebagai pembimbing lapang atas waktu, arahan, kesabaran, nasehat serta semangat yang telah diberikan hingga tesis ini dapat
terselesaikan. Penulis juga menyampaikan rasa terima kasih kepada Dr. Ir. Sukenda, M.Sc sebagai dosen penguji luar komisi dan Dr. Ir. Widanarni,
M.Si sebagai komisi program studi yang telah memberikan saran dan masukan dalam ujian sidang tesis ini.
Terima kasih dan penghargaan yang tinggi penulis haturkan kepada ayahanda H. Drs. Sumaryadi, MM. dan Ibunda Hj. Suryati, S.Pd yang telah tulus mendoakan, memberi kasih sayang serta semangat agar tidak mudah menyerah dan fokus dalam menyelesaikan studi. Selain itu kepada saudara/saudari saya Candra Ariastuti Wijaya, Surya Kusuma Wijaya, Dian Puspita Rini Wijaya, Roni Eka Abadi, Ivone Wulandari Budiharto dan Nindy Parenty Budiharto yang telah memberikan doa dan semangat.
Disamping itu, penghargaan penulis sampaikan kepada seluruh dosen Program Studi Ilmu Akuakultur Sekolah Pacsasarjana Institut Pertanian Bogor dan seluruh pegawai BPPI Subang Jawa Barat khususnya POKJA udang galah dan Laboratorium fisiologi dan genetika yang telah memberikan saran kepada penulis. Terima kasih kepada rekan-rekan mahasiswa Program Studi Ilmu Akuakultur Angkatan 2014 atas kebersamaan, kekompakan, kerjasama serta motivasinya dalam menempuh studi. Kepada Dudi Muhammad Wildan, Asep Sofian, Reni Agustina Lubis, Yusran Ibrahim, Fatahillah Maulana Jufrie, Wulandari Sarasati dan Rommy Suprapto penulis menyampaikan terima kasih atas kebersamaan dan kerjasamanya selama penelitian.
Penulis telah berusaha semaksimal mungkin dalam penyelesaian karya ilmiah ini. Semoga karya ilmiah ini dapat bermanfaat bagi penulis dan para pembaca pada umumnya.
Bogor, Maret 2017
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
2 METODE 3
Waktu dan Tempat 3
Bahan Penelitian 3
Rancangan Penelitian 3
Prosedur Penelitian 4
Parameter Uji 6
Analisis Data 7
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 13
4 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 21
DAFTAR TABEL
1 Rancangan perlakuan induksi dopamin dan medroxyprogesterone untuk menghambat pematangan gonad udang galah
4 2 Histologi gonad udang galah pascainduksi penghambatan dan maturasi 9 3 Waktu maturasi setelah proses penyuntikan Oodev® 12 4 Kualitas air selama masa pemeliharaan udang galah betina 13
DAFTAR GAMBAR
1 Konsentrasi estradiol 17-β pascainduksi penghambatan dan maturasi 8 2 Nilai IKG udang galah pascainduksi penghambatan dan maturasi 8 3 Histologi gonad udang sebelum diberi perlakuan dengan pembesaran
400 kali 9
4 Laju pertumbuhan harian pascainduksi penghambatan 11 5 Tingkat kelangsungan hidup udang galah pascainduksi penghambatan 12
DAFTAR LAMPIRAN
1 Prosedur pengujian Estradiol 17-β dengan metode ELISA (enzyme linked immuno sorbent assay)
22
2 Prosedur analisis histologi gonad 22
1
PENDAHULUAN
Latar Belakang
Udang galah Macrobrachium rosenbergii merupakan jenis udang air tawar yang bernilai ekonomis penting dan banyak diminati oleh masyarakat arga udang gala mencapai p p 000 per kilogram. Produksi udang galah di dunia pada tahun 2013 sebesar 203.033 ton sedangkan pada tahun 2014 sebesar 216.856 ton, mengalami peningkatan sebesar 13.823 ton (FAO 2015). Pada kegiatan budidaya udang galah, ketersediaan induk menjadi persyaratan utama. Namun pada udang galah betina memiliki kekurangan yaitu cepat mengalami pematangan gonad. Hal ini dapat merugikan para pembudidaya udang galah karena pada saat udang matang gonad, pertumbuhan somatik akan terhambat disebabkan energi yang digunakan untuk pertumbuhan akan digunakan untuk reproduksi (Cavalli et al. 2001).
Perkembangan gonad udang galah betina yang cepat secara alami dipengaruhi oleh beberapa kerja hormon (Swetha et al. 2011). Gonad Stimulating Hormone (GSH) dan Methyl Farnesoate (MF) merupakan hormon gonadotropin yang berperan penting pada aktivitas kelenjar seks dan progesteron pada udang galah betina karena berfungsi merangsang pembentukan sel telur dan perkembangan gonad. Produksi GSH dan MF secara alami dapat dihambat oleh aktivitas Gonad Inhibiting Hormone (GIH) dan Mandibular Organ Inhibiting Hormone (MOIH) yang dihasilkan oleh organ-X, terletak pada tangkai mata ( uberman 2 ) Menurut a’anan (1991) udang gala betina matang gonad pertama pada bobot berkisar 18-26 g.
Pertumbuhan pada krustasea dipengaruhi kerja hormon ekdisteroid (hormon molting) yang berada pada organ Y (Nagaraju et al. 2004). Organ Y akan mensintesis dan mensekresikan ekdisteroid menuju ke sel-sel pertumbuhan seperti tangkai mata dan hepatopankreas (Nagaraju 2011). Menurut Chang et al. (2011)
Molt Inhibiting Hormone (MIH) berperan untuk mengatur proses molting pada krustasea sedangkan Crustacea Hyperglemic Hormone (CHH) berperan dalam menyediakan karbohidrat dan lemak untuk memenuhi kebutuhan energi (Moles 2006). Hormon MF berperan dalam menstimulasi pertumbuhan pada krustasea. Hal ini dibuktikan oleh Allayie et al. (2010), pemberian ekstrak organ madibular dapat meningkatkan pertambahan bobot tubuh pada kepiting Charybdis lucifera.
Metode yang dapat digunakan untuk menghambat pematangan gonad, meningkatkan laju pertumbuhan dan udang dapat matang gonad kembali pascapenghambatan yaitu dengan metode hormonal. Oleh karena itu pada penelitian ini metode yang digunakan adalah metode hormonal dengan cara menginduksi dopamin dan medroxyprogesterone sebagai penghambat pematangan gonad dan Oodev® sebagai pematangan gonad pada udang galah betina pascapenghambatan.
Dopamin adalah neurotransmitter yang berada dalam sistem saraf pusat dan ovarium krustasea (Tinikul et al. 2009b). Dopamin bersifat hidrofilik (Shin
2
Hormon GIH merupakan hormon yang dapat menghambat perkembangan gonad pada krustasea (Tinikul et al. 2009a). Penelitian yang dilakukan oleh (Novienti 2001; Riani 2010) membuktikan bahwa dopamin dengan dosis 10-6 mol dan 10-9 mol dapat menghambat pematangan gonad udang windu selama 10 dan 14 hari. Hal ini juga dibuktikan oleh Tinikul et al. (2008) pemberian dopamin 2,5 x 10-6 mol dan 2,5 x 10-7 mol dapat menghambat pematangan gonad pada udang galah.
Medroxyprogesterone asetat adalah hormon steroid yang diproduksi oleh ovarium, korteks adrenal dan plasenta pada masa kehamilan (Suherman 2008).
Medroxyprogesterone bersifat lipofilik (Steele et al. 2013). Menurut Daido et al.
(2014) fungsi medroxyprogesterone yaitu menekan ovulasi dengan cara menghambat hipofisa untuk mensekresikan hormon Luteinizing Hormone (LH) dan Folicle Stimulating Hormone (FSH). Hormon FSH dan LH merupakan kunci yang mengatur reproduksi (Aizen et al. 2012). Hal ini dibuktikan oleh Yurnadi
et al. (2011) pemberian medroxyprogesterone 50 mg dapat menghambat pematangan gonad pada tikus jantan strain Sprague Dawley.
Oodev® (Oosit developer) merupakan premix bahan aktif yang di dalamnya terkandung hormon Pregnant Mare Serum Gonadotropin (PMSG) dan Anti Dopamine (AD). PMSG merupakan hormon sintesis glikoprotein yang disekresikan dari sel-sel tropoblas kuda yang di dalamnya terkandung FSH dan LH (Moore dan Ward 1980). Anti dopamin merupakan neurotransmiter yang menghambat sistem kerja dopamin (Dufour et al. 2010).
Keberadaan GnRH endogenous pada udang galah terdeteksi di Central Nervous System (CNS) di otak dan ganglion thorac (Ngernsoungnern et al. 2008). Hal ini juga dibuktikan oleh Tinikul et al. (2014) induksi GnRH memiliki pengaruh yang signifikan dalam merangsang pematangan ovarium pada udang vannamei. Menurut Huang (2008) keberadaan FSH dan LH endogenous pada rajungan Portunus trituberculatus terdeteksi di otak dan ganglion thorac. Hal ini dapat membuktikan bahwa keberadaan GnRH, FSH dan LH endogenus pada krustasea yang berperan penting sebagai kontrol reproduksi. Berdasarkan hal tersebut maka perlu dilakukan penggunaan dopamin dan medroxyprogesterone
untuk menghambat pematangan gonad dan Oodev® untuk udang dapat matang gonad kembali pascapenghambatan.
Perumusan Masalah
Udang galah betina mengalami pematangan gonad yang cepat. Pematangan pertama udang berkisar 15-35 g dalam waktu 4 sampai 6 bulan (Krettiawan et al. 2015). Ketika udang matang gonad, pertumbuhan somatik akan terhambat. Hal ini disebabkan energi yang digunakan untuk pertumbuhan akan digunakan untuk reproduksi (Cavalli et al. 2001). Berdasarkan kajian endokrinologi pada krustasea, pendekatan secara hormonal seperti induksi neurotransmitter dan hormon merupakan salah satu alternatif yang dapat dilakukan sebagai upaya untuk menghambat pematangan gonad yang berperan penting dalam meningkatkan laju pertumbuhan dan udang dapat matang gonad kembali pascapenghambatan.
3 Oodev® adalah hormon yang efektif mempercepat maturasi dan meningkatkan kinerja reproduksi. Aplikasi penggunaan dopamin, medroxyprogesterone dan Oodev® pada udang diharapkan dapat memberikan respon yang positif pada perbaikan kinerja reproduksi udang galah betina.
Tujuan Penelitian
Tujuan penelitian ini adalah mengevaluasi penggunaan neurotransmitter dopamin dan hormon medroxyprogesterone sebagai penghambat pematangan gonad dan Oodev® sebagai pematangan gonad udang galah betina pascapenghambatan
Manfaat Penelitian
Memberikan informasi dalam mendapatkan induk udang galah yang berukuran besar dengan cara mencegah reproduksi dini melalui penghambatan pematangan gonad dan udang tetap tumbuh normal serta udang dapat matang kembali pascapenghambatan.
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Maret 2016 hingga Juni 2016. Penelitian bertempat di Balai Penelitian Pemuliaan Ikan, Sukamandi, Subang, Jawa Barat. Analisis histologi dilakukan di Balai Veteriner Subang, Jawa Barat dan analisis estradiol dilakukan di Balai Penelitian Pemuliaan Ikan, Sukamandi, Subang, Jawa Barat.
Bahan Penelitian
Bahan yang digunakan dalam penelitian ini adalah udang galah betina keturunan populasi dari Asahan, dopamin dan medroxyprogesterone. Udang galah betina yang digunakan berasal dari koleksi Balai Penelitian Pemuliaan Ikan, Sukamandi, Subang, Jawa Barat dengan bobot 11,27±0,97 g. Neurotransmitter dopamin yang digunakan pada penelitian ini dengan dosis 0, 10-5 mol udang-1 dan 10-10 mol udang-1, hormon medroxyprogesterone dengan dosis 0, 75 mg 1,5 mL-1 bobot udang-1 dan 150 mg 3 mL-1 bobot udang-1 dan hormon Oodev® dosis 1 mL kg-1 bobot udang-1.
Rancangan Penelitian
4
Percobaan Tahap 1
Percobaan Tahap 1 dilakukan untuk menganalisis pengaruh dopamin,
medroxyprogesterone dan premix dopamin-medroxyprogesterone sebagai penghambat pematangan gonad. Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap Faktorial dengan ulangan individu 15 ekor. Adapun rancangan perlakuan dapat dijelaskan sebagai berikut.
Tabel 1 Rancangan perlakuan induksi dopamin dan medroxyprogesterone untuk menghambat pematangan gonad udang galah betina mempercepat maturasi pascapenghambatan. Percobaan Tahap 2 menggunakan RALF dengan sembilan perlakuan yang sama seperti pada percobaan Tahap 1.
Percobaan tahap 2 dilakukan dengan menginduksi Oodev® dengan dosis 1 mL kg-1 bobot tubuh-1 pada udang galah betina pascapenghambatan. Parameter
yang diamati yaitu konsentrasi estradiol 17-β, indeks kematangan gonad dan Bak dikeringkan selama 1 hari kemudian diisi air sebanyak 500 l.
Bak yang telah diisi air diberikan selter berupa paralon dan jaring PVC untuk menghindari terjadinya perilaku kanibal. Pemberian aerasi sebanyak 3 titik untuk setiap bak.
Pemilihan Udang Galah Betina
5 Udang diseleksi dengan kriteria berukuran 11,27±0,97 g berumur 4 bulan, sehat, tidak cacat, organ tubuh lengkap dan bebas dari penyakit.
Penebaran dan Aklimatisasi Udang
Udang hasil seleksi ditebar ke dalam bak penelitian dengan padat tebar 15 ekor bak-1, kemudian diaklimatisasi selama satu minggu. Hal ini dilakukan untuk menghindari udang stres pada saat pemberian perlakuan.
Pemeliharaan Udang
Selama pemelihaaraan udang diberi pakan komersil dengan kadar protein 35%. Dosis pemberian pakan sebanyak 5% dari biomassa. Pakan diberikan tiga kali dalam sehari. Untuk menjaga kualitas air dalam wadah pemeliharaan dilakukan penyiponan dan pergantian air setiap tiga hari sekali.
Induksi Penghambatan dan Maturasi
Induksi penghambatan dan maturasi dilakukan dengan cara penyuntikan dopamin, medroxyprogesterone dan Oodev® pada intramuskular kaki jalan ketiga udang galah betina. Penyuntikan dopamin dan medroxyprogesterone dilakukan sebanyak tiga kali pada minggu ke-0, 2 dan 4 dengan interval waktu setiap dua minggu sekali. Sebelum dilakukan proses penyuntikan dopamin dan
medroxyprogesterone diracik terlebih dahulu sesuai dengan dosis yang telah ditentukan. Proses penyuntikan dilakukan pada pagi hari pukul 07.00 untuk mengurangi stres pada udang (Riani 2010). Penyuntikan Oodev® dilakukan sebanyak 1 kali pada minggu ke-8. Proses penyuntikan dilakukan pada sore hari pukul 16.00 untuk mengurangi stres dan konsentrasi dopamin cukup rendah dalam tubuh udang.
Pengambilan Sampel Gonad dan Hemolim
Pengambilan sampel gonad dan hemolim dilakukan pada saat awal, tengah dan akhir penelitian. Pengambilan sampel gonad untuk mengetahui pengaruh pemberian dopamin, medroxyprogesterone dan Oodev® terhadap gonad udang galah betina dan pengambilan sampel hemolim pada udang untuk menganalisa profil hormon.
Waktu Maturasi Udang
Waktu maturasi merupakan periode waktu yang diamati setelah penyuntikan hormon Oodev® hingga udang telah matang gonad (Tingkat Kematangan Gonad IV). Pengamatan waktu maturasi dilakukan untuk mengetahui udang galah betina dapat kembali matang pascainduksi penghambatan menggunakan dopamin dan
6
Parameter Uji
Konsentrasi Estradiol
Analisis estradiol dilakukan dengan cara mengambil sampel hemolim sebanyak 0,3 mL pada intramuskular kaki jalan ketiga dengan menggunakan
syringe ukuran 1 mL yang telah diberikan antikoagulan. Sampel di sentrifuse dan disimpan pada freezer bersuhu -20°C. Pengukuran konsentrasi estradiol dilakukan menggunakan metode ELISA (Enzyme-Linked Immunosorbent Assay) seperti disajikan pada Lampiran 1.
Indeks Kematangan Gonad (IKG)
Indeks kematangan gonad atau dikenal dengan istilah Gonado Somatic Index (GSI) diamati pada awal, tengah dan akhir penelitian dengan menggunakan rumus (Effendie 2002) :
GSI = x 100
Histologi Gonad
Pengamatan histologi gonad dilakukan untuk mengamati gonad secara mikroskopis. Histologi gonad dilakukan dengan menggunakan metode pewarnaan Hematoksilin-Eosin (H&E) seperti disajikan pada Lampiran 2.
Laju Pertumbuhan
Pengamatan laju pertumbu an arian (α) udang dilakukan diawal dan diakhir penelitian menggunakan rumus (Effendi 2004) :
Keterangan :
Wo = Berat udang awal penelitian (g) Wt = Berat udang akhir penelitian (g) n = Lama waktu pemeliharaan (hari) Tingkat Kelangsungan Hidup (TKH)
Tingkat Kelangsungan hidup merupakan persentase jumlah udang yang hidup pada akhir penelitian dibandingkan jumlah udang awal. Perhitungan TKH dilakukan pada akhir penelitian dengan menggunakan rumus (Effendie 2002) :
7 Keterangan :
TKH = Tingkat Kelangsungan Hidup (%)
Nt = Jumlah udang yang hidup diakhir perlakuan (ekor) No = Jumlah udang yang hidup d iawal perlakuan (ekor)
Waktu maturasi
Pengamatan waktumaturasi dilakukan untuk mengetahui berapa lama udang galah betina mampu maturasi kembali setelah dilakukan pemberian dopamin dan
medroxyprogesterone.
Kualitas Air
Parameter kualitas air yang diukur selama masa penelitian adalah suhu, oksigen terlarut (DO) dan pH yang dilakukan pada awal, tengah dan akhir penelitian.
Analisis Data
Penelitian ini menggunakan rancangan acak lengkap faktorial dengan dua faktor, yaitu pemberian dopamin dan medroxyprogesterone. Data yang diperoleh ditabulasi dengan Ms. Excel 2010 dan uji ANOVA dianalisis dengan menggunakan program MINITAB 16. Perlakuan yang berbeda nyata diuji lanjut dengan uji Tuckey. Data histologi gonad, tingkat kelangsungan hidup, waktu maturasi dan kualitas air dianalisis secara deskriptif.
3
HASIL DAN PEMBAHASAN
Hasil
Konsentrasi Estradiol
8
Keterangan : Huruf berbeda di atas setiap bar menunjukkan berbeda signifikan (p<0,05) antar perlakuan. D1 (Dopamin 10-5 mol); D2 (Dopamin 10-10 mol); M1 (Medroxyprogesterone 1,5 mL); M2 (Medroxyprogesterone 3 mL); D1M1 (Dopamin 10-5 mol+Medroxyprogesterone 1,5 mL); D2M1 (Dopamin 10-10 mol+Medroxyprogesterone 1,5 mL); D1M2 (Dopamin 10-5
mol+Medroxyprogesterone 3 mL); D2M2 (Dopamin 10-10 mol+ Medroxyprogesterone 3 mL)
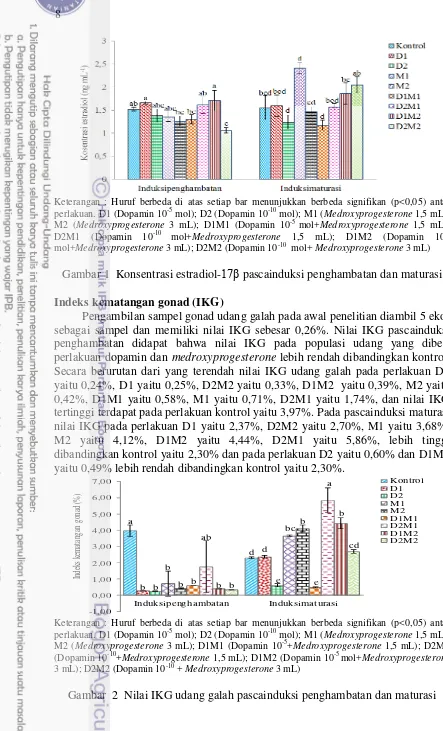
Gambar 1 Konsentrasi estradiol-17β pascainduksi penghambatan dan maturasi Indeks kematangan gonad (IKG)
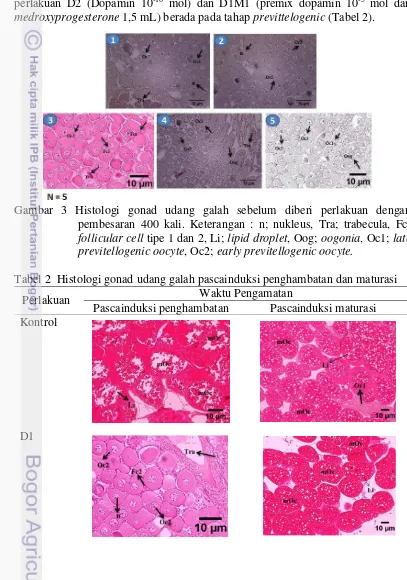
Pengambilan sampel gonad udang galah pada awal penelitian diambil 5 ekor sebagai sampel dan memiliki nilai IKG sebesar 0,26%. Nilai IKG pascainduksi penghambatan didapat bahwa nilai IKG pada populasi udang yang diberi perlakuan dopamin dan medroxyprogesterone lebih rendah dibandingkan kontrol. Secara berurutan dari yang terendah nilai IKG udang galah pada perlakuan D2 yaitu 0,24%, D1 yaitu 0,25%, D2M2 yaitu 0,33%, D1M2 yaitu 0,39%, M2 yaitu 0,42%, D1M1 yaitu 0,58%, M1 yaitu 0,71%, D2M1 yaitu 1,74%, dan nilai IKG tertinggi terdapat pada perlakuan kontrol yaitu 3,97%. Pada pascainduksi maturasi nilai IKG pada perlakuan D1 yaitu 2,37%, D2M2 yaitu 2,70%, M1 yaitu 3,68%, M2 yaitu 4,12%, D1M2 yaitu 4,44%, D2M1 yaitu 5,86%, lebih tinggi dibandingkan kontrol yaitu 2,30% dan pada perlakuan D2 yaitu 0,60% dan D1M1 yaitu 0,49% lebih rendah dibandingkan kontrol yaitu 2,30%.
Keterangan : Huruf berbeda di atas setiap bar menunjukkan berbeda signifikan (p<0,05) antar perlakuan. D1 (Dopamin 10-5 mol); D2 (Dopamin 10-10 mol); M1 (Medroxyprogesterone 1,5 mL); M2 (Medroxyprogesterone 3 mL); D1M1 (Dopamin 10-5+Medroxyprogesterone 1,5 mL); D2M1 (Dopamin 10-10+Medroxyprogesterone 1,5 mL); D1M2 (Dopamin 10-5 mol+Medroxyprogesterone
3 mL); D2M2 (Dopamin 10-10 + Medroxyprogesterone 3 mL)
Gambar 2 Nilai IKG udang galah pascainduksi penghambatan dan maturasi
9 Histologi gonad
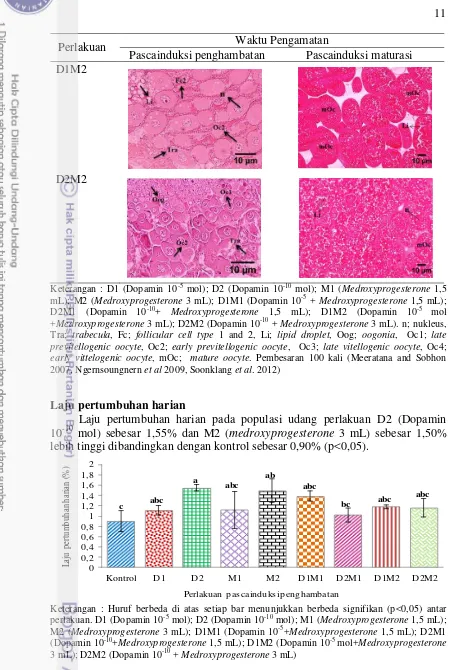
Histologi gonad udang galah menggunakan metode pewarnaan Hematoksilin-Eosin. Histologi gonad pada awal penelitian, gonad berada pada tahap previttelogenic (Gambar 3). Histologi gonad pascainduksi penghambatan didapatkan bahwa gonad pada populasi udang yang diberi perlakuan dopamin dan
medroxyprogesterone berada pada tahap previttelogenic dan vittelogenic
sedangkan pada perlakuan kontrol gonad berada pada tahap mature (Tabel 2). Histologi gonad pascainduksi maturasi, gonad berada pada tahap mature kecuali perlakuan D2 (Dopamin 10-10 mol) dan D1M1 (premix dopamin 10-5 mol dan
medroxyprogesterone 1,5 mL) berada pada tahap previttelogenic (Tabel 2).
Gambar 3 Histologi gonad udang galah sebelum diberi perlakuan dengan pembesaran 400 kali. Keterangan : n; nukleus, Tra; trabecula, Fc;
follicular cell tipe 1 dan 2, Li; lipid droplet, Oog; oogonia, Oc1; late previtellogenic oocyte, Oc2; early previtellogenic oocyte.
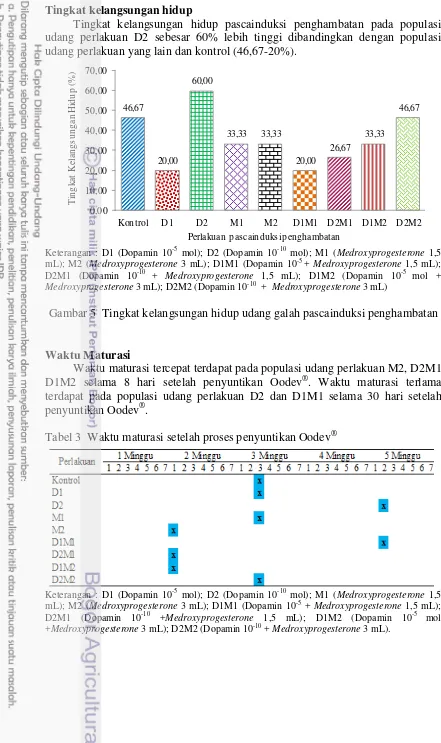
Tabel 2 Histologi gonad udang galah pascainduksi penghambatan dan maturasi
Perlakuan Waktu Pengamatan
Pascainduksi penghambatan Pascainduksi maturasi Kontrol
10
Perlakuan Waktu Pengamatan
Pascainduksi penghambatan Pascainduksi maturasi D2
M1
M2
D1M1
11 mL); M2 (Medroxyprogesterone 3 mL); D1M1 (Dopamin 10-5 + Medroxyprogesterone 1,5 mL); D2M1 (Dopamin 10-10+ Medroxyprogesterone 1,5 mL); D1M2 (Dopamin 10-5 mol
+Medroxyprogesterone 3 mL); D2M2 (Dopamin 10-10 + Medroxyprogesterone 3 mL). n; nukleus,
Tra; trabecula, Fc; follicular cell type 1 and 2, Li; lipid droplet, Oog; oogonia, Oc1; late previtellogenic oocyte, Oc2; early previtellogenic oocyte, Oc3; late vitellogenic oocyte, Oc4;
early vittelogenic oocyte, mOc; mature oocyte. Pembesaran 100 kali (Meeratana and Sobhon 2007, Ngernsoungnern et al 2009, Soonklang et al. 2012)
Laju pertumbuhan harian
Laju pertumbuhan harian pada populasi udang perlakuan D2 (Dopamin 10-10 mol) sebesar 1,55% dan M2 (medroxyprogesterone 3 mL) sebesar 1,50% lebih tinggi dibandingkan dengan kontrol sebesar 0,90% (p<0,05).
Keterangan : Huruf berbeda di atas setiap bar menunjukkan berbeda signifikan (p<0,05) antar perlakuan. D1 (Dopamin 10-5 mol); D2 (Dopamin 10-10 mol); M1 (Medroxyprogesterone 1,5 mL); M2 (Medroxyprogesterone 3 mL); D1M1 (Dopamin 10-5+Medroxyprogesterone 1,5 mL); D2M1 (Dopamin 10-10+Medroxyprogesterone 1,5 mL); D1M2 (Dopamin 10-5 mol+Medroxyprogesterone
3 mL); D2M2 (Dopamin 10-10 + Medroxyprogesterone 3 mL)
Gambar 4 Laju pertumbuhan harian pascainduksi penghambatan 0
Kontrol D1 D2 M1 M2 D1M1 D2M1 D1M2 D2M2
12
Tingkat kelangsungan hidup
Tingkat kelangsungan hidup pascainduksi penghambatan pada populasi udang perlakuan D2 sebesar 60% lebih tinggi dibandingkan dengan populasi udang perlakuan yang lain dan kontrol (46,67-20%).
Keterangan : D1 (Dopamin 10-5 mol); D2 (Dopamin 10-10 mol); M1 (Medroxyprogesterone 1,5 mL); M2 (Medroxyprogesterone 3 mL); D1M1 (Dopamin 10-5 + Medroxyprogesterone 1,5 mL); D2M1 (Dopamin 10-10 + Medroxyprogesterone 1,5 mL); D1M2 (Dopamin 10-5 mol +
Medroxyprogesterone 3 mL); D2M2 (Dopamin 10-10 + Medroxyprogesterone 3 mL)
Gambar 5 Tingkat kelangsungan hidup udang galah pascainduksi penghambatan
Waktu Maturasi
Waktumaturasi tercepat terdapat pada populasi udang perlakuan M2, D2M1, D1M2 selama 8 hari setelah penyuntikan Oodev®. Waktu maturasi terlama terdapat pada populasi udang perlakuan D2 dan D1M1 selama 30 hari setelah penyuntikan Oodev®.
Tabel 3 Waktu maturasi setelah proses penyuntikan Oodev®
Keterangan : D1 (Dopamin 10-5 mol); D2 (Dopamin 10-10 mol); M1 (Medroxyprogesterone 1,5 mL); M2 (Medroxyprogesterone 3 mL); D1M1 (Dopamin 10-5 + Medroxyprogesterone 1,5 mL); D2M1 (Dopamin 10-10 +Medroxyprogesterone 1,5 mL); D1M2 (Dopamin 10-5 mol
+Medroxyprogesterone 3 mL); D2M2 (Dopamin 10-10 + Medroxyprogesterone 3 mL).
46,67
Kontrol D1 D2 M1 M2 D1M1 D2M1 D1M2 D2M2
13 Kualitas Air
Kualitas air selama masa pemeliharaan tidak jauh berbeda pada setiap pengambilan sampel. Adapun kualitas air yang diukur selama penelitian adalah Suhu, DO dan pH (Tabel 4).
Tabel 4 Kualitas air selama masa pemeliharaan udang galah betina Parameter Kisaran Kualitas Air Standart
Suhu (°C) 28,7-30,1 28-31 (New 2002)
pH 5,4-7 7-8,5 (New 2002)
DO (ppm) 3,7-8,4 3-7 (New 2002)
Pembahasan
Induksi dopamin dan medroxyprogesterone pada udang galah dapat mempengaruhi konsentrasi estradiol-17β Pada Gambar 1 dapat dilihat, pascainduksi penghambatan perlakuan D2M2 memiliki konsentrasi estradiol terendah yaitu sebesar 1,06 ng mL-1 dibandingkan perlakuan yang lainnya. Hal ini sesuai dengan pernyataan Tinikul et al. (2008), penggunaan dopamin dengan dosis 2,5 x 10-6 dan 2,5x 10-7 mol udang-1 dapat menurunkan konsentrasi vitelogenin pada TKG IV sebesar 3,88± 0,65 mg mL-1 dibandingkan kontrol sebesar 9,90 ± 1,02 mg mL-1 pada udang galah. Selain itu penggunaan
medroxyprogesterone 1,25 mg dapat menghambat pematangan gonad pada tikus jantan strain Sprague Dawley (Yurnadi et al. 2011). Pascainduksi maturasi perlakuan M1 memiliki konsentrasi estradiol tertinggi sebesar 2,41 ng mL-1 dibandingkan perlakuan yang lainnya. Hal ini sesuai dengan pernyataan Akbar (2015), pemberian Oodev® 0,5 mL kg-1 dapat meningkatkan konsentrasi testosteron pada udang vannamei.
Induksi dopamin dan medroxyprogesterone dapat menurunkan konsentrasi estradiol dalam hemolim udang. Menurunnya konsentrasi estradiol diduga karena premix dopamin 10-10 mol dengan hormon medroxyprogesterone 3 mL mampu menekan konsentrasi estradiol. Hal ini sesuai dengan pernyataan Fingerman (1997), fungsi dopamin untuk menghambat pematangan gonad pada udang dengan cara menstimulasi sel neuroendokrin organ X pada medulla terminal di tangkai mata agar mensintesis hormon GIH. Menurut Lee et al. (1999), penggunaan medroxyprogesterone dapat menghambat proses steroidogenesis pada gonad tikus. Induksi Oodev® dapat meningkatkan konsentrasi estradiol dalam hemolim udang. Meningkatnya konsentrasi estradiol diduga disebabkan FSH dan LH eksogenus yang terkandung dalam Oodev® merangsang otak dan ganglion thorac untuk mensekresikan GSH. GSH diketahui merupakan hormon gonadotropin sebagai pemicu diproduksinya hormon esterogen estradiol. Alur mekanismenya sebagaimana dijelaskan oleh Fingerman (1997), GSH yang ditransportasikan melalui hemolim merangsang kelenjar esterogen yang terletak didalam gonad untuk mengaktifkan sintesis dan sekresi pelepasan Estradiol.
14
Tinikul et al. (2009a), menyatakan dopamin dapat menghambat pematangan gonad dan perkembangan oosit pada udang galah. Nilai IKG pascainduksi maturasi mengalami peningkatan setelah diberikan hormon Oodev® kecuali perlakuan D1M1 (Dopamin 10-5 mol + Medroxyprogesterone 1,5 mL) dan D2 (Dopamin 10-10 mol). Hal ini sesuai dengan pernyataan Sari (2014), pemberian Oodev® 1 mL kg-1 dapat meningkatkan nilai IKG pada ikan betok. Selain itu penggunaan PMSG dan anti dopamin dapat meningkatkan nilai IKG pada ikan sidat (Sudrajat et al. 2014). Pada kedua perlakuan yang tidak mengalami perkembangan gonad kemungkinan membutuhkan dosis Oodev® yang lebih banyak dibandingkan perlakuan lainnya. Hal ini sesuai dengan pernyataan Tinikul
et al. (2009a), dopamin dapat menghambat pematangan gonad dan perkembangan oosit pada udang galah dengan bobot 42,71±5,8 g tetapi bahan kimia ini tidak berpengaruh terhadap proses pematangan gonad yang diinduksi secara hormonal.
Hasil histologi gonad udang galah pascainduksi penghambatan berada pada tahap previttelogenic dan vittelogenic sedangkan kontrol berada pada tahap
mature. Hal ini terlihat pada Tabel 2 perlakuan yang diberikan dopamin dan
medroxyprogesterone terdapat sel awal oogonia dan oosit yang berkembang karena pertambahan sitoplasma dibandingkan dengan perlakuan kontrol yang inti sel nya sudah melebur. Berdasarkan perbandingan histologi gonad dari Meeratana & Sobhon (2007) dan Ngernsoungnern et al. (2009), pada tahap previttelogenic, oosit berbentuk oval, terdapat nukleolus yang dikelilingi oleh nukleus dan terdapat folikel sel sedangkan pada tahap vittelogenic oosit lebih besar dari tahap
previttelogenic, terdapat nukleolus yang dikelilingi oleh nukleus, terdapat folikel sel yang mengelilingi oosit dan mengandung butiran lemak. Pada perlakuan kontrol oosit berukuran hampir dua kali lipat dari tahap vittelogenic dan ovarium penuh dengan oosit matang. Menurut Soonklang et al. (2012), tahap tersebut merupakan tahap udang sudah matang gonad. Hasil histologi gonad udang galah pascainduksi maturasi berada pada tahap mature kecuali pada perlakuan D2 (Dopamin 10-10 mol) dan perlakuan D1M1 (Dopamin 10-5 +
Medroxyprogesterone 1,5 mL). Hal ini membuktikan bahwa hormon Oodev® mampu melakukan proses maturasi setelah udang diberi dopamin dan
medroxyprogesterone. Qonitah (2013), melaporkan induksi Oodev® dapat mempercepat kematangan gonad 80% pada udang vaname betina. Pada kedua perlakuan yang tidak mengalami perkembangan gonad kemungkinan membutuhkan dosis Oodev® yang lebih banyak dibandingkan perlakuan yang lainnya. Hal ini sejalan dengan pernyataan Tinikul et al. (2008), bahwa dopamin mampu menunda pematangan oosit dengan menahan meosis pada tahap profase.
Laju pertumbuhan harian pada populasi udang perlakuan D2 (Dopamin 10-10 mol) lebih tinggi dibandingkan populasi udang perlakuan yang lainnya. Hal ini sesuai dengan pernyataan Vance et al. (1986), pemberian dopamin dapat meningkatkan kadar hormon pertumbuhan. Dopamin dapat menekan hormon somastatin pada hipotalamus sehingga dapat menstimulasi GHRH (Growth Hormone Releasing Hormone) untuk mensekresikan hormon pertumbuhan. Menurut Jin & Hashizume (2014), dopamin pada hipotalamus terlibat dalam mekanisme regulasi hormon pertumbuhan dan prolaktin pada kambing.
15 Menurut Chang et al. (2007), setelah 2 jam penyuntikan dopamin dengan dosis 10-6, 10-7 dan 10-8 mol secara signifikan menurunkan oxyhemocyanin pada udang windu. Menurunnya oxyhemocyanin dapat mengganggu sistem kerja metabolisme tubuh, osmoregulasi dan respirasi yang mengakibatkan udang sulit beradaptasi dalam lingkungan dan stres. Pada krustasea fenomena molting terjadi karena beberapa faktor yaitu pertumbuhan, reproduksi dan stres (Hess 2014) sedangkan sifat udang galah juga cenderung kanibal (New 2002). Pada saat udang galah molting kondisi tubuhnya lemah sehingga menjadi mangsa bagi udang galah lainnya yang tidak sedang molting, fenomena ini dapat mengakibatkan kematian (New 2002).
Waktumaturasi tercepat terdapat pada populasi udang perlakuan M2, D2M1, D1M2 selama 8 hari setelah penyuntikan Oodev®, populasi udang perlakuan D1, M1, D2M2, kontrol selama 16 hari setelah penyuntikan Oodev® dan waktu maturasi terlama terdapat pada perlakuan D2 dan D1M1 selama 30 hari setelah penyuntikan Oodev®. Menurut a’ananet al. (1991), waktu maturasi udang galah selama 42 hari. Hal ini menunjukkan pemberian Oodev® mampu mempercepat waktu maturasi pada perlakuan M2, D2M1, D1M2, D1, M1, D2M2 dan kontrol sedangkan pada perlakuan D2 dan D1M1 diduga dosis Oodev® yang diberikan belum mampu untuk menginduksi maturasi sehingga membutuhkan waktu maturasi yang lebih lama dibandingkan perlakuan yang lainnya. Hal ini sejalan dengan pernyataan Tinikul et al. (2009a), dopamin dapat menghambat pematangan gonad dan perkembangan oosit pada udang galah dengan bobot 42,71±5,8 g tetapi bahan kimia ini tidak terhadap proses pematangan gonad yang diinduksi secara hormonal.
Kualitas air merupakan salah satu faktor yang mempengaruhi kelangsungan hidup udang. Nilai suhu, kelarutan oksigen dan pH selama pemeliharaan udang galah memiliki kisaran yang tidak terlalu jauh (Tabel 4). Kisaran suhu selama masa pemeliharaan sebesar 28,7-30,1°C. Kisaran suhu ini masih dalam kondisi optimum untuk kehidupan udang galah yaitu 28-31°C (New 2002). Oksigen terlarut selama pemeliharaan memiliki kisaran 3,7-8,46 ppm. Kisaran oksigen terlarut ini masih dalam kondisi optimum untuk kehidupan udang galah yaitu 3-7 ppm (New 2002). Nilai pH pada masa pemeliharaan udang memiliki kisaran 5,4-7. Nilai pH ini dibawah standar kondisi optimum untuk kehidupan udang galah yaitu 7-8,5 (New 2002). Namun, tidak mempengaruhi kelangsungan hidup udang galah selama pemeliharaan.
4 SIMPULAN DAN SARAN
Simpulan
1. Pemberian dopamin, medroxyprogesterone dan premix dopamin
16
2. Perlakuan dopamin 10-10 mol udang-1, medroxyprogesterone 150 mg 3 mL-1 bobot tubuh-1 dan premix dopamin 10-10 mol udang-1 dan medroxyprogesterone
150 mg 3 mL-1 bobot tubuh-1 efektif untuk penghambatan reproduksi dan peningkatan laju pertumbuhan melalui penurunan konsentrasi estradiol dalam hemolim.
3. Udang galah dapat diinduksi maturasi dengan menggunakan Oodev®, baik pada udang yang mengalami penghambatan pematangan gonad maupun tidak. 4. Udang yang mengalami penghambatan dengan medroxyprogesterone 150 mg
3 mL-1 bobot tubuh-1 lebih cepat matang gonad setelah diinduksi maturasi. 5. Pengembangan aplikasi hormon masih perlu disempurnakan untuk mengurangi
tingkat stres akibat penyuntikan. Aplikasi melalui pakan perlu dieksplorasi untuk meningkatkan tingkat kelangsungan hidup udang galah betina.
Saran
1. Untuk menghindari reproduksi dini dan mendapatkan induk udang galah betina yang berukuran besar dapat dilakukan penghambatan reproduksi dengan cara pemberian medroxyprogesterone 150 mg 3 mL-1 kg-1 2 minggu-1 sebanyak 3 kali pada udang yang berukuran awal 11,27±0,97 g.
2. Untuk mempercepat maturasi udang galah dapat dilakukan dengan induksi secara hormonal dengan pemberian Oodev® minimal sebanyak 1 mL kg-1 bulan-1
17
DAFTAR PUSTAKA
Aizen J, Kobayashi M, Selicharova I, Sohn YC, Yoshizaki G, Levavi-Sivan B. 2012. Steroidogenic response of carp ovaries to piscine FSH and LH depends on the reproductive phase. General and Comparative Endocrinology. 178:28-36.
Akbar F, Sudrajat AO, Subaidah S. 2015. Sperm quality of Litopenaeus vannamei
broostock injected by PMSG and antidopamin. Jurnal Akuakultur
Indonesia. 14 (2):98-103
Allayie SA, Ravichandran S, Bhat BA. 2010. Role of mandibular glands in growth of mangrove crab Charybdis lucifera (Fabricius, 1798). World Journal of Zoology. 5(2):125-128.
Cavalli OC, Lavens P, Sorgeloos P. 2001. Reproduktive performance of
Macrobrachium rosenbergii females in capacity. Journal of the World Aquaculture Society. 32(1):60-67.
Chang CH, Wu ZR, Chen CS, Kuo CM, Cheng W. 2007. Dopamine modulates
the physiological response of the tiger shrimp Penaeus monodon.
Aquaculture. 270:333-342.
Chang ES, Mykles DL. 2011. Regulation of crustacean molting: A review and our perspectives. General and Comparative Endocrinology.172:323-330.
Daido I, Tahir AM, Chalid T. 2014. Changes of body mass index and lipi profile in injectable depot medroxyprogesterone acetate and levonorgestrel implant acceptors. Indonesian Journal of Obstetrics and Gynecology. 2(3):1-15. Dufour S, Sebert ME, Weltzien FA, Rousseau K, Pasqualini C. 2010.
Neuroendocrine control by dopamine of teleost reproduction. Journal of Fish Biology. 76:129-160.
Effendi I. 2004. Pengantar Akuakultur. Depok (ID): Penebar Swadaya.
Effendie MI. 2002. Biologi Perikanan. Bogor (ID): Yayasan Pustaka Nusatama. [FAO] Food and Agriculture Organization. 2015. Production Statistics giant
freshwater prawn, Macrobrachium rosenbergii. [Internet] [diunduh 22 Desember]. Tersedia dari www.fao.org
Fingerman M. 1997. Roles of neurotransmitters in regulating reproductive hormone release and gonadal maturation in decapod crustaceans.
Invertebrate Reproduction and Development. 31:47-54.
Hess WN. 2014. Actors influencing moulting in the crustacean. Crangon armillatus. Marine Biological Laboratory. 81(2):215-220.
Huang H, Ye H, Li S, Wang G. 2008. Immunocytological evidence for the presence of vertebrate FSHand LH-like substances in the brain and thoac ganglion of the swimming crab, Portunus trituberculatus. Natural Science.
18:1453-1457.
Huberman A. 2000. Shrimp endocrinology. A review. Aquaculture. 191:191-208.
Jin J, Hashizume T. 2014. Effects of hypothalamic dopamine on growth
hormone-releasing hormone-Induced growth hormone secretion and
thyrotropin-releasing hormone-induced prolactin secretion in goats. Animal
18
Krettiawan H, Anggraeni F. 2015. Evaluasi potensi seleksi individu secara simultan berdasarkan karakter pertumbuhan dan kematangan kelamin udang galah betina Macrobrachium rosenbergii (de man 1879). Bogor (ID): Forum Inovasi Teknologi Akuakultur.
Lee TC, Miller WL, Auchus RJ. 1999. Medroxyprogesterone acetate and
dexamethasone are competitive inhibitors of different human steroidogenic
enzymes. Journal of Clinical Endocrinology and Metabolism.
84(6):2104-2110.
Malarkey WB, Burleson M, Cacioppo JT, Poehlmann K, Glaser R, Kiecolt-Glaser JK. 1997. Differential effects of estrogen and medroxyprogesterone
on basal and stress-induced growth hormone release, IGF-1 levels, and cellular immunity in postmenopausal women. Endocrine.7(2):227-233. Meeratana P, Sobhon P, 2007. Classification of differentiating oocytes during
ovarian cycle in the giant freshwater prawn, Macrobrachium rosenbergii (de man 1879). Aquaculture. 270:249-258.
Moles MLF. 2006. Biochemical and functional aspects of crustacean hyperglycemic hormone in decapod crustaceans. Comparative Biochemistry and Physiology. 142:390-400.
Moore WT, Ward DN. 1980. Pregnant Mare Serum Gonadotropin rapid chromatographic procedures for the purification of intact hormone and isolation of subunit. Journal of Biological Chemistry. 17(4):6928-6929. Nagaraju GPC. 2011. Review Reproductive regulators in decapod crustaceans : an
overview.The Journal of Experimental Biology. 214:3-16.
Nagaraju GPC, eddy P , eddy PS 2 4 Mandibular organ: it’s relation to body weigh, sex, molt and reproduction in the crab Oziotelphusa senex senex ( Fabricus 1971). Aquaculture. 232:603-612.
New M.B. 2002. Farming freshwater prawns: a manual for the culture of the giant river prawn Macrobrachium rosenbergii. FAO FisheriesTechnical Paper. pp 1-20.
Ngernsoungnern P, Ngernsoungnern A, Sobhon P, Sretarugsa P. 2009. Gonadotropin releasing hormone (GnRH) and a GnRH analog induce ovarian maturation in the giant freshwater prawn, Macrobrachium rosenbergii.Invertebrate Reproduction and Development. 53:125-135. Ngernsoungnern P, Ngernsoungnern A, Kavanaugh S, Sobhon P, Sower SA,
Sretarugsa P. 2008. The identification and distribution of gonadotropin-releasing hormone-like peptides in the central nervous system and ovary of the giant freshwater prawn, Macrobrachium rosenbergii. Invert Neurosci
8:49-57.
Novienti DM. 2001. Penentuan Dosis Dopamin untuk Menunda Pematangan Gonad Induk Udang Windu Penaeus monodon Afkir [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Qonitah AM. 2013. Rekayasa Hormonal Pada Udang Vaname Selama 14 Hari Sebagai Pengganti Teknik Ablasi Mata Dalam Usaha Percepatan Pematangan Gonad [skripsi]. Bogor (ID): Institut Pertanian Bogor.
19 acid) Microspheres: New Strategy for Encapsulating Small Hydrophilic Drugs with High Efficience. Biotechnol. 3(1):215-233
Soonklang N, Meeratana P, Chaitip W, Peter JH, Michael JS, And Sobhon P,
Praphaporn S. 2012. Ultrastructure of differentiating oocytes and
vitellogenesis in the giant freshwater prawn, Macrobrachium rosenbergii
(de Man). Microscopy Research And Technique. 00:1-14.
Steele WB, Garcia SN, Huggett DB, Venables BJ, Barnes SE, Point TWL. 2013. Tissue-specific bioconcentration of the synthetic steroid hormone
medroxyprogesterone acetate in the common carp Cyprinus carpio. Environmental Toxicology and Pharmacology. 36:1120-1126.
Sudrajat AO, Sugati A, Alimuddin. 2014. Induksi maturasi ikan sidat Anguilla bicolor menggunakan kombinasi hormon berbeda. Jurnal Akuakultur Indonesia. 2(12):189-201
Suherman SK. 2008. Farmakologi dan Terapi. Edisi 5 FKUI. Gaya Baru, Jakarta. hlm 455-467.
Swetha CH, Sainath SB, Reddy PR, Reddy PS. 2011. Reproductive endrocrinologi of female crustacean : persepective and prospective. Marine Science Research and Development. 3:1-13.
Riani E, Toelihere M, Effendi I, Yusuf TL, and Agung PS. 2010. Quality Improvement Of Disqualified Tiger Prawn Penaeus monodon FAB Broodstock using dopamin. Biotropia.17(1):17-21.
Tinikul Y, Jaruwan P, Tinikul R., Anuracpreeda P, Chotwiwatthanakun C, Senin P, Poomtong T, Hanna PJ, Sobhon P. 2014. Effects of gonadotropin-releasing hormones and dopamin on ovarian maturation in the Pacific white shrimp Litopenaeus vannamei and their presence in the ovary during ovarian development. Aquaculture. 420:79-88.
Tinikul Y, Soonthornsumrith B, Phoungpetchara I, Meeratana P, Poljaroen J, Duangsuwan P, Soonklang N, Mercier A.J, Sobhon P. 2009a. Effects of serotonin, dopamin, octopamine, and spiperone on ovarian maturation and embryonic development in the giant freshwater prawn Macrobrachium rosenbergii (De Man, 1879). Crustaceana. 82:1007-1022.
Tinikul Y, Mercier AJ, Sobhon P, 2009b. Distribution of dopamine and
octopamine in the central nervous system and ovary during the ovarian maturation cycle of the giant freshwater prawn Macrobrachium rosenbergii.
Tissue Cell. 41:430-442.
Tinikul Y, Mercier J, Soonklang N, Sobhon P. 2008. Changes in the levels of serotonin and dopamin in the central nervous system and ovary, and their possible rolesin the ovarian development in the giant freshwater prawn,
Macrobrachium rosenbergii. General and Cimparative Endocrinology
20
Vance ML, Kaiser DL, Frohman LA., Rivier J, Vale WW, Thorner MO. 1986. Role of dopamine in the regulation of growth hormone secretion: dopamine and bromocriptine augment growth hormone (GH)-releasing hormone-stimulated GH secretion in normal man. Journal of Clinical Endocrinology and Metabolism. 64(6):1136-1141.
21
22
Lampiran 1 Metode ELISA (enzyme linked immuno sorbent assay)
1. Semua reagen dibiarkan pada suhu kamar (18-25 °C) sebelum digunakan 2. Selanjutnya dipersiapkan terlebih dahulu larutan standar dengan konsentrasi
25, 50, 100, 250, 500, 1000 dan 2000 pg mL-1 dan larutan QC (quality control)
3. Dimasukkan ke dalam masing-masing sumur pelat (microplate) sebanyak 25 µl standar, sampel dan QC (quality control)
4. Ditambahkan 200 µl konjugat enzim HRP Estradiol (Enzym Conjugate) ke dalam setiap sumur, kemudian dikocok perlahan selama kurang lebih 10 deti 5. Inkubasi pada suhu kamar selama 2 jam
6. Setelah diinkubasi, larutan pada pelat dibuang dan dicuci dengan larutan pencuci (washing solution) dengan volume 300 µl setiap sumur. Pencucian dilakukan sebanyak 4 kali menggunakan alat Microplate Strip Washer.
Setelah pencucian selesai, dikeringkan dengan cara dibanting secara perlahan pada kertas penyerap
7. Ditambahkan 100 µl larutan substrat (TBM Substrate) pada masing-masing sumur pelat
8. Inkubasi selama 20 menit pada suhu ruang
9. Setelah inkubasi dengan larutan substrat, reaksi enzimatis dihentikan dengan menambahkan 50µL larutan penyetop (Stop Solution, H2SO4 0,5 M) ke dalam setiap sumur pelat
10. Setelah itu, absorbans dibaca pada panjang gelombang 450 nm menggunakan
ELISA reader (absorbance microplate reader, Biorad) yang telah dilengkapi dengan program MPM6. Pembacaan dilakukan tidak boleh lebih dari 10 menit setelah penambahan larutan penyetop reaksi
Lampiran 2 Prosedur histologi gonad
1. Udang dibedah dan diambil gonadnya, gonad dicuci dengan NaCl fisiologis 0,65%, selanjutnya difiksasi dalam larutan davidson selama 24 jam. Gonad yang sudah difiksasi dipindahkan ke dalam alkohol 70% beberapa kali hingga kuning telur hilang
2. Gonad didehidrasi ke dalam alkohol dengan konsentrasi bertingkat yaitu (80%, 85%, 90%, dan 95%) masing-masing selama 2 jam kemudian pindahkan ke dalam alkohol berkonsentrasi 100% sebanyak 4 kali masing- masing selama satu jam
3. Organ dibersihkan, didalam alkohol 100% + xylol (1 : 1) selama 45 menit, kemudian ke dalam xylol I, II dan III masing-masing selama 45 menit
4. Organ direndam kembali kedalam xylol + parafin (1 : 1) selama 45 menit pada suhu 60o C. Kemudian direndam ke dalam parafin I, II dan III masing- masing selama 45 menit dalam suhu 65oC
5. Selanjutnya organ ditanam dalam blok parafin cair pada suhu 60 C selama 24 jam sampai parafin mengeras
23 7. Untuk deparafinasi, preparat berturut-turut direndam dengan menggunakan xylol I, II, alkohol 100% I, 100% II, 95%, 90%, 85%, 80%, 70% dan 50% dan dicuci sampai warna putih
8. Pewarnaan preparat dilakukan dengan merendam ke dalam cairan hamotoxylin selama 2 menit selanjutnya dibersihkan dengan mencuci dengan air kran mengalir
9. Dehidrasi terhadap preparat dilakukan dengan merendam secara berturut-turut dalam alkohol 70%, 80%, 85%, 90%, 95% I, 95% II, 100% I dan 100% II masing-masing selama satu menit
10. Penjernihan warna objek preparat dilakukan dengan merendam di dalam xylol I dan xylol II masing-masing selama 1 menit
11. Preparat diberi zat perekat Canada balsem, selanjutnya ditutup dengan gelas penutup, dikeringkan selama 10 menit dan di beri label sesuai dengan perlakuan sehingga didapatkan preparat permanen histologi gonad yang dapat diamati dibawah mikroskop
12. Pengamatan histologi dan pengambilan file gambar dilakukan menggunakan mikroskup binokuler Olympus CX31, gambar dikoneksikan dengan CCTV Sony mode SSC. G113 ke komputer. Selanjutnya ditampilkan pada monitor dengan menggunakan window 7 melalui program software Grabee. Objek amatan terbaik selanjutnya di simpan pada flashdisk
Lampiran 3 Hasil Uji ANOVA
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda terhadap kosentrasi estradiol pascainduksi penghambatan pada selang kepercayaan 95%.
Medroxyprogesterone N Mean Grouping
1 9 1,521 A
2 9 1,423 A B
3 9 1,345 B
Uji lanjut Tukey pengaruh dosis dopamin yang berbeda terhadap kosentrasi estradiol
pascainduksi penghambatan pada selang kepercayaan 95%.
Dopamin N Mean Grouping 2 9 1,560 A 1 9 1,379 B 3 9 1,351 B
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda dan dosis dopamin yang berbeda terhadap kosentrasi estradiol pascainduksi penghambatan pada selang kepercayaan 95%.
medroxyprogesterone dopamin N Mean Grouping
24
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda terhadap kosentrasi estradiol pascainduksi maturasi pada selang kepercayaan 95%.
medroxyprogesterone N Mean Grouping 3 9 1,790 A 2 9 1,717 A 1 9 1,463 B
Uji lanjut Tukey pengaruh dosis dopamin yang berbeda terhadap kosentrasi estradiol pascainduksi maturasi pada selang kepercayaan 95%.
dopamin N Mean Grouping 1 9 1,809 A 3 9 1,618 A B 2 9 1,543 B
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda dan dosis dopamin yang berbeda terhadap kosentrasi estradiol pascainduksi maturasi pada selang kepercayaan 95%.
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda terhadap indeks kematangan gonad pascainduksi penghambatan pada selang kepercayaan 95%.
25
Uji lanjut Tukey pengaruh dosis dopamin yang berbeda terhadap indeks kematangan gonad pascainduksi penghambatan pada selang kepercayaan 95%.
dopamin N Mean Grouping 1 6 1,6986 A 3 6 0,7719 A B 2 6 0,4068 B
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda dan dosis dopamin yang berbeda terhadap indeks kematangan gonad pascainduksi penghambatan pada selang kepercayaan 95%.
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda terhadap indeks kematangan gonad pascainduksi maturasi pada selang kepercayaan 95%.
Medroxy N Mean Grouping 3 6 3,7500 A 2 6 3,3400 A 1 6 1,7567 B
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda terhadap indeks kematangan gonad pascainduksi maturasi pada selang kepercayaan 95%.
dopamin N Mean Grouping 1 6 3,3633 A 3 6 3,0517 A 2 6 2,4317 B
26
Laju pertumbuhan harian pascainduksi penghambatan
Source DF Seq SS Adj SS Adj MS F P medroxy 2 0,05523 0,05523 0,02762 0,83 0,454 dopamin 2 0,02216 0,02216 0,01108 0,33 0,722 medroxy*dopamin 4 1,07091 1,07091 0,26773 8,00 0,001 Error 18 0,60235 0,60235 0,03346
Total 26 1,75065
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda terhadap laju pertumbuhan harian pascainduksi penghambatan pada selang kepercayaan 95%.
medroxyprogesterone N Mean Grouping 3 9 1,2781 A 1 9 1,1872 A 2 9 1,1778 A
Uji lanjut Tukey pengaruh dosis dopamin yang berbeda terhadap laju pertumbuhan pascainduksi penghambatan pada selang kepercayaan 95%.
dopamin N Mean Grouping 3 9 1,2437 A 2 9 1,2239 A 1 9 1,1755 A
Uji lanjut Tukey pengaruh dosis medroxyprogesterone yang berbeda dan dosis dopamin yang berbeda terhadap laju pertumbuhan harian pascainduksi penghambatan pada selang kepercayaan 95%.
27