FAKUL
LTAS MAT
I
HILMAN
DEPART
TEMATIKA
INSITUT P
NIE RAMA
TEMEN BIO
A DAN ILM
ERTANIAN
BOGOR
2013
ADHAN
OKIMIA
MU PENGET
N BOGOR
ABSTRAK
HILMANIE RAMADHAN. Analisis Inhibisi Enzim
α
-Glukosidase dan
Sitotoksisitas Ekstrak Air-Etanol Benalu Jeruk (
Loranthus spp
.). Dibimbing oleh
ANNA P ROSWIEM dan WARAS NURCHOLIS.
Benalu jeruk merupakan tumbuhan parasit yang termasuk ke dalam suku
Loranthaceae
yang hidup menempel pada tumbuhan jeruk (
Citrus spp.
).
Penelitian ini bertujuan untuk menguji aktivitas antidiabetes dan sitotoksisitas
ekstrak benalu jeruk dengan variasi pelarut ekstraksi yaitu air dan etanol.
Aktivitas antidiabetes ekstrak benalu jeruk diuji dengan metode inhibisi enzim
α
-glukosidase dan menggunakan
acarbose
sebagai kontrol positif. Sitotoksisitas
benalu jeruk dilakukan dengan metode BSLT (
Brine Shrimp Lethality Test
).
Ekstraksi benalu jeruk dilakukan secara maserasi dengan pelarut air, etanol 30%,
70%, dan 96%. Penghambatan enzim
α
-glukosidase ekstrak air, etanol 30%, 70%,
dan 96% memiliki nilai IC50 berturut-turut sebesar 3488; 180; 65.15; dan 70.71
ppm. Nilai IC50
acarbose
sebagai pembanding adalah sebesar 0.04 ppm. Hasil
pengujian pada ekstrak etanol 70% dan 96% menunjukkan benalu jeruk
berpotensi sebagai antidiabetes. Pengujian toksisitas ekstrak air, etanol 30%, 70%,
dan 96% memperoleh nilai LC50
berturut-turut sebesar 699.92; 648.15; 864.60;
dan 978.85 ppm. Hasil pengujian toksisitas menunjukkan semua ekstrak bersifat
toksik karena memiliki nilai LC50 yang termasuk dalam golongan toksik.
Kata kunci : Benalu jeruk,
α
-glukosidase, Sitotoksisitas
ABSTRACT
HILMANIE RAMADHAN. Analysis of
α
-Glucosidase Enzyme Inhibition and
Cytotoxicity of Water-Ethanol
Loranthus spp.
Extract. Under direction of ANNA
P ROSWIEM and WARAS NURCHOLIS.
Loranthus spp.
is a plant parasite belonging to the Loranthaceae tribes that
live attached to the citrus plants (
Citrus spp
.). This study aimed to examine
antidiabetic activity and cytotoxicity of
Loranthus spp
. with the variation of
solvent extraction of water and ethanol. Antidiabetic activity of the extracts was
tested by the method of inhibition against
α
-glucosidase enzyme activity and
using
acarbose
as a positive control. Cytotoxicity of
Loranthus spp
. extracts was
conducted by BSLT (
Brine Shrimp Lethality Test
). Extraction of
Loranthus spp
.
carried by maceration with water solvent, 30% ethanol, 70% and 96%. Inhibition
of
α
-glucosidase enzyme extract water, ethanol 30%, 70%, and 96% had IC50
values, respectively for 3488, 180, 65.15, and 70.71 ppm. IC50 values for
acarbose
as a comparison is 0.04 ppm. The test results in 70% and 96% ethanol
extract showed
Loranthus spp
. have an antidiabetic. Toxicity testing of water
extract, ethanol 30%, 70%, and 96% gain in a row LC50 value of 699.92; 648.15;
864.60, and 978.85 ppm. Toxicity test results showed all the extracts are toxic
because it had LC50 values were included in the class according to the degree of
toxicity.
Analisis Inhibisi Enzim
α
-Glukosidase dan Sitotoksisitas Ekstrak
Air-Etanol Benalu Jeruk (Loranthus spp.)
HILMANIE RAMADHAN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSITUT PERTANIAN BOGOR
Judul Skripsi : Analisis Inhibisi Enzim
α
-Glukosidase dan Sitotoksisitas Ekstrak
Air-Etanol Benalu Jeruk (
Loranthus spp
.)
Nama
: Hilmanie Ramadhan
NIM
: G84070063
Disetujui
Komisi Pembimbing,
Dr. Anna P Roswiem, MS
Waras Nurcholis, S.Si, M.Si
Ketua
Anggota
Diketahui,
Dr. I Made Artika, M. App. Sc
Ketua Departemen Biokimia
PRAKATA
Assalamu’alaikum Warahmatullahi Wabarakatuh
Puja puji serta syukur penulis ucapkan pada Allah, Rabb semesta alam yang
telah mencurahkan begitu banyak nikmat, begitu banyak kemudahan dalam hidup
penulis hingga mampu menyelesaikan laporan penelitian ini dengan lancar. Tak
lupa pula shalawat beriringkan salam kepada Nabi besar penyampai risalah Allah
dan penutup para nabi yaitu Nabi Muhammad
Shallallahu ‘Alaihi Wasallam
, yang
berkat jasa beliau manusia bisa mengenal Allah-nya lewat Islam.
Terima kasih juga penulis ucapkan pada Ibu Anna P Roswiem dan Bapak
Waras Nurcholis atas bimbingan, arahan berikut kritik dan sarannya dalam
penulisan laporan penelitian ini. Secara khusus juga penulis ucapkan terima kasih
yang sangat besar pada kedua orang tua penulis Ayah dan Ibu atas doa dan
dorongan semangat untuk kesuksesan, kelancaran dan kemudahan jalan hidup
bagi penulis. Terima kasih yang sebesar-besarnya kepada Sri Laraswati yang telah
banyak membantu penulis dan teman - teman biokimia 44, Ganep, Isa, Deo, Indra,
Rama, Danio dan teman - teman lainnya yang tidak dapat dituliskan satu-persatu.
Kepedulian dan bantuan mereka sangat berarti, sehingga penulis dapat
menyelesaikan dan terus bersemangat dalam menjalani hidup.
Penulis sadar penuh bahwa tulisan dalam laporan penelitian ini masih sangat
jauh dari kesempurnaan, oleh karena itu saran maupun kritik yang membangun
sangat penulis harapkan. Penulis berharap hasil penelitian ini dapat memberikan
kontribusi bagi masyarakat secara umum dalam hal pemanfaatan benalu jeruk
dalam kesehariannya.
Wassalamu’alaikum warahmatullahi wabarakatuh
Bogor, Maret 2013
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 19 April 1989 sebagai anak ketiga
dari tiga bersaudara, putra dari pasangan Sukirmin Haryanto dan Ana Kurnia.
Tahun 2007 penulis lulus dari SMA Negeri 78 Jakarta Barat dan memperoleh
kesempatan melanjutkan studi di Institut Pertanian Bogor melalui Seleksi
Penerimaan Mahasiswa Baru (SPMB). Penulis kemudian memilih Fakultas
Matematika dan Ilmu Pengetahuan Alam (FMIPA) dan mengambil Biokimia
sebagai mayor.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... vi
DAFTAR LAMPIRAN ...
viPENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 2
Benalu Jeruk ... 2
Diabetes Melitus ... 3
Enzim
α
-glukosidase ... 4
Metode Ekstraksi dan Pelarut ... 5
BAHAN DAN METODE ... 5
Bahan dan Alat ... 5
Metode Penelitian ... 5
HASIL DAN PEMBAHASAN...6
Kadar Air Benalu Jeruk ... 7
Ekstrak Benalu Jeruk ... 7
Inhibisi Enzim
α
-Glukosidase ... 7
Uji Toksisitas Metode BSLT ... 9
SIMPULAN DAN SARAN...10
DAFTAR PUSTAKA ... 10
LAMPIRAN ... 13
DAFTAR GAMBAR
Halaman
1 Benalu (
Loranthus spp.
) ... 2
2 Struktur Acarbose ... 4
DAFTAR TABEL
Halaman
1 Nilai rendemen ekstrak benalu jeruk... 7
2 Uji aktivitas inhibisi enzim
α
-glukosidase ... 8
3 Tingkat kekuatan IC50 ... 9
4 LC50 ekstrak benalu jeruk... 9
5 Tingkat toksisitas suatu ekstrak ... 9
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 15
2 Perhitungan kadar air serbuk benalu jeruk ... 16
3 Rendemen hasil ekstraksi benalu jeruk ... 17
4 Data nilai absorbansi dan % inhibisi ekstrak etanol 96% benalu jeruk ... 18
5 Data nilai absorbansi dan % inhibisi ekstrak etanol 70% benalu jeruk ... 19
6 Data nilai absorbansi dan % inhibisi ekstrak etanol 30% benalu jeruk ... 20
7 Data nilai absorbansi dan % inhibisi ekstrak air benalu jeruk ... 21
PENDAHULUAN
Salah satu kebiasaan manusia yang diwarisi dari nenek moyangnya adalah melakukan pengobatan sendiri jika menderita sakit. Pengobatan sendiri di Indonesia dilakukan dengan menggunakan obat tradisional atau jamu dan obat-obat paten baik dari golongan obat bebas maupun golongan obat bebas terbatas (Sartono 1996). Sejak ribuan tahun yang lalu, obat dan pengobatan tradisional sudah ada di Indonesia, jauh sebelum pelayanan kesehatan formal dengan obat-obatan modernnya dikenal masyarakat (Wijayakusuma 2002). Tumbuh-tumbuhan punya peran penting dalam kehidupan masyarakat, baik sebagai sumber pangan, papan, maupun obat-obatan. Dewasa ini telah terjadi perubahan gaya hidup pada masyarakat. Salah satu diantaranya adalah pergeseran pola makan. Ada kecenderungan masyarakat untuk mengkonsumsi makanan cepat saji atau fast food. Komposisi makanan cepat saji tersebut pada umumnya banyak mengandung karbohidrat dan lemak. Hasil studi yang dilakukan oleh Nuryati (2009) menunjukkan bahwa pria berumur 45 tahun atau lebih tua beresiko 12,7 kali lebih tinggi terkena diabetes mellitus dibanding pria berumur lebih muda dari 45 tahun, sedangkan wanita berumur 45 tahun atau lebih tua beresiko 13,0 kali lebih tinggi terkena diabetes mellitus dibanding wanita berumur lebih muda dari 45 tahun.
Diabetes mellitus (DM) telah dikategorikan sebagai penyakit global oleh World Health Organization (WHO) dengan jumlah penderita di dunia mencapai 199 juta jiwa pada tahun 2009. Menurut statistik dari studi Global Burden of Disease WHO pada tahun 2004, Indonesia menempati peringkat pertama di Asia Tenggara, dengan prevalensi penderita sebanyak 8,426,000 jiwa di tahun 2000 dan diproyeksi meningkat 2,5 kali lipat sebanyak 21,257,000 penderita pada tahun 2030 (Astiyandani 2010). Diabetes mellitus (DM) adalah kondisi konsentrasi glukosa dalam darah secara kronis lebih tinggi daripada nilai normal (hiperglikemia) akibat tubuh kekurangan insulin atau fungsi insulin tidak efektif (Widiastuti 2008). Diabetes mellitus terdiri atas dua tipe utama, yaitu DM tipe 1 dan DM tipe 2. DM tipe 1, sel beta pankreas yang kerja utamanya memproduksi insulin tidak mampu lagi memenuhi kebutuhan insulin tubuh bahkan produksinya dapat terhenti sama sekali (Pulungan & Herqutanto 2009), sedangkan DM tipe 2
Penelitian ini bertujuan untuk menguji aktivitas antidiabetes dan sitotoksisitas ekstrak benalu jeruk dari variasi pelarut ekstrak air dan etanol benalu jeruk. Aktivitas antidiabetes diuji dengan menggunakan metode inhibisi enzim α-glukosidase dengan acarbose sebagai kontrol positif. Adapun parameter uji yang digunakan adalah persen penghambatan aktivitas enzim α-glukosidase yang ditunjukkan dalam nilai IC50.
Hipotesis dalam penelitian ini adalah pelarut air dan etanol dapat mengekstraksi senyawa aktif dari benalu jeruk yang memiliki aktivitas antidiabetes dengan cara menghambat enzim α-glukosidase. Hasil penelitian ini diharapkan dapat memberikan informasi kepada masyarakat mengenai potensi benalu jeruk sebagai obat alternatif antidiabetes sehingga manfaat benalu jeruk dapat dieksplorasi secara optimal.
TINJAUAN PUSTAKA
Benalu Jeruk
Benalu (Loranthus spp.) merupakan salah satu kelompok tumbuhan parasit yang termasuk dalam suku Loranthaceae. Benalu merupakan jenis tumbuhan yang hidupnya tidak memerlukan media tanah. Benalu hidup sebagai parasit, menempel pada dahan-dahan pohon kayu lain dan mengisap mineral yang larut dalam pohon kayu yang ditempelinya. Bunga benalu berkelamin tunggal dan pada biji buahnya mengandung getah. Benalu biasanya terdiri atas akar pelekat, batang, daun, dan bunga (Gambar 1). Keunikan benalu adalah disatu pihak dianggap sebagai tumbuhan yang mengganggu karena sifat parasitnya pada tumbuhan komersial seperti teh dan tumbuhan penghasil buah-buahan, tetapi di lain pihak benalu dianggap sebagai tumbuhan yang bermanfaat karena potensinya sebagai tumbuhan obat. Pengembangbiakan benalu tersebut biasanya melalui binatang atau burung yang memakan biji buah benalu tersebut. Proses pengembangbiakannya sangat sederhana yaitu biji benalu yang bergetah itu dimakan binatang atau burung, kemudian biji benalu tersebut melekat di dahan kayu bersama dengan kotoran burung yang memakannya dan tumbuh di dahan itu. Tumbuhan parasit ini umumnya menyerang pepohonan atau tumbuhan perdu terutama pada bagian ranting dan cabang-cabangnya. Pohon atau perdu yang diserang benalu akan terganggu bahkan dapat mati apabila serangan tersebut dalam jumlah besar (Sunaryo et al.
2006). Benalu memiliki penyebaran yang sangat luas di semua belahan dunia. Hal ini dipengaruhi oleh migrasi fauna. Fauna yang berperan penting dalam penyebaran ini ialah burung. Burung bermigrasi pada waktu-waktu tertentu dikarenakan beberapa faktor seperti perubahan cuaca, kelangkaan jumlah makanan, dan kebiasaan burung tersebut. Burung-burung tersebut membawa biji yang dimakan oleh burung tersebut seusai memakan buah-buahan. Biji yang dibawa oleh burung tersebut kemudian akan jatuh di pohon daerah lain lalu akan tumbuh menjadi parasit di tumbuhan inang tersebut. Benalu banyak ditemukan di daerah tropis seperti di Asia Tenggara. Benalu di daerah tersebut banyak dijumpai di beberapa negara yang memiliki kawasan hutan yang luas, sebagai contoh benalu dapat dijumpai di Malaysia. Benalu di kawasan ini terdiri atas 23 marga dan 193 jenis (Barlow 1997), sedangkan di Jawa dilaporkan terdapat 14 marga dan 38 jenis benalu (Backer & Van Den Brink 1965).
Tanaman jeruk (Citrus spp.) adalah tanaman buah tahunan yang berasal dari Asia. Cina dipercaya sebagai tempat pertama kali jeruk tumbuh. Sejak ratusan tahun yang lalu, jeruk sudah tumbuh di Indonesia baik secara alami atau dibudidayakan. Tanaman jeruk yang ada di Indonesia adalah peninggalan orang Belanda yang mendatangkan jeruk manis dan keprok dari Amerika dan Itali. Keragaman genetik jeruk sangat luas, hal ini ditunjukkan dengan keragaman taksonomi yang sangat tinggi. Klasifikasi botani tanaman jeruk terdiri dari divisi Spermatophyta, sub divisi Angiospermae, kelas Dicotyledonae, ordo Rutales, keluarga Rutaceae, genus Citrus, dan spesies Citrus spp. (Cottin 1997).
Benalu jeruk merupakan tanaman benalu yang hidup menumpang pada tanaman jeruk. Biji benalu yang hinggap pada suatu tanaman dimakan oleh burung dan akan dikeluarkan bersama kotorannya. Biji benalu pada kotoran burung yang menempel pada dahan tanaman jeruk akan tumbuh dan hidup dengan mengisap mineral yang larut pada tanaman jeruk yang ditempelinya.
Gambar 1 Batang, bunga dan daun dari benalu (Loranthus spp.)
Diabetes Mellitus
Kelainan yang disebabkan oleh defisiensi insulin disebut diabetes melitus (Ganong 2002). Menurut Dallimunthe (2004) penyakit DM telah diketahui sejak ribuan tahun sebelum masehi. Ebers Papyurus menuliskan bahwa di Mesir sekitar tahun 1550 Sebelum Masehi ditemukan suatu penyakit yang ditandai dengan banyak kencing. Sebagian besar kasus DM disebabkan oleh rusaknya sel
β pankreas sehingga produksi insulin menjadi terhambat atau tidak ada sama sekali. Beberapa ahli berpendapat bahwa dengan meningkatnya umur, maka intoleransi terhadap glukosa juga meningkat.
Intoleransi glukosa pada usia lanjut berkaitan dengan obesitas, aktivitas fisik yang kurang, berkurangnya massa otot, penyakit penyerta, penggunaan obat – obatan, sehingga terjadi penurunan sekresi insulin dan resistensi insulin (Misnadiarly 2006). DM merupakan penyakit yang diturunkan atau diwariskan, bukan ditularkan. Para ahli kesehatan juga menyebutkan DM merupakan penyakityang terpaut kromosom seks atau kelamin. Faktor herediter sering kali pula penyebab timbulnya DM melalui peningkatan kerentanan sel – sel
β terhadap penghancuran oleh virus atau mempermudah perkembangan antibodi autoimun melawan sel – sel β, sehingga mengarah pada penghancuran sel – sel β.
Gejala klinis DM meliputi gejala – gejala pada stadium kompensasi dan dekompensasi pankreas, serta gejala – gejala kronik lainnya. Gejala – gejala pada stadium kompensasi, misalnya polifagia, poliuria, polidipsia dan penurunan berat badan. Adanya gejala klinis hiperglikemia dan glukosuria akan menyebabkan tekanan osmotik di dalam tubuli ginjal naik dan menghambat rearbsorsi air sehingga menyebabkan poliuria dan akibat adanya poliuria akan terus menerus menyebabkan dehidrasi tingkat jaringan. Penderita DM tidak dapat menggunakan glukosa dalam darah dan akan menggunakan lemak tubuhnya untuk mengganti energi atau makanan bagi sel, sehingga terjadi ketonemia dan ketonuria dan tubuh terlihat kurus. Adanya badan – badan keton di dalam darah akan menimbulkan terjadinya asidosis, sehingga frekuensi nafas meningkat dan penderita mengalami koma (Ressang 1984).
Cara umum yang digunakan untuk mendiagnosa penyakit DM didasarkan pada berbagai tes kimiawi terhadap urin dan darah (Guyton & John 1997). Pemeriksaan glukosa urin melalui tes sederhana atau kuantitatif laboratorium, dapat digunakan untuk
menentukan jumlah glukosa yang hilang dalam urin. American Diabetes Association (ADA 2004) menggunakan tiga standar untuk menentukan diagnose terjadinya DM, yaitu 1) konsentrasi glukosa plasma puasa lebih dari atau sama dengan 200 mg/dl atau 11.1 mmol/l; 2) glukosa plasma puasa lebih dari atau sama dengan 126 mg/dl atau 7 mmol/l, puasa dilakukan selama 8 jam; 3) glukosa darah lebih dari atau sama dengan 200 mg/dl atau 11.1 mmol/l (Rimbawan & Siagian 2004; Rubin 2004). Sebelum terjadi DM, biasanya diawali dengan prediabetes. Standar yang digunakan untuk mengetahui adanya prediabetes adalah bila gula darah sebelum makan mencapai 100 – 126 mg/dl atau 5.5 – 7 mmol/l dan glukosa darah setelah satu jam makan mencapai 140 – 199 mg/dl atau 7.8 – 11.1 mmol/l (Rubin 2004).
Pengobatan diabetes mellitus umumnya dilakukan dengan pengaturan diet, pemberian obat antidiabetes oral, dan terapi insulin. Akan tetapi pemberian obat-obatan antidiabetes oral dapat menimbulkan efek samping yang berbahaya. Efek tersebut dapat berupa gangguan mekanisme dalam tubuh hingga kematian (Tuyet & Chuyen 2007). Pemberian obat secara oral merupakan cara pemberian obat yang paling umum dilakukan karena mudah, murah, dan aman. Pada umumnya pemberian obat antidiabetes oral hanya dilakukan untuk penderita DM tipe 2, obat tersebut terbagi menjadi dua jenis diantaranya obat sintetik dan obat tradisional (Mathur & Shiel 2003). Obat sintetik yang memiliki aktivitas antidiabetes dibagi menjadi 4 kelas menurut mekanisme kerjanya. Pertama, golongan sulfonilurea yang memiliki mekanisme kerja utama pada peningkatan insulin. Kedua, golongan biguanida yang dapat mengurangi produksi glukosa hati sehingga dapat meningkatkan sensitivitas periferal dan mengurangi penyerapan glukosa intestinal. Ketiga, golongan inhibitor α -glukosidase salah satunya adalah Acarbose (Gambar 2). Obat ini dapat menghambat enzim spesifik yang menguraikan pati dalam usus halus sehingga menunda penyerapan glukosa hasil pemecahan karbohidrat di dalam usus. Keempat, merupakan insulin eksogen yang berperan dalam meningkatkan sensitivitas insulin secara tidak langsung dan menekan produksi glukosa hati (Thuyet & Chuyen 2007).
Klasifikasi Diabetes Mellitus
t D d D ( D d y i i m m M m k i t s m p d d s s m p s t t a & D a ( p m ( ( m a p i y r i S s g m p k d
tipe 1, DM Diabetes Mell dan tipe 2 DM Diabetes Mel (NIDDM).
Diabetes Tipe
Diabetes t ditandai oleh yang disebabk insulin. Diabe imun tubuh menghasilkan menghancurka Menurut PER memiliki ka ketoasidosis, insulin, onset terjadi pada um sel islet.
Individu y mempunyai cir poliphagia. B darah, pasien diberi 75 gra sebelumnya te satu malam, k meningkat leb pada individu sama akan me 140 mg/dl. Tin tubuh, mengak terhadap gluko akan mengand & Harvey 1994
Diabetes Tipe
Diabetes ti atau Diabetes M (NIDDM), penambahan mempertahank (Carolyn 200 (DMT2) merup metabolik yan akibat kelaina pankreas, gan insulin, atau ke Kasus diab yang umumny resistensi insu insulin belum Sel β pankreas sehingga terj glukosa darah meningkat. Ji pankreas, mak klinis, yang d darah yang me
yang tergantu litus Dependen M tidak tergan llitus Non-De
e 1
tipe 1 adala tingginya kad kan oleh ketiad tes tipe 1 terj menyerang insulin pada annya (Jacqui RKENI (2002) arakteristik pengobatanny akut, penderit mur muda, did
yang mengala ri – ciri poliur erdasarkan pe
yang mengal am glukosa elah melakuka konsentrasi gu bih dari 200 m
normal denga eningkat gluko ngginya kandun kibatkan laju f osa menjadi be dung banyak g
4).
e 2
ipe 2 tidak te Mellitus Non-D sebab tidak
hormon kan keseimbang 01). Diabetes pakan suatu ke ng ditandai o an sekresi ins ngguan kerja
eduanya. betes terbanya ya mempunya ulin. Pada aw menyebabkan s masih dapat m rjadi hiperin h masih norm
ka terjadi ke ka dapat men ditandai denga eningkat.
ung insulin a n-Insulin (IDD ntung insulin a ependent Insu
ah kondisi y dar glukosa da daan total horm
adi ketika sist sel β y a pankreas e et al. 200 ) diabetes tipe mudah terj ya harus den
a biasanya kur dapatkan antib
ami DM tipe ria, polidipsia engujian gluk ami tipe ini j secara oral an puasa sela la darahnya a md/dl, sedang an perlakuan y osa darah berk ngan darah dal filtrasi glomeru erlebihan dan u glukosa (Cham
ergantung insu Dependent Insu membutuh insulin un gan glukosa da Melitus tipe elompok peny oleh hiperglik sulin oleh se insulin/resiste
ak adalah DM ai latar belak walnya, resiste
n diabetes kli mengkompens sulinemi, ka mal atau sed elelahan sel b ngakibatkan D an kadar gluk
atau DM) atau ulin yang arah mon tem yang dan 04). e 1 jadi ngan rus, bodi e 1 dan kosa jika dan ama akan gkan yang kisar lam ulus urin mpe ulin ulin hkan ntuk arah e 2 akit emi l β ensi MT2 kang ensi inis. sasi, adar dikit beta DM kosa M dari D pengo insuli atau tua, riway pada E α-D-g enzim manu kunci karbo hidro pered subst Gluk gliko gliko P aktiv pemi Perke tekno kedok inform kerja mem senya meng Inhib untuk yang karbo kank et al. P enzim vivo bany vitro seper NPG secar pankr Daya Gambar 2 Menurut PERK DMT2 , yaitu obatannya tid in, onsetnya la tidak gemuk, b tidak ada ant yat diabetes pa kembar identik
Enzim
Enzim α-glukos glikosida gl m yang berp usia. Enzim t
i pada pr ohidrat. α-G olisis termina duksi yang ber trat dan diha kosidase men osidik pada osida (Gao et al enumpukan gl vitas enzim in
cu terjadinya embangan i ologi dalam
kteran telah masi yang te a enzim α-gl mbantu para ilm
awa-senyawa ghambat aktiv bitor enzim α
k mengatasi b berhubunga ohidrat, diant
er, HIV, hepat 2006) engujian aktiv m α-glukosidas dan in vitro. ak digunakan dengan men rti p-nitrofeni ) dan enzim ra pseudo in
reas penghas a hambat terha
Struktur Acarb
KENI (2002) sukar terjadi dak harus m ambat, penderi
biasanya terjad tibody sel isle ada keluarga, k. α-glukosidase sidase memilik lukohidrolase peran dalam ersebut merup oses akhir lukosidase m al residu g rikatan α-1,4 p asilkan α-D-g
nghidrolisis oligosakarida l. 2008). lukosa yang te ni merupakan diabetes me lmu penget dunia bio h banyak erkait dengan lukosidase. In muwan untuk baru ya vitas enzim α
α-glukosidase berbagai mac an dengan
aranya diabet titis, serta keg
vitas daya ham se dapat dilaku
. Metode spek dalam penguj ggunakan pse il-α-D-glukopir
α-glukosidase n vivo mengg
sil enzim α dap aktivitas α
bose
karakteristik ketoasidosis, menggunakan itanya gemuk di pada umur et, 30% ada 100% terjadi
e
ki nama kimia merupakan usus halus pakan enzim pemecahan mengkatalisis glukosa non pada berbagai glikosida. α
-ikatan α -dan α
-D-erbentuk dari n salah satu
sendiri dipelajari secara pseudo-substrat dengan mengetahui kemampuan sampel untuk menghambat reaksi hidrolisis glukosa pada substrat p-nitrofenil-α-D-glukopiranosida (p-NPG). Setelah mengalami hidrolisis substrat akan terhidrolisis menjadi α-D-glukosa dan p-nitrofenol yang berwarna kuning. Warna kuning yang dihasilkan p-nitrofenol menjadi indikator kemampuan inhibitor untuk menghambat reaksi yang terjadi. Semakin besar kemampuan inhibitor untuk menghambat maka produk yang dihasilkan semakin sedikit atau warna larutan setelah inkubasi lebih cerah dibandingkan dengan larutan tanpa inhibitor (Sugiwati 2005).
Metode Ekstraksi dan Pelarut
Ekstraksi merupakan proses penarikan komponen atau zat aktif dari suatu campuran padatan atau cairan dengan menggunakan pelarut tertentu. Pelarut yang digunakan tidak bercampur atau hanya bercampur sebagian dengan campuran padat atau cairan. Dengan kontak yang intensif, komponen aktif pada campuran akan berpindah ke dalam pelarut (Gamse 2002). Pemilihan pelarut merupakan salah satu faktor yang dapat menentukan kesempurnaan proses ekstraksi. Pelarut yang digunakan pada proses ekstraksi harus dapat menarik komponen aktif dari campuran dalam sampel (Gamse 2002).
Faktor-faktor yang harus diperhatikan dalam memilih pelarut diantaranya, selektivitas, sifat pelarut dan kemampuan pelarut untuk mengekstraksi, tidak bersifat racun, mudah diuapkan, dan relatif murah (Gamse 2002). Pelarut yang digunakan dalam proses ekstraksi dapat menembus pori-pori bahan padat sehingga bahan yang ingin diekstrak dapat dengan mudah tertarik. Pelarut yang umum digunakan diantaranya, etil asetat, heksana, eter, benzena, toluene, etanol, isopropanol, aseton dan air (Simpen 2008). Secara umum ekstraksi senyawa metabolit sekunder menggunakan metode maserasi dengan pelarut polar atau nonpolar.
Metode ekstraksi ini dapat dikelompokkan menjadi dua yaitu ekstraksi sederhana dan ekstraksi khusus. Ekstraksi sederhana terdiri atas maserasi, perkolasi, reperkolasi, evakolasi, dan dialokasi. Ekstraksi khusus terbagi atas sokletasi, arus balik dan ultrasonik (Harborne 1987). Penelitian ini menggunakan metode maserasi. Maserasi merupakan proses perendaman sampel pelarut organik yang digunakan pada temperatur ruangan. Proses ini sangat menguntungkan dalam isolasi
senyawa bahan alam karena dengan perendaman sampel tumbuhan akan terjadi pemecahan dinding dan membran sel akibat perbedaan tekanan antara di dalam dan di luar sel sehingga metabolit sekunder yang ada dalam sitoplasma akan terlarut dalam pelarut organik dan ekstrak senyawa akan sempurna karena dapat diatur lama perendaman yang dilakukan. Pemilihan pelarut untuk proses maserasi akan memberikan efektivitas yang tinggi dengan memperhatikan kelarutan senyawa bahan alam pelarut tersebut. Prinsip dari ekstraksi maserasi adalah penyarian zat aktif yang dilakukan dengan cara merendam serbuk dalam cairan penyari yang sesuai selama sehari atau beberapa hari pada suhu kamar dan terlindung dari cahaya (Sudjadi 1986).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah benalu jeruk, akuades, etanol 30%, etanol 70%, etanol 96%, enzim α -glukosidase, p-nitrofenil-α-D-glukopiranosida (p-NPG), larutan bufer fosfat (pH 7), Bovine Serum Albumin (BSA), acarbose (glukobay), dimetilsulfoksida (DMSO), HCl 2N, H2SO4 2
M, dan Na2CO3.
Alat-alat yang digunakan dalam penelitian ini adalah corong kaca, kertas saring, penangas air, neraca analitik, maserator, corong pisah, ayakan 20-100 mesh, pipet mikro, pipet volumetrik, pipet tetes, labu Erlenmeyer, tabung reaksi, microplate dan microplate reader.
Metode Penelitian
Ekstraksi Benalu Jeruk
Benalu jeruk yang telah didapat, diproses dengan dua tahapan, preparasi dan ekstraksi. Benalu jeruk dikeringkan dalam oven dengan suhu 40-50°C selama 4 hingga 5 hari. Simplisia benalu jeruk yang sudah kering kemudian digiling hingga berukuran 20-100 mesh dan berbentuk serbuk (dengan kadar air
dilakukan penggantian pelarut dan dilakukan pengulangan sebanyak 3 kali. Pelarut yang digunakan yaitu air, etanol 30%, etanol 70%, dan etanol 96%. Keseluruhan filtrat sampel diuapkan dalam rotavapor dan dihasilkan ekstrak berbentuk serbuk. Ekstrak serbuk ini akan diuji inhibisinya terhadap enzim α -glukosidase.
Penentuan Kadar Air Benalu Jeruk (AOAC 1999 dalam Samson 2010)
Penentuan kadar air dilakukan untuk mengetahui kadar air dari sampel. Sebanyak 2 gram sampel dimasukkan ke dalam cawan, dikeringkan pada suhu 105 oC selama 30 menit lalu ditimbang. Perlakuan dilakukan berulang-ulang sampai diperoleh bobot yang konstan. Penentuan kadar air pada sampel dilakukan sebanyak tiga kali pengulangan.
Uji Inhibisi α-Glukosidase (Sancheti et al.
2009)
Pengujian aktivitas inhibisi α-glukosidase dilakukan dengan microplate reader. Larutan standar, blanko, dan sampel dimasukkan ke dalam sumur microplate sebanyak 50 μL. Masing-masing sumur yang sudah berisi standar, blanko, sampel ditambahkan dengan 50 μL larutan bufer. Sebanyak 25 μL enzim α -glukosidase dengan konsentrasi 1 mg/mL dalam buffer fosfat 0.01 M dimasukkan ke dalam sumur microplate. Selanjutnya, substrat berupa campuran berisi bufer fosfat 0.1 M sebanyak 50 μL dan 25 μL 4-nitrophenyl α -D-glucopyranoside (p-NPG) 0.5 mM dalam 0.1 M bufer fosfat ditambahkan beberapa saat sebelum esai dimulai. Semua uji dilakukan sebanyak 3 kali ulangan. Inkubasi dilakukan pada suhu 37oC selama 30 menit. Reaksi
enzim dihentikan dengan menambahkan 0.2 M Na2CO3 sebanyak 100 μL. Hasil reaksi
diukur dengan microplate reader pada panjang gelombang 400 nm. Selanjutnya dilakukan penghitungan % inhibisi untuk menentukan nilai IC50 dengan menggunakan
rumus :
% inhibisi = C – S x 100% C
C adalah absorban larutan tanpa adanya ekstrak (kontrol) dan S adalah absorban larutan dengan pemberian ekstrak dari sampel (Sugiwati 2005, Tuyet & Chuyen 2007). IC50
dihitung dengan menggunakan persamaan regresi linear, konsentrasi sampel sebagai sumbu x dan % inhibisi sebagai sumbu y.
Nilai IC50 dihitung dari persamaan y = a + bx
dengan menggunakan rumus IC50 = (50-a) : b.
Uji Toksisitas dengan metode Brine Shrimp
Lethality Test (BSLT) (Meyer et al. 1982)
Telur Artemia salina menetas menjadi larva udang dalam air laut setelah inkubasi 48 jam. Masing-masing 10-12 larva dimasukkan ke dalam microplate, tambahkan ekstrak yang dilarutkan dalam air laut dengan konsentrasi 10, 100, dan 1000 ppm, inkubasi 24 jam. Toksisitas diukur berdasarkan jumlah larva A. salina yang mati setelah inkubasi. LC50 adalah
konsentrasi yang diperlukan untuk menyebabkan 50% kematian larva.
HASIL DAN PEMBAHASAN
Kadar Air Benalu Jeruk
Kadar air dalam sampel serbuk benalu jeruk diukur sebanyak tiga kali ulangan dan mempunyai rata-rata sebesar 2.33%. Persen kadar air tersebut menunjukkan bahwa serbuk benalu jeruk yang digunakan dapat disimpan untuk jangka waktu panjang. Hal ini sesuai dengan Winarno (1992) yang menyatakan bahwa sampel yang baik untuk dapat disimpan dalam jangka waktu panjang adalah sampel yang memiliki kadar air kurang dari 10% karena dapat terhindar dari pencemaran mikroorganisme dan jamur. Persen kadar air juga digunakan untuk mengetahui persen bahan kering dan sebagai faktor koreksi suatu sampel, jika sampel yang digunakan memiliki lingkungan agrobiofisik yang berbeda, sehingga dapat dipakai untuk memperkirakan jumlah bahan yang dibutuhkan jika ingin mengekstraksi bahan langsung dalam keadaan basah dan sebagai koreksi rendemen pada proses ekstraksi.
Ekstrak Benalu Jeruk
etanol 70%, dan etanol 96%. Etanol digunakan sebagai pelarut dalam proses ekstraksi karena etanol merupakan pelarut serbaguna yang baik digunakan untuk ekstraksi pendahuluan. Selain itu, etanol merupakan senyawa yang tergolong bertoksisitas rendah sehingga etanol relatif aman digunakan (BPOM 2005).
Metode ekstraksi yang digunakan adalah metode maserasi yang mengacu pada BPOM (2005). Pemilihan metode maserasi dengan cara perendaman sampel dilakukan karena metode ini sederhana, tidak memerlukan alat-alat yang rumit, relatif mudah, murah, dan tidak menggunakan pemanasan sehingga dapat mencegah rusaknya metabolit sekunder yang tidak tahan terhadap suhu tinggi. Proses perendaman simplisia yang dilakukan dalam metode maserasi menyebabkan terjadinya difusi akibat dari perbedaan konsentrasi di dalam dan di luar sel. Hal ini menyebabkan metabolit sekunder yang terdapat di dalam sitoplasma akan terekstrak (Campbell et al. 2002).
Ekstrak berupa cairan yang diperoleh setelah penyaringan kemudian dievaporasi untuk menguapkan sisa pelarut yang digunakan sehingga diperoleh ekstrak padatan berupa serbuk. Pemekatan dilakukan dengan menggunakan rotary evaporator pada suhu 40oC untuk mencegah kemungkinan terjadinya kerusakan komponen bahan aktif yang terkandung dalam ekstrak. Hasil ekstrak ini kemudian digunakan dalam pengujian inhibisi enzim α-glukosidase dan uji toksisitas.
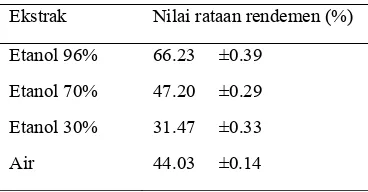
Hasil pemekatan ekstrak tersaji dalam persentase rendemen (Tabel 1). Data pada Tabel 1 menunjukkan bahwa ekstrak benalu jeruk yang menggunakan pelarut etanol 96% memiliki nilai rendemen tertinggi diantara ekstrak lainnya. Hal ini menunjukkan bahwa senyawa yang terkandung di dalam simplisia terekstrak lebih banyak dengan menggunakan pelarut etanol 96%. Etanol digunakan untuk mengekstrak senyawa-senyawa bioaktif yang bersifat polar dan semipolar.
Tabel 1 Nilai rendemen ekstrak benalu jeruk
Ekstrak Nilai rataan rendemen (%)
Etanol 96% 66.23 ±0.39
Etanol 70% 47.20 ±0.29
Etanol 30% 31.47 ±0.33
Air 44.03 ±0.14
Etanol diduga dapat merusak membran sel dan mengekstrak endoselular dalam jumlah yang lebih banyak (Ghisalberti 1993). Kandungan etanol yang sangat tinggi dalam pelarut etanol 96% menyebabkan senyawa aktif terekstrak lebih banyak sehingga nilai rendemen pada pelarut etanol 96% lebih tinggi dibandingkan dengan pelarut lainnya. Senyawa metabolit sekunder yang mudah larut dalam pelarut polar diantaranya adalah alkaloid dan flavonoid. Kedua metabolit ini menyebabkan suatu tanaman berpotensi sebagai antidiabetes melalui penghambatan kerja enzim α-glukosidase (Sari 2010).
Inhibisi Enzim α-Glukosidase
Pengujian terhadap daya hambat aktivitas enzim α-glukosidase menggunakan substrat p-nitrofenil- α-D-glukopiranosida (p-NPG) dan enzim α-glukosidase. Pada pengujian tersebut
α-glukosidase akan menghidrolisis substrat p-NPG menjadi glukosa dan p-nitrofenol yang berwarna kuning. Sampel yang ditambahkan ke dalam campuran substrat diharapkan akan menghambat kerja enzim sehingga mengurangi terbentuknya glukosa dan intensitas warna kuning yang terbentuk.
Inhibisi enzim α-glukosidase dilakukan untuk mengetahui ada atau tidaknya aktivitas antidiabetes pada empat ekstrak benalu jeruk (etanol 96%, etanol 60%, etanol 30%, dan air). Enzim yang dihambat adalah enzim α -glukosidase yang merupakan enzim yang berperan dalam pembentukan glukosa di usus halus manusia melalui hidrolisis karbohidrat. Penghambatan terhadap kerja enzim ini dapat dilakukan untuk mencegah peningkatan secara drastis kadar glukosa di dalam tubuh penderita diabetes melitus tipe II melalui penundaan proses pemecahan karbohidrat sehingga dapat menunda penyerapan glukosa oleh usus ke dalam darah (Sari 2010).
suatu senyawa inhibitor untuk menghambat reaksi enzimatis yang tejadi.
Aktivitas tersebut diukur berdasarkan absorbansi p-nitrofenol pada panjang gelombang 400 nm. Semakin besar aktivitas inhibisi dari suatu sampel, maka jumlah p-nitrofenol yang terbentuk semakin sedikit, sehingga intensitas warna kuning yang terbentuk semakin berkurang. Apabila ekstrak yang diuji memiliki kemampuan menghambat kerja enzim maka p-nitrofenol yang dihasilkan akan berkurang sehingga warna larutan yang dihasilkan setelah inkubasi lebih cerah dibandingkan warna larutan tanpa inhibitor (Sugiwati 2005). Harborne (1987) menyebutkan bahwa kisaran panjang gelombang 230-560 nm merupakan serapan maksimum bagi senyawa flavonoid. Hal ini menjadi dasar untuk menentukan panjang gelombang yang tepat dalam pengukuran persentase inhibisi enzim α-glukosidase.
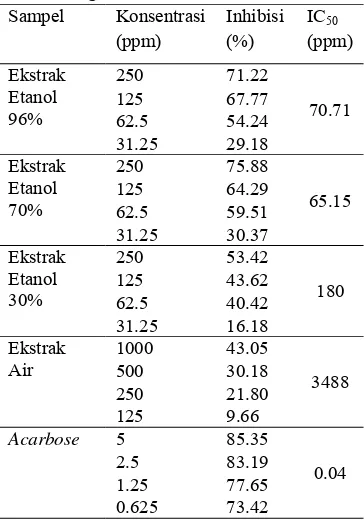
Hasil uji menunjukkan terdapat 3 sampel yang mempunyai persentase inhibisi di atas 50% yaitu etanol 96%, etanol 70%, dan etanol 30%. Sampel etanol 96% memiliki persentase inhibisi di atas 50% pada konsentrasi 250 ppm, 125 ppm, dan 62.5 ppm. Persentase tersebut berturut-turut sebesar 71.22%, 67.77%, dan 54.24%. Pada sampel etanol 70%, persentase inhibisi di atas 50% ditunjukkan pada tiga konsentrasi tertinggi, yaitu 250 ppm, 125 ppm, dan 62.5 ppm. Persentase inhibisi tersebut berturut-turut sebesar 75.88%, 64.29%, dan 59.51%. Persentase inhibisi di atas 50% juga terlihat pada sampel etanol 30% tetapi hanya pada konsentrasi tertinggi yaitu 250 ppm dengan persentase inhibisi 53.42%. Ekstrak air dengan konsentrasi 1000 ppm hanya mempunyai persentase inhibisi sebesar 43.05%. Acarbose (glukobay) sebagai pembanding atau kontrol positif memiliki persentase inhibisi paling tinggi di empat varian konsentrasinya yaitu 5 ppm, 2.5 ppm, 1.25 ppm, dan 0.625 ppm. Persentase inhibisinya berturut-turut sebesar 85.35%, 83.19%, 77.65%, dan 73.42%.
Berdasarkan hasil persentase inhibisi di atas, maka persentase inhibisi yang paling baik adalah ekstrak etanol 70% karena mempunyai persentase inhibisi paling besar yaitu 75.88% pada konsentrasi 250 ppm. Namun, apabila dibandingkan dengan acarbose (glukobay) sebagai kontrol positif, nilai persentase inhibisi yang dimiliki ekstrak etanol 70% lebih kecil. Persentase inhibisi yang dimiliki acarbose (glukobay) adalah
85.35% dengan konsentrasi 5 ppm, sedangkan nilai persentase inhibisi ekstrak etanol 70% adalah 75.88% pada konsentrasi 250 ppm. Nilai ini menunjukkan bahwa acarbose (glukobay) memiliki kemampuan inhibisi lebih baik dibandingkan dengan ekstrak etanol 70%. Acarbose (glukobay) memiliki kemampuan yang lebih baik karena dengan konsentrasi yang lebih kecil acarbose (glukobay) memiliki daya inhibisi yang lebih besar. Sedangkan ekstrak etanol 70% memiliki daya inhibisi lebih kecil daripada acarbose (glukobay) dan juga membutuhkan konsentrasi yang lebih besar. Hasil uji juga menunjukkan bahwa aktivitas penghambatan kerja enzim α-glukosidase ekstrak etanol 96%, etanol 70%, etanol 30%, dan air memiliki nilai IC50 berturut-turut sebesar 70.71 ppm, 65.15
ppm, 180 ppm, dan 3488 ppm. Data tersebut menunjukkan bahwa diantara ekstrak etanol dan air yang diuji, ekstrak etanol 70% memiliki aktivitas antidiabetes terbaik karena mempunyai nilai IC50 terendah yaitu 65.15
ppm. Berdasarkan tingkat kekuatan IC50
(Tabel 3) ekstrak etanol 96% dan etanol 70% masuk ke dalam golongan aktif karena nilai IC50 nya pada kisaran 50-100 ppm. Sedangkan
ekstrak etanol 30% masuk dalam golongan sedang dan ekstrak air masuk dalam golongan tidak aktif.
Tabel 2 Uji aktivitas inhibisi enzim α -glukosidase Sampel Konsentrasi (ppm) Inhibisi (%) IC50 (ppm) Ekstrak Etanol 96% 250 71.22 70.71 125 67.77 62.5 54.24 31.25 29.18 Ekstrak Etanol 70% 250 75.88 65.15 125 64.29 62.5 59.51 31.25 30.37 Ekstrak Etanol 30% 250 53.42 180 125 43.62 62.5 40.42 31.25 16.18 Ekstrak Air 1000 43.05 3488 500 30.18 250 21.80 125 9.66
Acarbose 5 85.35
Tabel 3 Tingkat kekuatan IC50 (Jun et al.
2003)
Intensitas Nilai IC50
Sangat aktif < 50 ppm
Aktif 50-100 ppm
Sedang 101-250 ppm
Lemah 250-500 ppm
Tidak aktif > 500 ppm
Ekstrak benalu jeruk masih ekstrak kasar sehingga jika dibandingkan dengan kontrol positif (Acarbose) dengan nilai IC50 sebesar
0.04 ppm sangat aktif dalam menginhibisi enzim α-glukosidase maka masih sangat jauh aktivitas yang dimiliki oleh ekstrak benalu jeruk. Efektivitas acarbose (glukobay) yang ditunjukkan oleh nilai IC50 tersebut
menyebabkan acarbose digunakan sebagai obat antidiabetes. Namun, penggunaan obat sintetik ini menyebabkan efek samping seperti kembung, diare, dan kram usus (Hartika 2009). Berdasarkan hasil uji, ekstrak etanol 70% memiliki rata-rata persentase inhibisi tertinggi dari ekstrak etanol 96%, 30% dan air sehingga dapat dikatakan ekstrak etanol 70% memiliki aktivitas inhibisi terbaik dibanding ekstrak etanol 30%, etanol 96%, dan air. Hasil uji penelitian telah menunjukkan bahwa ekstrak etanol 70% dan 96% berpotensi sebagai antidiabetes dibanding dengan sampel uji yang lainnya, tetapi disarankan oleh BPOM (2005) untuk ekstraksi tanaman obat lebih baik menggunakan ekstrak etanol 70% karena lebih rendah toksisitasnya sehingga lebih aman untuk digunakan.
Uji Toksisitas
Uji toksisitas pada tumbuhan berkhasiat obat dilakukan untuk mencegah terjadinya efek yang merugikan (Ismail et al. 2007). Pada uji toksisitas metode BSLT (Brine Shrimp Lethality Test) menggunakan hewan uji berupa larva udang Artemia salina Leach. Artemia termasuk ke dalam kelas Eranchipoda yang memiliki membran kulit yang sangat tipis sehingga memungkinkan terjadinya difusi zat dari lingkungan yang mempengaruhi metabolisme dalam tubuhnya. Larva udang Artemia ditemukan hampir di semua tempat di permukaan bumi yang memiliki kisaran salinitas dari 10-20 g/L sampai dengan 180-220 g/L. Hal ini menyebabkan larva udang Artemia mudah untuk dibiakkan dan dipelajari dengan teliti. Saat digunakan dalam pengujian Artemia dbiakkan selama 48 jam. Jika lebih
dari itu, dikhawatirkan kematian larva udang bukan disebabkan oleh toksisitas ekstrak melainkan oleh terbatasnya persediaan makanan (Kadarisman 2000).
Berdasarkan hasil uji toksisitas larva udang (Tabel 4) dari ekstrak etanol 96%, etanol 70%, etanol 30%, dan air diperoleh nilai LC50 berturut-turut sebesar 978.85 ppm,
864.60 ppm, 648.15 ppm, dan 699.92 ppm. Nilai ini menunjukkan bahwa pada konsentrasi 978.85 ppm, 864.60 ppm, 648.25 ppm, dan 699.92 ppm ekstrak etanol 96%, etanol 60 %, etanol 30%, dan air mampu membunuh larva udang sampai 50% populasi. Pada data hasil uji toksisitas larva udang ekstrak etanol 30% menunjukkan ada kematian cukup banyak hingga konsentrasi akhir 1000 ppm ini dikarenakan kebanyakan dari senyawa metabolit sekunder yang lebih aktif pada saat berada dalam ekstrak etanol 30% dan menyebabkan nilai LC50 ekstrak
etanol 30% lebih kecil dibandingkan ekstrak etanol 96%, etanol 70%, dan air. Nilai LC50
dari uji toksisitas larva udang diperoleh dari perhitungan persamaan regresi linier ( y = ax + b ) yang dihasilkan berdasarkan data uji toksisitas larva udang ekstrak etanol 96%, etanol 70%, etanol 30%, dan air.
Hasil uji (Tabel 4) menunjukkan bahwa ekstrak etanol 30% memiliki bioaktivitas yang lebih tinggi diantara ekstrak lainnya terhadap larva udang, yang ditunjukkan dengan nilai LC50 terkecil diantara ekstrak lainnya yaitu
648.15 ppm. Semakin kecil nilai LC50 dari
suatu sampel maka semakin tinggi bioaktivitasnya. Sedangkan berdasarkan nilai LC50 nya ekstrak etanol 96% memiliki
[image:18.612.326.507.536.606.2]bioaktivitas terendah diantara ekstrak lainnya dengan nilai LC50 sebesar 978.85 ppm.
Tabel 4 LC50 ekstrak benalu jeruk
Sampel LC50 (ppm)
Etanol 96% 978.85 Etanol 70% 864.60 Etanol 30% 648.15
Air 699.92
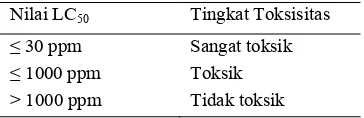
Tabel 5 Tingkat toksisitas suatu ekstrak (Meyer 1982)
Nilai LC50 Tingkat Toksisitas
≤30 ppm Sangat toksik
[image:18.612.325.507.646.705.2]Rendahnya aktivitas bioaktif terhadap larva udang menunjukkan bahwa kandungan senyawa metabolit sekunder yang terkandung dalam ekstrak sedikit, sehingga LC50 menjadi
besar dan menyebabkan berkurangnya bioaktivitas. Hasil uji toksisitas juga menunjukkan bahwa ekstrak etanol 96%, etanol 70%, etanol 30%, dan air dapat dikatakan toksik karena LC50 dari keempat
ekstrak ini masih berada di bawah 1000 ppm (Tabel 5).
SIMPULAN DAN SARAN
Simpulan
Ekstraksi benalu jeruk, uji potensi antidiabetes terhadap ekstrak benalu jeruk dan uji toksisitas dengan metode BSLT telah berhasil dilakukan. Ekstrak benalu jeruk dengan variasi konsentrasi pelarut menghasilkan rendemen tertinggi pada etanol 96% sebesar 66.23%. Dua pelarut dengan persentase inhibisi α-glukosidase di atas 50% adalah etanol 70% dan etanol 96% dengan nilai rata-rata inhibisi α-glukosidase sebesar 75.88% dan 71.22% pada konsentrasi 250 ppm. Hasil analisis secara in vitro untuk aktivitas antioksidan menunjukkan bahwa ekstrak etanol 70% merupakan ekstrak yang paling aktif karena memiliki nilai IC50 paling
kecil yaitu 65.15 ppm.
Hal tersebut menunjukkan kandungan senyawa dalam ekstrak etanol 96% dan 70% memliki potensi antidiabetes melalui penghambatan kerja enzim α-glukosidase. Berdasarkan data hasil uji toksisitas larva udang dapat disimpulkan ekstrak etanol 30% memiliki bioaktivitas yang lebih tinggi dengan nilai LC50 yang lebih kecil dari ekstrak
lainnya, yaitu 648.15. Semua ekstrak dikatakan toksik karena LC50 semua ekstrak
masih berada di bawah 1000 ppm.
Saran
Perlu dilakukan penelitian lanjutan tentang isolasi dan identifikasi senyawa yang berperan dalam aktivitas antidiabetes. Selain itu, diperlukan penelitian serupa terkait benalu jeruk dengan cara penambahan jenis ekstrak dengan pelarut yang lebih berbeda kepolarannya maupun dengan menggunakan ekstrak tunggal senyawa bioaktif yang terkandung di dalamnya yang telah diketahui memiliki peran penting sebagai antidiabetes.
DAFTAR PUSTAKA
[ADA] American Diabetes Association. 2004.
Gestational Diabetes Mellitus. Diabetes Care 27: S88-S90.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2005. Gerakan Nasional Minum Temulawak. Jakarta : BPOM RI.
Astiyandani PG. 2010. Uji klinis in vivo pengaruh konsumsi daluman (Cycllea barbata) terhadap penurunan kadar gula darah pada tikus wistar jantan dengan diabetes mellitus tipe 2. IPTEKMA ;1-4-2.
Azwar, A. 1992. Antropologi Kesehatan Indonesia Jilid I Pengobatan Tradisional. Jakarta: Penerbit Buku Kedokteran EGC.
Backer CA, Bakhuizen van den Brink RC. 1965. Flora of Java. The Netherlands 2: 67-76.
Barlow BA. 1997. Loranthaceae. The Netherlands 13: 209-401.
Burgess, GW 1995. Prinsip dasar ELISA dan variasi konfigurasinya, Teknologi ELISA dalam diagnosis dan penelitian. GW Burgess (Ed.) Wayan T. Ariana (terjemahan). Gadjah Mada University Press, Yogyakarta. hlm. 506.
Campbell NA, Jane B, Reece, Lawrence G. 2002. Biology. 5th ed. Jakarta: PT Gelora Aksara Pratama.
Carolyn DB. 2001. Diabetes and Nutrition. The Mitochondrial Part 1,2. J. Nutr. 131:344S-353S.
Champe PC, Harvey RA. 1994. Lippincott’s Illustrated Reviews: Biochemistry. Ed ke-2. Philadelphia: J.B. Lippincott Co.
Chiasson JL. 2006. Acarbose for the prevention of diabetes, hypertension, and cardiovascular disease in subjects with impaired glucose tolerance: The Study to Prevent Non-Insulin-Dependent Diabetes Mellitus (STOP-NIDDM) Trial. Endocr. Pract. 12:S25-S30.
Cottin R. 1997. Citrus of the world, a citrus directory. SRA INRA-CIRAD: 63.
Gamse T. 2002. Liquid-liquid Extraction and Solid-Liquid Extraction. New York: Graz Pr.
Ganong WF; Alih bahasa, Brahm U.Pendit et al. 2002. Buku Ajar Fisiologi Kedokteran. Diterjemahkan oleh Djauhari Widjajakusumah. Penerbit Buku Kedokteran EGC. Jakarta.
Gao H et al. 2008. Chebulagic acid is a potent
α-glucosidase inhibitor. Biosci Biotechnol Biochem 72:601-603.
Ghisalberti EL. 1993. Detection and isolation of bioactive natural products. In: Colgate SM and Molyneux RJ (eds.) Bioactive Natural Products: Detection, Isolation and Structural Determination. USA: CRC Press.
Gustaviani R. 2007. Diagnosis dan klasifikasi diabetes mellitus. Dalam : Sudoyo AW, Setiyohadi B, Alwi I, Simadibrata M, Setiati S. Buku ajar ilmu penyakit dalam. Edisi IV. Jilid III. Jakarta : Pusat Penerbitan Departemen Ilmu Penyakit Dalam FKUI :1857 – 9.
Guyton AC, John EH. 1997. Fisiologi Kedokteran. Edisi ke-9. Penerbit Buku Kedokteran EGC Jakarta. Terjemahan dari Irawati, Ken Arita Tenggadi dan Alex Santoso.
Hanefeld et al. 1991. Therapeutic potentials of acarbose as first-line drug in NIDDM insufficiently treated with diet alone. Diabetes Care. 14:732-737.
Harborne JB. 1987. Metode Fitokimia. Iwang S, penerjemah. Bandung: ITB Pr. Terjemahan dari: Phytochemical Method.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama.
Hartika R. 2009. Aktivitas Inhibisi α -Glukosidase Ekstrak Senyawa Flavonoid Buah Mahkota Dewa. [skripsi]. Bogor: Departemen Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Pertanian Bogor.
I Wayan S. 2004. Pemanfaatan obat penurun panas oleh masyarakat Angkah, Tabanan Bali, dalam Prosiding Seminar Nasional XXV Tumbuhan Obat Indonesia. Tawangmangu: Pokjanas.
Ismail S et al. 2007. Eksplorasi Biotamedika Kandungan Kimia, Toksisitas, dan Aktivitas Antioksidan Tumbuhan Asli Kalimantan Timur. Laporan Penelitian. Universitas Mulawarman. Tidak diterbitkan.
Jacquie SR et al. 2004. Canine and Feline Diabetes Mellitus: Nature or Nature?. J. Nutr. 134:2072S-2080S.
Jaya et al. 2007. Ekstrak buah pare untuk penderita diabetes melitus. Media Informasi Kesehatan 2007;220-222-4.
Jun et al. 2003. Comparisont of antioxidant activities of isoflavones from kudzu root (pueraria labata ohwl). J. Food Sci. 68: 2117-2122.
Kadarisman I. 2000. Isolasi dan Identifikasi Senyawa Kimia Bioaktif dari Rimpang Bangle (Zingiber cassumunar Roxb.). Skripsi Jurusan Kimia FMIPA. Institut Pertanian Bogor. Bogor. Tidak diterbitkan.
Khopkar SM. 2003. Konsep Dasar Kimia Analitik. Jakarta: UI-Press.
Liu et al. 2006. Synthesis and pharmacological activities of santhone derivatives as alfa-glucosidase inhibitors. Bioorganica and medical chemistry 14: 5683-5690.
Merentek E. 2006. Resistensi Insulin Pada Diabetes Melitus Tipe 2. Cermin dunia kedokteran No.150,2006.
Meyer HN et al. 1982. Brine Shrimp Lethality Test : Med Plant Research Vol. 45. Hipokrates Verlag Gmbrl. Amsterdam.
Misnadiarly. 2006. Diabetes Mellitus : Ulcer, Infeksi, Gangren. Jakarta: Penerbit Popular Obor.
Nuryati S. 2009. Gaya hidup dan status gizi serta hubungannya dengan hipertensi dan diabetes melitus pada pria dan wanita dewasa DKI Jakarta. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Paran S. 2008. Diabet Cookies. Jakarta: Kawan Pustaka.
Perkeni. 2002. Konsesus Pengelolaan Diabetes Mellitus Tipe 2 Di Indonesia 2002. PB PERKENI.
Ungaran: Trubus Agriwidaya.
Pulungan A, Herqutanto. 2009. Diabetes melitus tipe 1: “penyakit baru” yang akan makin akrab dengan kita. Majalah Kedokteran Indonesia ; 455-458-59.
Purnomo B. 2000. Uji ketoksikan akut fraksi etanol daun benalu (Dendropthae sp.) pada mencit jantan dan uji kandungan kimia [skripsi]. Yogyakarta: Fakultas Farmasi, Universitas Gadjah Mada.
Ressang. 1984. Patologi Khusus Vateriner. Edisi 2. Denpasar: Percetakan Bali.
Richter A. 1992. Phytochemistry. Vol. 31; 3925-3927.
Rimbawan, Siagian A. 2004. Indeks Glikemiks Pangan. Jakarta: Penebar Swadaya.
Rolfes et al. 2006. Understanding Normal and Clinical Nutrition. Belmont, CA: Thomson Wadsworth.
Rubenstein D, Wayne D, Bradley J. 2007. Lecture Notes Kedokteran Klinis. Jakarta: Penerbit Erlangga.
Rubin AL. 2004. Diabetes for Dummies. 2nd edition. Indiana: Wiley Publishing.
Sari N. 2010. Potensi buah Makassar (Brucea javanica [L.] Merr.) sebagai inhibitor enzim α-glukosidase [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
.Samson ZM. 2010. Senyawa golongan alkaloid ekstrak buah mahkota dewa sebagai inhibitor α-glukosidase. [skripsi]. Bogor: FMIPA Institut Pertanian Bogor.
Sancheti S, Sancheti S, Seo SY. 2009. Chaenomeles sinensis: a potent α-and
β-glucosidase inhibitor. American Journal of Pharmocology and Toxicology 4(1): 8-11.
Sartono. 1996. Apa Yang Sebaiknya Anda Ketahui Tentang Obat-Obatan Bebas dan Bebas Terbatas. Jakarta: PT. Gramedia Pustaka Utama.
Simpen I. 2008. Isolasi cashew nut shell liquid dari kulit jambu mete (Anarcadium occidentalle L) dan kajian beberapa sifat fisiko-kimianya. J Kimia 2:71-76.
Sudjadi 1986. Metode Pemisahan. Yogyakarta: UGM-Press.
Sugiwati S. 2005. Aktivitas antihiperglikemik dari ekstrak buah mahkota dewa (Phaleria macrocarpa (Scheff) Boerl.) sebagai inhibitor α-glukosidase in vitro dan in vivo pada tikus putih. [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Sugiyarto M, Supriyanto A. 1992. Pemuliaan Tanaman Jeruk. Hlm 92-106. Prosiding Simposium Pemuliaan Tanaman IPPTI Komisariat Daerah Jawa Timur. Balai Penelitian Tanaman Pangan Malang.
Sunaryo, Rachman E, Uji T. 2006. Kerusakan morfologi tumbuhan koleksi Kebun Raya Purwodadi oleh benalu (Loranthaceae dan Viscaceae). Berita Biologi 8(2): 129-139.
Sutedja L. 2003. Bioprospekting Tumbuhan Obat Indonesia sebagai Sediaan Fitofarmaka Antidiabetes. Laporan Kemajuan Tahap II Riset Unggulan Terpadu, Pusat Penelitian Kimia-LIPI.
Tjay T. H dan Rahardja K. 2002. Obat-Obat Penting: Khasiat Penggunaan dan Efek Samping, Edisi IV, 567-584, Direktorat Jenderal Pengawasan Obat Dan Makanan, Departemen Kesehatan Republik Indonesia, Jakarta.
Tuyet T, Chuyen NV. 2007. Antihyperglikemic activity of an aqueous extract from flower buds of Cleistocalyx operculatus (Roxb.) Merr and Perry. Biosci Biotechnol Biochem 71: 69-76.
WHO. 2010. Definition, diagnosis and classification of diabetes melitus and it’s complications. Geneva: WHO Publishing.
Widiastuti RK. 2008. Uji penurunan kadar glukosa darah ekstrak etanol herba daun sendok (Plantago mayor L.) pada tikus jantan yang diberi glukosa. Skripsi. Universitas Muhammadiyah Surakarta.
Wijayakusuma H. 2002. Tumbuhan Berkhasiat Obat: Rempah, Rimpang dan Umbi. Jakarta: Milenia Populer.
Winarno FG. 1992. Kimia Pangan dan Gizi. Jakarta: Gramedia.
Lampiran 1 Diagram Alir Penelitian
Benalu Jeruk
Serbuk Benalu Jeruk
Akuades
Etanol 30% Etanol 70%
Etanol 96%
Filtrat
Filtrat
Filtrat
Filtrat
Ekstrak air
Ekstrak
Etanol 30%
Ekstrak etanol
70%
Ekstrak Etanol
96%
Uji Inhibisi Enzim
α
-Glukosidase
Uji Toksisitas
Larutan
Acarbose
(Kontrol
positif)
Buffer
Lampiran 2 Perhitungan kadar air serbuk benalu jeruk
Ulangan Bobot
labu
awal / A
(gram)
(Bobo labu + sampel) / B
(gram)
Bobot setelah
dikeringkan / C
(gram)
Kadar
air
(%)
1 19.41 21.41
21.33
4
2 30.34 32.34
32.30
2
3 33.36 35.39
35.37
0.98
Rerata 2.33
Contoh perhitungan :
Kadar air (%) = (B-C) / (B-A) x 100%
= (21.41 - 21.33) / (21.41 - 19.41) x 100%
Lampiran 3 Rendemen hasil ekstraksi benalu jeruk
Sampel Ulangan Bobot Simplisia (g)
Bobot labu awal (g)
Bobot labu + ekstrak kental sampel (g)
Bobot ekstrak kental sampel (g)
Rendemen (%)
Rata-Rata Rendemen
Standard Deviasi
Etanol 96%
1 30.0006 221.93 241.80 19.87 66.34 66.23 0.39 2 30.0004 221.47 241.44 19.97 66.55
3 30.0009 221.86 241.60 19.74 65.80
Etanol 70%
1 30.0002 220.64 234.80 14.16 46.96 47.20 0.29 2 30.0012 220.96 235.13 14.17 47.12
3 30.0007 220.89 235.15 14.26 47.52
Etanol 30%
1 30.0001 220.72 230.16 9.44 31.12 31.47 0.33
2 30.0009 220.49 229.94 9.45 31.51 3 30.0010 220.91 230.44 9.53 31.78
Air 1 30.0009 223.22 236.43 13.21 44.01 44.03 0.14 2 30.0014 223.78 236.96 13.18 43.90
3 30.0004 223.33 236.58 13.25 44.18
Contoh perhitungan :
Rendemen (%) = (bobot ekstrak kental sampel / bobot simplisia) x 100%
= (19.87 / 30.0006) x 100%
Lampiran 4 Data nilai absorbansi dan % inhibisi ekstrak etanol 96% benalu jeruk
Hasil analisis ekstrak etanol 96%
Konsentrasi
(ppm)
Absorbansi (A)
Inhibisi (%)
Ul-1 Ul-2 Ul-3 Ul-1 Ul-2 Ul-3
250
0.407 0.339 0.35 69.47 72.88 71.31
125
0.465 0.371 0.392 65.12 70.32 67.87
62.5
0.668 0.601 0.477 49.89 51.92 60.90
31.25
0.916 0.886 0.889 31.28 29.12 27.13
Aktivitas inhibisi ekstrak etanol 96% benalu jeruk terhadap
α
-glukosidase :
y = a ln(x) + b
% inhibisi = a ln (konsentrasi) + b
Jenis
ekstrak
y a b
ln(x) x=IC50 rerata
Ul-1 50 18.99
-31.28 4,28014745 72.2510924 70.7155
Ul-2 50 23.85
-51.64 4,26163522 70.9258681
Ul-3 50 23.11
-47.84 4.23366508 68.9695484
y = 18,99ln(x) ‐31,28R² = 0,969 y = 23,85ln(x) ‐51,64
R² = 0,953
y = 23,11ln(x) ‐47,84
R² = 0,895
0 10 20 30 40 50 60 70 80 90
0 50 100 150 200 250 300
%
inh
Lampiran 5 Data nilai absorbansi dan % inhibisi ekstrak etanol 70% benalu jeruk
Hasil analisis ekstrak etanol 70%
Konsentrasi
(ppm)
Absorbansi (A)
Inhibisi (%)
Ul-1 Ul-2 Ul-3 Ul-1 Ul-2 Ul-3
250
0.341 0.322 0.298 74.42 75.59 77.64
125
0.393 0.391 0.64 70.52 70.36 51.99
62.5
0.528 0.489 0.597 60.39 62.93 55.21
31.25
0.952 0.907 0.916 28.58 31.23 31.28
Aktivitas inhibisi ekstrak etanol 70% benalu jeruk terhadap
α
-glukosidase :
y = a ln(x) + b
% inhibisi = a ln (konsentrasi) + b
Jenis
ekstrak
y a b
ln(x) x=IC50 rerata
Ul-1 50 22.21
-41.42 4.11616389 61.3235466
65.1485
Ul-2 50 23.25
-45.22 4.09548387 60.0683975
Ul-3 50 20.67
-38.98 4.30478955 74.0536292
y = 22,21ln(x) ‐41,42R² = 0,918
y = 23,25ln(x) ‐45,22 R² = 0,914
y = 20,67ln(x) ‐38,98
R² = 0,926
0 10 20 30 40 50 60 70 80 90
0 50 100 150 200 250 300
%
inh
Lampiran 6 Data nilai absorbansi dan % inhibisi ekstrak etanol 30% benalu jeruk
Hasil analisis ekstrak etanol 30%
Konsentrasi
(ppm)
Absorbansi (A)
Inhibisi (%)
Ul-1
Ul-2
Ul-3
Ul-1 Ul-2 Ul-3
250
0.606 0.603 0.623
53.38
53.61
53.26
125
0.711 0.728 0.779
45.31
44
41.56
62.5
0.812 0.782 0.748
37.38
39.85
43.89
31.25
1.061 1.103 1.133
18.38
15.15
15.01
Aktivitas inhibisi ekstrak etanol 30% benalu jeruk terhadap
α
-glukosidase :
y = a ln(x) + b
% inhibisi = a ln (konsentrasi) + b
Jenis
ekstrak
y a b
ln(x) x=IC50 rerata
Ul-1 50 16.35
-34.68
5.17920489 177.54159
180.051
Ul-2 50 16.59
-35.97
5.18203737 178.045186
Ul-3 50 15.32
-29.94
5.21801567 184.567577
y = 16,35ln(x) ‐34,68 R² = 0,971 y = 16,59ln(x) ‐35,97
R² = 0,934
y = 15,32ln(x) ‐29,94
R² = 0,862
0 10 20 30 40 50 60
0 50 100 150 200 250 300
%
in
h
Lampiran 7 Data nilai absorbansi dan % inhibisi ekstrak air benalu jeruk
Hasil analisis ekstrak air
Konsentrasi
(ppm)
Absorbansi (A)
Inhibisi (%)
Ul-1
Ul-2
Ul-3
Ul-1 Ul-2 Ul-3
1000
0.732 0.726 0.714
42.22
40.49
46.44
500
0.866 0.897 0.901
31.65
26.47
32.41
250
1.011 0.925 1.053
20.20
24.18
21.01
125
1.132 1.139 1.177
10.65
6.63
11.70
Aktivitas inhibisi ekstrak air benalu jeruk terhadap
α
-glukosidase :
y = a ln(x) + b
% inhibisi = a ln (konsentrasi) + b
Jenis
ekstrak
y a b
ln(x) x=IC50 rerata
Ul-1 50
9.32
-26.32
8.1888412
3600.54752
3488.38
Ul-2 50
10.82
-37.45
8.08225508 3236.52364
Ul-3 50
8.511
-19.76
8.19645165 3628.05384
y = 9,320ln(x) ‐26,32R² = 0,828 y = 10,82ln(x) ‐37,45
R² = 0,903
y = 8,511ln(x) ‐19,76
R² = 0,808
‐20 ‐10 0 10 20 30 40 50
0 500 1000 1500
%
in
h
Lampiran 8 Data hasil pengujian toksisitas
Sampel Ulangan
Jumlah udang mati
pada konsentrasi (
μ
g/mL atau
μ
L/mL)
LC50
(
μ
g/mL)
1000 500 100 10
Ekstrak
Etanol
96%
1 4 3 1 1
978.85
2 5 3 1 0
3 5 4 2 0
Ekstrak
Etanol
70%
1 5 3 1 0
864.60
2 6 3 2 0
3 6 3 2 0
Ekstrak
Etanol
30%
1 8 4 2 0
648.15
2 7 3 2 1
3 8 4 2 0
Ekstrak
Air
1 6 3 1 1
699.92