i
ADSORPSI, EMULSIFIKASI, DAN ANTIBAKTERI EKSTRAK
DAUN PARE
(Momordica charantia)
SILVY AULYA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
SILVY AULYA. Adsorpsi, Emulsifikasi, dan Antibakteri Ekstrak Daun Pare
(
Momordica charantia
). Dibimbing oleh DIMAS ANDRIANTO dan POPI ASRI
KURNIATIN.
Daun pare (
Momordica charantia
) mengandung saponin yang dapat
digunakan sebagai bahan aktif pembersih wajah. Kosmetik yang beredar saat ini
mengandung bahan kimia berbahaya bagi kulit wajah, seperti merkuri,
hidrokuinon, dan zat pewarna. Untuk itu, masyarakat mulai beralih menggunakan
kosmetik herbal. Penelitian bertujuan menentukan potensi ekstrak daun pare
sebagai pengadsorpsi logam, penurun tegangan permukaan, dan antibakteri. Daun
pare diekstrak menggunakan empat pelarut, yaitu air, etanol, metanol, dan
heksana. Ekstrak kemudian diukur daya adsorpsinya melalui kemampuan
menjerap logam Hg, Pb, dan Cu, daya emulsifikasi melalui kemampuan
menurunkan tegangan permukaan, dan antibakteri dengan metode pengenceran.
Hasil uji adsorpsi menunjukkan ekstrak etanol daun pare menjerap logam Pb
sebesar 30.43% dan Hg sebesar 24.38%, namun hanya ekstrak n-heksana daun
pare yang menjerap logam Cu sebesar 21.42%. Hasil uji tegangan permukaan
menunjukkan ekstrak air paling stabil menurunkan tegangan permukaan. Hasil uji
antibakteri terhadap
Staphylococcus epidermidis
menunjukkan nilai KHM (Kadar
Hambat Minimum) sebesar 62.5 ppm untuk ekstrak air dan etanol daun pare
sedangkan nilai KBM (Kadar Bunuh Minimum) sebesar 2000 ppm untuk ekstrak
etanol dan metanol daun pare.
iii
ABSTRACT
SILVY AULYA. Adsorption, Emulsification, and Antibacteria of
Momordica
charantia
Leaves Extract. Under the direction of DIMAS ANDRIANTO and
POPI ASRI KURNIATIN.
Bitter melon (
Momordica charantia
) leaves contains saponin. Saponin can
be used as an active substance in facial cleanser. Actually, the reality shows that
many of circulated cosmetic contain the chemical materials that hazardous to
facial skin such as mercury, hydroquinone, and colorant substances. Knowing
that, people begin to realize the importance of herbal cosmetic usage. This
research aim to observe the potential of bitter melon leaves as the metal adsorber,
surface tension reducer, and anti bacterial. The bitter melon leaves extracted using
four solvents, namely water, ethanol, methanol, and hexane. The extracts then
experience with the measurement of the ability of metal adsorption, emulsification
power tested by the ability of reducing the surface tension, and the antibacterial
activity using dilution method with microplate. The adsorption test shows that
ethanol extraction of bitter melon leaves is able to adsorb Pb at 30.43% and Hg at
24.38%, but only n-hexane extraction of bitter melon leaves that can adsorb Cu at
21.42%. The surface tension test shows the water extraction of bitter melon leaves
is the best extraction to reduce the surface tension. The result of antibacterial test
to
Staphylococcus epidermidis
exhibit that the MIC (Minimal Inhibitory
Concentration) at 62.5 ppm for water and ethanol extraction of bitter melon
leaves and the MBC (Minimal Bactericidal Concentration) at 2000 ppm for
ethanol and methanol extraction of bitter melon leaves.
ADSORPSI, EMULSIFIKASI, DAN ANTIBAKTERI EKSTRAK
DAUN PARE
(Momordica charantia)
SILVY AULYA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
v
Judul Skripsi : Adsorpsi, Emulsifikasi, dan Antibakteri Ekstrak Daun Pare
(
Momordica charantia
).
Nama
: Silvy Aulya
NIM
: G84080017
Disetujui
Komisi Pembimbing
Dimas Andrianto, M.Si
Ketua
Popi Asri Kurniatin, M.Si.,Apt.
Anggota
Diketahui
Dr. I Made Artika M.App.Sc.
Ketua Departemen Biokimia
PRAKATA
Bismillaahirrahmaanirrahiim
Assalaa
mu’alaikum w
arahmatullaahi wabarakaatuh
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala rahmat
dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan karya
ilmiah ini. Karya ilmiah yang berjudul Adsorpsi, Emulsifikasi, dan Antibakteri
Ekstrak Daun Pare (
Momordica charantia
) merupakan penelitian yang telah
dilaksanakan pada bulan Februari 2012 hingga Juni 2012 di laboratorium
penelitian Departemen Biokimia Institut Pertanian Bogor. Penelitian ini juga
merupakan salah satu Program Kreativitas Mahasiswa bidang Penelitian (PKMP).
Ucapan terima kasih penulis sampaikan kepada Dimas Andrianto, M.Si dan
Popi Asri Kurniatin, M.Si., Apt. selaku komisi pembimbing yang telah
memberikan kesempatan bagi penulis untuk belajar banyak hal dalam penelitian
ini dan memberikan bimbingan hingga saat penulisan karya tulis ini. Penulis juga
menyampaikan rasa terima kasih dan penghargaan tertinggi kepada Ayahanda
Yunadi, Almarhumah Ibunda Yasmimanizarti, serta adik-adik tercinta
Muhammad Fadhli, Maivenny Suciwati, dan Arief Saputera atas doa tulus,
semangat, dan kasih sayang yang selalu mengiringi langkah penulis. Terima kasih
juga penulis ucapkan kepada DIKTI yang telah membiayai penelitian ini melalui
program PKMP.
Ucapan terima kasih juga penulis sampaikan kepada rekan-rekan yang telah
membantu penelitian ini, Dewi dan Feby di mayor Biokimia yang telah banyak
membantu pelaksanaan penelitian ini, Maman di Fisika yang telah mengajarkan
pengukuran tegangan permukaan, Ibu Nunuk di Pusat Studi Biofarmaka yang
secara teknis membantu pengujian aktivitas antibakteri. Terima kasih pula untuk
teman-teman terdekat Kenyar, Beki, Yoan, dan rekan-rekan di Pondok Asad.
Akhir kata, penulis berharap semoga karya tulis ini bermanfaat bagi
perkembangan ilmu pengetahuan.
Wassalamu’alaikum warahmatullahi wabarakatuh
Bogor, Juni 2012
vii
RIWAYAT
HIDUP
Penulis dilahirkan di Bekasi pada tanggal 19 Desember 1990 sebagai anak
pertama dari empat bersaudara dari ayahanda Yunadi dan almarhumah ibunda
Yasmimanizarti. Riwayat pendidikan formal penulis dimulai dari TK Islam Bhakti
IV Cipinang Bali-Jakarta, SDI Alhayatiddiniyah Cipinang Bali-Jakarta, dan SDN
06 Pagi Cipinang Melayu, kemudian penulis melanjutkan pendidikan ke SMPN
80 Halim Perdana Kusuma. Penulis lulus dari SMAN 2 Padangpanjang pada
tahun 2008 kemudian melanjutkan pendidikan ke Departemen Biokimia Institut
Pertanian Bogor melalui
Program Penerimaan Mahasiswa Baru Jalur Penelusuran
Minat dan Kemampuan (PMDK)
2008. Penulis mengambil minor Ilmu dan
Teknologi Pangan
untuk memperkaya pengetahuan penulis dalam bidang pangan.
Penulis aktif dalam kegiatan organisasi kemahasiswaan seperti
Community
Research dan Education of Biochemistry Student
(CREBs IPB) sebagai staf divisi
keilmuan tahun 2009/2010, sebagai staf Badan Pengawas tahun 2010/2011 dan
Ikatan Mahasiswa Serambi Mekkah dan Pagaruyung (IMASERAMPAG). Selain
itu, penulis aktif pada kepanitiaan beberapa acara seperti Seminar Kesehatan dan
Expo Biokimia, Seminar Nasional Sains IV, Lomba Karya Ilmiah Populer, dan
pernah menjadi tenaga pengajar di bimbingan belajar El Rahma.
Masa perkuliahan penulis juga diisi dengan kunjungan industri ke beberapa
tempat seperti Lembaga Penelitian Biologi Molekuler Eijkman Jakarta, PT
Djojonegoro C-1000 Sukabumi, PT Nissin Biscuit Indonesia Semarang, dan
Coca-Cola Amatil Indonesia Semarang. Tahun 2011 penulis melaksanakan pratik
lapangan di Pusat Studi Biofarmaka (PSB) LPPM IPB
dengan judul “
Uji
Aktivitas Antioksidan dan Kadar Flavonoid Ekstrak Air dan Etanol Daun Saga
(
Abrus precatorius
Linn). Tahun 2012 penulis melaksanakan penelitian ini
sebagai tugas akhir dan pada tahun yang sama penulis juga melaksanakan
penelitian yang didanai oleh DITJEN DIKTI dengan judul “
Ekstrak Daun Pare
(Momordica charantia)
Sebagai Bahan Aktif Kosmetik Pembersih Wajah” pada
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA... 1
Pare ... 1
Adsorpsi ... 2
Emulsifikasi ... 3
Antibakteri ... 4
BAHAN DAN METODE ... 5
Alat dan Bahan ... 5
Metode ... 5
HASIL DAN PEMBAHASAN ... 7
Ekstraksi Daun Pare ... 7
Komponen Fitokimia Ekstrak Daun Pare ... 8
Kadar Logam Simplisia Daun Pare ... 9
Hasil Uji Adsorpsi ... 9
Uji Tegangan Permukaan (Daya Emulsifikasi) ... 11
Uji Aktivitas Antibakteri ... 12
SIMPULAN DAN SARAN ... 13
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
ix
DAFTAR TABEL
Halaman
1 Hasil pengukuran rendemen ... 8
2 Hasil pengujian fitokimia simplisia dan ekstrak daun pare ... 9
3 Hasil pengukuran uji logam simplisia daun pare menggunakan AAS... 9
4 Uji aktvitas antibakteri ekstrak pare terhadap bakteri
S.epidermidis
... 13
DAFTAR GAMBAR
Halaman
1 Daun pare ... 2
2 Susunan alat AAS.. ... 3
3 Alat pengukur tegangan permukaan ... 7
4 Hasil pengujian penjerapan logam Hg ... 10
5 Hasil pengujian penjerapan logam Pb ... 10
6 Hasil pengujian penjerapan logam Cu ... 10
7 Hasil uji tegangan permukaan ... 11
8 Uji antibakteri. ... 12
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 17
2 Hasil pengukuran kadar air ... 18
3 Hasil pengukuran uji tegangan permukaan ... 18
4 Hasil pengujian penjerapan logam Hg ... 19
5 Hasil pengujian penjerapan logam Pb ... 20
PENDAHULUAN
Kosmetik merupakan salah satu bagian terpenting dari penampilan para wanita. Kosmetik sangat beragam jenis dan merknya. Salah satu jenis kosmetik adalah pembersih wajah. Mengingat tingkat polusi, debu, dan asap rokok pada saat ini semakin tinggi, maka pembersih wajah merupakan salah satu kebutuhan yang harus dipenuhi oleh masing-masing orang (Tranggono et al. 2007). Menurut Wardani (2010), ada dua faktor yang mempengaruhi kesehatan kulit, yakni faktor eksternal dan internal. Faktor eksternal diantaranya adalah sinar matahari, polusi, debu, dan asap rokok. Sementara faktor internal adalah sakit yang berkepanjangan karena kurangnya asupan gizi sehingga mempengaruhi kesehatan kulit.
Kulit adalah lapisan atau jaringan yang menutupi seluruh tubuh dari bahaya yang datang dari luar (Damin 2006). Lapisan kulit pada dasarnya sama di semua bagian tubuh, kecuali di telapak tangan, telapak kaki, dan bibir. Namun, kulit wajah sedikit berbeda karena di lapisan bawahnya terdapat lebih banyak pembuluh darah. Karena kaya akan pembuluh darah, wajah biasanya mempunyai kulit yang lebih halus dari bagian tubuh yang lain (Daniel 2005).
Masalah kulit wajah seringkali menjadi sorotan. Salah satu masalah kulit wajah yang sering dijumpai, yaitu timbulnya jerawat. Jerawat adalah suatu keadaan pori-pori kulit yang tersumbat sehingga menimbulkan kantung nanah. Penyumbatan pori-pori seringkali disebabkan oleh penggunaan kosmetik yang salah. Pemilihan jenis kosmetik ini perlu diperhatikan dengan baik (Retno & Fatma 2007).
Membersihkan kulit pada prinsipnya adalah menghilangkan residu, kotoran, atau minyak sehingga harus dilakukan dengan rutin. Terutama untuk kulit wajah dianjurkan menggunakan pembersih yang sesuai dengan jenis kulit masing-masing (Retno & Fatma 2007).
Saat ini masyarakat menyadari pentingnya penggunaan kosmetik herbal. Hal ini menyangkut faktor keamanan kosmetik terhadap kesehatan kulit wajah dan bahaya iritasi yang dapat ditimbulkan oleh bahan baku sintetik (Retno & Fatma 2007). Kosmetik yang berkembang saat ini dilaporkan banyak mengandung bahan kimia berbahaya bagi kesehatan wajah, seperti merkuri, hidrokuinon, asam retinoat, dan zat pewarna (BPOM 2009). Produk kosmetik
yang mengandung bahan kimia berbahaya ini ditarik dari peredaran dan dilarang untuk diperdagangkan. Untuk itu, timbullah tuntutan adanya inovasi dalam produksi kosmetik herbal.
Tanaman pare (Momordica charantia) adalah salah satu tanaman herbal Indonesia. Biasanya tanaman pare dimanfaatkan sebagai tanaman obat. Daunnya berkhasiat sebagai obat cacingan, obat batuk, obat demam, peluruh haid, obat sembelit, penambah nafsu makan, melancarkan pengeluaran ASI, mengobati penyakit sipilis, dan liver (Kuswoyo 2009). Selain itu, daun pare terkadang dimanfaatkan oleh masyarakat di beberapa daerah untuk mencuci muka, contohnya masyarakat di daerah Padang Pariaman Sumatera Barat. Masyarakat Padang Pariaman memanfaatkan daun pare untuk membersihkan wajah. Mereka biasanya meremas-remas daun pare dengan air bersih kemudian air hasil remasan daun pare digosokkan ke wajah.
Daun pare sebagai salah satu tanaman herbal Indonesia yang biasa dipakai oleh beberapa masyarakat untuk membersihkan wajah diduga mengandung bahan aktif yang berkhasiat. Salah satu kandungan kimia dari daun pare adalah saponin (Kuswoyo 2009). Saponin dalam daun pare ini diharapkan mampu menurunkan tegangan permukaan dan mempunyai aktivitas antibakteri. Dalam penelitian ini diharapkan saponin berpotensi sebagai salah satu bahan aktif kosmetik pembersih wajah yang berbasis herbal.
Penelitian ini bertujuan untuk menentukan potensi ekstrak air, etanol, metanol, dan n-heksana daun pare sebagai penjerap logam Hg, Pb, dan Cu, penurun tegangan permukaan, dan aktivitas antibakterinya. Hipotesis penelitian ini adalah ekstrak daun pare memiliki kemampuan menjerap logam Hg, Pb, dan Cu, mampu menurunkan tegangan permukaan, dan memiliki aktivitas antibakteri. Penelitian ini juga diharapkan bermanfaat untuk memberikan informasi tentang potensi ekstrak daun pare sebagai inovasi pembersih wajah yang berasal dari bahan herbal.
TINJAUAN PUSTAKA
Pare
2
(Nunun 2009). Daun tunggal berbentuk bulat telur, berbulu, panjang tangkai 7-13 cm, dan berwarna hijau. Bunga tunggal berkelamin satu, kelopak berbentuk lonceng, berusuk banyak, panjang 5-15 cm, mahkota berbentuk bulat telur berwarna kuning (Adi et al. 2008).
Buah pare berbentuk bulat panjang, berusuk, warna jingga. Biji berbentuk pipih, keras, warna cokelat kekuningan. Akar tunggang dan berwarna putih kotor (Adi et al. 2008). Buah pare mengandung karantin, hidroksitriptamin, flavonoid, alkaloid, asam stearat, asam palmitat, vitamin A, B, dan C (Robby 2009). Biji mengandung senyawa momordisin. Biji pare memiliki khasiat sebagai antiradang. Buah pare berkhasiat sebagai peluruh dahak, pembersih darah, penurunan panas, penyegar badan, penambah nafsu makan, penurun gula darah, memperlancar pencernaan, dan obat malaria (Santoso 1996).
Bagian utama tanaman pare yang mempunyai nilai ekonomi cukup tinggi adalah buahnya. Dari sudut pandang petani (produsen) peluang pasar pare merupakan salah satu alternatif usaha tani yang dapat dijadikan sumber penghasilan dan peningkatan pendapatan (Nunun 2009). Sebaliknya, bagi kalangan pengguna (konsumen) selain dijadikan berbagai masakan, buah pare juga mensuplai gizi yang berfungsi ganda sebagai obat. Rasa pahit tanaman pare terutama daun dan buah disebabkan oleh kandungan zat sejenis glukosida yang disebut momordisin atau charantin (Subahar et al. 2004).
Para ahli kesehatan menemukan kandungan zat lain pada tanaman pare antara lain insulin dan resin. Zat penimbul rasa pahit pada tanaman pare mempunyai nilai sosial dan kegunaan yang luas dalam pelayanan kesehatan masyarakat, diantaranya sebagai bahan obat tradisional untuk menyembuhkan beberapa jenis penyakit. Daun pare berkhasiat sebagai obat cacing, batuk abses, demam, peluruh haid, sembelit, menambah nafsu makan, melancarkan pengeluaran ASI, sipilis, dan liver (Kuswoyo 2009).
Gambar 1 Daun pare
Kandungan kimia dari daun pare yaitu resin, minyak, flavonoid, karbohidrat, zat warna, saponin, alkaloid, dan triterpenoid (Kuswoyo 2009). Salah satu kandungan kimia yang berpotensi menjadi bahan baku pembersih wajah adalah saponin dari ekstrak daun pare. Kandungan saponin dari ekstrak daun pare ini memiliki kemampuan untuk membersihkan kotoran di kulit wajah misalnya debu dan sisa riasan.
Adsorpsi
Adsorpsiataupenjerapan adalah suatu proses yang terjadi ketika suatu fluida, cairan maupun gas, terikat pada suatu padatan atau cairan (zat penjerap, adsorben) dan akhirnya membentuk suatu lapisan tipis atau film (zat terjerap, adsorbat) pada permukaannya (Bassett et al. 1994). Berbeda dengan absorpsi, pada absorpsi terjadi reaksi kimia antara molekul-molekul adsorbat dengan permukaan adsorben (Ryan 2008). Adsorpsi suatu zat pada permukaan adsorben dipengaruhi oleh beberapa faktor, yaitu jenis adsorben, jenis adsorbat atau zat yang teradsorpsi, luas permukaan adsorben, konsentrasi zat terlarut, dan temperatur (Suardana 2008).
Adsorpsi dibedakan menjadi dua jenis, yaitu adsorpsi fisik (disebabkan oleh gaya Van Der Waals (terjadinya gaya tarik menarik yang relatif lemah antara adsorbat dengan permukaan adsorben) dan adsorpsi kimia (terjadi karena terbentuknya ikatan kovalen dan ion antara molekul-molekul adsorbat dengan adsorben, dikenal dengan istilah absorpsi) (Ryan 2008).
Adsorben ialah zat yang melakukan penjerapan terhadap zat lain (baik cairan maupun gas) pada proses adsorpsi. Umumnya adsorben bersifat spesifik, hanya menjerap zat tertentu. Adsorben yang paling banyak dipakai untuk menjerap zat-zat dalam larutan adalah arang. Zat ini banyak dipakai di pabrik untuk menghilangkan zat-zat warna dalam larutan. Penjerapan bersifat selektif, yang dijerap hanya zat terlarut atau pelarut sangat mirip dengan penjerapan gas oleh zat padat. Beberapa jenis adsorben yang biasa digunakan, yaitu arang aktif, gel silika, dan alumina aktif (Atkins 1997).
maupun dalam fase gas. Struktur pori berhubungan dengan luas permukaan, dimana semakin kecil pori-pori arang aktif, mengakibatkan luas permukaan semakin besar. Dengan demikian kecepatan adsorpsi bertambah. Karbon aktif ini cocok digunakan untuk mengadsorpsi zat-zat organik. Komposisi arang aktif, diantaranya terdiri dari silika (SiO2), karbon, (Meilita & Tuti 2010).
Proses adsorpsi pada penelitian ini akan dilakukan untuk melihat kemampuan ekstrak daun pare (Momordica charantia) dalam menjerap kotoran. Kotoran yang ada pada wajah berasal dari banyak faktor salah satunya akibat polusi dari udara, jenis kulit, dan akibat pemakaian kosmetik (Retno & Fatma 2007). Ekstrak daun pare sebagai bahan aktif kosmetik pembersih wajah diharapkan akan menjerap kotoran-kotoran berupa logam dari polusi udara yang ada pada kulit wajah dengan kontrol positif yang digunakan adalah arang aktif.
Sumber utama pencemaran udara adalah asap kendaraan bermotor. Udara yang tercemar ini, diantaranya mengandung beberapa logam berat, diantaranya logam Hg, Pb, dan Cu. Saeni (1997) menyatakan bahwa partikel Hg, Pb, dan Cu yang dikeluarkan oleh asap kendaraan bermotor berukuran antara 0,08 – 1,00 µg dengan masa tinggal di udara selama 4 – 40 hari. Masa tinggal yang lama menyebabkan partikel Pb dapat disebarkan angin hingga mencapai 100 – 1000 km dari sumbernya. Hal tersebut yang menyebabkan pencemaran timbal di udara mudah tersebar. Oleh karena itu, dalam penelitian ini sampel logam yang digunakan adalah logam Hg, Pb, dan Cu. Hasil penjerapan logam oleh ekstrak daun pare ini akan diukur dengan menggunakan AAS (Atomic Absorption Spectrophotometer).
Atomic Absorption Spectrophotometry
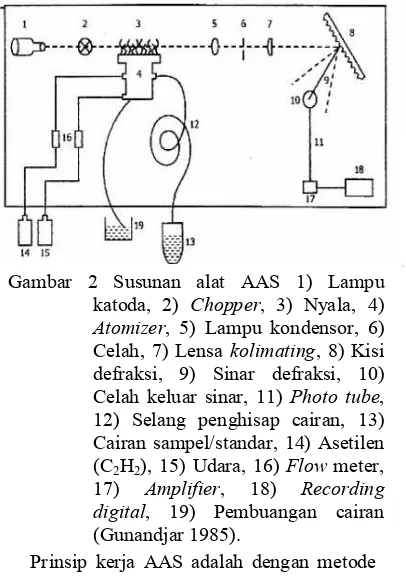
Atomic Absorption Spectrophotometry (AAS) adalah suatu metode analisis yang dapat digunakan untuk menentukan unsur-unsur di dalam suatu bahan. Alat ini memiliki kepekaan, ketelitian serta selektivitas yang tinggi. Dalam spektrofotometri serapan atom lampu katoda rongga (Hollow Cathoda Lamps) digunakan sebagai sumber radiasi. Perkembangan terakhir cara analisis AAS selain atomisasi dengan nyala dapat juga dilakukan atomisasi tanpa nyala yaitu ada yang menggunakan energi listrik pada batang karbon atau bahkan hanya dengan penguapan (Gunandjar 1985). Susunan alat AAS secara umum dapat dilihat pada Gambar 2.
Prinsip kerja AAS adalah dengan metode analisis yang didasarkan pada proses penyerapan tenaga radiasi oleh atom-atom yang berada pada tingkat tenaga dasar. Penyerapan tersebut menyebabkan tereksitasinya elektron ke tingkat tenaga yang lebih tinggi. Penguraian intensitas radiasi yang diberikan sebanding dengan jumlah atom pada tingkat dasar yang menyerap tenaga radiasi tersebut (Gunandjar 1985).
Emulsifikasi
Emulsifikasi adalah suatu proses yang terjadi antara dua cairan atau senyawa yang tidak dapat bercampur (Ginting 2006). Berdasarkan fase terdispersinya, dikenal dua jenis emulsi, yaitu emulsi minyak dalam air dan emulsi air dalam minyak. Emulsi minyak dalam air, yaitu dimana fase minyak terdispersi dalam fase air. Emulsi air dalam minyak, yaitu dimana fase air terdispersi dalam fase minyak (Sumardjo et al. 2008).
Terdapat tiga teori yang menerangkan mengenai sistem emulsi, yaitu Teori Tegangan Permukaan, bila cairan kontak dengan cairan kedua yang tidak larut dan tidak saling bercampur, kekuatan (tenaga) yang menyebabkan masing-masing cairan pecah menjadi partikel-partikel yang lebih kecil disebut tegangan permukaan. Zat-zat yang dapat menurunkan tegangan permukaan disebut zat aktif permukaan (surfaktan) atau zat pembasah. Dengan menurunnya tegangan permukaan, gaya tarik-menarik antar molekul Gambar 2 Susunan alat AAS 1) Lampu
katoda, 2) Chopper, 3) Nyala, 4) Atomizer, 5) Lampu kondensor, 6) Celah, 7) Lensa kolimating, 8) Kisi defraksi, 9) Sinar defraksi, 10) Celah keluar sinar, 11) Photo tube, 12) Selang penghisap cairan, 13) Cairan sampel/standar, 14) Asetilen (C2H2), 15) Udara, 16) Flow meter,
4
dari masing-masing cairan akan berkurang dan kedua cairan dapat saling becampur. Kedua adalah Oriented-Wedge Theory, lapisan monomolekuler dari zat pengemulsi melingkari suatu tetesan dari fase dalam pada emulsi. Zat pengemulsi akan memilih larut dalam salah satu fase yang merupakan gambaran kelarutannya pada cairan tertentu dan terikat kuat kemudian terbenam di dalam fase tersebut dibandingkan fase lainnya. Ketiga adalah Teori Plastik atau Teori Lapisan Antarmuka, menempatkan zat pengemulsi pada antarmuka antar minyak dan air, mengelilingi tetesan fase dalam sebagai suatu lapisan tipis atau film yang diabsorpsi pada permukaan dari tetesan tersebut. Lapisan tersebut mencegah kontak dan bersatunya fase terdispersi. Makin kuat dan makin lunak lapisan tersebut, makin besar dan stabil emulsinya (Lachman 1994).
Penelitian ini menitikberatkan pada Teori Tegangan Permukaan. Larutan ekstrak daun pare dengan konsentrasi tertentu diukur besar tegangan permukaannya, kemudian akan direaksikan dengan ekstrak daun pare. Pemberian ekstrak ini diharapkan mampu menurunkan tegangan permukaan yang artinya ekstrak mampu membersihkan kotoran yang terdapat pada wajah.
Antibakteri
Antimikrob diantaranya meliputi antibakteri, antiprotozoa, antifungal, dan antivirus. Senyawa antibakteri adalah zat yang dapat menghambat pertumbuhan mikrob dan dapat digunakan untuk kepentingan pengobatan infeksi pada manusia, hewan, dan tumbuhan. Antibakteri digunakan untuk menghambat pertumbuhan bakteri (Schunack 1990). Berdasarkan cara kerjanya antibakteri dibedakan menjadi bakteriostatik dan bakterisida (Vega 2011). Antibakteri bakteriostatik bekerja dengan cara menghambat perbanyakan populasi bakteri dan tidak mematikan, sedangkan bakterisida bekerja membunuh bakteri. Bakteriostatik dapat bertindak sebagai bakterisida dalam konsentrasi tinggi (Schunack et al. 1990).
Kadar minimal yang dibutuhkan untuk menghambat pertumbuhan suatu bakteri atau membunuhnya, masing-masing dikenal dengan Kadar Hambat Minimal (KHM) dan Kadar Bunuh Minimal (KBM) (Schunack et al. 1990). Sifat suatu antibakteri berbeda satu dengan yang lainnya, ada yang berspektrum luas dan ada pula yang berspektrum sempit, tergantung dari banyaknya bakteri yang dihambat atau dibunuh (Vega 2011).
Menurut Dwijoseputro (1990), antibakteri dapat dibedakan berdasarkan keefektifan kerjanya, yaitu antibakteri berspektrum luas yang efektif terhadap berbagai jenis mikrob baik bakteri Gram positif maupun bakteri Gram negatif dan antibakteri berspektrum sempit yang hanya efektif terhadap mikrob tertentu, misalnya hanya efektif pada bakteri Gram positif saja atau Gram negatif saja. Menurut Todar (2007), disebutkan pula antibakteri berspektrum terbatas bila efektif terhadap spesies bakteri tertentu. Mekanisme kerja antibakteri dapat terjadi melalui beberapa cara, yaitu kerusakan dinding sel, perubahan permeabilitas sel, dan menghambat sintesis protein dan asam nukleat (Fradiaz 1987). Kerja antibakteri juga dipengaruhi beberapa faktor, antara lain konsentrasi zat antibakteri, spesies bakteri, jumlah bakteri, suhu, dan pH lingkungannya (Vega 2011).
Uji antibakteri dapat dilakukan dengan metode difusi dan metode dilusi (pengenceran). Metode difusi dilakukan dengan mengukur diameter zona bening yang merupakan petunjuk adanya respon penghambatan pertumbuhan bakteri oleh suatu senyawa antibakteri dalam ekstrak (Hermawan et al. 2007). Metode difusi dapat dilakukan dengan menggunakan tiga cara, yaitu metode silinder, metode lubang, dan metode cakram kertas. Melalui metode ini akan terlihat ada tidaknya daerah hambatan di sekeliling lubang (Kusumaningjati 2009).
Metode dilusi (pengenceran) adalah senyawa antibakteri diencerkan hingga diperoleh beberapa macam konsentrasi, masing-masing konsentrasi ditambahkan suspensi bakteri uji dalam media cair. Ada tidaknya pertumbuhan bakteri ditandai dengan terjadinya kekeruhan. Larutan uji senyawa antibakteri pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan bakteri uji, ditetapkan sebagai Kadar Hambat Minimal (KHM). Larutan yang ditetapkan sebagai KHM selanjutnya dikultur ulang pada media cair tanpa penambahan bakteri uji ataupun senyawa antibakteri kemudian diinkubasi selama 24 jam. Media cair yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai Kadar Bunuh Minimal (KBM) (Pratiwi 2009). Dalam penelitian ini uji antibakteri akan dilakukan terhadap bakteri Staphylococcus epidermidis dengan metode pengenceran menggunakan microplate.
buah anggur. Koloni biasanya berwarna putih atau krem. Hidup di permukaan kulit dan membran mukosa manusia maupun hewan (James & Hilary 2001).
BAHAN DAN METODE
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah neraca analitik, blender, tabung reaksi, pipet tetes, pipet Mohr, labu Erlenmeyer, gelas piala, pipet volumetrik, kertas saring, gelas ukur, cawan porselin, oven, tanur, gegep, eksikator, rotary evaporator, vorteks, penangas air, vial, aluminium foil, laminar, mikropipet, Atomic Absorption Spectrophotometer (AAS), autoklaf, cawan Petri, inkubator, alat-alat pengukur tegangan permukaan, pipet mikro.
Bahan untuk pembuatan ekstrak adalah simplisia daun pare, akuades, etanol, metanol, heksana. Bahan untuk uji fitokimia adalah NaOH, H2SO4 pekat, kloroform, akuades,
metanol, pereaksi Dragendorf, pereaksi Meyer, dan pereaksi Wagner, pereaksi Lieberman Buchard, eter. Bahan untuk uji penjerapan logam adalah HCl 18%, standar arang aktif, standar logam Hg, Pb, dan Cu. Bahan untuk uji aktivitas antibakteri adalah Nutrient Broth, DMSO, isolat bakteri Staphylococcus epidermidis, media TSB, kloramfenikol, tip biru, tip kuning, dan microplate.
Metode
Pembuatan Simpilisia Daun Pare (BPOM 2004)
Daun pare yang digunakan dalam penelitian ini diambil dari lima daun setelah pucuk (daun tua). Daun yang telah disortir kemudian dicuci dengan air bersih agar hama dan kotoran di daun terbuang. Daun pare yang telah dicuci kemudian ditiriskan hingga semua air sisa cucian terpisah, setelah itu daun pare ditempatkan di dalam wadah yang bersih dan kering kemudian dirajang kasar. Hasil rajangan ini ditempatkan dalam nampan tahan panas, kemudian dikeringkan dalam oven pada suhu 500C selama 2-3 hari. Simplisia (daun pare kering) dihaluskan dengan blender berukuran 20-80 mesh kemudian dikemas dalam plastik dan disimpan di suhu ruang untuk pengujian berikutnya.
Penentuan Kadar Air Daun dan Simplisia (AOAC 1984)
Cawan porselin dikeringkan dalam oven pada suhu 1050C selama 30 menit, lalu cawan
didinginkan di dalam eksikator selama 30 menit. Sampel yang akan diukur kadar airnya adalah daun dan simplisia. Cawan kosong ditimbang bobotnya kemudian ditambahkan 3 gram sampel. Sampel di dalam cawan dikeringkan pada oven suhu 1050C selama 12 jam. Cawan beserta isinya kemudian didinginkan di dalam eksikator selama 30 menit, kemudian ditimbang kembali dan ditentukan kadar air sampel sampai massa sampel stabil atau tidak berubah. Penentuan kadar air dilakukan 3 kali ulangan.
Ekstraksi Simplisia Daun Pare (BPOM 2004) .
Ekstraksi adalah proses pemisahan satu atau lebih komponen dari suatu campuran homogen berdasarkan prinsip beda kelarutan. Pelarut yang digunakan dalam proses ekstraksi adalah akuades, etanol, metanol, dan heksana. Sebanyak 18 gram bubuk daun pare kering ditimbang kemudian dimasukkan ke dalam labu Erlenmeyer ukuran 250 mL. Pelarut (akuades, etanol, metanol, dan heksana) ditambahkan ke dalam labu Erlenmeyer sebanyak 180 mL dengan perbandingan daun pare : pelarut adalah 1:10. Campuran ditutup dengan aluminium foil, kemudian didiamkan selama 24 jam. Ekstrak kemudian disaring menggunakan kertas saring, dan filtrat ditampung dalam labu Erlenmeyer. Ampas hasil saringan kemudian ditambahkan pelarut kembali dengan jumlah perbandingan yang sama, kemudian didiamkan kembali selama 24 jam. Ekstrak kemudian disaring menggunakan kertas saring, dan filtrat ditampung dalam labu Erlenmeyer. Lakukan hal ini sampai tiga kali perendaman. Semua hasil filtrat digabungkan dalam satu labu Erlenmeyer. Labu evaporator ditimbang bobot kosongnya kemudian ditambahkan filtrat yang didapat ke dalam labu evaporator. Filtrat kemudian diuapkan pada vakum evaporator dan dihitung rendemen yang diperoleh. Semua ekstrak simplisia daun pare (air, etanol, metanol, dan heksana) disimpan di dalam lemari es suhu 4 yang akan digunakan pada pengujian berikutnya.
Uji Fitokimia (Harbone 1987)
6
tabung yang merupakan metode yang paling sederhana karena tidak menggunakan alat yang canggih dan masih manual. Uji ini meliputi uji flavonoid, uji alkaloid, uji tanin, uji steroid, uji terpenoid, uji saponin, dan uji glikosida.
Uji Flavonoid dan Senyawa Fenolik.
Ekstrak sampel sebanyak 0.1 g ditambah 2 mL etanol 30% sampai terendam lalu dipanaskan. Filtratnya dibagi 2, yang satu ditambah NaOH sebanyak 3 tetes 10% (b/v) dan filtrat satunya lagi ditambahkan H2SO4
sebanyak 3 tetes. Terbentuknya warna merah karena penambahan NaOH menunjukkan adanya senyawa fenolik hidrokuinon, sedangkan warna merah yang terbentuk akibat penambahan H2SO4 pekat menunjukkan
adanya flavonoid.
Uji Alkaloid. Sebanyak 10 mL kloroform ditambah dengan ekstrak sampel 0.1 g dan beberapa tetes ammonia. Fraksi kloroform dipisahkan dan diasamkan dengan 10 tetes H2SO4 2 M. Fraksi asam diambil kemudian
ditambahkan dengan pereaksi Dragendorf 3 tetes, pereaksi Meyer sebanyak 3 tetes, dan pereaksi Wagner sebanyak 3 tetes. Adanya alkaloid ditandai dengan terbentuknya endapan merah oleh pereaksi Dragendorf, endapan putih oleh pereaksi Meyer, dan endapan coklat oleh pereaksi Wagner.
Uji Tanin. Sebanyak 1 g serbuk bahan ditambah 10 mL akuades kemudian dididihkan selama 30 menit. Setelah dingin, campuran disaring dan filtratnya ditambah FeCl3 1% sebanyak 5 mL (b/v). Warna biru
tua atau hitam menunjukkan adanya tanin.
Uji Saponin. Ekstrak sebanyak 0.1 g ditimbang kemudian ditambahkan akuades 5 mL dan dipanaskan selama 5 menit. Larutan tersebut didinginkan kemudian dikocok. Timbulnya busa selama ± 10 menit menunjukkan adanya saponin.
Uji Triterpenoid dan Steroid. Ekstrak sebanyak 0.1 g ditambah 2 mL etanol 30% kemudian dipanaskan dan disaring. Selanjutnya filtrat diuapkan dan ditambahkan eter sebanyak 1 mL. Lapisan eter ditambah dengan pereaksi Lieberman Buchard (3 tetes asam asetat anhidrida dan 1 tetes H2S04
pekat). Warna merah atau ungu menunjukkan adanya triterpenoid dan warna hijau menunjukkan adanya steroid.
Uji Glikosida. Ekstrak sebanyak 1 mL diuapkan diatas penangas air sampai kering. Selanjutnya ditambahkan asam asetat anhidrat sebanyak 1 mL dan ditambahkan 10 tetes asam sulfat pekat. Warna biru hijau menunjukkan adanya glikosida.
Uji Kandungan Logam Simplisia Menggunakan AAS
Cawan porselen bersih ditimbang bobot kosongnya terlebih dahulu. Sebanyak 5 gram serbuk simplisia dimasukkan ke dalam cawan. Simplisia di dalam cawan dipanaskan hingga menjadi arang di atas penangas. Simplisia yang telah menjadi arang dipindahkan ke tanur sampai menjadi abu berwarna putih.
Simplisia yang telah menjadi abu dikeluarkan dari tanur kemudian didinginkan. Sebanyak 10 mL HCl 18% ditambahkan ke abu simplisia kemudian dipanaskan hingga mendidih, tetapi tidak sampai kering. Simplisia yang telah dilarutkan dengan HCl kemudian disaring ke dalam labu takar 50 mL. Sampel ditera dengan akuades sampai 50 mL. Kadar logam sampel diukur dengan AAS.
Penentuan Daya Adsorpsi Ekstrak Daun Pare Menggunakan AAS (Noor 2008)
Standar logam yang digunakan untuk uji ini adalah larutan Pb asetat, larutan HgCl2,
dan larutan CuSO4. Pengujian penjerapan
logam ini dilakukan dengan lima perlakuan. Perlakuan pertama setiap logam direaksikan dengan arang aktif sebagai kontrol positif. Perlakuan kedua setiap logam direaksikan dengan ekstrak air daun pare, lalu perlakuan ketiga setiap logam direaksikan dengan ekstrak etanol daun pare, perlakuan keempat setiap logam direaksikan dengan ekstrak metanol daun pare, dan perlakuan terakhir setiap logam direaksikan dengan ekstrak n-heksana daun pare. Kelima perlakuan ini kemudian diukur konsentrasi logamnya lalu dibandingkan dengan konsentrasi logam awal sebelum perlakuan atau sebelum direaksikan dengan ekstrak.
Uji Tegangan Permukaan (Daya Emulsifikasi)
Tegangan permukaan zat cair adalah kecenderungan permukaan zat cair untuk menegang, sehingga permukaannya seperti ditutupi oleh suatu lapisan elastis. Lapisan inilah yang disebut tegangan permukaan. Uji tegangan permukaan pada penelitian ini diukur dengan menggunakan alat Laboratory stand (Gambar 3). Pertama diukur panjang kaca dengan menggunakan jangka sorong dan tebal kaca diukur menggunakan mikrometer sekrup. Ekstrak ditimbang sebanyak 0.1 gram lalu dilarutkan dalam 100 mL akuades. Larutan ekstrak yang telah dibuat tadi diukur tegangan permukaannya dengan Laboratory stand. Gelas piala yang berisi larutan ekstrak perlahan-lahan dinaikkan sampai kaca yang tergantung pada alat tercelup seluruhnya dalam larutan ekstrak, kemudian secara perlahan gelas piala ditarik ke arah bawah dan dibaca perubahan skalanya. Setiap 1 mm simpangan jarum setara dengan massa 0.1 gram. Pengujian ini dilakukan sebanyak tiga kali ulangan. Setelah itu, dilakukan pemekatan larutan ekstrak dengan penambahan ekstrak 0.1 gram lalu diukur kembali tegangan permukaannya sampai konsentrasi menjadi 1%.
Besar tegangan permukaan dihitung dengan menggunakan rumus :
dengan, = tegangan permukaan (N/m) F = gaya (Newton)
p = panjang kaca t = lebar kaca
Gambar 3 Alat pengukur tegangan permukaan
Penentuan Aktivitas Antibakteri Metode Dilusi (Pengenceran) Menggunakan Microplate (Batubara et al. 2009)
Bakteri yang digunakan dalam penelitian ini, yaitu Staphylococcus epidermidis. Isolat bakteri ini diperoleh dari laboratorium Mikrobiologi Universitas Indonesia. Bakteri yang digunakan sebelumnya dilakukan tahap persiapan, sebelum diuji bakteri dari media padat di kultur kedalam media TSB selama 18 jam. Metode yang digunakan yaitu metode dilusi menggunakan microplate. Microplate ini memiliki 96 sumur yang terdiri dari 12 kolom dan 8 baris. Kolom 1 dan 2 berisi media bakteri yang diberi ekstrak air, kolom 3 dan 4 media yang diberi ekstrak etanol, kolom 5 dan 6 media yang diberi ekstrak metanol, kolom 7 dan 8 media yang diberi ekstrak n-heksana, kolom 9 dan 10 adalah kontrol positif, yaitu DMSO 20% dan terakhir kolom 11 dan 12 adalah kontrol negatif, yaitu kloramfenikol. Baris pertama berisi 160 µL DMSO 20%, 40 µl ekstrak dengan konsentrasi 10.000 ppm sehingga konsentrasinya menjadi 2000 ppm. Baris kedua samapi kedelapan hanya dimasukkan 100 µL DMSO 20%. Kemudian dilakukan pengenceran ½ kali dengan cara diambil 100 µL sampel dari kolom pertama lalu dicampur ke kolom kedua sehingga konsentrasinya menjadi 1000 ppm. Begitu seterusnya sampai kolom ke delapan hingga konsentrasinya akhir 15.63 ppm. Setelah itu semua sumur ditambahkan 100 µL media NB steril dan 10 µL inokulum bakteri. Inkubasi selama 24 jam pada suhu 37 °C.
Konsentrasi ekstrak yang tidak menunjukkan pertumbuhan bakteri (bening) secara visual dideskripsikan sebagai konsentrasi hambat minimum (KHM). Sebanyak 100 µL dari media yang tidak menunjukkan pertumbuhan bakteri diinokulasikan pada 100 µL media baru, kemudian diinkubasi selama 24 jam pada suhu 37 °C. Konsentrasi yang tidak menunjukkan pertumbuhan bakteri setelah inokulasi kedua dideskripsikan sebagai konsentrasi bunuh minimum (KBM).
HASIL DAN PEMBAHASAN
Ekstrak Daun Pare
8
bahan herbal adalah ≤ 10%. Artinya, simplisia daun pare dengan kadar air 9.74% layak digunakan sebagai bahan herbal dan memenuhi syarat untuk dilakukan pengujian selanjutnya. Bahan herbal yang memiliki kadar air lebih dari 10% juga tidak baik digunakan karena hasil ekstrak yang diperoleh akan banyak mengandung air daripada kandungan metabolit sekunder yang diinginkan.
Pengujian selanjutnya dimulai dengan melakukan ekstraksi terhadap simplisia daun pare. Simplisia pare yang diperoleh diekstrak menggunakan empat pelarut, yaitu air, etanol, metanol, dan heksana. Metode yang digunakan dalam ekstraksi adalah metode maserasi (perendaman). Keempat ekstrak yang diperoleh selanjutnya dihitung nilai rendemennya. Hasil perhitungan nilai rendemen dapat dilihat pada Tabel 1. Ekstrak air memiliki rendemen sebesar 16.48%, ekstrak etanol sebesar 27.95%, ekstrak metanol 15.14%, dan ekstrak n-heksana sebesar 13.28%. Pengukuran rendemen ini menunjukkan bahwa ekstrak etanol memiliki rendemen paling besar, yaitu 27.95%. Hasil uji ini menunjukkan bahwa pelarut etanol yang tergolong dalam pelarut semi polar paling baik dalam mengekstrak kandungan metabolit sekunder yang ada pada daun pare. Tabel 1 Hasil pengukuran rendemen
Ekstrak Total rendemen Air 16.48 % Etanol 27.95 % Metanol 15.14 % n-Heksana 13.28 %
Komponen Fitokimia Ekstrak Daun Pare
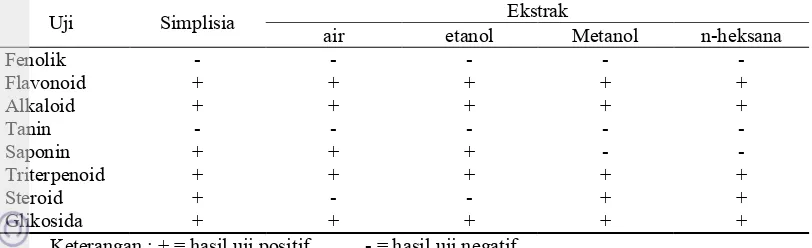
Uji fitokimia juga dilakukan terhadap simplisia daun pare, ekstrak air, etanol, metanol, dan n-heksana. Hasil Uji Fitokimia dapat dilihat pada Tabel 2. Uji ini dilakukan untuk mengetahui kandungan senyawa metabolit sekunder yang terdapat di dalam simplisia dan ekstrak daun pare. Senyawa-senyawa yang diidentifikasi yaitu Senyawa-senyawa fenolik, flavonoid, alkaloid, tanin, saponin, triterpenoid, steroid, dan glikosida.
Hasil uji fitokimia menunjukkan simplisia daun pare dan semua ekstrak daun pare tidak mengandung senyawa fenolik. Uji flavonoid memberikan hasil positif, artinya daun pare mengandung senyawa flavonoid, begitu juga dengan uji alkaloid yang juga memberikan hasil positif pada simplisia daun pare dan semua ekstrak daun pare. Berbeda dengan uji tanin, simplisia dan semua ekstrak daun pare
menunjukkan hasil negatif, sedangkan untuk uji saponin, ternyata hanya simplisia, ekstrak air, dan ekstrak etanol yang mengandung saponin.
Saponin dalam daun pare ini yang diduga berpotensi sebagai salah satu bahan aktif pembersih wajah. Artinya ekstrak yang berpotensi untuk dikembangkan sebagai bahan aktif pembersih adalah ekstrak air dan etanol daun pare karena kedua ekstrak ini memberikan hasil positif pada uji saponin. Uji triterpenoid dan glikosida menunjukkan simplisia dan semua ekstrak daun pare memberikan hasil positif. Berbanding terbalik dengan uji saponin, uji steroid menunjukkan hasil negatif pada ekstrak air dan etanol. Hasil positif untuk uji steroid ditunjukkan oleh ekstrak metanol dan n-heksana.
Ekstrak daun pare yang mengandung saponin adalah ekstrak air dan ekstrak etanol. Saponin dalam ekstrak daun pare ini yang diduga berpotensi sebagai salah satu bahan aktif kosmetik pembersih wajah. Dalam penelitian ini diharapkan ekstrak daun pare yang mengandung saponin dapat mengadsorpsi logam, menurunkan tegangan permukaan, dan sebagai antibakteri.
Saponin membentuk larutan koloidal dalam air dan membentuk busa yang mantap jika dikocok dan tidak hilang dengan penambahan asam (Harborne 1996). Diberi nama saponin karena sifatnya menyerupai sabun (sapo berarti sabun). Saponin diklasifikasikan berdasarkan sifat kimianya menjadi dua yaitu saponin steroid dan saponin triterpenoid. Saponin steroid tersusun atas inti steroid (C27) dengan molekul karbohidrat.
Tabel 2 Hasil pengujian fitokimia simplisia dan ekstrak daun pare
Uji Simplisia Ekstrak
air etanol Metanol n-heksana
Fenolik - - - - -
Flavonoid + + + + +
Alkaloid + + + + +
Tanin - - - - -
Saponin + + + - -
Triterpenoid + + + + +
Steroid + - - + +
Glikosida + + + + +
Keterangan : + = hasil uji positif - = hasil uji negatif
Kadar Logam Simplisia Daun Pare
Uji kandungan logam juga dilakukan terhadap simplisia daun pare. Tujuannya untuk melihat apakah sampel daun pare yang digunakan dalam penelitian ini mengandung logam berat atau tidak. Namun hasil yang didapat ternyata daun pare yang digunakan mengandung logam Pb sebesar 0.45 ppm dan logam Cu sebesar 0.62 ppm sedangkan logam Hg tidak terdeteksi. Hasil ini setara dengan kadar logam Pb sebesar 4.5% dan kadar logam Cu sebesar 6.2%. Hasil pengukuran kadar logam dapat dilihat pada Tabel 3.
Logam Pb yang terdapat dalam sampel daun pare diperkirakan berasal dari polusi udara seperti asap kendaraan bermotor dan asap pabrik (Darmono 2001). Fardiaz (1995) juga menyatakan bahwa semua bahan pangan alami mengandung timbal dalam konsentrasi kecil dengan kadar maksimal sebesar 0.72 ppm. Jika dalam darah kadar Pb melebihi 0.72 ppm maka dapat mengakibatkan keracunan akut yang cukup berbahaya.
Logam Cu yang terdapat dalam sampel daun pare diperkirakan berasal dari pemakaian pestisida (Fardiaz 1995). Menurut survey yang dilakukan, daun pare yang digunakan dalam penelitian ini mengalami penyemprotan hama dua hari sebelum dipetik. Menurut Saeni (1995), logam Cu merupakan unsur renik esensial untuk semua tanaman dan hewan termasuk manusia. Oleh karena itu, logam Cu harus selalu ada pada makanan. Batas ambang logam Cu untuk perikanan dan peternakan adalah sebesar 0.02 ppm dan untuk pertanian adalah sebesar 0.2 ppm. Pada konsentrasi yang lebih tinggi Cu akan toksik, terutama untuk bakteri, ganggang, dan jamur. Kadar Cu yang terdeteksi pada tanaman pare yang digunakan dalam penelitian ini sudah melebihi ambang batas maksimum, yaitu sebesar 0.62 ppm. Namun, kadar yang dapat menyebabkan keracunan dalam tubuh adalah sebesar 20 ppm.
Hasil uji kadar logam ini menunjukkan bahwa tingkat polusi udara saat ini sudah sangat tinggi. Padahal sampel daun pare yang diambil berasal dari daerah yang cukup jauh dari perkotaan, yaitu di desa Ciherang-Bogor. Disekitar daerah ini masih jarang pemukiman penduduk dan masih banyak terdapat areal pesawahan. Logam berat sampai pada daerah ini mungkin juga karena hembusan angin (Saeni 1997).
Tabel 3 Hasil pengukuran uji logam simplisia daun pare menggunakan AAS
Standar Logam Konsentrasi Logam Pb 0.45 ppm Hg Tidak terdeteksi Cu 0.62 ppm
Hasil Uji Adsorpsi
Uji adsorpsi (penjerapan) dilakukan menggunakan tiga logam standar, yaitu logam Hg, Pb, dan Cu. Alasan digunakannya ketiga logam ini karena logam inilah yang paling banyak terdapat di udara yang terpapar oleh polusi (Darmono 2001). Penelitian ini dilakukan untuk menguji ekstrak daun pare sebagai bahan aktif kosmetik pembersih wajah yang diharapkan mampu mengadsorpsi logam-logam tersebut.
10
Gambar 4 Hasil pengujian penjerapan logam Hg. aw (awal), aa (arang aktif), ea (ekstrak air), ee (ekstrak etanol), em (ekstrak metanol), eh (ekstrak n-heksana)
Hasil uji adsorpsi terhadap logam Hg menunjukkan bahwa 1% arang aktif mampu mengadsorpsi 27.21% logam Hg, 1% ekstrak air daun pare mengadsorpsi 6.24% logam Hg,
1% ekstrak etanol daun pare mengadsorpsi 30.43% logam Hg, 1% ekstrak metanol daun pare mengadsorpsi 10.22% logam Hg, dan 1% ektrak n-heksana mengadsorpsi 27.15% logam Hg. Hasil ini memberi informasi bahwa ekstrak etanol daun pare merupakan ekstrak terbaik untuk mengadsorpsi logam Hg dengan hasil penjerapan sebesar 30.43%.
Pengujian untuk logam Pb pada Gambar 5 menunjukkan bahwa semua ekstrak daun pare mampu mengadsorpsi logam timbal (Pb). Konsentrasi awal logam Pb sebelum penambahan arang aktif dan ekstrak daun pare, yaitu sebesar 1544.41 ppm. Penambahan 1% arang aktif menyebabkan konsentrasi logam Pb berkurang menjadi 909.69 ppm, penambahan 1% ekstrak air menurunkan konsentrasi logam Pb menjadi 956.23 ppm, penambahan 1% ekstrak etanol menurunkan konsentrasi logam Pb menjadi 791.05 ppm, penambahan 1% ekstrak metanol menurunkan konsentrasi logam Pb menjadi 1007.05 ppm, dan penambahan 1% ekstrak n-heksana menurunkan konsentrasi logam Pb menjadi 1167.94 ppm. Artinya, sebanyak 1% arang aktif mampu mengadsorpsi 41.09% logam Pb, sebanyak 1% ekstrak air daun pare mengadsorpsi 38.08% logam Pb, 1% ekstrak etanol daun pare mengadsorpsi 49.78% logam Pb, 1% ekstrak metanol daun pare mengadsorpsi 34.74% logam Pb, dan 1% ekstrak n-heksana dan pare mengadsorpsi 24.38% logam Pb. Hasil ini memberi informasi bahwa ekstrak etanol daun pare merupakan ekstrak terbaik untuk mengadsorpsi logam Pb.
Gambar 5 Hasil pengujian penjerapan logam Pb. aw (awal), aa (arang aktif), ea (ekstrak air), ee (ekstrak etanol), em (ekstrak metanol), eh (ekstrak n-heksana)
Menurut Saeni (1997), menyatakan bahwa partikel Pb yang menempel pada permukaan daun yang berbulu, tujuh kali lebih besar daripada permukaan daun yang licin. Menurut Nunun (2009), daun pare tergolong daun yang permukaannya berbulu, sehingga penjerapan daun pare terhadap logam Pb lebih tinggi dibandingkan dengan logam Hg. Selain itu, penelitian yang dilakukan selama ini lebih banyak membandingkan tentang penjerapan logam akibat tingginya polusi udara dengan indikator air, rambut, dan beberapa tanaman yang memang mempunyai kemampuan dalam menjerap logam. Beberapa contoh tanaman yang biasa dijadikan sebagai indikator, yaitu eceng gondok, kangkung, dan bayam (Saeni 1997). Sampai saat ini belum banyak penelitian yang dilakukan tentang penjerapan logam dengan perbandingan pelarut yang digunakan.
Uji adsorpsi logam tembaga (Cu) memberikan hasil yang berbeda dibandingkan dengan uji adsorpsi logam Hg dan Pb (Gambar 6).
Gambar 6 Hasil pengujian penjerapan logam Cu. aw (awal), aa (arang aktif), ea (ekstrak air), ee (ekstrak etanol), em (ekstrak metanol), eh (ekstrak n-heksana) 0 1000 2000 3000 4000 5000 6000
aw aa ea ee em eh
[l o ga m ] (ppm ) 0 500 1000 1500 2000
aw aa ea ee em eh
[l o ga m ] (ppm ) 0 2000 4000 6000 8000
aw aa ea ee em eh
Konsentrasi awal logam Cu sebelum penambahan arang aktif dan ekstrak daun pare, yaitu sebesar 4759.05 ppm. Penambahan 1% arang aktif menyebabkan konsentrasi logam Cu berkurang menjadi 4592.91 ppm, penambahan 1% ekstrak air justru menambah konsentrasi logam Cu menjadi 5742.86 ppm, penambahan 1% ekstrak etanol juga menaikkan konsentrasi logam Cu menjadi 4766.52 ppm, penambahan 1% ekstrak metanol juga menaikkan konsentrasi logam Cu menjadi 5778.32 ppm, dan penambahan 1% ekstrak n-heksana yang dapat menurunkan konsentrasi logam Cu menjadi 4512.63 ppm. Artinya, sebanyak 1% arang aktif mampu mengadsorpsi 3.49% logam Cu, sebanyak 1% ekstrak n-heksana daun pare mampu mengadsorpsi 5.18% logam Cu, sedangkan ekstrak air daun pare, ekstrak etanol daun pare, dan ekstrak metanol daun pare tidak dapat mengadsorpsi logam Cu. Gambar 6 menunjukkan ketiga ekstrak justru menambah konsentrasi logam Cu. Ekstrak air daun pare sebanyak 1% menambah konsentrasi logam Cu sebesar 21.42%, 1% ekstrak etanol daun pare menambah konsentrasi logam Cu sebesar 0.16%, dan 1% ekstrak metanol menaikkan konsentrasi logam Cu sebesar 21.42%.
Hasil ini memberi gambaran bahwa hanya ekstrak n-heksana daun pare yang mampu mengadsorpsi logam Cu, yaitu penjerapannya sebesar 5.18%. Peningkatan jumlah logam Cu pada pengujian penjerapan logam terhadap ekstrak air, ekstrak etanol, dan ekstrak metanol ini dapat terjadi karena dari hasil pengujian kandungan logam terhadap simplisia daun pare sebelumnya, simplisia daun pare yang digunakan sudah mengandung logam Cu sebesar 0.62 ppm atau 6.2 %. Hal ini yang mungkin menyebabkan terjadinya penambahan kandungan logam Cu saat pengujian penjerapan logam. Ekstrak daun pare yang seharusnya mengadsorpsi logam Cu tetapi karena simplisia sudah mengandung logam sehingga malah menambah konsentrasi logam Cu itu sendiri.
Uji Tegangan Permukaan (Daya Emulsifikasi)
Daya emulsifikasi dalam penelitian ini diukur melalui uji tegangan permukaan. Uji tegangan permukaan dilakukan untuk melihat potensi ekstrak dalam membantu menurunkan tegangan permukaan sehingga memperluas permukaan cairan. Dalam kehidupan sehari-hari menurunkan tegangan permukaan digunakan dalam membersihakan kotoran di
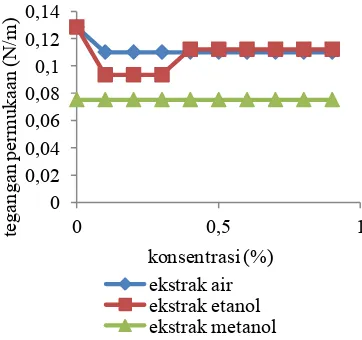
pakaian, karena dengan turunnya tegangan permukaan maka air/fluida/ekstrak dapat masuk lebih dalam dan membersihkan kotoran. Berikut adalah grafik yang menunjukkan tegangan permukaan ekstrak air, ekstrak etanol, dan ekstrak metanol. Ekstrak n-heksan tidak dilakukan pengujian karena ekstrak tersebut tidak dapat larut dalam air sehingga tidak dapat diukur besar tegangan permukaannya.
Gambar 7 menunjukkan bahwa ekstrak air adalah ekstrak yang paling stabil dalam menurunkan tegangan permukaan. Ekstrak etanol hanya mampu menurunkan tegangan permukaan sampai konsentrasi 0.2%. Pada pemekatan selanjutnya ekstrak ini justru menaikkan tegangan permukaan. Berbeda dengan ekstrak metanol yang memang sama sekali tidak dapat menurunkan tegangan permukaan saat dilakukan pengujian. Hasil ini memberi informasi bahwa ekstrak air adalah ekstrak yang paling efektif dalam menurunkan tegangan permukaan.
Informasi yang dapat diperoleh dari Gambar 7, memiliki kaitan dengan uji fitokimia yang telah dilakukan sebelumnya. Uji fitokimia pada Tabel 2 menunjukkan bahwa hanya ekstrak air dan etanol yang memberikan hasil positif terhadap uji saponin. Artinya, ekstrak air dan etanol daun pare mengandung senyawa saponin.
Menurut Adam (1995) menyatakan bahwa saponin memiliki molekul yang dapat menarik air atau hidrofilik dan molekul yang dapat melarutkan lemak atau lipofilik sehingga dapat menurunkan tegangan permukaan sel yang akhirnya menyebabkan kehancuran kuman. Saponin ini bekerja sebagai surfaktan, yang membuat air mudah masuk ke dalam pori-pori dan dapat mengikat kotoran dengan cara menurunkan tegangan permukaan.
Gambar 7 Hasil uji tegangan permukaan 0 0,02 0,04 0,06 0,08 0,1 0,12 0,14
0 0,5 1
12
Saponin memiliki sifat seperti sabun. Sabun termasuk salah satu jenis surfaktan yang terbuat dari minyak atau lemak alami. Surfaktan mempunyai struktur bipolar. Bagian kepala bersifat hidrofilik dan bagian ekor bersifat hidrofobik. Karena sifat inilah sabun mampu mengangkat kotoran (biasanya lemak). Selain itu, pada larutan, surfaktan akan menggerombol membentuk misel setelah melewati konsentrasi tertentu yang disebut Konsentrasi Kritik Misel (KKM) (Lehninger 1982). Saponin dalam ekstrak air dan etanol daun pare ini diharapkan mampu mengikat kotoran yang ada pada wajah dengan menurunkan tegangan permukaan sehingga mampu masuk ke pori-pori wajah dan membentuk misel untuk mengangkat kotoran-kotoran yang ada pada wajah.
Berdasarkan Tabel 2 juga menunjukkan bahwa ekstrak metanol dan ekstrak n-heksan daun pare tidak mengandung saponin. Hal ini terbukti dengan pengujian emulsifikasi ini, bahwa saat uji tegangan permukaan ekstrak metanol tidak dapat menurunkan tegangan permukaan dan ekstrak n-heksana bahkan tidak dapat diukur tegangan permukaannya.
Uji Aktivitas Antibakteri
Uji ini dilakukan untuk melihat kemampuan daya hambat bakteri ekstrak daun pare sebagai salah satu bahan aktif kosmetik pembersih wajah. Ekstrak daun pare sebagai bahan aktif kosmetik pembersih wajah diharapkan mampu menghambat pertumbuhan bakteri, terutama bakteri penyebab timbulnya jerawat akibat wajah yang terpapar oleh polusi, kotoran, dan pemakaian kosmetik yang salah.
Menurut Prihatman (2001), dilaporkan bahwa daun pare mengandung saponin dan memiliki aktivitas antibakteri. Dalam penelitian ini, bakteri yang digunakan adalah bakteri Staphylococcus epidermidis. Bakteri S. epidermidis ini merupakan salah satu bakteri paling banyak penyebab jerawat setelah bakteri Propionibacterium acnes (Anggraini 2010). Metode yang digunakan dalam penelitian ini adalah metode dilusi (pengenceran) menggunakan microplate. Metode dilusi diukur secara visual dengan melihat timbulnya kekeruhan yang menunjukkan daya hambat ekstrak terhadap bakteri uji. Alasan pemilihan metode ini adalah lebih menghemat sampel karena pengujian dilakukan dalam jumlah mikro dan dari segi pengerjaan lebih efisien karena menggunakan microplate (Gambar 8).
Gambar 8 Uji antibakteri. 1) ekstrak air, 2) ekstrak etanol, 3) ekstrak metanol, 4) ekstrak n-heksana, k(+) kontrol positif (DMSO 20%), k(-) kontrol negatif (kloramfenikol), A) konsentrasi 2000 ppm, B) konsentrasi 1000 ppm, C) konsentrasi 500 ppm, D) konsentrasi 250 ppm, E) konsentrasi 125 ppm, F) konsentrasi 62.5 ppm, G) konsentrasi 31.25 ppm, H) konsentrasi 15.63 ppm.
Hasil pengujian ini dilihat berdasarkan nilai KHM (Kadar Hambat Minimal) dan KBM (Kadar Bunuh Minimal). Nilai KHM menunjukkan konsentrasi minimal daya hambat ekstrak terhadap bakteri uji. Nilai KBM menunjukkan konsentrasi minimal daya bunuh ekstrak terhadap bakteri uji. Berdasarkan Tabel 4 dapat dilihat bahwa ekstrak air dan ekstrak etanol daun pare memiliki nilai KHM sebesar 62.5 ppm. Hal ini berarti pada konsentrasi 62.5 ppm ekstrak air dan etanol daun pare mampu menghambat pertumbuhan bakteri S.epidermidis. Ekstrak metanol dan ekstrak n-heksana daun pare memiliki nilai KHM sebesar 250 ppm. Artinya, ekstrak metanol dan n-heksana daun pare mampu menghambat pertumbuhan bakteri S.epidermidis pada konsentrasi 250 ppm.
Nilai KBM juga dapat dilihat pada Tabel 4. Ekstrak etanol dan metanol daun pare memiliki nilai KBM sebesar 2000 ppm. Nilai ini menunjukkan ekstrak etanol dan metanol daun pare mampu membunuh bakteri S.epidermidis pada konsentrasi tertinggi yang dilakukan, yaitu 2000 ppm. Hasil tersebut memberi informasi bahwa ekstrak etanol adalah ekstrak terbaik sebagai antibakteri. Pada konsentrasi 62.5 ppm saja ekstrak etanol daun pare telah mampu menghambat pertumbuhan bakteri S.epidermidis dan mampu membunuh pada konsentrasi 2000 ppm.
Tabel 4 Uji aktvitas antibakteri ekstrak pare terhadap bakteri S.epidermidis
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil pengujian yang telah dilakukan terhadap ekstrak daun pare dengan menggunakan empat pelarut, yaitu air, etanol, metanol, dan n-heksan, memberi informasi bahwa ekstrak etanol daun pare memiliki kemampuan terbaik dalam megadsorpsi logam Pb dan Hg, namun hanya ekstrak n-heksana daun pare yang mampu mengadsorpsi logam Cu. Uji emulsifikasi menunjukkan ekstrak air daun pare paling efektif untuk menurunkan tegangan permukaan, dan untuk uji antibakteri ekstrak etanol daun pare paling efektif menghambat pertumbuhan bakteri S. epidermidis.
Saran
Perlu dilakukan uji aktivitas antibakteri ekstrak daun pare dengan menggunakan bakteri Propionibacterium acne karena bakteri ini adalah bakteri spesifik penyebab jerawat. Untuk penelitian selanjutnya perlu diambil sampel daun pare yang tidak mengandung logam berat. Ekstrak etanol berpotensi untuk dikembangkan lebih lanjut.
DAFTAR PUSTAKA
Adam S. 1995. Dasar-Dasar Mikrobiologi dan Mikrobiologi untuk Perawat. Jakarta : Kedokteran EGC.
Adi LT, Sugiarto A, Astutiningsih, editor. 2008. Tanaman Obat dan Jus untuk Mengatasi Penyakit Jantung, Hipertensi, Kolesterol, dan Stroke. Jakarta: Agromedia Pustaka.
Anggraini TA. 2010. Uji aktivitas antibakteri senyawa alfa mangostin hasil isolasi kulit buah manggis (Garcinia mangostana L) terhadap Staphylococcus epidermidis [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah.
AOAC.1984. Official Methods of Analysis. Virginia: Association of Official Analytical Chemistry.
Atkins PW. 1997. Kimia Fisika Jilid 2. Jakarta: Erlangga.
Bassett J, Denney RC, Jeffery GH, Mendham J. 1994. Buku Ajar Vogel Kimia Analisis Kuantitatif Anorganik. Pudjaatmaka AH, Setiono L, penerjemah. Jakarta: Buku Kedokteran EGC. Terjemahan dari: Vogel’s Textbook of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis.
Batubara I, Mitsunaga T, Ohasi H. 2009. Screening antiacne potency of Indonesian medical plants : antibacterial, lipase inhibition, and antioxidant activities. J Wood Sci 55:230-235.
[BPOM RI] Badan Pengawas Obat dan Makanan Republik Indonesia. 2004. Ekstrak Tumbuhan Indonesia Vol. 2. Jakarta: BPOM RI.
[BPOM RI]. 2009. Public Warning/ Peringatan.
http://www.laurent.co.id/doc/Binder1.p df [19Januari 2012].
Damin S. 2006. Pengantar Kimia Kedokteran. Jakarta : Penerbit Buku Kedokteran EGC.
Daniel SW. 2005. Anatomi Tubuh Manusia. Jakarta : Grasindo.
Darmono. 2001. Lingkungan Hidup dan Pencemaran, Hubungaannya dengan Senyawa Logam. Jakarta : UI Press.
Dwidjoseputro. 1990. Dasar-Dasar Mikrobiologi. Jakarta: Djambatan.
Fardiaz. 1995. Polusi Air dan Udara. Yogyakarta : Kanisius.
Nilai penghambatan Ekstrak
Air Etanol Metanol n-Heksan KHM (Konsentrasi Hambat
Minimum) (ppm) 62.5 62.5 250 250
KBM (Konsentrasi Bunuh Minimum)
14
Fradiaz F. 1987. Mikrobiologi Pangan Jilid I. Bogor : PAU.
Ginting. 2006. Penambahan Bahan Pengikat pada Nugget Itik Serati. Jurnal Agribisnis Peternakan 20 (1) : 6-10.
Gunandjar. 1985. Kuliah Spektrofotometri Serapan Atom. Yogyakarta : Batan.
Harborne JB. 1996. Meotde Fitokimia : Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Sudiro I, penerjemah. Bandung : ITB. Terjemahan dari : Phytochemical Method.
Hermawan A, Hana W, Wiwiek T. 2007. Pengaruh ekstrak daun sirih (Piper betle L.) terhadap pertumbuhan Staphylococcus aureus dan Escherichia coli dengan metode difusi disk [artikel ilmiah]. Universitas Erlangga.
James PO, Hilary H. 2001. Staphylococcus epidermidis biofilms : importance and implications. J Med Microbiol 50 : 582-587.
Kusumaningjati. 2009. Potensi antibakteri kitosan sebagai pengawet tahu [skripsi]. Bogor : Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Kuswoyo NP. 2009. Formulasi tablet hisap ekstrak daun pare (Momordica charantia L) secara granulasi basah dengan variasi konsentrasi PVP sebagai bahan pengikat [skripsi]. Surakarta: Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Lachman. 1994. Teori dan Praktek Ilmu Farmasi Industri Edisi III. Depok : UI Press.
Lehninger AL. 1982. Dasar-Dasar Biokimia Jilid II. Maggy Thenawidjaja, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
Meilita TS, Tuti SS. 2010. Arang aktif (pengenalan dan proses pembuatannya). [makalah ilmiah]. Sumatera Utara : Fakultas Teknik, Universitas Sumatera Utara.
Noor AK. 2008. Tinjauan keseimbangan adsorpsi tembaga dalam limbah pencuci PCB dengan zeolit [artikel
ilmiah]. Yogyakarta : Seminar Nasional IV SDM teknologi Nuklir.
Nunun PK. 2009. Formulasi tablet hisap ekstrak daun pare (Momorcica charantia L) [skripsi]. Surakarta : Fakultas Farmasi, Universitas Muhammadiyah Surakarta.
Pratiwi I. 2009. Uji antibakteri ekstrak kasar daun Acalypha indica terhadap bakteri Salmonella choleraesuis dan Salmonella typhimurium [skripsi]. Surakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Surakarta.
Prihatman K. 2001. Saponin untuk pembasmi hama udang. [artikel ilmiah]. Bandung: Pusat Penelitian Perkebunan Gambung.
Retno IT, Fatma L. 2007. Buku Pegangan Ilmu Pengetahuan Kosmetik. Jakarta: Gramedia Pustaka Utama.
Robby C. 2009. Uji toksisitas akut ekstrak etanol buah pare (Momordica charantia) terhadap Artemia salina Leach dengan metode Brine Shrimp Lethality Test (BSLT) [skripsi]. Semarang : Fakultas Kedokteran, Universitas Diponegoro.
Ryan H. 2008. Pembuatan arang aktif dan penggunaannya [skripsi]. Jakarta: Fakultas Teknik, Universitas Indonesia.
Saeni MS. 1997. Penentuan tingkat pencemaran logam berat dengan analisis rambut [artikel ilmiah]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Santoso W. 1996. Usaha Tani : Tanaman Pare. Jakarta : Isntalasi Penelitian dan Pengkajian Teknologi Pertanian.
Schunack. 1990. Senyawa Obat, Buku Pelajaran Kimia Farmasi. Edisi kedua. Joke R. Wattimena dan Sriwoelan Soebito [penerjemah]. Yogyakarta : GMU-Press.
Subahar TSS. 2004. Khasiat dan Manfaat Pare Si Pahit Pembasmi Penyakit. Jakarta: Agromedia Pustaka.
Sumardjo D, Hanif A, Manurung J, Simanjuntak J, editor. 2008. Pengantar Kimia: Buku Panduan Kuliah Mahasiswa Kedokteran dan Program Strata1 Fakultas Bioeksata. Jakarta: Buku Kedokteran EGC.
Todar K. 2007. The Control of Microbial Growth. Winconsin: University of Winconsin.
Tranggono RI, Latifah F, Djajadisastra J, editor. 2007. Buku Pegangan Ilmu Pengetahuan Kosmetik. Jakarta: Gramedia Pustaka Utama.
Vega D. 2011. Efektivitas madu dan sari buah mengkudu (Morinda citrifolia) sebagai antibakteri terhadap Eschericia coli pada karkas ayam [artikel ilmiah]. Surabaya : Fakultas Kedokteran Hewan, Universitas Airlangga.
16
Lampiran 1 Diagram alir penelitian
Pembuatan simplisia daun pare
Penentuan kadar
air simplisia dan
daun pare
Uji logam simplisia
dengan AAS
Ekstraksi simplisia daun pare
dengan pelarut akuades,
etanol, metanol, dan heksana
Penentuan aktivitas
antibakteri ekstrak air,
etanol, metanol, dan
heksana
Uji daya adsorpsi
Uji tegangan
18
Lampiran 2 Hasil pengukuran kadar air
Sampel Ulangan Kadar air Rerata
Air
1 2 3
65.36 % 64.90 % 64.04 %
64.77 %
Simplisia
1 2 3
11.76 % 11 % 6.47 %
9.74 %
Lampiran 3 Hasil pengukuran uji tegangan permukaan
Konsentrasi Ekstrak Simpangan (mm)
Ekstrak air Ekstrak etanol Ekstrak metanol Blanko 0.7 0.6 0.4
0.1 % 0.6 0.5 0.4
0.2 % 0.6 0.5 0.4
0.3 % 0.6 0.5 0.4
0.4 % 0.6 0.6 0.4
0.5 % 0.6 0.6 0.4
0.6 % 0.6 0.6 0.4
0.7 % 0.6 0.6 0.4
0.8 % 0.6 0.6 0.4
0.9 % 0.6 0.6 0.4
1 % 0.6 0.6 0.4
Konsentrasi Ekstrak Tegangan permukaan (
)
Ekstrak air Ekstrak etanol Ekstrak metanol Blanko 0.1285 0.1285 0.0753
0.1 % 0.1101 0.0935 0.0753 0.2 % 0.1101 0.0935 0.0753 0.3 % 0.1101 0.0935 0.0753 0.4 % 0.1101 0.1122 0.0753 0.5 % 0.1101 0.1122 0.0753 0.6 % 0.1101 0.1122 0.0753 0.7 % 0.1101 0.1122 0.0753 0.8 % 0.1101 0.1122 0.0753 0.9 % 0.1101 0.1122 0.0753 1 % 0.1101 0.1122 0.0753
Contoh perhitungan :
Blanko : simpangan = 1.7 -1 = 0.7 mm setara dengan 0.7 gram
m = 0.7 gram = 7 x 10
-4kg
F = m x g
= 7 x 10
-4kg x 9.8
= 6.86 x 10
-3kg
= 6.86 x 10
-3N
panjang kaca = 2.56 cm = 2.56 x 10
-2m
tebal kaca = 1.1 mm = 1.1 x 10
-3m
γ
blanko =
=
=
Lampiran 4 Hasil pengujian penjerapan logam Hg
[logam] (ppm) Absorbansi 3.0000 0.1564 10.0000 0.3094 25.0000 0.9387 40.0000 0.6320
Keterangan : A = perlakuan 1 [setelah penambahan arang aktif]
B = perlakuan 2 [setelah penambahan ekstrak air]
C = perlakuan 3 [setelah penambahan ekstrak etanol]
D = perlakuan 4 [setelah penambahan ekstrak metanol]
E = perlakuan 5 [setelah penambahan ekstrak n-heksan]
Contoh perhitungan :
Rerata =
=
= 5436.0046 ppm
% Serapan A =
x 100
=
= 27.2112 %
y = 0,0212x + 0,0966 R² = 0,9998
0 0,2 0,4 0,6 0,8 1
0 10 20 30 40 50
ab
so
rb
an
si
konsentrasi (ppm)
0 5 10 15 20 25 30 35
arang aktif ekstrak air ekstrak etanol ekstral metanol
ekstrak n-heksana
s
er
apa
n
l
o
ga
m
(%)
perlakuan terhadap logam Hg Ulangan [logam Hg
20
Lampiran 5 Hasil pengujian penjerapan logam Pb
[logam] (ppm) Absorbansi 1.0000 0.0468 2.0000 0.0850 3.0000 0.1211 4.0000 0.1571 6.0000 0.2471
Ulangan [logam Pb
awal] ppm A (ppm) B (ppm) C (ppm) D (ppm) E (ppm) 1 1574.5946 920.5955 991.0262 816.2072 962.0993 1162.0721 2 1572.0793 861.4841 948.2647 793.5688 1028.7569 1206.0913 3 1486.5563 947.0070 929.3994 763.3842 1032.5300 1135.6606 Rerata 1544.4101 909.6955 956.2301 791.0534 1007.7954 1167.9413 STDEV 50.1186 43.7909 31.5761 26.5012 39.6189 35.5803 % serapan - 41.0975 38.0844 48.7796 34.7456 24.3762
Keterangan : A = perlakuan 1 [setelah penambahan arang aktif]
B = perlakuan 2 [setelah penambahan ekstrak air]
C = perlakuan 3 [setelah penambahan ekstrak etanol]
D = perlakuan 4 [setelah penambahan ekstrak metanol]
E = perlakuan 5 [setelah penambahan ekstrak n-heksan]
Contoh perhitungan :
Rerata =
=
=
1544.4101 ppm% Serapan A =
x 100
=
= 41.0975 % y = 0,0398x + 0,0042
R² = 0,9969
0 0,05 0,1 0,15 0,2 0,25 0,3
0 2 4 6 8
ab
so
rb
an
si
konsentrasi (ppm)
0 10 20 30 40 50 60
arang aktif ekstrak air ekstrak etanol ekstral metanol
e