PEMURNIAN DAN KARAKTERISASI PROTEIN
INSEKTISIDAL DARI BAKTERI ENTOMOPATOGEN
Serratia marcescens
PUTRI JUMIARTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
PUTRI JUMIARTI. Pemurnian dan Karakterisasi Protein Insektisidal dari Bakteri
Entomopatogen
Serratia marcescens
. Dibimbing oleh I MADE ARTIKA dan TRI
PUJI PRIYATNO.
Pengendalian serangga hama merupakan masalah utama yang dihadapi
olah para petani Indonesia, namun belum ada solusi tepat dalam penanganannya.
Penggunaan insektisida berbahan aktif kimia yang selama ini dilakukan
menimbulkan dampak negatif seperti resistensi, resurgensi, dan fenomena biotipe
pada hama. Selain itu juga timbul dampak negatif terhadap lingkungan serta
terhadap organisme bukan sasaran. Pemanfaatan protein insektisidal dari bakteri
entomopatogen
Serratia marcescens
berpotensi dalam menekan pertumbuhan
serangga hama. Penelitian ini bertujuan melakukan pemurnian protein insektisidal
dari
S. marcescens
dan mengetahui tingkat toksisitasnya terhadap larva serangga
hama
Tenebrio molitor.
Protein insektisidal dimurnikan dengan metode presipitasi
dengan ammonium sulfat, dialisis, dan kromatografi penukar ion. Selain itu juga
dilakukan uji toksisitas terhadap larva serangga
T. molitor
instar II-III serta
penentuan nilai LC
50. Protein yang telah dimurnikan kemudian dianalisis bobot
molekulnya. Hasil menunjukkan adanya pita protein yang berukuran 30.42 KDa
sampai dengan 95.29 KDa. Berdasarkan hasil penelitian, protein insektisidal
S.
marcescens
merupakan protein toksin yang bersifat oral dengan nilai LC
50terendah yang ditunjukkan oleh protein insektisidal fraksi B, yaitu pada
konsentrasi 4.82 µg/ml.
Kata kunci: bakteri entomopatogen, protein insektisidal,
Serratia marcescens
, dan
ABSTRACT
PUTRI JUMIARTI. Purification and Characterization of Insecticidal Protein
Isolated from Entomopathogenous Bacteria
Serratia marcescens
. Under the
direction of I MADE ARTIKA and TRI PUJI PRIYATNO.
Insect pest control has been a major problem faced by farmers in Indonesia,
and there has been no perfect solution to handle it. The use of insecticides derived
from chemically active compound has made a negative impact such as the
emergence of resistant pest, pest resurgence, and phenomenon of biotype. In
addition, it has other negative impacts on the environment and on non-target
organisms. Use of insecticidal proteins from the bacterium
Serratia marcescens
entomopathogenic is one potential solution in suppressing the growth of insect
pests. This study aims to isolate and purify the insecticidal protein from
S.
marcescens
and determine the level of toxicity against
Tenebrio molitor
larvae of
insect pests. After the isolation, the insecticidal protein was purified by the
method of precipitation with ammonium sulphate, dialysis, and ion exchange
chromatography. It was also subjected to toxicity test using insect larvae
T.
molitor
instar II-III as well as determination of LC
50values. The purified protein
was subjected to molecular weight analysis. Results showed that the protein bands
were 30.42 to 95.29 kDa. Based on the results of the study, the insecticidal protein
S. marcescens
is a protein toxin that is active orally with the lowest LC
50value
indicated by the insecticidal protein fraction B, which is at a concentration of 4.82
ug / ml.
PEMURNIAN DAN KARAKTERISASI PROTEIN
INSEKTISIDAL DARI BAKTERI ENTOMOPATOGEN
Serratia marcescens
PUTRI JUMIARTI
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pemurnian dan Karakterisasi Protein Insektisidal dari Bakteri
Entomopatogen
Serratia marcescens
Nama
: Putri Jumiarti
NIM
: G84080011
Disetujui
Komisi Pembimbing
Dr. Ir. I Made Artika, MApp. Sc.
Ketua
Dr. Tri Puji Priyatno
Anggota
Diketahui,
Ketua Departemen Biokimia
Dr. Ir. I Made Artika, M.App.Sc
NIP : 19630117 198903 1 000
PRAKATA
Puji syukur penulis persembahkan kepada Allah SWT atas segala berkah
dan rahmat-Nya sehingga penulis dapat menyelesaikan penelitian dan karya
ilmiah yang berjudul ” Pemurnian dan Karakterisasi Protein Insektisidal dari
Bakteri Entomopatogen
Serratia marcescens
”. Penelitian ini bertujuan
memurnikan protein insektisidal dari
S. marcescens
dan mengetahui tingkat
toksisitasnya terhadap larva serangga hama
Tenebrio molitor
. Penelitian ini
dilaksanakan mulai bulan Februari 2012 di Laboratorium Kimia dan Biokimia,
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya
Genetik Pertanian (BB-Biogen). Melalui penelitian ini diharapkan dapat
dihasilkan protein insektisidal yang potensial untuk dikembangkan sebagai
biopestisida untuk pengendalian hama tanaman.
Penulis mengucapkan terima kasih kepada pembimbing utama Dr. Ir. I Made
Artika, MApp. Sc. serta pembimbing kedua Dr. Tri Puji Priyatno yang telah
memberikan bimbingan, pengarahan, saran, serta waktunya selama penelitian dan
penulisan karya ilmiah ini. Ungkapan terima kasih yang tak terhingga penulis
ucapkan kepada orang tua tercinta dan keluarga atas doa, dukungan, dan kasih
sayang yang telah diberikan. Penulis juga ingin menyampaikan ungkapan terima
kasih kepada Ibu Ifa Mandzila, Mbak Pipiet, yang telah banyak membantu dalam
penelitian ini, Arena YP, Cinthya LHD, Daniel RSN, M Faris Fathin,
teman-teman Wisma Jelita, serta teman-teman-teman-teman Biokimia 45 yang telah banyak
memberikan dukungan. Penulis menyadari masih banyak terdapat kekurangan
dalam penyusunan karya ilmiah ini. Oleh karena itu, penulis mengharapkan kritik
dan saran yang membangun untuk perbaikan dalam penulisan selanjutnya.
Semoga penelitian ini dapat bermanfaat baik bagi penulis maupun pembaca.
.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 4 Maret 1990 dari ayah Joko
Sumanto dan ibu Sumarni Parmi. Penulis merupakan anak pertama dari dua
bersaudara. Pendidikan penulis dimulai dari TK Pewa Natar, SD Al-Kautsar
Bandar Lampung, kemudian melanjutkan ke SLTP Al-Kautsar Bandar Lampung.
Tahun 2008 penulis lulus dari SMA Al-Kautsar Bandar Lampung dan pada tahun
yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis memilih program studi mayor Biokimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif dalam organisasi Himpunan
Profesi Mahasiswa Biokimia
Community Research and Education of Biochemistry
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
PENDAHULUAN
TINJAUAN PUSTAKA
Bakteri Entomopatogen ... 2
Serratia marcescens ... 2
Protein Toksin
(Insecticidal Toxin)
... 3
Pemurnian dan Karakterisasi Protein Insektisidal ... 4
Tenebrio molitor
... 5
BAHAN DAN METODE
Bahan dan Alat ... 5
Metode Penelitian ... 6
HASIL DAN PEMBAHASAN
Biakan Bakteri
Serratia marcescens
... 8
Isolasi protein Insektisidal ... 8
Hasil Presipitasi Protein Menggunakan Amonium Sulfat ... 8
Hasil Dialisis Protein Presipitat Amonium Sulfat ... 9
Hasil Pemurnian Protein Insektisidal Menggunakan Kromatografi Kolom
Penukar Ion ... 9
Profil protein Insektisidal pada Natif Gel ... 9
Profil Protein Insektisidal pada Elektroforegram SDS PAGE ... 10
Toksisitas Protein
Serratia marcescens
... 11
Penentuan LC50 ... 13
SIMPULAN DAN SARAN
Simpulan ... 13
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR TABEL
1 Data mortalitas protein insektisidal terhadap larva
T. molitor
... 12
DAFTAR GAMBAR
Halaman
1 Sel Bakteri Entomopatogen
Serratia marcescens
... 3
2 Ilustrasi Metode kromatografi ... 5
3 Larva
Tenebrio molitor
... 5
4 Kromatogram Protein Hasil Kromatografi Penukar Ion ... 9
5 Hasil Natif PAGE Protein Insektisidal . ... 10
6 Hasil SDS PAGE Protein Insektisidal ... 11
7 Hasil SDS PAGE Protein Insektisidal dan Ukuran Pita ... 11
8 Gejala Toksisitas pada
Larva Tenebrio molitor
... 12
DAFTAR LAMPIRAN
Halaman
1 Alur metode penelitian ... 18
2 Bagan uji toksisitas protein
Serratia marcescens
terhadap larva
Tenebrio
molitor
. ... 19
3 Kurva pertumbuhan
Serratia marcescens
... 20
4 Data pengukuran konsentrasi protein hasil kromatografi penukar ion ... 20
5 Kurva standar protein ... 21
6 Hasil penentuan konsentrasi protein dengan uji Bradford dan contoh
perhitungan ... 21
7 Presentase mortalitas larva terhadap protein nondialisis ... 22
8 Presentase mortalitas larva terhadap protein dialisis. ... 22
9 Presentase mortalitas larva terhadap protein fraksi A ... 23
10 Presentase mortalitas larva terhadap protein Fraksi B ... 23
11 Tabel transformasi persentase mortalitas ke nilai probit ... 23
12 Hasil analisis probit protein insektisidal Nondialisis ... 23
13 Hasil analisis probit protein insektisidal Dialisis ... 24
14 Hasil analisis probit protein insektisidal Fraksi A ... 24
15 Hasil analisis probit protein insektisidal Fraksi B... 24
1
PENDAHULUAN
Masalah hama sudah menjadi rutinitas yang dihadapi oleh petani dalam budidaya tanaman. Berbagai teknologi pengendalian hama telah diaplikasikan tetapi persoalan hama belum juga terselesaikan. Pengendalian hama menggunakan insektisida berbahan kimia, meskipun efektif tetapi juga memiliki dampak negatif seperti timbulnya resistensi, resurgensi, dan dampak negatif lainnya terhadap lingkungan serta terhadap organisme bukan sasaran (Arifin 2011). Munculnya fenomena biotipe, yaitu berkembangnya strain serangga baru yang mampu beradaptasi secara fisiologis ataupun genetis terhadap tanaman yang tahan, juga merupakan salah satu persoalan pengendalian serangga hama (Clarige & Hollander 1983).
Program pengendalian hama terpadu merupakan strategi pengendalian yang dianggap paling tepat dan efektif dalam menekan pertumbuhan serangga hama (Priyatno et al 2011). Strategi ini memerlukan beberapa komponen pengendalian yang kompatibel dan dapat diaplikasikan secara terpadu, disamping kemampuan petani dalam mengaplikasikannya. Selain itu komponen pengendalian yang digunakan dalam program pengendalian hama terpadu (PHT) juga harus selalu dikembangkan untuk meningkatkan efektivitasnya serta kemudahan dalam pengaplikasiannya oleh petani.
Dalam program PHT, agensia pengendalian hayati, seperti Metarhizium
anisopliae, Beauveria bassiana, dan Bacillus
thuringiensis menjadi komponen utama
pengendalian (Iman & Priyatno 2001). Pemanfaatan agensia hayati mempunyai beberapa kelebihan terutama selektivitasnya, meski harus diakui tidak seefektif insektisida berbahan aktif kimia. Agensia hayati yang sudah sangat umum digunakan untuk pengendalian hama serangga salah satunya adalah B. thuringiensis (Bt). Bakteri ini menghasilkan protein insektisidal delta-endotoksin yang sudah dikembangkan menjadi insektisida dan gen penyandi protein insektisidalnya dimanfaatkan dalam pengembangan tanaman transgenik (Iman & Priyatno 2001). Bakteri lain yang menghasilkan protein insektisidal di antaranya adalah Photorhabdus luminescens, Xenorhabdus nematophilus, Serratia
entomophila and Serratia proteamaculans
(Binglin et al 2006).
Bakteri entomopatogen dari genus
Serratia, kecuali S. entomophila dan S.
proteamaculans, dikenal sebagai patogen
oportunistik atau fakultatif. Hasil penelitian sebelumnya menunjukkan adanya tingkat kematian wereng batang coklat yang tinggi akibat terinfeksi bakteri merah. Tingkat kematian wereng batang cokelat menjadi tinggi ketika serangga terinfeksi dalam keadaan mengalami tekanan kuat akibat suhu lingkungan tinggi, kualitas pakan rendah, populasi berlimpah, luka, atau faktor-faktor lainnya (Mohan et al. 2011).
Bakteri merah yang diisolasi dari wereng batang cokelat yang mati (isolat SM201102) telah diidentifikasi dengan cara perbandingan sekuen 16S rRNA isolat bakteri merah dengan sekuen 16S rDNA bakteri lain yang terdapat dalam database GeneBank, melalui analisis Blastn menunjukkan bahwa bakteri merah mempunyai tingkat kesamaan 99% dengan
Serratia sp. endosimbion WBC (No. aksesi
GU124498) dan S. marcescens (No. aksesi HQ154570), serta 98% dengan S. entomophila
(Priyatno et al 2011).
Faktor virulensi S. entomophila dan S.
proteamaculans terletak dalam plasmid
pADAP (amber disease-associated plasmid) yang berukuran 153 kb. Hurst et al (2000) telah mengidentifikasi tiga gen toksin dalam pADAP, yaitu sepABC (untuk patogenisitas dari S. entomophila). Protein dari sepABC
mempunyai kesamaan sekuen asam aminonya dengan toksin insektisidal yang dihasilkan oleh Photorhabdus luminescens (Bowen et al. 1998) dan Xenorhabdus nematophilus
(Morgan et al. 2001), yang dikenal dengan nama komplek toksin (TC). Namun pada kedua bakteri tersebut, gen penyandi Tc ini berada dalam DNA genomnya. Kompleks toksin memiliki berat molekul tinggi (≈1 MDa) dan menunjukkan aktvitas insektisidal terhadap serangga dari ordo Coleoptera, Dictyoptera, Hymenoptera, dan Lepidoptera (Bowen et al. 1998). Komplek toksin (TC) ini memiliki potensi untuk menjadi salah satu kandidat pengganti toksin B. thuringiensis
(Bt) dalam pengembangan tanaman transgenik tahan hama serangga.
Serratia marcescens diduga memiliki
gen-gen yang menyandikan komplek toksin yang berpotensi sebagai salah satu penghasil protein insektisidal. Oleh karena itu perlu dilakukan pemurnian serta karakterisasi protein insektisidal dari S. marcescens. Sementara itu, faktor-faktor virulensi S.
marcescens terhadap manusia akan
2
ada laporan yang menyatakan bahwa komplek toksin insektisidal menjadi salah satu faktor virulensi S. marcescens terhadap manusia.
Tujuan dari penelitian ini adalah memurnikan protein insektisidal dari S.
marcescens dan mengetahui tingkat
toksisitasnya terhadap larva serangga hama
Tenebrio molitor. Hipotesis dari penelitian ini
adalah protein insektisidal yang dimurnikan dari bakteri entomopatogen S. marcescens
toksisitasnya bersifat oral dan dapat dimanfaatkan sebagai biopestisida.
TINJAUAN PUSTAKA
Bakteri Entomopatogen
Pengendalian hama serangga menggunakan musuh alaminya merupakan hal yang banyak dianjurkan oleh pakar perlindungan tanaman saat ini dibandingkan pengendalian dengan insektisida berbahan aktif kimia. Musuh alami berupa entomopatogen terdiri dari jamur, bakteri, protozoa, dan virus, dapat menghasilkan suatu metabolit yang bersifat toksin terhadap serangga hama. Keunggulan entomopatogen adalah kekhususan atau selektivitas inangnya relatif tinggi, sehingga tidak menimbulkan polusi dan kontaminasi pada lingkungan hidup. Hal ini sangat selaras dengan tujuan program pengendalian hama terpadu (PHT) yang memperketat penggunaan insektisida kimia ataupun program pertanian organik (Iman & Priyatno 2001). Entomopatogen potensial yang banyak dimanfaatkan dan tersedia produk komersialnya adalah Bacillus
thuringiensis atau Bt, Nuclear Polyhedrosis
Virus (NPV), serta jamur entomopatogen
misalnya Metarizhium anisopliae dan
Beauveria bassiana.
Salah satu entomopatogen yang potensial adalah bakteri. Bakteri entomopatogen merupakan parasit atau bakteri patogen dari serangga hama yang menghasilkan protein toksin yang dapat mengendalikan populasi serangga hama. (Akhdiya et al 2007). Bakteri entomopatogen merupakan bakteri yang menjadi musuh alami atau bakteri pengganggu bagi serangga. Bakteri akan tumbuh pada tubuh serangga yang mati, ketika berada pada fase stasioner bakteri akan melepaskan berbagai macam faktor virulensi seperti kompleks protein toksin (Toxin complex) dengan bobot molekul tinggi, lipopolisakarida (LPS), lipase, protease, dan berbagai macam antibodi (Forst & Nealson 1996).
Bakteri entomopatogen yang sampai sekarang banyak dimanfaatkan adalah
Bacillus thuringiensis. Salah satu keunggulan
B. thuringiensis sebagai agen hayati adalah
kemampuan menginfeksi serangga hama yang spesifik misalnya untuk mengendalikan serangga hama dari golongan ordo Lepidoptera, namun diketahui juga mampu menginfeksi ordo yang lain seperti ordo Diptera dan Coleoptera. Cara kerja bakteri B.
thuringiensis adalah kristal bakteri yang
berupa matriks protein di dalam saluran makanan tengah (mesonteron) tubuh serangga yang rentan akan mengalami hidrolisis. Hasil hidrolisis ini menghasilkan fraksi-fraksi yang lebih kecil yang menimbulkan efek toksik tehadap dinding saluran makanan. Kerusakan dinding saluran makanan mengakibatkan serangga sakit dan dapat menyebabkan kematian serangga.
Contoh lain bakteri entomopatogen lain yang telah berhasil dikembangkan sebagai biopestisida adalah bakteri entomopatogen
non-sporing forming dari genus Serratia,
yaitu S. entomophila dan S. proteamaculans. Kedua bakteri entomopatogen tersebut telah dimanfaatkan sebagai biopestisida yang efektif untuk mengendalikan grass grub
(Costelytra zealandica) di New Zealand
(Priyatno et al 2011).
Serratia marcescens
Serratia marcescens merupakan bakteri
Gram negatif dari keluarga Enterobacteriaceae. Bakteri ini telah lama dikenal dalam dunia penelitian, terutama pada bidang kesehatan karena pernah menjadi penyebab terjadinya infeksi pencernaan pada manusia. Bakteri merah ini dikenal juga dengan nama Chromobacterium prodigiosum, karena memiliki kemampuan menghasilkan pigmen merah yang disebut prodigiosin. Habitat S. marcescens berada di air, tanah, permukaan daun, dalam tubuh serangga, hewan, dan manusia (Khanafari et al. 2006). Bakteri ini dapat tumbuh dalam keadaan anaerob. Berdasarkan penelitian yang pernah dilakukan, S. marcescens mengalami pertumbuhan yang tinggi pada keadaan anaerob. Bakteri ini memiliki kemampuan hidup pada keadaan ekstrim misalnya pada lingkungan yang terpapar antiseptik, desinfektan, dan pada air destilasi (Mame & Costerton 1998).
3
karena memiliki flagela peritrik. Bakteri S.
marcescens dapat tumbuh dalam kisaran suhu
5oC sampai dengan 40oC dan dalam kisaran pH antara 5 hingga 9. Serratia marcescens
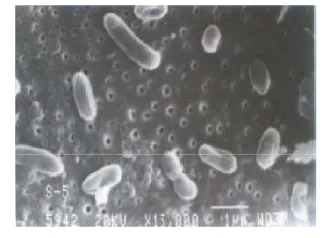
dapat digambarkan secara detil karena merupakan spesies yang sudah umum ditemukan dalam spesimen ilmu pengobatan. Sel bakteri S. marcescens ditunjukkan pada Gambar 1. Salah satu karakteristik dari bakteri ini dapat menghasilkan pigmen merah yang disebut prodigiosin. Warna prodigiosin yang dihasilkan bergantung pada umur biakan, mulai dari warna merah muda hingga merah tua. Berdasarkan penelitian, pigmen biologis yang dihasilkan oleh bakteri ini ternyata memiliki aktivitas antifungal, imunosupresi, dan antiproliferasi (Lauzon et al 2003).
Serratia marcescens merupakan bakteri
yang patogen terhadap serangga karena dapat menghasilkan beberapa enzim hidrolitik seperti protease, kitinase, nuclease, dan lipase yang bersifat toksin (Flyg et al 1983). Bakteri ini juga dapat menghasilkan serrawetin, senyawa surfaktan yang membantu dalam proses kolonisasi (Hejazi &Falkiner 1997).
Berdasarkan penelitian yang telah dilakukan oleh Flyg pada tahun 1983 di Universitas Stockholm, strain S. marcescens
yang diisolasi dari serangga sering kali memproduksi protease dibandingkan tipe liarnya. Protease ekstraseluler dari S.
marcescens yang telah dimurnikan bersifat
toksik pada serangga. Penelitian mengenai efek virulensi strain Serratia terhadap larva
Costelytra zealandica (ulat rumput New
Zealand) juga membuktikan bahwa strain
Serratia memiliki efek toksik yang tinggi
terhadap serangga hama ketika protein toksiknya diinjeksikan ke tubuh serangga (Biglin et al 2006).
Marga Serratia terdiri atas bakteri patogen serangga (Binglin et al 2006). Entomopatogen dari marga Serratia, kecuali Serratia
entomophila dan Serratia proteamaculans,
dikenal sebagai patogen oportunistik atau fakultatif karena tidak virulen ketika berada dalam saluran pencernaan, tetapi menjadi sangat virulen ketika masuk ke dalam haemolim akibat serangga terluka atau dalam keadaan stres (Mohan et al. 2011). Entomopatogen Serratia entomophila dan
Serratia proteamaculans merupakan strain
Serratia yang telah diketahui secara pasti
merupakan bakteri entomopatogen yang virulensinya tinggi terhadap serangga hama. Kedua strain Serratia ini menghasilkan kompleks toksin yang mekanisme toksinnya mirip dengan kompleks toksin yang dihasilkan
oleh Photorhabdus luminescens dan
Xenorhabdus nematophila.
Gambar 1 Sel bakteri entomopatogen Serratia
marcescens (Singh et al 2008)
Protein Toksin (Insecticidal Toxin)
Protein toksin yang memiliki efek insektisidal dapat diisolasi dari bakteri entomopatogen. Protein toksin kompleks dengan berat molekul tinggi mempunyai spektrum toksin yang luas terhadap berbagai kelas serangga (Bowen and Ensign 1998).
Terdapat dua bentuk toksin bakteri. Jenis yang pertama adalah endotoksin. Endotoksin merupakan komponen lipopolisakarida (LPS) membran luar bakteri Gram negatif berikatan dengan dinding sel bakteri sehingga bentuk protein toksin ini tidak disekresikan ke lingkungan ekstraseluler. Jenis protein toksin yang kedua adalah eksotoksin. Eksotoksin merupakan protein toksin yang disekresikan oleh bakteri Gram negatif ataupun bakteri Gram positif. Protein toksin pada umumnya merupakan bentuk eksotoksin yang dapat dilepaskan atau disekresikan ke lingkungan ekstraseluler dari sel bakteri penghasilnya. Gen penyandi protein toksik biasanya terdapat pada plasmid bakteri. Protein toksin jenis eksotoksin terdiri atas dua subunit. Unit yang pertama merupakan unit yang berikatan pada membran sel dan akan masuk ke dalam sel, sementara unit yang kedua merupakan unit yang memiliki aktivitas toksik. Eksotoksin termasuk ke dalam substansi yang paling toksik dan berperan dalam patogenesis penyakit yang ditimbulkan oleh bakteri patogen (Muliawan 2009). Salah satu sub kelas dari eksotoksin adalah enterotoksin, yaitu protein toksin ekstraseluler bakteri yang umumnya memberikan efek toksik pada saluran pencernaan (Akhdiya et al 2007).
4
banyak digunakan oleh peneliti di luar negeri dalam perakitan tanaman transgenik (varietas tahan) (Liu et al 2003). Kelas yang kedua merupakan toksin “Make Caterpillar Flopy” (Mcf toxin). Toksin jenis ini akan aktif ketika diinjeksikan secara langsung ke dalam tubuh larva serangga (Waterfield et al 2005). Kelas yang ketiga merupakan toksin yang bersifat biner. Protein toksin jenis ini dapat aktif baik ketika diinjeksikan secara langsung ke tubuh larva serangga (Waterfield et al 2005) maupun secara oral dengan cara ditambahkan ke dalam pakan larva serangga, contohnya adalah toksin “Photorhabdus insect-related
protein” atau lebih dikenal sebagai toksin
pirAB (Duchaud et al 2003).
Salah satu contoh protein toksin yang bersifat insektisidal adalah kristal protein Bt yang dihasilkan oleh bakteri entomopatogen serangga penggerek kapas Bacillus
thuringiensis. Kristal protein Bt di alam
berupa protoksin, Bt-protoksin kemudian dapat berubah menjadi polipeptida yang lebih pendek dan bersifat toksin karena adanya aktivitas proteolisis dalam sistem pencernaan serangga. Toksin yang telah aktif dalam sistem pencernaan serangga kemudian akan berinteraksi dengan sel-sel epithelium di
midgut (usus tengah) serangga. Toksin Bt ini
menyebabkan terbentuknya pori-pori (lubang yang sangat kecil) atau kebocoran pada sel membran di saluran pencernaan dan mengganggu keseimbangan osmotik dari sel-sel tersebut. Karena keseimbangan osmotik terganggu, sel menjadi bengkak dan pecah dan menyebabkan matinya serangga (Hofte & Whiteley 1989). Selain Kristal protein Bt, terdapat juga contoh protein toksin insektisidal yang memiliki mekanisme toksisitas yang serupa. Misalnya protein toksin Photorabdus luminescens.
Pemurnian dan Karakterisasi Protein
Terdapat banyak metode yang dapat digunakan dalam pemurnian protein toksin. Metode pemurnian dapat ditentukan berdasarkan jenis protein yang akan diisolasi serta tingkat kemurnian protein yang diinginkan. Tahap-tahap pemurnian yang akan dilakukan harus disesuaikan dengan jenis protein, maksudnya apakah protein tersebut merupakan protein ekstraseluler atau protein intraseluler (Scopes 1993).
Secara umum pemurnian protein selalu diawali dengan tahap isolasi protein (pemisahan sel) hingga dihasilkan ekstrak kasar yang mengandung protein. Hal yang membedakan pada protein intraseluler,
terdapat tahap perusakan sel terlebih dahulu sebelum dilakukan isolasi protein. Perusakkan sel dapat dilakukan secara kimia, fisika, dan enzimatik (Koolman & Roehm 2005).
Isolasi protein dapat dilakukan dengan cara sentrifugasi pada kecepatan yang tinggi (5000-10000 rpm) atau presipitasi menggunakan garam seperti ammonium sulfat (Scopes 1993). Kedua metode tersebut bertujuan menghilangkan molekul atau partikel pengotor dari sel seperti organel sel, karbohidrat atau lipid yang tidak diinginkan agar didapat isolat protein yang murni. Tahap yang selanjutnya adalah memisahkan protein dari senyawa yang berbobot molekul rendah yang berada dalam ekstrak sel dengan proses dialisis. Protein merupakan molekul yang berukuran besar, hal ini menyebabkan molekul protein akan terjebak di dalam kantong membran dialisis sementara molekul-molekul kecil akan berdifusi dengan sendirinya keluar dari kantung membran. Selanjutnya dapat dilakukan pemisahan protein yang diinginkan berdasarkan ukuran atau muatannya (Lehninger 1982). Metode yang sudah umum digunakan dalam pemisahan protein berdasarkan ukurannya adalah filtrasi gel. Pada filtrasi gel protein akan dialirkan pada butiran berpori kecil dari polimer hidrofilik. Protein yang berukuran kecil akan teradsorb pada pori sementara protein yang berukuran besar akan keluar lebih dulu. Sementara itu pemisahan berdasarkan muatan protein dapat dilakukan dengan metode kromatografi penukar ion. Kromatografi penukar ion akan memisahkan protein berdasar perbedaan densitas dan tanda muatan listrik pada pH tertentu (Bollag et al
1996). Ilustrasi mengenai filtrasi gel dan kromatografi penukar ion dapat diamati pada Gambar 2.
5
Gambar 2 Ilustrasi dua metode kromtografi. (A) Kromatografi penukar ion: muatan protein digunakan dalam pemurnian protein. (B) Filtrasi gel: fraksinasi protein berdasarkan ukuran (Hedhammar
et al 2005).
Tenebrio molitor
Tenebrio molitor merupakan serangga
yang tergolong ke dalam ordo coleopteran dan berasal dari famili Tenebrionidae. Tenebrio
molitor merupakan salah satu hama bagi dunia
agrikultur, biasanya serangga ini merupakan hama perusak bagi produk pascapanen. Serangga ini merupakan hama pada produk biji-bijian atau serealia. Larva dari Tenebrio
molitor ini umumnya dikenal masyarakat
sebagai “ulat hongkong” atau “yellow
mealworm” yang sering digunakan sebagai
pakan burung ataupun ikan (Herman et al
2004).
Tenebrio molitor sudah sangat umum
digunakan sebagi hewan uji dalam penelitian atau studi biokimia. Alasannya adalah ukuran stadium larva dari serangga ini yang relatif besar jika dibandingkan dengan serangga coleopteran lainnya. Selain itu serangga ini juga memiliki waktu generasi yang lambat jika dibandingkan dengan serangga Tenebrionidae lainnya, sehingga serangga ini dirasa lebih cocok digunakan sebagai hewan uji pada penelitian atau studi yang membutuhkan serangga dengan fase larva dalam waktu yang cukup lama (Oppert 2010).
Tenebrio molitor merupakan serangga
yang sangat mudah proses pembiakannya. Hal ini dikarenakan serangga ini memiliki daya adaptasi terhadap lingkungan yang sangat baik, serta tergolong mudah dalam hal pemberian pakan. Larva serangga T. molitor
yang dibiakkan dalam keadaan optimum,
yaitu dengan suhu lingkungan yang terkontrol serta nutrisi yang baik membutuhkan waktu kurang lebih sembilan bulan. Sementara jika dibiakkan pada keadaan suboptimal atau kondisi alaminya, serangga ini membutuhkan waktu kurang lebih dua puluh bulan untuk perkembangan dari telur hingga imago dengan dua puluh fase instar. Umumnya serangga ini memiliki fase instar yang cukup panjang, serangga ini memiliki fase instar sebanyak 9 hingga 18 periode dan fase instar larva serangga ini dapat bertahan selama 90 hingga 140 hari (Rand & Laing 2011). Larva serangga T. molitor instar II-III yang digunakan untuk uji toksisitas ditunjukkan pada Gambar 3.
Gambar 3 Larva Tenebrio molitor instar II-III yang digunakan dalam bioasai
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan pada penelitian ini adalah kultur sel bakteri S.
marcescens isolat SM201102 yang diisolasi
dari wereng batang cokelat koloni Sukamandi yang mati dengan gejala tubuh berwarna merah, larva serangga Tenebrio molitor instar II-III (larva yang berumur 3-4 minggu) (Prabhakar 2001), media Luria Bertani (LB) cair, K2HPO4 50 mM dan 1 M, KOH 5 M, KCl 150 mM pH 6.3, KCl 300 mM, akuades, reagen Bradford, bufer salin fosfat (PBS) 1x, poliakrilamid 10%, Tris HCl pH 6.8 dan 8.8, ammonium persulfat 10%, serbuk ammonium sulfat, suspensi DEAE-sepharos (Pharmacia Biotech, Uppsala Swedia), kantong dialisis (Sigma), kertas saring, dan pakan buatan larva.
Sementara alat-alat yang digunakan pada penelitian ini adalah gelas plastik volume 50 ml, tabung vial 1.5 ml, kuvet 1 ml, pinset,
shaker, stirrer, pipet volumetrik, pipet mikro
6
UV Vis Hitachi U 2000, pH meter Thermo Orion 410 A+, indikator universal, kolom berukuran 2.6 x 40 cm, kolom sephacryl S-400, laminar Hitachi Clear Bench, penangas air, alat freeze drier, dan peralatan elektroforesis SDS PAGE Biorad.
Metode Penelitian
Pembuatan Media Pertumbuhan S.
marcescens
Media yang digunakan dalam pembiakan
S. marcescens adalah media Luria Bertani.
Media dibuat dengan cara melarutkan 5 g ekstrak yeast, 10 g tripton, dan 10 g NaCl dalam 1L akuades. Larutan dihomogenkan menggunakan pengaduk magnet selama beberapa menit hingga benar-benar larut. Setelah larut media tersebut diautoklaf selama 20 menit pada suhu 121oC dan pada tekanan 1 atm.
Pembiakan S. marcescens
Bakteri S. marcescens yang digunakan pada penelitian ini adalah isolat SM201102 yang diisolasi dari wereng batang coklat koloni Sukamandi. Bakteri dikulturkan pada media Luria Bertani (LB) agar miring dalam tabung reaksi. Kemudian bakteri diinokulasikan ke dalam 1 L media LB cair dan diinkubasikan selama 48 jam dalam orbital dengan kecepatan 75 rpm pada suhu ruang (±25oC).
Isolasi Protein Insektisidal S. marcescens
Pemisahan Sel Bakteri. Biakan bakteri S.
marcescens yang telah diinkubasi,
disentifugasi dengan kecepatan 5000 rpm selama 30 menit pada suhu 4oC untuk memisahkan sel dari supernatannya. Supernatan yang didapat akan dipisahkan dengan peletnya untuk kemudian dipurifikasi proteinnya. Purifikasi protein dilakukan dengan dua metode, yaitu purifikasi menggunakan kromatografi kolom dan purifikasi protein insektisidal dengan cara presipitasi menggunakan amonium sulfat dan dialisis.
Purifikasi Protein Insektisidal Menggunakan Metode Presipitasi
Amonium Sulfat dan Dialisis. Fraksi
supernatan yang didapat setelah proses pemisahan sel dengan sentrifugasi, ditambahkan dengan 307.17 g amonium sulfat hingga fraksi supernatan menjadi jenuh 100%. Penambahan amonium sulfat dilakukan sedikit demi sedikit dengan cara ditunggu hingga larut sebelum penambahan
selanjutnya, larutan dihomogenkan dengan menggunakan batang pengaduk magnetik. Setelah fraksi supernatan mencapai 100% jenuh, fraksi supernatan diinkubasi semalaman (±18 jam) pada suhu 4oC. Selanjutnya fraksi supernatan tersebut disentrifugasi dengan kecepatan 5000 rpm selama 30 menit, pelet yang didapat dilarutkan dengan bufer salin fosfat (PBS). Volume protein yang didapat diukur, sebagian didialisis menggunakan bufer salin fosfat (PBS) dan sebagian lainnya disimpan dalam tabung tersendiri pada suhu 4oC. Dialisis dilakukan selama semalam, setelah didialisis protein yang didapat disimpan dalam tabung yang telah dilabel pada suhu 4oC. Selanjutnya protein insektisidal hasil dialisis dan protein nondialisis dipekatkan dengan cara freeze
drying. Protein insektisidal yang dihasilkan
juga diuji toksisitasnya dengan bioasai.
Purifikasi Protein Insektisidal dengan Kromatografi Kolom. Fraksi supernatan dari presipitasi amonium sulfat ditambah K2HPO4 1 M hingga konsentrasinya menjadi 50 mM K2HPO4. Kemudian pH-nya diatur hingga menjadi 8.6 dengan KOH 1 M.
Selanjutnya 200 ml suspensi DEAE-Sepharos (Pharmacia Biotech, Uppsala, Swedia) dicampurkan dengan K2HPO4 50 mM. Campuran resin ini kemudian dicuci dengan 50 mM KH2PO4, melalui sentrifugasi pada kecepatan 5000 rpm selama 10 menit sebanyak lima kali. Penambahan K2HPO4 dilakukan pada pelet campuran resin setiap kali selesai sentrifugasi hingga lima kali sentrifugasi. Pencucian dihentikan ketika etanol sudah hilang dari campuran resin.
Setelah etanol pada suspensi DEAE-Sepharos hilang, resin ditambahkan ke dalam supernatan dan dihomogen selama 15 menit menggunakan pengaduk magnetik, lalu diinkubasi semalam hingga protein insektisidal terabsorbsi pada resin. Setelah inkubasi maka resin dan protein yang terabsorbsi akan mengendap, sementara air yang berada di permukaan atas dibuang. Campuran protein yang telah terabsorsi pada resin dituang ke dalam kolom berukuran 2.6 x 40 cm, harus dipastikan kandungan air pada resin dalam jumlah paling minimal.
Selanjutnya resin dielusi menggunakan KCl dengan konsentrasi 300 mM. Fraksi ditampung berdasarkan volume, yaitu setiap volume 2 ml. Setelah elusi setiap fraksi diukur absorbannya pada panjang gelombang 280 nm. Fraksi-fraksi yang memiliki puncak yang baik selanjutnya dipekatkan dengan metode
7
mengandung protein insektisidal akan dimurnikan lebih lanjut dan akan diuji toksisitasnya dengan bioasai.
Penentuan konsentrasi protein fraksi. Uji Bradford. Sampel protein diencerkan menjadi 5x, 10x, 50 x, 100x, 200x, 400x, dan 800x dengan PBS hingga volume akhir mencapai 800 µL. Kemudian ke dalam campuran ditambahkan reagen Bradford sebanyak 200 µL dan dihomogenkan dengan vorteks. Absorban diukur pada panjang gelombang 595 nm setelah campuran diinkubasi pada suhu ruang (±25oC) selama 10 menit. Konsentrasi protein ditentukan dengan persamaan kurva standar.
Pengukuran Konsentrasi Protein
dengan Spektrofotometer UV 280 nm.
Sampel protein dipipet hingga volume 200 µl ke dalam kuvet, kemudian diukur absorbannya pada panjang gelombang 280 nm dan konsentrasi protein ditentukan dengan mengkonversi bahwa sampel dengan absorbansi 1.3 memiliki konsentrasi 1 mg/ml. Perbandingannya adalah sebagai berikut :
. / Keterangan :
[X] : konsentrasi protein sampel Ax : absorban sampel
(Grimsley & Pace 2003)
Analisis Natif Gel
Pembuatan natifgel 10%. Separation gel dibuat dengan cara mencampurkan 1.95 µL dH2O, buffer Tris HCl pH 8.6 1.3 ml, 1.7 mL 30% akrilamid (30:1), 50 µL APS (amonium persulfat) 10%, dan 2 µL TEMED (N,N,N’,N’-tetrametil-etilendiamin).
Campuran tersebut kemudian diaduk dan dicetak ke dalam cetakan gel hingga mencapai 2/3 bagian cetakan, kemudian 1/3 bagian diisi dengan akuades dan didiamkan sampai gel mengeras. Selanjutnya stacking gel
dibuat dengan mencampurkan 1.4 mL dH2O, 250 µL buferTris-HCl pH 6.8 1 M, 330 µL 30% akrilamid, 20 µL SDS 10%, 20 µL APS 10%, dan 2 µL TEMED. Selanjutnya campuran tersebut diaduk, sementara itu akuades dalam 1/3 bagian cetakan dibuang, untuk kemudian diganti dengan campuran
stacking gel. Sisir pencetak sumur disisipkan
pada cetakan.
Preparasi dan running sampel.
Sampel protein ditambahkan dengan 2x SB
(sample buffer) dalam volume 30 µL dengan
perbandingan 1:1. Gel dimasukkan ke dalam bak elektroforesis yang telah diisi running
buffer. Sampel yang telah disiapkan
dimasukkan sebanyak 10-20 µL ke dalam sumur. Elektroforesis dijalankan pada tegangan listrik 110 V dengan arus 120 mA hingga sampel mencapai batas bawah gel.
Pewarnaan gel. Gel SDS-PAGE
dimasukkan ke dalam wadah yang berisi reagen pewarna (0.25 g Coomassie Brilliant
Blue R250, 125 mL metanol, 25 mL asam
asetat glasial, dan 100 mL akuades). Pewarnaan dapat dilakukan selama 2-3 jam. Pewarna yang tidak berikatan dengan sampel dalam gel dicuci dengan proses destaining. Gel dimasukkan ke dalam wadah yang berisi larutan pencuci (10 mL metanol, 100 mL asam asetat glasial, dan 800 mL akuades). Pencucian warna dilakukan sekitar 24 jam pada orbital.
Analisis bobot molekul. Gel yang telah diwarnai, kemudian didokumentasikan. Bobot molekul dianalisis dengan perangkat lunak Photocapt-MW.
Perkiraan Bobot Molekul dengan Analisis SDS PAGE
Pembuatan Gel 10% SDS-PAGE.
Pembuatan gel SDS PAGE diawali dengan pembuatan separation gel. Akuades sebanyak 1.9 mL ditambahkan dengan 1.3 mL buferTris-HCl pH 8.8 1.5 M, 1.7 mL 30% akrilamid (30:1), 50 µL SDS 10%, 50 µL APS (amonium persulfat) 10%, dan 2 µL TEMED (N,N,N’,N’-tetrametil-etilendiamin).
Campuran tersebut kemudian diaduk dan dicetak ke dalam cetakan gel hingga mencapai 2/3 bagian cetakan, kemudian 1/3 bagian diisi dengan akuades dan didiamkan sampai gel mengeras. Stacking gel dibuat dengan campuran 1.4 mL akuades, 250 µL buferTris-HCl pH 6.8 1 M, 330 µL 30% akrilamid, 20 µL SDS 10%, 20 µL APS 10%, dan 2 µL TEMED. Selanjutnya campuran tersebut diaduk, sementara itu akuades dalam 1/3 bagian cetakan dibuang, untuk kemudian diganti dengan campuran stacking gel. Sisir pencetak sumur disisipkan pada cetakan.
Preparasi dan Running Sampel. Sampel protein ditambahkan dengan 2x SB (sample
buffer) dalam volume 30 µL dengan
8
Pewarnaan Gel. Gel SDS-PAGE
dimasukkan ke dalam wadah yang berisi reagen pewarna (0.25 g Coomassie Brilliant
Blue R250, 125 mL metanol, 25 mL asam
asetat glasial, dan 100 mL akuades). Pewarnaan dapat dilakukan selama 2-3 jam. Pewarna yang tidak berikatan dengan sampel dalam gel dicuci dengan proses destaining. Gel dimasukkan ke dalam wadah yang berisi larutan pencuci (10 mL metanol, 100 mL asam asetat glasial, dan 800 mL akuades). Pencucian warna dilakukan sekitar 24 jam pada orbital.
Analisis Bobot Molekul. Gel yang telah diwarnai, kemudian didokumentasikan. Bobot molekul dianalisis dengan perangkat lunak
Photocapt-MW.
Bioasai
Sebanyak 100 μl suspensi protein toksin dengan konsentrasi 0.5, 1, 2.5, 5, 10, 20, dan 40 μg/ml dicampur dengan 0.5 g pakan buatan hingga merata. Kemudian pakan diletakkan dalam gelas plastik (vol. 50 ml) lalu dikering anginkan selama semalam (±18 jam) pada suhu ruang (25oC). Selanjutnya pada setiap tabung diinfestasikan 5 ekor larva Tenebrio
molitor instar II-III. Mortalitas larva diamati
setiap hari selama 7 hari (Tan et al 2006). Setelah dilakukan pengamatan tingkat mortalitas pada larva, dilakukan pula penentuan nilai LC50 untuk setiap protein toksin.
HASIL DAN PEMBAHASAN
Biakan Bakteri S. marcescens
Bakteri entomopatogen yang digunakan pada penelitian ini adalah bakteri Serratia
marcescens isolat SM201102 yang diisolasi
dari wereng batang coklat koloni Sukamandi. Setelah pengkulturan didapatkan biakan bakteri yang berwarna merah. Hal ini menandakan bakteri merah (S. marcescens) benar-benar tumbuh pada media tersebut. Pigmen merah tersebut merupakan prodigiosin, yaitu biopigmen yang dihasilkan oleh bakteri ini ketika berada pada rentang suhu 27oC-30oC (Sundaramoorthy et al 2009).
Pigmen merah yang dihasilkan menandakan bahwa bakteri merah sedang berada pada fase stasioner, hal ini sesuai dengan kurva pertumbuhan S. marcescens
yang menunjukkan terjadinya fase stasioner pada jam ke 40-50 inkubasi (Hardjito et al
2002). Kurva pertumbuhan S. marcescens dapat diamati pada Lampiran 3. Fase stasioner
ditandai dengan banyak dihasilkannya produk-produk metabolit oleh sel bakteri. Produk metabolisme yang dihasilkan tersebut antara lain adalah fosfolipase, lipase, protease dan beberapa antibiotik, kompleks protein toksin (kompleks toksin) berberat molekul tinggi, lipopolisakarida, serta berbagai macam antibodi (Akhdiya et al 2007).
Hasil Isolasi Protein Insektisidal
Isolasi protein insektisidal dilakukan menggunakan metode sentrifugasi dengan kecepatan tinggi. Setelah proses sentrifugasi dihasilkan supernatan yang merupakan ekstrak bebas sel yang berwarna kuning kemerahan (warna kuning berasal dari media LB dan kemerahan merupakan pigmen prodigiosin yang dihasilkan bakteri) serta masih memiliki bau khas biakan S.
marcescens. Supernatan yang dihasilkan
tersebut merupakan ekstrak kasar yang mengandung protein insektisidal S.
marcescens. Protein insektisidal yang ada
dalam supernatan kemudian akan dimurnikan lebih lanjut menggunakan metode presipitasi ammonium sulfat, dialisis, dan kromaografi kolom penukar ion.
Hasil Presipitasi Protein Insektisidal Menggunakan Amonium Sulfat
Ekstrak kasar protein insektisidal yang dihasilkan dari proses pemisahan sel dipresipitasikan dengan ammonium sulfat hingga mencapai konsentrasi ammonium sulfat 100%. Setelah proses presipitasi didapatkan endapan protein yang kemudian diresuspensi menggunakan buffer salin fosfat (PBS 1x) hingga didapat protein presipitat sebanyak 10 ml. Protein presipitat yang dihasilkan berwarna cokelat pekat dan berbau sama dengan biakan awal bakteri S.
marcescens. Protein insektisidal yang
dihasilkan dari proses pengendapan dengan ammonium sulfat ini (selanjutnya disebut protein insektisidal nondialisis) ditentukan konsentrasinya menggunakan metode Bradford. Protein insektisidal nondialisis memiliki konsentrasi sebesar 6415.909 µg/ml. Presipitasi dengan kejenuhan 100% ini dimaksudkan agar protein insektisidal yang terdapat pada ekstrak kasar tersebut dapat terendapkan dengan sempurna.
9
tidak terdenaturasi dan aktivitasnya dapat diperbaiki selama pelarutan pelet kembali. Selain itu, garam-garam ini dapat menstabilkan protein melawan denaturasi, proteolisis ataupun kontaminasi bakteri (Mutiah 2005). Protein insektisidal presipitat yang dihasilkan sebagian dimurnikan kembali dengan metode dialisis. Protein insektisidal nondialisis kemudian diuji toksisitasnya pada larva Tenebrio molitor instar II-III secara oral.
Hasil Dialisis Protein Insektisidal
Dialisis merupakan suatu metode yang digunakan untuk memisahkan molekul-molekul yang berukuran lebih besar dari molekul yang ukurannya lebih kecil dalam suatu media. Dialisis dilakukan pada protein insektisidal yang dihasilkan melalui proses presipitasi menggunakan ammonium sulfat. Protein presipitat diambil sebanyak 5 ml dan dimasukkan ke dalam kantung membran selofan. Proses dialisis dilakukan selama semalam (±18 jam) dalam bufer PBS. Setelah proses dialisis didapat protein dialisat sebanyak 3 ml yang berwarna cokelat tua dan masih memiliki bau khas biakan S.
marcescens. Protein hasil dialisis kemudian
ditentukan konsentrasinya menggunakan uji Bradford. Berdasarkan hasil uji, didapat konsentrasi protein dialisis sebesar 2335.227 µg/ml.
Dialisis yang dilakukan pada penelitian ini dilakukan dengan menggunakan kantung membran selofan sebagai membran semipermiabel dengan ukuran porinya (cut off) maksimal 12 KDa. Hal ini dimaksudkan agar molekul protein yang memiliki ukuran yang lebih kecil akan terdistribusi dengan sendirinya keluar membran (ke larutan bufer) semipermiabel hingga tercapai kesetimbangan antara cairan di dalam dan di luar kantung. Sementara molekul protein insektisidal yang lebih besar dari 12 KDa akan tetap berada di dalam kantung membran (Koolman & Roehm 2005). Ketepatan ukuran molekul protein yang didapat pada proses dialisis akan terlihat dari hasil analisis bobot molekul protein menggunakan SDS PAGE. Protein hasil dialisis ini (selanjutnya disebut protein dialisis) selanjutnya akan diuji toksisitasnya pada larva serangga T. molitor instar II-III.
Hasil Pemurnian Protein Insektisidal menggunakan Kromatografi Kolom Penukar Ion
Adanya variasi muatan pada kompleks protein yang satu dengan lainnya memungkinkan untuk digunakannnya metode
kromatografi penukar ion dalam pemurniannya. Protein insektisidal yang terdapat dalam supernatan kultur dimurnikan menggunakan metode kromatografi kolom penukar ion. Elusi dilakukan menggunakan KCl dengan konsentrasi 300 mM agar menjaga aktivitas protein insektisidal serta mereduksi adanya protein-protein lainnya (Bowen & Esign 1998).
Setelah proses elusi, dihasilkan 35 fraksi yang ditampung berdasarkan volumenya. Setiap 2 ml fraksi yang dihasilkan ditampung. Fraksi-fraksi yang dihasilkan kemudian diukur absorbansinya pada panjang gelombang 280 nm dengan spektrofotometer UV Vis. Hasil pembacaan absorban untuk 35 fraksi protein insektisidal disajikan pada Lampiran 4. Berdasarkan pembacaan absorban dari fraksi-fraksi yang ditampung dihasilkan kromatogram pada Gambar 4. Diambil dua fraksi protein yang masing-masing terletak pada titik A dan B. Berdasarkan pembacaan absorban, diduga pada titik tersebut terdapat protein insektisidal yang memiliki aktivitas tosik. Kedua fraksi tersebut dipekatkan dengan metode freeze dry, kemudian diukur konsentrasinya dengan metode Bradford. Setelah uji Bradford diketahui bahwa protein insektisidal fraksi A dan Fraksi B, masing-masing memilki konsentrasi sebesar 2196.591 µg/ml dan 76.222 µg/ml. Keduanya memiliki konsentrasi yang jauh berbeda. Efek toksik protein insektisidal Fraksi A dan B akan ditentukan melalui uji toksisitas terhadap serangga hama
T. molitor instar II-III.
Gambar 4 Kromatogram fraksi-fraksi hasil pemurnian protein insektisidal dengan kromatografi kolom penukar ion.
Profil Protein Insektisidal pada Natif Gel
Analisis natif PAGE ini dilakukan untuk mengetahui bobot molekul protein sebelum terdenaturasi dan untuk mengetahui apakah
0.000 0.200 0.400 0.600 0.800 1.000 1.200 1.400
0 50 100
10
protein insektisidal terdiri atas satu kompleks toksin atau beberapa kompleks toksin (Bollag
et al 1996).
Analisis natif PAGE dilakukan pada sampel protein insektisidal yang masih berupa protein hasil presipitasi ammonium sulfat. Setelah dilakukan elektroforesis didapat elektroforegram seperti yang ditunjukkan pada Gambar 5. Hasil natif PAGE tersebut menunjukkan bahwa protein insektisidal terdiri atas beberapa kompleks toksin dengan ukuran yang berbeda. Protein insektisidal S.
marcescens terdiri atas tiga subkompleks
toksin yang ditandai dengan munculnya tiga pita protein pada gel natif. Masing-masing berukuran 87.50, 57.40, dan 53.21 KDa. Sebagai perbandingan, hasil analisis natif gel untuk protein insektisidal bakteri P.
luminescens menghasilkan tiga pita pula
dengan bobot molekul yang berkisar antara 55 hingga 66.2 KDa.
Berdasarkan hasil analisis natif PAGE tersebut diduga bahwa protein insektisidal S.
marcescens merupakan protein yang bersifat
multimerik, artinya efek toksin baru akan ditimbulkan ketika protein berada dalam bentuk kompleks. Jika dilihat dari mekanisme toksisitas dari penelitian mengenai protein toksin P. luminescens, menyatakan pula bahwa efek toksik baru akan muncul ketika subkompleks protein toksin ini berinteraksi dengan subkompleks protein lainnya (Binglin et al 2007). Ketiga protein subkompleks yang telah terseparasi tersebut diduga memiliki perannya masing-masing dalam menimbulkan efek toksin. Namun belum dapat dipastikan apakah ketiga protein subkompleks tersebut merupakan produk dari satu gen ataukan produk dari gen yang berbeda (Bowen & Esign 1998).
Gambar 5 Hasil natif PAGE protein insektisidal : Marker protein (M) dan protein sampel (S)
Profil Protein Insektisidal pada Elektroforegram SDS PAGE
Analisis bobot molekul keempat protein insektisidal yang telah dimurnikan dilakukan dengan SDS PAGE. Prinsip dasar metode ini adalah pergerakan molekul protein pada media yang dialiri arus listrik. Molekul protein akan bergerak dari katoda ke anoda, pergerakan molekul protein dipengaruhi oleh ukuran, bentuk, dan muatan elektrik protein tersebut (Koolman & Roehm 2005). Selain analisis ukuran molekul dari protein, dengan dilakukannya analisis SDS PAGE juga dapat menunjukkan tingkat kemurnian protein yang dihasilkan (Barker 1998).
Berdasarkan hasil SDS PAGE yang ditunjukkan pada Gambar 6 dan 7, terlihat bahwa protein insektisidal fraksi A, fraksi B, dialisis, dan nondialisis memiliki jumah pita yang berbeda setelah diwarnai. Protein insektisidal fraksi A (lajur 2) memperlihatkan adanya 10 pita protein dengan bobot molekul 14.00 KDa hingga 95.29 KDa. Protein insektisidal fraksi B (lajur 1) memperlihatkan adanya 6 pita protein yang berbobot molekul 30.42 KDa hingga 95.29 KDa. Protein insektidal dialisis (lajur 3) memperlihatkan jumlah pita protein yang sama dengan protein fraksi A, namun dengan rentang ukuran molekul yang berbeda. Protein insektisidal hasil dialisis memiliki rentang ukuran molekul protein dari 12.75 KDa hingga 95.29 KDa. Sementara protein nondialisis (lajur 4) memiliki jumlah pita protein yang paling banyak, yaitu 11 pita protein dengan rentang ukuran molekul 12.25 KDa hingga 95.29 KDa. Perbedaan jumlah pita protein pada hasil analisis SDS PAGE ini menandakan tingkat kemurnian masing-masing protein insektisidal yang juga berbeda. Terlihat pada Gambar 6 dan 7 protein insektisidal dengan tahap pemurnian terendah, protein nondialisis (lajur 4) memiliki jumlah pita protein yang paling banyak yaitu sebnayak 11 pita protein.
Berdasarkan hasil elektroforesis keempat protein insektisidal tersebut, masing-masing protein memiliki pita dengan ukuran yang mirip. Terlihat pada Gambar 6 dan 7 masing-masing protein insektisidal memiliki kesamaan rentang bobot molekul dari 30 KDa hingga yang tertinggi 95.29 KDa. Hal ini dibuktikan dengan adanya pita dengan ukuran 95.29 KDa dan 58~59 KDa pada masing-masing protein insektisidal. Hasil SDS PAGE ini sesuai dengan penelitian mengenai protein insektisidal bakteri entomopatogen
Photorabdus luminescens yang pernah
11
1998, bahwa kompleks toksin bakteri entomopatogen memiliki beberapa pita protein dengan bobot molekul 30 KDa hingga lebih dari 212 KDa. Jika dihubungkan dengan hasil uji toksisitas, protein insektisidal fraksi B memiliki efek toksin yang paling baik. Hal ini ditunjukkan oleh grafik persentase mortalitas larva serangga uji terhadap protein insektisidal fraksi B (grafik terdapat pada Lampiran 10) yang cenderung naik seiring dengan naiknya dosis toksin yang diberikan. Namun belum dapat dipastikan pita protein mana yang memiliki efek toksin, karena belum diketahui apakah pita-pita tersebut merupakan suatu subunit yang berasal dari satu protein insektisidal atau masing-masing pita protein tersebut memiliki aktivitas toksinnya sendiri (Akhdiya et al 2007). Oleh karena itu diperlukan penelitian yang lebih lanjut agar dapat diketahui apakah terdapat aktivitas toksin pada masing-masing pita protein atau apakah jenis protein insektisidal
S. marcescens bersifat multimerik.
Gambar 6 Hasil SDS PAGE protein insektisidal. Marker protein (M), protein fraksi B (1), protein fraksi A (2), protein dialisis (3), dan protein nondialisis (4)
Gambar 7 Hasil SDS PAGE protein insektisidal dan ukuran masing-masing pita protein. Marker protein (M), protein fraksi B (1), protein fraksi A (2), protein dialisis (3), dan protein nondialisis (4)
Toksisitas Protein Insektisidal Serratia marcescens
Biosai atau uji toksisitas dilakukan untuk mengetahui dan membandingkan efek oral yang dimiliki oleh protein toksin S.
marcescens yang dihasilkan pada setiap tahap
pemurnian. Tingkat mortalitas serta gejala kematian diamati pada uji toksisitas ini. Uji toksisitas ini dilakukan selama tujuh hari dan diamati setiap harinya (Tan et al 2006).
Pengamatan tingkat mortalitas dilakukan terhadap larva T. molitor instar II-III. Uji toksisitas tidak dilakukan langsung pada wereng, hal ini disebabkan tipe mulut wereng merupakan mulut pencucuk dan penghisap sehingga kurang cocok digunakan sebagai hewan uji untuk protein insektisidal yang bersifat oral (Prriyatno et al 2011). Larva serangga T. molitor merupakan larva serangga
M
1
2
3
12
yang sudah umum digunakan sebagai hewan uji protein insektisidal karena memiliki nafsu makan yang cukup besar (mudah lapar), mudah dibiakkan, serta memiliki fase instar yang cukup lama sebelum berubah menjadi serangga (Herman et al 2004).
Larva serangga yang diberi perlakuan protein insektisidal baru menimbulkan gejala keracunan setelah hari ke tiga uji toksisitas. Gejala keracunan yang terjadi adalah mulai timbulnya warna kehitaman pada bagian atas tubuh larva, kemudian larva berhenti makan, dan seluruh tubuh larva berubah warna hitam ketika mati. Gejala toksisitas ini mirip dengan gejala toksisitas yang ditimbulkan oleh delta-endotoksin Bt. Gejala toksik yang dtimbulkan pada larva serangga dapat diamati pada Gambar 8.
Gambar 8 Gejala toksisitas pada larva T. molitor
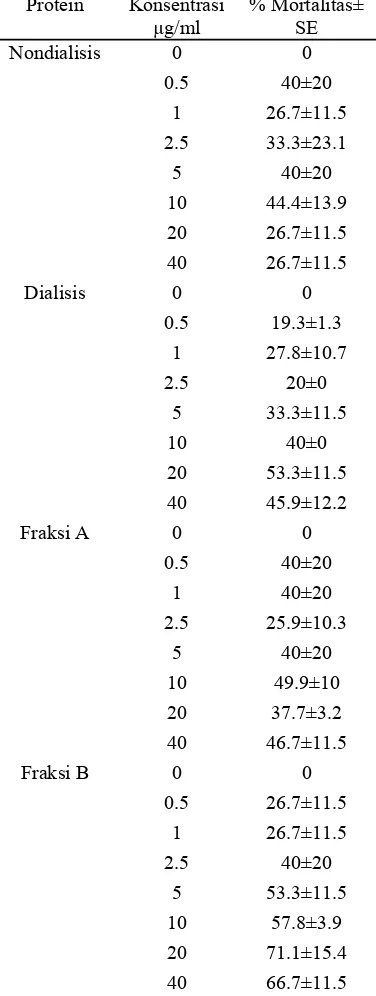
Berdasarkan hasil pengamatan, tingkat mortalitas yang ditimbulkan oleh setiap protein insektisidal berbeda. Presentase mortalitas masing-masing protein insektisidal disajikan pada Tabel 1 dan presentase mortalitas dalam bentuk grafik dapat diamati pada Lampiran 7, 8, 9, dan 10. Berdasarkan data bioasai pada Tabel 1 terlihat bahwa dari keempat protein insektisidal yang diujikan terhadap larva serangga hanya protein insektisidal fraksi B yang menunjukkan persentase mortalitas yang semakin tinggi seiring dengan dinaikannya dosis protein insektisidal. Sementara jika diperhatikan tingkat mortalitas yang diakibatkan oleh ketiga protein insektisidal yang lainnya, terjadi ketidaksesuaian antara mortalitas yang terjadi dengan dosis yang diberikan. Contohnya pada protein insektisidal nondialisis yang memberikan efek mortalitas yang tinggi pada tingkat dosis terendah, sementara ketika dosis dinaikkan mortalitas yang terjadi justru menurun. Hal ini dapat terjadi karena ketahanan individu larva yang secara genetik berbeda terhadap protein insektisidal. Selain itu diduga karena proses
makan oleh larva yang terhenti sebelum protein insektisidal menimnbulkan efek toksin. Namun tingkat mortalitas yang ditimbulkan oleh setiap protein insektisidal dapat dipastikan bukan terjadi karena keracunan pelarut, hal ini terlihat dari tidak adanya kematian pada setiap kontrol. Kontrol yang digunakan adalah pakan buatan larva yang dicampur dengan pelarut saja tanpa protein insektisidal.
Tabel 1 Data mortalitas protein insektisidal terhadap larva T. molitor
Protein Konsentrasi µg/ml
% Mortalitas± SE Nondialisis 0 0
0.5 40±20
1 26.7±11.5
2.5 33.3±23.1
5 40±20
10 44.4±13.9
20 26.7±11.5
40 26.7±11.5
Dialisis 0 0
0.5 19.3±1.3
1 27.8±10.7
2.5 20±0
5 33.3±11.5
10 40±0
20 53.3±11.5
40 45.9±12.2
Fraksi A 0 0
0.5 40±20
1 40±20
2.5 25.9±10.3
5 40±20
10 49.9±10
20 37.7±3.2
40 46.7±11.5
Fraksi B 0 0
0.5 26.7±11.5
1 26.7±11.5
2.5 40±20
5 53.3±11.5
10 57.8±3.9
20 71.1±15.4
40 66.7±11.5
13
Penentuan LC50
Lethal concentration (LC50) merupakan
konsentrasi toksin yang dapat membunuh 50% dari populasi hewan uji. Setelah dilakukan pengamatan selama 7 hari (Tan et al 2006), didapatkan persentase kematian larva. Kemudian dilakukan analisis probit untuk menentukan nilai LC50 dari setiap protein insektisidal yang diujikan.
Nilai probit didapat dengan cara mentransformasikan persentase kematian ke unit probit menggunakan tabel tranformasi nilai probit yang terdapat pada Lampiran 11. Nilai probit yang didapat kemudian diregresikan terhadap Log konsentrasi protein insektisidal yang diujikan. Selanjutnya didapat grafik dan persamaan linier untuk masing-masing protein insektisidal. Grafik serta persamaan linier untuk masing-masing protein insektisidal dapat diamati pada Lampiran 12, 13, 14, dan 15. Penentuan LC50 dilakukan dengan cara memasukkan nilai probit 5 sebagai nilai y pada persamaan grafik probit hingga didapat nilai x. Nilai antiLog x tersebut merupakan konsentrasi LC50 dari protein insektisidal yang diujikan.
Setelah dilakukan analisis probit persentase mortalitas dan perhitungan LC50 didapatkan konsentrasi LC50 untuk masing-masing protein insektisidal. Protein insektisidal fraksi A memiliki nilai LC50 pada konsentrasi 9.33µg/ml, protein insektisidal fraksi B memiliki nilai LC50 pada konsentrasi 4.82µg/ml, protein dialisis pada konsentrasi 23.44µg/ml, dan protein nondialisis pada konsentrasi 19.49µg/ml. Hasil analisis probit menunjukkan nilai LC50 yang berbeda-beda antara keempat protein insektisidal yang diujikan. Hal ini sesuai dengan tingkat kematian yang juga sangat bervariasi di antara keempat protein insektisidal. Tingkat kemurnian protein insektisidal (tahap pemurnian yang didapat) juga mempengaruhi nilai LC50 setiap protein insektisidal. Hasil analisis probit menunjukkan bahwa protein fraksi B memiliki nilai LC50 yang paling kecil dibandingkan dengan ketiga protein insektisidal lainnya. Telah diketahui bahwa protein insektisidal Fraksi B merupakan protein insektisidal yang diperoleh melalui proses pemurnian hingga tahap kromatografi penukar ion, sehingga dapat dikatakan protein insektisidal yang melalui pemurnian dengan kromatografi penukar ion ini merupakan protein insektisidal yang memiliki tingkat kemurnian paling tinggi pada penelitian ini. Sementara itu protein insektisidal fraksi A yang juga melewati proses pemurnian dengan
kromatografi penukar ion juga memiliki nilai LC50 yang cukup rendah dibandingkan dengan protein insektisidal yang hanya melewati proses pemurnian presipitasi amonium sulfat (nondialisis) dan dialisis.
SIMPULAN DAN SARAN
Simpulan
Protein insektisidal yang diisolasi dari bakteri entomopatogen Serratia marcescens
merupakan protein toksin yang bersifat oral. Hasil natif PAGE dan SDS PAGE protein toksin menunjukkan adanya kemungkinan protein toksin bersifat multimerik dengan bobot molekul protein yang diduga berkisar antara 30.42 KDa sampai dengan 95.29 KDa. Berdasarkan hasil analisis probit, protein toksin fraksi B merupakan protein toksin dengan nilai LC50 terendah, yaitu pada konsentrasi 4.82 µg/ml.
Saran
Penelitian protein insektisidal dari bakteri entomopatogen Serratia marcescens ini perlu dilanjutkan hingga jenis kompleks toksin dapat diidentifikasi apakah merupakan toksin TCa atau TCd. Teknik bioasai perlu diperbaiki agar didapat hasil yang lebih maksimum dan perlu juga dilakukan uji toksisitas lanjutan untuk mengetahui apakah protein toksin ini berspektrum luas atau tidak.
DAFTAR PUSTAKA
Akhdiya A, Pratiwi E, dan Samudra I M. 2007. Protein toksin dari bakteri pathogen serangga Photorjabdus luminescens HJ. Berita Biologi 8 (6).
Arifin K. 2011. Penggunaan musuh alami sebagai komponen pengendalian hama padi berbasis ekologi.
Pengembangan Inovasi Pertanian 4:29-46.
Barker K. 1998. At the Bench : A Laboratory navigator. New York : Cold Spring Harbor Laboratory Press.
14
Binglin T, Trevor AJ, dan Mark RHH. 2006. Virulence of Serratia strains against
Costelytra zealandica. Applied and
Environmental Microbiology 72:
6417-6418.
Blackburn M, Golubeva E, Bowen D, ffrench-Constant RH. 1998. A novel insecticidal toxin from Photorhabdus
luminescens, Toxin complex a (Tca)
and its histopathological effects on the midgut of Manduca sexta. Appl
Environ Microbiol64(8):3036-3041.
Bollag DM, Rozycki MD, Edelstein SJ. 1996. Protein Methods. Ed ke 2. Michigan: Willey-Liss.
Bowen DJ dan Ensign JC. 1998. Purification and characterization of high molecular weight insecticidal protein complex produced by entomophatogenic
bacteriumPhotorabdus luminescens.
Appl. Environ Microbiol 64:
3029-3035.
Bowen D, Rocheleau T, Blackburn M, Andreev O, Golubeva E, Bhartia R, dan Ffrench-Constant RH. 1998. Insecticidal toxins from the bacterium Photorhabdus
luminescens. Science 280:2129-2132.
Buell CR, Joardar V, Lindeberg M et al. 2003. The complete genome sequence of the Arabidopsis and tomato pathogen
Pseudomonas syringae pv. tomato
DC3000. Proc Natl Acad Sci USA 100: 10181–10186.
Claridge M F, J Den Hollander. 1983. The biotype concept and itsapplication to insect pests of agriculture.Crop
Protection 2:85-95.
Dodd SJ, Hurst MR, Glare TR, O'Callaghan M, Ronson CW. 2006. Occurrence of
sep insecticidal toxin complex genes
in Serratia spp. and Yersinia
frederiksenii. Appl Environ
Microbiol 72:6584-6592.
Duchaud et al. 2003. The genome sequence of the enthomopathogenic bacterium
Photorabdus luminescens. Nat.
Biotechnol 21: 1307-1313.
Finney DJ. 1952. Probit Analysis. Cambridge : Cambridge University Press.
Flyg Casper dan Xanthopoulos G Kleanthis. 1983. Insect phatogenic properties of
S. marcescens passive and active
resistance to insect immunity studied with protease-deficient and phage – resistance mutants. Journal of
General microbiology 129 :453-464.
Forst, S. and K. Nealson. 1996. Molecular biology of the symbioticpathogenic bacteria Xenorhabdus spp. and
Photorhabdus spp. Microbiological
Reviews 60:21-43.
Granados, G. 2000. Maize insects. Tropical Maize. Improvement and production. Food and Agriculture Organization of the United Nations, Rome. p. 81−349.
Hardjito L, Huq A, dan Colwell R R. 2002. The influence of environmental conditions on the production of pigment by Serratia marcescens.
Biotech Bioprocess Eng 7:100-104.
Hedhammar M, Karlstrom AE, dan Hober S. 2005. Chromatographic Methods for Protein Purification. Stockholm : AlbaNova University Press.
Herman M, Kusumawati K, dan Diani D. 2004. Perakitan dan Bioasai Tanaman Transgenik Tahan Serangga Hama. Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian.
Hofte H, Whitely HR. 1989. Insecticidal crystal protein of Bacillus
thuringiensis. Microbiol. Rev.
53:242–255.
Hurst MRH, Glare TR, Jackson TA, dan Ronson CW. 2000. Plasmid-located pathogenicity determination of
Serratia entomophila, the causal
agent of amber diseases of grass grub, showing similarity to the insecticidal toxins of Photorhabdus
luminescens. J. Bacteriol. 182:5127–
15
Iman M dan Priyatno TP. 2001. Paradigma Baru Pengendalian Wereng Batang Coklat. Buletin AgroBio 4:50-55.
Khanafari et al. 2006. Review of prodigiosin, pigmentation in Serratia marcescens.
Biological Sciences 6 (1): 1-13.
Koolman J, Roehm KH. 2005. Atlas of
Biochemistry. Ed ke-2. New York :
Thieme.
Lauzon CR, Bussert TG, Sjogren RE, Prokopy RJ. 2003. Serratia marcescens as a bacterial pathogen of Rhagoletis
pomonella flies. J entomol
100:87-92.
Leopold Kurz et al. 2003. Virulence factors of the human opportunistic pathogen S.
marcescens identified by in vivo
screening. EMBO Journal 22(7): 1451-1460.
Liu D et al. 2003. Insect resistence conffered by 283 kDa Photorabdus
luminescens TcdA in Arabidopsis
thaliana. Nat. Biotechnol 21:
1222-1228.
Mame TJ, Costerton Jw. 1998. Prolonged survival of S. marcescens in chlorhexidine. Appl Envimn
Micmbiol 42:1093-1102.
Muliawan SY. 2009. Bakteri Anaerob yang Erat Kaitannya dengan Problem di
Klinik. Jakarta: Penerbit Buku
Kedokteran EGC.
Mutiah D. 2005. Ultrafiltrasi, presipitasi bertingkat dan kromatografi penukar ion sebagai tahapan pemurnian enzim proteaseBacillus megaterium MS-961 [skripsi]. Bogor. Fakultas Teknologi Pertanian, Institut pertanian Bogor.
Mutuura A, and Munroe E, 1970. Taxonomy and distribution of the European corn borer and allied species: genus Ostrinia (Lepidoptera:Pyralidae). Memoirs of the Entomological Society of Canada No.71, 112 pp.
Mohan M, Selvakumar G, Sushil SN, Bhatt JC dan Gupta HS, 2011. Entomopathogenicity of endophytic
S. marcescens strain SRM against
larvae of Helicoverpa armigera
(Noctuidae: Lepidoptera). World J.
Microbiol. Biotechnol. Published
online: 07 April 2011.
Morgan JA., M Sergeant, D Ellis, M Ousley, and P Jarrett. 2001. Sequence analysis of insecticidal genes from
Xenorhabdus nematophilus
PMFI296. Appl. Environ. Microbiol. 67:2062–2069.
Oppert B. 2010. Rapi bioassay to screen potential biopesticides in T. molitor
larvae. Biopesticide International. 6 : 67-73
Parkhill J et al. 2001. Genome sequence of
Yersinia pestis, the causative agent of
plague. Nature 413:523–527.
Prabhakar S. 2006. Molecular characterization of digestive proteases of the yellow mealworm, Tenebrio molitor L. [Disertasi].Manhattan : Kansas state University.
Priyatno TP et al. 2011. Identifikasi Entomopatogen Bakteri Merah pada Wereng Batang Coklat (Nilaparva
lugens Stål.). Jurnal AgroBiogen
7:85-95.
Rand & Laing. 2011. Determination of insecticidal toxicity of three species of entomopathogenic spore-forming bacterial isolates against T. molitor.
African Journal of Microbiology
Research. 5:2222-2228.
Scopes RK. 1993. Protein Purification:
Principles and Practice. Ed ke-3.
New York: Springer Press.
Singh G, Sharma R Joginder, dan Hoondal S Gurinder. 2008. Chitinase Production
by Serratia marcescens GG5. Turk J
Biol. 32: 231-236.
Simpson J R. 2002. Proteins and Proteomics :
A Laboratory Manual. New York :
Cold Spring Harbor Press.
Sundaramoorthy N, Yogesh P, Rhandapani R. 2009. Production of prodigiosin from
Serratia marcescens isolated from
soil. Indian Journal of Science and
16
Vasconcelos et al. 2003. The complete genome sequence of
Chromobacterium violaceum reveals
remarkable and exploitable bacterial adaptability. Proc. Natl. Acad. Sci. USA 100:11660–11665.
Waterfield N, Dowling A, Sharma S, Daborn PJ, Potter U, dan Ffrench CRH. 2001. Oral toxicity of Photorhabdus
luminescens W14 toxin complexes in
Escherichia coli. Appl. Environ.
Microbiol 67:5017–5024.
Waterfield N, Hares M, Yang G, Dowling A, dan Ffrench-Constant R. 2005. Potentiation and cellular phenotypes of the insecticidal toxin complexes of Photorhabdus bacteria. Cell
Microbiol 7: 373–382.
Yuwono Triwibowo. 2005. Biologi
17
18
Lampiran 1 Alur metode penelitian
Kultur bakteri
Serratia marcescens
Pemisahan sel bakteri
Supernatan yang
mengandung protein
insektisidal
Pengendapan
ammonium
sulfat
Kromatografi
kolom dengan eluen
KCl 300 mM
Protein
nondialisis
Fraksi
didialisis
Protein
dialisis
Fraksi dengan puncak
terbaik ditampung
protein Fraksi A dan B
Bioasai
menggunakan
19
Lampiran 2 Bagan uji toksisitas protein insektisidal
Serratia marcescens
terhadap
Larva Tenebrio molitor
Protein insektisidal
S. marcescens
yang
telah dimurnikan
Protein
Nondialisis
Protein
Dialisis
Protein
Fraksi A
Protein
Fraksi B
Masing-masing protein di buat ke dalam 7 konsentrasi (dosis) :
0.5 µg/ml, 1 µg/ml, 2.5 µg/ml, 5 µg/ml, 10 µg/ml, 20 µg/ml, dan 40
µg/ml.
Dilakukan tiga
ulangan untunk setiap
dosis
Pakan buatan luntuk larva
Protein insektisidal S.
marcescens
Lima ekor larva T.
molitor instar II-III
diinveskan pada setiap ulangan dosis
Pengamatan dilakukan selama 7
20
Lampiran 3 Kurva pertumbuhan
Serratia marcescens
(Hardjito
et al
2002)
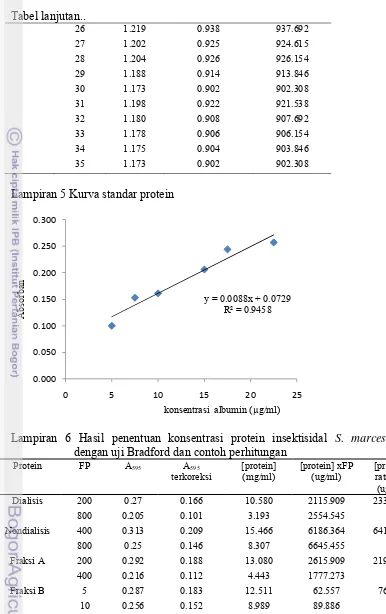
Lampiran 4 Data pengukuran konsentrasi protein insektisidal hasil kromatografi
penukar ion pada A280
Elusi KCl
No Fraksi A280 [protein] (mg/ml) [protein] (u/ml)
300 mM 1 1.206 0.928 927.692
2 1.195 0