VERIFIKASI METODE ANALISIS SERAT PANGAN DENGAN
METODE AOAC DAN ASP TERHADAP PARAMETER
REPEATABILITY, SELEKTIVITAS, DAN RUGGEDNESS
SKRIPSI
KANDI JELITA
F24063180
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
VERIFICATION OF DIETARY FIBER ANALYSIS METHOD AT
REPEATABILITY, SELECTIVITY, AND RUGGEDNESS PARAMETERS
USING AOAC AND ASP METHODS
Kandi Jelita,C. Hanny Wijaya, and Didah Nur Faridah
Department of Food Science and Technology, Faculty of Agricultural Technology, Bogor Agricultural University, IPB Darmaga Campus PO Box 220, Bogor, West Java,
Indonesia.
Phone 62 251 8624622, e-mail: [email protected] ABSTRACT
Methods of analyzing dietary fiber (DF) have undergone extensive development in the last two decades. At present, the most widely used methods are the enzymatic-gravimetric AOAC official method and the enzymatic-chemical Englyst method. Enzymatic-gravimetric was used in this research because of its economic value. New modifications of the AOAC method are continuously being proposed by researchers. We need to ensure that the method has good performance by verification method.
The purpose of this study was to verified enzymatic-gravimetric method for analyzing DF. Four kind of food, raw peanut, raw soybean, carrot, and oat were analyzed for total DF, soluble DF and insoluble DF content by two current enzymatic-gravimetric methods; AOAC Official Methods (1999) and the Asp Method (1992). The results obtained by these two methods were compared. Results for raw soybean were significantly different while other samples were relatively similar. Different enzyme used in two methods leads to variance of DF content for high protein sample. Asp method could efficiently hydrolyze protein because it has two enzyme hydrolyzing step. Ruggedness test was carried out to find the best concentration of ethanol for precipitate SDF between 95% and 78%. Ethanol 78% could precipitate SDF.
KANDI JELITA. F24063180. Verifikasi Metode Analisis Serat Pangan Dengan Metode AOAC Dan Asp Terhadap Parameter Repeatability, Selektivitas, Dan Ruggedness. Di bawah bimbingan C. Hanny Wijaya dan Didah Nur Faridah. 2011
RINGKASAN
Analisis serat pangan diperlukan untuk mengetahui kandungan serat pangan dalam produk pangan. Analisis serat pangan yang berkembang saat ini terbagi pada dua kelompok utama, yaitu enzimatik gravimetri dan enzimatik kimia. Metode yang digunakan dalam penelitian ini adalah metode enzimatik gravimetri dengan alasan lebih mudah dan ekonomis.
Penelitian dilakukan dengan membandingkan hasil analisis serat pangan antara metode AOAC dan metode Asp untuk menentukan metode terbaik dalam menganalisis serat pangan. Metode terbaik dipilih berdasarkan hasil verifikasi, antara lain memiliki repeatability yang baik, yaitu memiliki nilai RSD (Relative Standard Deviation) maksimal 2/3 RSDR (Horwitz), dan memiliki nilai serat pangan
yang berada di dalam rentang data sekunder. Selain itu, ruggedness test dilakukan untuk mengetahui konsentrasi etanol yang dapat mengendapkan serat pangan larut (SDF). Konsentrasi etanol yang digunakan ialah 78% dan 95%. Matriks sampel yang digunakan dalam penelitian ini ialah kacang kedelai, kacang tanah, oat, dan wortel.
Ketelitian hasil analisis SDF tidak dapat diterima secara statistik karena sebagian besar nilai RSD yang lebih besar dari nilai RSD maksimal yang dapat diterima, yaitu 2/3 RSDR pada metode
AOAC dan Asp. Rataan TDF dan IDF kacang kedelai dengan metode AOAC ialah 59.42 dan 57.65%, dengan nilai standar deviasi (SD) sebesar 0.10 dan 0.23%. Nilai ini berbeda nyata jika dibandingkan dengan rataan yang diperoleh menggunakan metode Asp, yaitu 35.22 dan 30.43% dengan nilai SD sebesar 0.23 dan 0.25%. Rataan TDF dan IDF kacang tanah dengan metode AOAC ialah 12.49 dan 11.48%, dengan nilai SD sebesar 0.07 dan 0.02%. Tidak berbeda nyata dengan rataan yang diperoleh menggunakan metode Asp, yaitu 12.22 dan 11.29% dengan nilai SD sebesar 0.04 dan 0.03%. Nilai TDF dan IDF oat metode AOAC ialah 13.64 dan 8.46% dengan SD 0.10 dan 0.03%, sementara dengan metode Asp menghasilkan nilai 11.84 dan 7.28% dengan SD 0.10 dan 0.07%. Nilai TDF dan IDF wortel metode AOAC ialah 23.69 dan 9.19% dengan SD 0.08 dan 0.10%, sementara dengan metode Asp menghasilkan nilai 24.30 dan 9.50% dengan SD 0.21 dan 0.13%. Nilai serat pangan tiap sampel yang dianalisis menggunakan metode AOAC dan Asp kemudian dibandingkan dengan data sekunder.
Kacang kedelai yang mewakili bahan pangan tinggi protein menghasilkan nilai serat pangan yang lebih tinggi dibandingkan batas atas rentang data sekunder pada metode AOAC. Hal ini diduga karena tidak sempurnanya proses hidrolisis yang terjadi selama analisis. Sementara itu, nilai serat pangan pada sampel kacang kedelai yang dianalisis menggunakan metode Asp berada dalam rentang data sekunder karena memiliki dua tahap hidrolisis protein oleh enzim. Kacang tanah yang mewakili bahan pangan tinggi lemak memiliki nilai serat pangan yang berada dalam rentang data sekunder, baik yang dianalisis menggunakan metode AOAC maupun Asp. Tingginya kadar lemak yang terkandung di dalam sampel kacang tanah tidak mengakibatkan data analisis memiliki variasi yang besar. Begitu pula yang terjadi pada sampel oat dan wortel, tingginya kandungan karbohidrat dan air yang terdapat di dalam sampel tidak mempengaruhi keakuratan analisis jika dibandingkan dengan data sekunder.
VERIFIKASI METODE ANALISIS SERAT PANGAN DENGAN
METODE AOAC DAN ASP TERHADAP PARAMETER
REPEATABILITY
, SELEKTIVITAS, DAN
RUGGEDNESS
SKRIPSI
Sebagai salah satu syarat memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Ilmu dan Teknologi Pangan,
Fakultas Teknologi Pertanian,
Institut Pertanian Bogor
Oleh
KANDI JELITA
F24063180
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Verifikasi Metode Analisis Serat Pangan Dengan Metode AOAC
Dan Asp Terhadap Parameter
Repeatability
, Selektivitas, Dan
Ruggedness
Nama
: Kandi Jelita
NIM
: F24063180
Menyetujui,
Dosen Pembimbing I,
Dosen Pembimbing II,
(Prof. Dr. Ir. C. Hanny Wijaya, M.Sc )
(Dr. Didah Nur Faridah, S.TP, M.Si)
NIP 196004220 198303 .2. 003
NIP 19711117 199802 .2. 001
Mengetahui :
Plt. Ketua Departemen,
(Dr. Ir. Nurheni Sri Palupi, M.Si)
NIP 19610802 198703.2.002
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul Verifikasi Metode Analisis Serat Pangan Dengan Metode AOAC Dan Asp Terhadap Parameter
Repeatability, Selektivitas, Dan Ruggednessadalah hasil karya saya sendiri dengan arahan Dosen Pembimbing Akademik, dan belum diajukan dalam bentuk apapun pada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Juni 2011
Yang membuat pernyataan
© Hak cipta milik Kandi Jelita, tahun 2011
Hak cipta dilindungi
Dilarang mengutip dan memperbanyak tanpa izin tertulis dari Institut Pertanian
Bogor, sebagian atau seluruhnya dalam bentuk apapun, baik cetak, fotokopi,
BIODATA PENULIS
iii
KATA PENGANTAR
Puji dan syukur dipanjatkan ke hadapan Allah SWT atas karuniaNya sehingga skripsi ini berhasil diselesaikan. Penelitian dengan judul Perbandingan Metode Analisis Serat Pangan Secara Enzimatik-Gravimetri antara Metode AOAC dan Metode Asp dilaksanakan di laboratorium Ilmu dan Teknologi Pangan, Institut Pertanian Bogor sejak bulan Juni sampai Desember 2010.
Dengan telah selesainya penelitian hingga tersusunnya skripsi ini, penulis ingin menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada:
1. Kedua orang tua, Ir. Al-Qudri A.Gani, MM dan Dra. Lailatul Fadhliah, yang senantiasa
memberikan dorongan serta doa selama penulis melaksanakan kuliah.
2. Prof. Dr. Ir. C. Hanny Wijaya, M.Sc. sebagai dosen pembimbing utama.
3. Dr. Didah Nur Faridah, S.TP, M.Si atas saran dan bantuan moril yang diberikan selaku dosen pembimbing pendamping.
4. Segenap teknisi laboratorium ITP IPB yang telah membantu penulis dalam pelaksanaan penelitian.
5. Lab Jasa Analisis (LJA) yang telah mendanai penelitian yang dilakukan oleh penulis.
6. Ir. Sri Endah Agustina, M.S. dan Dr. Rimbawan yang telah memberikan saran dan dukungan moril
selama penulis melakukan studi di Fakultas Teknologi Pertanian.
7. Seluruh teman, sahabat, adik dan kakak kelas yang telah member dukungan yang tulus serta kegembiraan yang tak terkira.
8. Pemerintah Aceh yang telah membiayai kuliah penulis selama empat tahun.
Akhirnya penulis berharap semoga tulisan ini bermanfaat dan memberikan kontribusi yang nyata terhadap perkembangan ilmu pengetahuan di bidang analisis pangan.
Bogor, Juni 2011
iv
DAFTAR ISIHalaman
DAFTAR ISI ... iv
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I.PENDAHULUAN ... 1
II. TINJAUAN PUSTAKA ... 3
2.1 SERAT PANGAN (DIETARY FIBER) ... 3
2.2 PRINSIP ANALISIS SERAT PANGAN METODE AOAC DAN ASP... 5
2.3 VALIDASI DAN VERIFIKASI METODE ... 11
2.4 FAKTOR-FAKTOR KESALAHAN PADA ANALISIS SERAT PANGAN METODE ENZIMATIK-GRAVIMETRI ... 13
2.5 PENGOLAHAN DATA ... 14
III.METODE PENELITIAN ... 17
3.1 BAHAN DAN ALAT ... 17
3.2 METODE PENELITIAN ... 17
IV. HASIL DAN PEMBAHASAN ... 22
4.1 TOTAL SERAT PANGAN ... 22
4.2 SERAT PANGAN TIDAK LARUT (IDF) DAN SERAT PANGAN LARUT (SDF) ... 25
4.3 VERIFIKASI METODE TERHADAP ASPEK REPEATABILITY ... 27
4.4 VERIFIKASI METODE TERHADAP ASPEK SELEKTIVITAS ... 29
4.5 RUGGEDNESS TEST ... 30
V.KESIMPULAN DAN SARAN ... 31
5.1 KESIMPULAN ... 31
5.2 SARAN ... 31
DAFTAR PUSTAKA ... 32
v
DAFTAR TABELHalaman
1 Tipe serat pangan ... 4
2 Data kadar air dan kadar lemak sampel sebelum dan setelah proses persiapan sampel ... 5
3 Perbedaan prosedur analisis serat pangan metode AOAC dan Asp ... 10
4 Data proksimat sampel ... 11
5 Verifikasi metode pengujian ... 12
6 Nilai TDF sampel menggunakan metode AOAC dan Asp ... 23
7 Data sekunder serat pangan pada kacang kedelai, kacang tanah, oat, dan wortel ... 23
8 Nilai IDF dan SDF sampel menggunakan metode AOAC dan Asp ... 25
9 Data serat pangan sampel dengan metode AOAC... 27
10 Data serat pangan sampel dengan metode Asp ... 27
vi
DAFTAR GAMBARHalaman
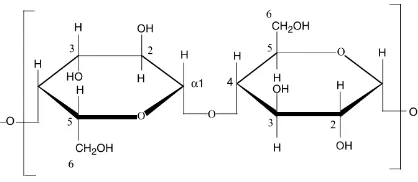
1. Ikatan α (1-4) antar monomer glukosa pada pati dan glikogen ... 3
2. Ikatan β (1-4) antar unit glukosa dalam selulosa ... 4
3. Reaksi hidrolisis pati oleh enzim termamyl ... 6
4. Mekanisme reaksi enzim protease ... 8
5. Reaksi pemecahan ikatan peptida oleh enzim pepsin menghasilkan asam amino ... 9
6. Diagram Ishikawa faktor-faktor kesalahan analisis serat pangan metode Enzimatik- gravimetri ... 14
7. Diagram proses evaluasi metode analisis serat pangan terhadap parameter repeatability .. 21
8. Diagram proses evaluasi metode analisis serat pangan terhadap parameter selektivitas .... 21
9. Diagram proses evaluasi metode analisis serat pangan terhadap parameter ruggedness .... 22
10. Perbandingan nilai RSD dan RSDR (Horwitz) TDF metode AOAC ... 28
11. Perbandingan nilai RSD dan RSDR (Horwitz) TDF metode Asp ... 28
12. Perbandingan nilai RSD dan RSDR (Horwitz) IDF metode AOAC ... 28
13. Perbandingan nilai RSD dan RSDR (Horwitz) IDF metode Asp... 28
14. Perbandingan nilai RSD dan RSDR (Horwitz) SDF metode AOAC...……. ... 28
15. Perbandingan nilai RSD dan RSDR (Horwitz) SDF metode Asp ... 28
vii
DAFTAR LAMPIRANHalaman
1. Contoh perhitungan serat pangan, SD, dan RSD ... 36
2. Analisis TDF, SDF, dan IDF metode AOAC ... 37
3. Uji t dan F untuk TDF kacang kedelai metode AOAC dan metode Asp ... 43
4. Uji t dan F untuk TDF kacang tanah metode AOAC dan metode Asp ... 44
5. Uji t dan F untuk TDF oat metode AOAC dan metode Asp ... 45
6. Uji t dan F untuk TDF wortel metode AOAC dan metode Asp ... 46
7. Uji t dan F untuk IDF kacang kedelai metode AOAC dan metode Asp ... 47
8. Uji t dan F untuk IDF kacang tanah metode AOAC dan metode Asp ... 48
9. Uji t dan F untuk IDF oat metode AOAC dan metode Asp ... 49
10. Uji t dan F untuk IDF wortel metode AOAC dan metode Asp ... 50
11. Uji t dan F untuk SDF kacang kedelai metode AOAC dan metode Asp ... 51
12. Uji t dan F untuk SDF kacang tanah metode AOAC dan metode Asp ... 52
13. Uji t dan F untuk SDF oat metode AOAC dan metode Asp ... 53
14. Uji t dan F untuk SDF wortel metode AOAC dan metode Asp ... 54
15. Uji t dan F untuk ruggenness test TDF kacang kedelai (78%) dan metode Asp (95%) ... 55
16. Uji t dan F untuk ruggenness test TDF kacang tanah (78%) dan metode Asp (95%) .... 56
17. Uji t dan F untuk ruggenness test TDF oat (78%) dan metode Asp (95%) ... 57
18. Uji t dan F untuk ruggenness test TDF wortel (78%) dan metode Asp (95%) ... 58
19. Data serat pangan sampel dengan metode AOAC dan Asp ... 59
20. Data serat pangan ruggedness test ... 61
21. Instruksi kerja analisis total serat pangan metode enzimatik gravimetri ... 62
I.
PENDAHULUAN
1.
LATAR BELAKANG
Serat pangan adalah komponen pangan atau bahan pangan yang tidak dapat dicerna oleh enzim dalam pencernaan tubuh manusia. Sebagian besar serat pangan merupakan polisakarida yang berasal dari tumbuhan, sementara sebagian lainnya ialah gum, selulosa termodifikasi, mucilage, oligosakarida, dan pektin. Berdasarkan kelarutannya dalam air, serat pangan terbagi menjadi dua jenis yaitu serat pangan larut (SDF) dan serat pangan tidak larut (IDF). SDF terdiri
dari pektin dan turunannya, gum, serta mucilage. Sementara IDF terdiri dari selulosa,
hemiselulosa, lignin dan selulosa termodifikasi.
Manfaat serat pangan bagi kesehatan telah dipubikasikan di berbagai literatur ilmiah. Serat pangan yang dikonsumsi dalam jumlah yang cukup dapat mengurangi risiko kanker kolon dan dapat menjaga kadar lemak dalam darah sehingga dapat mengurangi risiko obesitas, hipertensi, dan penyakit jantung. Beberapa tipe serat pangan seperti pektin dan hidrokoloid mampu memperlambat absorpsi D-glukosa dan mengurangi sekresi insulin sehingga sangat berguna bagi penderita diabetes. Jumlah Dietary Reference Intake (DRI) serat pangan adalah sebesar 25 g per 2000 kcal per hari (BeMiller, 2009).
Kadar serat pangan dapat diketahui dari hasil analisis dengan menggunakan metode analisis baik secara enzimatik gravimetri maupun enzimatik kimia. Analisis serat pangan yang digunakan dalam penelitian ini ialah secara enzimatik gravimetri karena lebih mudah dan ekonomis. Dari beberapa metode analisis secara enzimatik gravimetri, metode yang dipilih ialah metode AOAC Official Method 985.29; 993.19; dan 991.42 (1999) sebagai metode standar dan metode Asp (1992) sebagai metode yang digunakan untuk menganalisis kadar serat pangan dengan sampel yang sama.
Metode Asp dipilih karena pada metode ini, enzim yang digunakan berbeda dengan metode AOAC untuk menghidrolisis pati dan protein, yaitu pepsin dan pankreatin. Enzim yang digunakan pada metode Asp merupakan enzim fisiologis, yaitu enzim yang terdapat di saluran pencernaan tubuh manusia. Sementara metode AOAC menggunakan enzim protease dan amiloglukosidase. Selain perbedaan enzim yang digunakan, metode Asp juga lebih ekonomis dibandingkan metode AOAC
Sebelum metode analisis standar diterapkan di laboratorium, dilakukan terlebih dahulu tahapan verifikasi metode. Verifikasi metode dilakukan terhadap metode standar AOAC Official Method 985.29; 993.19; dan 991.42 (1999) dan Asp (1992) dengan parameter yaitu repeatability, selektivitas, dan ruggedness. Verifikasi terhadap semua parameter tersebut diharapkan dapat menghasilkan prosedur analisis serat pangan yang dapat diterapkan oleh laboratorium. Verifikasi terhadap parameter repeatability dinilai dari standar deviasi analisis serat pangan terhadap matriks sampel yang dilakukan sebanyak tujuh hingga sepuluh kali. Sementara itu, verifikasi terhadap parameter selektivitas dilakukan dengan membandingkan kadar kontaminan (impurities) yang terdapat di residu akhir analisis serat pangan antara metode AOAC dan Asp. Kontaminan yang akan dibandingkan ialah kadar abu dan kadar protein. Verifikasi terhadap
parameter ruggedness dilakukan untuk mengevaluasi salah satu titik kritis metode, yaitu
2
Prosky et al. (1988) menggunakan etanol dengan konsentrasi 78% sementara AOAC dan Asp
menggunakan konsentrasi 95%.
Matriks sampel yang digunakan untuk menganalisis kadar serat pangan dalam penelitian ini ialah kacang kedelai, kacang tanah, oat, dan wortel. Kacang kedelai dipilih karena memiliki kadar protein yang tinggi. Kacang tanah memiliki kadar lemak yang tinggi, oat merupakan makanan sumber karbohidrat, sementara wortel termasuk dalam jenis sayur dan buah. Pemilihan matriks sampel tersebut bertujuan mempelajari pengaruh perbedaan komposisi kimia pada berbagai matriks sampel dengan menggunakan metode yang berbeda (AOAC dan Asp).
2.
TUJUAN PENELITIAN
II.
TINJAUAN PUSTAKA
2.1
SERAT PANGAN (
DIETARY FIBER
)
Deskripsi serat pangan oleh Trowell yang diacu dalam Cummings & Englyst (1991) menyebutkan bahwa serat pangan merupakan bagian dari makanan yang diperoleh dari dinding sel tumbuhan. Berdasarkan aspek fisiologi dan nutrisi, serat pangan meliputi semua jenis polisakarida dan lignin, serta beberapa jenis oligosakarida, yang tahan terhadap enzim pencernaan di jalur gastrointestinal atas. Serat pangan dapat didefinisikan sebagai ingredien pangan fungsional karena tidak dapat dicerna oleh enzim pencernaan manusia dan mampu mempengaruhi satu atau lebih fungsi tubuh sehingga dapat memberikan manfaat bagi kesehatan (Diplock et al. 1999).
Selama lebih dari dua dekade, manfaat serat pangan telah banyak dipublikasi. Serat pangan berperan dalam mengatur motilitas saluran gastrointestinal, mempengaruhi metabolisme glukosa dan lemak, memperlancar buang air besar, menstimulasi aktivitas metabolisme bakteri, detoksifikasi terhadap zat-zat yang berada dalam kolon, serta berkontribusi dalam menjaga kestabilan ekosistem di kolon dan integritas mukosa intestinal (Guillon et al. 2000).
Ditinjau dari sudut geografis, konsumsi serat pangan cukup bervariasi. Di negara maju, seperti Amerika Serikat, konsumsi serat relatif lebih rendah dibandingkan masyarakat di negara lain. Sebagai contoh, rata-rata asupan serat pangan di Amerika Serikat hanya berkisar antara 12 hingga 15 g per hari. Nilai ini jauh lebih kecil dibandingkan rekomendasi World Health Organization (WHO), yaitu sekitar 25 hingga 40 g per hari. Sementara penduduk Afrika diketahui mengonsumsi serat sebanyak 50 g per hari (Jalili et al. 2001).
Polisakarida terdiri atas polisakarida yang dapat dicerna dan tidak dapat dicerna. Polisakarida yang dapat dicerna memiliki ikatan α (1-4) seperti yang terdapat pada pati serta beberapa jenis glikogen dalam daging. Ikatan ini dapat dicerna oleh enzim amilase yang disekresikan oleh kelenjar saliva dan pankreas. Selain ikatan α (1-4), terdapat titik percabangan dalam rantai pati dan glikogen yaitu ikatan α (1-6) yang dapat dihidrolisis oleh enzim α (1-6) dextrinase (isomaltase) yang disekresikan oleh pankreas. Sebaliknya, polisakarida yang tidak dapat dicerna memiliki ikatan β (1-4). Enzim yang disekresikan oleh kelenjar saliva dan pankreas tidak dapat
menghidrolisis ikatan kovalen β (1-4). Meskipun polisakarida dengan jenis ikatan β (1-4) bersifat resistan terhadap pencernaan manusia, bakteri yang terdapat pada usus besar mampu memetabolisme serat dan menghasilkan asam lemak rantai pendek (asam asetat, propionat dan butirat) sebagai metabolit. Ikatan antar monomer glukosa pada pati dan glikogen dapat dilihat pada Gambar 1 dan 2.
4
Gambar 2. Ikatan β (1-4) antar unit glukosa dalam selulosa (Jalili et al. 2001)
Serat pangan berdasarkan kelarutannya terhadap air terbagi pada dua jenis. Pertama serat pangan larut (SDF) yang terdiri dari pektin dan turunannya, gum, serta mucilage. Sementara serat tidak larut (IDF) terdiri dari selulosa, hemiselulosa, lignin dan selulosa termodifikasi. Sumber
makanan yang kaya akan SDF ialah buah-buahan, polong-polongan, oat dan beberapa jenis
sayur-sayuran. Di samping itu, IDF banyak terdapat di dalam sereal, biji-bijian, polong-polongan serta sayur-sayuran. Keterangan lebih detail tentang tipe serat pangan dapat dilihat pada Tabel 1.
Tabel 1. Tipe Serat Pangana
Tipe Karakteristik Sumber Derajat
Degradasi* Larut
Pektin Kaya akan asam galakturonat,
rhamnosa, arabinosa, galaktosa; karakteristik lapisan tengah dan dinding luar Serealia utuh, polong-polongan, kol, umbi-umbian, apel +
Gum Sebagian besar terbentuk oleh
monomer heksosa dan pentosa
Oatmeal, kacang kering, beberapa jenis polong
+++
Mucilage Disintesa oleh sel tumbuhan dan dapat mengandung glikoprotein
Bahan tambahan makanan
+++
Tidak Larut
Selulosa Struktur dasar dinding sel;
hanya terdiri dari monomer glukosa
Serealia utuh, bekatul, kol dan sejenisnya, kacang kapri, buncis, apel, umbi-umbian
+
Hemiselulosa Komponen dinding sel primer
dan sekunder; tipe yang berbeda terdiri dari unit monomer yang berbeda pula
Bekatul, sereal, biji utuh
+
Lignin Terdiri dari alkohol aromatik;
perekat, dan komponen dinding sel lainnya
Sayuran, gandum 0
5
2.2
PRINSIP ANALISIS SERAT PANGAN METODE AOAC DAN ASP
Metode analisis yang dikembangkan oleh AOAC Official Methods dan Asp et al. (1992) adalah metode yang dipilih pada penelitian ini. Kedua metode ini termasuk dalam kategori analisis serat pangan secara enzimatik gravimetri. Enzimatik gravimetri lebih ekonomis dibandingkan dengan metode enzimatik kimia.
Sebelum keempat sampel dianalisis kadar serat pangannya, sampel terlebih dahulu diberikan perlakuan pendahuluan yang sesuai dengan karakteristik sampel. Karakteristik sampel dibedakan menjadi tiga jenis, antara lain sampel tinggi lemak, sampel basah, dan sampel kering. Teknik persiapan sampel pada metode AOAC tidak berbeda dengan metode Asp.
Sampel kacang kedelai dan kacang tanah merupakan sampel yang memiliki kadar lemak yang tinggi, yaitu lebih dari 10%. Kedua sampel ini membutuhkan ekstraksi lemak terlebih dahulu melalui ekstraksi pelarut menggunakan 25 bagian (v/b) petroleum eter atau heksana. Dalam penelitian ini solven yang digunakan adalah petroleum eter karena memiliki titik didih
yang rendah, yaitu 35-38oC sehingga lebih mudah dipisahkan dari bahan pangan melalui
penguapan atau pemanasan. Selain itu, petroleum eter lebih bersifat hidrofobik, selektif terhadap lemak, murah, tidak higroskopis, dan tidak mudah terbakar dibandingkan dengan etil eter. Komposisi utama petroleum eter adalah pentana dan heksana (Min dan Ellefson, 2010). Pentana dan heksana bersifat sinergis dalam mengekstrak lemak dan pencampuran keduanya mengakibatkan petroleum eter bersifat lebih stabil (Fialkov dan Chumak, 2000). Ekstraksi lemak dengan petroleum eter dilakukan sebanyak tiga kali, lalu petroleum eter dibiarkan menguap selama 15 menit. Sampel kemudian dikeringkan sekitar 12 jam pada oven bersuhu 105oC hingga kadar air sampel kurang dari 5%.
Ekstraksi lemak yang dilakukan pada penelitian ini termasuk ekstraksi pelarut (liquid-liquid extraction). Ekstraksi pelarut didefinisikan sebagai proses pemisahan suatu zat dari sebuah campuran dengan mencampurkan dalam sebuah pelarut yang mampu melarutkan zat yang diinginkan tetapi tidak melarutkan zat lainnya (Holden 1999). Data hasil analisis serat pangan dikoreksi oleh selisih bobot akibat penghilangan lemak dan air selama proses persiapan sampel.
Sampel wortel merupakan sampel yang termasuk dalam jenis sampel basah. Oleh karena itu, sampel ini dikeringkan terlebih dahulu pada suhu 70oC menggunakan oven vakum hingga kadar air sampel kurang dari 5% karena memiliki zat yang relatif sensitif terhadap panas (Devahastin dan Suvarnakuta 2008). Sampel kemudian diblender dan diayak agar ukuran sampel homogen, yaitu 40-50 mesh.
Sampel oat merupakan jenis sampel basah sahingga harus dikeringkan terlebih dahulu
menggunakan oven pada suhu 105oC hingga kadar air sampel kurang dari 5%. Berbeda dengan
sampel wortel yang sensitif terhadap panas, sampel oat tidak memiliki substansi yang sensitif terhadap panas sehingga air dalam sampel dapat diuapkan menggunakan suhu yang relatif lebih tinggi. Sampel kemudian diblender dan diayak agar ukuran sampel homogen, yaitu 40-50 mesh.
6
Tabel 2. Data kadar air dan kadar lemak sampel sebelum dan setelah proses persiapan sampel
Sampel Kadar air (%) Kadar Lemak (%)
Awal Akhir Awal Akhir
Kacang Kedelai 11.67 1.24 16.98 1.31
Kacang Tanah 15.02 1.36 48.01 2.97
Wortel* 78.98 1.25 0.23 -
*tidak dilakukan ekstraksi terhadap lemak
Sampel yang telah homogen disimpan di dalam kemasan tertutup dan kedap udara. Sampel
dikemas sebanyak lima gram per kemasan. Silika gel (SiO2.H2O) diletakkan di dalam kemasan
agar dapat menyerap air. Silika gel menyerap air melalui proses adsorpsi dan kondensasi kapiler
(Karukstis dan Van Hecke 2003). Selanjutnya sampel disimpan di dalam freezer bersuhu 0 –
(-20oC). Metode penyimpanan ini bertujuan menurunkan aktivitas enzim dan pertumbuhan
mikroba yang masih ada di dalam sampel (Morawicki 2009). Aktivitas enzim dapat menurun akibat proses denaturasi protein oleh panas, perlakuan pH, atau salting out.
Pertumbuhan mikroba juga dapat dihambat melalui proses pengeringan dan penambahan bahan pengawet. Kadar bahan pengawet yang digunakan ditentukan berdasarkan kemungkinan kontaminasi, kondisi penyimpanan, lama penyimpanan, serta analisis yang akan dilakukan terhadap sampel. Kadar air yang rendah pada sampel yang digunakan dalam penelitian ini menyebabkan penambahan pengawet dalam sampel selama penyimpanan tidak dibutuhkan. Nilai Aw yang rendah dapat menghambat pertumbuhan mikroba yang dapat menyebabkan kerusakan sampel.
Persamaan lainnya antara metode AOAC dan Asp terletak pada prosedur hidrolisis pati
menggunakan enzim α-amilase tahan panas (Termamyl). Sampel terlebih dahulu dipanaskan
(95-100oC selama 30-35 menit) agar granula pati tergelatinisasi sehingga lebih mudah dihidrolisis oleh enzim. Suspensi pati yang dipanaskan akan mengembang hingga volume tertentu serta menyerap air. Hal tersebut berakibat pada rentannya pati terhadap zat kimia atau enzim yang ada di sekelilingnya (Uhlig 1998). Enzim yang tahan panas dibutuhkan agar enzim tidak terdenaturasi selama proses gelatinisasi sampel. Selama proses ini, terjadi pemotongan terhadap
molekul pati pada ikatan α (1-4). Pemotongan oleh enzim termamyl menghasilkan glukosa, maltosa dan oligosakarida (Ceirwyn, 1999).
Mekansime reaksi enzim termamyl dapat dilihat pada Gambar 3. Enzim termamyl memiliki gugus karboksil dan gugus nitrogen (imidazol) pada sisi aktifnya. Substrat (pati) membentuk kompleks dengan enzim termamyl. Karboksil anion kemudian menyerang substrat pada posisi C nomor 1. Produk antara yang terbentuk ialah glukosil-enzim yang selanjutnya dipisahkan melalui reaksi deglukosilasi. Gugus imidazol berperan dalam reaksi deglukosilasi dengan mengikat proton pada air sehingga molekul air menjadi OH- yang menyerang C1 pada kompleks glukosil-enzim. Hasil reaksi berupa glukosa, maltosa dan oligosakarida yang memiliki C1 dengan
7
Gambar 3. Reaksi hidrolisis pati oleh enzim termamyl (Naz 2002)
Komponen penyebab utama ketidakakuratan analisis serat pangan ialah pati (BeMiller 2010). Proses penghilangan pati yang tidak sempurna akan meningkatkan jumlah residu akhir yang berarti sebagai kesalahan hasil analisis. Oleh karena itu, pada prosedur analisis serat pangan metode AOAC dan Asp terdapat tahap hidrolisis pati lanjutan menggunakan enzim. Tahap ini bertujuan untuk memastikan bahwa pati yang terdapat di dalam sampel terhidrolisis dengan sempurna. Akan tetapi, enzim yang digunakan pada kedua metode tersebut berbeda satu sama lain. Enzim yang digunakan pada metode AOAC untuk menghidrolisis pati ialah amiloglukosidase, sementara pada metode Asp digunakan enzim pankreatin.
Enzim amiloglukosidase merupakan salah satu enzim amilase. Produksi enzim
amiloglukosidase komersial dapat dilakukan dengan menggunakan mikroba, yaitu Aspergillus
sp. dan Rhizopus sp. Enzim yang digunakan dalam penelitian ini berasal dari Aspergillus niger,
karena selain dapat memecah pati pada ikatan α (1-4), enzim yang berasal dari A. niger juga
mampu memecah ikatan α (1-6) (Uhlig 1998). Enzim ini memecah substrat (pati) menjadi glukosa dari C terluar dari strukstur pati. Hasil reaksi pemecahan pati ialah glukosa yang
memiliki konfigurasi β. Kondisi optimumnya ialah pada rentang pH 4.0-4.4 dan suhu 58-65oC (Naz 2002).
Enzim pankreatin merupakan campuran enzim lipase, protease, dan amilase. Oleh karena itu, selain mampu menghidrolisis lemak, enzim ini juga mampu menghidrolisis protein dan pati (Johnson dan Hillier 2008). Enzim pankreatin memiliki aktivitas optimum pada rentang pH antara 6.0 hingga 7.0 (Uhlig 1998).
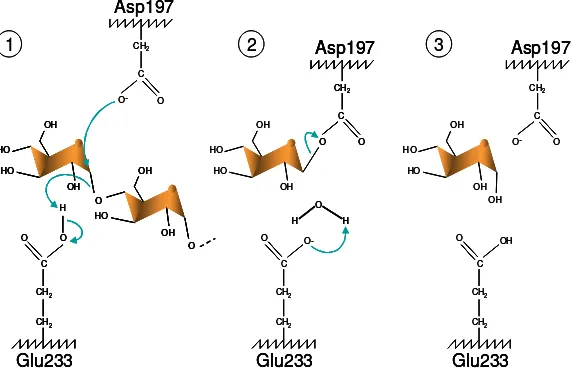
Selain enzim yang digunakan untuk menghidrolisis pati, perbedaan lainnya antara metode AOAC dan metode Asp ialah penggunaan enzim untuk menghidrolisis protein. Metode AOAC menggunakan enzim protease, sementara metode Asp menggunakan enzim fisiologis, yaitu pepsin dan pakreatin. Enzim fisiologis ialah enzim yang merupakan bagian dari enzim pencernaan di dalam tubuh manusia. Penggunaan enzim fisiologis didasarkan pada definisi serat pangan sebagai komponen yang tidak dapat dicerna oleh enzim pencernaan manusia (Trowell 1974). C O-O CH2 CH2 Glu233 C O O CH2 Asp197 HO OH HO OH O H H C OH O CH2 CH2 Glu233 C -O O CH2 Asp197 HO OH HO HO OH C O O CH2 CH2 Glu233 C -O O CH2 H HO OH HO O OH OH HO HO O Asp197
1 2 3
C O-O CH2 CH2 Glu233 C O O CH2 Asp197 HO OH HO OH O H H C O-O CH2 CH2 Glu233 C O O CH2 Asp197 C O O CH2 Asp197 HO OH HO OH O H H O H H C OH O CH2 CH2 Glu233 C -O O CH2 Asp197 HO OH HO HO OH C OH O CH2 CH2 Glu233 C -O O CH2 Asp197 HO OH HO HO OH C O O CH2 CH2 Glu233 C -O O CH2 H HO OH HO O OH OH HO HO O Asp197 C O O CH2 CH2 C O O CH2 CH2 Glu233 C -O O CH2 H HO OH HO O OH HO OH HO O OH OH HO O OH OH HO HO O OH HO HO O HO HO O Asp197
8
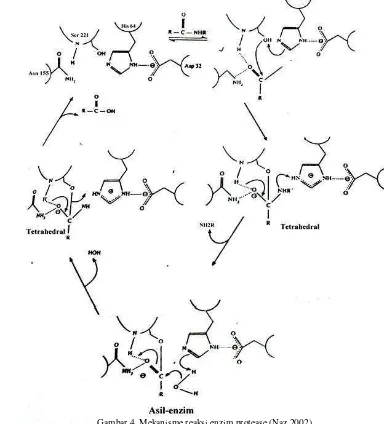
Enzim protease yang digunakan dalam analisis serat pangan metode AOAC berasal dari Bacillus subtilis. Hidrolisis menggunakan enzim protease bertujuan menghidrolisis protein yang terdapat di dalam sampel. Enzim protease memutuskan ikatan peptida pada struktur protein. Mekanisme reaksi pemutusan ikatan peptida terdiri atas reaksi alkilasi dan deasilasi. Naz (2002) menjelaskan tahapan reaksi tersebut sebagai berikut: 1) pembentukan kompleks enzim-protein dengan ikatan kovalen yang bersifat reversible, 2) pembentukan produk antara tetrahedral akibat penyerangan oleh serin 221 yang bersifat reaktif terhadap C karbonil. 3) protonasi pada substrat yang menyebabkan berubahnya struktur tetrahedral menjadi kompleks asil-enzim. 4) produk antara tetrahedral terbentuk kembali akibat penyerangan H2O terhadap kompleks asil-enzim. 5)
aktivitas His 64-Ser 221 mengakibatkan terjadinya pembebasan sisi asilasi pada substrat sehingga menghasilkan asam amino. Mekanisme reaksi enzim protease dapat dilihat pada Gambar 4. Protease aktif pada kondisi pH antara 6-8 (Barberis et al. 2008).
9
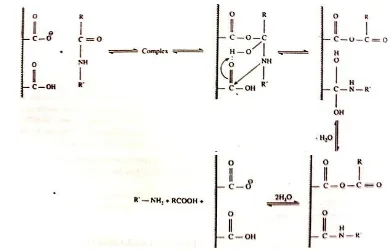
Hidrolisis protein pada metode Asp menggunakan enzim pepsin, yaitu enzim proteolitik yang aktif pada pH asam. Oleh karena itu, pada lambung manusia pepsin berperan dalam pencernaan protein tahap awal yang menghasilkan asam amino dan polipeptida (Ganapathy et al. 2006). Asam amino kemudian diserap sementara polipeptida yang ukurannya lebih besar dihidrolisis oleh enzim pankreatin di usus dua belas jari (Silk 1985). Mekanisme kerja enzim pepsin serupa dengan enzim protease, yaitu memecah ikatan peptida pada protein menjadi asam amino. Enzim pepsin terdiri atas dua gugus karboksil, yaitu gugus yang terprotonasi dan gugus yang terionisasi. Tahap pertama dari pemecahan ikatan peptida ialah terbentuknya kompleks enzim-substrat. Tahap selanjutnya ialah penyerangan pada gugus karboksilat pada ikatan peptida. Oksigen karbonil pada gugus terprotonasi kemudian mengikat proton dari gugus hidroksil yang mengakibatkan terbentuknya produk antara berupa kompleks amino-asil-enzim. Kompleks tersebut kemudian bereaksi dengan air sehingga menghasilkan asam amino. Reaksi pemecahan ikatan peptida oleh enzim pepsin dapat dilihat pada Gambar 5.
Gambar 5. Reaksi pemecahan ikatan peptida oleh enzim pepsin menghasilkan asam amino (Naz 2002)
10
Protein yang tersisa pada residu akhir diperhitungkan sebagai faktor koreksi, baik pada metode AOAC maupun Asp. Analisis protein pada residu dilakukan melalui metode analisis nitrogen Kjehldahl (AOAC 1999). Selain protein, mineral yang tersisa pada residu akhir juga dikoreksi melalui metode pengabuan. Asp (2001) menjelaskan bahwa pengendapan mineral terjadi pada tahap presipitasi serat pangan larut (SDF) menggunakan etanol. Oleh karena itu, sebagian besar peneliti menyarankan adanya koreksi terhadap kadar abu dan protein terhadap residu serat di akhir analisis (Prosky et al. 1988; Schweizer et al. 1988; Lee et al. 1992).
Presipitasi SDF dilakukan dengan menambahkan etanol 95% ke dalam larutan analisis yang terdiri atas IDF, SDF terlarut, hasil hidrolisis enzim, mineral, serta komponen kontaminan lainnya. Tingkat kelarutan polisakarida, dalam hal ini SDF, di dalam larutan menurun akibat penambahan larutan tertentu seperti alkohol, iodin, tembaga, dan garam amonium kuartener. Penurunan tingkat kelarutan polisakarida di dalam air menyebabkan polisakarida mengalami presipitasi atau pengendapan (Aman & Westerlund 2006).
Perbedaan antara analisis TDF dan IDF terletak pada proses presipitasi. Komponen IDF terlebih dahulu dipisahkan dari larutan analisis melalui penyaringan, sehingga filtrat yang diperoleh hanya terdiri atas komponen SDF terlarut yang selanjutnya dipresipitasi. Asp (2001) menyatakan bahwa presipitasi menggunakan etanol akan mengendapkan polisakarida yang memiliki derajat polimerisasi >10. Akan tetapi, pada beberapa kasus, polisakarida yang memiliki derajat polimerisasi yang besar tidak dapat dipresipitasi oleh etanol, terutama molekul yang bercabang. Polisakarida yang memiliki derajat polimerisasi <10 tidak termasuk dalam kategori serat pangan (Anonim 2001).
Garbelotti et al. (2003) menyatakan bahwa perbedaan prosedur analisis utama di antara metode enzimatik gravimetri yang berkembang saat ini terletak pada enzim yang digunakan,
waktu, serta suhu reaksi. Lee et al. (1992) memperbaharui teknik analisis pada metode AOAC
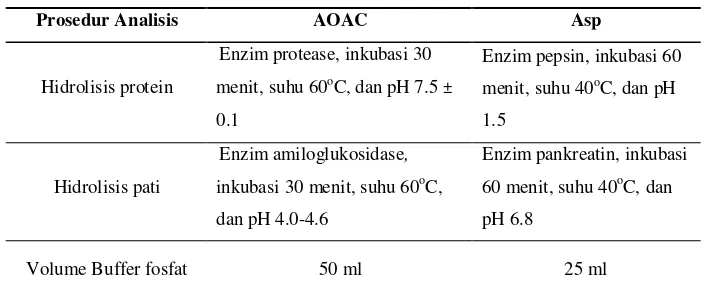
untuk mempersingkat waktu reaksi sehingga dapat meningkatkan presisi metode. Perbedaan kondisi analisis antara metode AOAC dan Asp dapat dilihat pada Tabel 3.
.
Tabel 3. Perbedaan prosedur analisis serat pangan metode AOAC dan Asp
Prosedur Analisis AOAC Asp
Hidrolisis protein
Enzim protease, inkubasi 30
menit, suhu 60oC, dan pH 7.5 ±
0.1
Enzim pepsin, inkubasi 60
menit, suhu 40oC, dan pH
1.5
Hidrolisis pati
Enzim amiloglukosidase,
inkubasi 30 menit, suhu 60oC,
dan pH 4.0-4.6
Enzim pankreatin, inkubasi
60 menit, suhu 40oC, dan
pH 6.8
Volume Buffer fosfat 50 ml 25 ml
11
dan karbohidrat pada jumlah tertentu dapat mengganggu proses analisis serat pangan sehingga hasil yang diperoleh menjadi kurang akurat. Data proksimat sampel dapat dilihat pada Tabel 4.
Tabel 4. Data Proksimat sampela
Sampel
Data Analisis Proksimat (DM*)
Air Protein Lemak Karbohidrat Abu
Kacang Kedelai 13.00% 35.00% 17.00% 31.00% 4.40%
Kacang Tanah 15.00% 24.80% 47.90% 24.60% 2.70%
Oat 13.00% 17.60% 7.00% 55.90% 4.05%
Wortel 79.00% 1.50% 0.20% 10.40% 0.80%
*DM: Dry Matter Basis (basis kering)
a
Liu 1999; NAS 1979; dan Hanif et al. 2006
2.3
VALIDASI DAN VERIFIKASI METODE
Validasi metode adalah suatu proses untuk mengkonfirmasi bahwa prosedur analisis yang dilakukan untuk pengujian tertentu sesuai dengan tujuan yang diharapkan (Huber 2001). Garfield et al. (2000) menyatakan bahwa validasi metode adalah suatu proses penting dari quality control laboratorium. Sifat-sifat dari sebuah metode ditentukan dan dievaluasi secara obyektif. Hasil validasi metode dapat digunakan untuk menilai kualitas, tingkat kepercayaan (reliability), dan konsistensi hasil analisis. Hal tersebut merupakan bagian dari Good Laboratory Practice (GLP) (Huber 2001).
Metode analisis mempunyai atribut tertentu seperti ketepatan, ketelitian, spesifisitas, sensitivitas, kemandirian, dan kepraktisan yang harus dipertimbangkan ketika memilih metode yang cocok untuk memecahkan masalah tertentu (Garfield et al. 2000). Namun atribut-atribut tersebut tidak dapat dioptimalkan sekaligus sehingga harus diputuskan atribut metode yang tepat. Informasi yang digunakan untuk mengambil keputusan harus seimbang dengan pertimbangan praktis seperti biaya, waktu, risiko, kesalahan, dan tingkat keahlian yang diperlukan.
Ketika menggunakan metode yang dikembangkan oleh pihak lain, baik metode yang digunakan oleh laboratorium lain, metode yang telah dipublikasi, atau metode baku, terdapat dua hal penting yang harus diperhatikan. Pertama, apakah data validasi cukup memadai atau membutuhkan tindakan revalidasi sebelum penggunaan. Kedua, jika data validasi telah cukup memadai, apakah laboratorium mampu mencapai level performa yang ditunjukkan oleh data validasi tersebut. Dengan kata lain, dibutuhkan analis yang kompeten serta peralatan dan fasilitas yang memadai. Misalnya, jika metode yang digunakan telah divalidasi oleh organisasi terstandarisasi seperti AOAC Internasional, laboratorium umumnya hanya menjaga performa data dengan cara memverifikasi metode.
12
Tabel 5. Verifikasi metode pengujiana
Parameter yang dievaluasi
Prosedur yang harus diikuti
Jumlah
pengujian Kalkulasi Keterangan
Repeatability
Analisis terhadap sampel dengan analis, peralatan,
laboratorium yang sama dalam rentang waktu singkat 10 Terhadap standar deviasi pada masing-masing sampel Menentukan standar deviasi pada masing-masing sampel Selektivitas (spesifisitas) Analisis terhadap sampel dengan metode kandidat serta metode standar
1
Hasil dari konfirmasi teknik dengan uji beda digunakan untuk mendapatkan data mengenai kemampuan metode untuk mengkonfirmasi identitas analat dan kemampuannya untuk mengukur analat setelah diisolasi dari gangguan-gangguan yang ada Memberikan bukti pendukung yang dibutuhkan untuk memberikan kepercayaan yang cukup terhadap metode yang digunakan Ruggedness (Robustness) Mengidentifikasi variabel yang dapat memberikan efek yang signifikan terhadap performa metode. Evaluasi dilakukan dengan memberi perlakuan berbeda pada variabel dan melihat dampak perubahan terhadap keakuratan data
2
Terhadap nilai rata-rata hasil analisis dari tiap set percobaan
Mengontrol titik kritis metode
a
EURACHEM Guide (1998)
Menurut EURACHEM Guide (1998), parameter-parameter tersebut meliputi
13
reproducibility, akurasi, ketidakpastian, sensitivitas, ruggedness (robustness), dan recovery. Selektivitas (spesifisitas) menyatakan kemampuan metode untuk menentukan analat yang dimaksud di antara keberadaan komponen lainnya di dalam matriks sampel secara akurat dan spesifik pada keadaan yang telah ditentukan dalam metode. Limit deteksi ialah konsentrasi terendah analat dalam sampel yang mampu dideteksi, namun tidak dihitung secara kuantitatif. Limit kuantitasi ialah konsentrasi terendah analat dalam sampel yang dapat ditentukan dengan
presisi yang bisa diterima (repeatability) serta akurasi. Linearity menunjukkan kemampuan
metode untuk memperoleh hasil analisis yang proposional terhadap konsentrasi analat. Rentang ialah set nilai tertentu dimana tingkat kesalahan alat dalam pengukuran diharapkan berada di antara batas yang telah ditentukan. Repeatability menunjukkan presisi pada kondisi yang berulang. Misalnya, hasil analisis diperoleh melalui metode yang sama dari sampel dengan laboratorium,
operator, serta peralatan yang sama pada rentang waktu yang pendek. Reproducibility
menunjukkan presisi pada kondisi yang diulang kembali. Misalnya, hasil analisis diperoleh melalui metode yang sama dari sampel dengan laboratorium, operator, serta peralatan yang berbeda. Akurasi ialah kedekatan yang diterima antara hasil analisis dengan nilai acuan. Ketidakpastian merupakan parameter yang berhubungan dengan hasil pengukuran, ketidakpastian menunjukkan penyebaran nilai yang dapat dijelaskan sebagai atribut hasil. Parameter dapat berupa standar deviasi atau interval kepercayaan. Sensitivitas ialah perubahan respon pengukuran oleh perubahan stimulus yang berkaitan. Stimulus dapat berupa jumlah analat yang berada di dalam sampel. Ruggedness (robustness) ialah penelitian yang dilakukan untuk mengetahui perbedaan hasil analisis akibat perubahan kecil pada lingkungan maupun kondisi analisis yang dilakukan. Recovery merupakan pengukuran analat yang ditambahkan pada sampel dalam jumlah yang diketahui.
2.4
FAKTOR-FAKTOR KESALAHAN PADA ANALISIS SERAT PANGAN
METODE ENZIMATIK-GRAVIMETRI
Diagram ishikawa adalah diagram sebab-akibat yang merupakan salah satu dari tujuh pengendali mutu. Diagram ini menunjukkan penyebab dari suatu hal, pada pembahasan ini ialah kesalahan analisis serat pangan metode enzimatik gravimetri yang dilakukan pada penelitian ini. Faktor-faktor kesalahan yang digambarkan dalam diagram ishikawa diperoleh melalui pengamatan selama penelitian dilakukan.
Faktor-faktor kesalahan yang dapat terjadi selama analisis serat pangan metode enzimatik gravimetri digambarkan melalui diagram Ishikawa (Gambar 6). Faktor-faktor kesalahan digolongkan ke dalam empat kategori utama yaitu reagen dan enzim, metode, alat, dan analisis. Masing-masing kategori terbagi menjadi beberapa faktor. Pada faktor reagen dan enzim, kontaminasi atau kemurnian, umur simpan, serta sifat-sifat kimia reagen dan enzim merupakan kemungkinan penyebab terjadinya kesalahan selama analisis.
14
Neraca analitik, pH-meter dan inkubator bergoyang adalah alat yang mungkin dapat menjadi penyebab kesalahan analisis. Neraca analitik dan pH-meter harus dikalibrasi terlebih dahulu karena dapat menyebabkan keragaman pada data yang dihasilkan. Inkubator bergoyang harus memiliki suhu yang stabil agar enzim dapat bekerja secara maksimal. Inkubator bergoyang digunakan dalam waktu yang cukup lama, yaitu 30 hingga 60 menit sehingga kestabilan alat sangat dibutuhkan untuk menghasilkan data yang baik. Faktor analis yaitu ketrampilan, sikap atau perilaku dan faktor kelelahan menjadi penentu hasil analisis. Prosedur yang panjang dan memakan waktu mengharuskan analis mengatur waktu dengan baik agar hasil analisis tidak terpengaruh oleh ketrampilan yang tidak konstan akibat kelelahan.
Gambar 6. Diagram Ishikawa faktor-faktor Kesalahan Analisis Serat Pangan Metode Enzimatik-gravimetri
2.5
PENGOLAHAN DATA
2.3.1 Rata-rata ( ̅)
Cara terbaik untuk mengevaluasi sebaran data hasil analisis adalah dengan menghitung rata-rata. Rata-rata memberikan perkiraan yang tepat mengenai nilai dengan populasi data (Oakland 2003). Rumus rata-rata ialah:
̅= + + + …+ = /
∑ = jumlah semua pengukuran sampel hingga ulangan ke-n
Kesalahan analisis serat
pangan Metode
Analis Persiapan sampel
Penyaringan
Faktor koreksi
Keterampilan
Sikap/perilaku
Kelelahan Reagen & Enzim
Alat Umur simpan
Sifat-sifat kimia Kontaminasi
Neraca analitik
pH-meter
15 2.3.2 Standar Deviasi dan RSD
Cara yang terbaik untuk mengevaluasi ketelitian dari data analisis adalah dengan menghitung standar deviasi. Standar deviasi mengukur penyebaran data-data percobaan dan memberikan indikasi yang bagus mengenai seberapa dekat data tersebut satu sama lain (Nielsen 2003). Standar deviasi dapat dihitung dengan rumus:
= ∑ ( − ̅)
−1
Cara lain untuk mengukur ketelitian adalah dengan menghitung nilai Relative
Standard Deviation (RSD). Nilai RSD ini merupakan nilai standar deviasi yang dinyatakan sebagai presentase dari rata-rata. RSD dapat dihitung dengan rumus:
=
̅ × 100%
Keterangan:
SD = standar deviasi ; xi = nilai yang diperoleh dari setiap ulangan ; x̅ = nilai rata-rata;
n= jumlah ulangan; RSD = standar deviasi relatif
Nilai RSD yang dapat diterima tergantung dari konsentrasi analat yang diperoleh dari hasil pengujian. Nilai RSD yang dapat diterima dibandingkan dengan nilai RSD Horwitz
(RSDR). RSDR dihitung menggunakan rumus:
% = 2( , )
RSDR adalah standar deviasi relatif antar laboratorium dan C adalah konsentrasi
dalam bentuk fraksi desimal. RSD dalam laboratorium biasanya ½ sampai 2/3 RSDR
(Pomeranz dan Meloan 1994; Garfield 2000). Batas RSD yang dapat diterima dalam penelitian ini adalah 2/3 RSD.
2.3.3 Uji t dan F
16
ℎ = ̅ ̅
1
+ (1)
= ( − 1) + ( − 1)
+ −2
dengan derajat bebas sebesar + −2
Uji F atau uji rasio varian ialah uji yang digunakan untuk membandingkan antara dua standar deviasi, yang berarti membandingkan pula ketelitian antara dua metode. Asumsi dasar atau hipotesis nol dari uji ini adalah bahwa tidak ada perbedaan yang signifikan antara dua standar deviasi. Hipotesis nol ditolak jika nilai F hitung lebih besar dari nilai F Tabel yang berarti bahwa terdapat perbedaan yang signifikan antara ketelitian dua metode. Nilai F hitung didapat dari rumus:
ℎ =
[image:30.612.239.419.75.190.2]III.
METODE PENELITIAN
3.1
BAHAN DAN ALAT
Bahan utama yang digunakan dalam penelitian ini adalah kacang kedelai, kacang tanah, oat,
dan wortel yang diperoleh dari daerah Bogor. Bahan kimia yang digunakan yaitu petroleum eter, etanol 95%, etanol 78%, aseton, buffer fosfat 0.08 M pH 6.0; 0.1 M pH 6.0, termamyl (120 L, Novo Laboratories), protease (P-3910, Sigma Chemical), amiloglukosidase (A-9913, Sigma Chemical), larutan NaOH 0.275N, larutan HCl 0.325 M; 4 M; 0.02 M, celite C-211, pepsin, pankreatin, K2SO4, HgO, H2SO4, NaOH 60%-Na2SO3 5%, H3BO3, indikator MM dan MB, serta
akuades.
Alat-alat yang digunakan adalah alat-alat gelas, neraca analatik, mortar dan alu, blender, desikator, crucible dengan celite, oven vakum, tanur, waterbath, pH meter, labu Kjehldal, alat
destilasi dan alat-alat gelas lainnya.
3.2
METODE PENELITIAN
3.2.1 Metode AOAC Official Methods 985.29; 993.19; dan 991.42
Persiapan sampel
Metode persiapan sampel terdiri atas persiapan sampel kering, basah, dan tinggi lemak. Sampel kering dapat langsung digiling hingga berukuran 40-50 mesh. Sampel yang basah dihomogenisasi dan dikeringkan dengan oven terlebih dahulu. Sampel yang mengandung lemak lebih dari 10% harus dihilangkan lemaknya dengan cara dicampurkan dalam 25 ml petroleum eter/g sampel selama satu jam sebanyak tiga kali ulangan, selanjutnya diblender kering. Sampel dikeringkan selama 12 jam dengan oven vakum pada suhu 70 oC atau selama 5 jam dalam oven biasa pada suhu 105 oC hingga kadar air sampel kurang dari 5%. Kehilangan bobot akibat penghilangan air dan/atau lemak dicatat dan dibuat faktor koreksi yang tepat untuk menghitung % TDF, IDF, atau SDF.
Analisis
3.2.1.1 Total serat pangan (AOAC Official Methods985.29)
Semua prosedur analisis dilakukan terhadap blanko untuk melihat apakah terdapat endapan non serat yang berasal dari reagen atau enzim yang tersisa dalam residu dan dapat terhitung sebagai serat pangan. Sampel ditimbang sebanyak 1 g, dengan keakuratan hingga 0.1 mg, dalam gelas piala 400 ml. Perbedaan bobot antar sampel diusahakan tidak lebih dari 20 mg. Sebanyak 50 ml buffer fosfat pH 6.0 dimasukkan ke dalam gelas piala. Nilai pH diukur
hingga pH 6.0 ± 0.2. Sebanyak 0.1 ml larutan termamyl ditambahkan.
18
diletakkan dalam air mendidih selama 15 menit, digoyangkan secara perlahan dalam interval waktu 5 menit. Waktu pemanasan dapat ditambahkan jika
jumlah sampel yang ditempatkan di dalam waterbath menyulitkan untuk
mencapai suhu internal antara 95-100oC. Termometer digunakan untuk
memastikan tercapainya suhu 95-100oC selama 15 menit. Prosedur ini dapat dilakukan selama 30 menit. Selanjutnya larutan tersebut didinginkan pada suhu ruang. Nilai pH ditepatkan hingga 7.5 ± 0.2 dengan penambahan 10 ml NaOH 0.275 N.
Sebanyak 5 mg protease dimasukkan ke dalam sampel dengan cara dilengketkan pada ujung spatula. Protease dapat pula digunakan dalam bentuk larutan (50 mg dalam 1 ml buffer fosfat) yang dipipet sebanyak 0.1 ml dan dimasukkan ke dalam sampel sesaat sebelum digunakan.
Sampel ditutup kembali dengan kertas alufo. Lalu diinkubasi selama 30 menit pada suhu 60oC dengan agitasi kontinyu. Sampel didinginkan dan ditambahkan 10 ml HCl 0.325 M. Nilai pH diukur hingga berkisar antara 4.0-4.6, jika nilai pH belum tercapai, maka dapat ditetesi kembali dengan asam. Enzim amiloglukosidase ditambahkan dan sampel ditutup kembali dengan kertas alufo. Selanjutnya diinkubasi selama 30 menit pada suhu 60oC dengan
agitasi kontinyu. Sebanyak 280 ml etanol 95% yang sebelumnya telah
dipanaskan hingga suhunya 60oC (volume diukur setelah pemanasan)
ditambahkan. Agar terbentuk endapan, sampel dibiarkan pada suhu kamar
selama 60 menit. Secara kuantitatif endapan disaring melalui crucible.
Sebelumnya, crucible yang mengandung celite ditimbang hingga keakuratan
mendekati 0.1 mg.
Residu dicuci dengan 3 x 20 ml etil alkohol 78%, 2 x 10 ml etil alkohol 95%, dan 2 x 10 ml aseton secara berturut-turut. Pada beberapa sampel dapat saja terbentuk getah, filtrasi dapat dibantu dengan pengadukan menggunakan spatula. Waktu yang dibutuhkan untuk pencucian dan penyaringan bervariasi antara 0.1 sampai 6 jam, rata-rata waktu yang dibutuhkan ialah 0.5 jam per sampel. Lamanya waktu filtrasi dapat dikurangi dengan penghisapan vakum secara hati-hati setiap lima menit selama filtrasi.
Crucible yang mengandung residu dikeringkan selama satu malam di dalam oven vakum dengan suhu 70oC atau oven biasa pada suhu 105oC. lalu didinginkan dalam desikator dan ditimbang hingga keakuratan mencapai 0.1 mg. Untuk memperoleh bobot residu, kurangi dengan bobot crucible dan celite. Analisis residu dari satu sampel ulangan digunakan untuk analisis protein menggunakan metode Kjeldahl, faktor konversi yang digunakan ialah N x 6.25, kecuali pada kasus sampel yang diketahui nilai N dalam proteinnya. Sampel
ulangan lainnya diabukan selama 5 jam pada suhu 525oC. kemudian
didinginkan dalam desikator dan ditimbang hingga keakuratan mendekati 0.1 mg. Kurangi dengan bobot crucible dan celite untuk memperoleh bobot abu. Perhitungan:
Penentuan blanko :
19
Bobot residu = rata-rata bobot residu (mg) untuk dua ulangan sampel blanko; dan PB dan AB = bobot (mg) dari, masing-masing, protein dan abu
yang ditentukan dari kedua ulangan sampel blanko. Perhitungan total serat pangan (TDF) :
TDF (%) = [(bobot residu – P – A – B) / bobot sampel] x 100
Bobot residu = rata-rata bobot residu (mg) untuk dua ulangan sampel; P dan A = bobot (mg) dari, masing-masing, protein dan abu yang ditentukan dari kedua ulangan sampel, B = blanko (mg), dan bobot sampel = rata-rata bobot sampel (mg) yang diambil.
3.2.1.2 Serat pangan tidak larut (AOAC Official Methods991.42)
Prosedur yang dilakukan sama dengan analisis total serat pangan, hingga langkah filtrasi sampel secara kuantitatif ke dalam crucible. Selanjutnya residu dicuci dengan 2 x 10 ml air (melarutkan SDF), 2 x 10 ml etil alkohol 95%, dan 2 x 10 ml aseton secara berturut-turut. Langkah pengeringan crucible hingga tahap akhir serupa dengan prosedur total serat pangan.
Perhitungan:
Perhitungan serat pangan tidak larut (IDF) :
IDF, % = [(bobot residu – P – A – B) / bobot sampel] x 100
Bobot residu = rata-rata bobot residu (mg) untuk dua ulangan sampel; dan P dan A = bobot (mg) dari, masing-masing, protein dan abu yang ditentukan dari kedua ulangan sampel, B = blanko (mg), dan bobot sampel = rata-rata bobot sampel (mg) yang diambil.
3.2.1.3 Serat pangan larut (AOAC Official Methods993.19)
Prosedur yang dilakukan sama dengan analisis total serat pangan, hingga langkah filtrasi sampel secara kuantitatif ke dalam crucible. Bobot filtrat ditepatkan hingga 100 g dengan air destilata. Sebanyak 280 ml etanol 95%
(yang telah dipanaskan hingga suhu 60 oC) ditambahkan ke dalam sampel. Lalu
dibiarkan mengendap pada suhu kamar selama 1 jam.Langkah pengeringan
crucible hingga tahap akhir serupa dengan prosedur total serat pangan. Perhitungan:
Perhitungan serat pangan larut (SDF) :
SDF (%) = [(bobot residu – P – A – B) / bobot sampel] x 100
Bobot residu = rata-rata bobot residu (mg) untuk dua ulangan sampel; P dan A = bobot (mg) dari, masing-masing, protein dan abu yang ditentukan dari kedua ulangan sampel, B = blanko (mg), dan bobot sampel = rata-rata bobot sampel (mg) yang diambil.
Perhitungan total serat pangan (TDF) :
20 3.2.2 Metode Asp et al., 1992
Persiapan sampel
Persiapan sampel yang dilakukan pada analisis serat pangan menggunakan metode Asp sama seperti persiapan sampel yang dilakukan pada metode AOAC.
Analisis
Sampel kering diekstrak lemaknya dengan pelarut petroleum eter pada suhu kamar selama 15 menit kemudian dikeringkan pada suhu ruang. Sejumlah 1 g sampel bebas lemak (w) dimasukkan ke dalam erlenmeyer, kemudian ditambah 25 ml 0.1 M buffer fosfat pH 6 dan dibuat menjadi suspensi. Sampel kemudian ditambahkan 0.1 ml termamyl, ditutup dengan alufo dan diinkubasi pada suhu 100oC selama 15 menit dan didinginkan, kemudian ditambahkan 20 ml akuades dan pH diatur menjadi 1.5 dengan menambahkan HCl 4 M. Sampel lalu ditambahkan 100 mg pepsin, ditutup dan diinkubasi pada suhu 40oC dan diagitasi selama 60 menit. Sampel kemudian ditambahkan 20 ml akuades dan pH diatur menjadi 6.8, lalu ditambahkan 100 mg pankreatin, ditutup, dan diinkubasi pada suhu 40oC selama 60 menit sambil diagitasi, dan terakhir pH diatur
dengan HCl menjadi 4.5. Residu diperoleh melalui penyaringan menggunakan crucible yang berisi celite (bobot kering diketahui). Residu kemudian dicuci dengan 2 x 10 ml
aquades, 2 x 10 ml etanol 95%, dan 2 x 10 ml aseton, lalu dikeringkan pada suhu 105oC
hingga berat tetap (sekitar 12 jam) dan ditimbang setelah didinginkan dalam desikator.
Residu kemudian diabukan dalam tanur 525oC selama minimal 5 jam, didinginkan dalam
desikator, dan ditimbang. Nilai blanko diperoleh dengan cara yang sama namun tanpa menggunakan sampel.
3.2.3 Evaluasi terhadap Parameter Repeatability, Selektivitas, dan Ruggedness
3.2.3.1. Repeatability
Evaluasi terhadap parameter repeatability dilakukan dengan menganalisis kandungan serat pangan (TDF, IDF, dan SDF) yang terdapat dalam empat sampel, yaitu kacang kedelai, kacang tanah, oat, dan wortel menggunakan metode AOAC dan Asp. Menurut EURACHEM Guide (1998), evaluasi
terhadap parameter repeatability dilakukan dengan menganalisis sampel
sebanyak tujuh hingga sepuluh kali. Hasil analisis serat pangan tiap sampel kemudian dirata-rata serta ditentukan nilai SD dan RSD.
Hasil analisis serat pangan mencapai persyaratan repeatability yang baik
jika memiliki nilai RSD maksimal 2/3 RSDR (Horwitz). Parameter selektivitas
21
[image:35.612.253.513.142.313.2]sampel antara metode AOAC dan Asp untuk mengetahui apakah keragaman kedua set data tersebut berbeda secara nyata pada taraf kepercayaan 99%. Diagram proses evaluasi metode serat pangan terhadap parameter repeatability dapat dilihat pada Gambar 7.
Gambar 7. Diagram proses evaluasi metode analisis serat pangan terhadap parameter repeatability
3.2.3.2. Selektivitas
[image:35.612.233.517.472.639.2]Evaluasi terhadap parameter selektivitas dilakukan dengan menganalisis kadar kontaminan yang mungkin masih terdapat pada residu serat. Kontaminan yang dibandingkan antara kedua metode ialah protein dan abu.. Diagram proses evaluasi metode serat pangan terhadap parameter ruggedness dapat dilihat pada Gambar 8.
Gambar 8. Diagram proses evaluasi metode analisis serat pangan terhadap parameter selektivitas
Sampel
Dianalisis 7-10 kali (Metode AOAC)
Dianalisis 7-10 kali (Metode Asp)
Rata-rata kadar abu dan protein
Uji t dan Uji F Rata-rata kadar abu dan protein
Sampel
Dianalisis 7-10 kali (Metode AOAC)
Dianalisis 7-10 kali (Metode Asp)
Rata-rata, SD, dan RSD
22
3.2.3.3. Ruggedness Test
Evaluasi terhadap parameter ruggedness dilakukan dengan memvariasikan
[image:36.612.235.518.294.475.2]konsentrasi etanol yang digunakan dalam pengendapan SDF, baik pada metode AOAC maupun Asp. Analisis serat pangan dilakukan sebanyak dua ulangan (duplo) terhadap empat sampel, yaitu kacang kedelai, kacang tanah, oat, dan wortel menggunakan metode AOAC dan Asp. Rata-rata nilai serat pangan antara perlakuan menggunakan etanol 95% dan 78% dibandingkan menggunakan uji t dan uji F. Jika hasil analisis tidak berbeda secara signifikan, konsentrasi etanol yang dipilih ialah konsentrasi terkecil, yaitu 78%. Diagram proses evaluasi metode serat pangan terhadap parameter ruggedness dapat dilihat pada Gambar 9.
Gambar 9. Diagram proses evaluasi metode analisis serat pangan terhadap parameter Ruggedness
Metode AOAC dan Asp
Etanol 78%
(duplo)
Etanol 95%
(duplo)
Rata-rata, SD, dan RSD
22
IV.
HASIL DAN PEMBAHASAN
Metode yang direkomendasikan untuk menganalisis komponen kimia yang terkandung dalam produk pangan ialah metode yang telah divalidasi atau diverifikasi (EURACHEM Guide 1998). Metode analisis serat pangan yang digunakan dalam penelitian ini ialah enzimatik-gravimetri berdasarkan AOAC Official Method 985.29; 993.19; dan 991.42 (1999) dan metode Asp (1992).
Prinsip analisis serat pangan secara enzimatik gravimetri ialah hidrolisis karbohidrat yang dapat dicerna, lemak, dan protein menggunakan enzim. Molekul yang tidak larut maupun yang tidak terhidrolisis dipisahkan melalui penyaringan sebagai residu. Residu serat tersebut kemudian dikeringkan serta ditimbang. Selanjutnya residu hasil penimbangan tersebut dianalisis kadar protein dan abunya. Kadar serat pangan diperoleh setelah residu dikurangi kadar protein dan kadar abu. Kekurangan metode enzimatik-gravimetri ialah memiliki prosedur yang sangat panjang dan tidak praktis sehingga memerlukan waktu yang lama (Ceirwyn 1999).
Matriks sampel yang digunakan dalam penelitian ini antara lain kacang kedelai, kacang tanah, oat, serta wortel. Keempat sampel yang dipilih ialah sampel yang mewakili kelompok bahan pangan dalam piramida makanan. Matriks sampel tersebut antara lain merupakan makanan tinggi protein, lemak, karbohidrat, serta kelompok sayur dan buah.
Sebelum sampel dianalisis kadar serat pangannya, sampel yang mengandung kadar air yang tinggi terlebih dahulu dikeringkan. Proses pengeringan sampel berbeda satu sama lain. Sampel wortel memiliki kadar air yang tinggi dan komponen yang sensitif terhadap panas. Oleh karena itu
proses pengeringan wortel dilakukan menggunakan oven vakum pada suhu 70oC selama lima jam
hingga kadar air kurang dari 5%. Untuk sampel yang mengandung kadar lemak yang tinggi (> 10%), seperti kacang kedelai (17.00%) dan kacang tanah (47.90%), maka kedua sampel tersebut terlebih dahulu dihilangkan lemaknya dengan proses ekstraksi menggunakan pelarut petroleum eter. Sampel hasil ekstraksi kemudian dikeringkan dengan menggunakan oven pada suhu 105oC selama 12 jam untuk menghilangkan pelarut petroleum eter. Sampel kacang kedelai dan kacang tanah Sementara oat tidak dihilangkan lemaknya karena kadar lemaknya kurang dari 10%, yaitu 7%.
Wortel yang telah dikeringkan, kacang tanah dan kacang kedelai yang sudah dihilangkan lemaknya serta oat kemudian dikecilkan ukurannya menjadi 40-50 mesh. Sampel yang telah berbentuk bubuk kering selanjutnya dapat dianalisis kadar serat pangannya menggunakan metode AOAC dan Asp.
4.1
TOTAL SERAT PANGAN (TDF)
23
Tabel 6. Nilai TDF sampel menggunakan metode AOAC dan Asp
Sampel Kacang kedelai Kacang tanah Oat Wortel
AOAC Asp AOAC Asp AOAC Asp AOAC Asp
TDF (%) 59.42 35.22 12.49 12.22 13.64 11.84 23.69 24.30
SD 0.10 0.23 0.07 0.04 0.10 0.10 0.08 0.21
RSD 0.17 0.66 0.58 0.33 0.74 0.81 0.35 0.82
RSDR 1.08 1.17 1.37 1.37 1.35 1.38 1.24 1.24
Keterangan* Berbeda nyata Tidak berbeda Berbeda nyata Tidak berbeda
*Hasil uji t antara rata-rata TDF sampel metode AOAC dan Asp
Tabel 7. Data sekunder serat pangan pada kacang kedelai, kacang tanah, oat, dan wortel
Sampel Data sekunder
TDF (%) IDF (%) SDF (%)
Kacang Kedelaia 30.03-49.02 22.52-36.765 7.54-12.31
Kacang Tanahb 8.07-13.74 7.13-12.13 0.94-1.41
Oatc 8.22-14.81 4.85–10.60 2.51–6.20
Worteld 23.25-30.30 9.20-11.72 11.53-21.10
a
Redondo-Cuenca et al. 2006; Kutoz et al. 2003
b
Sanchez-Castillo et al. 1999; Kutoz et al. 2003
cEnglyst dan Hudson 1996; Prosky et al. 1988 d
Englyst dan Hudson 1996; AOAC 1995
Kadar TDF kemudian dirata-ratakan dan ditentukan SD nya. Nilai RSD (Relative standard deviation) diperoleh dari nilai SD yang dinyatakan sebagai presentase dari rata-rata. Nilai RSD digunakan untuk menguji apakah analisis memiliki repeatability yang baik dengan membandingkannya terhadap RSDR (Horwitz). RSD analisis dapat diterima jika nilainya
kurang dari 2/3 RSDR.
[image:38.612.156.513.286.461.2]24
digunakan pada metode AOAC untuk menghidrolisis protein adalah protease dengan aktivitas enzim sebesar 50 U/ml, sementara pada metode Asp enzim protease yang digunakan adalah pepsin dengan aktivitas enzim sebesar 2755 U/mg. Rendahnya aktivitas enzim yang digunakan pada metode AOAC menyebabkan hidrolisis protein pada sampel tidak sempurna sehingga komponen protein terhitung sebagai serat pangan.
Kadar TDF oat metode AOAC ialah 13.64% dengan SD 0.10%. Sementara dengan
metode Asp menghasilkan nilai 11.84% dengan SD 0.10%. Kadar TDF oat metode AOAC lebih tinggi dibandingkan metode Asp dan nilai keduanya berbeda secara signifikan setelah diuji menggunakan uji t.
Oat mengandung kadar lemak sebesar 7% (Tabel 4). Kadar lemak yang terdapat di dalam sampel oat tidak diekstrak terlebih dahulu menggunakan petroleum eter karena kadar lemak yang terdapat di dalam oat kurang dari 10%. Kadar TDF oat dengan menggunakan metode AOAC lebih tinggi dibandingkan dengan menggunakan metode Asp. Hal ini diduga karena pada metode AOAC masih terdapat lemak yang terikat pada matriks sampel. Lemak yang masih tersisa dikarenakan proses penghilangan lemak pada sampel hanya dilakukan dengan proses pencucian residu menggunakan aseton, sementara pada metode Asp penghilangan lemak dilakukan baik dengan proses pencucian maupun proses hidrolisis dengan menggunakan enzim pankreatin. Prosedur hidrolisis lemak ini tidak terdapat pada metode AOAC. Meskipun demikian, kadar TDF oat metode AOAC masih berada di dalam rentang data sekunder (8.22-14.81%), begitu pula dengan metode Asp.
Data sekunder diperoleh dari publikasi ilmiah mengenai kadar serat pangan pada sampel yang digunakan pada penelitian ini, yaitu kacang kedelai, kacang tanah, oat dan wortel. Data sekunder berupa rentang nilai karena berasal dari beberapa referensi ilmiah. Kadar serat pangan yang diperoleh dari referensi menggunakan baik metode enzimatik-kimia maupun enzimatik-gravimetri. Metode enzimatik-kimia yang digunakan ialah metode Englyst (Redondo-Cuenca et al. 2006; Sanchez-Castillo et al. 1999; Englyst dan Hudson 1996).
Enzim yang digunakan pada tahap isolasi serat pangan ialah α-amilase tahan panas,
pankreatin, dan pullulanase untuk hidrolisis pati dan protein. Residu yang diperoleh berupa polisakarida dan oligosakarida selanjutnya ditambahkan HCL 5 M dan H2SO4 12 M untuk
menghasilkan monosakarida-monosakarida. Monosakarida yang telah terpisah kemudian diidentifikasi menggunakan HPLC. Penjumlahan monosakarida yang teridentifikasi merupakan kadar TDF. Metode enzimatik-gravimetri yang digunakan ialah metode Prosky (Kutoz et al. 2003; Prosky et al. 1988) dan metode AOAC (AOAC 1995). Metode Prosky menggunakan enzim yang sama dengan metode Asp, yaitu pepsin dan pankreatin, sementara metode AOAC menggunakan enzim protease dan amiloglukosidase.
25
4.2
SERAT PANGAN TIDAK LARUT (IDF) DAN SERAT PANGAN
LARUT (SDF)
Uji t terhadap kadar IDF memiliki kecenderungan yang sama seperti yang terjadi pada analisis TDF terhadap semua sampel. Sampel yang memiliki nilai yang berbeda secara signifikan antara metode AOAC dan Asp ialah kacang kedelai dan oat. Sementara sampel kacang tanah dan wortel memiliki nilai yang tidak berbeda nyata. Uji t terhadap kadar SDF menghasilkan nilai yang berbeda nyata hanya pada sampel kacang kedelai, sementara kadar SDF sampel kacang tanah, oat, dan wortel tidak berbeda nyata.
[image:40.612.124.498.362.680.2]Kadar IDF kacang kedelai dengan metode AOAC ialah 57.65%, dengan nilai SD sebesar 0.23%. Nilai ini berbeda nyata jika dibandingkan dengan metode Asp, yaitu 30.43% dengan nilai SD sebesar 0.25%. Kadar SDF kacang kedelai metode AOAC ialah 1.31% dengan SD 0.02%. Nilai ini juga berbeda nyata jika dibandingkan dengan metode Asp, yaitu 4.36% dengan SD sebesar 0.04%. Seperti yang telah dijelaskan pada sub-bab sebelumnya bahwa kadar protein tidak dapat dihidrolisis dengan sempurna pada metode AOAC, terutama pada sampel tinggi protein seperti kacang kedelai. Perbedaan aktivitas enzim protease yang digunakan pada metode AOAC dan Asp menghasilkan kadar IDF dan SDF yang berbeda.
Tabel 8. Nilai IDF dan SDF sampel menggunakan metode AOAC dan Asp
Sampel
AOAC Asp Uji t*
IDF
(%)
SDF
(%) IDF (%) SDF (%) IDF SDF
Kacang
Kedelai
x̅ 57.65 1.31 30.43 4.36
Berbeda
nyata
Berbeda
nyata
SD 0.23 0.02 0.25 0.04
RSD 0.39 1.55 0.84 0.92
RSDR 1.09 1.92 1.20 1.60
Kacang
Tanah
x̅ 11.48 0.92 11.29 0.94
Tidak berbeda nyata Tidak berbeda nyata
SD 0.02 0.02 0.03 0.01
RSD 0.18 1.97 0.22 1.14
RSDR 1.39 2.04 1.39 2.02
Oat x̅ 8.46 2.60 7.28 2.02
Berbeda
nyata
Tidak
berbeda
nyata
SD 0.03 0.01 0.07 0.01
RSD 0.34 0.50 0.93 0.60
RSDR 1.45 1.73 1.48 1.80
Wortel x̅ 9.19 13.87 9.50 14.61
Tidak berbeda nyata Tidak berbeda nyata
SD 0.10 0.05 0.13 0.16
RSD 0.91 0.39